核桃是果木兼用树种,有着丰富的营养价值。中国核桃产量居世界首位,使得核桃成为开发功能性食品的优质原料。目前,核桃榨油后得到的副产物核桃饼粕的综合利用率低,或用作肥料、饲料。核桃中蛋白质含量为18%~25%,其中谷蛋白占总蛋白的70%以上。谷蛋白为水不溶性蛋白质,且双亲性较差,因此,为有效利用核桃蛋白,扩大其在食品加工及其他领域的应用,从核桃饼粕中提取蛋白质并综合性利用加工成为核桃蛋白高值化应用的主要加工方向。
糖基化(glycosylation)作为一种常用的、简洁有效的蛋白质修饰方法,能高效地修饰蛋白质特性。糖基化反应的本质是美拉德(Maillard)反应中Amadori重排,即蛋白分子中的赖氨酸残基与糖分子中的羟基共价键结合形成糖-蛋白类物质。在蛋白质分子中的氨基酸侧链上引入糖类物质的基团,生成的蛋白-糖类物质能够在特定环境中阻碍蛋白分子相互聚集,提高蛋白质的功能特性[1]。糖基化改性相比其他改性方法,因其快速化、强烈化、显著化和高效化等特点,而逐渐成为现代食品加工领域热点的研究方向之一。
目前,糖基化改性的研究多集中在大豆、花生、大米、乳清分离蛋白、酪蛋白等[2],较为详尽地阐述了影响改性蛋白的众多因素,如温度、时间和pH等。而且大量的研究也表明了糖基化的改性具有良好的效果,有研究表明[3]糖基化改性后大豆分离蛋白和葡萄糖复合物的溶解度、乳化特性均有显著提高;即使在蛋白的等电点处,经改性后的糖-蛋白复合物也具有良好的溶解性[4];DECOURCELLE等[5]研究鱼虾蛋白与糖的反应,得到糖-蛋白复合物的溶解性也有显著提高;有研究[6]称,酪蛋白与糖反应,改善了糖-蛋白共价复合物的乳化效果,复合产物拥有了更优良的功能特性;还有研究[7]称,在糖基化改性中,选择多糖比单糖与双糖的效果更好,更有助于蛋白功能特性的提升。
实验选用葡萄糖、乳糖和葡聚糖修饰核桃谷蛋白,以接枝度、褐变度、溶解度、乳化特性、起泡特性等指标为依据,并结合光谱图分析核桃谷蛋白改性前后功能特性以及蛋白分子结构表征的变化,为核桃蛋白的综合性利用、产业化生产和高质化精深加工提供理论参考,以期为核桃产业的深加工以及食品工业生产提供有利的支撑和保障。
1 材料与方法
1.1 材料与试剂
核桃饼粕(冷榨后含蛋白质质量分数为66.29%),新疆中亚食品有限公司;核桃谷蛋白(walnut glutenin,WG,纯度为80.26%),实验室自制;葡萄糖、乳糖,天津市凯通化学试剂有限公司;葡聚糖,Admas Reagent Co., Ltd.;邻苯二甲醛(o-phthalaldehyde, OPA ),上海高鸣化工有限公司;十二烷基硫酸钠(sodium dodecyl sulfate, SDS)、Ellman’s试剂,北京索来宝科技有限公司;2-巯基乙醇(分析纯),北京津同乐泰化工产品有限公司;KBr (光谱纯),天津市金贝尔科技有限公司;甘氨酸、碳酰二胺,国药集团化学试剂有限公司;5-5’-二硫代双(2-硝基苯甲酸)[5,5’-dithiobis-(2-nitrobenzoic acid), DTNB]、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA),Sigma公司。
1.2 仪器与设备
便携式数显pH计(Testo205),德图仪表(深圳)有限公司;电热恒温水浴锅(DZKW-S-6),北京市永光明医疗仪器有限公司;低速离心机(TDL-5-A),上海安亭科学仪器厂;紫外-可见分光光度计(TU-1810PC),北京普析通用仪器有限责任公司;真空冷冻干燥机(ALPHA 1-2),德国Marin Christ公司;定时恒温磁力搅拌器(MHY-16310),北京美华仪科技有限公司;扫描电子显微镜(S-5500),日本日立公司。
1.3 实验方法
1.3.1 改性蛋白的制备
工艺流程:WG→制备溶液→搅拌→调pH→加糖(葡萄糖、乳糖和葡聚糖)→搅拌→调pH→恒温反应→糖-蛋白复合物→真空冷冻干燥→糖基化蛋白
称取2.00 g WG分散于去离子水中(蛋白质质量浓度为60~80 g/L),室温下搅拌1 h,用1 mol/L NaOH调不同pH,分批加入单糖、双糖和多糖,不断搅拌,调溶液pH 7.0终止反应。之后真空冷冻干燥处理,得到糖-蛋白接枝产物。葡萄糖改性蛋白(glucose modified protein,GMP)、乳糖改性蛋白(lactose modified protein,LMP)、葡聚糖改性蛋白(dextran modified protein,DMP),对照样品不添加糖类[1]。
1.3.2 溶解度的测定
根据HORAX等[8]方法稍作改动。配制10 g/L的WG、GMP、LMP和DMP各10 mL,搅拌20~30 min,置于离心管中,离心(4 500 r/min,15 min),取上清液。取空试管,加入考马斯G-250、去离子水和上清液,振荡1 min左右,静置10 min后,波长595 nm处测定。对照组不加上清液。按公式(1)计算:
溶解度![]()
(1)
式中:m0,样品蛋白含量;m1,上清液蛋白质含量。
1.3.3 接枝度测定(邻苯二甲醛)比色法
称取50 mg OPA,分散在甲醛溶液中,加入SDS、2-巯基乙醇和硼砂溶液,充分混匀后定容,制得OPA溶液[9]。
测定时,准确称取4.00 mL OPA溶液,加入200 μL样品,35 ℃水浴2 min后测定吸光值A340;同理,做空白对照组。接枝度按公式(2)计算:
(2)
式中:A0,接枝反应前溶液吸光度;A1,接枝反应后溶液吸光度。
1.3.4 褐变程度的测定
用0.10 g/100 mL SDS溶液作为溶剂,稀释样液,磁力搅拌20 min,测定吸光值![]() 同理,做空白对照组。
同理,做空白对照组。
1.3.5 持水性的测定
参考PAREDES-L PEZ等[11]的方法。准确称取0.10 g的WG、GMP、LMP和DMP记为m0,置于离心管中,记录总质量m1,添加10 mL去离子水,离心(4 500 r/min,15 min),记录此时总质量m2。按公式(3)计算:
PEZ等[11]的方法。准确称取0.10 g的WG、GMP、LMP和DMP记为m0,置于离心管中,记录总质量m1,添加10 mL去离子水,离心(4 500 r/min,15 min),记录此时总质量m2。按公式(3)计算:
持水性![]()
(3)
式中:m0,蛋白样品质量;m1,离心管与样品总质量;m2,离心管与沉淀物质量。
1.3.6 持油性的测定
依照PEDROCHE等[12]的方法,准确称取0.10 g的WG、GMP、LMP和DMP记为m0,置于离心管中称量,记为m1,加入5 mL大豆油,振荡1 min,3 300 r/min离心15 min,吸去残留油脂,称量离心管与样品质量记为m2。按公式(4)计算:
持油性![]()
(4)
式中:m0,蛋白样品质量;m1,样品与离心管总质量;m2,吸油后样品与离心管总质量。
1.3.7 起泡及起泡稳定性的测定
起泡性与泡沫稳定性[13]:准确称取1.00 g的WG、GMP、LMP和DMP溶解于pH 7.0的磷酸缓冲溶液中,取10.0 mL置于25 mL离心管中测定其体积值记为V0,以10 000 r/min的速度均质2 min;记录均质数据。分别按公式(5)、(6)计算起泡性和泡沫稳定性:
起泡性![]()
(5)
泡沫稳定性![]()
(6)
式中:V0,初始样液体积;V1,均质放置0 min后样液总体积;V2,均质放置30 min后样液总体积。
1.3.8 荧光分光光度分析
将蛋白置于pH 7.0的磷酸盐缓冲液(phosphate buffer saline,PBS)中,使蛋白质量浓度为0.3 mg/mL。在狭缝5 nm,激发波长310 nm条件下进行扫描测定[14]。
1.3.9 紫外分光光度分析
使用pH 7.0的PBS蛋白质量浓度调节为0.1 mg/mL,在200~400 nm波长下扫描测定[15]。
1.3.10 巯基与二硫键测定
游离巯基含量的测定:将30 mg样品分散于Ellman’s试剂中,经均质和4 800 r/min离心15 min,在412 nm波长处使用分光光度计测定[15]。
总巯基含量的测定:将30 mg样品分散于10.0 mL混合试剂中(精确称取20.84 g Tris、13.51 g甘氨酸、2.98 g EDTA和960.96 g碳酰二胺,加水定容至1 000 mL)中,在412 nm波长处测量。巯基含量按公式(7)计算:
(7)
式中:A412,吸光度;n,稀释倍数;m,上清液中蛋白质含量。
NTSB 合成根据PETRUCCELLI等[16]的方法:称取 1.0 g DTNB 溶解在 100 mL 1 mol/L 的 Na2SO3溶液中,调节 pH 值到7.5。加入 0.5 mL 0.1 mol/L 的 CuSO4氨溶液,38 ℃下保温。涡旋振荡至溶液从亮红色变为淡黄色,-20 ℃冰箱中保存备用。
NTSB 测试液:用 0.2 mol/L 的 Tris-base 缓冲液(10 mmol/L EDTA,0.1 mol/L Na2SO3和 3 mol/L异硫酸胍)将 NTSB 储液稀释 100 倍,调节 pH 值到 9.5。
二硫键含量的测定:取50 mg蛋白样品,置于Tris-base缓冲液,加入NTSB溶液,静置1 h,离心(10 000 r/min 10 min),在412 nm波长处测量,对照样品加入NTSB溶液。二硫键含量按公式(8)计算:
二硫键含量![]()
(8)
式中:SHT,总巯基含量;SHF,自由巯基含量。
1.3.11 圆二色光谱(circulat dichroism,CD)分析
将蛋白用pH 7.0的PBS稀释为0.3 mg/mL,放置3 h。扫描波长190~250 nm,扫描速率100 nm/min,测试温度25 ℃[14]。重复8次扫描,取平均值。
1.3.12 扫描电子显微镜观察
将WG和改性蛋白样品固定于双面导电胶上,样品表面喷涂电镀层,喷金厚度约10 nm,在20 kV电压下进行扫描,拍样品图[17]。
1.4 数据处理
每组试验做3次重复实验。运用Excel 2003绘制图表进行数据分析,光谱图用仪器自带系统软件进行分析。
2 结果与分析
2.1 接枝度与褐变度的测定
衡量糖基化反应的指标一般为接枝度与褐变度。接枝度与褐变度往往反映较为直观地说明糖基化反应发生的进程,接枝度反映美拉德反应的初级程度,褐变度反映美拉德反应的高级程度。糖基化实质是游离氨基与羰基相互作用形成的共价化合物,新化合物的形成、接枝度的升高是游离氨基减少的主要原因[18]。TURAN等[19]在阐述这种反应的高级阶段时,也说明了游离氨基与羰基之间的反应会生成含氮类的棕色、褐色聚合物或共聚物。
由图1可知,GMP的接枝度最大,其次是DMP,可能是由于分子质量相对较小的糖具有更多的还原性羰基,数量相对较多的羰基更容易与蛋白分子发生反应,处于蛋白分子外部的游离氨基可以更快地与糖分子相互接触并产生作用,处于蛋白分子内部的氨基会因外部氨基产生反应后也随之发生相应变化,从而表明接枝度与糖类分子质量有一定相关性。TER等[20]在研究中称,蛋白分子中氨基所触发的与糖的反应性可以判定糖基化的反应进程。Maillard反应会有终产物产生,褐变程度的高低顺序依次为:LMP>GMP>DMP,说明糖的构型能影响糖基化反应。乳糖和谷蛋白反应体系产生了更多的糖基化产物,从而可以反映出LMP向着高级阶段进行,可能是由于反应过程中发生了焦糖化反应和产生了生色团[19]。

图1 糖基化改性的接枝度与褐变度
Fig.1 Grafting degree and browning degree of glycosylation modification
2.2 理化指标的测定
通过表1中改性前后的数据对比,WG的溶解度为17.43%,而GMP、LMP与DMP的溶解度分别为:94.84%、59.62%和98.42%;WG的持水性和持油性分别为:4.27%和4.81%;GMP、LMP与DMP的溶解度与持水性明显高于WG,而GMP、LMP与DMP的持油性比WG低,分别是WG的78.17%、80.87%和61.54%。这是因为蛋白与糖产生反应,随着接枝程度的逐渐增大,糖链不断介入到蛋白分子中,为蛋白分子提供了充足的亲水性羟基基团,这种亲水性基团会在蛋白质的表面形成水化膜,使得核桃谷蛋白的亲水性有较为显著的增加[21-22]。改性后蛋白的起泡性与起泡稳定性平均提高了27.50%与5.39%。
表1 改性前后理化特性的比较
Table 1 Comparison of physical and chemical properties before and after modification
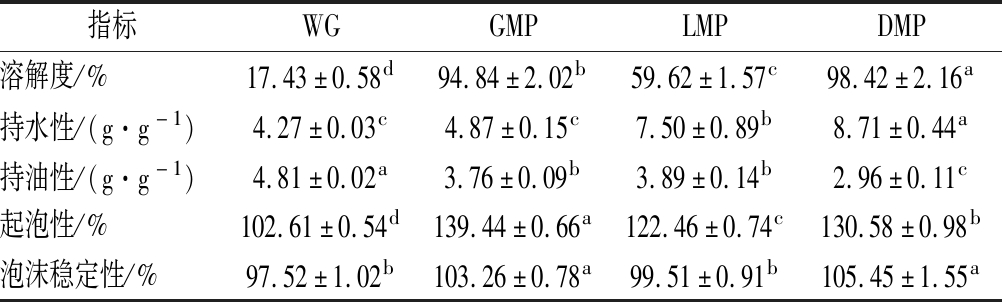
指标WGGMPLMPDMP溶解度/%17.43±0.58d94.84±2.02b59.62±1.57c98.42±2.16a持水性/(g·g-1)4.27±0.03c4.87±0.15c7.50±0.89b8.71±0.44a持油性/(g·g-1)4.81±0.02a3.76±0.09b3.89±0.14b2.96±0.11c起泡性/%102.61±0.54d139.44±0.66a122.46±0.74c130.58±0.98b泡沫稳定性/%97.52±1.02b103.26±0.78a99.51±0.91b105.45±1.55a
注: 同一列肩标上的不同小写字母表示显著差异 (P<0.05)(下同)
2.3 荧光光谱分析
蛋白质是由氨基酸通过肽键连接组合成的大分子类物质,具有较大空间和结构。因此这种组合方式使得蛋白质分子内的大量基团,如氨基、羧基和羟基等,在受到外界影响时会发生某些变化,进而影响其功能特性[23]。蛋白的荧光光学性质与发色团结构及其微环境具有紧密联系,荧光光谱图显示接枝反应会使谷蛋白中存在一定量的色氨酸由于光激发产生的电子跃迁,造成微环境改变[24-25]。由图2可知,在310 nm的激发波长下,WG的荧光峰在428 nm波长处,蛋白质-糖接枝物的荧光峰在431 nm波长处,比较发现,改性蛋白的吸收峰发生红移,荧光强度都显著降低,可能是改性使得发色团暴露而发生荧光猝灭。

图2 核桃谷蛋白与改性蛋白的荧光光谱
Fig.2 Fluorescence spectra of WG and modified protein
此外,接枝物的荧光强度显著低于WG对照组。GMP、LMP与DMP的糖基化改性,一是由于反应所处的较高温度,在较高温度下,蛋白质的构象不稳定,会引起蛋白中的色氨酸大量减少,导致荧光强度降低[26];二是由于外界环境的改变,使蛋白质由原本的折叠状态逐渐展开呈伸展状态,蛋白质此时去折叠化,由顺序结构向无序结构化转变。
2.4 紫外光谱分析
蛋白的表面疏水性对蛋白质三、四级结构有重要作用,蛋白的紫外吸收特性主要基于蛋白质侧链上的色氨酸、酪氨酸和苯丙氨酸残基的变化[27]。
由图3所示,WG在284 nm波长处出现最高紫外吸收峰,吸光度为0.47。而改性蛋白的紫外吸收高低顺序依次为:GMP>DMP>LMP,接枝产物的吸收峰均出现在276~278 nm波长处,吸收峰蓝移,生色基团外在微环境发生了改变[28],使得肽链上具有紫外吸收的色氨酸、酪氨酸残基表露出来,其所带的杂环π→π*电子跃迁也是引发吸收峰向短波长方向移动的关键因素之一[29],300~400 nm波长附近的紫外吸光度的波峰消失,变得平滑,可能是改性使核桃谷蛋白中结构得到伸展,电子跃迁能量逐渐减小,导致紫外吸收减弱[30]。
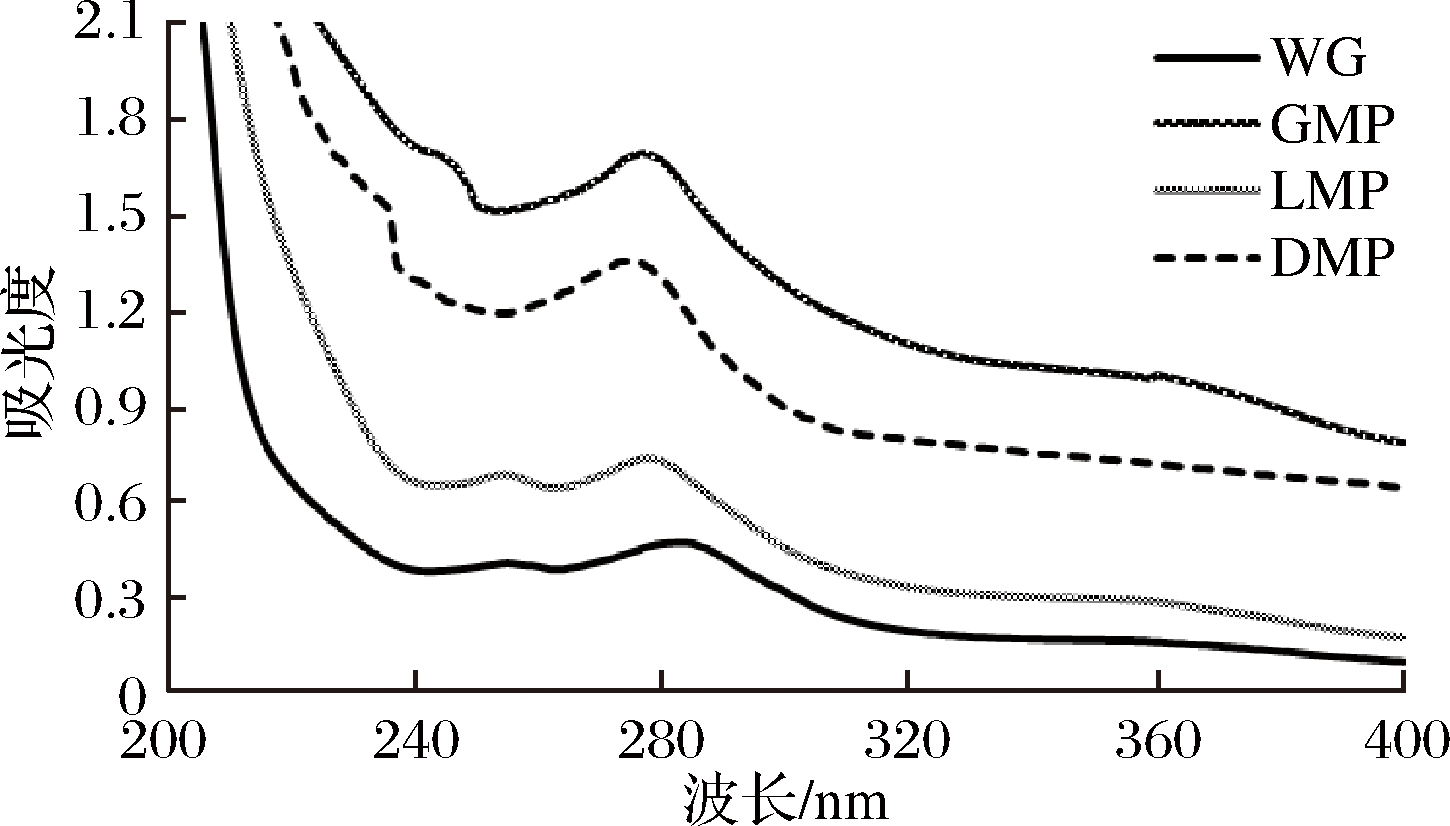
图3 核桃谷蛋白与改性蛋白的紫外光谱
Fig.3 UV-visible spectroscopy of WG and modified protein
2.5 巯基与二硫键的测定
巯基与二硫键含量对于蛋白质空间构象的稳定起着关键作用,二者之间的交换作用可使得蛋白分子间发生凝聚[28]。图4对比发现,3种改性蛋白的总巯基含量呈下降趋势,可知糖基化处理使得蛋白质结构改变,WG的巯基大部分游离在蛋白表面,而改性蛋白的巯基相对来说,是包埋或嵌在分子内部。与WG相比,二硫键含量高低顺序依次为:LMP>DMP>GMP,说明随着糖基化反应的进行,接枝度高的DMP和GMP所含的二硫键是减少的。巯基和二硫键不仅可以维持蛋白质分子的结构稳定,还能改变某些功能特性[31],这些化学键的断裂、结合和重组,都可以使得蛋白质的更高级结构产生一定变化,同时,结构的改变又会作用于蛋白质的功能特性。

图4 核桃谷蛋白与改性蛋白的巯基与二硫键含量
Fig.4 —SH and disulfide bond of WG and modified protein
注:组间不同小写字母表示差异显著
2.6 圆二色光谱分析
WG、GMP、LMP和DMP四种蛋白的主要构成为β-折叠与无规则卷曲,仅存在少量的α-螺旋结构。α-螺旋结构通常存在于蛋白质分子内部,高度有序稳定,不易改变蛋白功能特性[32]。与α-螺旋相比,β-折叠与无规则卷曲结构会使得蛋白质稳定性降低,蛋白的功能特性易被改变。KATO等[33]发现,蛋白分子的柔性越好,其乳化性能越好。
如表2所示,WG以β-折叠结构为主,α-螺旋结构占17.62%,是改性蛋白的1.41倍。经糖基化改性的GMP、LMP和DMP,其α-螺旋结构均呈下降趋势(P<0.05),可能是蛋白质和糖共价结合后,α-螺旋结构遭到破坏,蛋白结构分子发生伸展。与对照组相比,改性处理使蛋白的β-折叠、β-转角和无规则卷曲结构在整体上变化不明显,但含量均增加了约1.06倍。说明接枝反应后的GMP、LMP和DMP在溶液中结构向无序转变,增加了蛋白的不规则性。
表2 核桃谷蛋白与改性蛋白二级结构变化的对比分析 单位:%
Table 2 Comparative analysis of secondary structure changes between WG and modified proteins

名称二级结构的分布和含量α-螺旋β-折叠β-转角无规则卷曲WG17.62±0.11a35.71±0.26f20.65±0.11e26.02±0.05dGMP11.93±0.04de37.85±0.06b22.37±0.05a27.85±0.13aLMP14.26±0.02c36.93±0.14d21.96±0.03bc26.85±0.07cDMP11.44±0.10e38.17±0.16a22.45±0.07a27.94±0.28a
2.7 扫描电镜对WG与改性蛋白的观察
如图5所示,未改性的WG颗粒大小不一,大多呈散落小颗粒圆球状堆积结构。经糖基接枝反应后的GMP、LMP与DMP所形成的是质地十分紧密的较大块状结构,且这种结构的表面均表现出一定的光滑性,有较为明显的棱角质地感,且所形成的块状大小以及规模更加趋近于晶体化。
对比发现,对核桃谷蛋白进行改性处理后,大部分以片层或块状结构存在,体积较大。这可能是因为WG与糖基共价结合,分子间的疏水作用减弱,大分子物质分散开来,使得接枝物呈现展开的结构特点,有助于蛋白质溶解性、水合能力的提升[34]。

a-WG(5 000×);b-GMP(5 000×);c-LMP(5 000×);d-DMP(5 000×);e-WG(10 000×);f-GMP(10 000×);g-LMP(10 000×);h-DMP(10 000×)
图5 核桃谷蛋白及其糖基化接枝物的SEM图
Fig.5 The SEM micrographs of WG and its glycosylation grafting
3 结论
经糖基化改性,GMP、LMP与DMP接枝反应较充分,溶解度与持水性均有较大幅度提高,但由于接枝物构象限制,起泡特性变化较小,总体上变化并不明显。结合荧光光谱图分析,接枝产物的吸收峰发生变化,可知分子内部的氨基酸基团极性状态发生了一定改变,使得蛋白质的高级结构发生相应改变,且荧光强度及吸收强度也被影响,蛋白的亲水性以及疏水性发生了变化。蛋白的游离巯基是决定亲水性的主要原因,蛋白分子内部以及分子间化学键变化,都可以引发蛋白相对高级结构变化,而结构表征性变化又会影响到蛋白外在功能特性。扫描电子显微镜显示,糖基化修饰会影响蛋白分子的微观结构,对蛋白质理化性质也有影响。圆二色光谱分析得出,接枝物的α-螺旋结构有较为明显的下降,β-折叠、β-转角和无规则卷曲结构在整体上未发生显著性变化,说明糖基化修饰使得谷蛋白二级结构遭到破坏。
在相关科学研究中,毛晓英课题组[35-37]在蛋白质结构氧化性修饰对核桃蛋白结构和乳化特性影响的研究中发现,适当的氧化浓度有利于提高核桃蛋白的乳化活性和乳化稳定性。孙乾等[25]采用酰基化与磷酸化对核桃谷蛋白进行改性处理,发现蛋白的溶解度、持水性均得到提升,与本研究结果相似。化学法对谷蛋白的改性效果极为明显,但可能会带来蛋白的不可逆变性或有与蛋白结合紧密的残存物质。薛雨菲等[38]和张爱琴等[39]运用复合蛋白酶和谷氨酰胺转氨酶改性核桃谷蛋白,发现酶解可使深藏于蛋白质内部的亲水性基团逐渐暴露而改善蛋白质的功能特性。酶法反应温和,但在功能特性的改变上并非有较大差异性,且会在蛋白质酶解时产生苦味。糖基化修饰对蛋白的功能特性有较为显著的改变,但研究发现反应易受温度、pH以及时间等因素影响,从而使改性后的蛋白有较浓重的色泽干扰,这直接影响了产品的感官特性[7]。在改性技术上,应更可能地选择物理、化学、酶法以及糖基化法等多技术方法联用,规模化生产具有安全性、稳定性、高附加值的核桃蛋白。
[1] LAURA J,MAR V,ROSINA L.Glycosylation of individual whey proteins by maillard reaction using dextran of different molecular mass[J].Food Hydrocolloids,2006,21(3):433-443.
[2] 曹静. 基于大豆多糖的糖基化蛋白制备及其性能研究[D].广州:华南理工大学,2018.
[3] 夏秀芳,洪岩,郑环宇,等.湿法糖基化改性对大豆分离蛋白溶解性和乳化能力的影响[J].中国食品学报,2016,16(1):167-172.
[4] 张琳静,于国萍.木瓜蛋白酶水解大豆浓缩蛋白及糖基化修饰对水解产物溶解性的影响[J].食品科学,2011,32(16):1-4.
[5] DECOURCELLE N,SABOURIN C,DAUER G,et al.Effect of the maillard reaction with xylose on the emulsifying properties of a shrimp hydrolysate (Pandalus borealis)[J].Food Research International,2010,43(8):2 155-2 160.
[6] OLIVER C M,MELTON L D,STANLEY R A.Creating proteins with novel functionality via the maillard reaction:a review[J].Critical Reviews in Food Science & Nutrition,2006,46(4):337-350.
[7] 彭秀清. 大豆多糖共价交联调控大豆蛋白乳化性质及相关分子机制[D]. 广州: 华南理工大学, 2019.
[8] HORAX R,HETTIARACHCHY N,KANNAN A,et al.Protein extraction optimisation,characterisation,and functionalities of protein isolate from bitter melon (Momordica charantia) seed[J].Food Chemistry,2011,124(2):545-550.
[9] BRANDS C M J,VAN B M A J S.Kinetic modelling of reactions in heated disaccharide-casein systems[J].Food Chemistry,2003,83(1):13-26.
[10] DIFTIS N,KIOSSEOGLOU V.Improvement of emulsifying properties of soybean protein isolate by conjugation with carboxymethyl cellulose[J].Food Chemistry,2003,81(1):1-6.
[11] PAREDES-L PEZ O,ORDORICA-FALOMIR C,OLIVARES-V
PEZ O,ORDORICA-FALOMIR C,OLIVARES-V ZQUEZ M R.Chickpea protein isolates:physicochemical,functional and nutritional characterization[J].Journal of Food Science,1991,56(3):726-729.
ZQUEZ M R.Chickpea protein isolates:physicochemical,functional and nutritional characterization[J].Journal of Food Science,1991,56(3):726-729.
[12] PEDROCHE J,YUST M M,LQARI H,et al.Brassica carinata protein isolates:chemical composition,protein characterization and improvement of functional properties by protein hydrolysis[J].Food Chemistry,2004,88(3):337-346.
[13] AGYARE K K,ADDO K,XIONG Y L.Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH,temperature and salt[J].Food Hydrocolloids,2007,23(1):72-81.
[14] SPOTTI M J,MARTINEZ M J,PILOSOF A M R,et al.Influence of maillard conjugation on structural characteristics and rheological properties of whey protein dextran systems[J].Food Hydrocolloids,2014,39(11):223-230.
[15] VAN D P,VAN L A,HENDRICKX M E G.Changes in sulfhydryl content of egg white proteins due to heat and pressure treatment[J].Journal of Agricultural and Food Chemistry,2005,53(14):5 726-5 733.
[16] PETRUCCELLI S, MARIA C. Partial reduction of soy protein isolate disulfide bonds[J]. Journal of Agricultural & Food Chemistry, 1995, 43(8):2 001-2 006.
[17] ZHANG Q,TU Z,XIAO H,et al.Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J].Food & Bioproducts Processing,2014,92(1):30-37.
[18] LAROQUE D,INISAN C,BERGER C,et al.Kinetic study on the maillard reaction.consideration of sugar reactivity[J].Food Chemistry,2008,111(4):1 032-1 042.
[19] TURAN D,GIBIS M,GUNES G,et al.The impact of the molecular weight of dextran on formation of whey protein isolate (WPI)-dextran conjugates in fibers produced by needleless electrospinning after annealing[J].Food & Function,2018,9(4):10-15.
[20] TER H R,SCHOLS H A,GRUPPEN H.Effect of saccharide structure and size on the degree of substitution and product dispersity of α-lactalbumin glycated via the maillard reaction[J].Journal of Agricultural and Food Chemistry,2011,59(17):9 378-9 385.
[21] BERA M B, MUKHERJEE R K.Solubility,emulsifying,and foaming properties of rice bran protein concentrates[J].Journal of Food Science,1989,54(1):142-145.
[22] 王松,夏秀芳,黄莉,等.湿法糖基化改性对大豆分离蛋白功能性质的影响[J].食品科学,2014,35(9):38-42.
[23] 王中江,江连洲,魏冬旭,等.pH值对大豆分离蛋白构象及表面疏水性的影响[J].食品科学,2012,33(11):47-51.
[24] 袁也. 荧光蛋白的拉曼光谱研究及其结构与功能解析[D].武汉:华中农业大学,2016.
[25] 孙乾,张爱琴,薛雨菲,等.化学改性对核桃谷蛋白结构表征及功能特性的影响[J].食品科学,2019,40(20):87-93.
[26] 田素燕,李连之,高磊,等.圆二色光谱法研究环境因素对细胞红蛋白二级结构的影响[J].分析化学,2009,37 (8):1 097-1 101.
[27] MARZBAN G,HERNDL A,PIETROZOTTO S,et al.Conformational changes of mal d 2,a thaumatin-like apple allergen,induced by food processing[J].Food Chemistry,2008,112(4):803-811.
[28] 周昊,王成章,叶建中,等.高静压处理改善白果蛋白致敏性和功能特性[J].农业工程学报,2016,32(8):292-298.
[29] ZHONG D,JIAO Y,ZHANG Y,et al.Effects of the gene carrier polyethyleneimines on structure and function of blood components[J].Biomaterials,2013,34(1):294-305.
[30] 耿勤,黄丽,杨榕,等.米渣蛋白中谷蛋白与亚油酸的相互作用机制[J].食品科学,2017,38(21):152-157.
[31] MAO X,HUA Y.Composition,structure and functional properties of protein concentrates and isolates produced from walnut (Juglans regia L.)[J].International Journal of Molecular Sciences,2012,13(2):1 561-1 581.
[32] VALUEVA T A,REVINA T A,MOSOLOV V V,et al.Primary structure of potato kunitz-type serine proteinase inhibitor[J].Biological Chemistry,2000,381(12):1 215-1 221.
[33] KATO A,KOMATSU K,FUJIMOTO K,et al.Relationship between surface functional properties and flexibility of proteins detected by the protease susceptibility[J].Journal of Agricultural and Food Chemistry,1985,33(33):931-934.
[34] 李燕燕,王立,钱海峰,等.酰化大米蛋白理化性质及胰蛋白酶酶解性质研究[J].现代食品科技,2015,31(2):81-86.
[35] 孙领鸽,毛晓英,王丹丹,等.丙二醛氧化修饰对核桃分离蛋白乳化性质的影响[J].中国食品学报.2020,20(5):84-90.
[36] 王丹丹,毛晓英,孙领鸽,等.氢过氧化物氧化对核桃蛋白结构和乳化特性的影响[J].中国食品学报,2019,19(12):60-68.
[37] 王丹丹,孙领鸽,毛晓英.脂质氢过氧化物氧化对核桃分离蛋白结构的影响[J].食品与发酵工业,2019,45(1):94-99.
[38] 薛雨菲,张玥,程怡媚,等.酶法改性对核桃谷蛋白微观结构及功能特性的影响[J].食品与机械,2019,35(10):18-23.
[39] 张爱琴,齐凤敏,赵爱萍,等.谷氨酰胺转氨酶改性核桃谷蛋白的结构表征分析[J].中国粮油学报,2019,34(11):38-44.