益生菌是一类摄入人体后对肠道环境有益的活性微生物[1],其中乳酸菌属及双歧杆菌属最为常见。干酪乳杆菌属于革兰氏阳性菌,常见于发酵蔬菜、发酵乳等食品及人体肠道内[2],在厌氧或兼性厌氧环境中生长良好。干酪乳杆菌能黏附于肠道上皮细胞进而定植于肠道,并代谢生成短链脂肪酸等产物[3-4],酸化肠道环境,抑制单增李斯特菌[5]、金黄色葡萄球菌[6]、沙门氏菌、大肠杆菌[7]等致病菌的定植;能够发酵牛奶中的乳糖并制备成酸奶,对于乳糖不耐症患者是一大福音;干酪乳杆菌对代谢综合症的缓解作用也较为显著[8]。
乳酸菌广泛的益生功效备受关注,如何高效制备乳酸菌制剂一直被不断探索,真空冷冻干燥法是目前生产生物活性制剂的主要手段。为了提高冻干后菌株的存活率、单位质量菌粉所含活菌数以及菌粉的货架期稳定性[9],各种糖类[10]、蛋白质以及一些小分子化合物[11-13]对菌体的保护作用被深入剖析。已发现糖类的冻干保护效果优于其他类保护剂,且低聚糖对乳杆菌的冻干保护效果最好[14];亦有研究认为,海藻糖的冻干保护效果最好[15],它具有低流动性、高黏度和高玻璃转化温度,能够在冻干过程形成玻璃态保护菌体蛋白功能[16],并且通过氢键替代水化层稳定脂质膜和蛋白质结构。
冻干保护剂的使用确实提高了乳酸菌制剂的制备效率,但是很难仅通过优化保护剂进一步提高制备效率。通过提高菌体抗逆性和冻干存活率亦被研究,如酸胁迫、低温胁迫、渗透压胁迫等,但是菌体在生长过程中不可避免产生的表面物质对菌体冻干存活的影响一直被忽视。乳酸菌表面物质主要是由荚膜多糖和表面蛋白组成。荚膜多糖依靠糖的多羟基结构与细胞膜表面的磷脂产生氢键作用,附着于细胞表面;表面蛋白也是菌体表面物质的一种,包括S层蛋白、膜蛋白、分泌蛋白与其他表面蛋白。已有研究表明,荚膜多糖和表面蛋白对菌体有一定的保护作用,能够帮助菌体抵御外界的恶劣环境[17-19]。但是菌体表面物质与冻干保护剂对菌体的冻干保护效果是否有差异,在已有高效保护剂的条件下增加或减少表面物质对菌体冻干存活是否有影响,至今均无定论。菌体自身表面物质与细胞膜的结合可能使其较外源添加的保护剂能更有效地保护菌体细胞膜的完整性或流动性,这种结合亦可能影响保护剂对细胞膜的保护。故本研究选择水苏糖、海藻糖及菊粉作为冻干保护剂,通过物理剥离和发酵控制的方法探索表面物质的产生及产量对干酪乳杆菌冻干存活的影响。
1 材料和方法
1.1 材料与试剂
1.1.1 菌株
干酪乳杆菌17005、干酪乳杆菌173011CQQJ3、干酪乳杆菌PS5-4,来自于江南大学食品生物技术菌种保藏中心,由人类粪便中筛选得到。
1.1.2 试剂
K2HPO4·3H2O、MnSO4·H2O、MgSO4、K2SO4、CuSO4、NaCl、无水乙酸钠、无水葡萄糖、1水合乳糖、柠檬酸氢二胺、L-半胱氨酸盐酸盐、琼脂粉、H2SO4、无水乙醇、蒽酮,国药集团化学试剂有限公司;酵母粉和蛋白胨,苏州达麦迪生物医学科技有限公司;阿拉伯糖、海藻糖、水苏糖及菊粉,上海创赛科技有限公司;酵母浸粉FM 528,安琪酵母股份有限公司。
1.2 仪器与设备
GRP-9080型隔水式恒温培养箱,上海森信实验仪器有限公司;FE20型pH计、EL3002型电子天平,梅特勒-托利多仪器(上海)有限公司;MS 3 basic型涡旋振荡器,德国IKA公司;保兴BIOTECH-3000发酵罐,上海保兴生物设备(上海)有限公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;SW-CJ-1CU型超净工作台,苏州安泰空气技术有限公司;UV-2450紫外分光光度计,日本岛津公司;K1100凯氏定氮仪,济南海能仪器股份有限公司;Telstar Lyobeta 5ps 冻干机,西班牙泰事达公司;超声破碎仪JY92-IIDN,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 菌株的活化及培养
取冻存于-80 ℃的保菌管,接种环蘸取少量菌液后在MRS固体平板划线纯化,置于37 ℃隔水式恒温培养箱中培养36~48 h,挑取单菌落接种于5 mL MRS液体培养基,37 ℃恒温培养12~18 h,即得菌株的种子液。
1.3.2 干酪乳杆菌表面物质的剥离
采用物理超声法对稳定期收集的菌体进行表面物质的剥离[20],具体操作如下:离心(8 000×g,15 min)收集培养至稳定期的菌体,生理盐水洗涤两次,菌泥按照1∶1(g∶mL)重悬于1 mol/L NaCl溶液混匀后,分别置于63、72、81、90 W的功率条件下,冰浴超声6、12、18 min,超声前后取样测定菌悬液中菌体的活菌数,计算超声后的存活率。
1.3.3 表面物质剥离前后干酪乳杆菌的透射电镜观察
按1.3.2中得到的最优条件剥离菌体表面物质后,用体积分数为4%戊二醛前固定,随后加入1 mg/mL 四氧化锇后固定,最后用75%乙醇脱水,环氧树脂包埋,制备超薄切片,乙酸双氧铀和柠檬酸铅进行切片染色,完成后置于透射电镜下观察[21]。
1.3.4 表面物质剥离前后干酪乳杆菌的冻干
离心(8 000×g,15 min)收获稳定期的菌体后,取4份湿菌泥样品,每份1 g,分别添加1 mL的生理盐水、200 g/L水苏糖溶液、200 g/L海藻糖溶液和200 g/L菊粉溶液,充分混匀后进行冻干;另取4份湿菌泥样品,每份1 g,按照最优超声条件剥离表面物质,离心(8 000×g,15 min)收集表面物质被剥离后的菌泥,分别添加1 mL的生理盐水、200 g/L水苏糖溶液、200 g/L海藻糖溶液和200 g/L菊粉溶液,并分别用无菌水定容至与未剥离组菌悬液相同体积(确保冻干前剥离组与未剥离组活菌数一致,保护剂浓度和比例一致),充分混匀后进行冻干。
冻干条件:预冻,控制层板1 h内降温至-50 ℃,保持4 h;一次干燥,控制层板1.3 h升温至-30 ℃,保持30 h;二次干燥,控制层板1 h升温至25 ℃,保持20 h。
1.3.5 冻干样品的活菌数及存活率计算
将冻干样品以无菌水复溶至冻干前体积,采用平板菌落计数法进行活菌计数,并根据公式(1)计算冻干存活率:
冻干存活率![]()
(1)
1.3.6 干酪乳杆菌表面物质含量的测定
以1.3.2中得到的最优条件剥离菌体表面物质,超声结束后离心(8 000×g,20 min)取上清液,用于荚膜多糖和表面蛋白的测定。其单位菌体表面物质含量为单位菌体荚膜多糖与表面蛋白含量之和。
荚膜多糖含量的测定采用硫酸-蒽酮比色法[22]:称取0.2 g蒽酮溶解于100 mL的体积分数为81%的H2SO4,取适量上清液按一定比例稀释至1 mL,加入4 mL H2SO4-蒽酮溶液,沸水浴10 min后取出并冷却至室温,测定OD620,根据公式(2)计算荚膜多糖含量(mg/CFU):
多糖含量![]()
(2)
表面蛋白含量的测定采用凯氏定氮法[23]:称取3.6 g K2SO4和0.4 g CuSO4作为消化催化剂加至消化管,取1 mL上清液及10 mL浓H2SO4加入消化管,置于石墨炉上消化。消化程序为120 ℃/2 min,180 ℃/2 min,240 ℃/30 min,350 ℃/60 min,420 ℃/60 min,待样品冷却至室温后进行滴定,所得蛋白浓度即为每1 mL上清液中蛋白浓度,根据样品体积及浓度计算得到样品的总蛋白浓度,并根据公式(3)计算单位菌体表面蛋白含量(mg/CFU):
蛋白含量![]()
1.3.7 不同发酵条件下菌体表面物质含量测定与冻干
1.3.7.1 不同碳氮比
配制碳氮比为4∶1、4∶3的发酵培养基各3 L,氮源为酵母浸粉FM 528,葡萄糖质量浓度为80 g/L,其余营养成分参考MRS培养基。干酪乳杆菌17005按1.3.1的条件活化后,以体积分数为2%的接种量接种于5 L发酵罐中进行pH6.0、37 ℃恒温培养,并分别于对数期及稳定期收集菌体,一部分菌泥用于单位菌体表面物质含量的测定,一部分菌泥以质量体积比1∶1(g∶mL)添加200 g/L水苏糖进行冻干,测定冻干前后活菌数并计算存活率
1.3.7.2 不同碳源
以葡萄糖、阿拉伯糖为碳源,配制2种不同碳源的发酵培养基。其中质量碳源浓度为20 g/L,氮源(酵母浸粉FM 528)质量浓度为15 g/L、无机盐、微量元素与MRS培养基一致。菌株按1.3.1的条件活化后,以2%接种量接种于5 L发酵罐(装液量为3 L),菌株培养及收集方式及冻干条件参考1.3.7.1。
1.3.8 数据统计与分析
每个实验值的测定均为3次平行实验的平均值。数据分析采用Graphpad 7.0完成,结果以均值±标准差显示。显著性采用T检验分析,P<0.05为数据存在显著性差异。
2 结果讨论
2.1 干酪乳杆菌表面物质剥离的最优条件
将菌体重悬于1 mol/L NaCl溶液中,由于高渗透压作用菌体产生收缩,其表面物质与细胞壁之间的空隙增大,在超声的空化作用下表面物质更易于破碎溶出[24]。图1表明在较低功率(63和72 W)时,菌体的活性均不受影响,即使延长超声时间,菌体活性依然未有损失。超声功率继续提高后,不同菌株的耐受性呈现出差异。干酪乳杆菌173011CQQJ3和干酪乳杆菌PS5-4对超声具有较强的耐受能力,只在90 W功率超声18 min时存活率有所下降;干酪乳杆菌17005在81和90 W时超声较短的时间,其活性不受影响,但超声时间达到18 min,存活率显著降低。过高的超声频率及时间会使菌体破裂,且超声过程中会由于水分子高速运动不断释放热量,影响菌体活性。为了确保菌体表面物质被完全剥离,在菌体活性保持无损失的前提下采取最大的超声功率和超声时间,即干酪乳杆菌17005、干酪乳杆菌173011CQQJ3、干酪乳杆菌PS5-4表面物质剥离条件分别为90 W/6 min、90 W/12 min、90 W/12 min;并通过透射电镜验证最优条件处理后的干酪乳杆菌17005表面物质的剥离情况。
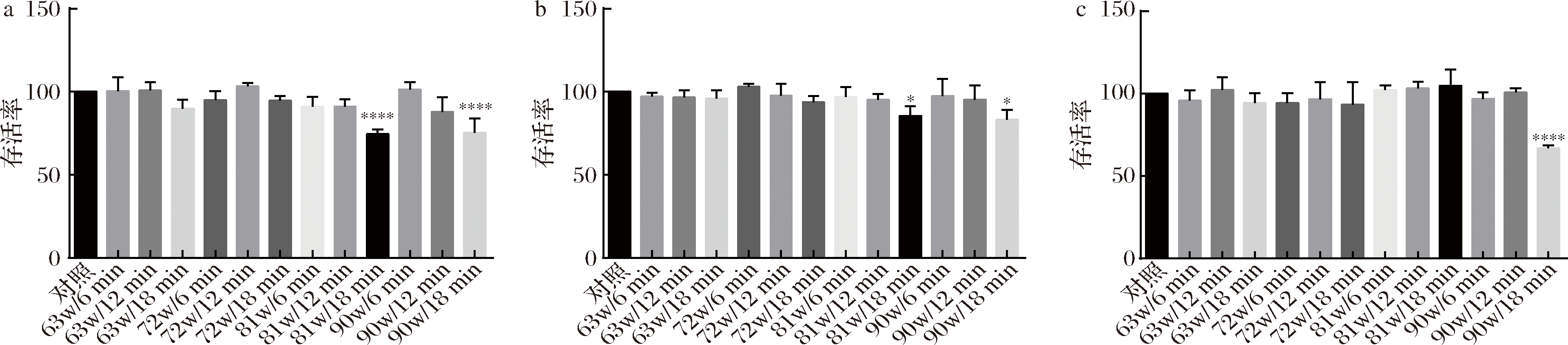
a-干酪乳杆菌17005; b-干酪乳杆菌173011CQQJ3; c-干酪乳杆菌PS5-4
图1 干酪乳杆菌在不同超声条件下的存活率
Fig.1 The survival rate of different L.casei under different ultrasonic conditions
注:*表示在P<0.05上具有显著性差异;**表示在P<0.01上具有显著性差异;***表示在P<0.001上具有显著性差异;****表示在P<0.0001上具有显著性差异(下同)
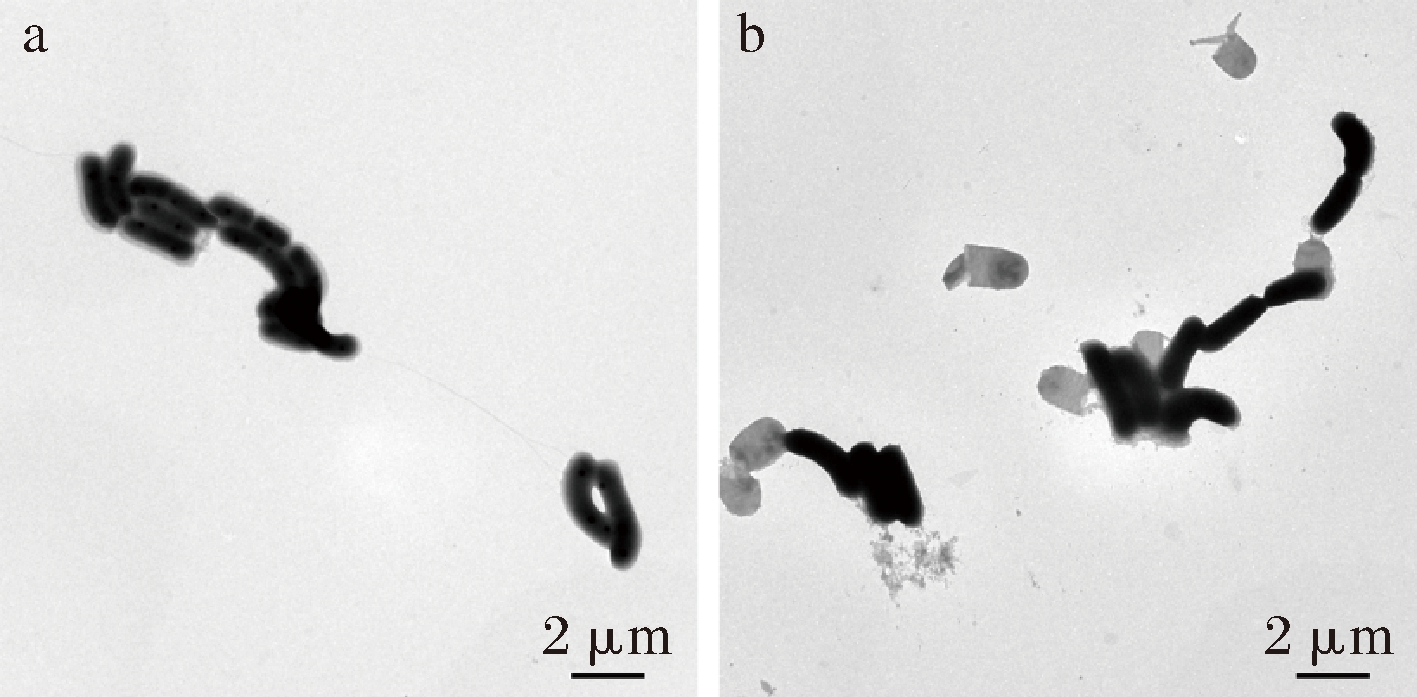
a-未剥离组; b-剥离组
图2 表面物质剥离前后的干酪乳杆菌形态
Fig.2 The morphological characteristics of L.casei before and after the surface material stripped
对比图2-a及图2-b发现,剥离组菌体的表面物质被显著剥离,且视野中的菌体完整无损伤,证实了该方法的可行性及有效性。干酪乳杆菌17005的湿菌泥经过超声处理后,再离心收集的菌泥湿重约为处理前的70%左右,进一步证实了表面物质被高效剥离;但是处理后干重仅降低7%,即1 g湿菌泥仅有0.015 g的表面物质,也证实了菌体的表面物质可以与培养基中水分子通过氢键结合,一方面增加了菌泥的含水量降低菌体收集效率,另一方面这层特殊的结构可能对菌体的冻干存活产生影响。
2.2 表面物质对于菌体冻干存活率及活菌数的影响
2.2.1 无保护剂条件下干酪乳杆菌表面物质剥离前后冻干存活率
为了研究干酪乳杆菌表面物质的冻干保护作用,将表面物质剥离前后的3株干酪乳杆菌重悬于生理盐水中冻干,其冻干存活率如图3。
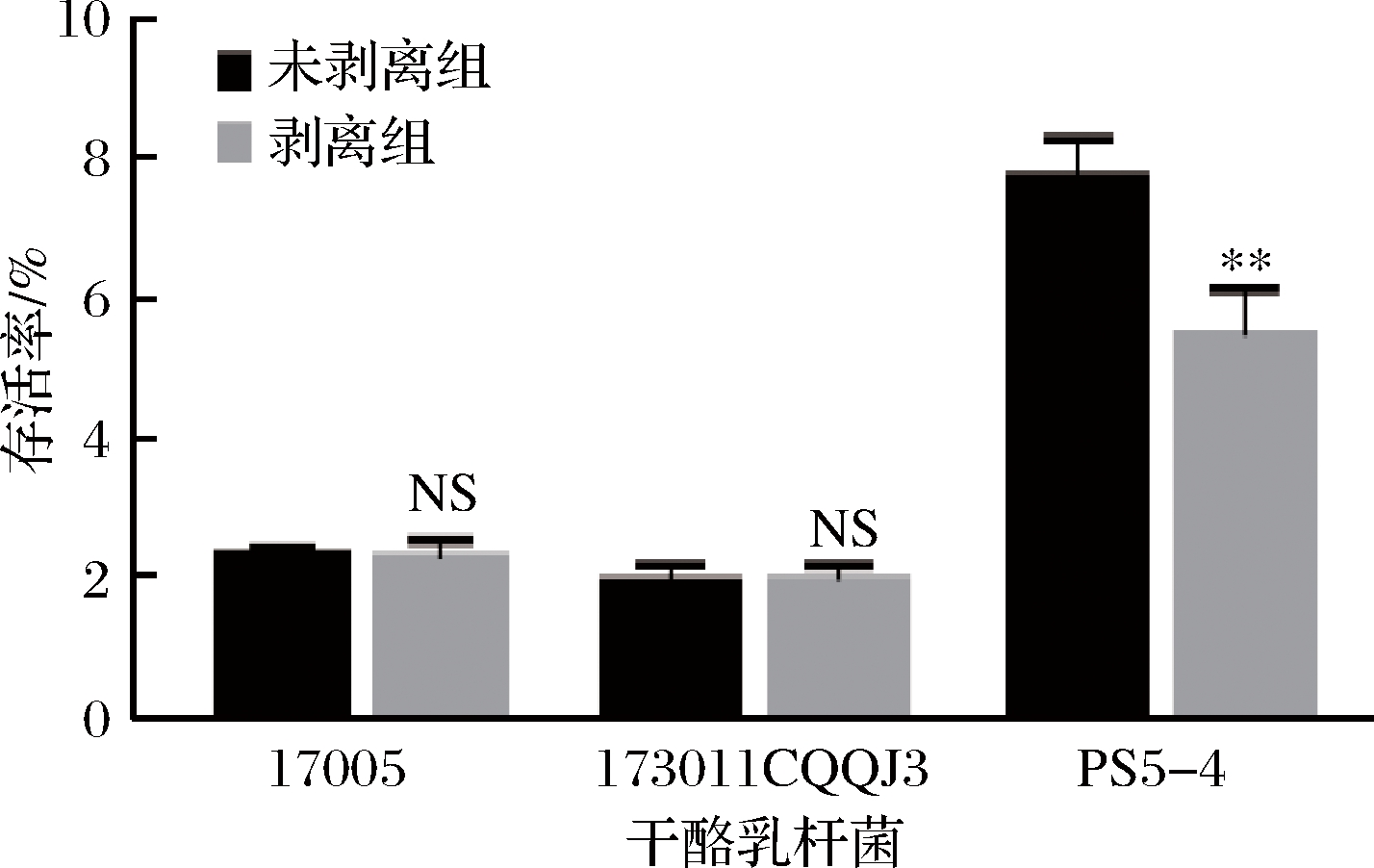
a-干酪乳杆菌17005; b-干酪乳杆菌173011CQQJ3; c-干酪乳杆菌ps5-4
图3 三株干酪乳杆菌表面物质剥离前后混合生理盐水的冻干存活率
Fig.3 The freeze-drying survial rate of three strains of L.casei with saline solution before and after the surface substance stripped
注:NS表示没有显著性差异(P<0.05)(下同)
在没有保护剂的条件下,3株菌的死亡率均超过90%。虽然表面物质未剥离对菌体的冻干存活略有提高,但仅依靠表面物质对菌体的保护作用,不足以降低冻干对菌体造成的损失。为比较单位质量表面物质和单位质量保护剂(水苏糖或海藻糖)对菌体的保护差异,在菌体表面物质剥离后,将其置于含有与表面物质等量的保护剂溶液中(10 g/L),但结果表明存活率未有显著差异(数据结果未列出)。在这种低量的情况下,无论是菌体自身的表面物质,还是保护剂均无法有效保持菌株在冻干过程中的活性。要确保菌株冻干后的活性,依然需要大量的冻干保护剂。但是表面物质均是大分子结构,附着在菌体表面以多种形式与细胞膜结合,其是否会影响保护剂对菌体的冻干保护作用? DIMOPOULOU等[17]研究酒球菌属的胞外多糖及冻干存活率关系时总结道,在麦芽糊精与蔗糖作保护剂时,胞外多糖的产生能够显著提高酒球菌属的冻干存活率。因此应该添加保护剂对表面物质及保护剂的保护效果差异进行研究。
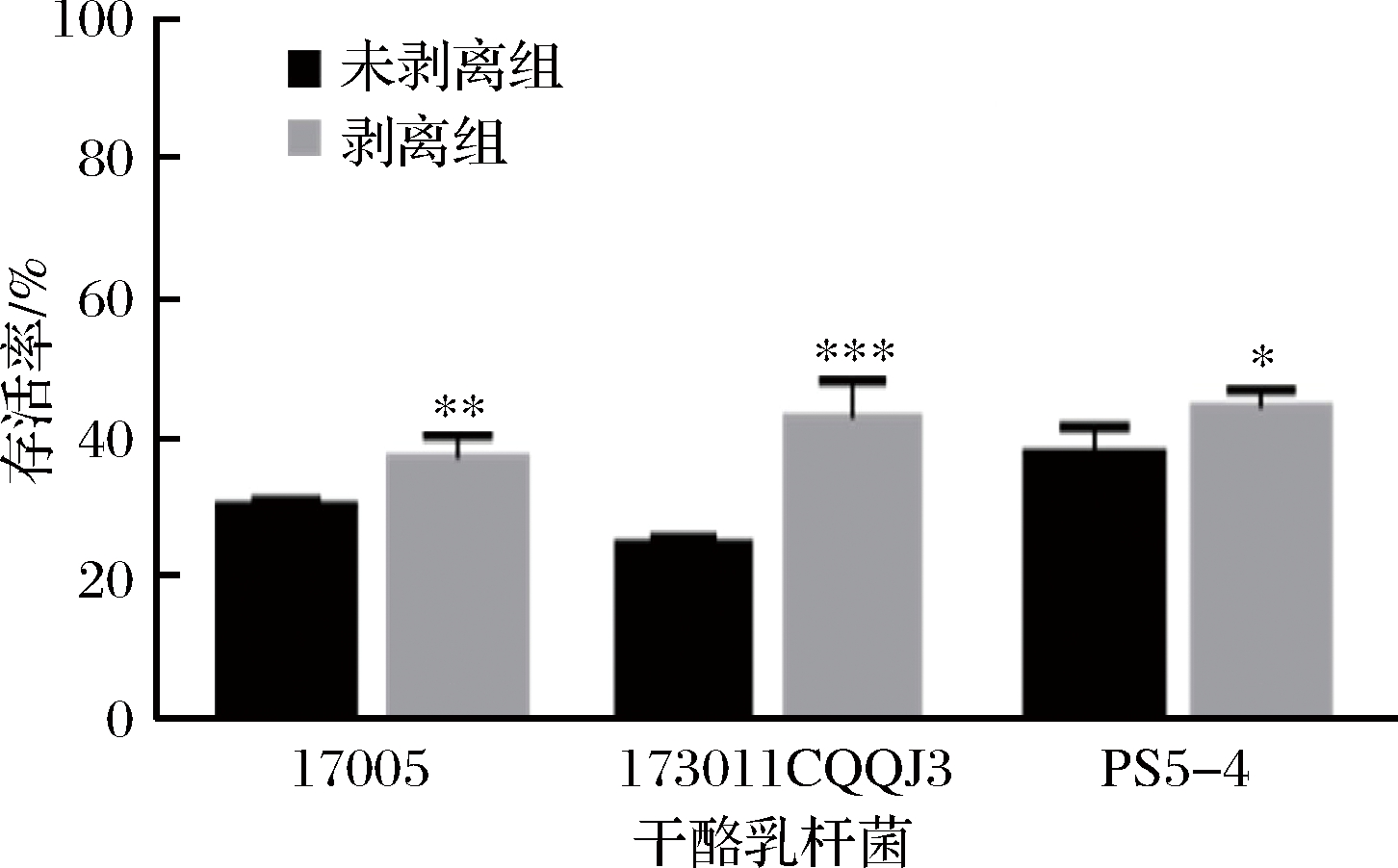
2.2.2 以水苏糖或海藻糖作为保护剂条件下干酪乳杆菌表面物质剥离前后冻干存活率
将剥离表面物质前后的菌体以水苏糖作为保护剂进行冻干,其冻干存活率如图4所示。表面物质剥离后3株干酪乳杆菌的冻干存活率均有不同程度的提高。干酪乳杆菌17005、173011CQQJ3及PS5-4未剥离组的存活率分别为(30.46±6.08)%、(23.82±8.68)%、(35.71±3.59)%,而表面物质剥离后存活率分别达到了(49.73±4.51)%、(35.71±3.59)%、(38.89±10.39)%。为了排除剥离过程中1 mol/L 的NaCl溶液对于菌株冻干活性的影响,分别将菌体重悬于1 mol/L的NaCl溶液和生理盐水中且不进行超声,静置半小时后冻干,其冻干存活率如图5所示,未处理组与高渗处理组的3株干酪乳杆菌冻干存活率无显著性差异,说明短时间的高渗透压环境对菌株冻干存活率没有显著影响。结果表明在以水苏糖作为保护剂时,无表面物质的干酪乳杆菌冻干存活率显著提高。
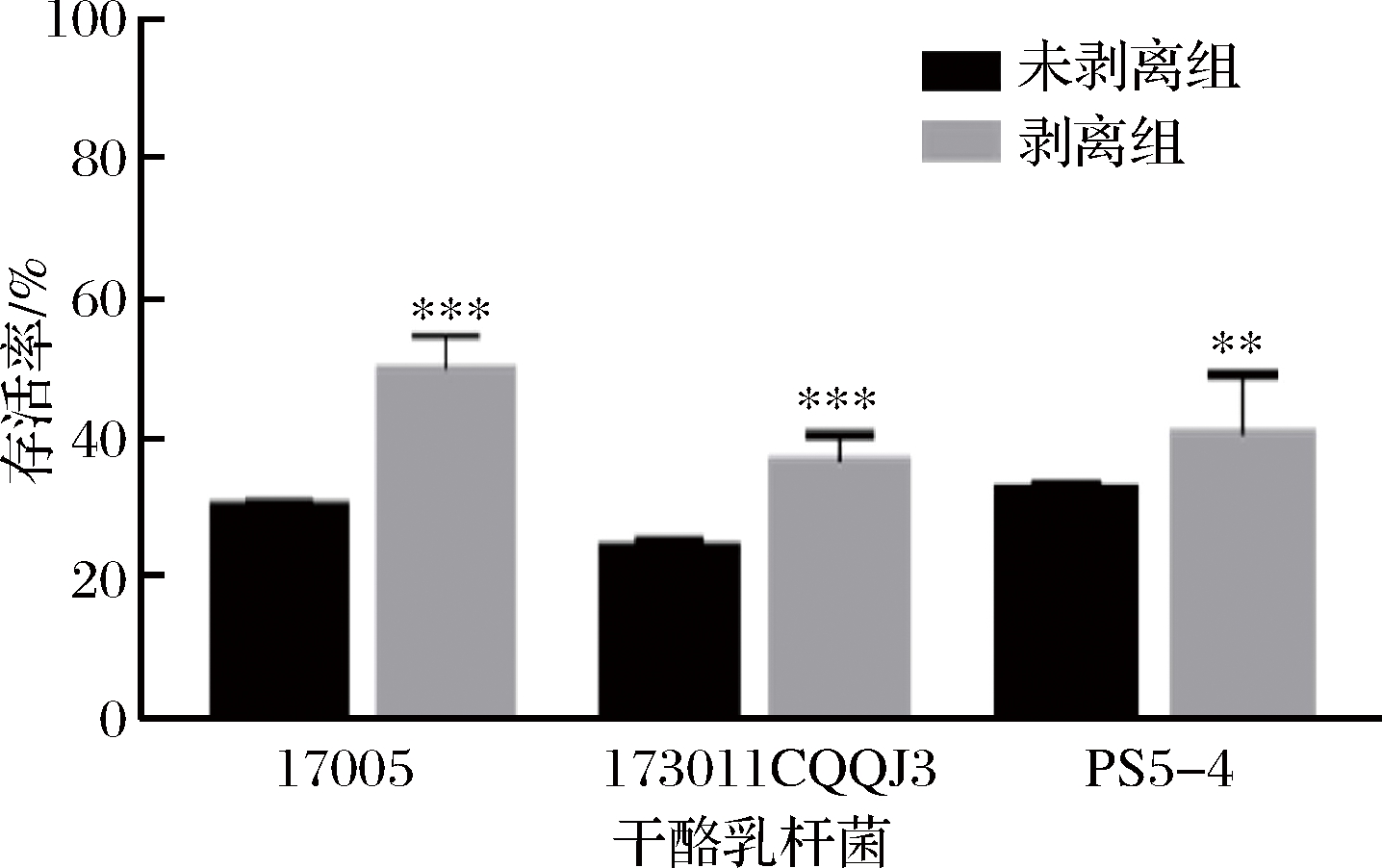
a-干酪乳杆菌17005; b-干酪乳杆菌173011CQQJ3; c-干酪乳杆菌ps5-4
图4 三株干酪乳杆菌表面物质剥离前后以水苏糖为保护剂的冻干存活率
Fig.4 The survival rate of three strains of L.casei before and after the surface substance stripped with stachyose as cryoprotectant
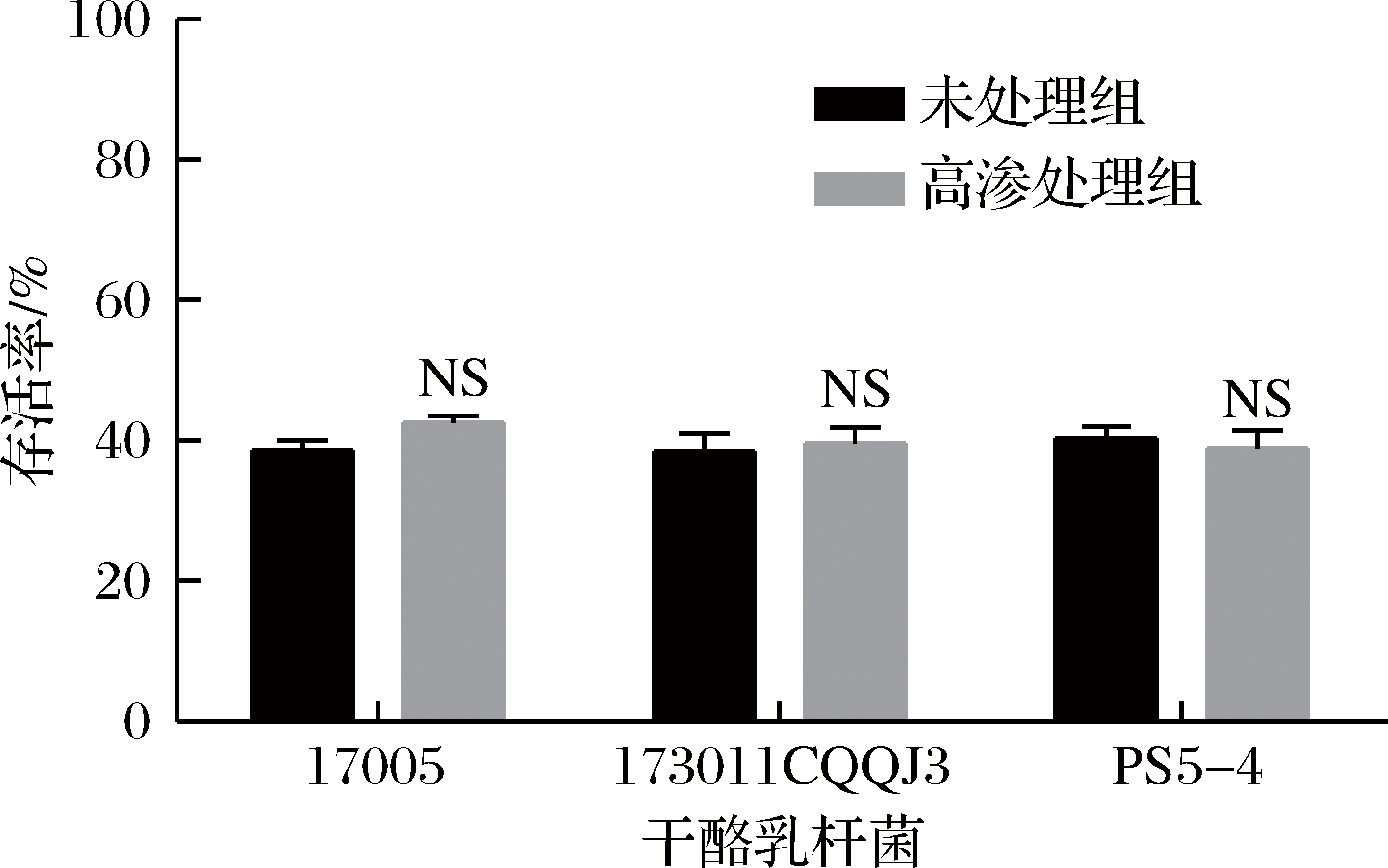
图5 三株干酪乳杆菌高渗透压处理前后的冻干存活率
Fig.5 The freeze-drying survial rate of three strains of L.casei before and after processed in hyperosmotic media
以海藻糖作为保护剂时,得到与水苏糖作为保护剂一样的规律。结果如图6所示,3株干酪乳杆菌在表面物质剥离前后以海藻糖作为保护剂时冻干存活率均有一定的提高,说明在以最适的小分子糖为保护剂时,菌体产生的大分子表面物质会影响小分子糖对菌体的冻干保护。越来越多的证明表明,小分子糖类保护剂与细胞膜的结合,维持其完整性和流动性是菌体减少冻干损失的主要原因。表面物质作为大分子,其在冻干过程中对菌体的保护作用可能不及小分子糖类保护剂,且亦会影响小分子羟基类物质与细胞膜的结合。
a-干酪乳杆菌17005; b-干酪乳杆菌173011CQQJ3; c-干酪乳杆菌ps5-4
图6 三株干酪乳杆菌表面物质剥离前后以海藻糖为保护剂的冻干存活率
Fig.6 The survial rate of three strains of L.casei before and after the surface substance stripped with trehalose as cryoprotectant
2.2.3 以菊粉为保护剂的条件下干酪乳杆菌表面物质剥离前后冻干存活率
菊粉是不同聚合度的大、小分子聚果糖的混合物,相对分子量显著高于水苏糖和海藻糖。结果如图7所示,在以大分子菊粉为保护剂时,3株菌的冻干存活率均较低,且表面物质剥离后,存活率降低。表明在以大分子为保护剂时,菌体表面物质的存在利于对菌的冻干保护。大分子保护剂不像小分子糖类能够穿透细胞壁,与细胞膜紧密结合,在细胞膜和细胞壁之间形成有效的保护层结果表明。在以小分子糖类为保护剂时,菌体的表面物质作为大分子附着在菌体表面可能影响小分子羟基类物质对菌体的保护;在以大分子多羟基类物质为保护剂时,表面物质因其与菌体更好的结合,体现出较大分子保护剂更优的保护作用。

a-干酪乳杆菌17005; b-干酪乳杆菌173011CQQJ3; c-ps5-4
图7 三株干酪乳杆菌表面物质剥离前后以菊粉为保护剂的冻干存活率
Fig.7 The survial rate of three L.casei before and after stripping the surface substance with inulin as cryoprotectant
2.3 干酪乳杆菌表面物质分析
基于2.2中表面物质影响小分子糖对菌体冻干保护的假设,对3株干酪乳杆菌的表面物质成分进行分析测定,结果如图8所示。3株干酪乳杆菌表面物质中大部分是表面蛋白,多糖仅占很少比例。谭莎莎等[14]研究乳杆菌冻干保护规律时总结羟基类保护剂的冻干保护效果显著优于蛋白类物质,因羟基基团能够与菌体细胞膜形成紧密氢键结合,保护细胞膜的完整结构;且海藻糖和水苏糖在冻干过程中能够形成高黏度、低流动的玻璃态介质,当蛋白质水化层被破坏后,代替水化层保护蛋白质的功能;而大分子的蛋白类物质起不到该方面的保护作用,表面物质的高蛋白可能是其影响水苏糖和海藻糖冻干保护效果的主要原因。
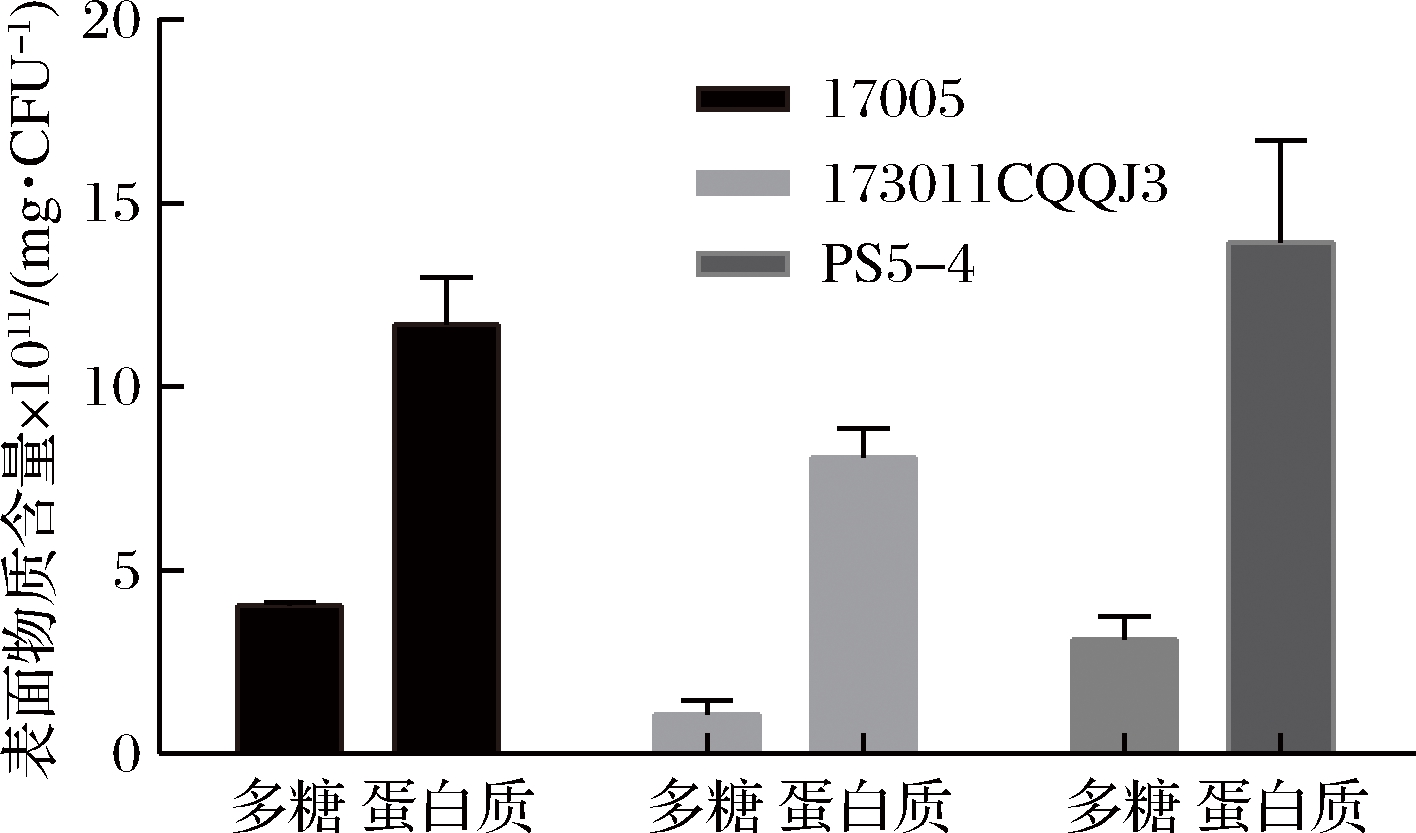
图8 干酪乳杆菌单位菌体糖含量及蛋白含量
Fig.8 The polysacharide and protein content of L.casei
2.4 不同发酵条件对菌株表面物质的产量及冻干存活的影响
为了进一步验证表面物质含量与菌体冻干存活率的关系,以干酪乳杆菌17005作为研究对象,通过改变发酵条件探索表面物质产量与干酪乳杆菌的冻干存活率的关系,分别从培养基的碳氮比,碳源种类2方面进行分析。
2.4.1 不同碳氮比发酵对菌株表面物质及冻干存活率的影响
有研究表明,过高的碳氮比会增加微生物胞外多糖的产生[25]。因此,以高碳氮比和低碳氮比分别培养干酪乳杆菌17005,分析对数期和稳定期菌体的表面物质的产生和冻干存活率。结果如表1所示,在对数生长期(8 h)高碳氮比培养的干酪乳杆菌17005较低碳氮比产生更多的表面物质,且进一步影响了菌体的冻干存活率,较低的表面物质的产生利于对数期菌体的冻干存活。但是在稳定期(14 h)收集的菌体,虽然高碳氮比较低碳氮比亦产生较多的表面物质,冻干存活率却无显著性差异。且稳定期收集的菌体比对数期的菌体产生更多的表面物质,而冻干存活率并未降低。说明在稳定期培养环境的饥饿胁迫和高渗胁迫(80 g/L碳源发酵结束环境渗透压较高)提高的菌体抗逆性是除保护剂之外保持菌体冻干活性的主要因素[26],表面物质产生的多少并不会显著影响稳定期菌株的冻干存活率。
表1 干酪乳杆菌17005单位菌体表面物质含量及冻干存活率
Table 1 The content of surface substance of each L.casei 17005 cell and its freeze-drying survival rate
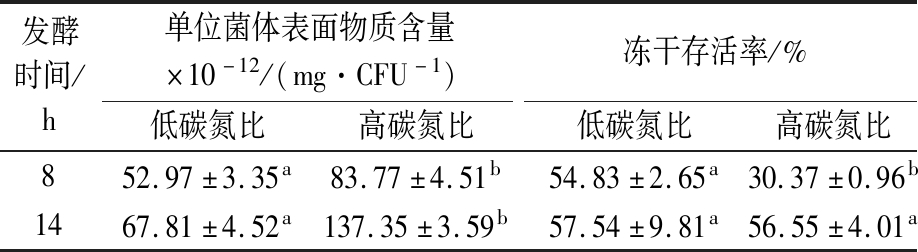
发酵时间/h单位菌体表面物质含量×10-12/(mg·CFU-1)冻干存活率/%低碳氮比高碳氮比低碳氮比高碳氮比852.97±3.35a83.77±4.51b54.83±2.65a30.37±0.96b1467.81±4.52a137.35±3.59b57.54±9.81a56.55±4.01a
注:各行不同字母表示数据之间存在显著性差异(P<0.05)(下同)
2.4.2 不同碳源发酵对菌体的表面物质含量及冻干存活率的影响
碳源的种类会显著影响荚膜的产生,戊糖无法被乳酸菌磷酸化生成6-磷酸葡萄糖参与荚膜合成途径[27],阿拉伯糖是戊糖,较葡萄糖产生更少的表面物质(表2)。在对数期,阿拉伯糖培养的菌体表面物质含量显著低于葡萄糖培养的菌体,其冻干存活率亦与表面物质含量呈负相关,与不同碳氮比发酵培养形成的结果一致。但在稳定期,菌体的冻干存活率与表面物质的关系与2.4.1的结果相反,这可能是该组实验采取的是20 g/L的碳源,发酵结束培养环境的渗透压并未达到对菌体产生渗透胁迫的条件,且阿拉伯糖的利用效率低,发酵12 h依然有阿拉伯糖尚未完全利用,此时菌体未受到的饥饿和高渗胁迫,表面物质对菌体冻干存活的影响是主要因素;且表面物质的含量超过一定量(单位菌体表面物质含量>1.6×10-10 mg/CFU)时,其对水苏糖的保护效果的影响不再变化。因此,在不受到其他胁迫影响的条件下,干酪乳杆菌菌体的冻干存活与表面物质的产生呈负相关,表面物质产生的越多,越会降低水苏糖对菌体的冻干保护。
表2 不同碳源发酵后干酪乳杆菌17005单位菌体表面物质含量及冻干存活率
Table 2 The content of surface substance of each L.casei 17005 cell under different carbon sources fermentation conditions and freeze-drying survival rate
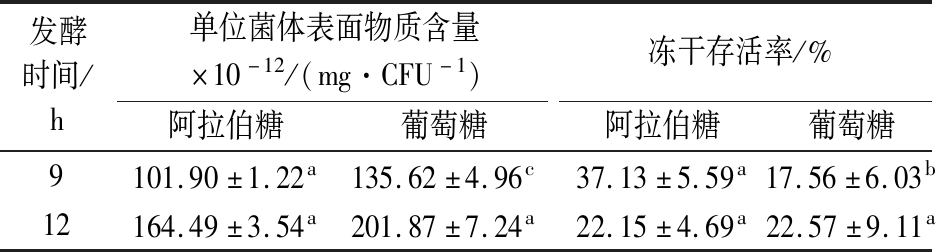
发酵时间/h单位菌体表面物质含量×10-12/(mg·CFU-1)冻干存活率/%阿拉伯糖葡萄糖阿拉伯糖葡萄糖9101.90±1.22a135.62±4.96c37.13±5.59a17.56±6.03b12164.49±3.54a201.87±7.24a22.15±4.69a22.57±9.11a
3 结论
干酪乳杆菌的表面物质包括表面蛋白与荚膜多糖,且表面蛋白含量显著高于多糖含量。表面物质被剥离后,以海藻糖或水苏糖作为保护剂时菌体的冻干存活率显著提高,表面物质的过量产生会降低糖类对菌体的冻干保护作用。以阿拉伯糖作为底物碳源相较于葡萄糖可有效减少菌体表面物质的产生,提高菌体以水苏糖或海藻糖作为保护剂时的冻干存活率;降低发酵过程的碳氮比亦均可有效减少干酪乳杆菌表面物质的产生,进而提高对数期菌体以水苏糖或海藻糖作为保护剂时的冻干存活率。
[1] LIU Y,TRAN D,RHOADS J.Probiotics in disease prevention and treatment[J].Journal of Clinical Pharmacology,2018,58:164-179.
[2] GIRAFFA G,CHANISHVILI N,WIDYASTUTI Y.Importance of Lactobacillius in food and feed biotechnology[J].Research in Microbiology,2010,161(6):480-487.
[3] PRIYADARSHINI M,KOTLO K,DUDEJA P,et al.Role of short chain fatty acid receptors in intestinal physiology and pathophysiology[J].Comprehensive Physiology,2018,8(3):1 091-1 115.
[4] LIU Y,ALOOKARAN J,RHOADS J.Probiotics in autoimmune and inflammatory disorders[J].Nutrients,2018,10(10):1-19.
[5] MATHIPA M,THANTSHA M,BHUNIA A.Lactobacillus casei expressing internalins A and B reduces Listeria monocytogenes interaction with Caco-2 cells in vitro[J].Microbial Biotechnology,2019,12(4):715-729.
[6] SOUZA R,JARDIN J,CAUTY C,et al.Contribution of sortase SrtA2 to Lactobacillus casei BL23 inhibition of Staphylococcus aureus internalization into bovine mammary epithelial cells[J].PloS One,2017,12(3):1-21.
[7] PENG M,TABASHSUM Z,PATEL P,et al.Linoleic acids overproducing Lactobacillus casei limits growth,survival,and virulence of Salmonella typhimurium and Enterohaemorrhagic Escherichia coli[J].Frontiers in Microbiology,2018,11(9):1-14.
[8] PORTER N,CANALES P,PETERSON D,et al.A subset of polysaccharide capsules in the human symbiont Bacteroides thetaiotaomicron promote increased competitive fitness in the mouse gut[J].Cell Host & Microbe,2017,22(4):494-506.
[9] 颜玉虾. 海带乳酸菌咀嚼片的研制[D].福建:福建农林大学,2016.
[10] 李宝磊. 真空冷冻干燥对乳酸菌损伤机制及关键保护技术研究[D].哈尔滨:哈尔滨工业大学,2011.
[11] 王琳. 干酪乳杆菌冷冻干燥保护剂筛选及作用机理研究[D].天津:天津科技大学,2012.
[12] 仇梓冰, 于长青,张东杰,等.植物乳杆菌冷冻干燥保护剂配方优化及耐受性研究[J].中国食品添加剂,2016(10):142-148.
[13] 秦鹏, 谢鹏,刘广宇,等.响应曲面法优化罗伊氏乳杆菌冷冻干燥保护剂的配比[J].安徽农业科学,2016,44(5):6-7.
[14] 谭莎莎, 马方励,崔树茂,等.罗伊氏乳杆菌冻干保护剂的优选及高密度冻干工艺优化[J].食品与发酵工业,2020,46(4):1-6.
[15] CROWE L,REID D,CROWE J.Is trehalose special for preserving dry biomaterials[J].Biophysical Journal,1996,71(4):2 087-2 093.
[16] BELL L,HAGEMAN M.Glass transition explanation for the effect of polyhydroxy compounds on protein denaturation in dehydrated solids[J].Journal of Food Science,1996,61(2):372-375.
[17] DIMOPOULOU M,BARDEAU T,RAMONET P,et al.Exopolysaccharides produced by Oenococcus oeni:From genomic and phenotypic analysis to technological valorization[J].Food Microbiology,2016,53:10-17.
[18] DONOT F,FONTANA A,BACCOU J,et al.Microbial exopolysaccharides:main examples of synthesis,excretion,genetics and extraction[J].Carbohydrate Polymers,2012,87(2):951-962.
[19] PATEL A,PRAJAPAT J.Food and health applications of exopolysaccharides produced by lactic acid bacteria[J].Advances in Dairy Research,2013,1(2):1-7.
[20] 冯美琴. 植物乳杆菌胞外多糖发酵,结构鉴定及其功能特性研究[D].南京:南京农业大学,2012.
[21] 崔琳, 王学东,刘秀玫.微生物样品在电镜观察中的特殊制备方法[J].东北农业大学学报,1999(1):102-104.
[22] 林艺华. 硫酸蒽酮法测定风柜斗草粗多糖含量[J].福建分析测试,2017,26(6):52-55.
[23] 丁立人. 凯氏定氮仪测定饲料中粗蛋白含量误差因素分析[J].农业与技术,2018,38(21):17-19.
[24] TALLON R,BRESSOLLIER P,URDACI M.Isolation and characterization of two exopolysaccharides produced by Lactobacillus plantarum EP56[J].Research in Microbiology,2003,154(10):705-712.
[25] 邓超, 杜秀娟,黄涛,等.碳氮比对固氮菌株WN-F合成胞外多糖的影响[J].生物技术通报,2018,34(3):194-199.
[26] 靳志强, 刘子宇.影响冻干乳酸菌存活性的相关因素[J].中国乳业,2006(3):51-53.
[27] FRAUNHOFER M,JAKOB F,VOGEL R.Influence of different sugars and initial pH on beta-glucan formation by Lactobacillus brevis TMW 1.2112[J].Current Microbiology,2018,75(7):794-802.