人体肠道菌群是一个复杂的微生态系统,对宿主生理的许多方面都有影响,如疾病发展、药物代谢和免疫系统的调节等[1]。其中,乳酸菌因能产生乳酸并抑制肠道中有害微生物的生长,对宿主健康产生有益作用,被认为是一类益生菌[2]。人体肠道菌群的组成受多种因素的影响,其中饮食是一种重要的环境因素。CARMODY 等[3]研究认为饮食在形成宿主相关微生物群落个体差异中起主导作用。随含益生元的饮食摄入,通过增加特定细菌的数量来显著调节肠道菌群结构[4],可促进宿主肠道健康。国内外已有大量研究表明,低聚糖作为一种益生元,不易被肠道消化,能显著增殖部分乳酸菌和双歧杆菌[5-8]。菊粉、低聚果糖和低聚木糖、低聚异麦芽糖是4种重要的功能性低聚糖, 也是目前应用较为广泛的益生元。
近年来,国内外有一些关于乳酸菌代谢功能性低聚糖的研究,如王苗等[9]发现其实验中有4 株乳酸菌均能够优先利用魔芋甘露低聚糖中的聚合度≤3的组分进行生长和发酵产酸。BANUELOS等[10]实验表明,产气乳酸杆菌CECT5714和发酵乳杆菌CECT5716能在低聚果糖培养基中生长。但这些研究多以探究特定的低聚糖对特定菌株的生长影响为主,缺乏菌株对不同种类低聚糖广谱性利用的报道。有文献指出在完全不可控的环境条件下,通过食品的自然发酵可以获得丰富的益生菌资源[11]。因此,本文拟探究食品源乳酸菌对多种低聚糖的广谱性利用情况,筛选出能高效代谢多种低聚糖的菌株,对其鉴定和益生特性研究,为益生菌剂和合生元产品的开发提供菌种资源和数据参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
实验菌株:四川腊肉源乳酸菌55株、四川泡菜源乳酸菌20株以及生牛乳源乳酸菌35株,药敏实验质控菌株为大肠杆菌(E.coli ATCC 25922),由四川农业大学食品微生物实验室提供。
主要试剂:低聚果糖(纯度95%),河南素荷生物科技有限公司;低聚木糖(纯度99%),浙江一诺生物科技有限公司;菊粉(纯度95%),英博生物科技有限公司;低聚异麦芽糖(纯度99%),河南万邦实业有限公司;L-半胱氨酸盐酸盐(纯度99%),源叶生物有限公司;胃蛋白酶(BR)、胰蛋白酶(BR),上海瑞永生物科技有限公司;三号胆盐(BR),上海化学试剂站分装厂;HBIG11乳酸菌生化鉴定条、MRS合成培养基,青岛海博生物技术有限公司;药敏纸片,杭州微生物试剂有限公司;细菌基因组DNA提取试剂盒(离心柱型),天根生化科技(北京)有限公司。
Basal MRS培养基(500 mL):蛋白胨5 g;酵母抽提物2.5 g,柠檬酸铵1 g,醋酸钠2.5 g,MgSO4 50 mg;MnSO4 12.5 mg,K2HPO4 1 g,L-半胱氨酸盐酸盐0.25 g,吐温-80 500 μL。
MRS固体培养基(1 L):MRS合成培养基55 g,L-半胱氨酸盐酸盐0.5 g,琼脂18 g,CaCO3 15 g。
MRS液体培养基(1 L):MRS合成培养基55 g,L-半胱氨酸盐酸盐0.5 g。
1.1.2 主要仪器与设备
电热恒温水浴锅(HWS24型),上海一恒科技有限公司;pH计(PHSJ-3F型),上海仪电科学仪器股份有限公司;电泳仪(DYY-6D型),北京市六一仪器厂;PCR仪(T100型)、凝胶成像仪(Gel Doc XR型),Bio-Rad。
1.2 实验方法
1.2.1 菌株的活化
实验菌株采用体积分数为50%的甘油于-20 ℃保存。实验时平板活化后挑取单一菌落接种于MRS液体培养基,37 ℃静置培养 24 h,连续转接2次,将最后1次培养液采用4 ℃、8 000 r/min离心10 min,得菌体沉淀,然后用无菌生理盐水洗涤菌体沉淀2次,再用相同体积的无菌生理盐水重悬得到乳酸菌细胞悬液,备用。
1.2.2 代谢低聚糖乳酸菌菌株的筛选
1.2.2.1 代谢低聚糖乳酸菌菌株的初筛
配制Basal MRS培养基,并加入溴甲酚紫(终质量浓度0.03 g/L),实验组分别加入10 g/L的低聚木糖、低聚异麦芽糖、低聚果糖和菊粉,阳性对照组加入10 g/L葡萄糖,阴性对照组在培养基中加入体积分数为1%的水,灭菌待用。将上述活化的菌株按体积分数为2%的接种量接种于上述3组培养基中,于37 ℃ 培养观察,颜色变黄者即为阳性。
1.2.2.2 代谢多种低聚糖乳酸菌菌株的复筛
配制Basal MRS培养基,分别加入10 g/L低聚木糖、低聚异麦芽糖、低聚果糖和菊粉,灭菌待用。将可代谢4种低聚糖的菌株活化后以体积分数2%接种量接种于上述培养基中,在37 ℃ 培养箱中培养24 h后,取1 mL发酵液采用平板法计数。选取平板菌落数较高的菌株作为后续研究菌株。
1.2.3 代谢多种低聚糖乳酸菌菌株的鉴定
1.2.3.1 菌落形态与细胞形态观察
用接种环取1环菌悬液,划线于MRS平板,37 ℃培养24 h后,观察菌落特征。挑取单菌落,经革兰氏染色,在生物学显微镜下观察细胞形态。
1.2.3.2 生理生化鉴定
采用乳酸菌生化鉴定条对实验菌株进行生理生化鉴定,包括七叶苷、纤维二糖、麦芽糖、甘露醇、水杨苷、山梨醇、蔗糖、棉子糖、蔗糖和乳糖的发酵实验。
1.2.3.3 16S rDNA 序列测定
采用细菌基因组提取试剂盒对实验菌株的基因组DNA进行提取,以实验菌株的基因组DNA为模板,利用通用引物7F:5′-CAGAGTTTGATCCTGGCT-3′和1540R:5′-AGGAGGTGATCCAGCCGCA-3′进行PCR扩增,将PCR扩增产物用琼脂糖凝胶电泳验证纯度,割胶回收目的片段,送成都擎科梓熙生物有限公司完成序列测定,最后将测得的16S rDNA基因序列在NCBI上注册并进行Blast比对,并利用MAGE5.0软件构建系统发育树。
1.2.4 代谢多种低聚糖乳酸菌的益生特性研究
1.2.4.1 单种低聚糖添加量对乳酸菌生长的影响
配制Basal MRS培养基,加入低聚糖并使质量浓度分别达到0、10、30、50和70 g/L,将配制好的培养基灭菌待用。取活化后的菌株以体积分数2%接种量接种于上述培养基中,37 ℃静置培养24 h后测定发酵液OD600值,比较不同含量低聚糖以及不同种类低聚糖对乳酸菌生长的影响。
1.2.4.2 生长曲线的测定
根据1.2.4.1实验结果,分别选取1种低聚糖作为实验菌株的最佳低聚糖并确定浓度,在Basal MRS培养基中分别加入菌种的最佳低聚糖和葡萄糖,静置培养,0~5 h时,每隔1 h取出发酵液,5~13 h时,每隔2 h取出发酵液测定,13~37 h时,每隔4 h取出发酵液测定OD600值,测定乳酸菌生长曲线。
1.2.4.3 pH耐受性试验
将活化后的菌株以体积分数2%接种量分别接种到pH 2.0、3.0、4.0和5.0的MRS液体培养基中,37 ℃水浴振荡培养2 h,在0、2 h取样,采用平板法计数,同时做平行试验。
1.2.4.4 胆盐耐受性试验
将活化后的菌株以体积分数2%接种量分别接种于质量浓度为1、2和3 g/L胆盐的MRS液体培养基中,37 ℃水浴振荡培养2 h,分别在0、2 h时取样,采用平板法计数,同时做平行试验。
1.2.4.5 模拟胃肠道耐受性试验
耐人工胃肠液试验:分别取1.0 mL菌悬液与9.0 mL人工胃液和人工肠液混合后,放入37 ℃水浴锅振荡培养,分别在0、2 h取样,采用平板计数法测定活菌数,同时做平行实验。
人工胃液:取16.4 mL稀HCl (1 mol/L),加约800 mL蒸馏水与10 g胃蛋白酶,充分混匀溶解,加水定容至1 000 mL,调pH至2.5,用0.22 μm无菌微孔滤膜过滤除菌。使用前37 ℃预热。
人工肠液:将胰腺液和胆液以2∶1的体积比混合均匀,得到人工肠液。使用前37 ℃预热。
胰腺液:1 g/L胰蛋白酶、11 g/L NaHCO3、2 g/L NaCl,将pH调8.0后,用0.22 μm无菌微孔膜过滤除菌。
胆液:9 g/L胆盐,将pH调整到8.0后,用0.22 μm无菌微孔滤膜过滤除菌。
1.2.4.6 药敏试验
采用K-B法[12]对实验菌株进行药敏性试验。调整菌体浊度为0.5麦氏单位,用无菌棉签均匀涂布MRS固体培养基表面,用无菌镊子取药敏纸片贴于培养基表面。培养48 h后取出,用游标卡尺测量抑菌圈直径,药敏实验使用E.coli ATCC 25922作为质控菌株。药敏纸片包括庆大霉素、红霉素、四环素、氯霉素、链霉素、利福平和环丙沙星。同时做平行试验。
1.3 数据分析
数据用![]() 表示,数据分析运用 SPSS 18.0 软件,采用方差分析(ANOVA)进行统计分析,各处理组间的差异比较用LSD 法,P<0.05 时有统计学意义。运用Origin Pro 8.1软件绘制统计图表。
表示,数据分析运用 SPSS 18.0 软件,采用方差分析(ANOVA)进行统计分析,各处理组间的差异比较用LSD 法,P<0.05 时有统计学意义。运用Origin Pro 8.1软件绘制统计图表。
2 结果与分析
2.1 可代谢低聚糖乳酸菌菌株情况
测试的110株乳酸菌在初筛时对低聚木糖、低聚异麦芽糖、低聚果糖和菊粉的代谢情况见表1。由表1可知,仅有8株乳酸菌不能代谢实验中的4种低聚糖。四川腊肉源55株乳酸菌中有38株、四川泡菜源20株乳酸菌中有17株、而生牛乳源35株乳酸菌中仅有8株可以代谢4种低聚糖,合计有63株乳酸菌对低聚木糖、低聚异麦芽糖、低聚果糖和菊粉均有代谢能力,为代谢低聚糖益生菌筛选提供了重要菌源。
表1 乳酸菌对不同低聚糖的代谢情况
Table 1 Metabolism of different oligosaccharides by lactic acid bacteria
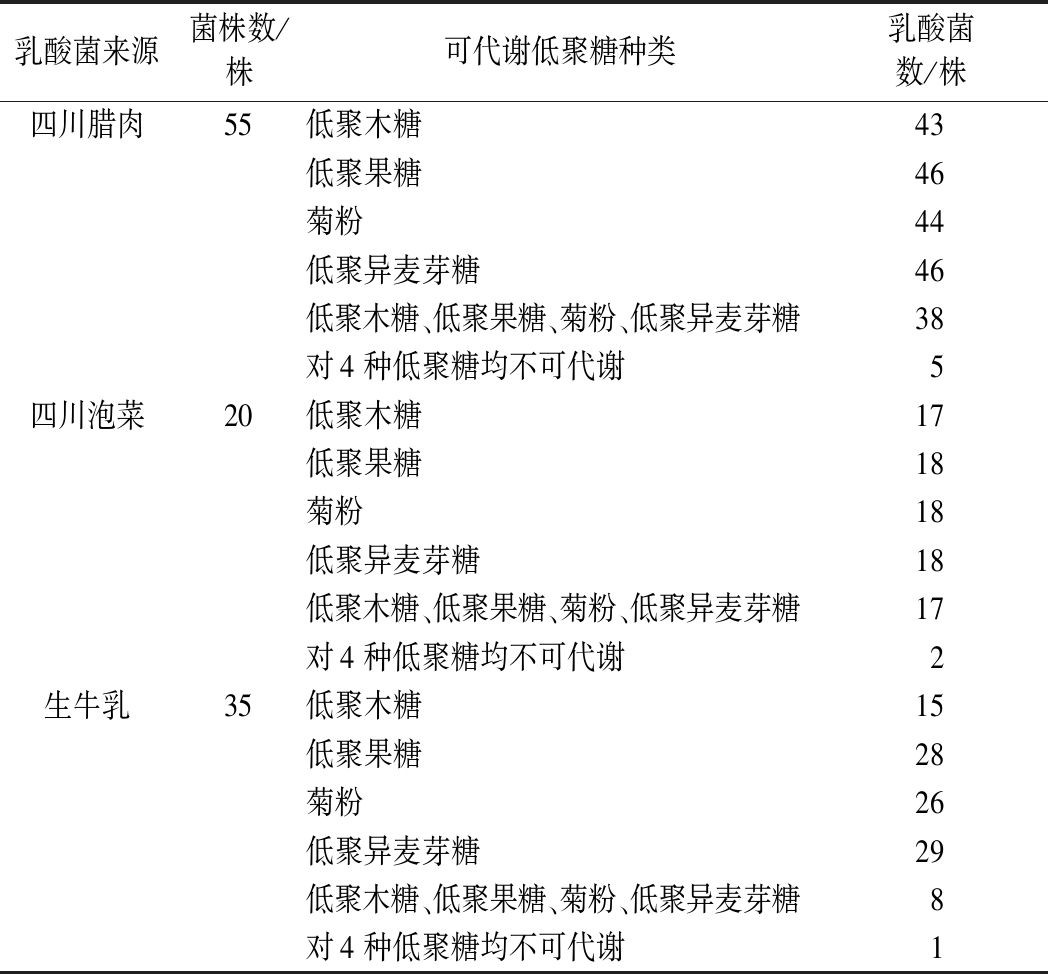
乳酸菌来源菌株数/株可代谢低聚糖种类乳酸菌数/株四川腊肉55低聚木糖43低聚果糖46菊粉44低聚异麦芽糖46低聚木糖、低聚果糖、菊粉、低聚异麦芽糖38对4种低聚糖均不可代谢5四川泡菜20低聚木糖17低聚果糖18菊粉18低聚异麦芽糖18低聚木糖、低聚果糖、菊粉、低聚异麦芽糖17对4种低聚糖均不可代谢2生牛乳35低聚木糖15低聚果糖28菊粉26低聚异麦芽糖29低聚木糖、低聚果糖、菊粉、低聚异麦芽糖8对4种低聚糖均不可代谢1
以可利用4种低聚糖的菌株进行复筛试验,选择菌落计数结果最多的生牛乳源菌株SNR24、四川腊肉源菌株RP30和四川泡菜源菌株PC140 三株菌作为后续实验菌株。这3株菌的复筛试验结果见表2,其在以4种低聚糖为唯一碳源的培养基中良好生长,活菌数可达109 CFU/mL左右。
表2 三株菌于不同低聚糖培养基中的生长情况 单位:lg(CFU·mL-1)
Table 2 Growth of three strains in different oligosaccharide media
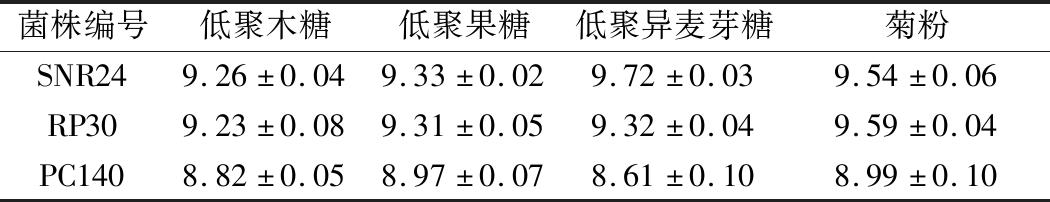
菌株编号低聚木糖低聚果糖低聚异麦芽糖菊粉SNR249.26±0.049.33±0.029.72±0.039.54±0.06RP309.23±0.089.31±0.059.32±0.049.59±0.04PC1408.82±0.058.97±0.078.61±0.108.99±0.10
2.2 代谢多种低聚糖乳酸菌菌株的鉴定
将2.1小节中筛选得到的3株乳酸菌在MRS培养基上划线培养,菌落形态如图1所示,3株菌的菌落形态呈近圆形,乳白色,表面湿润,无褶皱,中间突起,边缘整齐。经革兰氏染色后,其细胞形态为革兰氏阳性、短杆状、无芽孢,如图2所示。
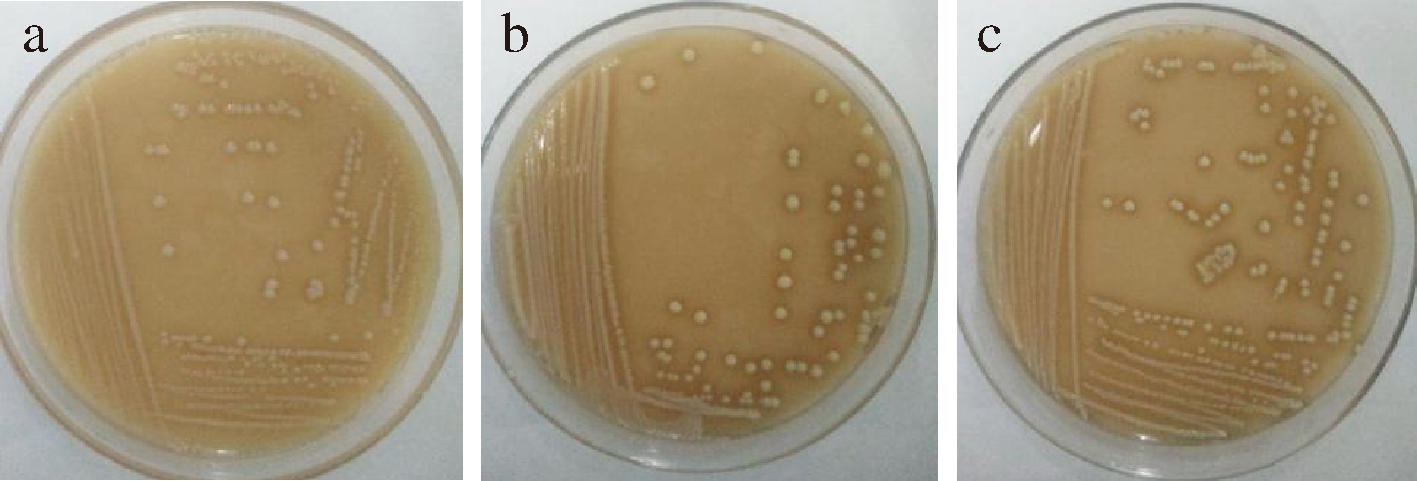
a-菌株SNR24; b-菌株RP30; c-菌株PC140
图1 三株乳酸菌的菌落形态图
Fig.1 Colony morphology of three lactic acid bacteria strains

a-菌株SNR24; b-菌株RP30; c-菌株PC140
图2 三株乳酸菌的细胞形态图(1 000×)
Fig.2 Cell morphology of three lactic acid bacteria strains
3株乳酸菌的生理生化鉴定结果见表3,可根据《伯杰氏系统细菌学手册》[13]对菌株进行鉴定,但最终鉴定结果还应结合形态学分析、16S rDNA序列分析结果来确定。
表3 三株乳酸菌的生理生化特性
Table 3 Physiological and biochemical characteristics of three lactic acid bacteria strains

菌株编号七叶苷纤维二糖麦芽糖甘露醇水杨苷山梨醇蔗糖棉子糖蔗糖乳糖SNR24+++++-++++RP30+++++-++++PC140++++++++++
注:“+”表示阳性,由反应生成;“-”阴性,无反应生成
将菌株SNR24、RP30和PC140的16S rDNA基因经PCR扩增及其产物电泳后回收测序,其测序结果提交 GenBank 数据库注册,登录号分别为MN602938、MN602939和MN602940。通过在NCBI数据库进行Blast比对,菌株SNR24与Lactobacillus fermentum 同源性为100%,菌株RP30、PC140与Lactobacillus plantarum同源性为100%。基于16S rDNA测序结果的系统发育树如图3所示。结合形态学、传统生理生化和16S rDNA 基因序列分析可知,菌株SNR24被鉴定为发酵乳杆菌,菌株RP30、PC140被鉴定为植物乳杆菌。

图3 三株乳酸菌基于16S rDNA绘制的系统发育树
Fig.3 Phylogenetic tree of three lactic acid bacteria strains based on 16S rDNA
2.3 代谢多种低聚糖乳酸菌的益生特性
2.3.1 低聚糖不同添加量对乳酸菌生长的影响
不同含量的各种低聚糖对菌株SNR24、RP30和PC140生长的影响如图4所示。菌株SNR24、RP30和PC140在未添加低聚糖对照组的OD600值分别为0.036、0.034和0.025,而添加了低聚糖实验组的OD600值>0.2,呈显著性差异(P<0.05),表明菌株SNR24、RP30和PC140均能代谢低聚木糖、低聚果糖、低聚异麦芽糖和菊粉。随着部分低聚糖添加量的增加,发酵液OD600值并非一直递增,说明低聚糖添加量与发酵液OD600并非呈现线性增长关系。试验结果表明,菌株SNR24、RP30和PC140的最适宜低聚糖及添加量分别为50 g/L菊粉和30 g/L低聚异麦芽糖、50 g/L菊粉。
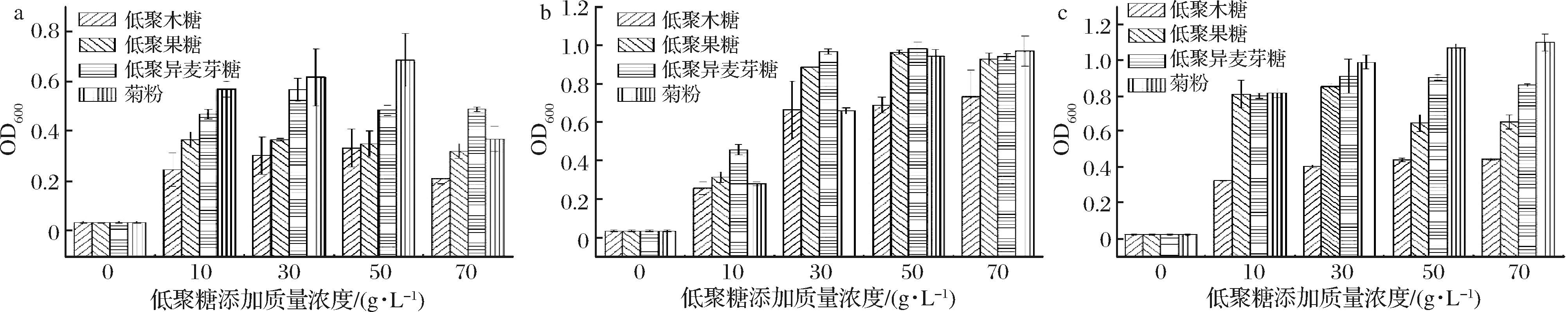
a-菌株SNR24; b-菌株RP30; c-菌株PC140
图4 低聚糖添加量对3株乳酸菌生长的影响
Fig.4 Effect of oligosaccharide addition on the growth of three lactic acid bacteria strains
2.3.2 三株乳酸菌生长曲线
根据2.3.1结果,以50 g/L的菊粉作为唯一糖源的培养基分别培养菌株SNR24和PC140,以30 g/L的低聚异麦芽糖作为唯一糖源的培养基培养菌株RP30,并以相同质量浓度的葡萄糖作为对照组,绘制生长曲线。如图5所示,这3菌珠在低聚糖的Basal MRS中生长曲线与在葡萄糖的Basal MRS中生长曲线基本一致;3株乳酸菌在最初培养的3 h内生长缓慢为生长延滞期,之后开始进入对数生长期,菌株SNR24在培养11 h后开始进入稳定期,而菌株RP30和PC140在培养13 h后才进入稳定期。在相同的条件下培养达到稳定期后,菌株RP30和PC140发酵液的OD600值显著>菌株SNR24。
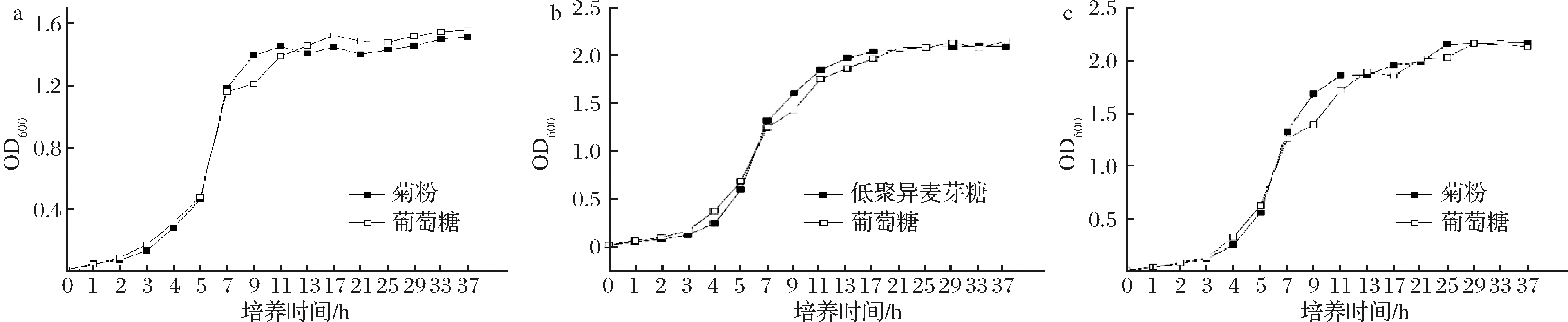
a-菌株SNR24; b-菌株RP30; c-菌株PC140
图5 三株乳酸菌生长曲线
Fig.5 Growth curve of three lactic acid bacteria strains
2.3.3 三株菌的耐酸性
人体胃液pH通常在3.0左右, 空腹和食用酸性食品可达1.5, 食用碱性食物可达4.0~5.0, 且食物 (尤其是流体) 通过胃的时间相对较短, 一般1~2 h。乳酸菌作为益生菌必须具备相对较好的耐酸性[14]。以0 h时乳酸菌活菌数为对照,乳酸菌经不同pH处理2 h后活菌数结果如图6所示。由图6可知,3株乳酸菌对pH分别为5.0、4.0和3.0的环境均有较好的耐受能力。但3株乳酸菌对pH 2.0环境的耐受能力较差,经处理后,菌株SNR24、RP30和PC140的活菌对数值分别下降了2.30、2.93和3.40。

图6 不同酸度环境对3株乳酸菌存活的影响
Fig.6 Effect of different acidity environment on the survival of three lactic acid bacteria strains
2.3.4 三株菌的胆盐耐受性
人体小肠的胆盐质量浓度一般在0.3~3 g/L,可以在细胞外产生高渗透压,对菌体细胞造成影响[15]。以0 h时乳酸菌活菌数为对照,乳酸菌经不同胆盐含量处理2 h后活菌数结果如图7所示。由图7可知,3株乳酸菌对质量浓度1和2 g/L胆盐耐受能力较好,经质量浓度2 g/L胆盐处理2 h后,菌株SNR24、RP30和PC140的活菌对数值分别下降了1.56、1.46和1.53。3株菌对质量浓度3 g/L胆盐的耐受能力较差,经处理后,菌株SNR24、RP30和PC140的活菌对数值分别下降了4.19、3.66和4.05。

图7 不同胆盐含量对3株乳酸菌存活的影响
Fig.7 Effect of different bile salt concentration on the survival of three lactic acid bacteria strains
2.3.5 三株菌的模拟胃肠道耐受性
由表4可知,经人工胃液和人工肠液处理2 h后,3株乳酸菌的活菌数均有所下降,但下降的数量<一个数量级,说明这3株乳酸菌对人工模拟的胃肠道环境均有较好的耐受能力。其中菌株SNR24对人工胃液的耐受能力最强,存活率达71.23%,但对人工肠液的耐受能力最弱,存活率仅有16.15%。菌株RP30在经过人工胃液和人工肠液处理后,其活菌率>50%。综合来看,菌株RP30对人工模拟胃肠液的耐受性最强。
表4 三株乳酸菌经人工胃肠液处理后活菌数及其存活率
Table 4 The number and survival rate of three lactic acid bacteria strains treated with artificial gastrointestinal fluid
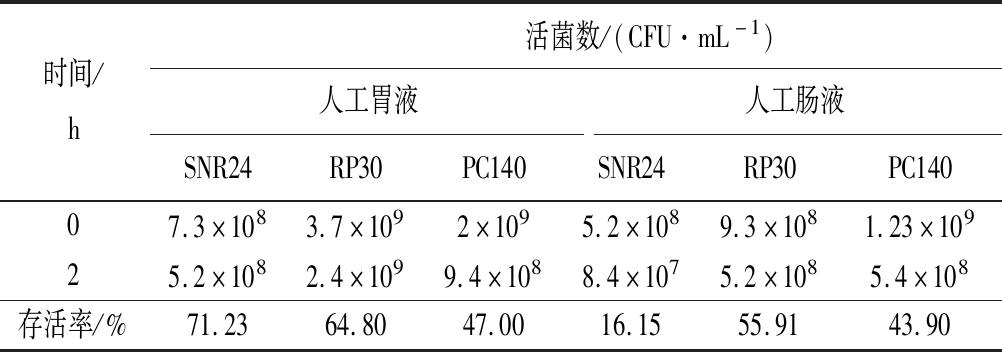
时间/h活菌数/(CFU·mL-1)人工胃液人工肠液SNR24RP30PC140SNR24RP30PC14007.3×1083.7×1092×1095.2×1089.3×1081.23×10925.2×1082.4×1099.4×1088.4×1075.2×1085.4×108存活率/%71.2364.8047.0016.1555.9143.90
2.3.6 三株菌对常见抗生素的药敏性
表5为抑菌圈直径判断标准[16]及乳酸菌药敏试验结果,质控菌株ATCC 25922对抗生素产生的抑菌圈直径均在质控范围内,因此实验测得的数据可信。由表5可知,3株乳酸菌对大环内酯类抗生素红霉素、氯霉素类抗生素氯霉素和安沙霉素类抗生素利福平均敏感,而对氨基糖苷类抗生素链霉素、喹诺酮类抗生素环丙沙星均有耐药性。对于氨基糖苷类抗生素庆大霉素,菌株SNR24中度敏感,而菌株RP30和PC140为耐药。对于四环素类抗生素四环素,菌株SNR24敏感性,而菌株RP30和PC140为耐药。
表5 抑菌圈直径判断标准及3株乳酸菌药敏试验结果
Table 5 Criterion for inhibitory result and antibiotic resistance results for three lactic acid bacteria strains
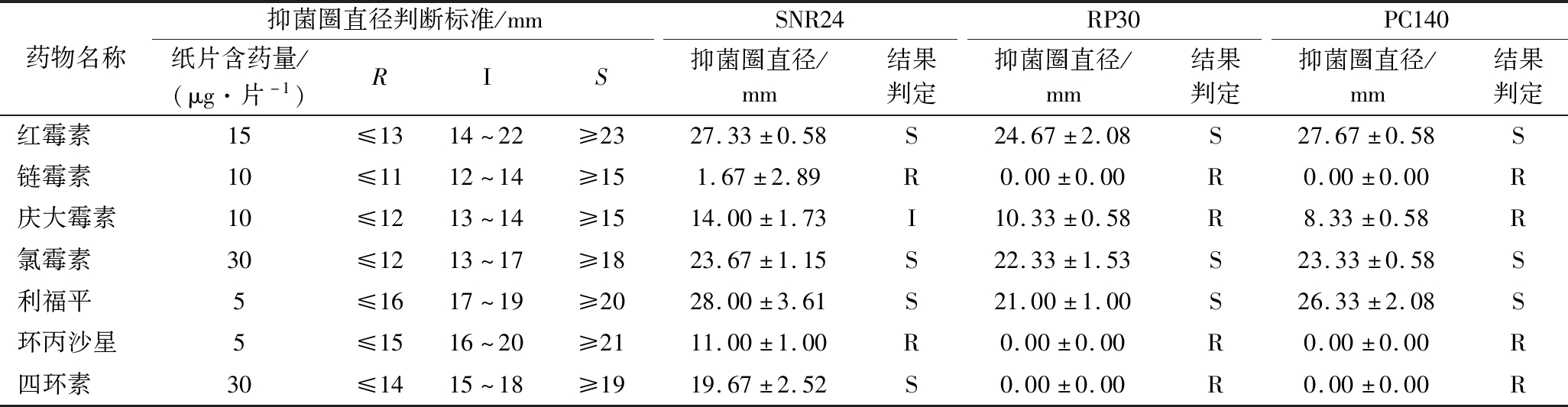
药物名称抑菌圈直径判断标准/mmSNR24RP30PC140纸片含药量/(μg·片-1)RIS抑菌圈直径/mm结果判定抑菌圈直径/mm结果判定抑菌圈直径/mm结果判定红霉素15≤1314~22≥2327.33±0.58S24.67±2.08S27.67±0.58S链霉素10≤1112~14≥151.67±2.89R0.00±0.00R0.00±0.00R庆大霉素10≤1213~14≥1514.00±1.73I10.33±0.58R8.33±0.58R氯霉素30≤1213~17≥1823.67±1.15S22.33±1.53S23.33±0.58S利福平5≤1617~19≥2028.00±3.61S21.00±1.00S26.33±2.08S环丙沙星5≤1516~20≥2111.00±1.00R0.00±0.00R0.00±0.00R四环素30≤1415~18≥1919.67±2.52S0.00±0.00R0.00±0.00R
注:“R”表示耐药;“I”表示中敏;“S”表示敏感
3 结论与讨论
本实验测试了110株乳酸菌对低聚木糖、低聚异麦芽糖、低聚果糖和菊粉的代谢情况,其中四川腊肉源38株、四川泡菜源17株和生牛乳源8株乳酸菌都可以代谢4种低聚糖,发酵食品如腊肉和泡菜源乳酸菌利用低聚糖的能力强于生牛乳源,不同来源乳酸菌对低聚糖的代谢能力存在差异。刘思思[17]筛选得到11株对低聚果糖和低聚木糖均有代谢能力的乳酸菌,其中有8株为分离自发酵食品的植物乳杆菌;IGNATOVA等[18]从乳制品中分离到18 株对低聚果糖和低聚半乳糖均有代谢能力的保加利亚乳杆菌;而毛丙永[19]从人体粪便中仅筛选出2株对低聚果糖有代谢能力的乳酸菌,且不能同时代谢乳酮糖。综上所述,相较于人体肠道来源乳酸菌而言,来源于发酵食品源中乳酸菌代谢低聚糖能力较强和具有广谱性,为筛选代谢低聚糖乳酸菌提供了重要菌源。
乳酸菌对抗生素的抗性可能是固有的,也可能是获得的。若乳酸菌的耐药性基因是由质粒编码的,则其耐药性基因可以在系统发育中远缘细菌间转移,这致使乳酸菌作为益生菌使用存在着潜在的危险性[20]。通常研究认为诸多乳杆菌(如干酪乳杆菌、鼠李糖乳杆菌等)以及双歧杆菌均具有对万古霉素有耐药性,且被认为是一种固有耐药性[21]。JACOBSEN等[22]通过小鼠体内实验发现从发酵香肠中分离的L.plantarum DG 522和L.plantarum DG 507通过质粒将抗性基因tet(M)、erm(B)转移至E.faecalis JH2-2。因此,对于本实验筛选获得的菌株是否具有获得性耐药基因也可以通过全基因组序列分析做进一步的安全评价。
近年来许多文献表明,乳酸菌对低聚糖的代谢机制具有菌种特异性,并存在多种转运机制,且其对不同聚合度低聚糖的代谢能力也并不相同[23]。ROSSI等[24]探究了55株双歧杆菌对菊粉的利用情况,发现短果聚糖先消失后长果聚糖逐渐消耗,OSE等[25]在相关实验中也观察到类似现象。本实验获得的发酵乳杆菌和2株植物乳杆菌均能强烈代谢4种低聚糖,具有良好的益生特性,具有益生菌开发的潜质,在后续工作中还应加强其安全评价及低聚糖代谢机制的深入研究。
[1] XU X, XU P, MA C,et al.Gut microbiota, host health, and polysaccharides[J].Biotechnology Advances,2013,31(2):318-337.
[2] 柳青.具有潜在益生特性乳酸菌的筛选鉴定及其特性研究[D].呼和浩特:内蒙古农业大学, 2018.
[3] CARMODY R N, GERBER G K, LUEVANO J M, et al.Diet dominates host genotype in shaping the murine gut microbiota[J].Cell Host & Microbe,2015,17(1):72-84.
[4] GIBSON G R, ROBERFEOID M B.Dietary modulation of the human colonic microbiota-introducing the concept of prebiotics[J].Journal of Nutrition,1995,125(6):1 401-1 412.
[5] 耿铁柱.低聚糖对益生菌饮料活菌数量的影响[D].重庆:西南大学,2016.
[6] 罗予,孟林敏,毛理纳,等.低聚果糖体内外对肠道菌的影响[J].中国微生态学杂志,2003(6):10-11.
[7] 谷雪玲,吕宏伟,宋泽和,等.低聚异麦芽糖对乳酸杆菌增殖及产酸效果的研究[J].家畜生态学报,2018,39(9):43-45.
[8] SAULNIER D M, MOLENAAR D, VOS W M, et al.Identification of prebiotic fructo-oligosaccharide metabolism in Lactobacillus plantarum WCFS1 through microarrays[J].Applied and Environmental Microbiology,2007,73(6):1 753-1 765.
[9] 王苗,蒋敏,李恒,等.乳酸菌对魔芋甘露低聚糖的降解与利用[J].食品与发酵工业,2016,42(11):20-24.
[10] BANUELOS O, FERMANDEZ L, CORRAL J M, et al.Metabolism of prebiotic products containing beta(2-1) fructan mixtures by two Lactobacillus strains[J].Anaerobe,2008,14(3):184-189.
[11] JAMES A, WANG Y S.Characterization, health benefits and applications of fruits and vegetable probiotics[J].Cyta-Journal of Food, 2019,17(1):770-780
[12] 王莉. K-B纸片扩散法药敏试验技术要点[J].医药前沿,2013(25):59-60.
[13] R.E.步坎南, N.E.吉本斯伯, 等.伯杰细菌鉴定手册[M].第八版.北京:科学出版社,1984:797-822.
[14] 刘宏宇,汪立平,艾连中,等.乳酸菌的抗氧化活性和耐酸耐胆盐性能的研究[J].食品工业科技,2014,35(2):92-96;99.
[15] 胡爱华,敖晓琳,陈岑,等.乳酸菌耐酸耐胆盐机制的研究进展[J].食品工业科技,2015,36(8):380-383;389.
[16] 李禤,贾丹,刘军龙,等.新分离植物乳杆菌的药敏性和抑菌性试验[J].中国兽医科学,2019,49(7):879-886.
[17] 刘思思.乳酸菌利用低聚糖的特性及在肠道中的作用[D].无锡:江南大学,2015.
[18] IGNATOVA T, ILIEV I, KIRILOV N, et al.Effect of oligosaccharides on the growth of Lactobacillus delbrueckii subsp bulgaricus strains isolated from dairy products[J].Journal of Agricultural and Food Chemistry,2009,57(20):9 496-9 502.
[19] 毛丙永.功能性低聚糖对肠道细菌的影响及机制[D].无锡:江南大学,2015.
[20] 曾小群,潘道东,郭宇星,等.不同来源乳酸菌的药敏试验[J].中国食品学报,2012,12(9):179-185.
[21] CATALOLUK O, GOGEBAKAN B.Presence of drug resistance in intestinal Lactobacilli of dairy and human origin in Turkey[J].FEMS Microbiology Letters,2004(236):7-12.
[22] JACOBSEN L, WILCKS A, HAMMER K, et al.Horizontal transfer of tet (M) and erm (B) resistance plasmids from food strains of Lactobacillus plantarum to Enterococcus faecalis JH2-2 in the gastrointestinal tract of gnotobiotic rats[J].FEMS Microbiology Ecology, 2007,59(1):158-166.
[23] 陈臣,卢艳青,于海燕,田怀香.乳酸菌代谢低聚糖机理的研究进展[J].中国食品学报,2019,19(6):274-283.
[24] ROSSI M, CORRADINI C, AMARETTI A, et al.Fermentation of fructo-oligosaccharides and inulin by bifidobacteria:A comparative study of pure and fecal cultures[J].Applied and Environmental Microbiology,2005(71):6 150-6 158.
[25] OSE R, HIRANO K, MAENO S, et al.The ability of human intestinal anaerobes to metabolize different oligosaccharides:Novel means for microbiota modulation?[J].Anaerobe,2018,51:110-119.