炎性肠病(inflammatory bowel disease,IBD)主要包括克罗恩病(Crohn’s disease, CD)和溃疡性结肠炎(ulcerative colitis, UC)[1],其发病机制尚不明确,目前认为是由感染、遗传、免疫等因素引起的[2]。现有的治疗方法如氨基水杨酸类药物、皮质醇类药物、免疫抑制剂、抗生素等虽然取得了一定的效果,但是副作用较大,不适合长期治疗[1]。
在肠炎患者中,营养不良发生率很高,主要表现为体质量丢失、儿童发生营养不良甚至会导致发育迟缓[3]。且在IBD的治疗过程中药物手术等因素会进一步加重营养障碍,而营养不良的发生可引起肠黏膜屏障的一系列病理生理变化,容易继发各种并发症。因此,增强IBD患者的营养支持至关重要[4]。近年来,我国制定了一系列特殊医学用途配方食品(food for special medical purpose,FSMP)的法规标准,但由于其属于新兴领域,在原材料的选择上研究较少,且已经申请获批的产品大多是针对婴幼儿的,缺乏对特定疾病状态的研究。研究表明,饮食影响着肠道微生物的组成、肠道屏障和宿主免疫,且摄入特定的饮食成分或饮食模式与肠炎之间存在关联[5]。共轭亚油酸(conjugated linoleic acid,CLA)是一种新发现的营养素,具有抗炎和提高免疫等作用,最常见、最有活性的异构体为t9,c11-CLA和t10,c12-CLA。YUAN等[6]研究发现c9,t11-CLA可以通过调节PPAR γ的机制缓解结肠炎。益生菌具有改善肠道微生态、机体免疫等多种功能,已被广泛应用于乳制品、婴幼儿食品以及药品等领域[7]。BASSAGANYA-RIERA等[8]研究发现,部分益生菌可以通过在结肠中产生CLA改善结肠炎[8]。尽管已经有关于CLA及产CLA的益生菌在结肠炎中发挥作用的报道,但是,两者单独使用还不能解决肠炎患者营养不良的情况。因此,本研究将CLA及产CLA的双歧杆菌作为功能组分添加到营养配方中验证对溃疡性结肠炎恢复的影响。
1 材料与方法
1.1 试剂与仪器
PB3002-N电子天平,梅特勒-托利多公司;DG250厌氧工作站,英国DWS;Multiskan GO多功能酶标仪,赛默飞公司;1150H型石蜡包埋机、PM2245手动轮转切片机,徕卡;Pannormic MIDI数字切片扫描仪,3DHISTCH公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司;QGC-36T氮吹仪,上海泉岛公司;GCMS-QP2010Ultra气相色谱质谱联用仪,日本SHIMADZU公司。
葡聚糖硫酸钠(dextran sulfate sodium,DSS)(分子质量36 k~50 kDa)、FastDNA Spin Kit for Feces, MP Biomedicals;髓过氧化物酶(myeloperoxidase,MPO)试剂盒,南京建成生物工程研究所;阿利新蓝染色液、MUC2试剂盒,南京森贝伽生物科技有限公司;细胞因子试剂盒,R&D system;乳清蛋白、酪蛋白、马铃薯蛋白、中链甘油三脂、菊粉,上海创赛有限公司;CLA,南京库克生物技术有限公司;大豆油、麦芽糊精、复合矿物质、复合维生素,南通特洛菲饲料科技有限公司;双歧杆菌GDMCC60797,广东省微生物菌种保藏中心;其他化学分析试剂均购自国药集团化学试剂有限公司。饲料配方见表1,由南通特洛菲饲料科技有限公司提供。
表1 不同饲料的主要营养成分含量 单位:g/kg
Table 1 The major nutritional composition of different feed
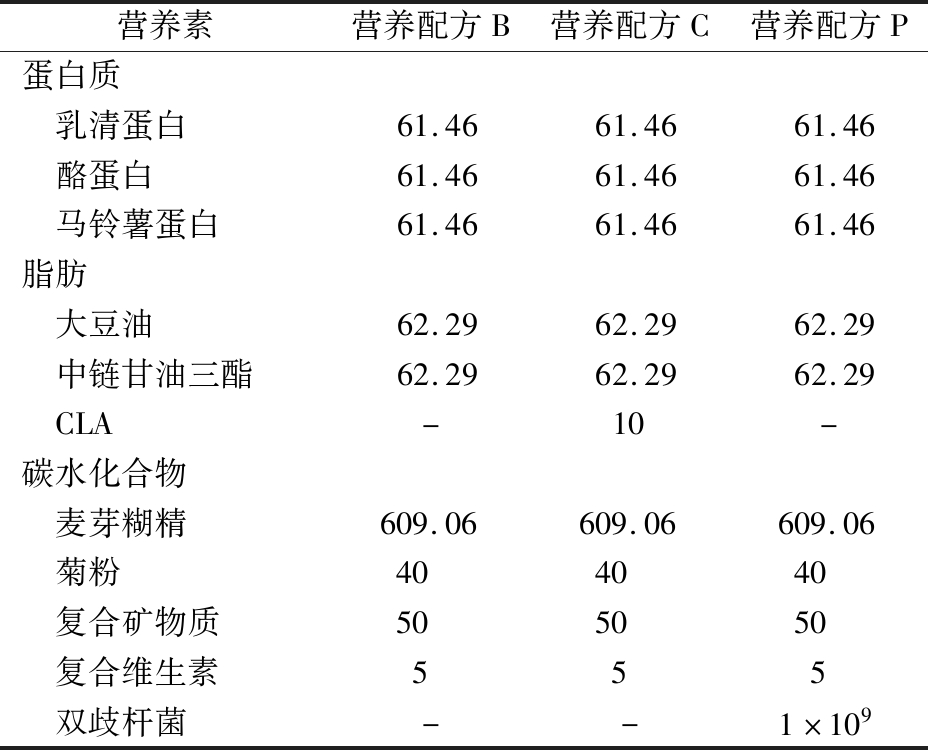
营养素营养配方B营养配方C营养配方P蛋白质 乳清蛋白61.4661.4661.46 酪蛋白61.4661.4661.46 马铃薯蛋白61.4661.4661.46脂肪 大豆油62.2962.2962.29 中链甘油三酯62.2962.2962.29 CLA-10-碳水化合物 麦芽糊精609.06609.06609.06 菊粉404040 复合矿物质505050 复合维生素555 双歧杆菌--1×109
注:“-”表示不含; 双歧杆菌含量单位为CFU/mL
1.2 实验方法
1.2.1 动物实验设计
动物实验方案经江南大学动物伦理委员会批准(JN.No20180615c1101030[139])。50 只雄性C57BL/6J小鼠(SPF级,8 周龄,18~20 g)随机分为5 组,包括正常对照组、模型组和实验组(营养配方组B、营养配方组C、营养配方组P),每组10 只。实验全程在SPF级环境中进行,饲养在江南大学实验动物中心进行,恒定温度21~26 ℃,湿度40%~70%,噪声≤60 dB,动物照度15~20 lx。动物购入后,先经过1周时间的适应期,然后除对照组外,将其他组小鼠的饮用水更换为质量浓度25 g/L的DSS溶液,DSS处理循环3 次诱导慢性肠炎[9]。造模成功后将模型组小鼠处死,实验组改为饮用水和配方饲料喂养。期间,每天记录体质量,2周后处死小鼠,测定结肠长度,参考YAN等[10]的方法收集样品。
1.2.2 益生菌转化CLA的测定
将活化好的双歧杆菌以体积分数2%的接种量接种到含有质量浓度0.64 mg/mL油酸的mMRS液体培养基中,之后参考王俊通[11]的方法进行益生菌转化CLA的测定。
1.2.3 结肠组织中MPO的测定
参照MPO试剂盒的说明书进行测定。
1.2.4 结肠组织病理切片的制作、苏木素-伊红(hematoxylin eosin,HE)染色和组织损伤评分
参照文献[12]的方法对结肠组织进行HE染色。使用Pannoramic MIDI数字切片扫描仪扫描制作好的切片。组织损伤评分参考REES[13]的方法对结肠组织切片进行组织损伤评分,具体标准见表2。
表2 组织损伤评分标准
Table 2 Standard for evaluation of histological injury
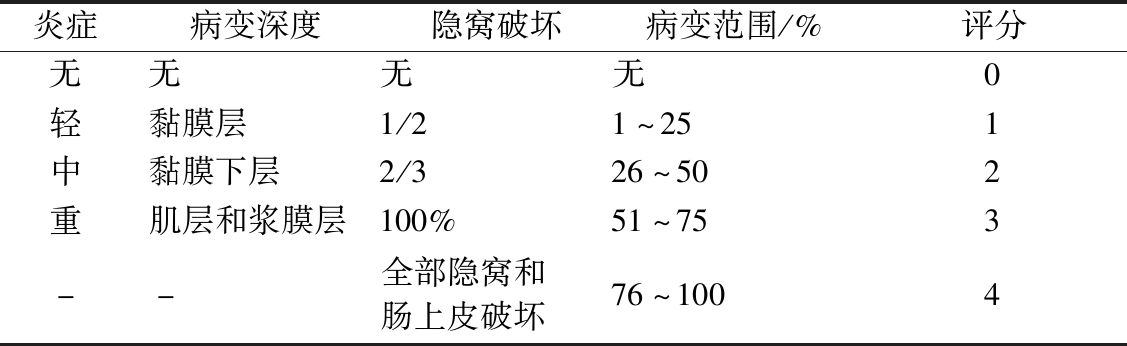
炎症病变深度隐窝破坏病变范围/%评分无无无无0轻黏膜层1/21~251中黏膜下层2/326~502重肌层和浆膜层100%51~753--全部隐窝和肠上皮破坏76~1004
注:“-”表示无
1.2.5 动物组织上清中细胞因子的测定
组织上清液中IL-6、IL-10、IL-17、IL-1β、TNF-α等细胞因子的测定采用R&D system的 ELISA试剂盒,具体步骤参照试剂盒说明书。
1.2.6 结肠黏液层的阿利新蓝染色
参考文献[12]的方法制作切片,参考试剂盒说明书进行阿利新蓝染色。使用Pannoramic MIDI数字切片扫描仪扫描制作好的切片。
1.2.7 结肠组织上清液中MUC2的表达
参照MUC2试剂盒中的说明书。
1.2.8 16Sr RNA基因V3~V4区扩增子高通量测序和粪便菌群的分析
通过FastDNA Spin Kit for Feces试剂盒从粪便样品中提取细菌的DNA,利用Illumina MiSeq平台对V3~V4区域进行扩增和测序(Illumina, San Diego, CA, USA)[10]。参考FANG等[14]的方法进行差异菌分析。
1.2.9 统计学分析
采用SPSS 20.0软件进行分析,计量资料以(平均值±均方误差表示,不同组别间样本比较采用单因素方差分析,若存在统计学差异,进一步应用最小显著性差异法进行两两比较。P<0.05被认为具有显著性差异。
2 结果与分析
2.1 双歧杆菌的CLA转化率
反刍动物的乳制品和肉制品是日常生活中CLA的主要来源,除此之外,很多细菌已被报道具有生物合成CLA的能力。COAKLEY等[15]报道了一系列双歧杆菌,特别是短双歧杆菌(Bifidobacterium breve)可极高效地将高达65%的亚油酸(linoleic aciol,LA)底物转化为CLA。本实验中,双歧杆菌GDMCC60797在含有亚油酸的培养基中培养3 d后,其发酵液中的CLA转化情况见表3。c9,t11-CLA为最主要的异构体,转化率较高,达到了64.45%。图1为72 h内c9,t11-CLA的变化过程,随着菌体生长CLA的含量逐渐增加(24、36 h),培养36 h后发酵液中的质量浓度趋于饱和,最大转化率为培养72 h左右,c9,t11-CLA的质量浓度达到了0.413 mg/mL。
表3 CLA转化率
Table 3 CLA conversion rate
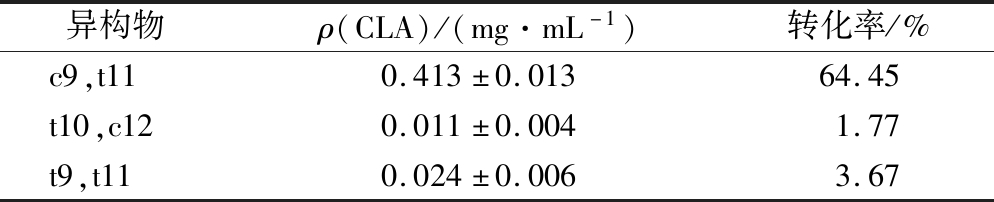
异构物ρ(CLA)/(mg·mL-1)转化率/%c9,t110.413±0.01364.45t10,c120.011±0.0041.77t9,t110.024±0.0063.67
注:ρ(LA)=0.64 mg/mL
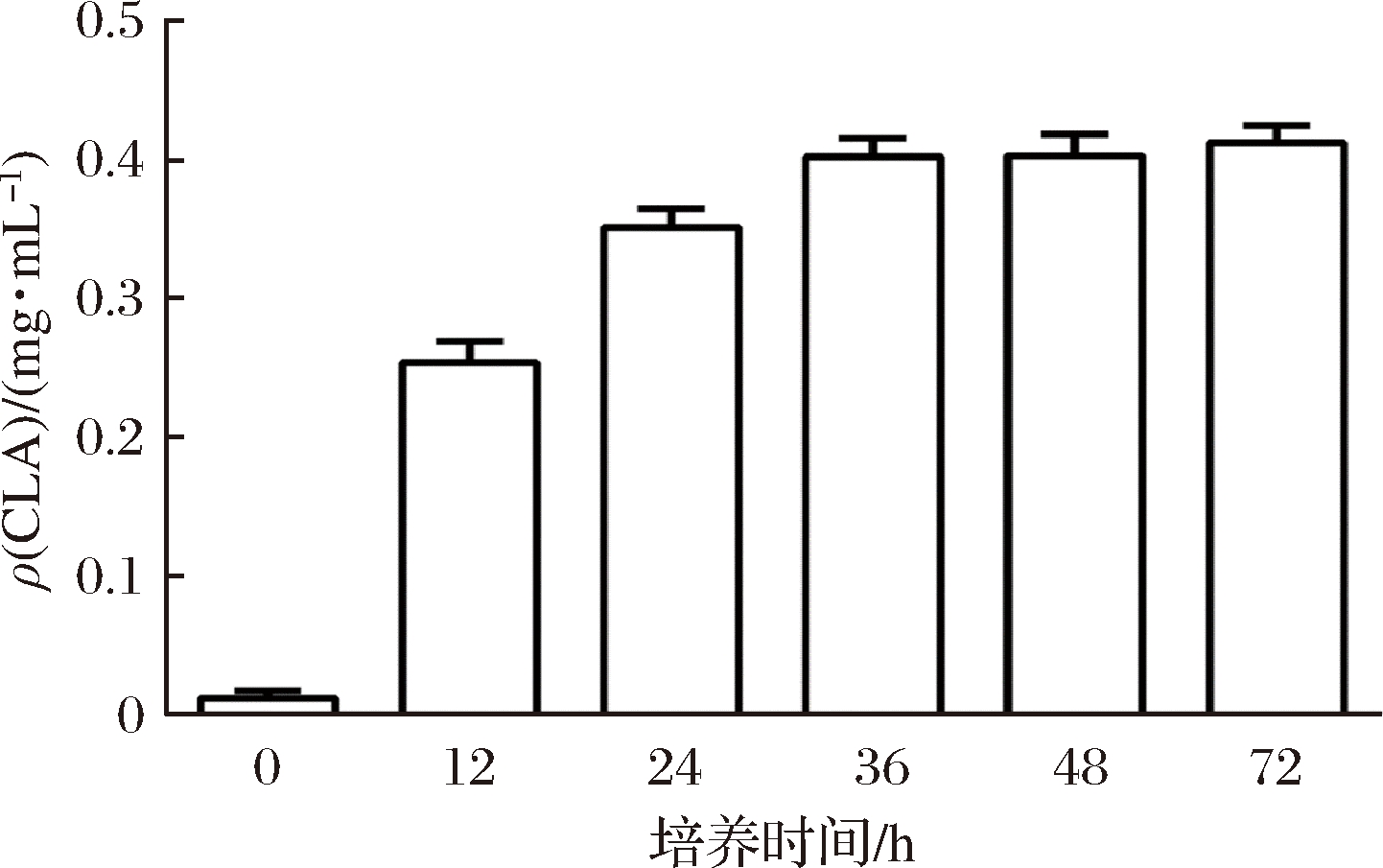
图1 72 h的CLA转化率
Fig.1 CLA conversion rate in 72 h
2.2 营养配方对结肠炎症状的影响
DSS诱导的结肠炎往往伴随着体质量的下降,这与临床症状十分吻合[16]。图2-a对比了不同营养配方饲养各组小鼠后体质量的变化情况,可以发现各营养配方组出现了不同程度的体质量增长,改善了肠炎引起的体质量丢失情况,其中营养配方组P小鼠的体质量增长最为显著,增长了(13.34±4.00)%,营养配方组B及组C的小鼠体质量分别增长了(7.00±5.35)%和(5.59±3.32)%。王威[4]的研究发现,营养支持治疗后肠炎患者的体质量较干预前有所上升。此外,YANG等[17]的研究发现,CLA及双歧杆菌均能改善肠炎引起的体质量丢失的情况,与本研究的结果一致。而添加了双歧杆菌的营养配方效果最佳,可能是由于其除了通过产CLA直接作用于结肠外,还能通过其他途径改善肠炎,这还有待进一步的研究。
DSS诱导的结肠炎会使小鼠结肠缩短,因此结肠长度结肠缩短可作为结肠损伤的宏观指标[11],相比于模型组(图2-c),经膳食干预后,营养配方组B小鼠的结肠长度与模型组没有显著差异,而营养配方组C和组P小鼠的结肠长度缩短症状均显著改善(P<0.05),其中营养配方C饲养后小鼠的结肠长度缩短症状改善更为显著(P<0.01)。说明了营养配方的摄入提高了营养物质的吸收并减少其流失,从而达到增强营养状态和促进病情缓解的效果。此外,添加双歧杆菌及CLA的营养配方对肠炎的恢复效果更为显著,改善了DSS引起的一系列临床症状。
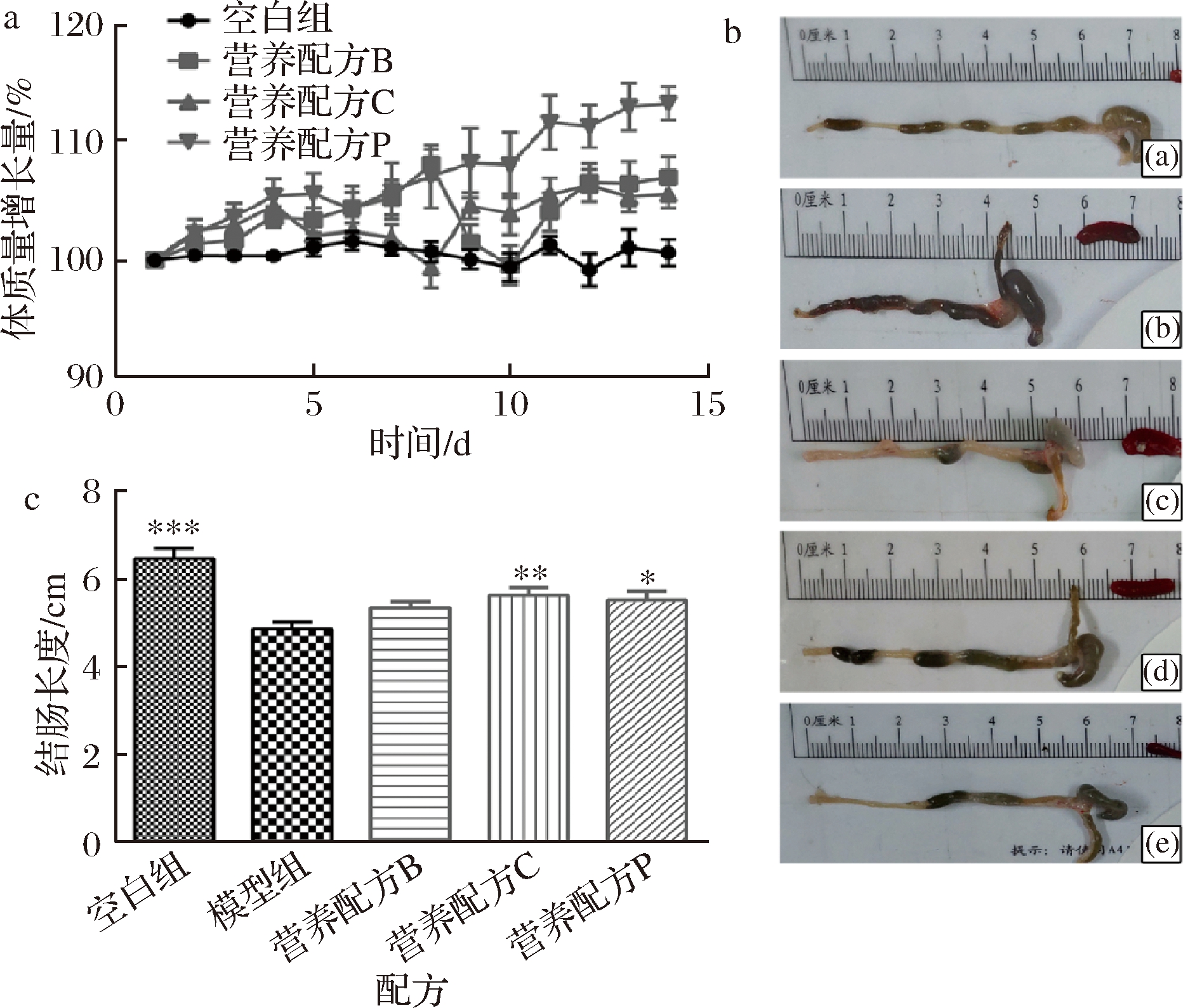
a-治疗期间体重变化;b-不同组小鼠的代表性结肠;c-结肠长度.
(a)-空白组;(b)-模型组;(c)-营养配方组B;(d)-营养配方组C;e-营养配方组P(下同)
图2 不同营养配方饲养后对肠炎症状的影响
Fig.2 The effect of different diets on the symptom of the colitis
*表示与模型组有显著差异(P<0.05);**表示有高度显著差异(P<0.01);***表示有极显著差异(P<0.001)
2.3 营养配方对结肠炎炎症的影响
研究表明炎症由多个部分组成,包括局部(如红肿)和全身(如发烧)表现,这是一个动态的过程,中性粒细胞参与炎症的早期阶段[18]。MPO是粒细胞中存在的一种酶,CHASSAING等[19]的研究发现结肠组织中MPO的活性与中性粒细胞浸润的严重程度呈正相关性,过量生成可造成黏膜组织损伤。由图3-a可知,DSS处理后模型组小鼠的MPO活性显著升高,表明存在严重的中性粒细胞浸润,与前期研究结果一致。与模型组相比,不同营养配方饲养后小鼠的MPO活性均显著降低(P<0.05),说明这些营养配方均可以在一定程度上改善中性粒细胞的富集浸润,从而缓解结肠炎的炎症。其中,经营养配方P饲养的小鼠改善效果最为显著。
为了评价不同膳食干预对结肠炎小鼠结肠组织结构的影响,对各组小鼠结肠的切片进行了HE染色,并进行病理分析,由病理专家评分(图3-c)。从染色结果(图3-b)可知,正常小鼠具有规则的结构,隐窝结构完整,没有出现炎症细胞浸润和杯状细胞丢失。DSS处理的小鼠结肠组织隐窝结构破坏甚至消失,出现了严重的杯状细胞丢失和炎症细胞浸润。BASSAGAYA-RIERA等[8]的研究发现,产CLA的益生菌及CLA均能减少结肠炎小鼠黏膜损伤和炎症介质浸润。本实验中,经营养配方干预后的小鼠结肠组织有轻微的炎症细胞浸润,但仍能观察到隐窝结构和杯状细胞。从与之对应的评分中可以看出,相对于模型组,各营养配方组的HE评分均出现显著降低(P<0.05)。说明通过喂食营养配方饮食可以减少粒细胞的浸润,从而改善结肠组织损伤。
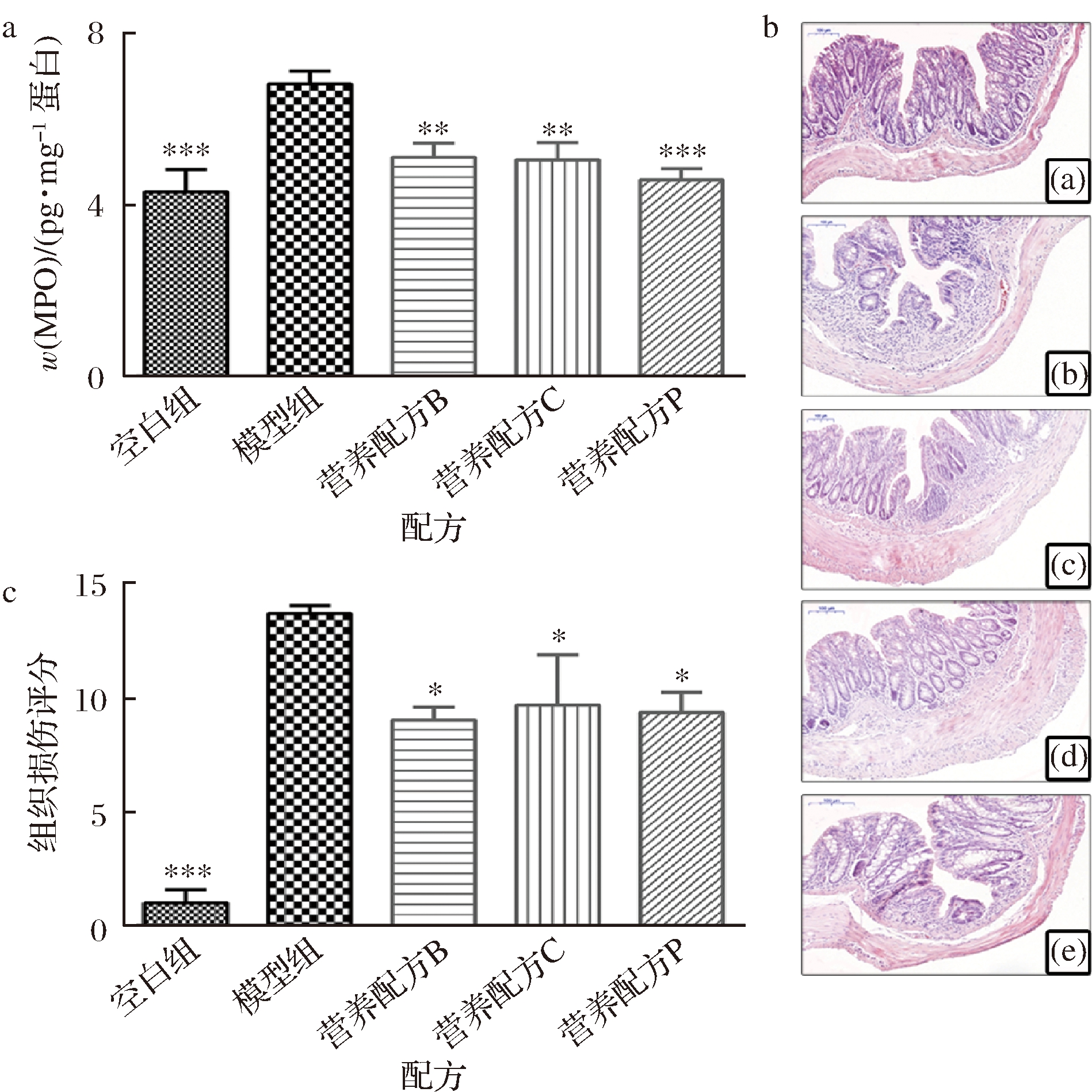
a-MPO活性;b-结肠HE染色;c-组织损伤评分
图3 不同营养配方饲养对肠炎症状的影响
Fig.3 The effect of different diets on inflammation
2.4 营养配方对结肠炎炎症因子表达的影响
为了分析不同配方饲养后小鼠结肠组织炎症水平的影响,通过ELISA法测定了各组小鼠组织上清液中细胞因子的质量分数。在DSS诱导的结肠炎模型中,小鼠的促炎因子TNF-α、IL-17、IL-6、IL-1β水平均出现显著上调,这与临床肠炎患者的细胞因子表现一致[20]。各营养配方组小鼠中的促炎因子TNF-α、IL-17、IL-6、IL-1β的表达相对模型组出现显著下调(P<0.05)。其中,添加双歧杆菌的小鼠TNF-α、IL-6、IL-1β炎症因子的表达下调更为显著(图4)。而添加CLA的小鼠所有炎症因子表达均下调的最为显著。尽管确切的发病机制尚不清楚,但NF-κB信号通路是涉及炎症的通路中被讨论较多的,巨噬细胞产生的关键促炎细胞因子TNF-α可激活NF-κB通路,而NF-κB可促进TNF-α及其他促炎细胞因子如IL-1β和IL-6的分泌[16]。研究表明CLA可以通过靶向PPAR γ细胞的机制来抑制NF-κB,从而抑制炎症因子的表达[21],这可能是添加了含CLA或双歧杆菌的配方饮食在抑制促炎因子表达上效果最佳的原因。此外,IL-17可以介导IL-6和IL-8的表达,而IL-6可引起炎症反应,IL-8可引起中性粒细胞在血液和组织中的积聚[18]。而前文已经测定了营养配方饮食干预后,与粒细胞正相关的MPO活性在结肠组织中降低,因此,推测通过降低了IL-17的表达,从而降低了MPO的活性。
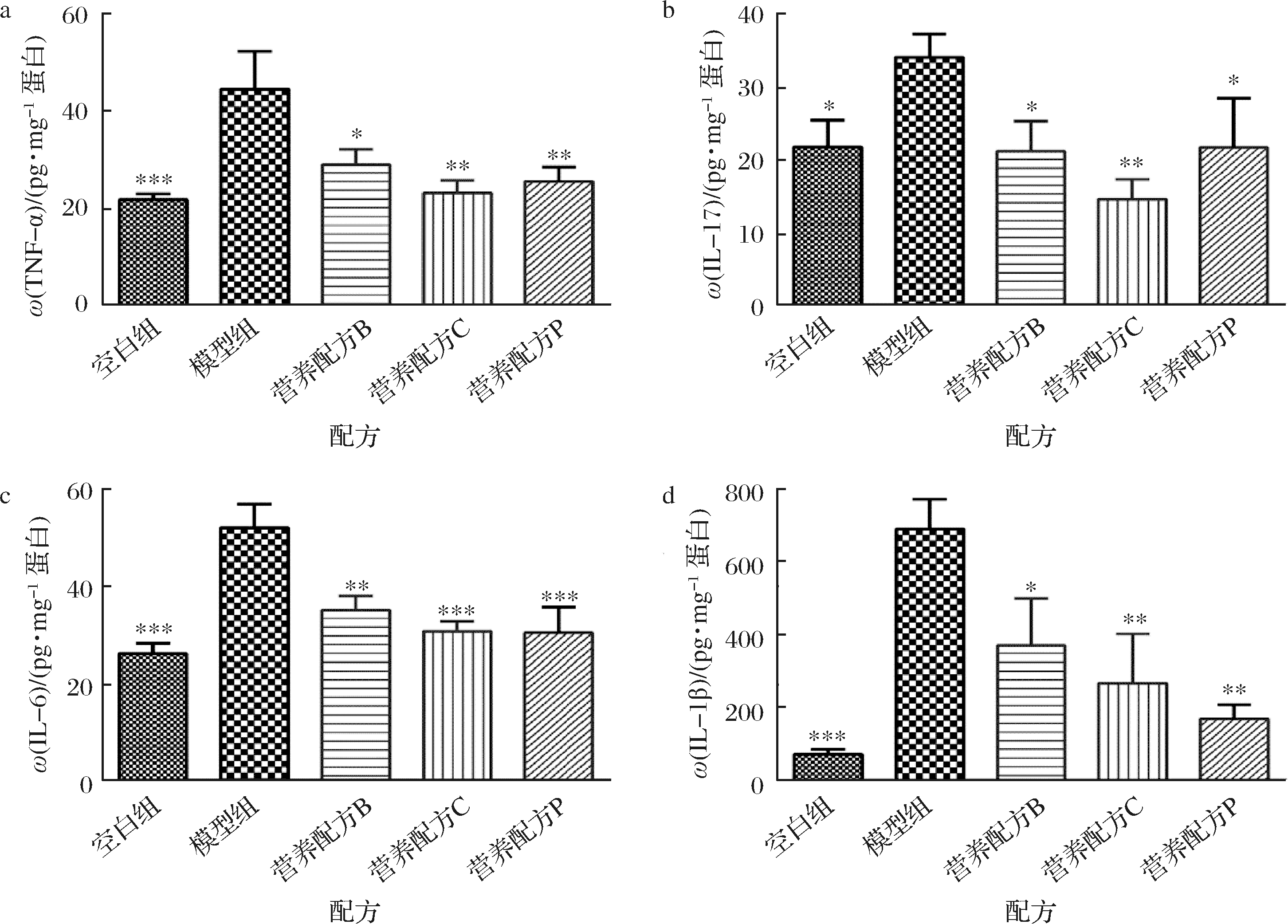
图4 不同营养配方饲养后对结肠组织炎症因子的影响
Fig.4 The effect of different diets on the inflammation cytokines levels in colonic tissue
2.5 营养配方对结肠炎黏膜层的影响
肠道覆盖着一层黏液,作为物理屏障保护着肠道,黏液层主要成分是黏蛋白MUC2。阿利新蓝染色可以将黏蛋白染成蓝色[17],故可通过阿利新蓝染色来检测结肠黏液层的完整度。染色结果如图5-a所示,正常组小鼠结肠含有大量杯状细胞,排列整齐,形状正常,杯状细胞内含有黏液;模型组的结肠黏膜层表面的黏液层及杯状细胞严重受损,基本观察不到,这可能导致致病菌与肠上皮接触,促使结肠炎症加剧和结肠组织的破坏;而各营养配方组仍能观察到黏液层覆盖着小鼠肠道上皮,并含有较多的杯状细胞,为结肠组织提供了良好的保护。
MUC2作为杯状细胞的标志,通过ELISA分析了杯状细胞中MUC2的表达情况,结果如图5-b所示,模型组MUC2的表达水平下降,与阿利新蓝染色的结果相一致,说明经DSS处理后小鼠的肠道黏膜层受损严重,相较于模型组,各营养配方组表达有所上升,有助于肠道黏膜层的修复。CHEN等[22]测定了不同浓度的CLA干预对肠炎的影响,发现至少10 mg/d的CLA摄入能显著改善肠炎引起的杯状细胞丢失,而本实验在营养配方中添加了体积分数1%的CLA,小鼠每天的摄食量约为3 g,因此每天摄入的CLA约有30 mg。从而改善了DSS引起的杯状细胞丢失。而杯状细胞的存在可防止肠道细菌毒素和其他外源性物质侵入肠道组织,进而防止肠黏膜损伤。
2.6 营养配方对小鼠肠道菌群的影响
越来越多的证据表明肠道微生物的失调与炎症性肠病的发病机制有关[23]。因此,基于16S rRNA扩增的测序方法,进一步研究了不同膳食干预对肠道微生物组成的影响(图6-a)。研究表明,肠炎患者肠道菌群中的厚壁菌门丰度会显著降低,而拟杆菌门丰度会显著升高[22]。HU等[24]通过分析厚壁菌门与拟杆菌门的丰度比值(Firmicutes:Bacteroidetes,F/B)来分析肠道菌群的变化,可以发现经DSS处理后的小鼠F/B值显著下降。与本实验的研究结果一致,而营养配方组B与营养配方组C没有改善这一现象,营养配方组P则显著增加了F/B值,表明添加了益生菌的营养配方组在菌群组成上能够发挥重要作用(图6-b)。
通过Linear discriminant analysis Effect Size(LEfSe)确定了各组肠道菌群的生物标志物[14],图6-c显示了各组之间的优势菌,从属水平上来看,空白组的优势菌属为毛螺菌属(Lachnospiraceae NK4A136 group)、Candidatus Saccharimonas属、假单胞菌属(Pseudomonas);模型组的优势菌属为梭菌属(Clostridium sensu stricto1);营养配方组B的优势菌属为红蝽杆菌属(Coriobacteriaceae UCG_002);营养配方组C的优势菌属为Parasutterella属;营养配方组P的优势菌属为双歧杆菌属(Bifidobacterium)。

a-阿利新蓝兰染色;b-MUC2表达
图5 不同营养配方饲养后对黏膜层的影响
Fig.5 The effect of different diets on the mucous layer
由图6-d可知,与模型组相比,膳食干预后毛螺菌属、Candidatus Saccharimonas属、假单胞菌属丰度没有显著变化;梭菌属丰度均显著降低(P<0.05),而LI等[25]的研究发现与健康小鼠相比,梭菌属丰度在肠易激综合症小鼠中显著增加,经治疗后显著下降。说明各营养配方组均能通过降低梭菌属的相对丰度来调节肠道菌群从而改善肠炎。营养配方组C中Parasutterella属、红蝽杆菌属显著升高(P<0.05);研究表明Parasutterella属、红蝽杆菌属与代谢相关,可能是营养配方中添加的CLA为其提供了良好的生存环境[26-27]。此外,各营养配方组中双歧杆菌属的丰度均显著增加(P<0.05),其中,营养配方组P小鼠最为显著。而双歧杆菌已证实能够对肠炎患者的恢复发挥有效作用[28]。
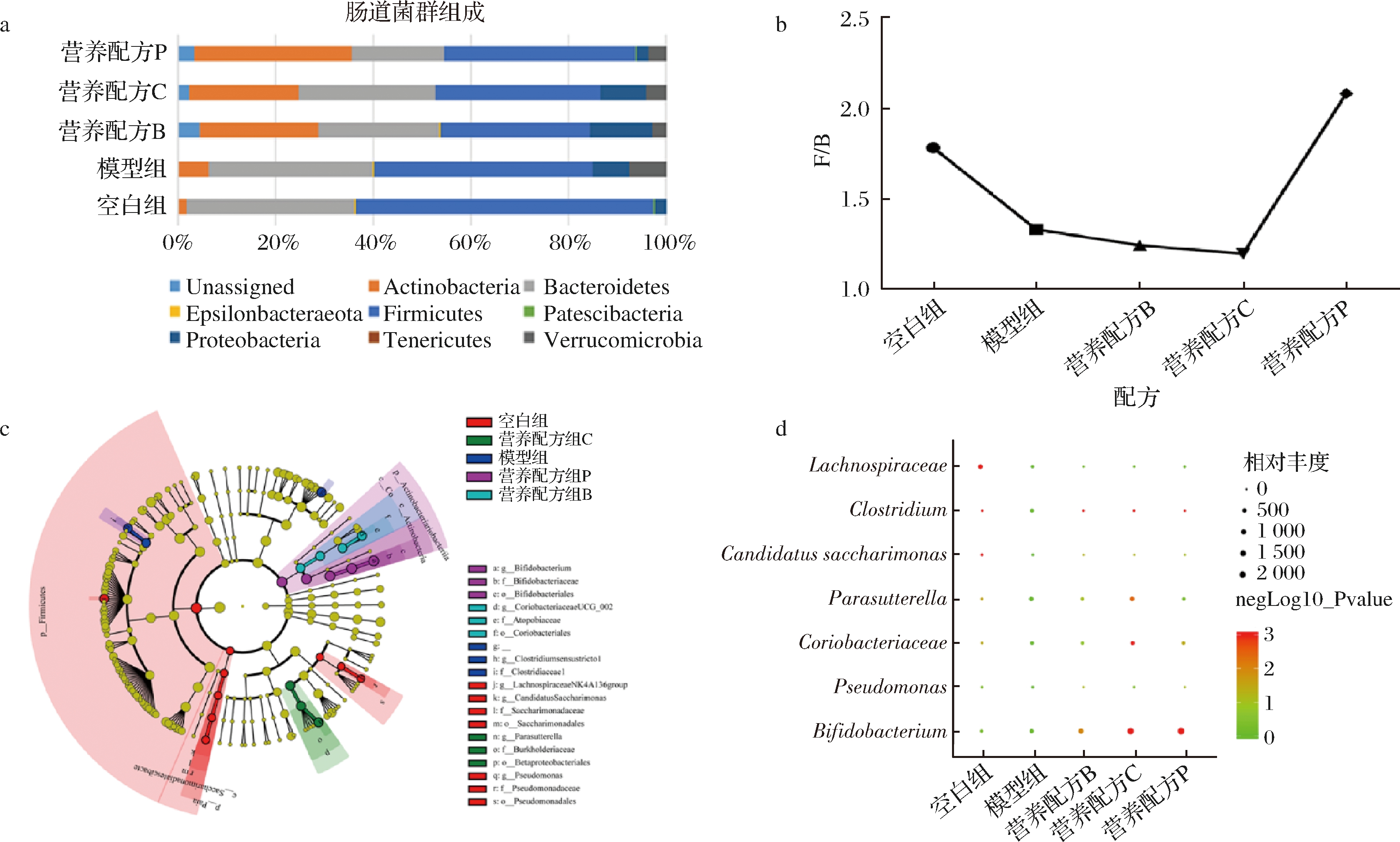
a-门水平菌群组成;b-厚壁菌门/拟杆菌门(F/B);c-属水平各组优势菌群;d-优势菌属的丰度差异
图6 不同营养配方饲养后对肠道菌群的影响
Fig.6 The effect of different diets on the gut microbial
结果表明,膳食干预通过降低肠炎小鼠梭菌属的丰度,增加双歧杆菌属的丰度来改善肠炎。此外,营养配方组P还能通过增加厚壁菌门丰度,降低拟杆菌门丰度来调节肠炎小鼠菌群的组成以改善肠炎。
3 结论
经膳食干预后,各营养配方组均能对DSS诱导的慢性肠炎小鼠产生有效作用,其中,添加CLA后在改善结肠缩短、抑制促炎因子的表达上效果更佳;添加益生菌后在体质量恢复、改善炎症、调节肠道菌群上效果更为显著,为临床上特殊医学用途配方食品原料的选择特供了依据。
[1] 吴佳红,史圣华,莫日根.溃疡性结肠炎的治法进展[J].内蒙古中医药,2016,35(12):133-134.
[2] NG S C,SHI H Y,HAMIDI N,et al.Worldwide incidence and prevalence of inflammatory bowel disease in the 21 st century:a systematic review of population-based studies[J].The Lancet,2017,390(10 114):2 769-2 778.
[3] HENGSTERMANN S,VALENTINI L,SCHAPER L,et al.Altered status of antioxidant vitamins and fatty acids in patients with inactive inflammatory bowel disease[J].Clin Nutr,2008,27(4):571-578.
[4] 王威.炎症性肠病的营养支持治疗方案回顾与疗效分析[J].中国现代药物应用,2019,13(23):49-50.
[5] LEVINE A,SIGALL BONEH R,WINE E.Evolving role of diet in the pathogenesis and treatment of inflammatory bowel diseases[J].Gut,2018,67(9):1 726-1 738.
[6] YUAN G,CHEN X,LI D.Modulation of peroxisome proliferator-activated receptor gamma (PPAR γ) by conjugated fatty acid in obesity and inflammatory bowel disease[J].Journal of Agricultural and Food Chemistry,2015,63(7):1 883-1 895.
[7] 朱诗雅,翟齐啸,赵星,等.不同乳杆菌缓解慢性酒精性肝损伤的作用比较[J].食品与发酵工业,2019,45(22):20-26.
[8] BASSAGANYA-RIERA J,VILADOMIU M,PEDRAGOSA M,et al.Probiotic bacteria produce conjugated linoleic acid locally in the gut that targets macrophage PPAR γ to suppress colitis[J].PloS One,2012,7(2):31238.
[9] WIRTZ S,POPP V,KINDERMANN M,et al.Chemically induced mouse models of acute and chronic intestinal inflammation[J].Nat Protoc,2017,12(7):1 295-1 309.
[10] YAN S,YANG B,ZHAO J,et al.A ropy exopolysaccharide producing strain Bifidobacterium longum subsp.longum YS108R alleviates DSS-induced colitis by maintenance of the mucosal barrier and gut microbiota modulation[J].Food Funct,2019,10(3):1 595-1 608.
[11] 王俊通.产共轭亚油酸乳酸菌对DSS诱导小鼠结肠炎的改善作用[D].无锡:江南大学,2016.
[12] 俞赟霞.产细菌素乳酸菌对小鼠肠道微生态的影响[D].无锡:江南大学,2018.
[13] REES V.Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines[J].Clinical & Experimental Immunology,1998,114(3):385-391.
[14] FANG Z,LI L,LIU X,et al.Strain-specific ameliorating effect of Bifidobacterium longum on atopic dermatitis in mice[J].Journal of Functional Foods,2019,60:103 426.
[15] COAKLEY M,ROSS R P,NORDGREN M,et al.Conjugated linoleic acid biosynthesis by human‐derived Bifidobacterium species[J].Journal of Applied Microbiology,2003,94(1):138-145.
[16] GASSULL M A,CABRÉ E.Nutrition in inflammatory bowel disease[J].Current Opinion in Clinical Nutrition & Metabolic Care,2001,4(6):561-569.
[17] YANG B,CHEN H,GAO H,et al.Bifidobacterium breve CCFM683 could ameliorate DSS-induced colitis in mice primarily via conjugated linoleic acid production and gut microbiota modulation[J].Journal of Functional Foods,2018,49:61-72.
[18] FOSSIEZ F,DJOSSOU O,CHOMARAT P,et al.T cell interleukin-17 induces stromal cells to produce proinflammatory and hematopoietic cytokines[J].Journal of Experimental Medicine,1996,183(6):2 593-2 603.
[19] CHASSAING B,AITKEN J D,MALLESHAPPA M,et al.Dextran sulfate sodium (DSS)-induced colitis in mice[J].Curr Protoc Immunol,2014,104(1):15.25.1-15.25.14.
[20] YOUNG D,IBUKI M,NAKAMORI T,et al.Soy-derived di-and tripeptides alleviate colon and ileum inflammation in pigs with dextran sodium sulfate-induced colitis[J].J Nutr,2012,142(2):363-368.
[21] SU C G,WEN X,BAILEY S T,et al.A novel therapy for colitis utilizing PPAR-γ ligands to inhibit the epithelial inflammatory response[J].The Journal of Clinical Investigation,1999,104(4):383-389.
[22] CHEN Y,YANG B,ROSS R P,et al.Orally Administered CLA Ameliorates DSS-Induced Colitis in Mice via Intestinal Barrier Improvement,Oxidative Stress Reduction,and Inflammatory Cytokine and Gut Microbiota Modulation[J].Journal of Agricultural and Food Chemistry,2019,67(48):13 282-13 298.
[23] WU H,YE L,LU X,et al.Lactobacillus acidophilus alleviated salmonella-induced goblet cells loss and colitis by notch pathway[J].Molecular Nutrition & Food Research,2018,62(22):1 800 552.
[24] HU Q,YUAN B,WU X,et al.Dietary intake of Pleurotus eryngii ameliorated dextran-sodium-sulfate-induced colitis in mice[J].Molecular Nutrition & Food Research,2019,63(17):1 801 265.
[25] LI J,CUI H,CAI Y,et al.Tong-xie-yao-fang regulates 5-HT level in diarrhea predominant irritable bowel syndrome through gut microbiota modulation[J].Frontiers in Pharmacology,2018,9:1 110.
[26] ZHENG J,ZHEANG J,GUO Y,et al.Improvement on metabolic syndrome in high fat diet-induced obese mice through modulation of gut microbiota by Sangguayin decoction[J].Journal of Ethnopharmacology,2020,246:112 225.
[27] JU T,KONG J Y,STOTHARD P,et al.Defining the role of Parasutterella,a previously uncharacterized member of the core gut microbiota[J].The ISME Journal,2019,13(6):1 520-1 534.
[28] 毛立新,郭元春,钱剑.双歧杆菌三联活菌胶囊治疗溃疡性结肠炎的临床观察[J].中国药房,2015,26(36):5 095-5 096.