谷胱甘肽(glutathione,GSH)是一种由谷氨酸、半胱氨酸和甘氨酸组成的非蛋白质硫醇肽,广泛存在于活性生物体中[1-2]。在大多数革兰氏阴性细菌和真核细胞中,GSH的生物合成主要通过两步ATP依赖的酶催化反应完成:1)L-谷氨酸和L-半胱氨酸在γ-谷氨酸半胱氨酸合成酶(γ-GCS,GSHI)的催化下消耗ATP产生γ-谷氨酰半胱氨酸;2)随后谷胱甘肽合成酶(GS,GSHⅡ)催化γ-谷氨酰半胱氨酸和L-甘氨酸产生GSH。基于谷胱甘肽重要的生理活性,例如抗氧化剂[3]、免疫增强剂[4]、氨基酸转运[5]和排毒[6]等,GSH已被广泛用于食品添加剂[7]、化妆品[8]和制药行业[9]。
迄今为止,许多基因工程技术,例如过表达或失活GSH代谢途径中的关键酶等,已用于高产GSH菌株的构建[10]。FEI等将来自酿酒酵母gshⅠ和gshⅡ基因引入到毕赤酵母(Pichia pastoris),重组酵母中GSH的产量达到4.15 g/L[11]。GE等将带有双功能GshF基因的载体转化到毕赤酵母中,使其GSH产量提高了近80%[12]。据报道,HARA等过表达了硫酸盐同化过程中的MET14和MET16基因,使酿酒酵母细胞内GSH含量分别增加了1.2倍和1.4倍[13]。此外,其他策略包括GSH的跨膜转运[14],添加前体[15]和运用高压空气处理[16]等,也可提高GSH的产量。
本研究中,基于本实验室保存的产GSH菌株(先前已构建了表达酿酒酵母gshⅠ和gshⅡ基因的毕赤酵母GS115菌株),致力于优化其gshⅠ和gshⅡ基因的拷贝数,以进一步提高GSH的产量。同时,通过CRISPR/Cas9技术分别敲除GSH降解基因(dug1/dug2/dug3),以减轻细胞内的GSH分解代谢压力。经过改造,毕赤酵母中GSH的产量显著增加,为未来GSH的工业化生产奠定了基础。
1 材料与方法
1.1 质粒、菌株和培养基
表1列出了本研究中使用的所有质粒和菌株。大肠埃希氏菌(Escherichia coli)JM109(美国Novagen)用于重组DNA实验。毕赤酵母GS115(基因组整合酿酒酵母gsh+I和gsh+II基因的菌株)被用作表达GSH合成酶的亲本菌株。
表1 本研究中使用的质粒和菌株
Table 1 Plasmids and strains used in this study

质粒/菌株描述来源pPICKαAα-factor,G418抗性InvitrogenpPICKA-gsh12表达gsh+I和gsh+II,G418抗性本研究构建pCas9表达Cas9蛋白,潮霉素抗性AddgenepCas9-sgRNA-DUG3潮霉素抗性本研究构建P.pastorisGS115出发菌株,表达酿酒酵母gsh+I和gsh+II基因实验室保存P.pastorisGS115-No.10高拷贝gsh+I和gsh+II基因本研究构建P.PastorisGS115-No.10-△dug1/△dug2/△dug3敲除基因dug1/dug2/dug3本研究构建
在含有100 μg/mL卡那霉素的Luria-Bertani培养基(10.0 g/L胰蛋白,5.0 g/L酵母提取物和10.0 g/L NaCl)中培养大肠杆菌转化体。毕赤酵母在含有0.25 mg/mL G418或0.2 mg/mL潮霉素的YPD培养基(20.0 g/L葡萄糖,20.0 g/L蛋白胨,10.0 g/L酵母提取物)中生长。
1.2 表达载体的构建
1.2.1 表达gsh+I和gsh+II基因载体的构建
分别用引物对F/R-GSH1和F/R-GSH2在毕赤酵母基因组上扩增出gsh+I和gsh+II基因,并用GAP启动子和AOX终止子进行表达。同时,使用引物对(F/R-PICKA-gsh)通过PCR将载体pPICKA线性化。最后,通过Gibson组装将5个片段(GSHI,GSHII,GAP1,GAP2,AOX2)连接到载体上(图1-a)。
1.2.2 用于CRISPR/Cas9的质粒和供体DNA的构建
首先通过重叠延伸PCR将六个引物组装成single guide RNA(sgRNA)。其次将纯化后的sgRNA通过一步克隆法与CRISPR/Cas9质粒相连,构建出载体pCas9-sgRNA-dug3(图1-c)。其中CRISPR/Cas9质粒可从Addgene获得。
使用引物对F/R-UP-donorDNA-dug3和F/R-DOWN-donorDNA-dug3,从GS115基因组上扩增靶基因dug3的5′-上游和3′-下游区域各1 000 bp片段。上游片段的反向引物和下游片段的正向引物彼此共享30~40 bp序列,以此将2个纯化的同源片段通过PCR融合在一起。基因dug2与dug1的敲除方法同dug3。
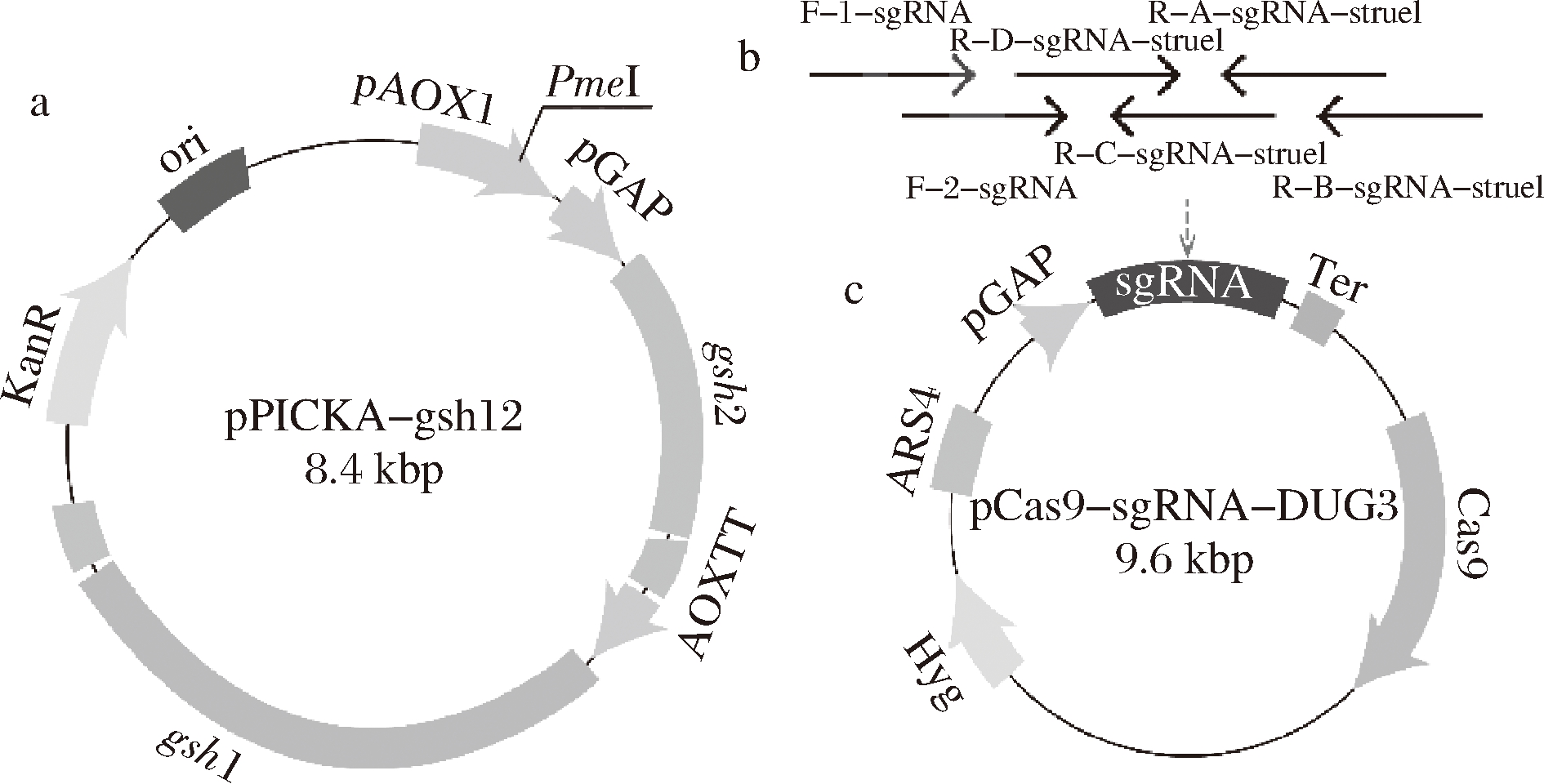
a-5个片段连接到载体; b-6个引物重叠延伸构建sgRNA;c-载体pCasq-sgRNA-dug3
图1 载体pPICKA-gsh12和pCas9-sgRNA-dug3的构建
Fig.1 Construction of plasmids pPICKA-gsh12 and pCas9-sgRNA-dug3
1.3 转化与筛选
1.3.1 pPICKA-GSH12转化和G418抗性菌株筛选
首先使用Thermo Scientific Fast Digest限制性内切酶Pme+I将质粒pPICKA-GSH12线性化,根据手册(Invitrogen)通过电转法将线性化质粒转化至毕赤酵母,涂布于含有0.25 mg/mL G418的YPD平板,于30 ℃下孵育2~3 d。选择平板上长出的较大菌落,点涂在含有 2 mg/mL G418质量浓度的YPD平板上。随后继续选择较大菌落,依次点涂在G418浓度逐次上升的YPD平板上(质量浓度梯度为5、10、20、25 mg/L)。最后,选择18个较大菌落和5个较小菌落进行发酵验证。
1.3.2 CRISPR-Cas9质粒、供体DNA的共转化与筛选
将0.5~1 μg环状质粒(pCas9-sgRNA-dug3)和5 μg线性供体通过电转法转化至毕赤酵母,并在含有0.2 mg/mL潮霉素的YPD平板上生长2~3 d。从板中挑选出23个菌落,使用分别位于上下游同源片段上的引物对F/R-dug3,以原始菌株作为对照,验证其是否包含正确整合的供体DNA盒。
1.4 摇瓶培养和GSH含量分析
在斜面培养基上挑取单菌落加入装有20 mL YPD培养基的250 mL摇瓶中,在30 ℃下培养24 h。然后将体积分数为10%的种子液加入到装有20 mL发酵培养基的250 mL摇瓶中。此时温度、搅拌速度和培养时间分别为30 ℃、220 r/min和48 h。
从发酵液中提取GSH。1 mL发酵液离心后加入等量的5%稀硫酸,将混合物在沸水中煮1 min,以8 000×g的速度离心5 min,取上清液过滤待用。使用HPLC方法分析GSH的含量,流动相中甲醇和10 mmol/L 1-庚烷磺酸钠、50 mmol/L KH2PO4缓冲液(pH 2.8)的比例为5∶95体积比,检测温度为30 ℃,流速为1 mL/min,检测波长为210 nm。
1.5 gsh+I和gsh+II基因拷贝数的定量分析
使用实时PCR测定gsh+I和gsh+II的相对拷贝数。首先,使用总RNA提取试剂盒(TIANGEN)从GS115和GS115-No.10中提取其总RNA。随后,使用Prime Script TM RT-PCR试剂盒(TAKARA)将总RNA反转录为cDNA用于下一步检测。以10-1~10-9为梯度稀释纯化的gsh+I基因,以其为模板建立标准曲线。使用引物F/R-gsh1-rtPCR,在Roche Light Cycle®480荧光定量PCR仪进行检测,每个稀释液重复3次。反应结束时,通过软件分析获得目标基因的标准曲线。
2 实验结果
2.1 基于G418筛选具有高拷贝数的gsh+I和gsh+II基因的毕赤酵母
在外源插入酿酒酵母S288C gsh+I和gsh+II基因的初始毕赤酵母GS115基础上,将线性化的重组质粒pPICKA-gsh12整合其上,这个过程是随机多拷贝发生的。由于质粒上的卡纳抗性基因与表达盒具有遗传连锁,因此可从G418高抗性推断该克隆所包含多拷贝的基因数。依次在含有不同质量浓度G418(2、5、10、20、25 mg/L)的YPD平板上筛选后,选择18个较大菌落和5个较小菌落进行摇瓶发酵。发酵结束后经测定,菌株GS115-No.10的最高摇瓶产量为1.6 g/L,比原始菌株GS115的产量高60%(图2-a)。
通过测定对照菌株GS115和重组菌株GS115-No.10在种子培养和发酵时期的生长曲线可知,在种子培养阶段,对照菌株比GS115-No.10提早进入稳定期(图2-c)。同样地,在发酵阶段,对照菌株比GS115-No.10早8小时进入稳定期(图2-d)。
将线性化的重组质粒pPICKA-gsh12通过5’AOX1位点,同源重组到毕赤酵母的基因组上。提取对照菌株GS115和GS115-No.10菌株的总RNA,并将其反转录为cDNA。然后通过RT-PCR确定这2个菌株中gsh+I基因的起始模板拷贝数。分析可知,经过筛选实验后,靶菌株与对照起始模板拷贝数的比率增加,GS115-No.10的拷贝数约为对照的5倍(图2-b)。此外,在连续3轮培养后,GS115-No.10中GSH的生成无明显变化,表明筛选出来的高拷贝菌株较稳定。
2.2 敲除GSH降解基因dug1/2/3
我们通过敲除dug1,dug2和dug3基因来研究GS115-No.10菌株中GSH产量的变化。首先将质粒pCas9-sgRNA-dug3和供体DNA-dug3共转化到GS115-No.10菌株中。从含有潮霉素的YPD平板上挑选47个转化体,使用F/R-dug3引物对,通过菌落PCR验证。经凝胶核酸电泳分析后,从转化体扩增出1 031 bp和1 978 bp两种条带(图3-c)。经过测定1 031 bp PCR产物的序列可知,供体DNA-dug3序列已成功替换了原始dug3基因的1 978 bp片段。按照上述步骤分别敲除dug1和dug2基因,通过凝胶电泳分析获得了818 bp(对照1 125 bp)和927 bp(对照2 016 bp)的条带。最后,通过传代培养除去游离质粒pCas9-sgRNA。敲除dug3/dug2/dug1基因的菌株用于发酵验证。如图3-a和3-b所示,敲除dug3的菌株干细胞质量为7.5 g/L,比对照低23.6%,而GSH的产量没有明显变化。结果表明,敲除dug基因使单位酵母体积中的GSH含量增加,但酵母的生长受到了影响。

a-对照和23个重组菌株的GSH产量;b-根据GS115-No.10和对照菌株的Ct值计算得出其对应的拷贝数(log)分别为2.9和2.18;c-在种子培养时期对照和GS115-No.10菌株的生长曲线; d-在发酵时期对照和GS115-No.10菌株的生长曲线;1~18号为大菌落,19-23号为小菌落
图2 筛选具有gsh+I和gsh+II基因高拷贝的菌株
Fig.2 Screening strains for high copy numbers of gsh+I and gsh+II genes

a-对照和敲除菌株的GSH产量; b-发酵44 h时对照和敲除菌株的OD600值; c-敲除dug1/2/3基因电泳图; d-单位质量细胞所含GSH的量
图3 敲除GSH分解代谢基因
Fig.3 Knockout of GSH catabolic genes
2.3 发酵培养基的优化
2.3.1 葡萄糖浓度的优化
由于单个基因缺失的菌株生长受到一定影响,我们优化了培养基以增强细胞生长。鉴于葡萄糖是毕赤酵母培养基的一种碳源,首先优化了其中的葡萄糖质量浓度。如图4所示,当初始葡萄糖添加量为60 g/L时,dug基因缺失菌株的GSH产量仍为1.6 g/L,但其细胞密度略有增加。在15~60 g/L范围内,培养基中葡萄糖含量与GSH产量正相关。但是,超出此范围,葡萄糖含量与GSH产量不成比例,图4显示,培养基中的葡萄糖越多,GSH的浓度越低。因此我们推断造成酵母生长负面影响的原因可能是葡萄糖效应。

图4 葡萄糖添加量优化后每组的GSH产量和相应的OD600
Fig.4 GSH production and corresponding OD600values of each group in the optimization of glucose addition amount
2.3.2 优化添加3种前体
酵母中GSH的合成需要谷氨酸、甘氨酸和半胱氨酸的参与。在本研究中,为了优化发酵培养基中这3种成分的添加量,进行了3因素3水平正交实验以确定最佳的方案。根据正交设计的直观分析,如表2所示,分别取各组最大的Ki值所对应的添加量,确定最优方案是谷氨酸添加量为81 mmol/L,甘氨酸27 mmol/L和半胱氨酸13.5 mmol/L,此时GSH摇瓶产量为1.7 g/L。通过方差分析发现,半胱氨酸的F值介于F0.10和F0.05之间,说明在这3个因素中,半胱氨酸的添加量是影响GSH产量的主要因素,而谷氨酸的影响最小。随着半胱氨酸浓度的增加,GSH的产量反而降低,这可能是由于过量添加半胱氨酸会影响细胞生长。
表2 三因素三水平实验分析表
Table 2 Three-factor three-level experimental analysis table

编组(A)谷氨酸/(mmol·L-1)(B)甘氨酸/(mmol·L-1)(C)半胱氨酸/(mmol·L-1)空列产量/(g·L-1)J2713.513.511.6K27272721.38L27545431.28M5413.52731.40N54275411.42O545413.521.44P8113.55421.46Q812713.531.70R81542711.35K14.264.454.744.37K24.274.504.134.28T=13.03K34.514.084.164.38K2118.1519.8022.4719.10K2218.2320.2517.0618.32K2320.3416.6517.3119.18
注:Ki值为不同添加量时对应的GSH产量之和;T为J-R组GSH产量之和
表2 方差法分析3种氨基酸的最佳添加量
Table 2 Analysis of the optimal addition of three amino acids by variance method
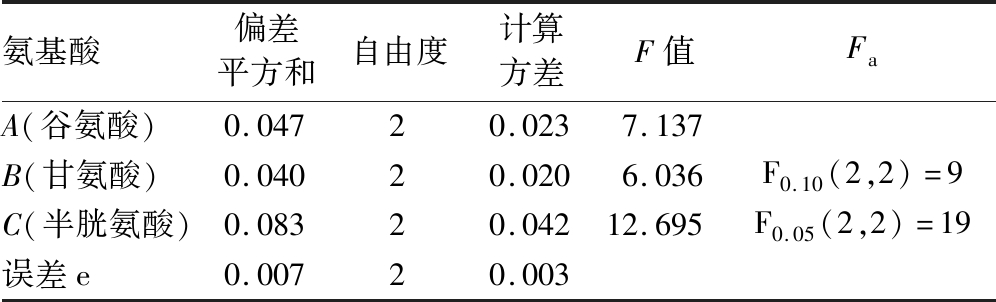
氨基酸偏差平方和自由度计算方差F值FaA(谷氨酸)0.04720.0237.137B(甘氨酸)0.04020.0206.036F0.10(2,2)=9C(半胱氨酸)0.08320.04212.695F0.05(2,2)=19误差e0.00720.003
注:F值为因素水平的改变引起的平均偏差平方和与误差的平均偏方平方和的比值;Fa的值可通过查询F分布表得到
3 讨论
谷胱甘肽在食品、药品和化妆品领域应用广泛。谷胱甘肽合成途径涉及2个酶(GshI和GshII)或一个双功能酶(GshF)。外源基因的拷贝数是影响其在毕赤酵母中表达效率的重要因素之一。产物合成代谢途径中关键酶的表达量与产物的产量有一定关系。由于GshI是谷胱甘肽合成途径中的关键酶[18],我们过表达了gsh+I基因以增加毕赤酵母中GSH的产量,但是谷胱甘肽的产量反而下降了。从液相色谱-质谱法的结果中可知,与对照相比,过量表达gsh+I基因时的中间产物γ-GC积累更多(数据未显示)。然后,我们在毕赤酵母GS115中同时过表达了gsh+I和gsh+II基因,并使用高浓度抗生素筛选出了具有高拷贝基因的宿主菌,使GSH的产量提高到1.6 g/L。
在实验过程中发现,发酵一定时间后,细胞内谷胱甘肽的含量有明显的下降趋势。由于谷胱甘肽参与细胞内的硫酸盐同化过程,因此推测当细胞内谷胱甘肽过多时,其降解机制被激活以稳定细胞硫代谢平衡[18]。在酵母中发现的包含3个基因dug1,dug2和dug3的GSH降解途径(dug途径),被认为是GSH降解的主要途径[19-20]。其中,dug1p功能亚基水解谷胱甘肽的一般肽键[21],而dug2p和dug3p功能亚基参与γ-谷氨酰半胱氨酸和γ-肽键的水解[22]。BAUDOUIN等研究发现△dug2或△dug3突变酵母中GSH的降解几乎被完全阻止,这表明dug2和dug3基因是该过程必不可少的[20]。
通过DNA序列BLAST发现了酿酒酵母中dug基因在毕赤酵母中的同源基因,其蛋白质序列同一性约为64%,表明毕赤酵母中的这个同源蛋白很可能发挥着相似的作用。因此,我们敲除此同源蛋白的对应基因序列。
在这项研究中,我们通过筛选具有高拷贝gsh+I和gsh+II基因的毕赤酵母,并分别敲除在谷胱甘肽降解途径中的3个基因(dug1/2/3),最后经过培养基优化,将毕赤酵母中GSH的产量提高到1.7 g/L。该研究为实现更经济的谷胱甘肽工业生产奠定了基础。
[1] ANDERSON, M.E.Glutathione:an overview of biosynthesis and modulation[J].Chem Biol Interact,1998,24(111-112):1-14.
[2] SANTOS L O, GONZALES T A, BEATRIZ, et al.Influence of culture conditions on glutathione production by Saccharomyces cerevisiae[J].Applied Microbiology & Biotechnology, 2007, 77(4):763-769.
[3] HARRIS I, TRELOAR A, INOUE S, et al.Glutathione and thioredoxin antioxidant pathways synergize to drive cancer initiation and progression[J].Cancer Cell, 2015, 27(2):211-222.
[4] DRÖGE W, BREITKREUTZ R.Glutathione and immune function[J].Proceedings of the Nutrition Society, 2000, 59(4):595-600.
[5] PETER S,DIANA D,HEIKO M.Phytoremediation of organic xenobiotics-glutathione dependent detoxification in Phragmites plants from European treatment sites[J].Bioresource Technology, 2008, 99(15):7 183-7 191.
[6] JESCHKE V, GERSHENZON J.Insect detoxification of glucosinolates and their hydrolysis products[J].Advances in Botanical Research, 2016, 80:199.
[7] YUCHENG Z, XIAOHONG B.Nystatin-enhanced glutathione production by Saccharomyces cerevisiae, depends on γ-glutamylcysteine synthase activity and K+[J].Engineering in Life Sciences, 2013, 13(2):156-162.
[8] TASKIN M.A new strategy for improved glutathione production from Saccharomyces cerevisiae:Use of cysteine-and glycine-rich chicken feather protein hydrolysate as a new cheap substrate[J].Journal of the Science of Food and Agriculture, 2013, 93(3):535-541.
[9] TIAN Y, JIANG W, GAO N, et al.Inhibitory effects of glutathione on dengue virus production[J].Biochemical and Biophysical Research Communications, 2010, 397(3):0-424.
[10] YANG Z, ZHANG Z.Engineering strategies for enhanced production of protein and bio-products in Pichia pastoris:A review[J].Biotechnology Advances, 2017:S0734975017301301.
[11] FEI L, WANG Y, ChEN S.Improved glutathione production by gene expression in Pichia pastoris[J].Bioprocess and Biosystems Engineering, 2009, 32(6):729-735.
[12] GE S, ZHU T, LI Y.Expression of bacterial GshF in Pichia pastoris for glutathione production[J].Applied and Environmental Microbiology, 2012, 78(15):5 435-5 439.
[13] HARA K Y, KIRIYAMA K, INAGAKI A, et al.Improvement of glutathione production by metabolic engineering the sulfate assimilation pathway of Saccharomyces cerevisiae[J].Applied Microbiology and Biotechnology, 2012, 94(5):1 313-1 319.
[14] KIRIYAMA K, HARA K Y, KONDO A.Extracellular glutathione fermentation using engineered Saccharomyces cerevisiae expressing a novel glutathione exporter[J].Applied Microbiology and Biotechnology, 2012, 96(4):1 021-1 027.
[15] WEN S, ZHANG T, TAN T.Utilization of amino acids to enhance glutathione production in Saccharomyces cerevisiae[J].Enzyme and Microbial Technology, 2004, 35(6-7):501-507.
[16] DONG Y, YANG Q, JIA S, et al.Effects of high pressure on the accumulation of trehalose and glutathione in the Saccharomyces cerevisiae cells[J].Biochemical Engineering Journal, 2007, 37(2):226-230.
[17] WU A L, MOYEROWLEY W S.GSH1, which encodes gamma-glutamylcysteine synthetase, is a target gene for YAP-1 transcriptional regulation[J].Molecular & Cellular Biology, 1994, 14(9):5 832-5 839.
[18] SUZUKI T, YOKOYAMA A, TSUJI T, et al.Identification and characterization of genes involved in glutathione production in yeast[J].Journal of Bioscience & Bioengineering, 2011, 112(2):107-113.
[19] BAUDOUIN P, LAGNIEL G, KUMAR C, et al.Glutathione degradation is a key determinant of glutathione homeostasis[J].Journal of Biological Chemistry, 2012, 287(7):4 552-4 561.
[20] KAUR H, GANGULI D, BACHHAWAT A K.Glutathione degradation by the alternative pathway (DUG Pathway) in Saccharomyces cerevisiae is initiated by (Dug2p-Dug3p)2 complex, a novel glutamine amidotransferase (GATase) enzyme acting on glutathione[J].Journal of Biological Chemistry, 2012, 287(12):8 920-8 931.
[21] KAUR H, KUMAR C, JUNOT C, et al.Dug1p is a Cys-Gly peptidase of the γ-glutamyl cycle of Saccharomyces cerevisiae and represents a novel family of Cys-Gly peptidases[J].Journal of Biological Chemistry, 2009, 284(21):14 493-14 502.
[22] GANGULI D, KUMAR C, BACHHAWAT A K.The alternative pathway of glutathione degradation is mediated by a novel protein complex involving three new genes in Saccharomyces cerevisiae[J].Genetics, 2006, 175(3):1 137-1 151.