红曲是以大米为主要原料,接种红曲菌(Monascus sp.)经固态发酵制成的紫红色曲米,有1 000多年的历史[1]。红曲被广泛用作食品着色剂、鱼肉防腐剂、醋酒发酵剂以及传统中药等,是药食两用的传统中药材,应用范围广,开发价值高,具有重要的经济意义[2-5]。现代研究发现,红曲中蕴含多种具有生物活性的物质,如莫纳可林类、γ-氨基丁酸、麦角甾醇、黄酮类及食用色素等[5]。自ENDO(远藤章)1979年发现红曲菌可以产生具有降血脂功能的莫纳可林K(monacolin K,又名洛伐他汀)以来[6],红曲产品的开发已经引起国内外的高度关注。然而,1995年BLANC等[7]发现,紫色红曲菌和红色红曲菌可产生桔霉素(citrinin,又叫桔青霉素),对脊椎动物具有肝肾毒性和致癌性,因此红曲菌发酵产品(包括红曲)的安全性引起了人们的担忧,限制了红曲菌发酵产品的应用,并已成为我国红曲产品出口及新产品开发的限制性因素。因为桔霉素对人体的危害极大,许多国家和地区都对红曲菌发酵产品的桔霉素含量制定了严格的限量标准[8]。目前,我国对红曲红色素、红曲黄色素和功能性红曲米中的桔霉素做了限量规定[红曲红色素的限量标准为40 μg/kg(以单位色价计),红曲黄色素的限量标准为1 000 μg/kg,功能性红曲米的限量标准为50 μg/kg][9-11]。因此筛选低产或不产桔霉素的红曲菌菌株成为红曲产业研究的热点[8,12-13]。
尽管红曲制作的历史悠久,但我国第一个红曲相关标准直至1985年才诞生[1]。现阶段相关标准对红曲生产菌种的规定为:红曲食品类产品用红曲菌属(Monascus)的菌种即可,中药和保健品对生产菌种统一要求用紫色红曲菌(Monascus purpureus)[1,14]。随着红曲菌分类学的研究和生产实践的发展,现行的一些红曲产品标准对红曲菌种的规定在一定程度上影响了红曲产业的更好发展。红色红曲菌(Monascus ruber)和紫色红曲菌均为工业上广泛应用的红曲菌[5,15],但前者不在红曲中药和保健品的生产菌种之列。本研究采用高效液相色谱法,分析比较选取的22株红曲菌生产的红曲中莫纳可林K和桔霉素含量,以期为红曲中药和保健品相关标准的修订提供科学依据。
1 材料与方法
1.1 菌株与试剂
1.1.1 实验菌株
本实验选择11株M. purpureus和11株M. ruber,共22株。其中,福建省微生物研究所红曲菌种资源库10株,中国普通微生物菌种保藏管理中心4株,中国工业微生物菌种保藏管理中心6株,美国模式培养物保存库(ATCC)2株。
1.1.2 实验试剂
洛伐他汀标准品(纯度99.4%),中国食品药品检定研究院;桔霉素标准品(纯度98%),上海阿拉丁生化科技股份有限公司;甲醇和乙腈(色谱纯),德国Merck公司产品;H3PO4(色谱纯),天津市光复精细化工研究所产品。其他试剂均为分析纯。
1.1.3 培养基配制
马铃薯葡萄糖(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,琼脂15 g,用于PDA斜面的制备。种子培养基(g/L):葡萄糖50,蛋白胨15,酵母粉10,MgSO4 0.5,KH2PO4 1,NaNO3 3,用于红曲菌的种子培养。米饭培养基:市售大米50 g浸泡过夜,沥干后装入500 mL三角瓶中,用于红曲菌的固态发酵[12]。以上培养基均于121 ℃灭菌30 min。
1.2 仪器和设备
Agilent 1260高效液相色谱仪(配二极管阵列检测器),美国Agilent公司;Waters 2695高效液相色谱仪(配2475荧光检测器),美国Waters公司;XA105型电子分析天平(双量程,d=0.01 mg/0.1 mg),梅特勒-托利多公司;GR110DR型全自动高压蒸汽灭菌锅,厦门致微仪器有限公司;Milli-Q Advantage A10超纯水系统,Millipore公司;S1000 PCR仪,美国Bio-Rad公司。
1.3 实验方法
1.3.1 红曲菌株的ITS复核
对选取的菌株采用ITS测序和比对的方法进行菌种复核。菌株的培养参照文献[15],培养完成后收集菌丝体用灭菌蒸馏水清洗,加入液氮研磨成粉末,采用生工生物工程(上海)股份有限公司的Ezup柱式真菌基因组DNA提取试剂盒提取DNA。
ITS的扩增采用引物ITS5 (5’-TCCTCCGCTTATTGATATGC-3’)和ITS4 (5’-GGAAGTAAAAGTCGTAACAAGG-3’)[16]。PCR反应总体积为50 μL: 10×PCR反应缓冲液5 μL,dNTPs(4种浓度均为2.5 mmol/L)1 μL,引物(均为10 μmol/L)各1 μL,Taq聚合酶2 U,DNA模板2 μL,加灭菌蒸馏水至50 μL。PCR反应程序为:94 ℃预变性3 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸60 s,33个循环;72 ℃终末延伸10 min。用10 g/L琼脂糖凝胶电泳检测扩增产物,阳性样本送测序公司用凝胶回收试剂盒回收目的片段进行双向测序。
拼接测序得到的ITS序列,并根据测序图谱人工校正碱基。采用MEGA 6.0软件[17]对DNA序列进行排序,并对排序结果进行校正,去除5’和3’端非对位排列区。利用MEGA 6.0软件基于K2P (Kimura 2-parameter)模型的邻接法(neighbour-joining,NJ)构建系统发育树,自展1 000次估计各分支的支持率。结合形态特征和多基因的系统发育分析,BARBOSA等[18]修订了红曲菌的分类系统,本研究主要参考该分类系统。所下载的各种红曲菌ITS 序列的GenBank登录号为:KY635847、KY635848、KY635850、KY635851、AY498585、AY498586、JF922046、KY511726、KY511740和KY511751。构建系统发育树所用的外类群为黄曲霉(Aspergillus flavus) DQ683124、寄生曲霉(Aspergillus parasiticus)EF661568和烟曲霉(Aspergillus fumigatus)HQ026746。
1.3.2 红曲的制备
将红曲菌株接种至PDA斜面培养基活化后参照文献[12]制备种子液并进行固态发酵。每个菌株做3个平行的固态发酵,未接种红曲菌的米饭培养基作为空白对照。将固态发酵后经过60 ℃干燥10 h的红曲米粉碎(60目,粉状)并充分混合均匀。
1.3.3 莫纳可林K含量的测定
按QB/T 2847—2007《功能性红曲米(粉)》检测红曲中的莫纳可林K含量[11]。使用Agilent 1260高效液相色谱仪,色谱柱为C18柱(4.6 mm×250 mm,5 μm),柱温为25 ℃,检测波长为238 nm,进样量为10 μL,流速为1 mL/min。根据保留时间定性化合物,使用外标法根据峰面积定量。自然发酵生产的红曲中莫纳可林K存在酸式和内酯式2种构型,这2种构型含量之和为红曲中莫纳可林K总量。
用体积分数75%乙醇稀释1 000 μg/mL的洛伐他汀储备液至质量浓度分别为1、10、30、75、150和400 μg/mL的洛伐他汀标准溶液,按标准进行高效液相色谱分析。以峰面积为纵坐标、洛伐他汀的质量浓度为横坐标,进行线性回归分析。R2>0.999时进行样品测定。
1.3.4 桔霉素含量的测定
参照GB 5009.222—2016《食品安全国家标准 食品中桔青霉素的测定》中的免疫亲和柱净化-高效液相色谱法来检测红曲米中的桔霉素含量[19]。使用Waters公司的2695高效液相色谱仪及2475荧光检测器,激发波长330 nm,发射波长500 nm,色谱柱为C18柱 (4.6 mm× 150 mm, 3.5 μm),柱温30 ℃,进样量为30 μL,流速为0.7 mL/min,流动相条件参照该标准。
用体积分数70%甲醇稀释桔霉素储备液至质量浓度分别为0.2、0.5、2、5、10和50 μg/L的桔霉素标准溶液,按标准进样分析,以峰面积为纵坐标、质量浓度为横坐标,绘制标准曲线。R2>0.999时测定样品。
2 结果与分析
2.1 红曲菌株的ITS复核
现阶段主流观点认为红曲菌属共包含10个物种,因此本研究下载了10种红曲菌模式菌株的ITS序列。利用选取的22株红曲菌株ITS序列和下载的红曲菌及外类群ITS序列构建的系统发育树见图1。
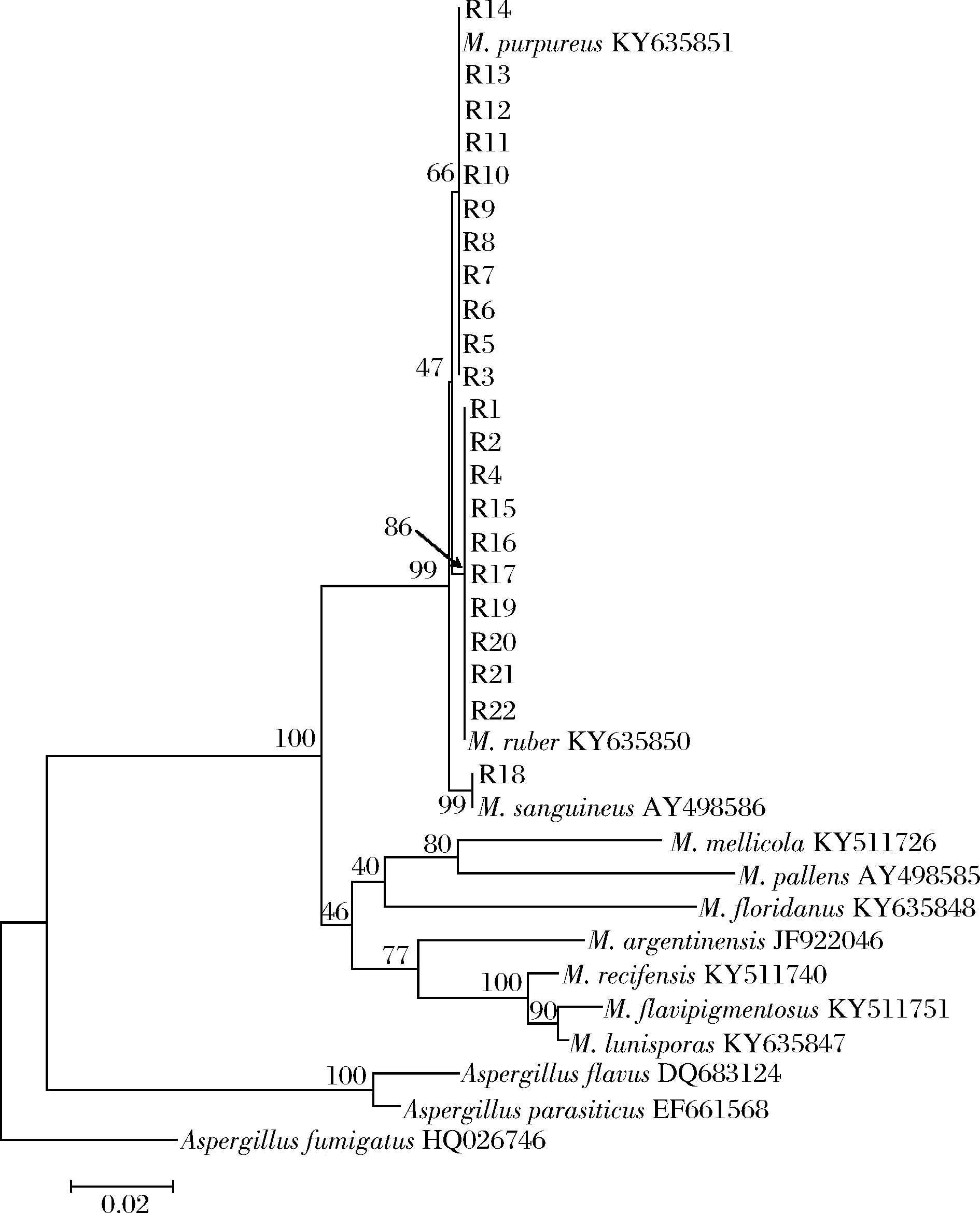
图1 利用ITS序列基于Kimura双参数模型构建的系统发育树
Fig.1 The phylogenetic tree resulted from analysis of the ITS sequences using the Kimura two-parameter model
11株红曲菌(R3、R5~R14)和M. purpureus的ITS序列完全相同,在系统发育树中构成一个单系,支持率为66%;10株红曲菌(R1、R2、R4、R15~R17、R19~R22)和M. ruber的ITS序列之间没有变异,在系统发育树中构成一个单系,支持率为86%;菌株R18和M. sanguineus的ITS序列完全相同,这两者构成的单系支持率为99%。由于不同红曲菌的ITS序列差异明显,参考BARBOSA等[18]红曲菌的分类系统,11株红曲菌(R3、R5~R14)被鉴定为M. purpureus, 10株红曲菌(R1、R2、R4、R15~R17、R19~R22)被鉴定为M. ruber,R18被鉴定为M. sanguineus。由于本研究的目的是比较红色红曲菌和紫色红曲菌不同菌株产莫纳可林K和桔霉素的能力,因此血红红曲菌的数据未纳入后续分析。
2.2 红曲中莫纳可林K和桔霉素含量的测定
莫纳可林K检测的回归方程为y=35.71x-26.47(R2=0.999 9),莫纳可林K在1~400 μg/mL呈良好的线性关系。桔霉素检测的回归方程为y=83 477.83x-5 510.89(R2=0.999 7),桔霉素在0.2~50 μg/L呈良好的线性关系,其检出限为8 μg/kg。
用21株红曲菌通过固态发酵生产的红曲中莫纳可林K和桔霉素含量的测定结果见表1。11株紫色红曲菌发酵生产的红曲只有R5检测到莫纳可林K,其含量极低;11份红曲中均检测出桔霉素,只有R8的桔霉素含量(18.37 μg/kg)未超过50 μg/kg,R14的含量为377.90 μg/kg,其他9份红曲中的桔霉素含量均>1 000 μg/kg。在10株红色红曲菌生产的红曲中只有R22未检测到莫纳可林K,其他9株红色红曲菌所制红曲中莫纳可林K的含量范围为2.67~14.20 mg/g,酸式莫纳可林K的比例为49.79%~87.09%;在4份红曲(R4、R15、R16和R17)中检测出桔霉素,但含量均<150 μg/kg。5株红色红曲菌(R1、R2、R19、R20和R21)所制作的红曲中莫纳可林K和桔霉素含量均符合QB/T 2447—2007《功能性红曲米(粉)》中莫纳可林K(≥4 mg/g)和桔霉素(≤50 μg/kg)的限量标准。
表1 二十一株红曲菌所制作的红曲中莫纳可林K和桔霉素的含量
Table 1 Monacolin K and citrinin contents of 21 samples of red yeast rice

菌株编号中文名拉丁名莫纳可林K/(mg·g-1)酸式比例/%桔霉素/(μg·kg-1)R3紫色红曲菌M.purpureus——8470.10±287.49R5紫色红曲菌M.purpureus0.10±0.0248.87±1.141890.71±147.26R6紫色红曲菌M.purpureus——3216.44±401.47R7紫色红曲菌M.purpureus——1084.30±167.92R8紫色红曲菌M.purpureus——18.37±2.69R9紫色红曲菌M.purpureus——11064.29±1160.37R10紫色红曲菌M.purpureus——6470.14±786.26R11紫色红曲菌M.purpureus——7341.21±557.52R12紫色红曲菌M.purpureus——3813.03±183.53R13紫色红曲菌M.purpureus——1444.48±125.92R14紫色红曲菌M.purpureus——377.90±15.65R1红色红曲菌M.ruber9.96±0.1367.53±0.46—R2红色红曲菌M.ruber5.15±0.2171.46±2.52—R4红色红曲菌M.ruber14.20±0.4549.79±0.32137.45±10.53R15红色红曲菌M.ruber12.66±0.4757.15±0.0574.69±11.20R16红色红曲菌M.ruber2.67±0.0455.31±1.6359.25±3.56R17红色红曲菌M.ruber6.90±0.5472.46±0.3798.71±9.21R19红色红曲菌M.ruber4.57±0.2470.17±0.47—R20红色红曲菌M.ruber7.67±0.3175.55±1.27—R21红色红曲菌M.ruber4.49±0.2387.09±1.59—R22红色红曲菌M.ruber———
注:“—”表示未检出,数据为3个样品的平均值
3 结论与讨论
准确的物种鉴定和分类是开展红曲菌其他相关生物学科学研究的基本条件。分类学研究属于基础研究,由于红曲菌被用于生产具有重大经济价值和医药价值的红曲,因此,红曲菌的分类学研究在基础研究和应用研究中均具有重要意义。长久以来研究者主要依靠形态学和生理生化特征鉴别红曲菌,导致其菌种名称较混乱,因此,曾描述记载的种名有30多个[18,20-22]。这些种名主要依靠形态特征,如菌落的形态、颜色和生长速度,以及菌丝、分生孢子、闭囊壳和子囊孢子的形态等命名[20]。传统的形态学鉴定是开展物种鉴定和系统分类工作的重要手段,但受环境因素影响大[18,23],存在主观性强、稳定性和重复性差等局限。因此利用形态特征来命名的物种需进一步采用DNA序列验证。采用传统分类方法结合多个基因序列数据的分析,大多数以形态特征命名的红曲菌被视为同种异名[18,23-24]。DNA序列数据的应用对厘清红曲菌的分类发挥了积极的作用,为探明传统红曲生产中的菌种问题提供了科学依据和先进手段。所以,应该运用分类学的新技术、新成果来分析红曲生产中的菌种类型、优势种类,指导实际生产中菌种的选择和改良以提升红曲品质等技术问题,促进红曲产业的健康发展[1]。经过研究,工业上广泛应用的红曲菌主要为红色红曲菌、丛毛红曲菌(M. pilosus)和紫色红曲菌[5,15]。但我国在制定红曲中药和保健品的标准时,选定紫色红曲菌为唯一生产菌种,其理由和依据不明,且难以查证[1,14]。或许是因为当时可依据的文献数据主要是关于紫色红曲菌的,但彼时对紫色红曲菌的研究大部分局限在色曲和酿造曲的生产菌种选育和发酵制作工艺等领域[1],以此作为选择高产莫纳可林K的功能性红曲生产菌种的依据不尽合理。
我国工业化生产的红曲产品主要有3类,即酿造用红曲、色素红曲和功能红曲。紫色红曲菌在历史上主要用于生产色素红曲,原因是这种红曲菌色素生产能力强,但该菌也是易产桔霉素的红曲菌种之一[1,14]。本研究证实了这一点:11份由紫色红曲菌生产的红曲中均检测出桔霉素,其中9份红曲的桔霉素含量均>1 000 μg/kg;相比之下,在10株红色红曲菌发酵生产的红曲中有6株未检测到桔霉素(检出限8 μg/kg),另外4株产桔霉素的能力也较弱。表明紫色红曲菌生产的色曲,桔霉素超标的几率较大。已知桔霉素聚酮合酶基因pksCT和转录激活因子ctnA在桔霉素的生物合成中起作用:pksCT的缺失导致M. purpureus IFO 30873丧失产桔霉素的能力,ctnA缺失则导致M. purpureus桔霉素的产量降低至几乎检测不到的水平[25-26]。在CHEN等[27]的研究中,选用的4株紫色红曲菌均具有pksCT和ctnA基因,都可产生桔霉素;而6株红色红曲菌均缺失pksCT和ctnA基因,发酵产物的桔霉素检测也呈阴性。红曲中药及保健品的生产菌种除了考虑其安全性(桔霉素含量)外,莫纳可林K的含量应是衡量红曲产品质量的关键指标之一,因为莫纳可林K是该类型红曲中唯一被阐明具有降胆固醇活性的成分。且最早发现产莫纳可林K的红曲菌为1株分离自泰国食物的M.ruber No.1005[6]。本研究结果表明,紫色红曲菌产莫纳可林K能力不如红色红曲菌,因此,只将紫色红曲菌列入可用于红曲中药和保健食品的真菌菌种名单值得商榷[1,14]。考虑到民间制作红曲所用的混合菌种应该包含了红色红曲菌,红色红曲菌也是工业中广泛应用的红曲菌之一[5],且红色红曲菌产莫纳可林K的能力较强,低产或不产桔霉素的几率高,红色红曲菌应该通过相应程序在红曲中药和保健品相关标准中获得合法地位。本研究以期为将来红曲中药和保健品相关标准的修订提供部分科学依据。
[1] 林风,吴丽云,李慧.红曲生产菌种选择管理中的问题与思考[J].中药材,2018,41(2):490-496.
[2] YANG Y,LIU B,DU X,et al.Complete genome sequence and transcriptomics analyses reveal pigment biosynthesis and regulatory mechanisms in an industrial strain,Monascus purpureus YY-1[J].Scientific Reports,2015,5:8 331.
[3] LIU Z,WANG Z,LYU X,et al.Comparison study of the volatile profiles and microbial communities of Wuyi Qu and Gutian Qu,two major types of traditional fermentation starters of Hong Qu glutinous rice wine[J].Food Microbiol,2018,69:105-115.
[4] SHI Y C,PAN T M.Beneficial effects of Monascus purpureus NTU 568-fermented products:A review[J].Appl Microbiol Biotechnol,2011,90:1 207-1 217.
[5] CHEN W,HE Y,ZHOU Y,et al.Edible filamentous fungi from the species Monascus:early traditional fermentations,modern molecular biology,and future genomics[J].Compr Rev Food Sci Food Saf,2015,14:555-567.
[6] ENDO A.Monacolin K,a new hypocholesterolemic agent produced by a Monascus species[J].J Antibiot (Tokyo),1979,32:852-854.
[7] BLANC P J,LAUSSAC J P,LE BARS J,et al.Characterization of monascidin A from Monascus as citrinin[J].Int J Food Microbiol,1995,27:201-213.
[8] 李贞景,薛意斌,刘妍,等.红曲菌中桔霉素的控制策略及研究进展[J].食品科学,2018,39(17):263-268.
[9] GB 1886.181—2016,食品安全国家标准食品添加剂红曲红[S].北京:中国标准出版社,2016.
[10] GB 1886.66—2015,食品安全国家标准食品添加剂红曲黄色素[S].北京:中国标准出版社,2015.
[11] QB/T 2847—2007,功能性红曲米(粉)[S].北京:中国轻工业出版社,2007.
[12] 刘颖,林风,郑军荣,等.低桔霉素且产Monacolin K红曲菌株的筛选与鉴定[J].福建农林大学学报(自然科学版),2015,44(5):456-461.
[13] FENG Y,CHEN W,CHEN F.A Monascus pilosus MS-1 strain with high-yield monacolin K but no citrinin[J].Food Sci Biotechnol,2016,25:1 115-1 122.
[14] 姜冰洁,许赣荣,张薄博,等.降脂红曲产品质量标准的探讨[J].中草药,2015,46(3):453-456.
[15] 李志强,刘颖,林风,等.福建古田红曲生产用红曲霉菌主要种类的鉴别[J].食品与发酵工业,2017,43(5):64-69.
[16] SCHOCH C L,SEIFERT K A,HUHNDORF S,et al.Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for fungi[J].Proc Natl Acad Sci USA,2012,109:6 241-6 246.
[17] TAMURA K,STECHER G,PETERSON D,et al.MEGA 6:Molecular evolutionary genetics analysis version 6.0[J].Mol Biol Evol,2013,30:2 725-2 729.
[18] BARBOSA R N,LEONG S L,VINNERE-PETTERSSON O,et al.Phylogenetic analysis of Monascus and new species from honey,pollen and nests of stingless bees[J].Stud Mycol,2017,86:29-51.
[19] GB 5009.222—2016,食品安全国家标准食品中桔青霉素的测定[S].北京:中国标准出版社,2016.
[20] 李钟庆,郭芳.红曲菌的形态与分类学[M].北京:中国轻工业出版社,2003.
[21] SHAO Y,LEI M,MAO Z,et al.Insights into Monascus biology at the genetic level[J].Appl Microbiol Biotechnol,2014,98:3 911-3 922.
[22] SHAO Y,XU L,CHEN F.Genetic diversity analysis of Monascus strains using SRAP and ISSR markers[J].Mycoscience,2011,52:224-233.
[23] PARK H G,JONG S C.Molecular characterization of Monascus strains based on the D1/D2 regions of LSU rRNAgenes[J].Mycoscience,2003,44:25-32.
[24] PARK H G,ELENA K S,JONG S C.Phylogenetic relationships of Monascus species inferred from the ITS and the partial β-tubulin gene[J].Bot Bull Acad Sin,2004,45:325-330.
[25] SHIMIZU T,KINOSHITA H,ISHIHARA S,et al.Polyketide synthase gene responsible for citrinin biosynthesis in Monascuspurpureus[J].Appl Environ Microb,2005,71:3 453-3 457.
[26] SHIMIZU T,KINOSHITA H,NIHIRA T.Identification and in vivo functional analysis by gene disruption of ctnA,an activator gene involved in citrinin biosynthesis in Monascuspurpureus[J].Appl Environ Microb,2007,73:5 097-5 103.
[27] CHEN Y P,TSENG C P,CHIEN I L,et al.Exploring the distribution of citrinin biosynthesis related genes among Monascusspecies[J].J Agric Food Chem,2008,56:11 767-11 772.