骨质疏松症是以骨量减少和骨的微观结构退化为特征,导致骨的脆性增加以致易于发生骨折的一种全身性骨骼疾病[1]。其严重后果是导致骨折,严重危害中老年人尤其是绝经后妇女的健康[2]。目前治疗骨质疏松的药物一类是抑制骨吸收,另一类是促进骨形成。这些药物均有各自的代谢特点及适用人群,有的药物还伴随一些特殊的不良反应[3]。因此寻找安全有效的具有改善骨质疏松症的物质已经成为重要的研究方向。研究发现,骨质疏松与肠道健康密切相关[4],肠道微生物可通过调节肠道菌群、肠道免疫因子、肠道屏障等进一步影响骨骼免疫状态、改变血清素,皮质醇和性激素的代谢,从而打破骨形成和吸收之间的平衡[5-6]。无菌小鼠与临床实验研究发现肠道菌群对骨代谢具有重要影响[7],利用抗生素、微生态制剂调节肠道菌群后也进一步影响了骨量水平。
大量动物实验结果显示,特定益生菌株如鼠李糖乳杆菌GG(Lactobacillus rhamnosus,LGG)、副干酪乳杆菌、长双歧杆菌等可减少肠道和骨骼的炎症,改善肠道通透性并防止骨质流失[8-10]。同时,混合益生菌制剂如VSL#3等可缓解肠道和骨骼的炎症,促进紧密连接蛋白的表达,降低肠上皮通透性,抑制骨质流失[11]。另外,临床实验表明罗伊氏乳杆菌可以减轻老年女性骨质疏松[12]。膳食补充益生菌可能对骨骼健康有益,具体机制包括:(1)通过调节RANKL,CD4T细胞和促炎性细胞因子来调节破骨细胞的功能和分化,以及通过修饰Wnt10b,IGF-1和OPG的表达来调节成骨细胞[13];(2)通过调节肠道菌群和增加有益菌(如双歧杆菌和乳杆菌)来预防局部肠道炎症和通透性,改善骨骼健康[13];(3)增加代谢产物如短链脂肪酸的水平,部分增强肠道和骨骼中钙的吸收和信号传导[14]。
本课题组前期从发酵蔬菜中分离得到1株益生菌(植物乳杆菌CCFM8610),已证明其具有良好的镉吸附、抗氧化以及耐酸耐胆盐特性;同时能缓解细胞氧化应激、调节细胞的免疫应答、抑制细胞凋亡并保护细胞活性。该菌株还具有保护宿主肠道屏障、减少肠道通透性、缓解肠道氧化损伤、调节肠道免疫系统、促进宿主细胞代谢等功效[15-17]。这些对肠道健康的调节特性都表明该菌株具备缓解骨质疏松的功能潜力。本研究通过双侧卵巢摘除大鼠建立骨质疏松模型,探讨了植物乳杆菌CCFM8610对去卵巢大鼠骨质疏松症的改善作用,为益生菌防治绝经后骨质疏松症提供研究基础。
1 材料与方法
1.1 材料与试剂
MRS培养基,国药集团化学试剂有限公司;大鼠抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase 5, TRACP5)酶联免疫吸附测定试剂盒、大鼠I型胶原交联羧基端肽(cross linked C-telopeptide of type I collagen, CTX-I)酶联免疫吸附测定试剂盒、大鼠胰岛素生长因子(insulin-like growth factor-1,IGF-1)酶联免疫吸附测定试剂盒、大鼠内毒素(endothelin, ET)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白细胞介素6(inter leukin-6,IL-6)酶联免疫吸附测定试剂盒ELISA Kit,南京森贝伽生物科技有限公司。
1.2 灌胃菌株的制备菌株
乳杆菌菌株保存于添加30%(体积分数)甘油的MRS培养基中,保存温度为-80 ℃,菌株在实验使用前,连续活化3次,将菌液8 000×g离心10 min,去上清液,用灭菌生理盐水将菌泥洗涤3次,重悬菌泥于质量浓度为120 g/L的脱脂乳粉溶液中,-80 ℃冰箱保存。使用前将菌悬液用无菌生理盐水稀释至109 CFU/mL备用。
1.3 动物实验设计
本研究采用的是购自上海斯莱克公司的SPF级健康SD雌性大鼠15只,12周龄,体重为(250±20)g。饲养温度为(23±2)℃,相对湿度为(50±10)%,小鼠自由饮食,采用国家标准啮齿类动物饲料饲养。动物实验具体开展时间:2018-04-10—2018-06-10。将雌性SD未交配大鼠适应性喂养1周后,随机分为3组,每组5只。去卵巢组大鼠以3.3 mL/kg体量的10%(体积分数)水合氯醛腹腔注射麻醉后,腹部常规消毒,腹部正中切口打开腹腔,切除双侧卵巢后,分2层缝合切口;假手术组只进行腹部切口,切除卵巢周围部分脂肪组织,不摘除卵巢,其余操作同上。术后连续3 d按2×104 U/100 g体量注射青霉素抗感染。
术后3周将存活者按体重随机分组,15只雌性SD大鼠随机分为3组:空白组、模型组、菌干预组,菌干预组灌胃对应的菌悬液(1×109 CFU/mL)灌胃体积均为1.5 mL/d,空白组和模型组灌胃等量的生理盐水,每天1次,连续灌胃3周。实验期间大鼠自由饮水,摄食标准饲料,每周称量1次大鼠体重。
1.4 大鼠骨相关性指标的测定
1.4.1 大鼠股骨结构性指标的测定
统一将各组大鼠左侧股骨从长径中点锯断,将股骨远心端按要求置于micro CT上,测定其距髁间窝约4 mm附近干骺端的骨密度(bone mineral density, BMD, g/cm3)、骨矿含量(bone mineral content, BMC, g)、骨体积分数(bone volume fraction, BV/TV, %)、骨小梁厚度(trabecular thickness, Tb.Th, mm)以及骨小梁分离度(trabecular separation, Tb.Sp, mm)。
1.4.2 大鼠血清骨代谢指标的测定
将收集到的大鼠血液放置2 h,3 000×g离心15 min后获得血清,参照相应ELISA试剂盒说明书进行实验,根据标准曲线计算血清中IGF-1、TRACP5、CTX-I。大鼠血清中Ca、P、Mg、碱性磷酸酶(alkaline phosphatase,ALP)的含量均利用全自动血清生化分析仪进行测定。
1.4.3 股骨组织病理学观察
取大鼠股骨左侧同一位置的组织,用质量分数为10%的多聚甲醛溶液固定后,经过脱钙、石蜡包埋、切片、苏木精和伊红染色后,在切片扫描仪下切片观察。
1.5 大鼠肠道中紧密蛋白基因表达量和内毒素的测定
参照过往文献报道的方法[18],提取大鼠结肠部位总RNA,反转录合成cDNA,最后对肠道中紧密连接蛋白ZO-1、ZO-2、Occludin、Claudin-1的mRNA表达水平将进行实时定量聚合酶联反应(quantitative real-time polymerase chain reaction,RT-PCR)分析。血清中ET的含量测定采用酶联免疫分析法,按照ELISA试剂盒说明书进行操作。
1.6 大鼠血清炎症因子指标的测定
血清中炎症因子TNF-α、IL-6的表达水平均采用ELISA试剂盒检测。
1.7 统计与分析
数据采用GraphPad Prism 6和SPSS进行统计和分析,采用T检验进行组间两两比较(independent-samples T-test)进行分析,采用单因素方差分析检测多组数据(One-Way, ANOVA),P< 0.05为差异有统计学意义。
2 结果与分析
2.1 植物乳杆菌CCFM8610对大鼠常规生理指标的影响
大鼠在麻醉后1 h时左右开始逐渐苏醒,手术当天精神稍差,活动量少,饮水摄食均较少,术后第1天逐渐恢复,术后第3天正常饮水进食,手术伤口恢复较好,术后24 h后切口无红肿。伤口裂缝,可正常活动。术后72 h后切口无明显感染征象,手术1周后切口完全愈合,缝线脱落。手术后体重显著增加,连续3周给大鼠灌胃植物乳杆菌CCFM8610,干预组大鼠的体重增加幅度趋于正常,与对照组差异不显著。
2.2 植物乳杆菌CCFM8610对大鼠骨结构和代谢指标的影响
由表1可知,手术后,经3周恢复、3周灌胃干预,再次行同一部位骨密度检测。结果显示,模型组大鼠股骨骨密度、骨矿含量、骨体积分数、骨小梁厚度和骨小梁分离度与空白对照组比较,明显降低,表明骨质疏松模型形成。而植物乳杆菌CCFM8610干预后,大鼠骨结构性指标均有显著性升高(P<0.05)。由图1-a~图1-c可知,与空白组比较,模型组的血清IGF-1显著降低,血清CTX-I显著性升高。与模型组比较,干预组的血清TRACP和CTX-I水平明显降低,而CTX-I水平显著升高。由图1-d、图1-e可知,与空白组相比,单纯造模组大鼠S-Ca、S-P、S-Mg浓度都显著性下降(P<0.05);骨形成的指标ALP显著增加(P<0.01),植物乳杆菌CCFM8610干预后,ALP显著下降(P<0.05),而S-P、S-Mg浓度均得到显著恢复。如图1-f观察大鼠股骨切片HE染色图显示,空白组大鼠股骨骨小梁厚度均匀,结构清晰,细胞数量丰满。而模型组老鼠切除卵巢1个月后股骨骨小梁明显稀疏,孔隙率增加,局部有较大的空隙形成,骨细胞减少,骨小梁之间间隔明显宽大,部分骨小梁有断裂,提示模型组大鼠松质骨不仅存在骨量的丢失,还存在结构的破坏,符合骨质疏松症组织形态学的表现。而植物乳杆菌CCFM8610干预后,干预组骨组织形态较模型对照组改善,但与空白组比,仍稀疏,骨小梁面积减少,存在断裂骨小梁。
表1 植物乳杆菌CCFM8610对骨质疏松大鼠股骨结构
指标的影响
Table 1 Effects of L.plantarum CCFM8610 on the
femoral structure indexes in ovariectomized rats
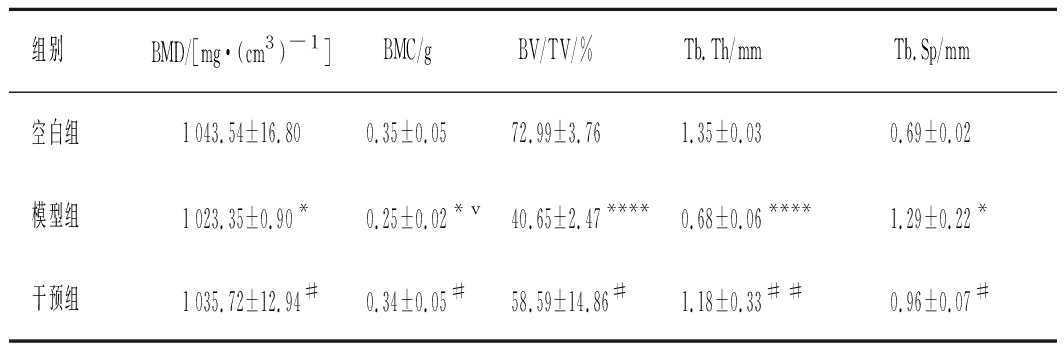
组别BMD/[mg·(cm3)-1]BMC/gBV/TV/%Tb.Th/mmTb.Sp/mm空白组1 043.54±16.800.35±0.0572.99±3.761.35±0.030.69±0.02模型组1 023.35±0.90*0.25±0.02*v40.65±2.47****0.68±0.06****1.29±0.22*干预组1 035.72±12.94#0.34±0.05#58.59±14.86#1.18±0.33##0.96±0.07#
注:*表示与空白组相比差异显著(P<0.05),****表示与空白组相比差异显著(P<0.000 1);#表示与模型组相比差异显著(P<0.05),##表示与模型组相比差异显著(P<0.01)(下同)
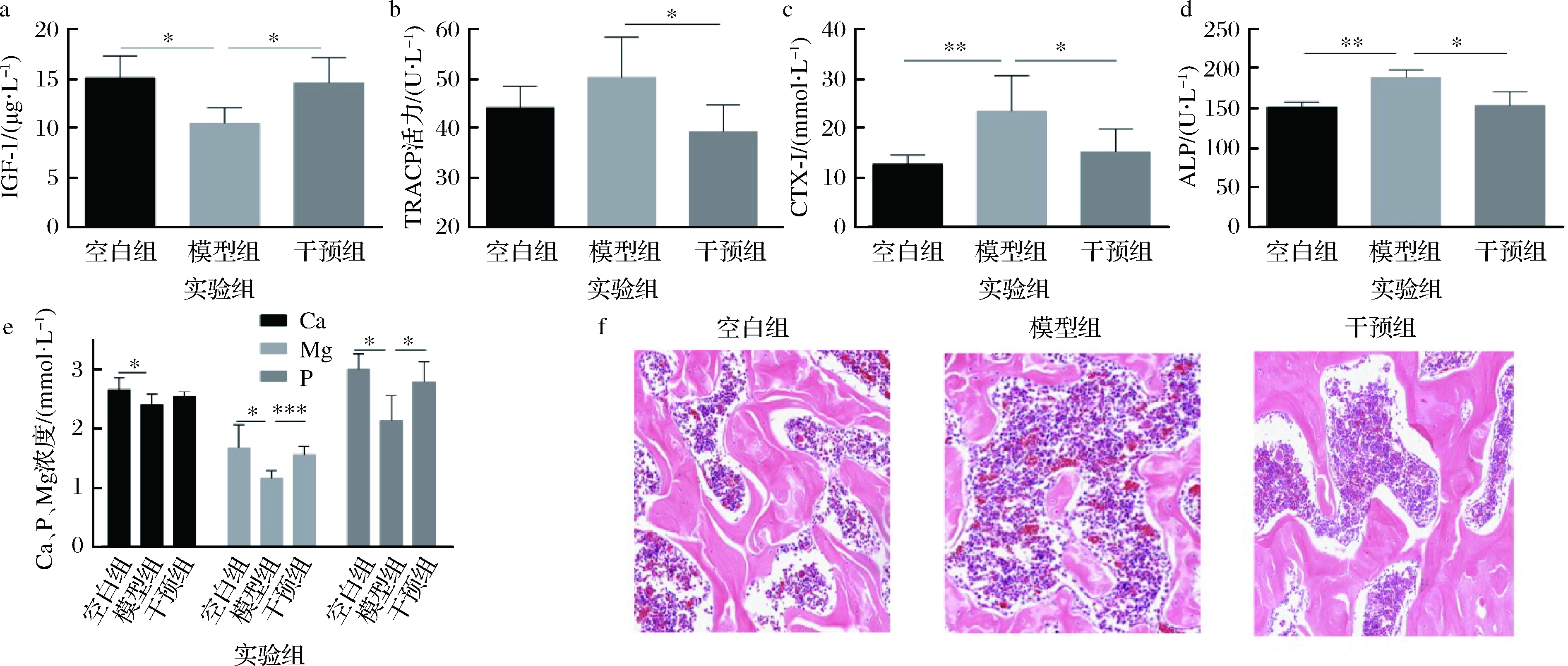
a-大鼠血清中IGF-1变化;b-大鼠血清中TRACP变化;c-大鼠血清中CTX-I变化;d-大鼠血清中ALP变化;e-大鼠血清中Ca、P、Mg变化;
f-大鼠股骨组织切片病理观察 (H&E,×100)
图1 植物乳杆菌CCFM8610对骨质疏松大鼠血清骨代谢指标和骨组织病理损伤的影响
Fig.1 Effects of L.plantarum CCFM8610 on serum bone metabolism index and pathological injury of femoral tissue in ovariectomized rats
注:*表示与模型组相比差异显著(P<0.05),**表示与模型组相比差异显著(P<0.01),***表示与模型组相比差异显著(P<0.001)(下同)
2.3 植物乳杆菌CCFM8610对大鼠肠道屏障的影响
由表2可知,去卵巢手术显著下调了结肠的细胞紧密连接相关蛋白基因相对表达量,导致了大鼠肠道物理屏障破坏,随着肠壁通透性增加,肠腔内有害菌和抗原入侵结肠组织,加剧结肠损伤和炎症反应。而相较于模型对照组,植物乳杆菌CCFM8610组ZO-1、ZO-2、Claudin-1和Occludin相对表达量均发生了上调,其中对Occludin和ZO-1相对表达量的上调程度相较于模型对照组高达2倍,如图2所示,去卵巢后,内毒素显著上升(P<0.05),而植物乳杆菌CCFM8610的摄入,显著降低了内毒素含量。具体来看,模型组的ET是(45.23±4.05) EU/mL,干预组的ET是(36.03±4.22) EU/mL,2组存在显著差异(P<0.01)。
表2 植物乳杆菌CCFM8610对骨质疏松大鼠结肠的
细胞紧密连接蛋白基因相对表达量的影响
Table 2 Effects of L.plantarum CCFM8610 on relative
expression of tight junction protein genes in the
colon of ovariectomized rats
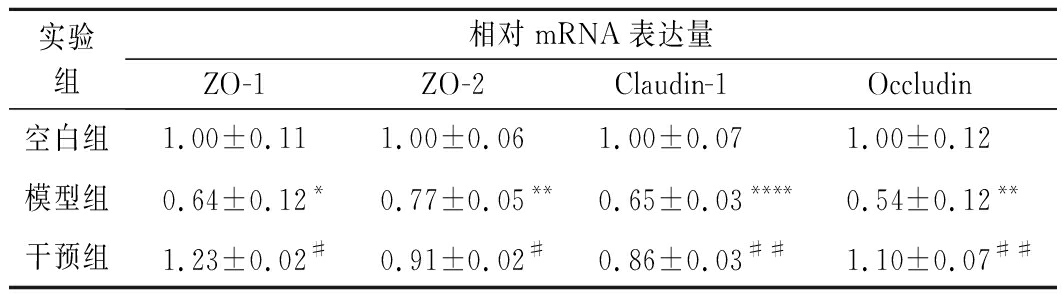
实验组相对mRNA表达量ZO-1ZO-2Claudin-1Occludin空白组1.00±0.111.00±0.061.00±0.071.00±0.12 模型组0.64±0.12*0.77±0.05**0.65±0.03****0.54±0.12**干预组1.23±0.02#0.91±0.02#0.86±0.03##1.10±0.07##
注:**表示与空白组相比差异显著(P<0.01)
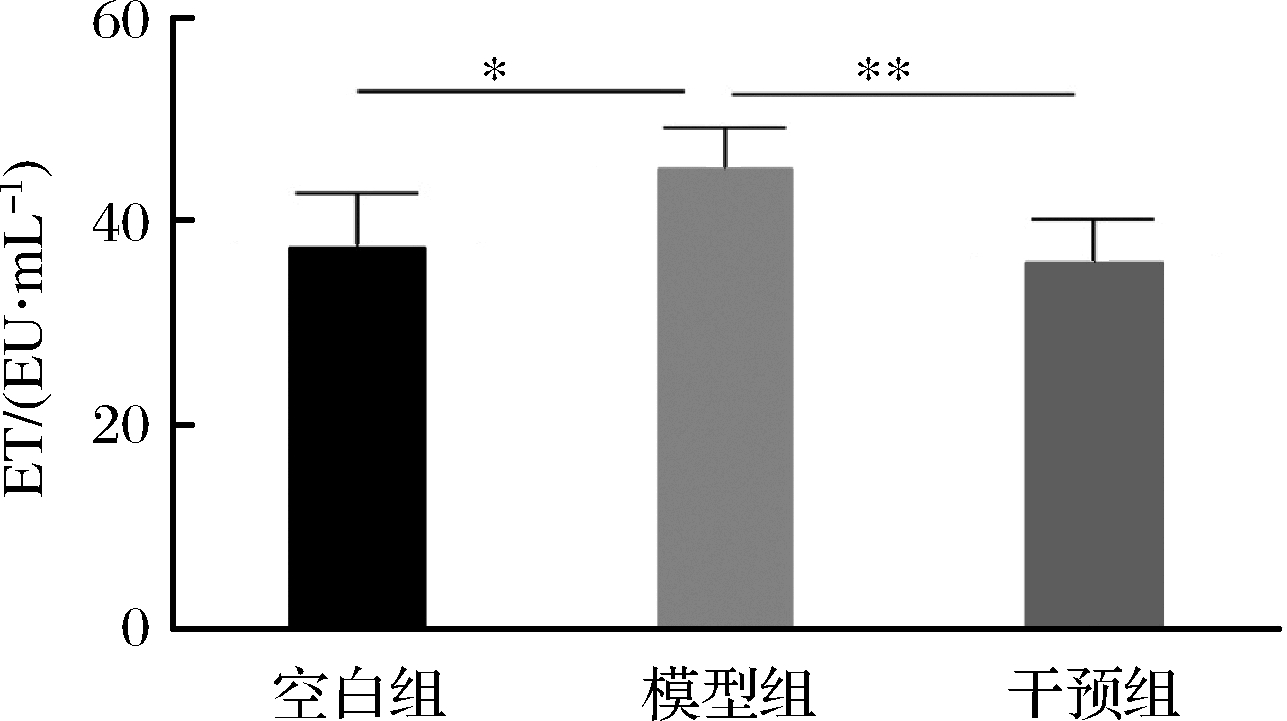
图2 植物乳杆菌CCFM8610对骨质疏松大鼠血清内
毒素变化的影响
Fig.2 Effects of L.plantarum CCFM8610 on
serum ET levels in osteoporotic rats
2.4 植物乳杆菌CCFM8610对大鼠血清炎症因子指标的影响
IL-6和TNF-α两个指标属于炎症促进因子,由表3可知,模型组大鼠血清中IL-6和TNF-α含量显著高于假手术组。经3周连续植物乳杆菌CCFM8610灌胃,两者血清含量得到明显降低。
表3 植物乳杆菌CCFM8610对骨质疏松大鼠血清中
IL-6和TNF-α浓度的影响
Table 3 Effects of L.plantarum CCFM8610 on IL-6 and
TNF-α concentrations in serum of ovariectomized rats

实验组IL-6/(ng·L-1)TNF-α/(ng·L-1)空白组142.62±4.20135.20±1.69模型组165.73±11.96* 154.24±7.04**干预组158.64±3.33##146.03± 1.91###
注:###表示与模型组相比差异显著(P<0.001)
3 讨论
去卵巢大鼠现已成为研究绝经后骨质疏松的经典动物模型[19]。骨重建过程是成骨细胞介导的骨形成作用和破骨细胞介导的骨吸收作用相偶联的动态平衡过程[20]。骨的形成是通过成骨细胞的功能活动来实现的,在成骨细胞生长、分化和成熟的每个阶段都能分泌不同的蛋白或细胞因子,作为其特征性标志物。TRACP是反映骨质破坏状态的常用指标[21]。CTX-I是反映骨吸收的特异性指标之一,在破骨细胞功能活跃,骨吸收速率异常增快的情况下,才会有大量的I型胶原溶解和I型胶原交联羧基末端肽排泄入血,并最终经肾脏排出[22-23]。本实验通过双侧卵巢切除术建立骨质疏松症大鼠模型,从骨密度、骨代谢和血清细胞因子等方面探讨了植物乳杆菌CCFM8610对去卵巢大鼠骨质疏松症的改善作用并对其作用机制进行初步探索。结果发现植物乳杆菌CCFM8610能够显著调节去卵巢大鼠骨代谢水平,增加骨密度并增强其骨吸收,缓解骨破坏性能,能显著改善去卵巢大鼠骨质疏松症。
我们将CCFM8610对去卵巢骨质疏松的缓解归因于以下两方面。一方面,RAEHTZ等[24-25]提出,雌激素缺乏会增加肠道通透性,从而降低屏障完整性。具体而言,雌激素缺乏导致紧密连接蛋白数量的转录水平降低,例如Claudin-2,-3和-15,以及JAM3,它们都被证明可以调节肠屏障的完整性[26-27]。此外,在动物实验中,雌激素缺乏的小鼠血清内毒素水平升高,肠屏障渗透能力受损。这些研究表明,由雌激素缺乏引起的肠道通透性增加导致进入上皮黏膜下层的抗原负荷增加,从而影响免疫细胞的活化和破骨细胞生成细胞因子的局部产生[28]。本研究表明去卵巢手术会导致肠屏障受损,致病菌产生过量内毒素,导致肠道生态失调。而植物乳杆菌CCFM8610可通过改善肠道紧密连接蛋白表达的降低、修复肠上皮屏障受损,同时降低去卵巢引起的内毒素增加,进而阻止肠道内毒素泄露,改变宿主肠道菌群组成、恢复其多样性和稳态来抑制骨吸收。过往研究发现,乳酸菌可通过各种生理调节机制提高宿主肠道的屏障功能。具体机制是:(1)从物理屏障的角度,益生菌可通过保护紧密连接蛋白ZO-1及Occludin,避免细胞骨架F-actin的重排,提高肠黏膜的完整性,并促进肠道上皮细胞的代谢活性[29];(2)从化学屏障的角度,益生菌可促进肠道上皮细胞分泌包括MUC2、MUC3在内的黏蛋白,从而抑制致病或有害微生物对肠黏膜的黏附[30];(3)从免疫屏障的角度,益生菌可提高外周血白细胞及腹膜巨噬细胞的吞噬活性并调节IFN-γ表达,促进肠道的特异及非特异性免疫[31];(4)从微生物屏障的角度,益生菌可通过产生有机酸、细菌素等调控宿主肠道微生态的结构与组成[32];从而保护肠道屏障。
另一方面,炎症因子在骨质疏松症的发病过程中发挥重要作用[33]。TNF-α作为肿瘤坏死因子家族的一员,是重要的破骨细胞激活因子,其可直接刺激破骨细胞前体细胞的增殖分化[34],也可通过抑制破骨细胞凋亡延长破骨细胞的存活时间[35]。IL-6是反映骨丢失的重要信号,由成骨细胞及单核/巨噬细胞合成并分泌,可直接促进破骨细胞的增殖分化,刺激骨吸收[36]。IL-6和IL-6受体在骨质疏松症的发病过程中有重要作用[37],绝经后骨质疏松症患者体内IL-6的mRNA水平明显高于正常绝经妇女[38]。实验结果表明,植物乳杆菌CCFM8610显著降低了骨质疏松症大鼠血清炎症因子活性,提示其能通过降低TNF-α等炎症因子的水平抑制破骨细胞活性。大量研究发现,益生菌的免疫调节活性成分主要是细胞壁、胞外多糖、代谢物;其调节机体的免疫主要是通过抑制核因子-κB以及丝裂原活化蛋白激酶代谢通路;益生菌刺激肠道分泌黏液、增强黏膜的稳定性以及调节吞噬细胞的吞噬能力与分泌细胞因子的能力,提高宿主的非特异性免疫能力[39]。此外,益生菌还能通过Toll样受体信号通路刺激巨噬细胞、树突状细胞等免疫细胞分泌相关细胞因子,介导辅助型T细胞0(T helper cell 0,Th0)分化成Th1、Th2、Th17和Treg细胞,同时刺激宿主体内B淋巴细胞的增殖分化,产生IgA、IgG等免疫球蛋白,调节宿主的特异性免疫能力[40]。
综上,本研究表明植物乳杆菌CCFM8610可通过调节宿主免疫系统及肠道屏障缓解去卵巢大鼠的骨质疏松症,为开发预防骨质疏松的有效膳食干预方案提供了新的思路。
[1] SATTUI S E, SAAG K G. Fracture mortality: Associations with epidemiology and osteoporosis treatment[J].Nature Reviews Endocrinology, 2014, 10(Suppl 8): 592-602.
[2] HERNLUND E, SVEDBOM A, IVERGARD M, et al. Osteoporosis in the European Union: Medical management, epidemiology and economic burden[J].Archives of Oteoporosis, 2013, 8(1-2): 136.
[3] COSMAN F, BEUR S J D, LEBOFF M S, et al. Clinician’s guide to prevention and treatment of osteoporosis[J].Osteoporosis International, 2014, 25(10): 2 359-2 381.
[4] PACIFICI R. Bone remodeling and the microbiome[J].Cold Spring Harbor Perspectives in Medicine, 2017, 8(4): a031 203.
[5] SJOGREN K, ENGDAHL C, HENNING P, et al. The gut microbiota regulates bone mass in mice[J].Journal of Bone and Mineral Research, 2012, 27(6): 1 357-1 367.
[6] ZHANG J, LU Y, WANG Y, et al. The impact of the intestinal microbiome on bone health[J].Intractable & Rare Diseases Research, 2018, 7(3): 148-155.
[7] HUANG Z, CHEN J, LI B, et al. Faecal microbiota transplantation from metabolically compromised human donors accelerates osteoarthritis in mice [J].Annals of the Rheumatic Diseases, 2020, 79(5): 646-656.
[8] TYAGI A M, YU M, DARBY T M, et al. The microbial metabolite butyrate stimulates bone formation via T regulatory cell-mediated regulation of WNT10B expression [J].Immunity, 2018, 49(6): 1-16.
[9] ZHANG J, MOTYL K J, IRWIN R, et al. Loss of bone and Wnt10b expression in male type 1 diabetic mice is blocked by the probiotic Lactobacillus reuteri[J].Endocrinology, 2015, 156(9): 3 169-3 182.
[10] PARVANEH K, EBRAHIMI M, SABRAN M R, et al. Probiotics (Bifidobacterium longum) increase bone mass density and upregulate Sparc and Bmp-2 genes in rats with bone loss resulting from ovariectomy[J/OL].BioMed Research International, 2015. DOI:10.1155/2015/897639.
[11] OHLSSON C, ENGDAHL C, FAK F, et al. Probiotics protect mice from ovariectomy-induced cortical bone loss[J].PLoS One, 2014, 9(3): e92 368.
[12] NILSSON A G, SUNDH D, BACKHED F, et al. Lactobacillus reuteri reduces bone loss in older women with low bone mineral density: A randomized, placebo-controlled, double-blind, clinical trial[J].Journal of Internal Medicine, 2018, 284(3): 307-317.
[13] SCHEPPER J D, IRWIN R, KANG J, et al. Probiotics in gut-bone signaling[J].Advances in Experimental Medicine & Biology, 2017, 1 033(1): 225-247.
[14] MCCABE L, BRITTON R A, PARAMESWARAN N. Prebiotic and probiotic regulation of bone health: Role of the intestine and its microbiome[J].Current Osteoporosis Reports, 2015, 13(6): 363-371.
[15] 翟齐啸. 乳酸菌减除镉危害的作用及机制研究[D]. 无锡: 江南大学, 2015.
[16] ZHAI Q, WANG G, ZHAO J, et al. Protective effects of Lactobacillus plantarum CCFM8610 against acute cadmium toxicity in mice[J].Applied and Environmental Microbiology, 2013, 79(5):1 508-1 515.
[17] ZHAI Q, WANG G, ZHAO J, et al. Protective effects of Lactobacillus plantarum CCFM8610 against chronic cadmium toxicity in mice indicate routes of protection besides intestinal sequestration[J].Applied and Environmental Microbiology, 2014, 80(13): 4 063-4 071.
[18] 王俊通. 产共轭亚油酸乳酸菌对DSS诱导小鼠结肠炎的改善作用[D]. 无锡: 江南大学, 2016.
[19] SAVILLE P D. Changes in skeletal mass and fragility with castration in the rat: A model of osteoporosis[J].Journal of the American Geriatrics Society, 1969, 17(2): 155-166.
[20] BARON R, HESSE E. Update on bone anabolics in osteoporosis treatment: Rationale, current status, and perspectives[J].Journal of Clinical Endocrinology & Metabolism, 2012, 97(2): 311-325.
[21] FAHMY S R, SOLIMAN A M, SAYED A A, et al. Possible antiosteoporotic mechanism of Cicer arietinum extract in ovariectomized rats[J].International Journal of Clinical & Experimental Pathology, 2015, 8(4): 3 477-3 490.
[22] ZHANG M, LI Y, MA Q, et al. Relevance of parathyroid hormone (PTH), vitamin 25 (OH) D3, calcitonin (CT), bone metabolic markers, and bone mass density (BMD) in 860 female cases[J].Clinical & Experimental Obstetrics & Gynecology, 2015, 42(2): 129-132.
[23] SANCHEZ A, BRUN L R, SALERNI H, et al. Effect of denosumab on bone mineral density and markers of bone turnover among postmenopausal women with osteoporosis[J].Journal of Osteoporosis, 2016, 2016: 1-6.
[24] RAEHTZ S, FEDORKO A, MCCABE L. Estrogen deficiency induced intestinal inflammation and permeability is linked with osteoporosis (488.8)[J].Faseb Journal, 2014(4):28.
[25] LI J Y, CHASSAING B, TYAGI A M, et al. Sex steroid deficiency-associated bone loss is microbiota dependent and prevented by probiotics[J].Journal of Clinical Investigation, 2016, 126(6): 2 049-2 063.
[26] ZEISSIG S, BURGEL N, GUNZEL D, et al. Changes in expression and distribution of claudin 2, 5 and 8 lead to discontinuous tight junctions and barrier dysfunction in active Crohn”s disease[J].Gut, 2007, 56(1): 61-72.
[27] ULLUWISHEWA D, ANDERSON R C, MCNABB W C, et al. Regulation of tight junction permeability by intestinal bacteria and dietary components[J].Journal of Nutrition, 2011, 141(5): 769-776.
[28] WADAHIRAIKE O, IMAMOV O, HIRAIKE H, et al. Role of estrogen receptor β in colonic epithelium[J].Proc Nati Acade ![]() 2006, 103(8): 2 959-2 964.
2006, 103(8): 2 959-2 964.
[29] NISSEN L, CHINGWARU W, SGORBATI B, et al. Gut health promoting activity of new putative probiotic/protective Lactobacillus spp. strains: A functional study in the small intestinal cell model[J].International Journal of Food Microbiology, 2009, 135(3): 288-294.
[30] LIU F, LI G, WEN K, et al. Porcine small intestinal epithelial cell line (IPEC-J2) of rotavirus infection as a new model for the study of innate immune responses to rotaviruses and probiotics [J].Viral Immunology, 2010, 23(2): 135-149.
[31] GILL H S, RUTHERFURD K J, PRASAD J, et al. Enhancement of natural and acquired immunity by Lactobacillus rhamnosus (HN001), Lactobacillus acidophilus (HN017) and Bifidobacterium lactis (HN019)[J].British Journal of Nutrition, 2000, 83(2): 167-176.
[32] GAREAU M G, SHERMAN P M, WALKER W A. Probiotics and the gut microbiota in intestinal health and disease [J].Nature Reviews Gastroenterology and Hepatology, 2010, 7(9): 503-514.
[33] POLAT B, HALICI Z, CADIRCI E, et al. The effect of alpha-lipoic acid in ovariectomy and inflammation-mediated osteoporosis on the skeletal status of rat bone[J].European Journal of Pharmacology, 2013, 718(1-3): 469-474.
[34] JULES J, FENG X. In vitro investigation of the roles of the proinflammatory cytokines tumor necrosis factor-α and interleukin-1 in murine osteoclastogenesis[J].Methods in Molecular Biology, 2014, 1 155: 109-123.
[35] 钱兴皋, 刘宇恒, 王琴, 等. 炎症因子对骨质疏松症发病影响的研究进展[J].中国康复理论与实践, 2013,19(7): 51-52.
[36] 杨明园, 李超, 李明. 细胞因子与绝经后骨质疏松症关系的研究进展[J].中国骨质疏松杂志, 2014(6): 698-705.
[37] MIHARA M, HASHIZUME M, YOSHIDA H, et al. IL-6/IL-6 receptor system and its role in physiological and pathological conditions[J].Clinical Science, 2012, 122(4): 143-159.
[38] CZEMY B, KAMINSKI A, KURZAWSKI M, et al. The association of IL-1β, IL-2, and IL-6 gene polymorphisms with bone mineral density and osteoporosis in postmenopausal women[J].European Journal of Obstetrics & Gynecology and Reproductive Biology, 2010, 149(1): 82-85.
[39] 任大勇. 益生乳酸杆菌的黏附及免疫调节作用研究[D]. 长春: 吉林大学, 2013.
[40] KO J S,YANG H R,CHANG J Y, et al. Lactobacillus plantarum inhibits epithelial barrier dysfunction and interleukin-8 secretion induced by tumor necrosis factor-α[J].World Journal of Gastroenterology, 2007, 13(13): 1 962-1 965.