Effects of exogenous ethylene on the cracking and cell wall metabolism of sweet potato
ABSTRACT Sweet potato is easy to sprout under high temperature environment, it has been found that exogenous ethylene treatment could effectively inhibit the sweet potato germination. But sweet potato would crack under high concentration of ethylene which reduces its commercial value. In this paper, sweet potatoes were treated with exogenous ethylene at the concentrations of 0,0.5,1 and 2 g/L. And based on the result, it analyzed the changes of germination rate, root cracking rate, raw pectin content, soluble pectin content, polygalacturonase (PG), cellulase (Cx), β-gluosidase (β-Glu), polyphenol oxidase (PPO), peroxidase (POD) of sweet potato and explored. The effects of different concentrations of exogenous ethylene on cracking and cell wall metabolism of sweet potato were analyzed. The results indicated that all ethylene treatment groups could inhibit the germination of sweet potato, and the higher ethylene concentration, the better the germination effect. However, the high concentration of 2 g/L ethylene caused the sweet potato to crack while the other groups had no cracking phenomenon. As the ethylene concentration increased, the activities of PPO and POD would increase, which led to hardening of cell wall and reduced extensibility. In addition, 0.5 g/L and 1 g/L ethylene could delay the increase of PG, Cx activities and the original pectin content in the middle and late stages. And 2 g/L exogenous ethylene treatment significantly increased the activities of sweet potato cell wall hydrolase (PG, Cx and β-glucosidase), and also promoted the decline of sweet potato pectin content and water-soluble pectin content, which eventually led to the increase of cracking.
Key words sweet potato;exogenous ethylene;fruit cracking;cell wall metabolism
新鲜甘薯口味甜美,富含淀粉、维生素和糖类等营养物质,具有抗癌活血,止血消炎,舒肠通便等功效[1]。然而甘薯在16~35 ℃的贮运环境下极易发芽[2],严重影响其商品价值。目前国内外关于甘薯的抑芽技术有辐照处理[3]、热处理[4]、植物提取物处理[5]等。但由于技术及成本问题限制,这些技术均不适用于我国甘薯贮运抑芽。
乙烯是迄今发现五大类植物激素之一,与器官休眠和植物成熟衰老等生理现象密切相关,GEBHARO等[6]研究了乙烯在洋葱休眠和发芽期间的作用,发现用5~10 μL/L外源乙烯连续处理洋葱18周,发芽率从100%降低至7.5%。同时,本实验室前期研究发现,外源乙烯能抑制甘薯发芽且效果显著,是一项操作方便、成本低廉的有效抑芽技术。但过高浓度乙烯处理会导致甘薯块茎开裂,使其失去商品价值。如能明确开裂机理,避免开裂的出现,乙烯抑芽技术就值得推广应用。然而目前乙烯甘薯抑芽技术研究匮乏,乙烯引起甘薯块茎开裂的机制更是缺乏文献基础。有研究表明,裂果现象本质为果皮和果肉组织生长速度不一而表现为果皮表面开裂现象[7],脐橙[8]、明枣[9]、荔枝[10]、苹果[11]、鳄梨[12]等果蔬的裂果现象与细胞壁组分及酶活性存在密切关系。本试验采用不同质量浓度的外源乙烯对甘薯进行处理,研究甘薯块茎开裂及细胞壁代谢情况,探寻裂果机理,为甘薯实际储运抑芽保鲜提供科学依据。
1 材料与方法
1.1 材料与试剂
“红心王”甘薯,购于重庆市北碚区天生农贸市场,该批甘薯需当日采摘,要求同一批次、大小均匀、机械伤少、无发芽、无病虫害,3 h内到达实验室,用清水洗净后晾干备用。
标准邮政6号纸箱,260 mm×150 mm×180 mm(内尺寸),3层B瓦楞,山东冠县万林纸制品有限公司;乙烯利,山东营养源食品科技有限公司;多聚半乳糖醛酸、水杨苷,上海源叶生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
UV-2450PC型紫外可见分光光度计,日本岛津公司;HH-2型数显恒温水浴锅,常州奥华仪器有限公司;FA2004型电子天平,上海恒平科学仪器有限公司;H1650R型台式高速冷冻离心机,湖南湘仪公司;RXZ-8000型智能人工气候箱,宁波东南仪器有限公司;KQ3200DB型超声波清洗器,昆山市超声仪器有限公司。
1.3 实验方法
1.3.1 样品准备
将晾干后的甘薯随机分为4组,每组1.5 kg并与一定量的乙烯利一起密封。实验中质量浓度设置根据乙烯利质量与箱内空气体积比分别为:0(对照组)、0.5、1、2 g/L。随后将封箱后的甘薯放置人工气候箱贮藏12 d,设置气候箱参数为温度(25±1)℃、温度(90±5)%来模拟常温物流环境。
取样:每2 d随机从3箱中取样,如图1所示,先将甘薯切成2 cm厚的圆柱体,再用小刀在距甘薯表皮1.0~1.5 mm处沿甘薯外周切开,图1脱离部位为甘薯周皮和次生韧皮部结合物,取样时脱去周皮部分仅取次生韧皮部浅黄色果肉,用于实验各项指标的测定。

图1 分离甘薯周皮和次生韧皮部
Fig.1 Separate the pericarp and secondary phloem of
sweet potato
1.3.2 发芽率的测定
以果皮出现肉眼可见的芽点视为发芽[13],参考PANKOMERA[14]的方法,观察并记录每个甘薯的发芽数,发芽级数记录为:1级=0芽;2级=1~3芽;3级=4~6芽;4级=7~9芽;5级=10芽及以上。按照公式(1)和公式(2)分别计算甘薯的发芽指数和发芽率:
发芽指数![]()
(1)
发芽率![]()
(2)
式中:i,发芽级数;K,甘薯总个数。
1.3.3 块根开裂率的测定
以果皮出现肉眼可见的裂纹视为块根开裂。按照公式(3)计算甘薯的块根开裂率:
裂果率![]()
(3)
1.3.4 原果胶含量的测定
参考曹建康等[15]的方法,测定甘薯的原果胶含量,单位以%表示。
1.3.5 水溶性果胶含量的测定
参考曹建康等[15]的方法,测定甘薯的水溶性果胶含量,单位以%表示。
1.3.6 多聚半乳糖醛酸酶(polygalacturonase,PG)活性的测定
参考曹建康等[15]的比色法,测定甘薯的PG活性,酶活性单位以mg/(h·g)表示。
1.3.7 纤维素酶(cellulase,Cx)活性的测定
参考曹建康等[15]的比色法,测定甘薯的Cx活性,酶活性单位以mg/(h·g)表示。
1.3.8 β-葡萄糖苷酶(β-glucosidase,β-Glu)活性的测定
参考曹建康等[15]的比色法,测定甘薯的β-Glu活性,酶活性单位以mg/(h·g)表示。
1.3.9 多酚氧化酶(polyphenol oxidase,PPO)活性的测定
参考ZHOU等[16]的方法,测量甘薯的PPO活性,酶活性单位以ΔOD420/(min·g)表示。
1.3.10 过氧化物酶(peroxidase,POD)活性的测定
参照MAEHLY等[17]的方法,测定甘薯的POD活性,酶活性单位以ΔOD470/(min·g)表示。
1.4 数据分析
使用Microsoft Excel 2007对各指标进行数据计算;采用Origin 2017对数据进行图像处理;用SPSS 25.0对各项指标进行显著性分析。
2 结果与分析
2.1 外源乙烯处理对甘薯发芽率和块根开裂率的影响
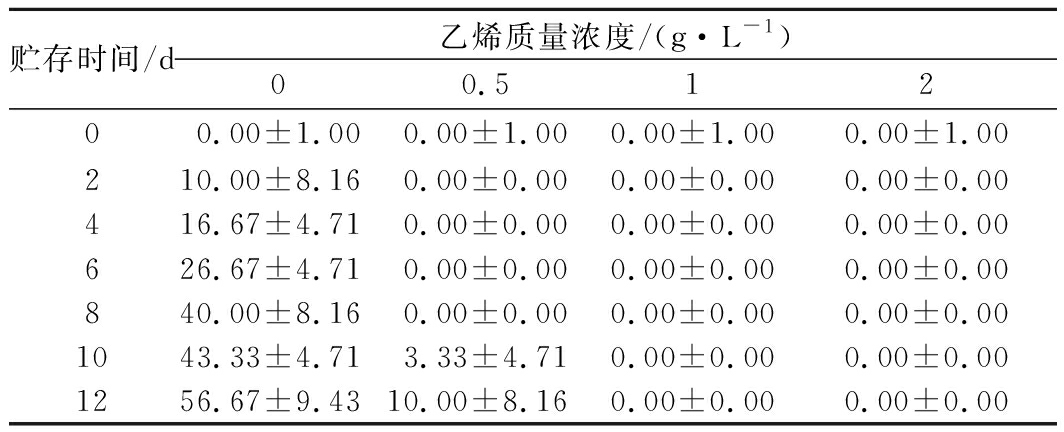
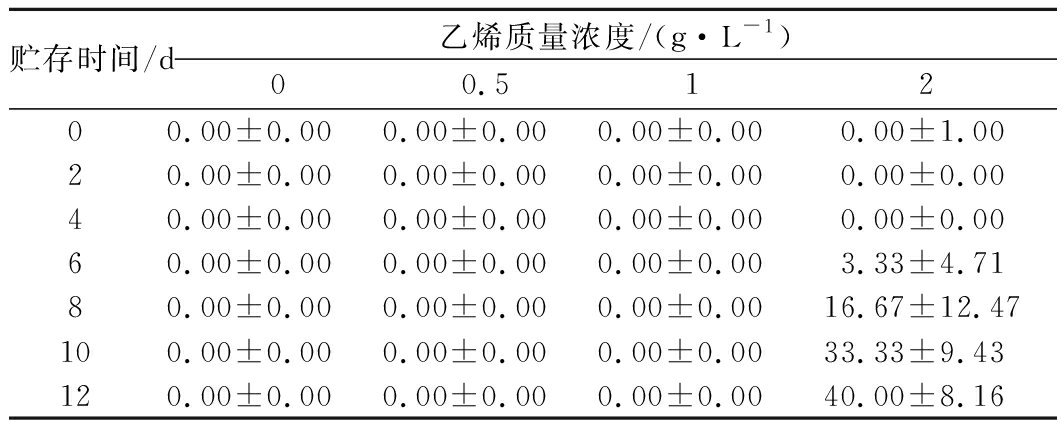
外源乙烯处理对甘薯发芽率的影响如表1所示,对照组在2 d时发生发芽现象,0.5 g/L乙烯组在10 d时发生发芽现象,1、 2 g/L乙烯组到实验末期也均未发芽,对照组12 d时发芽率分别为(56.67±9.43)%,与其他3组差异极显著(P<0.01),0.5 g/L乙烯组在12 d时发芽率为(10±8.16)%。表2显示了各组在贮存时期的裂果率,2 g/L乙烯处理组在6 d时观察到裂果现象,到12 d时裂果率高达(40±8.16)%。但对照组、0.5 g/L乙烯组、1 g/L乙烯组甘薯均未观察到裂果现象。综上可知,乙烯处理能明显延缓甘薯发芽,且浓度越高作用越明显。其中0.5 g/L外源乙烯处理能将甘薯发芽时间延迟8 d,1 g/L和2 g/L乙烯处理能将甘薯初始发芽时间至少延迟10 d,但外源乙烯质量浓度过高会使甘薯发生裂果现象,从而降低其商品性。
表1 外源乙烯处理对甘薯发芽率的影响 单位:%
Table 1 The effect of exogenous ethylene treatment on
germination rate of sweet potato
贮存时间/d乙烯质量浓度/(g·L-1)00.51200.00±1.000.00±1.000.00±1.000.00±1.00210.00±8.160.00±0.000.00±0.000.00±0.00416.67±4.710.00±0.000.00±0.000.00±0.00626.67±4.710.00±0.000.00±0.000.00±0.00840.00±8.160.00±0.000.00±0.000.00±0.001043.33±4.713.33±4.710.00±0.000.00±0.001256.67±9.4310.00±8.160.00±0.000.00±0.00
表2 外源乙烯处理对甘薯块根开裂率的影响 单位:%
Table 1 The effect of exogenous ethylene treatment on
fruit cracking rate of sweet potato
贮存时间/d乙烯质量浓度/(g·L-1)00.51200.00±0.000.00±0.000.00±0.000.00±1.0020.00±0.000.00±0.000.00±0.000.00±0.0040.00±0.000.00±0.000.00±0.000.00±0.0060.00±0.000.00±0.000.00±0.003.33±4.7180.00±0.000.00±0.000.00±0.0016.67±12.47100.00±0.000.00±0.000.00±0.0033.33±9.43120.00±0.000.00±0.000.00±0.0040.00±8.16
2.2 外源乙烯处理对甘薯原果胶含量的影响
果胶物质是一种多糖类高分子化合物,以部分甲酯化的形态存在于果实细胞初生壁中[18],通常在未成熟的果实中以原果胶状态存在,原果胶不溶于水,黏性强,可以使果实饱满挺立。如图2所示,各组甘薯果胶含量随贮存时间延长均呈现不同程度的下降,这是因为随甘薯成熟,原果胶在果胶酶作用下分解为可溶性果胶,与纤维素分离,进入细胞液中,使细胞松散,果实软烂。0~4 d,对照组原果胶含量下降最慢,而2 g/L乙烯组原果胶含量下降16.84%,与其余3组差异极显著(P<0.01),可能因为高乙烯质量浓度促进甘薯果实成熟,从而加剧原果胶的分解。4~12 d,对照组下降速度增快,12 d时原果胶含量显著低于0.5、1 g/L乙烯组(P<0.05),这是由于2 d后对照组已开始发芽,芽原基组织加速原果胶的降解。乙烯处理组中2 g/L乙烯组原果胶含量下降速度最快,与其余组差异极显著(P<0.01),其次是1 g/L乙烯组,但与0.5 g/L乙烯组差异不显著(P>0.05),说明外源乙烯处理会加速甘薯原果胶含量的下降,且外源乙烯质量浓度越高,甘薯原果胶含量下降速度越快。综上,外源乙烯会加速果胶分解,但由于有效抑制发芽,使得0.5 g/L乙烯组和1 g/L乙烯组与对照组相比能在贮藏中后期抑制甘薯原果胶含量的下降,而2 g/L乙烯组始终加快了果实原果胶的分解速度。
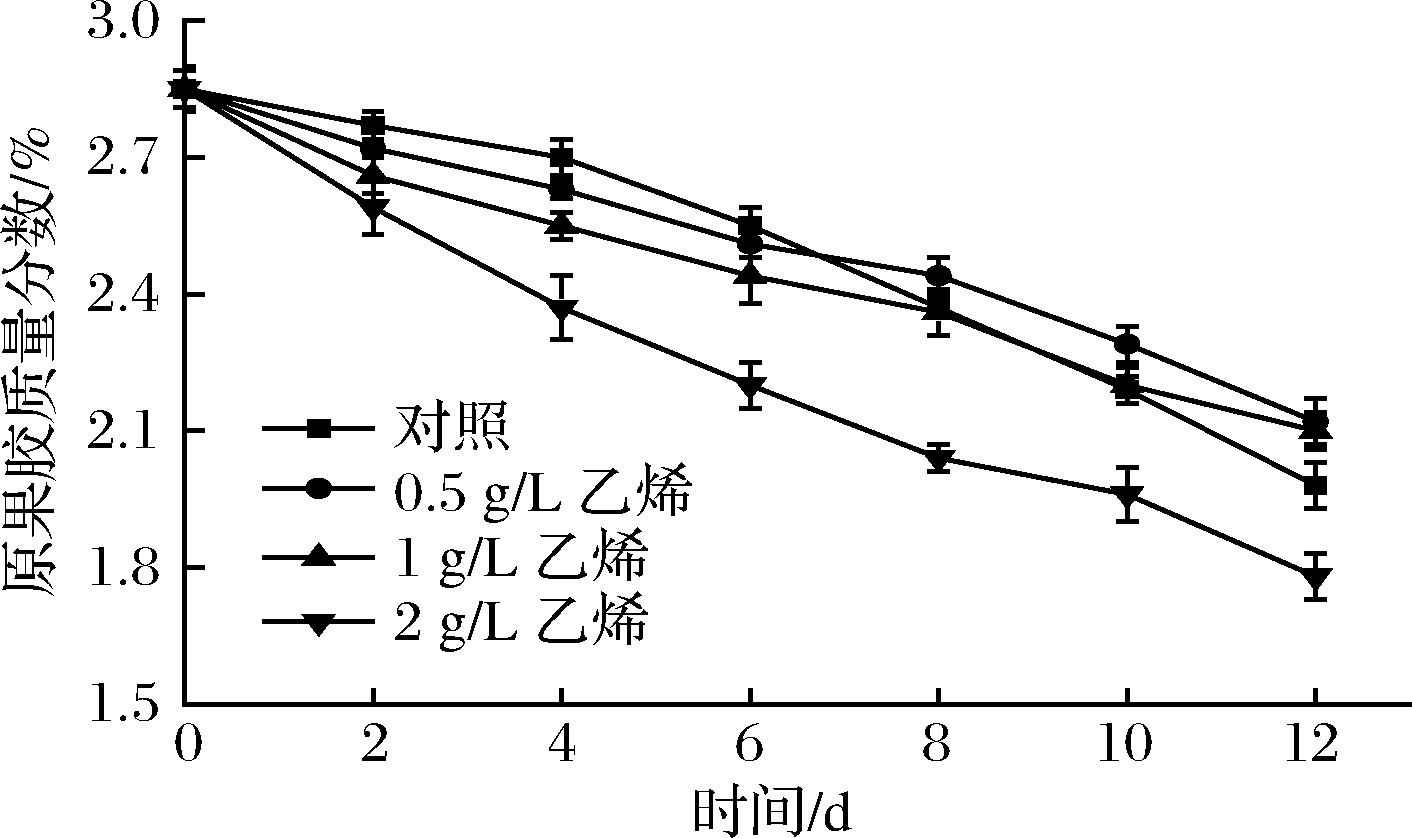
图2 外源乙烯处理对甘薯原果胶含量的影响
Fig.2 The effect of exogenous ethylene treatment on
raw pectin content of sweet potato
2.3 外源乙烯处理对甘薯水溶性果胶含量的影响
由图3可知,贮存过程中各组甘薯水溶性果胶含量随时间延长不断上升,这是因为原果胶被水解后从细胞壁流出,导致细胞中可溶性果胶含量增加,果皮强度下降[19]。0~4 d,对照组水溶性果胶含量上升最慢,与1、 2 g/L乙烯组差异显著(P<0.05),与0.5 g/L乙烯组差异不大(P>0.05)。4 d后CK组上升速度加快,12 d时水溶性果胶含量显著高于0.5、1 g/L乙烯组(P<0.05)。2 g/L乙烯组可溶性果胶含量上升速度最快,与其余组差异极显著(P<0.01),其次是1 g/L乙烯组。综上,外源乙烯处理均会加速果实水溶性果胶的累积,乙烯质量浓度越高,可溶性果胶含量变化速率越快,但由于外源乙烯同时具有抑芽效果,从而减少了由甘薯发芽导致的可溶性果胶含量的上升,与对照组比较,0.5 g/L乙烯组和1 g/L乙烯组均能在贮藏中后期有效抑制甘薯水溶性果胶含量的上升,而2 g/L乙烯组储运全程加速了水溶性果胶的累积。

图3 外源乙烯处理对甘薯可溶性果胶含量的影响
Fig.3 The effect of exogenous ethylene treatment on
soluble pectin content of sweet potato
2.4 外源乙烯处理对甘薯PG活性的影响
PG是一种在细胞壁结构改变中起到重要作用的酶,它主要将果实中多聚半乳糖醛酸降解为半乳糖醛酸,导致细胞壁结构解体,降低果皮的延展性,从而导致块根开裂的发生[20]。各组甘薯在贮藏期间的PG活性如图4所示,随着时间延长,各组甘薯PG活性均逐渐上升。其中2 g/L乙烯组PG活性全程上升速度最快,与其他3组差异极显著(P<0.01)。实验末期,2 g/L乙烯组较对照组PG活性提升了21.63%,这是因为乙烯能够调控PG基因表达,通过诱导PGmRNA的积累从而增加PG的活性[21]。0~4 d,对照组PG活性上升最慢,与2 g/L乙烯组差异显著(P<0.05),4 d后对照组上升速度加快,10 d后显著高于0.5、1 g/L乙烯组(P<0.05),12 d时,0.5、1 g/L乙烯组较对照组PG活性分别降低了22.01%、9.57%,这是因为对照组甘薯发芽最多,诱导PG活性上升速度加快。综上可知,2 g/L外源乙烯处理会明显加速甘薯PG活性的升高,而0.5、1 g/L外源乙烯处理可在后期延缓块根PG活性升高。
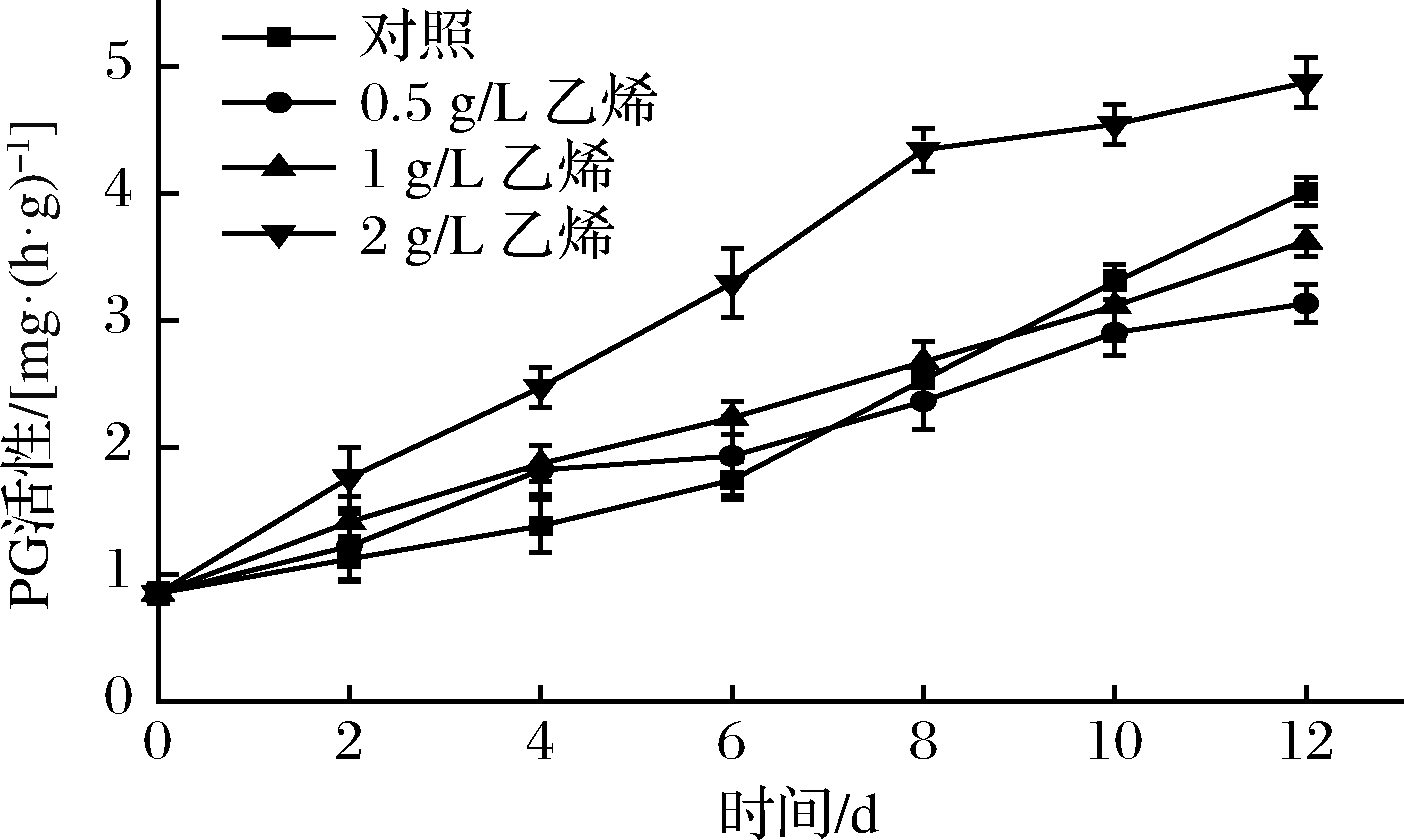
图4 外源乙烯处理对甘薯PG活性的影响
Fig.4 The effect of exogenous ethylene treatment on
PG activity of sweet potato
2.5 外源乙烯处理对Cx活性的影响
纤维素酶能够水解纤维素释放可溶性糖[22],降低果皮机械强度,增加果实开裂概率。如图5所示,各组甘薯随时间延长,Cx活性呈上升趋势,其中2 g/L乙烯组上升速度最快,12 d时比对照组Cx活性提高10.43%,这是因为乙烯可以促进纤维素酶的生成,且质量浓度越高,促进效果越明显[23]。对照组由于甘薯发芽作用,使该组Cx活性在0~4 d上升较慢,4 d后上升速度加快。12 d时,0.5、1 g/L乙烯组较对照组Cx活性分别降低了31.06%、20.71%。说明2 g/L外源乙烯处理会明显增大甘薯Cx活性,而0.5、1 g/L外源乙烯处理可在后期延缓甘薯Cx活性升高。
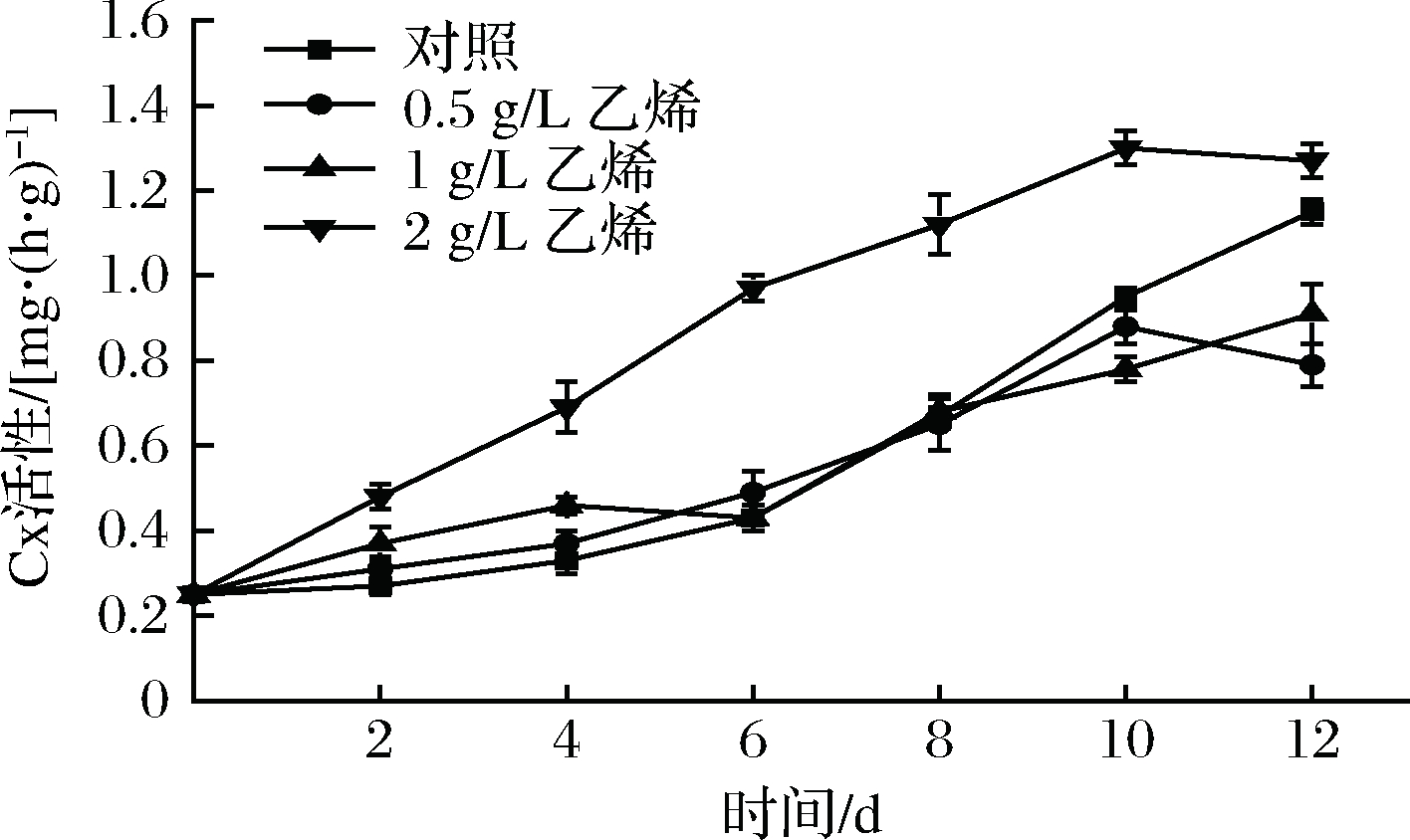
图5 外源乙烯处理对甘薯Cx活性的影响
Fig.5 The effect of exogenous ethylene treatment on
Cx activity of sweet potato
2.6 外源乙烯处理对甘薯β-Glu活性的影响
β-葡萄糖苷酶是一种能够水解结合于末端的非还原性β-D-葡萄糖苷键,在纤维素降解中起非常重要的作用[24]。如图6所示,各组甘薯β-Glu活性随时间延长逐渐上升,其中2 g/L乙烯组上升速度最快,12 d时较对照组β-Glu活性提高了22.83%。整个贮藏期间,对照组β-Glu活性与0.5、1 g/L乙烯组差异不显著(P>0.05),0.5 g/L乙烯组和1 g/L乙烯组间也无显著差异(P>0.05)。说明在常温储运条件下,2 g/L外源乙烯处理明显诱导了甘薯内β-Glu活性增强,而0.5、1 g/L乙烯组β-Glu活性与对照组差异不大。
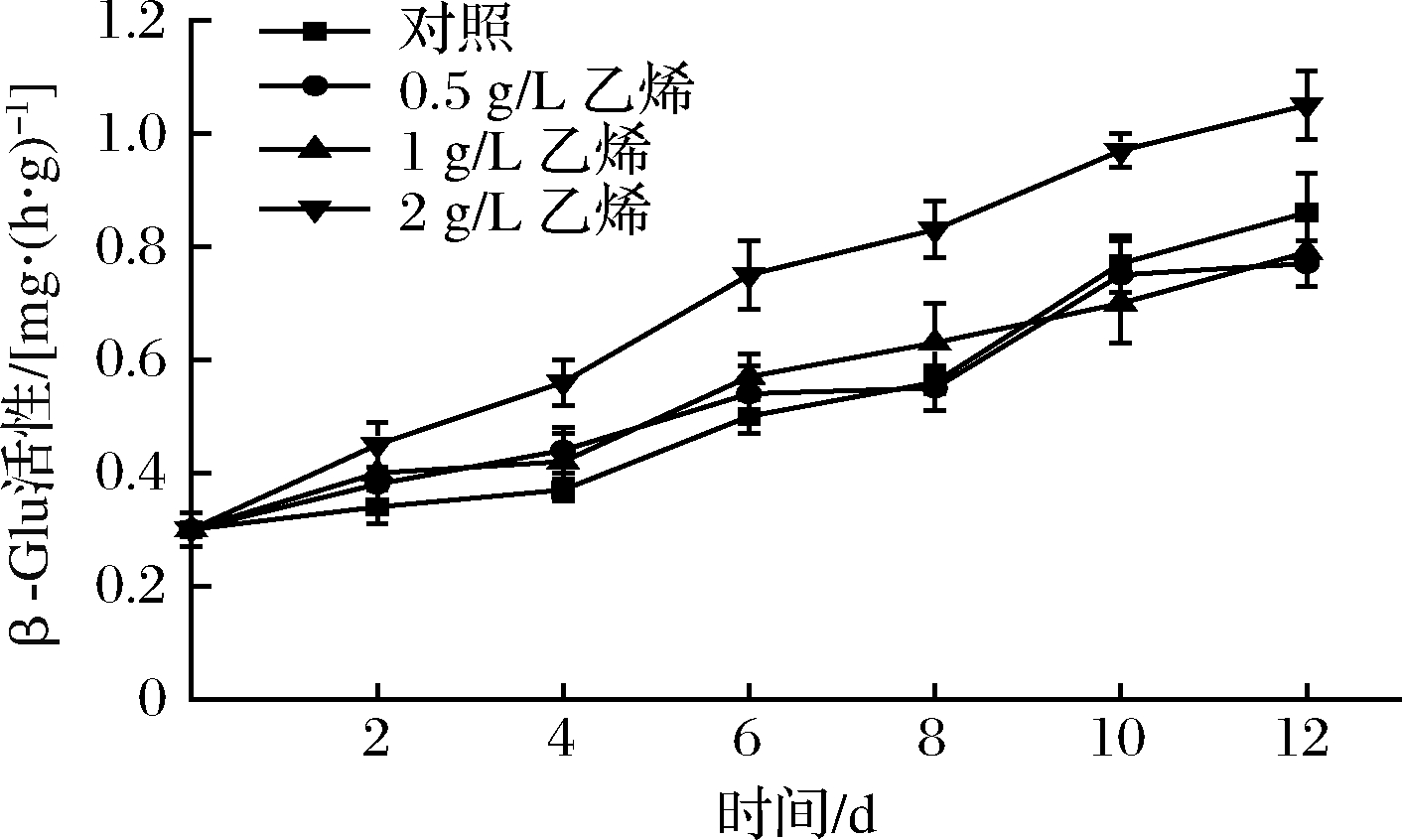
图6 外源乙烯处理对甘薯β-Glu活性的影响
Fig.6 The effect of exogenous ethylene treatment on β-Glu
activity of sweet potato
2.7 外源乙烯处理对甘薯PPO活性的影响
PPO是参与代谢的关键氧化酶,参与合成木质素及细胞壁成分间酚基交联键的形成,导致细胞壁硬化及延展性的降低[25],也可催化酚类物质生成醌类化合物[26]。如图7所示,乙烯处理组PPO活性均高于对照组,这是因为果皮中PPO对乙烯较敏感,乙烯可以促进PPO活性的增大。整个贮存过程中,2 g/L乙烯组PPO活性上升速度最快,与其余组相比差异极显著(P<0.01),12 d时与对照组相比,2 g/L乙烯组PPO活性提升了96.73%、0.5 g/L乙烯组PPO活性提升了41.76%、1 g/L乙烯组提升了52.61%。说明外源乙烯处理会明显诱导甘薯内PPO活性增强,且乙烯质量浓度越高,PPO活性提高程度越大。这与姜爱丽等[27]的研究结果一致。

图7 外源乙烯处理对甘薯PPO活性的影响
Fig.7 The effect of exogenous ethylene treatment on
PPO activity of sweet potato
2.8 外源乙烯处理对甘薯POD活性的影响
POD是一种普遍存于果蔬体内的氧化还原酶,参与细胞壁多聚化木质素前体的生物合成,能促进木栓化和木质化[28-29]。如图8所示,0~12 d各组甘薯POD活性均有所上升,这是因为POD是果蔬在逆境下防御系统的重要组成酶[30],贮藏环境引起块根防御系统,使得POD活性增加。其中,2 g/L乙烯组POD活性上升速度高于其余3组,差异显著(P<0.05),12 d时2 g/L乙烯组POD活性较对照组提高了78.37%,这可能因为乙烯质量浓度过高对甘薯果实造成伤害胁迫,使得细胞壁受到破损,增加了游离态POD[31]。综上可知,外源乙烯处理会明显提升甘薯POD活性,且外源乙烯质量浓度越高,甘薯POD活性提升程度越大。

图8 外源乙烯处理对甘薯POD活性的影响
Fig.8 The effect of exogenous ethylene treatment on
POD activity of sweet potato
3 结论
研究结果表明,不同质量浓度外源乙烯处理甘薯均有抑芽效果,且外源乙烯质量浓度越高,抑芽效果越好,但质量浓度过高会导致甘薯块根开裂,本实验中2 g/L乙烯处理组会导致甘薯块根开裂,其余组均无块根开裂现象,这是因为随乙烯质量浓度增大,甘薯果皮中PPO、POD酶活性逐渐上升,使细胞壁硬化程度及延展性加速下降;低质量浓度乙烯(0.5、1 g/L)处理甘薯可使贮藏中后期块根PG、Cx活性提高并抑制甘薯原果胶降解速度;2 g/L外源乙烯处理会明显增大甘薯细胞壁水解酶(PG、Cx和β-Glu)活性,促使甘薯原果胶含量下降、水溶性果胶含量上升,块根开裂易发性增加。
[1] 张碧莹,唐玲,张静,等.不同加工方式对甘薯汁品质及抗氧化活性的影响[J].食品与发酵工业,2017,43(12):157-163.
[2] 陈慧芳.甘薯发芽特点及苗床管理[J].陕西农业科学,2010,56(6):104-106.
[3] 王鹏,刘录详,纪瑞瑞,等.60Co-γ射线辐照对甘薯农艺性状变异的影响[J].植物生理学报,2015,51(7):1 167-1 172.
[4] HU W, TANAKA S I. Effects of heat treatment on the quality and storage life of sweet potato[J]. Journal of the Science of Food & Agriculture, 2010, 87(2): 313-319.
[5] BLAUWER V D, DEMEULEMEESTER K, DEMEYERE A, et al. Maleic hydrazide: Sprout suppression of potatoes in the field[J]. Communications in agricultural and applied biological sciences, 2012, 77(3):343-351.
[6] GEBHARD B. Exogenous ethylene inhibits sprout growth in onion bulbs[J]. Annals of Botany, 2008, 103(1): 23-28.
[7] KOCH M,NAUMANN M,PAWELZIK E.Cracking and fracture properties of potato (Solanum tuberosum L.) tubers and their relation to dry matter,starch, and mineral distribution[J].Journal of the Science of Food and Agriculture,2018,99(6):3 149-3 156.
[8] 陈继群,刘丽贞,陈杰忠,等.不同钙处理对脐橙裂果及其细胞壁酶活性的影响[J].华南农业大学学报,2014,35(6):29-32.
[9] 丁改秀,王保明,王小原,等.GA3对壶瓶枣细胞壁组分代谢及裂果率的影响[J].山西农业科学,2013,41(8):819-821;830.
[10] 邱燕萍,陈洁珍,欧良喜,等.糯米糍荔枝裂果与内源激素变化的关系[J].果树学报,1999,16(4):276-279.
[11] KITTEMANN D,NEUWALD D A,STREIF J.Influence of Calcium on fruit firmness and cell wall degrading enzyme activity in ‘Elstar’ apples during storage[J].Acta Horticulturae, 2010(877): 1 037-1 043.
[12] HOFSHI R,ARPAIA M L.Avocado fruit abnormalities and defects revisited[J].California Avocado Society Yearbook, 2002, 86:147-162.
[13] 陈曦,邓吉良,陈日东,等.UV-C处理对甘薯贮藏品质的影响[J].热带作物学报,2019,40(2):373-379.
[14] PANKOMERA P.Effects of postharvest treatments on sweetpotato (Ipomoea batatas) storage quality:A thesis presented in partial fulfilment of the requirements for the degree of doctor of philosophy in food technology at massey university,New Zealand[D].New Zealand: Massey University, 2015.
[15] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
[16] ZHOU Y,DENG L,ZENG K.Enhancement of biocontrol efficacy of pichia membranaefaciens by hot water treatment in postharvest diseases of citrus fruit[J].Crop Protection,2014,63:89-96.
[17] MAEHLY A C,CHANCE B. The assay of catalases and peroxidases[J]. Methods of Biochemical Analysis, 2006:357-424.
[18] 杨金姝,木泰华,马梦梅.果胶结构、提取方法及乳化特性研究进展[J].食品工业科技,2018,39(14):315-322.
[19] BALBONT N C,AYALA H,BASTIAS R M,et al.Cracking in sweet cherries:A comprehensive review from a physiological,molecular,and genomic perspective[J].Chilean Journal of Agricultural Research,2013,73(1):66-72.
N C,AYALA H,BASTIAS R M,et al.Cracking in sweet cherries:A comprehensive review from a physiological,molecular,and genomic perspective[J].Chilean Journal of Agricultural Research,2013,73(1):66-72.
[20] TUCKER G,YIN X R,ZHANG A D,et al.Ethylene and fruit softening[J].Food Quality and Safety,2017,1(4):253-267.
[21] 段学武,张昭其,季作梁.PG酶与果实的成熟软化[J].果树学报,2001,18(4):229-233.
[22] 王晓涛,魏佩玲,胡波,等.纤维素降解酶研究进展[J].草食家畜,2019(3):13-18.
[23] MACDONALD M T,LADA R R,DORAIS M,et al.Endogenous and exogenous ethylene induces needle abscission and cellulase activity in post-harvest balsam fir(Abies balsamea L.)[J].Trees Sturcture & Function,2011,25(5):947-952.
[24] 潘利华,罗建平.β-葡萄糖苷酶的研究及应用进展[J].食品科学,2006,27(12):803-807.
[25] KIM Y H,PARK S C,JI C Y,et al.Diverse antioxidant enzyme levels in different sweetpotato root types during storage root formation[J].Plant Growth Regulation,2015,75(1):155-164.
[26] ARINZE A E,SMITH I M.Distribution of polygalacturonase,total phenolic substances,polyphenol oxidase and peroxidase in rot zones in sweet potato[J].Plant Pathology,2007,31(2):119-122.
[27] 姜爱丽,孟宪军,胡文忠,等.外源乙烯处理对采后蓝莓感官性状和呼吸代谢的影响[J].食品工业科技,2011,32(9):375-378;383.
[28] 程玉娇,李云云,张敏.热处理对‘塔罗科’血橙物流变温环境下的保鲜效果[J].食品科学,2016,37(6):254-260.
[29] BURNETTE F S.Peroxidase and its relationship to food flavor and quality:A review[J].Journal of Food Science,1977,42(1):1-6.
[30] 程曦.控温包装在莴笋尖常温物流过程中的保鲜机理及优化研究[D].重庆:西南大学,2017.
[31] 肖婷,陈东秀,罗鸿,等.乙醇熏蒸对红薯尖冷藏期间品质的影响[J].食品与发酵工业,2019,45(15):209-217.