椰蓉是椰肉榨汁后的副产物,油脂、蛋白质、膳食纤维质量分数分别为42.6%、4.2%和23.2%[1]。研究表明,膳食纤维具有增加饱腹感、促进肠道消化、预防便秘、降低血糖、降低血清胆固醇等功效,被誉为“第七大营养素”[2-4]。椰子蛋白中氨基酸种类有18种,包含了人体必需的8种氨基酸,具有降血脂、降低胆固醇、提高免疫力等功效[5-8]。因此,椰蓉具有极高的综合利用价值。
据调查,由于人们过多地摄入脂肪、糖分等高能量物质,我国超重、肥胖的成年人比例超过30%[9],控制体重用配方食品已成为一类重要食品[10]。膳食纤维和蛋白质是控制体重用配方食品的两大基础营养物质[11-12],椰蓉若经过脱脂处理,将成为控制体重用配方食品的优质原料。椰蓉脱脂方法有化学法、酶法和发酵法,其中化学法是最常用的方法[13-14],采用化学法容易产生有机溶剂残留的现象,而采用酶法和发酵法则相对安全。目前已有一些关于油脂生物降解的研究报道[15-18],但能否应用于椰蓉脱脂,关键在于菌种是否被允许用于食品领域。本研究拟筛选具有食品安全性的椰子油降解菌种,并分析该菌种的降解特性,为椰蓉脱脂以及综合利用奠定基础。
1 材料与方法
1.1 材料与试剂
菌种筛选材料:自然发酵5 d的椰浆;椰子油,菲律宾椰来香精炼食用椰子油;蛋白胨、酵母膏、琼脂,市售生化试剂;正己烷、尿素、KH2PO4、MgSO4·7H2O、NH4Cl、(NH4)2SO4等,市售分析纯试剂;聚合酶链式反应引物和基因组DNA提取试剂盒,上海生工生物工程股份有限公司;Taq脱氧核糖核酸聚合酶、脱氧核糖核苷三磷酸,大连宝生物工程有限公司。
1.2 仪器与设备
SPX-100B-Z生化培养箱,,济南来宝医疗器械有限公司;ZHWY-C2112F双层可编程恒温摇床,上海智城分析仪器制造有限公司;H1850R高速离心机,湖南湘仪实验室仪器开发有限公司;101型电热鼓风干燥箱,广州市康恒仪器有限公司;S-3000N扫描电镜,日本日立公司; TprofessionalPCR仪,德国Biometra公司;SYDR/1305凝胶成像仪,美国Syngene公司。
1.3 驯化培养与平板分离
驯化培养基(g/L):椰子油50,酵母膏10,KH2PO4 2.5,MgSO4·7H2O 0.5,调节pH 6.0。驯化培养基经灭菌、冷却后,接入10%(体积分数)的自然发酵椰浆,于28 ℃、200 r/min的条件下培养96 h,再转接入新鲜的驯化培养基。重复操作驯化培养2次。
平板分离培养基(g/L):蛋白胨20,牛肉膏10,氯霉素0.1,琼脂 20,调节pH 6.0。制作平板后,将无菌的椰子油涂布在平板上,再将驯化培养液的稀释液涂布于平板上,置于28 ℃下培养72 h。
斜面培养基采用酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YEPD)。用接种针挑取平板上60个单菌落,分别接入斜面培养基,于28 ℃下培养至长出菌苔,置于4 ℃冰箱保藏备用。
1.4 摇瓶筛选
摇瓶筛选培养基(g/L):椰子油40,酵母膏5,KH2PO4 2.5,MgSO4·7H2O 0.5,调节pH 6.0。摇瓶筛选培养基经灭菌、冷却后,分别接入60株斜面菌种,置于28 ℃、200 r/min的条件下培养120 h。然后,测定培养液中油脂残余量,计算椰子油降解率,优选出降解率最高的菌株。
1.5 菌种鉴定
观察优选菌株的菌落形态,并利用扫描电镜观察菌体形态。按文献提供的方法[19-21],用氯仿-异戊醇法提取该菌种的DNA,采用通用引物NL1 (5′-GCA TAT CAA TAA GCG GAG GAA AAG-3′)和NL4 (5′-GGT CCG TGT TTC AAG ACG G-3′),用PCR扩增26S rDNA的D1/D2区域。PCR反应体系(50 μL):DNA模板 2 μL,引物NL1/NL4(10 μmol/L)各2 μL,2×Tap PCR Master Mix 25 μL,ddH2O 19 μL。PCR扩增条件为95 ℃变性1 min,52 ℃退火2 min,72 ℃延伸1 min,循环36次,72 ℃延伸10 min。扩增产物经凝胶电泳实验后,送至测序公司测序。将测序结果进行BLAST同源性比对,并使用软件MEGA6.0以Neighbor-Joining方法构建系统发育树。
1.6 不同氮源优选试验
种子培养基(g/L):葡萄糖25,酵母膏10,KH2PO4 2.5,MgSO4·7H2O 0.5 g/L,调节pH 6.0。灭菌、冷却后,接入斜面菌种,于28 ℃、200 r/min的条件下培养20 h。
氮源筛选培养基(g/L):椰子油40,不同氮源(酵母膏、蛋白胨、尿素、(NH4)2SO4、NH4Cl 5,KH2PO4 2.5,MgSO4·7H2O 0.5,调节pH 6.0。分别以不同氮源配制培养基,灭菌、冷却后,接入10%的种子培养液(体积分数),于28 ℃、200 r/min的条件下培养120 h,优选最佳氮源。
1.7 氮源用量优选试验
以最佳氮源配制椰子油降解培养基,该氮源的添加量分别为2.5、5.0、7.5、10、12.5、15 g/L,调节pH 6.0,按1.6所述方法进行接种以及培养,优选氮源的最佳添加量。
1.8 添加其他碳源试验
按照氮源最佳的复配方案配制椰子油降解培养基,分别添加0、2.5、5、7.5、10 g/L的葡萄糖、柠檬酸钠,调节pH 6.0,按1.6所述方法进行接种以及培养,优选最佳的外加碳源及用量。
1.9 油脂残余量测定
参照文献油脂提取方法[22],用等体积的氯仿对培养液进行萃取2次,取下层溶液,用0.2 μm有机滤膜抽滤,除去菌体,获取萃取液,70 ℃下加热蒸发去除氯仿,得到残余油脂。称量残余油脂质量,计算椰子油降解量以及降解率。
1.10 生物量测定
将离心分离所得的菌体置于105 ℃的烘箱中,干燥至恒重,称量质量,计算发酵液中的干菌体浓度[23]。
2 结果与分析
2.1 菌种筛选与鉴定
经摇瓶筛选,60个菌株对椰子油降解率的分布为2.78%~63.75%,有7个菌株的降解率>50%,如图1所示。其中,菌株YD22在60个菌株中的椰子油降解率最高,故优选为进一步研究的对象。该菌株的菌落如图2所示,菌落呈乳白色,边缘不整齐,表面干燥而呈现出皱褶。利用普通显微镜和电子显微镜观察菌体,如图3所示,菌体呈现椭圆型,有芽体,具有酵母形态特征。
将菌种YD22的26S rDNA进行扩增与测序,再将测序结果在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)在线数据库上进行比对,发现该菌与很多解脂亚罗酵母(Yarrowia lipolytica)的相似度达到99%。通过构建系统发育树,如图4所示,菌种YD22与Yarrowia lipolytica ZIM 2416(NCBI登录号HE660067.1)的亲缘关系最近,故被鉴定为解脂亚罗酵母。解脂亚罗酵母具有常见酿酒酵母不具备的特性,通常被用于柠檬酸、异柠檬酸、蛋白酶、脂肪酶、芳香型化合物、二元羧酸、单细胞油脂、生物表面活性剂等生物合成的研究[24-25]。解脂亚罗酵母能够广泛利用糖类、醇类以及一些疏水性化合物作为碳源,近年来又经常被用于油脂污染废水生物修复、油作物废料综合利用等领域[26-27],菌种YD22所具有的椰子油降解性能与这些研究结果是一致的。另外,解脂亚罗酵母被美国食品药品监督管理局(Food and Drug Administration,FDA)认为是具有食品安全性的微生物[28]。
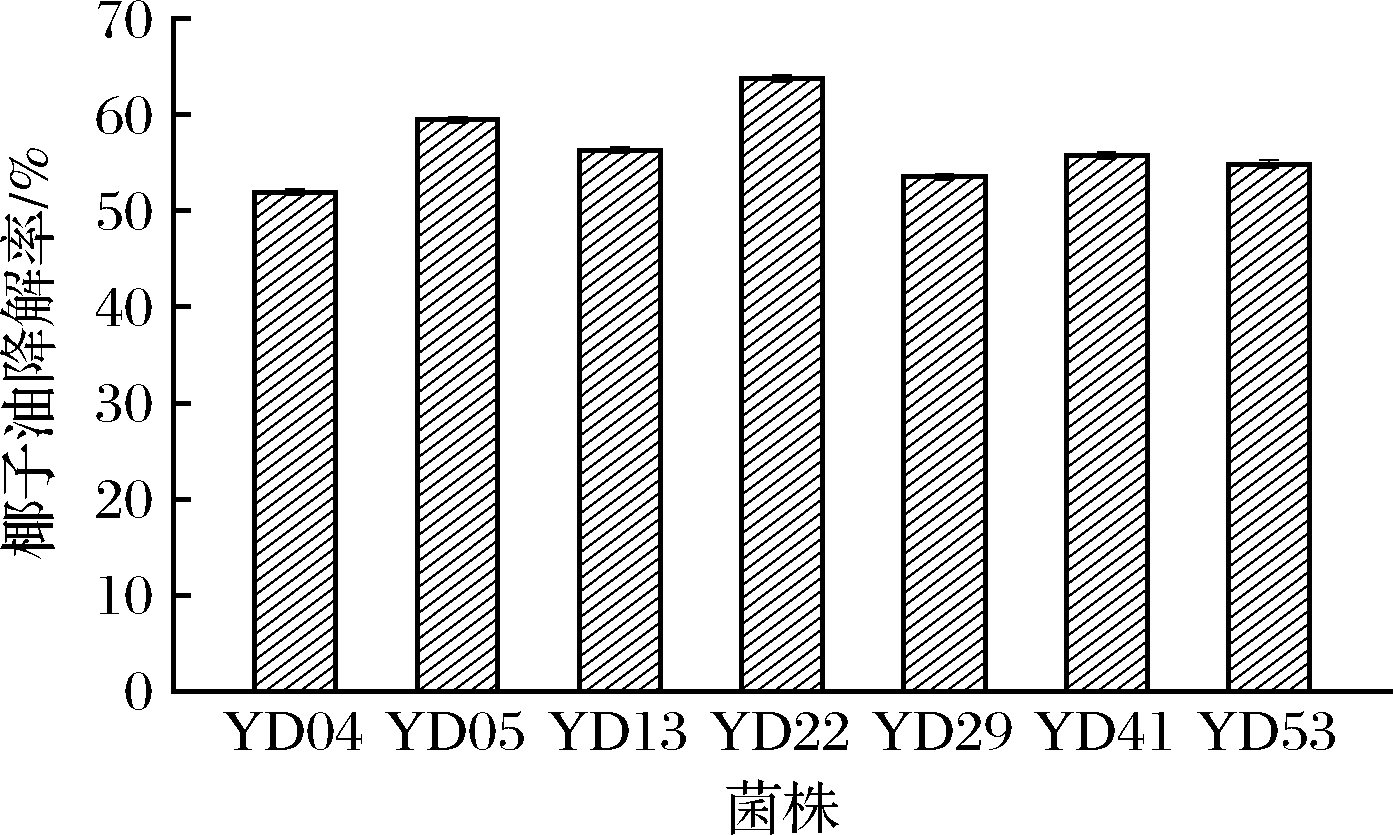
图1 降解率大于50%的菌株
Fig.1 Strains of degradation rate above 50%
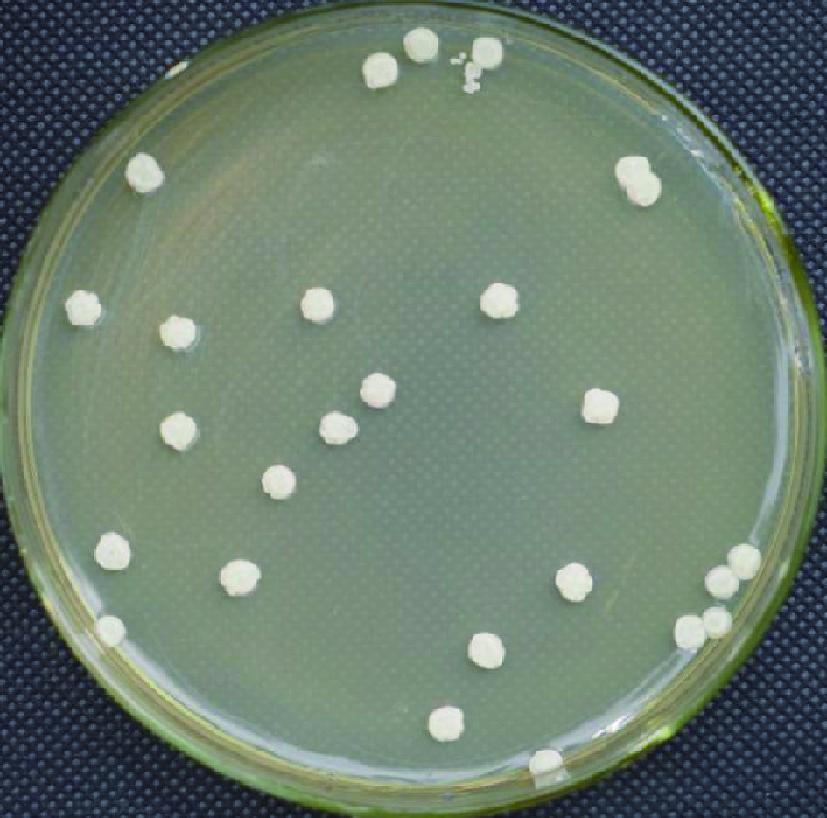
图2 菌种YD22的菌落形态
Fig.2 Colony morphology of strain YD22

图3 菌种YD22的电子显微镜扫描照片(×10 000)
Fig.3 Scanning electronmicroscope(SEM) photograph of
strain YD22

图4 菌种YD22的系统发育树
Fig.4 Phylogenetic tree of strain YD22
2.2 不同氮源对降解的影响
如图5所示,椰子油降解率与生物量呈现出一定的相关性。当环境条件和生长阶段相同时,菌体对椰子油具有比较稳定的比利用速率,单位体积内菌体量越大,椰子油的利用率也越大。因此,较大的生物量可以促进椰子油降解。已有研究表明,酵母浸粉、玉米浆等有机氮源不仅含有微生物生长所需的氮素物质,还含有比较丰富的生长因子,对酵母增殖有利[29-30]。从图5可以看出,有机氮源在促进酵母增殖和椰子油降解等方面的效果明显优于无机氮源。其中,以酵母膏为氮源时,生物量与椰子油降解率最大,故选择酵母膏作为最佳氮源。
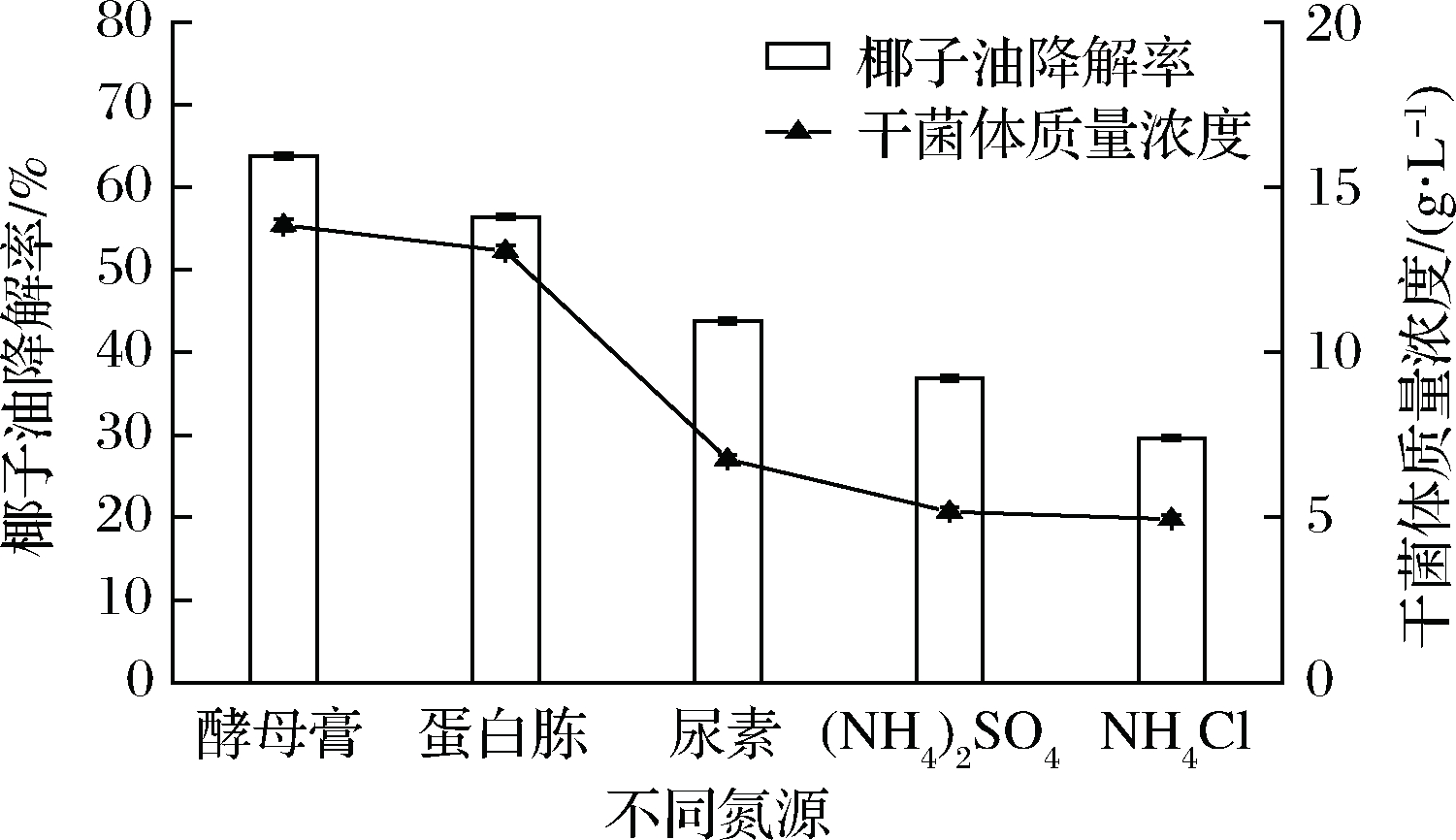
图5 不同氮源对椰子油降解的影响
Fig.5 Effect of different nitrogen sources on
degradation of coconut oil
2.3 酵母膏用量对降解的影响
以不同用量的酵母膏配制培养基,发酵结果如图6所示。在一定范围内,随着酵母膏用量的增加,生物量与椰子油降解率均呈现出不断增大的趋势。再次证明,椰子油降解与酵母增殖具有一定相关性,适当增加酵母膏用量,有利于促进酵母增殖,从而可以提高椰子油降解率。当酵母膏质量浓度增加至10 g/L时,氮源已不是微生物生长与代谢的限制因素,此时的椰子油降解率与生物量趋于最大,继续增大酵母膏用量,对酵母增殖和椰子油降解的影响微弱。因此,酵母膏的最佳用量选择为10 g/L。
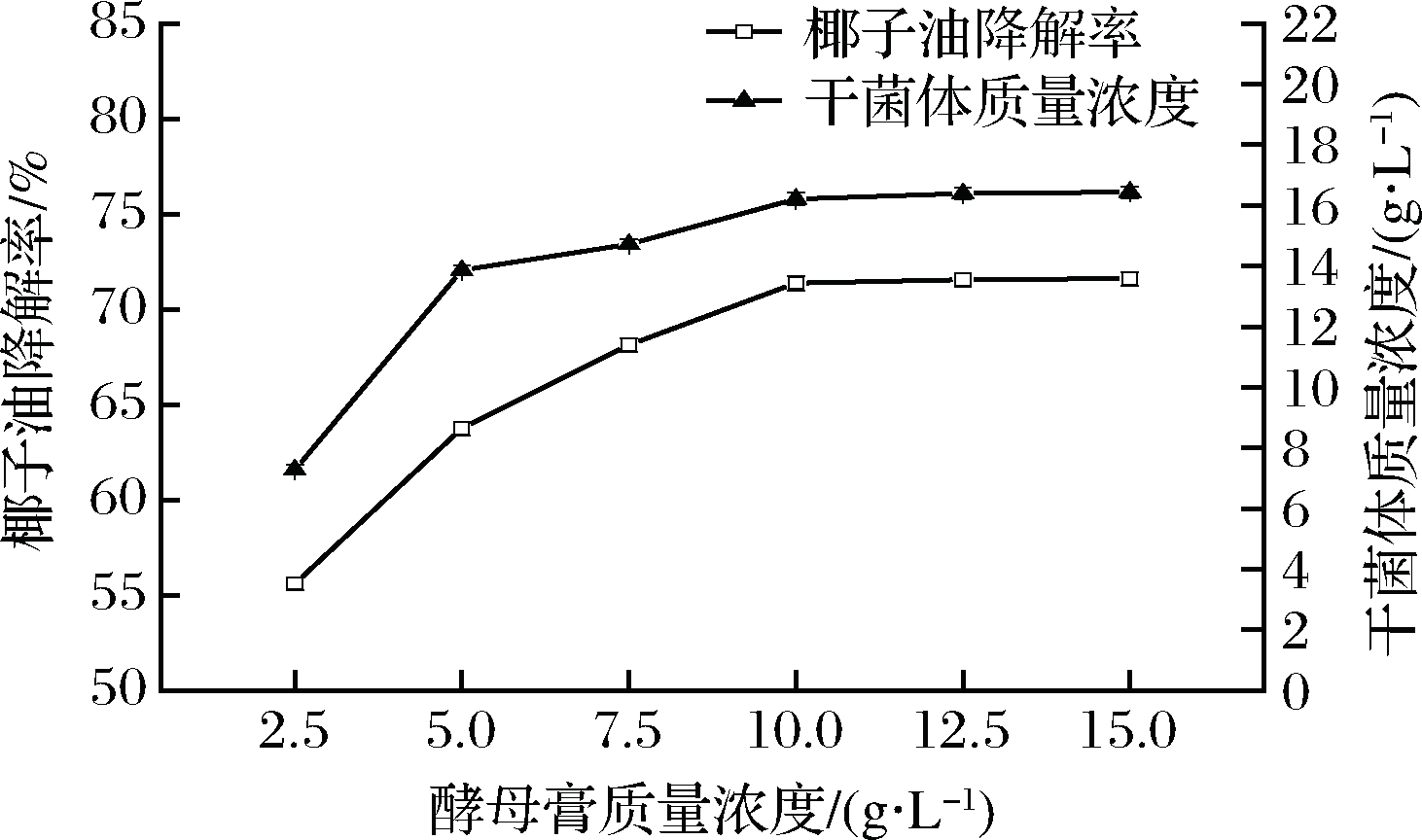
图6 酵母膏用量对椰子油降解的影响
Fig.6 Effect of yeast extract dosage on degradation of
coconut oil
2.4 外加碳源对降解的影响
在培养基中分别添加葡萄糖和柠檬酸钠,结果如图7和图8所示。葡萄糖和柠檬酸钠是容易利用碳源,它们被适量添加后,能够优先被酵母利用,对促进酵母增殖与椰子油降解具有一定作用。但是,在无外加碳源的培养基中,最终pH值下降至3.75,说明培养后期的pH已经不适宜酵母菌代谢。葡萄糖是生理酸性物质,添加量过大时,会引起pH较大幅度下降,对酵母进一步增殖和生理代谢反而不利。从图7可以看出,葡萄糖用量不宜过大,当葡萄糖用量为5 g/L时,生物量和椰子油降解率达到最高,干菌体质量浓度为20.15 g/L,椰子油降解率为76.54%。柠檬酸钠是生理碱性物质,其代谢会引起pH上升,将对椰子油代谢所引起pH下降具有一定的调节作用。从图8可以看出,随着柠檬酸钠用量逐渐增加,生物量和椰子油降解率也逐渐增大。当柠檬酸钠用量为7.5 g/L时,干菌体质量浓度和椰子油降解率达到最大,分别为22.49 g/L和85.76%。而后,柠檬酸钠用量继续增加时,生物量和椰子油降解率反而下降。在质量浓度为10 g/L柠檬酸钠的培养基中,虽然最终pH值显示为6.12,但是,柠檬酸钠被利用过程中的pH却超过了8.0,对酵母产生了抑制作用。通过比较无外加碳源、添加葡萄糖、添加柠檬酸钠的降解效果,优选质量度为7.5 g/L 柠檬酸钠为最佳外加碳源,其降解率是无外加碳源的1.2倍。在已报道的一些油脂降解研究中[15-16,31],油脂初始质量浓度通常低于10 g/L,油脂降解率一般低于80%。与这些已知的油脂降解菌相比,本实验的椰子油初始质量浓度与降解率较高。
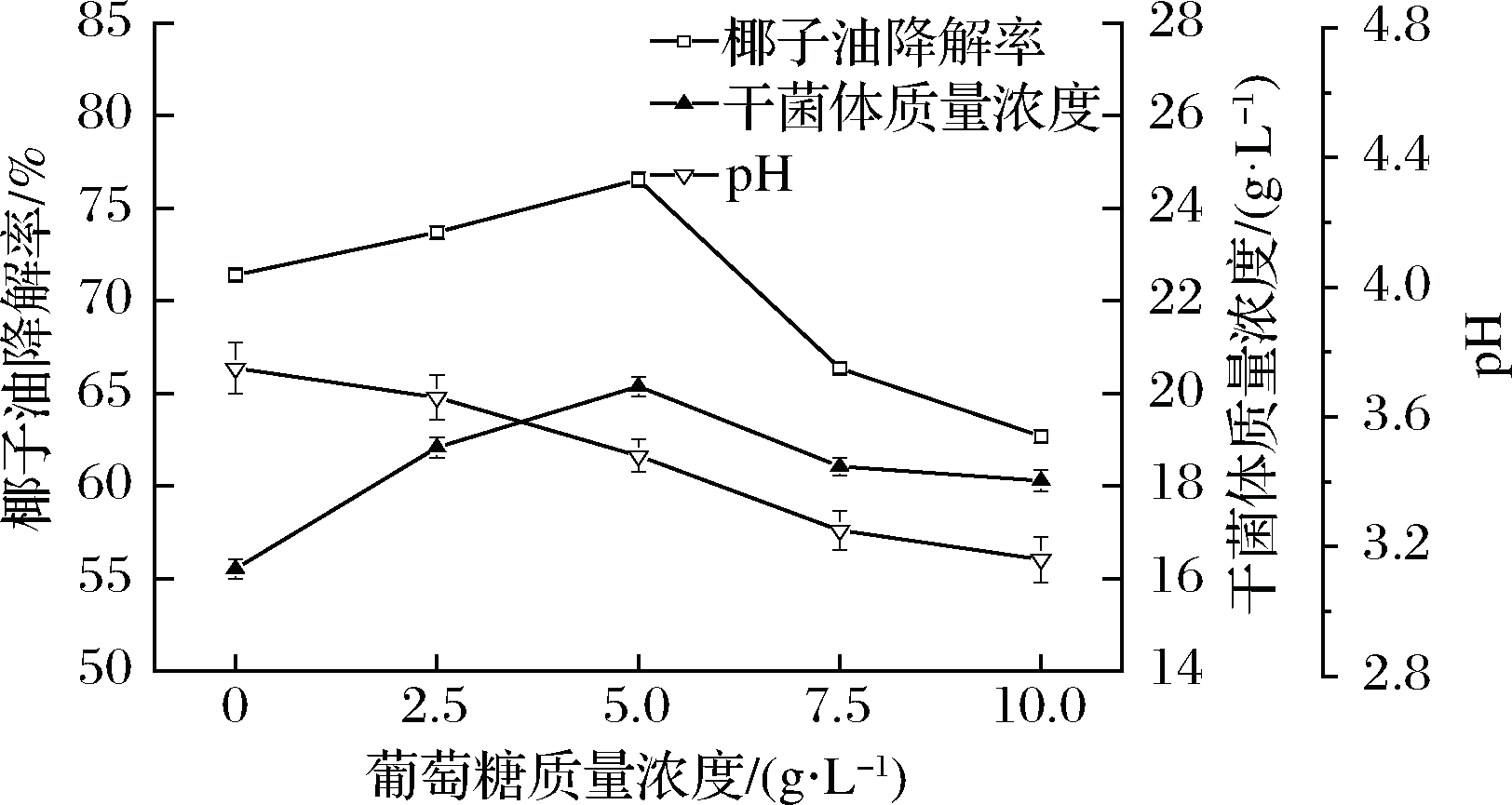
图7 葡萄糖用量对椰子油降解的影响
Fig.7 Effect of glucose dosage on degradation of
coconut oil
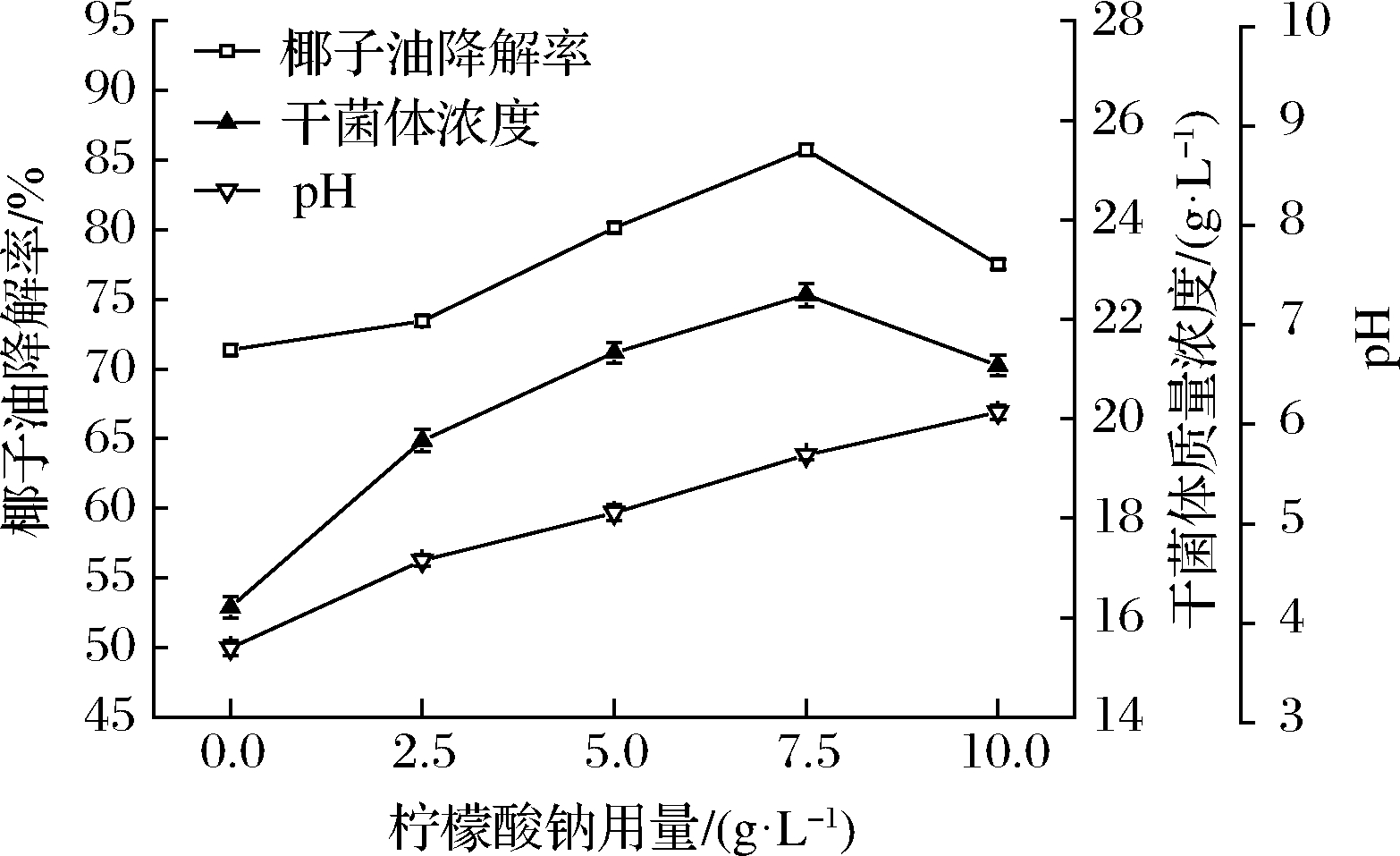
图8 柠檬酸钠用量对椰子油降解的影响
Fig.8 Effect of sodium citrate dosage on degradation of
coconut oil
3 结论
从自然发酵椰浆中,筛选获得1株椰子油高效降解菌株YD22。经过菌落形态、菌体形态与26S rDNA鉴定,该菌株被确定为解脂亚罗酵母。菌种YD22对椰子油的降解率与其生物量具有相关性,生物量越高,越有利于微生物降解椰子油。在氮源筛选试验中,酵母膏对酵母增殖和椰子油降解的促进作用最显著,被优选为最佳氮源,其最佳用量为10 g/L。在酵母膏为氮源的椰子油培养基中,适量添加葡萄糖和柠檬酸钠,可提高生物量和椰子油降解率。其中,在40 g/L椰子油培养基中,添加7.5 g/L柠檬酸钠时,椰子油降解效果最好,降解率达到85.76%,明显高于无外加碳源的培养基。与已知的油脂降解菌相比,菌种YD22是可用于食品的菌种,且对椰子油具有很强的降解能力,在食品工业中具有应用价值。同时,氮源和外加碳源的研究结果,为油脂降解领域的研究与生产提供参考。
[1] 张玉锋, 郭玉如, 赵瑞洁, 等. 椰蓉及其膳食纤维的理化性质和功能活性分析[J]. 食品科技, 2019, 44(4):66-70.
[2] FENDRI L B, CHAARI F, MAALOUL M, et al. Wheat bread enrichment by pea and broad bean pods fibers: Effect on dough rheology and bread quality[J]. LWT-Food Science and Technology, 2016, 73(11):584-591.
[3] 叶秋萍, 曾新萍, 郑晓倩. 膳食纤维的制备技术及理化性能的研究进展[J]. 食品研究与开发, 2019, 40(17):212-217.
[4] HUA M, LU J X, QU D, et al. Structure, physicochemical properties and adsorption function of insoluble dietary fiber from ginseng residue: A potential functional ingredient[J]. Food Chemistry, 2019, 286:522-529.
[5] RODSAMRAN P, SOTHORNVIT R. Physicochemical and functional properties of protein concentrate from byproduct of coconut processing[J]. Food Chemistry, 2018, 241:364-371.
[6] 马开创, 黄宏飞, 彭吟雪, 等. 椰子分级蛋白制备的研究[J]. 中国油脂, 2019, 44(5):67-72.
[7] 郭帅, 李艳. 椰子活性蛋白与功能肽的研究进展[J]. 食品科技, 2018, 43(5):67-71;76.
[8] 郭帅. 椰子谷蛋白-1功能特性的分析[J]. 食品工业科技, 2017, 38(16):75-78;100.
[9] 林玉桓, 王晓红. 中国居民膳食营养状况分析与对策[J]. 江苏调味副食品, 2019(2):1-3.
[10] 覃丽霞, 程冬萍, 颜继忠, 等. 控制体重配方食品的研究进展[J]. 现代食品, 2017(7):3-6.
[11] 吴斯妍, 贾鑫, 杨栋, 等. 膳食纤维功能特性及构效关系的研究进展[J]. 中国食物与营养, 2019, 25(6):47-50.
[12] 罗洁霞, 徐克. 我国居民家庭膳食蛋白质和脂肪摄入量比较[J]. 中国食物与营养, 2019, 25(2):79-83.
[13] 杜晓静, 白新鹏, 姜泽放, 等. 脱脂椰蓉可溶性膳食纤维制备工艺及单糖组成和理化特性分析[J]. 食品科学, 2019, 40(2):245-251.
[14] 曾仕林, 黄小雪, 何东平, 等. 椰子分离蛋白制备工艺的研究[J]. 粮食与油脂, 2019, 32(6):45-49.
[15] 张月月, 汪燕, 彭青春, 等. 1株耐高温酸性脂肪酶产生菌的筛选鉴定与其酶学特性研究[J]. 食品与发酵工业, 2017, 43(10):96-101.
[16] 史红玲, 陈梦言, 刘飞, 等. 生活废弃油脂高效降解菌的筛选、鉴定及应用[J]. 食品与发酵工业, 2019, 45(17):48-53.
[17] PHONGJARUS N, SUVAPHAT C, SRICHAI N, et al. Photoheterotrophy of photosynthetic bacteria (Rhodopseudomonas palustris) growing on oil palm and soybean cooking oils[J]. Environmental Technology & Innovation, 2018, 10:290-304.
[18] KUMAR S, MATHUR A, SINGH V, et al. Bioremediation of waste cooking oil using a novel lipase produced by Penicillium chrysogenum SNP5 grown in solid medium containing waste grease[J]. Bioresource Technology, 2012, 120:300-304.
[19] 刘飞, 郭孝敬, 陈欢, 等. 新疆哈萨克族奶酪中潜在益生酵母菌的筛选[J]. 食品与发酵工业, 2018, 44(7):128-134.
[20] GUT A M, VASILJEVIC T, YEAGER T, et al. Characterization of yeasts isolated from traditional kefir grains for potential probiotic properties[J]. Journal of Functional Foods, 2019, 58:56-66.
[21] MAÏWORÉ J, NGOUNE L T, PIRO-METAYER I, et al. Identification of yeasts present in artisanal yoghurt and traditionally fermented milks consumed in the northern part of Cameroon[J]. Scientific African, 2019, 6:1-9.
[22] 冯豪, 江冰心, 张建国. 利用麸皮水解液培养深黄伞形霉积累油脂[J]. 化工进展, 2018, 37(11):4 437-4 443.
[23] 张龙, 郑根成, 潘龙, 等. ε-聚赖氨酸高产改造菌发酵过程分析与工艺改进[J]. 工业微生物, 2018, 48(3):17-23.
![]() A, WENELSKA K, JUNKA A, et al. An efficient method of Yarrowia lipolytica immobilization using oil-and emulsion-modified bacterial cellulose carriers[J]. Electronic Journal of Biotechnology, 2019, 41:30-36.
A, WENELSKA K, JUNKA A, et al. An efficient method of Yarrowia lipolytica immobilization using oil-and emulsion-modified bacterial cellulose carriers[J]. Electronic Journal of Biotechnology, 2019, 41:30-36.
[25] JUSZCZYK P, RYMOWICZ W, KITA A, et al. Biomass production by Yarrowia lipolytica yeast using waste derived from the production of ethyl esters of polyunsaturated fatty acids of flaxseed oil[J]. Industrial Crops & Products, 2019, 138:1-10.
[26] VONG W C, YANG K L C A, LIU S Q. Okara (soybean residue) biotransformation by yeast Yarrowia lipolytica[J]. International Journal of Food Microbiology, 2016, 235:1-9.
[27] LIU X Y, YAN Y B, ZHAO P S, et al. Oil crop wastes as substrate candidates for enhancing erythritol production by modified Yarrowia lipolytica via one-step solid state fermentation[J]. Bioresource Technology, 2019, 294:1-9.
[28] DARVISHI F, FARAJI N, SHAMSI F. Production and structural modeling of a novel asparaginase in Yarrowia lipolytica[J]. International Journal of Biological Macromolecules, 2019, 125:955-961.
[29] 王亮, 胡曼, 王江月, 等. 马克斯克鲁维酵母高密度发酵条件的优化研究[J]. 食品工业科技, 2017, 38(17):111-118;124.
[30] 黄芳, 李欣, 李沛, 等. 富核糖核酸热带假丝酵母发酵培养基优化[J]. 中国酿造, 2019, 38(6):35-42.
[31] 张印, 薛永常. 油脂降解菌种的鉴定及降解条件优化[J]. 微生物学杂志, 2015, 35(2):90-94.