Detection of nine aminoglycosides residues in honey by ultra-performance liquid chromatography-tandem mass spectrometry
ABSTRACT Ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) method was developed for the simultaneous detection of aminoglycosides (neomycin, amikacin, dihydrostreptomycin, streptomycin, hygromyxin B, kananmycin, gendamicin, tobramycin, spectinomycin). The residues of aminoglycosides in the honey were extracted with TCA buffer, enriched and cleaned up with HLB solid phase extraction column, and eluted with aqueous elution. And the ion-pairing reagent was added to the final extract and used to optimize the chromatography conditions. Moreover, the extracts were separated on reversed-phase chromatographic column using acetonitrile-water as mobile phase by gradient elution, and detected by liquid chromatography-mass spectrometry under multiple reaction monitoring mode via positive ion mode. All the analytes were calibrated by the external method. The results showed that the method has a good linear relationship in the range of 20-1 000 ng/mL. Moreover, the quantification limit of neomycin, dihydrostreptomycin, streptomycin, kanamycin, and tobramycin is 5 μg/kg; the quantification limit of amikacin, hygromycin B, gentamicin, and spectinomycin is 10 μg/kg. Within the linear range, three concentrations of addition experiments were carried out in the blank honey samples, the sample recovery rates ranged from 72.6%-109.4%, and the relative standard deviations were 2.13%-8.23%. The method developed here has the advantages of easy operation, high sensitivity and good filter effect. By avoiding the use of ion-pairing reagent in the mobile phase, the method could effectively reduce the pollution of mass spectrometer and better meet the detection requirements of the aminoglycoside residues in honey.
Key words aminoglycosides; honey; ultra performance liquid chromatograph-tandem mass spectrometry
氨基糖苷类抗生素(aminoglycosides, AGs)是一类含有氨基糖苷健的抗生素,具有广谱抗菌性,临床应用广泛,主要用于治疗革兰氏隐性菌、绿脓杆菌的感染,目前已有数十个天然抗生素或半合成品种[1-2]。随着养殖业的发展,氨基糖苷类抗生素因其高效、低价,常常被用来治疗或者添加到饲料中预防各种动物疾病[3-5],是使用较为普遍的抗生素种类之一,但AGs同时具有一定的毒副作用,主要表现在肾毒性、耳毒性、神经肌肉毒性等[6]。在我国,AGs在养蜂业中被广泛使用,主要是防治蜜蜂幼虫病[7-9]。但是由于蜂农不科学的使用,可能导致蜂蜜及其蜂产品中AGs的残留,消费者直接食用这类残留超标的食品会带来潜在的危害。美国FDA、欧盟委员会和日本厚生劳动省等相关管理机构对动物源性食品中常用的几种AGs的残留限量标准作出了规定[10-12]。我国在新颁布实行的GB 31650—2019中对AGs在动物源性食品中也有明确的限量要求[13]。
目前,针对AGs残留的检测方法主要有微生物法、酶联免疫法、液相色谱法、气相色谱-质谱法和液相色谱-串联质谱法等[14-16]。液相色谱-串联质谱法因其高通量、定性定量准确、灵敏度高,而被广泛应用于此类抗生素的检测。由于AGs极性较强,在反相色谱柱上保留很弱,其分离检测仍然是此类药物残留检测的难点之一。本研究以新霉素、阿米卡星、双氢链霉素、链霉素、潮霉素B、卡那霉素、庆大霉素、妥布霉素、大观霉素9种药物作为研究对象,结合固相萃取小柱前处理净化,选取乙腈-水体系作为流动相,在最终提取液中添加离子对试剂优化色谱行为,采用反相色谱分离体系,建立了同时测定蜂蜜中9种氨基糖苷类药物的超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry, UPLC-MS/MS)分析方法。
1 材料与方法
1.1 主要仪器与装置
超高效液相色谱-串联质谱仪,美国安捷伦公司(Agilent 1290/6470);高速离心机,长沙湘仪离心机仪器有限公司(L-500型);电子天平(精确到0.01 g),常熟市双杰测试仪器厂;瓶口分液器,德国普兰德公司;(UMV-2)多管旋涡混合器,北京普立泰科仪器有限公司;Milli-Q实验室超纯水制备系统(Milli-Q Intergra115),美国Millipore公司产品;12管固相萃取装置,美国SUPELCO公司;旋涡混合器(XW-80A型),苏州江东精密仪器有限公司;移液器(规格10~100 μL、100~1 000 μL、1~5 mL),大龙兴创实验仪器有限公司。
1.2 试剂与材料
乙腈(色谱纯),德国Merck公司;甲酸、七氟丁酸(色谱纯),上海安谱实验科技股份有限公司;异丙醇(分析纯),天津市富宇精细化工有限公司;乙酸铵(优级纯),山东西亚化学股份有限公司;乙二胺四乙酸二钠、三氯乙酸(分析纯),成都市科龙化工试剂厂;NaCl(分析纯),成都金山化学试剂有限公司;HCl(优级纯),国药集团化学试剂有限公司;NaOH(分析纯),天津市科密欧化学试剂有限公司;CNW Poly-Sery HLB SPE 小柱(150 mg/6mL),上海安谱实验科技股份有限公司;有机微孔滤膜(0.22 μm),上海安谱实验科技股份有限公司;妥布霉素、庆大霉素、卡那霉素、潮霉素B、阿米卡星、新霉素、大观霉素、链霉素、双氢链霉素混合标准溶液(100 μg/mL),天津阿尔塔科技有限公司。
标准储备液的制备:准确移取氨基糖苷类混合标准溶液,用水定容至刻度,配成质量浓度为10 μg/mL的标准储备溶液,4 ℃避光可保存1个月。
样品提取液的制备:准确称取0.77 g乙酸铵,置于1 L的烧杯中,加入约900 mL水,溶解,用稀HCl溶液或NaOH溶液调节pH至4.0,然后分别加入0.15 g乙二胺四乙酸二钠、5 g NaCl和20 g三氯乙酸,使固体溶解,混合均匀,并转移至1 000 mL容量瓶中,定容至刻度。
1.3 样品前处理方法
1.3.1 提取
称取5 g(精确到0.01 g)样品,置于50 mL聚丙烯离心管中,加入20 mL样品提取液,置于多管旋涡混合器充分提取5 min;然后将样品在4 200 r/min下离心5 min,收集上清液于另一聚丙烯离心管中,用稀HCl或NaOH溶液将上清液pH调节至6.5±0.5。
1.3.2 净化
取HLB固相萃取小柱,预先以5 mL甲醇,5 mL水活化,然后将pH调节后的上清液全部过柱,控制上样流速小于1 mL/min,弃去流出液,以5 mL水淋洗,弃去淋洗液并真空抽干2 min,用2 mL V(甲酸)∶V(异丙醇)∶V(水)=10∶5∶85洗脱液进行洗脱,收集洗脱液于聚丙烯刻度管中,加入20 μL七氟丁酸,并用洗脱液定容至2 mL,旋涡混匀后,过0.22 μm有机微孔滤膜,使用UPLC-MS/MS进行分析。
1.3.3 基质匹配工作曲线
取空白蜂蜜样品,按1.3.1和1.3.2前处理方法,得到空白基质液,用空白基质液稀释标准溶液,配制出20、50、125、250、500、1 000 ng/mL氨基糖苷类混合标准工作液,用UPLC-MS/MS分析后,经仪器软件数据处理后,得到基质匹配工作曲线。
1.4 实验条件
1.4.1 色谱条件
色谱柱:Agilent Eclipse plus C18(2.1 mm×100 mm,1.8 μm);流动相:A为0.1%甲酸水溶液(含0.5 mmol/L乙酸铵),B为乙腈;流速0.3 mL/min;柱温40 ℃;进样量2 μL;梯度洗脱程序:0~2 min(5%B),2~2.5 min (5%B~8%B),2.5~6 min(8%B~40%B),6~6.5 min (40%B~90%B), 6.5~8.5 min(90%B),8.5~9.5 min(90%B~5%B),9.5~11 min(5%B)。
1.4.2 质谱条件
电喷雾离子源(electron spray ionization,ESI),多反应监测模式,正离子扫描,毛细管电压5 500 V,喷嘴电压500 V,雾化气压力45 psi,干燥气温度300 ℃,干燥气流速6 L/min,鞘气温度300 ℃,鞘气流速10 L/min,Delta EMV值为600,氨基糖苷类药物定性、定量离子、锥孔电压、碰撞能量等参数列于表1。
表1 目标物的保留时间及质谱参数
Table 1 Retention times and mass spectrometric
parameters for the analytes
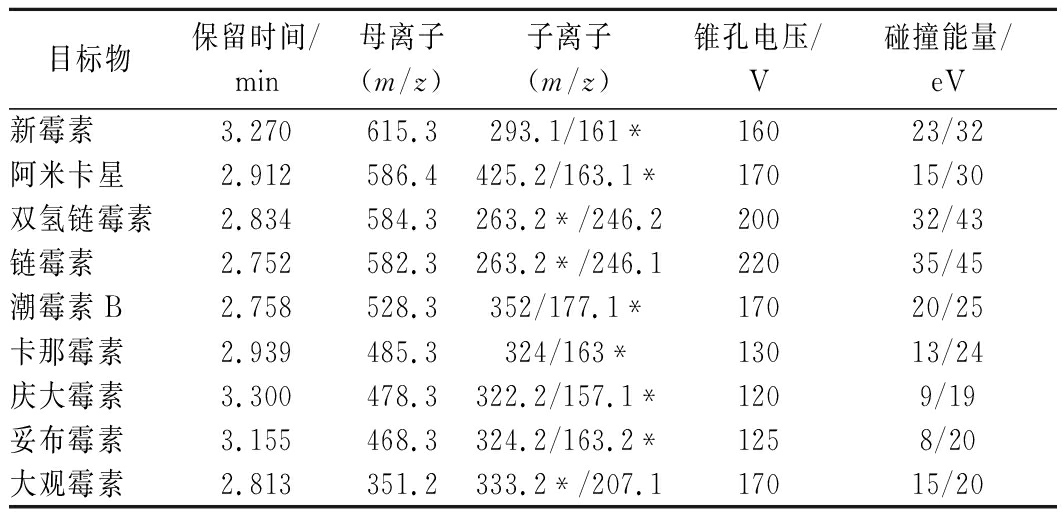
目标物保留时间/min母离子(m/z)子离子(m/z)锥孔电压/V碰撞能量/eV新霉素3.270615.3293.1/161*16023/32阿米卡星2.912586.4425.2/163.1*17015/30双氢链霉素2.834584.3263.2*/246.220032/43链霉素2.752582.3263.2*/246.122035/45潮霉素B2.758528.3352/177.1*17020/25卡那霉素2.939485.3324/163*13013/24庆大霉素3.300478.3322.2/157.1*1209/19妥布霉素3.155468.3324.2/163.2*1258/20大观霉素2.813351.2333.2*/207.117015/20
注:*为定量离子
2 结果与分析
2.1 液相色谱条件的选择
AGs易溶于水,极性强,在反相色谱柱几乎无保留,目前液相色谱法主要是在流动相中使用离子对试剂,如庚烷磺酸钠等,液质联用法在流动相添加七氟丁酸、三氟乙酸等具有挥发性且能增强保留的物质。然而,这将带来新的问题,如与质谱不兼容或者产生离子抑制效应(特别是对于负离子模式)等。随着亲水作用色谱的发展,有研究使用亲水色谱柱进行氨基糖苷类药物的分析[17-19],但常规的HILIC柱与比反相色谱柱相比,流动相条件发生变化,重新平衡时间较长,在梯度洗脱程序中的平衡时间也相对较长,此外,为了缩短分析时间,提高药物分离度,改善被分析物的峰形,需要使用高浓度盐(100~200 mmol/L)做流动相,如甲酸铵或者乙酸铵等,但会使目标物产生较强的离子抑制现象,降低灵敏度。
本实验将离子对试剂,如庚烷磺酸钠和七氟丁酸等,添加到最终提取溶液中,以常规C18色谱柱(Agilent Eclipse plus C18)为分析柱,选取乙腈-0.1%甲酸水为流动相体系,考察9种AGs药物的分离效果。实验表明,最终提取溶液中添加磺酸盐和七氟丁酸,都具有增强保留能力,提高各目标物的分离度,但七氟丁酸与磺酸盐相比,沸点较低,易挥发,能改善质谱的电离效果,增强被分析物的响应,此外,在最终提取溶液中使用七氟丁酸,避免了在流动相中使用对质谱负离子模式的离子抑制效应。因此,本研究确定在最终提取液中添加七氟丁酸,以反相色谱柱为分析柱,通过优化梯度洗脱条件,获得了9种目标物的合适的保留时间和较好的峰形,如图1所示。
2.2 质谱条件的优化
AGs药物结构中含有1个或者多个羟基和氨基,呈弱碱性,在质谱上有很强的正离子响应,同时该类药物具有很强的极性,需采用电喷雾源进行质谱分析[20-21]。本实验在正离子模式下,采用ESI离子源,将9种化合物的混合标准溶液配制成1 μg/mL进行母离子扫描,得到的母离子均为[M+H]+,优化锥孔电压,对得到的母离子进行子离子扫描,选择响应较好的2个特征离子作为定量定性离子对,优化碰撞能量,然后联机液相色谱仪,优化干燥气温度和流量,鞘气温度和流量,雾化气压力,毛细管电压等质谱参数,见1.4.2所述。
本方法中阿米卡星与卡那霉素、双氢链霉素与大观霉素、潮霉素B与链霉素、庆大霉素与新霉素保留时间较为接近,但根据质谱检测器的原理,对于不同质荷比的化合物具有质量分辨功能,若无法实现有效的色谱分离,也可通过目标物的特征离子对,实现专属的测定。
2.3 样品前处理的选择
2.3.1 样品的提取
与其他大多数抗生素不同,AGs药物易溶于水,难溶于乙腈等有机溶剂,这些化合物无法使用乙腈或其他有机溶剂进行萃取,因此常采用低pH的缓冲盐[22-23]进行提取。本研究中,使用含有三氯乙酸的缓冲盐溶液将氨基糖苷类抗生素从样品中萃取出来,并进一步利用有效的固相萃取净化,除去残留的三氯乙酸,减少共萃取干扰。
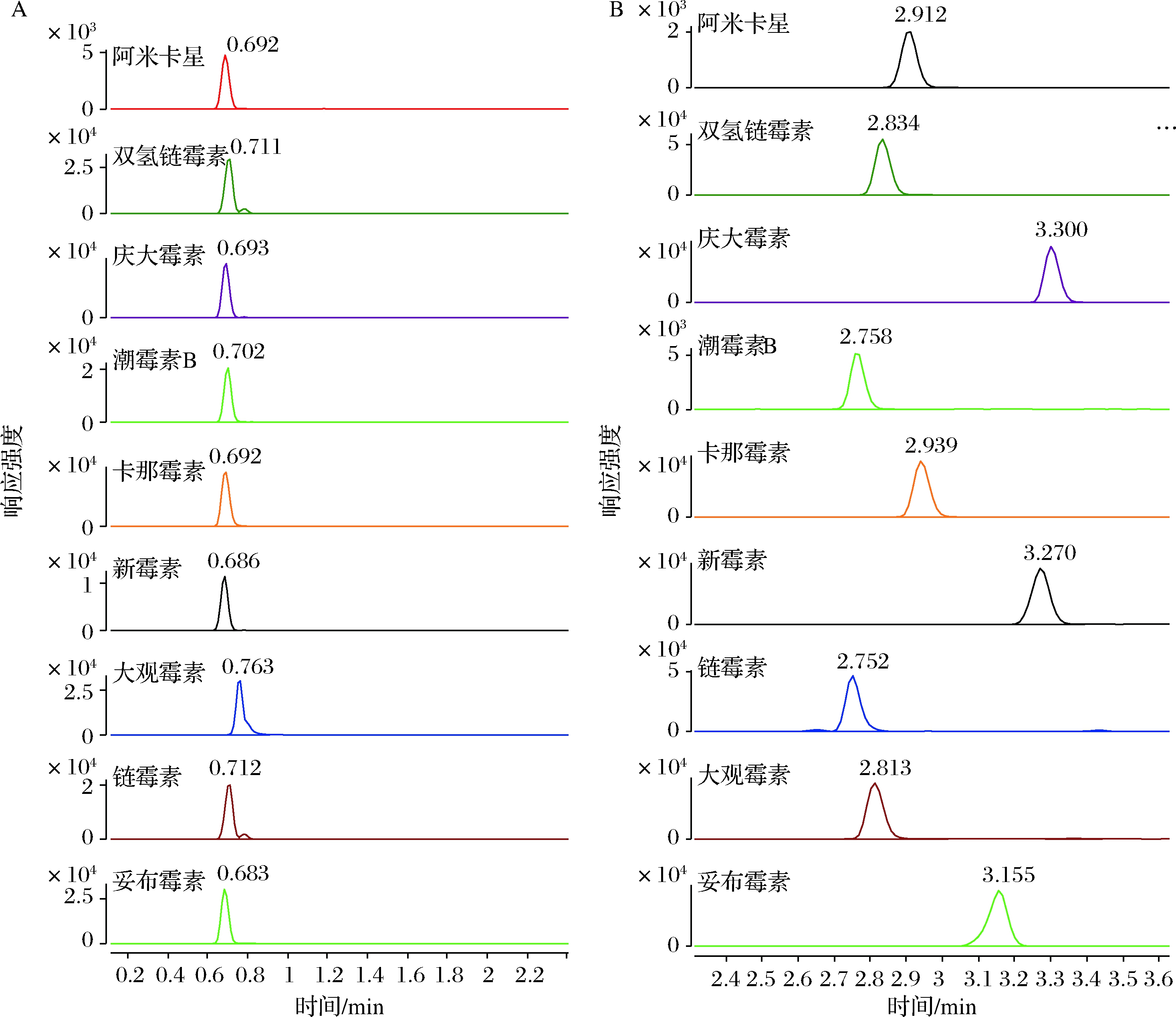
A-最终提取液中未添加七氟丁酸;B-最终提取液中添加七氟丁酸
图1 九种氨基糖苷类药物特征离子色谱图
Fig.1 Chromatograms of 9 kinds of aminoglycoside
2.3.2 样品的净化与基质效应的考察
根据AGs药物的结构特点,净化时用到的通用型固相萃取柱主要有HLB柱和离子交换柱(如SCX、PCX、WCX、CBX等)[24-28],由于离子交换柱多用于单个或者几种药物的检测,而HLB柱对多种AGs药物的净化具有较好的效果。本实验选择HLB柱对提取液进行净化处理,采用HLB固相萃取柱净化时有推荐的活化、淋洗、洗脱方法,推荐的洗脱液一般为甲醇。由于AGs药物为强极性化合物,水溶性极强,因此本研究尝试采用水性洗脱液,添加洗脱能力较强的异丙醇,并降低洗脱液的pH值,考察对洗脱效果的影响,分别用体积分数1%、5%、10%、15%的甲酸水性洗脱液进行洗脱,使用量为5 mL,实验发现,当洗脱液中甲酸的体积分数≥10%时,9种AGs可被洗脱,回收率均大于70%,如图2所示。对洗脱液的使用量进行了考察,使用5 mL的水性洗脱液进行洗脱,按1 mL/管分别收集洗脱液,上机测定洗脱液中的目标物含量,结果显示,收集的洗脱液第3管里目标物质含量已经很低,为节约分析时间,提高方法的灵敏度,洗脱液体积选择为2 mL。
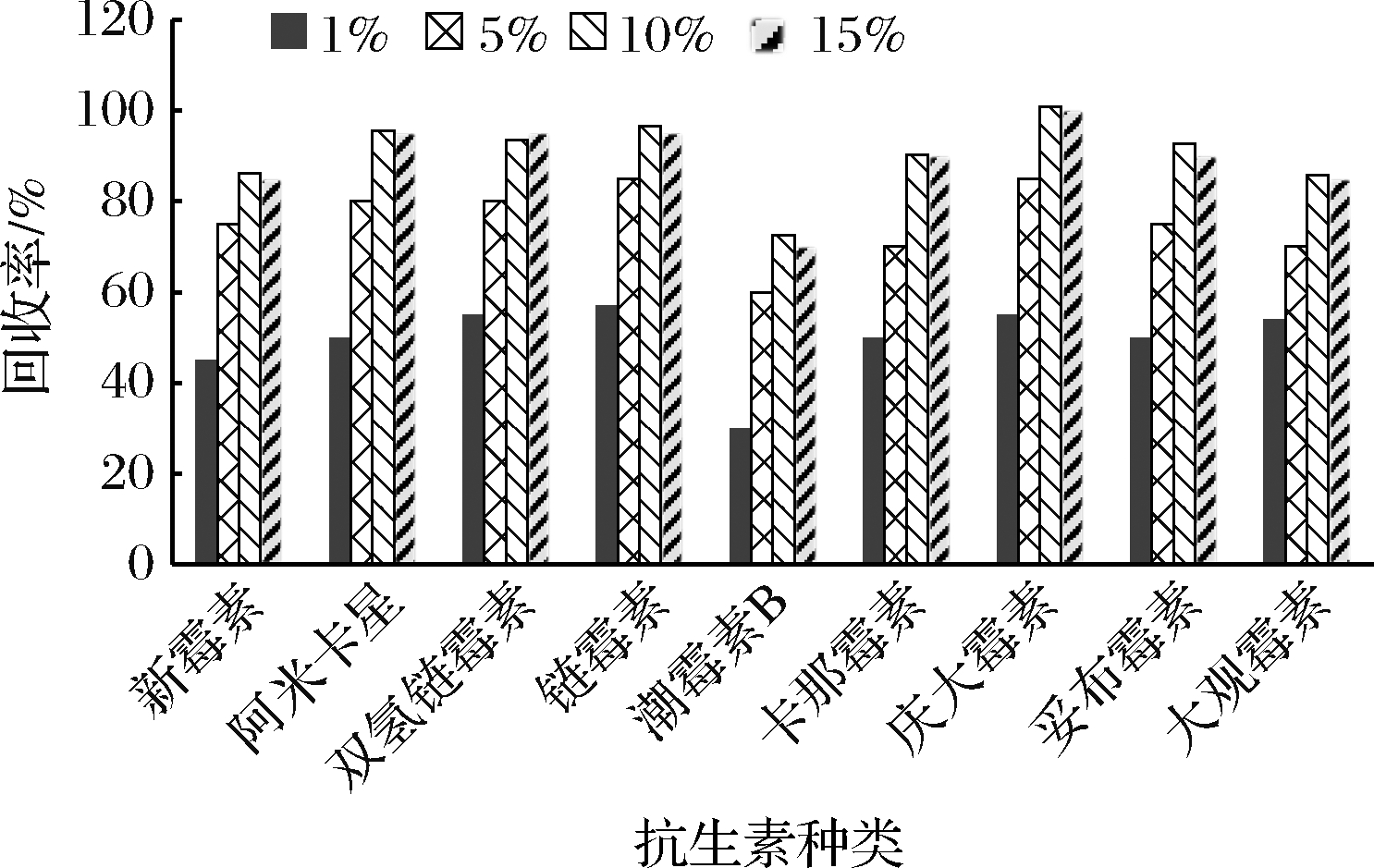
图2 不同洗脱条件下AGs的回收率
Fig.2 Recoveries of AGs under different elution conditions
比较了水性洗脱液和纯甲醇洗脱液的净化效果,其净化效果评价方式主要是考察AGs的基质效应,基质效应(matrix effect,ME)的计算方法参考相关文献[29-30]进行,即基质效应(ME)=A/B,其中A代表含有空白蜂蜜样品基被分析物的离子响应值,B代表纯溶剂中被分析物的相同浓度的离子响应值。若ME值为0.8~1.2时,基质效应不明显;若ME值介于0.5~0.8或1.2~1.5时,则为中等程度的基质抑制或增强效应;当ME值<0.5或>1.5,表明基质效应较强。用纯溶剂配制质量浓度为50 ng/mL的混合标准溶液,再用空白样品提取液配制同浓度水平的基质匹配标准溶液,做6组平行,考察样品基质对各药物的基质效应,其结果如图3所示。使用水性洗脱液洗脱目标物,除新霉素有较强的基质增强效应外,其他8种药物ME值均在0.8~1.2,基质效应不明显,而使用纯甲醇作为洗脱溶剂,样品基质对目标药物均有较强的基质抑制或增强效应。结果表明,与有机型洗脱液相比,使用水性洗脱液洗脱AGs药物时,固相萃取柱能保留大量的基质干扰成分,可使净化效果得以提高。
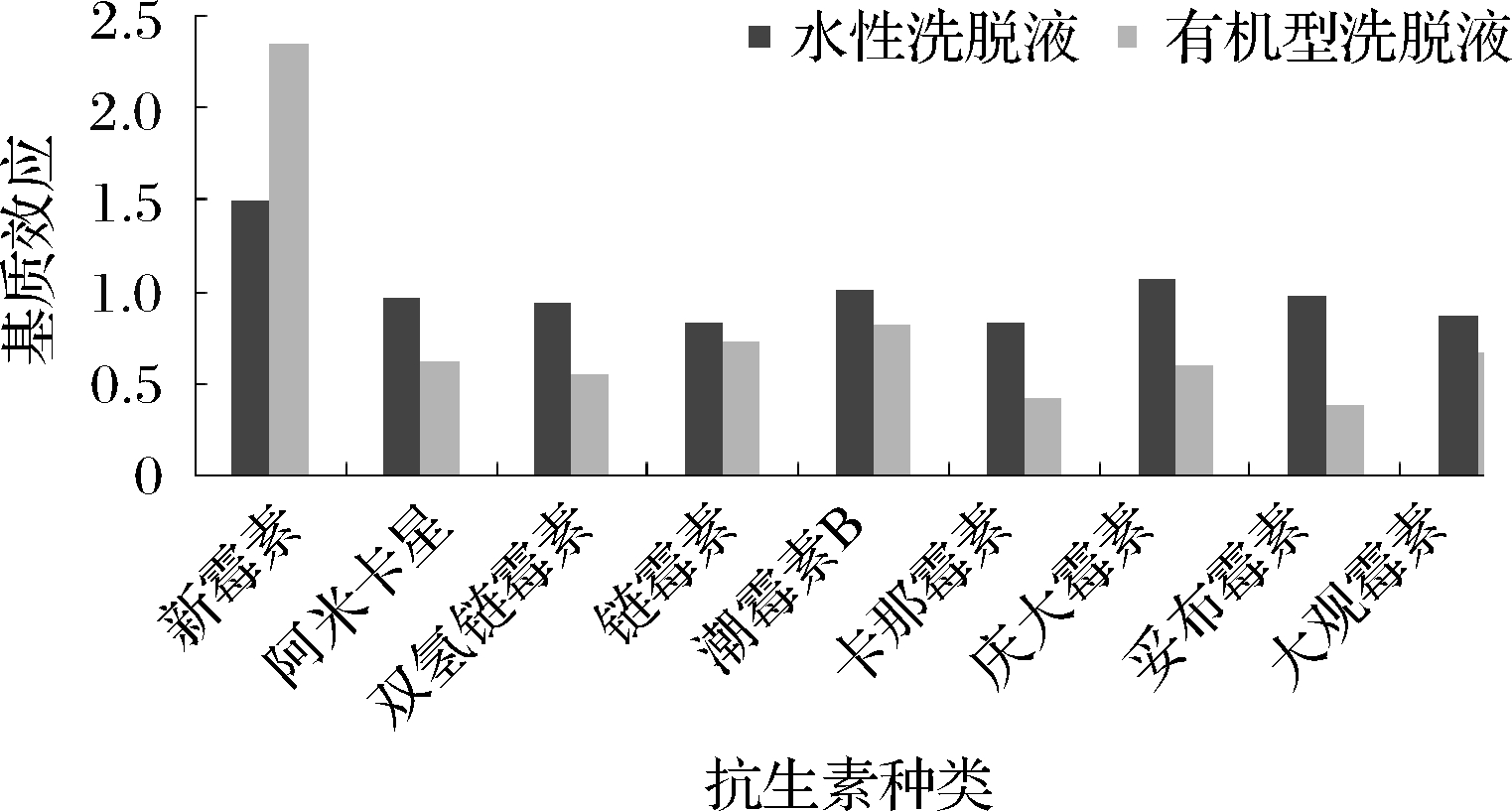
图3 不同洗脱溶剂下的氨基糖苷类药物的基质效应
Fig.3 Matrix effects of aminoglycoside in different elution solve
2.4 线性范围与定量限
准确移取一定体积的混合标准储备液,用1.3前处理方法得到的空白基质液稀释,配制基质匹配标准曲线,按照已优化的色谱和质谱条件进行分析,以混合标准溶液的质量浓度为横坐标,各目标物定量离子峰面积为纵坐标,做线性回归,结果显示9种AGs在20~1 000 ng/mL范围内,线性关系良好(R2>0.995)。
以不含待测组分的蜂蜜为空白样品,采用空白样品添加目标物,按照1.3前处理方法进行处理,并上机测定,以定量离子色谱峰的信噪比(S/N)≥10为方法的定量限,计算9种AGs的定量限,具体参数列于表2。
2.5 方法回收率与精密度
对蜂蜜样品分别进行3个质量浓度水平(50、100、200 μg/kg)的空白加标回收实验,每个添加水平取6个平行样品,按1.3和1.4实验条件进行前处理和测定,计算各个分析物的平均回收率和精密度。
由表3可以看出,被分析物的平均回收率在72.6%~109.4%,相对标准偏差为2.13%~8.23%,表明该方法的准确度和精密度良好,能够满足蜂蜜样品中9种AGs药物的检测要求。
表2 九种AGs药物的线性范围、回归方程、
相关系数和定量限
Table 2 Linear ranges, regression equations,
correlation coefficients and LOQs of 9 AGs
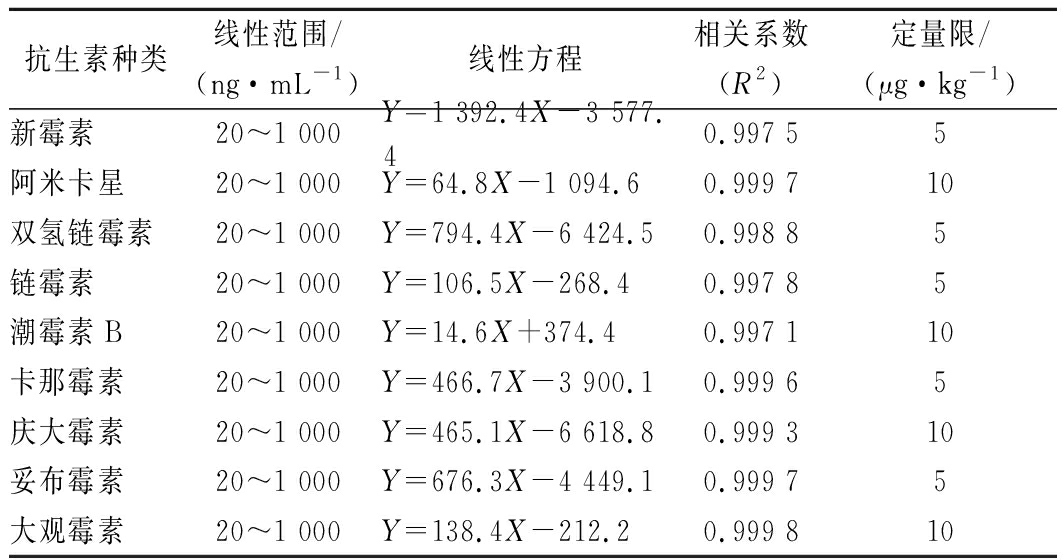
抗生素种类线性范围/(ng·mL-1)线性方程相关系数(R2)定量限/(μg·kg-1)新霉素20~1 000Y=1 392.4X-3 577.40.997 55阿米卡星20~1 000Y=64.8X-1 094.60.999 710双氢链霉素20~1 000Y=794.4X-6 424.50.998 85链霉素20~1 000Y=106.5X-268.40.997 85潮霉素B20~1 000Y=14.6X+374.40.997 110卡那霉素20~1 000Y=466.7X-3 900.10.999 65庆大霉素20~1 000Y=465.1X-6 618.80.999 310妥布霉素20~1 000Y=676.3X-4 449.10.999 75大观霉素20~1 000Y=138.4X-212.20.999 810
表3 蜂蜜样品中9种AGs药物的回收率和相对
标准偏差(n=6)
Table 3 Recoveries and RSDs of 9 AGs in honey
samples(n=6)
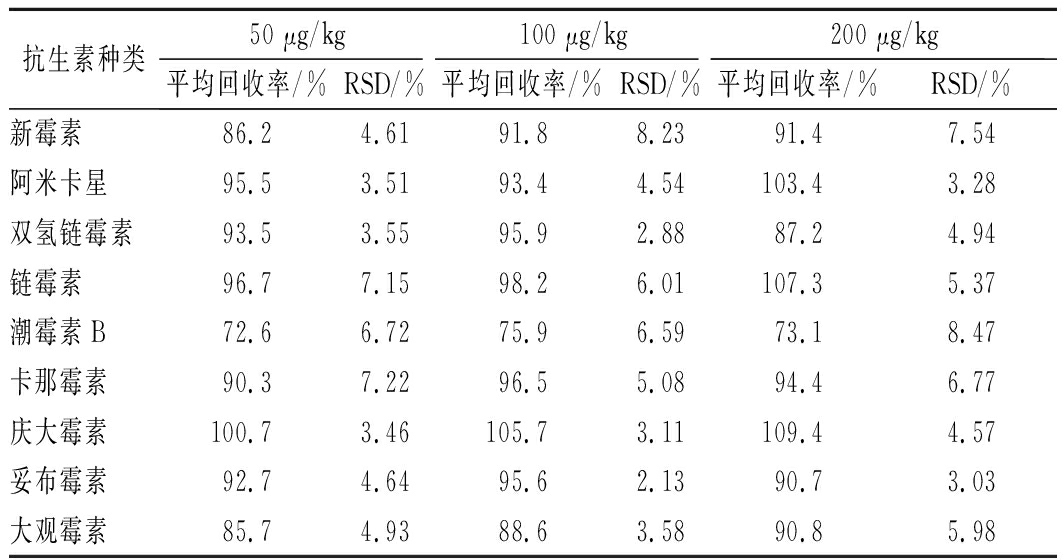
抗生素种类50 μg/kg100 μg/kg200 μg/kg平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%新霉素86.24.6191.88.2391.47.54阿米卡星95.53.5193.44.54103.43.28双氢链霉素93.53.5595.92.8887.24.94链霉素96.77.1598.26.01107.35.37潮霉素B72.66.7275.96.5973.18.47卡那霉素90.37.2296.55.0894.46.77庆大霉素100.73.46105.73.11109.44.57妥布霉素92.74.6495.62.1390.73.03大观霉素85.74.9388.63.5890.85.98
2.6 实际样品测定结果
经过确认的方法应用于实际蜂蜜样品的9种AGs药物残留量的测定,以考察该方法的适用性。选取了本实验室在流通环节抽取的53批次的蜂蜜样品作为检测对象,其中有2批次样品中链霉素有检出,检测值分别为29.7 μg/kg和62.1 μg/kg,其他8种AGs药物均未检出。检测结果表明,链霉素作为杀菌类药物在养蜂业中被使用。
3 结论
本研究使用三氯乙酸的缓冲盐溶液提取目标物,以HLB固相萃取柱富集净化,选择水性洗脱液洗脱,在最终提取液中添加离子对试剂优化色谱行为,选取乙腈-水体系作为流动相,采用反相色谱柱进行分离,建立了同时测定蜂蜜样品中妥布霉素、庆大霉素、卡那霉素、潮霉素B、阿米卡星、新霉素、大观霉素、链霉素、双氢链霉素9种氨基糖苷类药物残留的超高效液相色谱串联质谱法。该方法操作简单,灵敏度高,净化效果好,在流动相中避免使用离子对试剂,有效减少了对质谱仪的污染,各项目标参数均达到日常检测的技术要求,能够较好满足蜂蜜中氨基糖苷类药物残留检测的需要。
[1] 马伟, 胥传来. 动物源食品中氨基糖苷类抗生素多残留免疫检测方法研究进展[J].食品科学,2009, 30(11): 289-292.
[2] 高玲,张丹,高峰,等.水产品中氨基糖苷类药物残留的高效液相色谱-串联质谱检测方法研究[J]. 中国兽药杂志, 2012, 46(11): 27-30.
[3] 何强,孔祥虹,赵洁,等.奶粉中链霉素与双氢链霉素残留量的超高效液相色谱-串联质谱法测定[J].分析测试学报,2010,29(7):691-694.
[4] 吴映璇,林峰,姚仰勋.亲水作用色谱-质谱法同时检测鱼肉中链霉素和双氢链霉素残留[J]. 食品安全质量检测学报,2013,4(5):1 467-1 472.
[5] 刘雪红,张秀芹,侯颖,等.超高效液相色谱-串联质谱法检测牛奶中7种氨基糖苷类药物残留[J].中国兽药杂志,2015,49(3):48-52.
[6] 高月,王耀,胡骁飞,等.氨基糖苷类药物的危害及其检测方法研究进展[J].河南农业科学,2016,45(6):9-14.
[7] 杨慧元,杜玥,徐伟东.HPLC-MS/MS测定蜂蜜中氨基糖苷类药物残留[J].中国现代应用药学,2011,28(8):751-756.
[8] VAN BRUIJNSVOORT M, OTTINK S J, JONKER K M, et al. Determination of streptomycin and dihydrostreptomycin in milk and honey by liquid chromatography with tandem mass spectrometry[J]. Journal of Chromatography A,2004,1 058(1-2):137-142.
[9] KAUFMANN A, BUTCHER P, KOLBENER P. Trace level quantification of streptomycin in honey with liquid chromatography/tandem mass spectrometry[J].Rapid Commun Mass Spectrom, 2003, 17(22): 2 575-2 577.
[10] EU No.37/2010 of 22 December 2009. On pharmacologically active substances and their classification regarding maximum residue limits in food stuffs of animal origin[S].
[11] CX/RVDF 06/16/13(Part 2)October 2005. Joint FAO/WHO food standards programmed codex committee on residues of veterinary drugs in foods sixteenth session[S].
[12] Enforcement on May 29,2006. The Japanese positive list system for agricultural chemical residues in foods[S].
[13] GB 31650—2019. 食品中兽药最大残留限量[S].
[14] 张璐,孔祥虹,何强,等.蜂蜜中兽药残留检测方法的研究进展[J].食品安全质量检测学报,2015,6(11):4 368-4 372.
[15] 付启明,欧晓明,刘红玉,等.农产品中氨基糖苷类抗生素的残留检测方法研究进展[J].农药,2009,48(11):784-789;792.
[16] 李佩佩,龙举,方益,等.液相色谱法检测动物源性食品中氨基糖苷类药物残留的研究进展[J].理化检验(化学分册),2019,55(11):1 356-1 364.
[17] 王帅兵,曲斌,耿士伟,等.亲水作用色谱-高分辨质谱测定生鲜牛乳中7种氨基糖苷类药物残留[J].动物医学进展, 2017,38(9):67-72.
[18] 徐飞,王晓琳,李晓薇,等.基于HILIC模式的超高效液相色谱-串联质谱法检测牛奶中12种氨基糖苷类药物[J].分析实验室,2018,37(4):414-418.
[19] KUMAR P, RUBIES A, COMPANY R, et al. Hydrophilic interaction chromatography for the analysis of aminoglycosides[J].Journal of Separation Science,2012,35(4):498-504.
R, et al. Hydrophilic interaction chromatography for the analysis of aminoglycosides[J].Journal of Separation Science,2012,35(4):498-504.
[20] 赵凤娟, 方恩华,韩瑞阳,等. 亲水性Obelisc R液相色谱-串联质谱法测定猪肉样品中氨基糖苷类药物残留[J].质谱学报,2018,39(1):76-84.
[21] 王志兵,高杨,刘洋,等. 微波辅助衍生-离子液体分散液液微萃取-高效液相色谱法检测牛奶中氨基糖苷类抗生素残留[J].现代食品科技,2014,30(4):260-267.
[22] 宓捷波,张敏,柴铭骏,等.亲水作用色谱-串联质谱法测定动物源食品中10种氨基糖苷类药物的残留量[J].食品研究与开发,2019,40(19):197-204.
[23] 苏晶,汤立忠,陈长毅,等.高效液相色谱串联质谱法同时测定9种龙虾中氨基糖苷类和四环素类抗生素残留[J].食品工业科技,2016,37(2):60-67.
[24] 叶磊海,钟世欢,叶佳明,等.LC-MS-MS法同时测定动物肌肉组织和牛奶10种氨基糖苷类药物的方法优化研究[J].医药化工,2016,42(12):107-109.
[25] 龚强,丁利,朱绍华,等.高效液相色谱-串联质谱法检测乳制品中10种氨基糖苷类抗生素残留[J].色谱,2012,30(11):1 143-1 147.
[26] 王强,王旭峰,赵东豪,等.免疫亲和柱净化-UPLC-MS/MS测定鱼虾肉中的3种氨基糖苷类抗生素[J].食品科学,2018,39(20):326-331.
[27] 陶大利,白鹤,李琴. SPE净化-液质联用测定氨基糖苷类药物残留[J].中国乳品工业,2019,47(2):51-53.
[28] WANG X R, YANG S P, LI Y , et al. Optimization and application of parallel solid-phase extraction coupled with ultra-high performance liquid chromatography-tandem mass spectrometry for the determination of 11 aminoglycoside residues in honey and royal jelly[J].Journal of Chromatography A,2018,1 542:28-36.
[29] 刘进玺,秦珊珊,冯书惠,等.高效液相色谱-串联质谱法测定食用菌中农药多残留的基质效应[J].食品科学, 2016,37(18):171-177.
[30] 丁葵英,许文娟,郭礼强,等.液相色谱-串联质谱法测定蔬菜中烟碱类化合物的基质效应研究[J].食品安全质量检测学报, 2019,10(10):2 949-2 954.