番茄红素是一种抗氧化活性较强的天然色素,其单态氧淬灭速率是β-胡萝卜素的2倍[1],能有效清除自由基,延缓细胞衰老,对预防前列腺癌、肺癌及心血管疾病等有显著作用[2-3],被广泛应用于食品添加剂、保健食品与化妆品等行业。目前因植物提取法存在提取率低、纯度低等问题、化学合成法存在手性基团无法控制、得率低等缺点,番茄红素的工业生产受到一定限制。而目前天然微生物合成法在发酵过程中为了阻断从番茄红素到β-胡萝卜素的合成反应,需要添加阻断剂,导致番茄红素产量和纯度较低[4]。随着合成生物学和代谢工程的发展,改造模式微生物大肠杆菌和酿酒酵母构建高效细胞工厂已经引起广泛关注[5-7]。
酿酒酵母(Saccharomyces cerevisiae, S.cerevisiae)是公认为安全无毒(generally recognized as safe,GRAS)的真核模式微生物,已成功被改造用于生产青蒿酸[8]、次丹参醌[9]、白藜芦醇[10]以及人参皂苷[11]等多种天然产物。相对大肠杆菌,酿酒酵母具有真核表达系统的翻译后修饰且不含内毒素,以其作为宿主细胞生产番茄红素具有较大竞争力。酿酒酵母本身存在萜类化合物合成的通用途径即甲羟戊酸途径(mevalonate pathway, MVA pathway)[12],萜类化合物构成的基本单元为异戊烯焦磷酸(isopentenyldiphosphate, IPP)和二甲基烯丙基焦磷酸(dimethylallyl diphosphate, DMAPP)。这2个基本单元在法尼基焦磷酸合酶(farnesyl pyrophosphate synthase, FPPS)和牻牛儿基牻牛儿基焦磷酸合酶(geranylgeranyl diphosphate synthase,GGPPS)依次催化下,得到番茄红素合成前体牻牛儿基牻牛儿基焦磷酸(GGPP)。八氢番茄红素合酶(phytoene synthase,CrtB)将2分子GGPP缩合成八氢番茄红素(phytoene),在外源八氢番茄红素脱氢酶(phytoene denydrogenase,CrtI)作用下连续四步脱氢分别合成六氢番茄红素(phytofluene)、β-胡萝卜素(β-carotene)、链孢霉素(neurosporene)和最终产物番茄红素[13]。
本研究所选择的宿主酿酒酵母中,只需外源表达CrtE、CrtB和CrtI就能得到目标产物番茄红素。然而这3个酶来源分布广泛,包括噬夏孢欧文氏菌(Erwinia uredovora)等细菌、三孢布拉氏霉菌等真菌、番茄、西瓜等植物和藻类。不同物种来源的酶的催化活性往往有很大差异[14-16],因此筛选不同来源的路径基因进行组合,根据产量确定最佳组合,提高番茄红素合成途径通量可能是有效的手段。另一方面,由于目前文献报道的番茄红素的检测方法分析时间长、不易定量[17]、需要价格昂贵的标准品[18]等缺点,需要建立一种适用于实验室范围的快速稳定的测定方法。综上,本研究首先分别在乙醇脱氢酶系(adh2、adh3、adh4)基因位点整合3个拷贝数的不同来源CrtE基因强化GGPP供给,构建不同来源CrtB、CrtI的组合游离表达质粒,转化上述GGPP供给强化的突变株,然后筛选番茄红素合成基因组合,同时建立了一种酶标仪快速测定番茄红素的方法。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒
菌株:大肠感受态Escherichia coli JM109(E.coli JM109)、酿酒酵母宿主菌YPH499△gal80,实验室保藏。
质粒:pMD19-T载体,用于TA克隆,Takara公司;酵母表达载体pY26-GPD-TEF、大肠表达载体pET28(a)+、酵母CRISPR-Cas9编辑系统质粒302、149、BTS、Cas9载体,实验室保藏。
1.1.2 工具酶、试剂及培养基
Taq mix DNA聚合酶,BIO SCI宝赛生物公司;DNA连接酶,Takara公司;限制性内切酶(BamH I、Bgl II、EcoR I、Nco I、Nhe I、Not I),Thermo Scientific公司;质粒小提试剂盒、DNA产物纯化试剂盒、琼脂糖凝胶回收试剂盒,Axygen公司;氨苄青霉素,上海生工生物工程有限公司;G418、潮霉素(hygromycin B,Hyg)、番茄红素标准品,上海源叶生物有限公司;硫酸诺尔斯菌素(nourseothricin,Nour),上海愍康生物科技有限公司;天然β-胡萝卜素标准品,麦克林;甲苯、三氯甲烷、丙酮、正己烷、二氯甲烷、石油醚、2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT),国药集团化学试剂有限公司;甲醇、乙腈、二氯甲烷,用于高效液相色谱(high performance liquid chromatography,HPLC)检测,阿拉丁aladdin;玻璃珠(0.5 mm),Sigma Aldrich公司。
培养基:LB培养基(酵母膏5 g/L、蛋白胨10 g/L、NaCl 10 g/L,固体培养基添加20 g/L琼脂粉)用于大肠杆菌的培养;YPD培养基(酵母膏10 g/L、蛋白胨20 g/L、无水葡萄糖20 g/L,固体培养基添加20 g/L琼脂粉)用于酿酒酵母的培养。
1.1.3 仪器与设备
聚合酶链式反应(polymerase chain reaction,PCR)扩增仪、小型台式高速离心机,Eppendorf公司;凝胶成像仪,BIO-RAD公司;UV-3200分光光度计,MAPADA公司;SPARK多功能酶标仪,Tecan公司;高效液相色谱仪-示差检测器,Agilent公司。
1.2 试验方法
1.2.1 不同来源CrtE、CrtB、CrtI基因的异源表达
本研究合成异源基因查询NCBI数据库,根据宿主菌酿酒酵母进行密码子优化后由金唯智(苏州)公司合成保存在pUC57质粒上(命名为pUC57-CrtE、pUC57-CrtB、pUC57-CrtI)。本研究所用到的菌株、基因和引物如表1~表3所示。
表1 本研究所用的菌株
Table 1 Strains used in this work

菌株基因型来源 YPH499△gal80MATα, his3-△200, leu2-△1, trp1-△63, ura3-52, lys2-801, ade2-101, gal80△::loxp本实验室JM109 克隆宿主本实验室499-3AtCrtEYPH499△gal80: adh2- AtCrtE, adh3- AtCrtE, adh4- AtCrtE本实验室499-3PaCrtEYPH499△gal80: adh2- PaCrtE, adh3- PaCrtE, adh4- PaCrtE本实验室499-3TmCrtEYPH499△gal80: adh2- TmCrtE, adh3- TmCrtE adh4- TmCrtE本实验室
表2 本研究所用的基因
Table 2 Gens used in this work

基因物种来源检索号AtCrtEArabidopsis thalianaNP_195399.1PaCrtEPantoea agglomeransPHP91680.1TmCrtETaxus x mediaAAS49033.1McCrtBMomordica cochinchinensisAGW16352.1PaCrtBPantoea agglomeransAAA64982.1SlCrtBSolanum lycopersicumABM45873.1XdCrtBXanthophyllomyces dendrorhousALK24265.1BtCrtIBlakeslea trisporaAAX20903.1McCrtIMomordica charantia subsp. CharantiaAAR86105.1SlCrtISolanum lycopersicumCAB59726.1XdCrtIXanthophyllomyces dendrorhousCAA75240.1
1.2.2 质粒构建
番茄红素表达质粒构建:首先以pY26-GPD-TEF质粒为模板,用引物PY26-F、PY26-R反向扩增,Nco I/Nhe I双酶切后纯化得pY26载体片段;同时以含kan基因质粒pET28(a)+为模板,用引物Kan-F、Kan-R扩增,Nco I/Nhe I双酶切后纯化得kan基因,将二者所得产物16 ℃连接6 h后转化E.coli JM109,菌落PCR验证正确后测序确认。然后将质粒醋酸锂转化酿酒酵母YPH499△gal80,涂布于YPD(添加500 mg/L G418)平板上30 ℃倒置培养,2~3 d后平板上长出转化子表明kan抗性基因的功能性存在,成功将原始pY26-GPD-TEF质粒的筛选标记替换为KanMX,命名为pY26-kan,作为番茄红素合成基因表达的骨架质粒。接着Bgl II/Not I双酶切pUC57-CrtI、pY26-kan质粒后,纯化产物并16 ℃连接6 h后转化E.coli JM109,菌落PCR验证正确后测序确认(pY26-CrtI)。最后BamH I/EcoR I双酶切pUC57-CrtB、pY26-CrtI质粒后,纯化产物并连接转化E.coli JM109,菌落PCR验证后测序确认,构建pY26-McCrtB-BtCrtI等16个不同组合的番茄红素表达质粒(表4)。
表3 本研究所用到的引物
Table 3 Primers used in this work

引物序列 (5'-3')用于构建pY26-kan质粒PY26-FCATGCCATGGGATTTATCTTCGTTTCCTGCAGPY26-RCTAGCTAGCGGCCAGCAAAACTAAAAAACTGKan-FCATGCCATGGATGAGCCATATTCAACGGGKan-RCTAGCTAGCTTAGAAAAACTCATCGAGCATCAAATG用于在adh2位点构建CrtE表达盒AtCrtE2-FGCGGATCCacaaaaagcatacaatcaactatcaactattaactatatcgtaatacacaATGGCATCAGTGACACTGGAtCrtE2-RGCAAGCTTggcatacttgataatgaaaactata-aatcgtaaagacataagagatccgcTTAGTTTTGCCTATATGCGATATAGTTCGBTS12-FGCGGATCCacaaaaagcatacaatcaactatcaactattaactatatcgtaatacacaATGGAGGCCAAGATAGATGAGBTS12-RGCAAGCTTggcatacttgataatgaaaactataaatcgtaaagacataagagatccgcTCACAATTCGGATAAGTGGTCTATPaCrtE2-FGCGGATCCacaaaaagcatacaatcaactatcaactattaactatatcgtaatacacaATGACAGTGTGCGCAGAGPaCrtE2-RGCAAGCTTggcatacttgataatgaaaactataaatcgtaaagacataagagatccgcTTATGAAACCGCCGCCAGTmCrtE2-FGCGGATCCacaaaaagcatacaatcaactatcaactattaactatatcgtaatacacaATGGCTTATACCGCAATGGTmCrtE2-RGCAAGCTTggcatacttgataatgaaaactataaatcgtaaagacataagagatccgcTTAGTTTTGCCTGAAAGCGATG用于在adh3位点构建CrtE表达盒AtCrtE3-FGCGGATCCtctgttcacagttaaaactaggaatagtatagtcataagttaacaccatcATGGCATCAGTGACACTGGAtCrtE3-R GCAAGCTTatcattataaacaaagactttcata-aaaagtttgggtgcgtaacacgctaTTAGTTTTGCCTATATGCGATATAGTTCGBTS13-FGCGGATCCtctgttcacagttaaaactaggaatagtatagtcataagttaacaccatcATGGAGGCCAAGATAGATGAGBTS13-RGCAAGCTTatcattataaacaaagactttcataaaaagtttgggtgcgtaacacgctaTCACAATTCGGATAAGTGGTCTATPaCrtE3-FGCGGATCCtctgttcacagttaaaactaggaatagtatagtcataagttaacaccatcATGACAGTGTGCGCAGAGPaCrtE3-RGCAAGCTTatcattataaacaaagactttcataaaaagtttgggtgcgtaacacgctaTTATGAAACCGCCGCCAGTmCrtE3-FGCGGATCCtctgttcacagttaaaactaggaatagtatagtcataagttaacaccatcATGGCTTATACCGCAATGGTmCrtE3-RGCAAGCTTatcattataaacaaagactttcataaaaagtttgggtgcgtaacacgctaTTAGTTTTGCCTGAAAGGATG用于在adh4位点构建CrtE表达盒AtCrtE4-FGCGGATCCccatcaacaacaagtttacatttgcaacaactaatagtcaaataagaaaAATGGCATCAGTGACACTGG
续表3

引物序列 (5'-3')AtCrtE4-R GCAAGCTTaataaataaggcacacgcataatt-gacgtttatgagttcgttcgatttttTTAGTTTTGCCTATATGCGATATAGTTCGBTS14-FGCGGATCCccatcaacaacaagtttacatttgcaacaactaatagtcaaataagaaaAATGGAGGCCAAGATAGATGAGBTS14-RGCAAGCTTaataaataaggcacacgcataattgacgtttatgagttcgttcgatttttTCACAATTCGGATAAGTGGTCTATPaCrtE4-FGCGGATCCccatcaacaacaagtttacatttgcaacaactaatagtcaaataagaaaAATGACAGTGTGCGCAGAGCPaCrtE4-RGCAAGCTTaataaataaggcacacgcataattgacgtttatgagttcgttcgatttttTTATGAAACCGCCGCCAGCTmCrtE4-FGCGGATCCccatcaacaacaagtttacatttgcaacaactaatagtcaaataagaaaAATGGCTTATACCGCAATGGTmCrtE4-RGCAAGCTTaataaataaggcacacgcataattgacgtttatgagttcgttcgatttttTTAGTTTTGCCTGAAAGCGATG用于构建gRNA质粒gRNA(471 bp)-FAAGGAGGGTATTCTGGGCCTCCATGTCgRNA(471 bp)-RTCTGCAGAATTCGTCGACGAGCTCGGTACgRNA149bp(ADH2)-FGATAAGCCAACTACCTTTATgttttagagctagaaatagcaaggRNA302bp(ADH2)-RATAAAGGTAGTTGGCTTATCgatcatttatctttcactgcggaggRNA149bp(ADH3)-FGAACGTCAACATTGTTCACCgttttagagctagaaatagcaaggRNA302bp(ADH3)-RGGTGAACAATGTTGACGTTCgatcatttatctttcactgcggaggRNA149bp(ADH4)-FGGATCGTTGACAGCAACAGCgttttagagctagaaatagcaaggRNA302bpADH4)-RGCTGTTGCTGTCAACGATCCgatcatttatctttcactgcggag用于PCR验证CrtE基因整合JP-ADH2FCCATCCACTTCACGAGACTGJP-ADH3FTCACGTGTCGCATCACTCJP-ADH4FGTCAGATGCTTGGGATCACJP-ARGCCTTATTCACCAGTTCAGCJP-PRGCAGGCCAAGTCCAATAACJP-TRCACTGTTTGTATGGCAAAGAAC
注:引物序列中小写字母代表同源臂,加粗字母代表酶切位点
表4 本研究所用的质粒
Table 4 Plasmids used in this work

质粒特征来源pY26-GPD-TEF大肠杆菌/酿酒酵母穿梭双克隆质粒,Ura3筛选标记,2 μm,Ampr本实验室pY26-kanpY26-GPD-TEF替换Ura3为KanMX本研究pY26-McCrtB-BtCrtIpY26-kan: McCrtB, BtCrtI本研究pY26-McCrtB-McCrtIpY26-kan: McCrtB, McCrtI本研究pY26-McCrtB-SlCrtIpY26-kan: McCrtB, SlCrtI本研究pY26-McCrtB-XdCrtIpY26-kan: McCrtB, XdCrtI本研究pY26-PaCrtB-BtCrtIpY26-kan: PaCrtB, BtCrtI本研究pY26-PaCrtB-McCrtIpY26-kan: PaCrtB, McCrtI本研究pY26-PaCrtB-SlCrtIpY26-kan: PaCrtB, SlCrtI本研究pY26-PaCrtB-XdCrtIpY26-kan: PaCrtB, XdCrtI本研究pY26-SlCrtB-BtCrtIpY26-kan: SlCrtB, BtCrtI本研究pY26-SlCrtB-McCrtIpY26-kan: SlCrtB, McCrtI本研究pY26-SlCrtB-SlCrtIpY26-kan: SlCrtB, SlCrtI本研究pY26-SlCrtB-XdCrtIpY26-kan: SlCrtB, XdCrtI本研究pY26-XdCrtB- BtCrtIpY26-kan: XdCrtB, BtCrtI本研究pY26-XdCrtB-McCrtIpY26-kan: XdCrtB, McCrtI本研究pY26-XdCrtB-SlCrtIpY26-kan: XdCrtB, SlCrtI本研究pY26-XdCrtB-XdCrtIpY26-kan: XdCrtB, XdCrtI本研究Module1pMD19-T:ADH2 Larm-AtCrtE-ADH2 Rarm本研究Module2pMD19-T:ADH3 Larm-AtCrtE-ADH3 Rarm本研究Module3pMD19-T:ADH4 Larm-AtCrtE-ADH4 Rarm本研究Module4pMD19-T:ADH2 Larm-PaCrtE-ADH2 Rarm本研究Module5pMD19-T:ADH3 Larm-PaCrtE-ADH3 Rarm本研究Module6pMD19-T:ADH4 Larm-PaCrtE-ADH4 Rarm本研究Module7pMD19-T:ADH2 Larm-TmCrtE-ADH2 Rarm本研究Module8pMD19-T:ADH3 Larm-TmCrtE-ADH3 Rarm本研究Module9pMD19-T:ADH4 Larm-TmCrtE-ADH4 Rarm本研究
模块整合质粒构建:以pUC57-AtCrtE为模板,扩增出两端带有adh2 up(adh2基因起始密码子上游50 bp)和adh2 down(adh2 基因终止密码子下游50 bp)的片段连接pMD19-T,命名为Module1;其他模块类似方法构建并命名。
酿酒酵母CRISPR-Cas9编辑系统质粒构建:以302质粒为模板,用gRNA302bp-F/gRNA302bp(ADH2)-R引物扩增得到302 bp片段;同时以149质粒为模板gRNA149bp(ADH2)-F/gRNA149bp-R引物扩增得到149 bp片段;再以302 bp和149 bp片段为模板,用gRNA302bp-F/gRNA149bp-R融合PCR得到472 bp片段后BamH I/Bcu I双酶切纯化;sgRNA骨架质粒BTS BamH I/Bcu I双酶切纯化,将2个纯化产物连接转化E.coli JM109。菌落PCR验证正确后测序确认,命名为gRNA-ADH2。并用相同方法构建adh3、adh4位点sgRNA质粒。
1.2.3 模块整合基因组和转化子筛选
以上模块测序正确后,用限制性内切酶BamH I/Hind III切下Module1-Module9,并加入对应gRNA质粒醋酸锂转化已经转化了Cas9质粒的酿酒酵母YPH499△gal80,在YPD-Nour-Hyg平板上30 ℃恒温倒置培养2~3 d,直至长出单菌落。在整合位点起始密码子上游300 bp和整合表达的基因起始密码子下游300 bp设计验证引物,菌落PCR验证正确后,抽提基因组进一步验证。以基因组为模板,用验证引物对扩增出500 bp左右的片段送出测序,以YPH499△gal80基因组序列作为阴性对照、基因序列作为阳性对照比对。比对正确的单菌落接到YPD(添加100 mg/L Nour)培养基中,继续整合下一个位点,最终构建得到AtCrtE、PaCrtE、TmCrtE分别在adh2、adh3、adh4三个位点整合的重组菌499-3AtCrtE、499-3PaCrtE、499-3TmCrtE(表1)。
在上述3个GGPP强化供给的工程菌中分别转入16个不同组合的番茄红素游离表达质粒,在YPD-G418平板上30 ℃恒温倒置培养2~3 d,直至长出单菌落,根据颜色鉴别筛选出颜色较深的工程菌。
1.2.4 摇瓶发酵
将筛选到的工程菌接种到添加500 mg/L YPD液体培养基中30 ℃,220 r/min摇瓶培养24 h制备种子液,检测OD600。以最终OD600=0.5转接至含50 mL YPD液体培养基(添加500 mg/L G418)的三角瓶中,30 ℃,220 r/min摇瓶培养72 h检测中间过程生长OD600、细胞干重及最终产物含量。
1.2.5 番茄红素快速检测方法的探究
不同溶剂中番茄红素和β-胡萝卜素的吸收图谱:取10个小烧杯,分别称取5份1 mg番茄红素标准品和5份1 mg β-胡萝卜素标准品,加入小烧杯中,分别用甲苯、三氯甲烷、丙酮、正己烷、含2%(体积分数)二氯甲烷的石油醚溶解倒入25 mL的容量瓶中,定容后配成不同溶剂下的番茄红素标准溶液和β-胡萝卜素标准溶液。用分光光度计在400~600 nm范围内扫描吸收值。
正己烷中番茄红素标准曲线的制作:称取番茄红素标准品1.25 mg,加入烧杯中用正己烷溶解后倒入25 mL容量瓶中,定容后配制成质量浓度为50 mg/L 的标准品溶液,分别稀释成0.01、0.02、0.025、0.05、0.1、0.2、0.3、0.4、0.5、1、2、3、4、6、8、10、12、15、20、25、30、35、40和45 mg/L不同浓度的稀释液。以正己烷作为空白对照,分别吸取200 μL至96孔酶标板,在最大吸收波长472 nm处测定吸光值。每个浓度样品重复3个平行样,室温测得吸光值后制作标准曲线,并确定检测限。
1.2.6 番茄红素提取与检测
胞内番茄红素含量的检测:取6管发酵液,每管取收集1.5 mL发酵液于12 000 r/min离心3 min,无菌水清洗后,加适量体积的玻璃珠和1 mL提取液(含10 g/L BHT的丙酮),振荡破碎3 min,冰浴1 min,重复5次,12 000 r/min离心10 min,取上清液;再加入1 mL提取液提取后将6管所得的上清液合并;上清液用液氮吹干后,用正己烷溶解并用0.22 μm有机膜过滤,用酶标仪检测OD472。
HPLC检测:以Waters Xbridge BEH C18为色谱柱(150 mm×2.1 mm 3 μm),V(乙腈)∶V(甲醇)∶V(二氯甲烷)=21∶21∶8为流动相,流速1.0 mL/min,柱温30 ℃,检测波长472 nm。
2 结果与分析
2.1 强化前体供应工程菌的构建和生产番茄红素酿酒酵母细胞的初筛
本研究分别选取不同物种(植物、真菌、细菌)来源的3种CrtE、4种CrtB和4种CrtI进行密码子优化,来源包括模式植物拟南芥(Arabidopsis thaliana, At)、曼地亚红豆杉、番茄(Solanum lycopersicum, Sl)、葫芦科苦瓜属的木鳖果(Momordica cochinchinensis, Mc)、苦瓜(Momordica charantia subsp. Charantia, Mc)、成团泛菌、三孢布拉氏霉菌、红法夫酵母。用CRISPR-Cas9的方法分别在宿主菌YPH499△gal80中乙醇脱氢酶系的adh2、adh3、adh4基因的开放阅读框(open reading frame, ORF)整合3个拷贝数的AtCrtE、PaCrtE和TmCrtE,阳性克隆经过特异性引物验证后(图1),得到前体强化菌499-3AtCrtE、499-3PaCrtE和499-3TmCrtE。菌落PCR验证引物JP-ADH2F、JP-ADH3F、JP-ADH4F分别在adh2、adh3、adh4基因位点上游300 bp左右,JP-AR、JP-PR、JP-TR在整合基因AtCrtE、PaCrtE和TmCrtE 300 bp左右。
双基因表达质粒pY26-kan的基础上,将McCrtB、PaCrtB、SlCrtB、XdCrtB、BtCrtI、McCrtI、SlCrtI和XdCrtI进行组合得到16个番茄红素表达质粒(表4),分别转入499-3AtCrtE、499-3PaCrtE和499-3TmCrtE这3株强化GGPP供应的重组菌中,转化后涂布G418平板,形成48株重组菌,结果如图2所示。通过观察颜色发现,相比较宿主菌YPH499△gal80,有9株菌有颜色(AtE-PaB-BtI、PaE-PaB-BtI、PaE-McB-BtI、PaE-XdB-BtI、PaE-XdB-XdI、TmE-PaB-BtI、TmE-PaB-XdI、TmE-XdB-BtI和TmE-XdB-XdI),其余菌均为白色,其中499-3TmCrtE转入pY26-PaCrtB-BtCrtI质粒的重组菌(命名为TmE-PaB-BtI)颜色较深,最终筛选得到1株最优组合的菌株,即TmCrtE、PaCrtB、BtCrtI。
CrtE所编码的GGPPS是番茄红素合成路径中的关键限速酶,由图2-b、2-c、2-g可知,当转入相同质粒pY26-PaCrtB-BtCrt时,含TmCrtE菌株颜色最深,含PaCrtE菌株次之,含AtCrtE菌株颜色最浅。由图2-c和2-d可知,木鳖果McCrtB和三孢布拉霉氏菌来源BtCrtI组合后菌体呈浅黄色,而成团泛菌PaCrtB和BtCrtI组合后菌体呈浅黄色但较前者深,因此木鳖果来源McCrtB在酿酒酵母中表达并不是一个好的选择。由图2-g~2-j可知,PaB-BtI、XdB-BtI、XdB-XdI 3个组合的菌颜色都较深。

a-工程菌499-3AtCrtE;b-工程菌499-3PaCrtE;c-工程菌499-3TmCrtE
图1 工程菌499-3AtCrtE、499-3PaCrtE和499-3TmCrtE的PCR验证
Fig.1 PCR verification of strains 499-3AtCrtE, 499-3PaCrtE and 499-3TmCrtE
注:a图中, M为DNA分子量标准;泳道1,2,3为YPH499△gal80阴性对照的PCR产物;泳道4,5,6为499-3AtCrtE的PCR产物。引物
JP-ADH2F/JP-AR用于验证AtCrtE基因在adh2位点的整合(泳道1和4),引物JP-ADH3F/JP-AR用于验证AtCrtE基因在adh3位点的整合
(泳道2和5),引物JP-ADH4F/JP-AR用于验证AtCrtE基因在adh4位点的整合(泳道3和6)。b图中, M为DNA分子量标准;泳道1,2,3为
YPH499△gal80阴性对照的PCR产物;泳道4,5,6为499-3PaCrtE的PCR产物。引物JP-ADH2F/JP-PR用于验证PaCrtE基因在adh2位点
的整合(泳道1和4),引物JP-ADH3F/JP-PR用于验证PaCrtE基因在adh3位点的整合(泳道2和5),引物JP-ADH4F/JP-PR用于验证
PaCrtE基因在adh4位点的整合(泳道3和6)。c图中,M为DNA分子量标准;泳道1,2,3为YPH499△gal80阴性对照的PCR产物;泳道
4,5,6为499-3TmCrtE的PCR产物。引物JP-ADH2F/JP-TR用于验证TmCrtE基因在adh2位点的整合(泳道1和4),引物JP-ADH3F/JP-TR
用于验证TmCrtE基因在adh3位点的整合(泳道2和5),引物JP-ADH4F/JP-TR用于验证TmCrtE基因在adh4位点的整合(泳道3和6)

a-YPH499△gal80;b-AtE-PaB-BtI:499-3AtCrtE转入质粒pY26-
PaCrtB-BtCrtI;c-PaE-PaB-BtI:499-3PaCrtE转入质粒pY26-PaCrtB-BtCrtI;
d-PaE-McB-BtI:499-3PaCrtE转入质粒pY26-McCrtB-BtCrtI;e-PaE-
XdB-BtI:499-3PaCrtE转入质粒pY26-XdCrtB-BtCrtI;f-PaE-XdB-XdI:
499-3PaCrtE转入质粒pY26-XdCrtB-XdCrtI;g- TmE-PaB-BtI:499-
3TmCrtE转入质粒pY26-PaCrtB-BtCrtI;h-TmE-PaB-XdI:499-3TmCrtE
转入质粒pY26-PaCrtB-XdCrtI;i-TmE-XdB-BtI:499-3TmCrtE转入质粒
pY26-XdCrtB-BtCrtI;j-TmE-XdB-XdI:499-3TmCrtE转入质粒pY26-
XdCrtB-XdCrtI
图2 酿酒酵母番茄红素重组菌初筛
Fig.2 Preliminary screening of S.cerevisiae lycopene
production recombinant strains
2.2 番茄红素和β-胡萝卜素在不同溶剂中的吸收图谱
番茄红素和β-胡萝卜素由于独特的分子结构(共轭双键),在可见光范围内均有吸收。番茄红素是一种多不饱和脂肪烃,极性较低,基本不溶于水,在多元醇(乙醇、甘油、丙二醇)中难溶,易溶于油脂溶剂中。番茄红素和β-胡萝卜素在甲苯、三氯甲烷、丙酮、正己烷及含2%(体积分数)二氯甲烷的石油醚不同溶剂中的吸收图谱如图3所示。
由图3可知,番茄红素在5种不同的溶剂中的吸收情况和吸收峰不相同。在三氯甲烷和石油醚中的番茄红素在400~600 nm有3个明显的吸收峰,位置分别在450、475、510 nm左右。在甲苯中番茄红素在450~515 nm吸收较强;在丙酮中,番茄红素在420~475 nm吸收较强,吸收峰在450 nm处;在正己烷中,番茄红素在440 nm处有吸收峰,在430~495 nm吸收较强。β-胡萝卜素在5种不同溶剂中吸收情况和吸收峰类似。溶解于5种不同溶剂中的β-胡萝卜素在420~485 nm吸收较强,且吸收峰有1~2个,其中在440~465 nm均有1个吸收峰,而在甲苯中430 nm处还有1个吸收峰。
从β-胡萝卜素对番茄红素的检测干扰程度来看,甲苯作为溶剂时番茄红素吸收较强(450~500 nm),此时β-胡萝卜素的吸收也较强,对检测干扰较大;三氯甲烷作为溶剂时在番茄红素最大吸收峰472 nm处β-胡萝卜素的吸收值高于番茄红素,对检测有较大干扰;正己烷作为溶剂时番茄红素在472 nm处有较强吸收,而β-胡萝卜素的吸收较低。丙酮和石油醚都有一定毒性,因此选择正己烷作为检测溶剂,并根据番茄红素在正己烷中的吸收图谱,选择472 nm为测定波长。
目前文献报道的番茄红素的检测方法主要有紫外分光光度法[19]、高效液相色谱法[20]、薄层色谱法[17]。液相色谱法存在程序复杂、检测时间长,薄层色谱法存在耗时长、不易定量等问题。然而酶标仪的测定仍然是基于紫外分光光度法,根据文献[19]报道,由于β-胡萝卜素分子和番茄红素分子结构均为长链多双键的脂肪烃,检测时β-胡萝卜素对番茄红素的干扰始终无法避免,但对于快速高通量检测番茄红素的产量是一种较为有效的手段。

a-甲苯;b-三氯甲烷;c-丙酮;d-正己烷;e-石油醚
图3 番茄红素和β-胡萝卜素在不同溶剂中的吸收图谱
Fig.3 Absorption spectrum of lycopene and beta-carotene in different solvent
2.3 番茄红素在正己烷中标准曲线的制作和检测范围的确定
在472 nm处测定一系列不同浓度的番茄红素标准液,以吸光值对番茄红素的质量浓度作图,得到不同浓度的番茄红素在正己烷中的吸收值(图4-a)。由图4-b 可知,番茄红素在低质量浓度0.05~12 mg/L时,吸光值和番茄红素的质量浓度成线性关系;质量浓度高于20 mg/L时,吸光值随番茄红素质量浓度的升高而增大,但没有良好的线性关系。以正己烷为溶剂测得的回归方程Y=0.070 3X+0.008 2(R2=0.997 2)。质量浓度在0.5~12 mg/L,线性关系良好,准确度高,可用来计算番茄红素产量。由图4-c可知,番茄红素标准品溶液质量浓度为0.01~0.5 mg/L时,吸收值没有良好的线性关系,因此最低检出限为0.5 mg/L。

a-0.01~50 mg/L番茄红素在正己烷中的吸收;b-番茄红素在正己烷中的标准曲线;c-低质量浓度番茄红素在正己烷中的吸收
图4 不同质量浓度的番茄红素在正己烷中的吸收
Fig.4 Absorbance of lycopene with different concentrations in hexane
2.4 番茄红素摇瓶发酵测定
为了进一步验证初筛的9株重组菌颜色鉴别结果,选择YPD基本培养基作为发酵培养基,摇瓶发酵72 h后破碎细胞,最终产量用酶标仪检测。由于摇瓶发酵规模和重组菌产量较低的限制,为了筛选生产性能最优的重组菌,仅在发酵结束时测定最终产量。从图5可知,最高产量的重组菌TmE-PaB-BtI最终产量为1.33 mg/g DCW,表明来源于曼地亚红豆杉的TmCrtE、成团泛菌的PaCrtB和三孢布拉霉氏菌的BtCrtI组合,可强化番茄红素生产能力。对比仅转入pY26-PaCrtB-BtCrtI质粒的对照菌499-PaB-BtI,当整合3个拷贝数的AtCrtE后,AtE-PaB-BtI发酵72 h时产量为0.22 mg/g DCW,提高了2倍;当整合3个拷贝数的PaCrtE后,PaE-PaB-BtI最终产量为0.35 mg/g DCW,提高了3.6倍;当整合3个拷贝数的TmCrtE后,TmE-PaB-BtI最终产量提高了16.5倍。结果表明当整合3个拷贝数的CrtE,提高了宿主菌中GGPP的积累,对番茄红素产物的积累有利,而且曼地亚红豆杉来源的TmCrtE比其他来源的CrtE对增加产物的积累更加有效。
由图6可知,工程菌的生长速度比宿主菌YPH499△gal80慢,最终生物量均有所降低。10株工程菌中,PaE-PaB-BtI生长速度最为缓慢,最终生物量降仅为宿主菌的21.5%(图6-b);PaE-XdB-BtI和TmE-PaB-XdI这2株菌生长相对较好,但最终生物量仅为宿主菌的43.9%和45.3%(图6-b、图6-c);与仅转入pY26-PaCrtB-BtCrtI质粒的对照菌499-PaB-BtI相比,整合表达3个拷贝数CrtE后对生长有一定影响,最终生物量降低33.2%~48.6%(图6-d)。
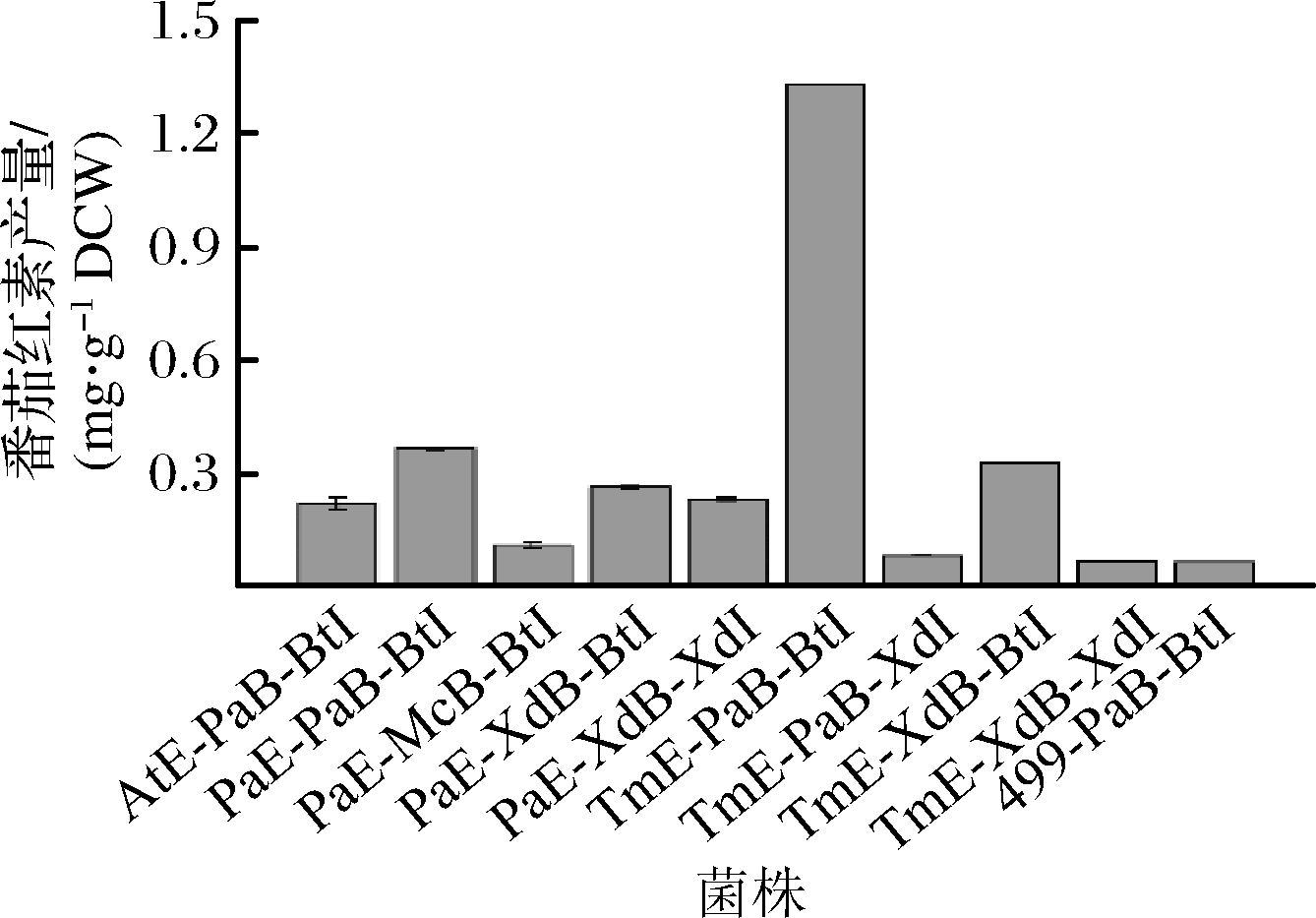
图5 酿酒酵母重组菌番茄红素产量
Fig.5 Lycopene production of recombinant S.cerevisiae strains
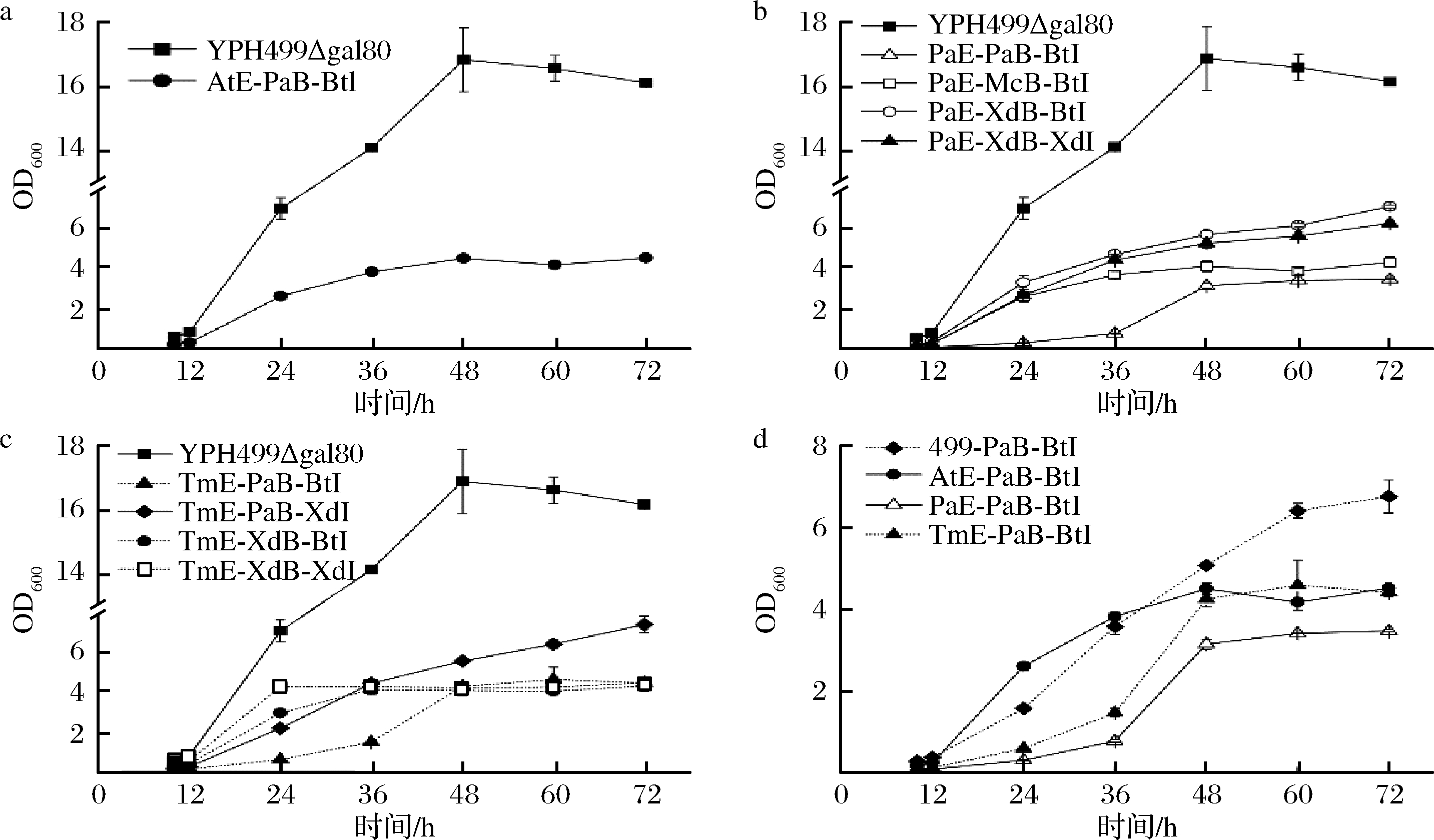
a-AtE-PaB-BtI生长曲线;b- PaE-PaB-BtI、PaE-McB-BtI、PaE-XdB-BtI、PaE-XdB-XdI生长曲线;c- TmE-PaB-BtI、TmE-PaB-XdI、
TmE-XdB-BtI、TmE-XdB-XdI生长曲线;d- 499-PaB-BtI、AtE-PaB-BtI、PaE-PaB-BtI、TmE-PaB-BtI生长曲线
图6 酿酒酵母重组菌生长曲线
Fig.6 Growth curve of recombinant S.cerevisiae strains
2.5 发酵产物HPLC验证
对筛选最佳组合TmE-PaB-BtI的产物进行HPLC验证,结果如图7所示,产物和标准品在相同时间范围内有多个出峰。
3 讨论
随着合成生物学和代谢工程的发展,研究人员针对宿主细胞和目的产物生物合成途径进行目的性改造,在生产具有重要经济价值和药用价值的化合物(萜类、黄酮类等)具有十分广阔的应用前景。目前已有很多文献报道了构建高效细胞工厂合成番茄红素的策略。KIM等[21]引入成团泛菌来源的CrtE、CrtB、和CrtI,过表达dxs和idi提高MEP通量,并引入异源强化的MVA途径从而强化IPP和DMAPP供给,最终产量达到1.35 g/L。陈艳[22]敲除GAL诱导系统,并敲除远端遗传位点ypl062w后通过对番茄红素合成路径中异源基因来源(CrtE、CrtB、和CrtI)的组合筛选,获得强化番茄红素生产能力的较优组合,利用启动子强度和整合拷贝数对关键限速酶BtCrtI进行微调,将番茄红素产量提高到40.64 mg/g DCW。
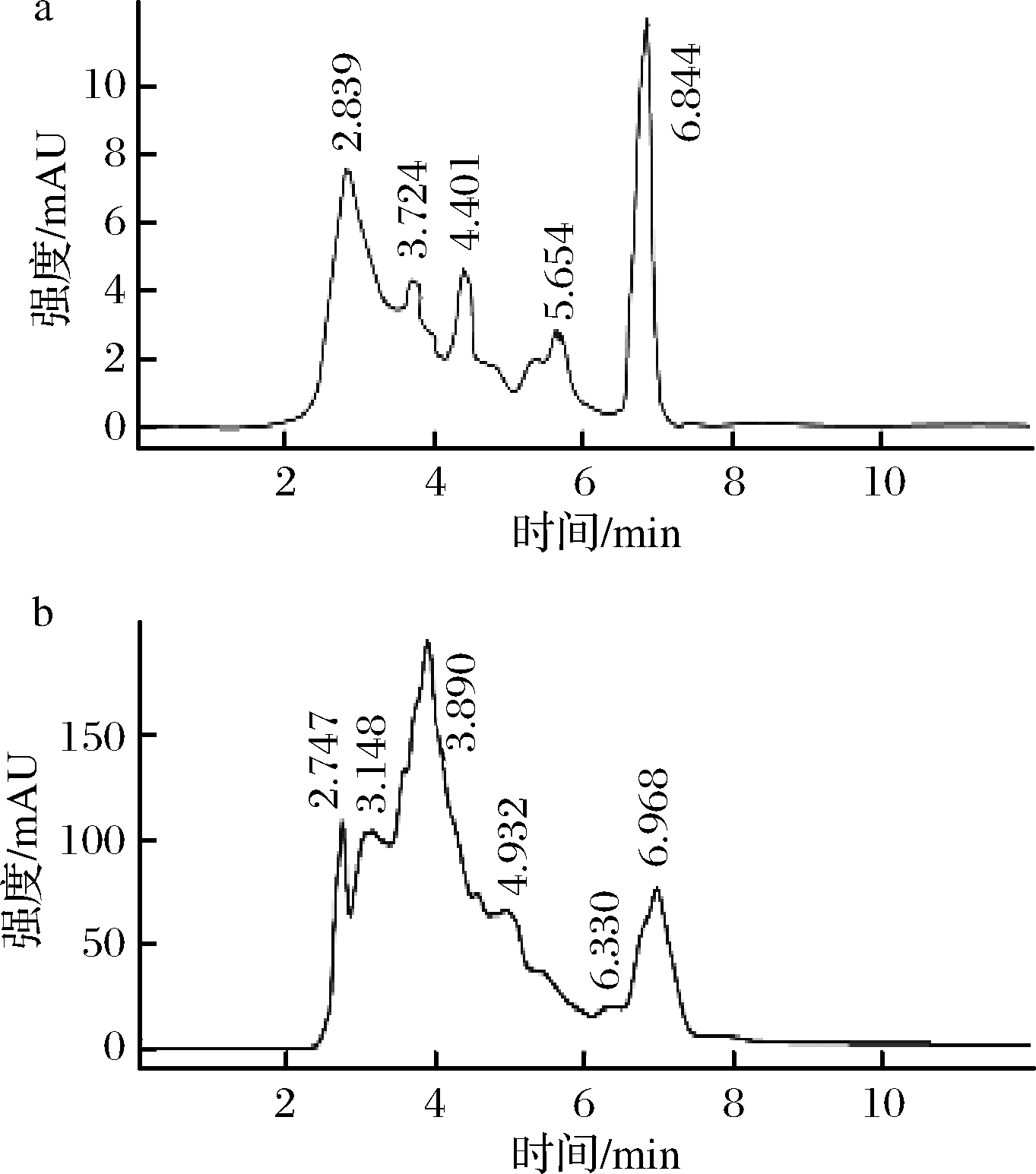
a-500 mg/L番茄红素标准品;b-TmE-PaB-BtI发酵产物
图7 番茄红素和发酵产物HPLC分析
Fig.7 HPLC analysis of lycopene and fermentation product
GGPP是酿酒酵母中番茄红素合成途径的关键前体物质[23],提高其供给能提高番茄红素合成的通量。代谢工程中利用多基因重组技术对细胞代谢途径进行定向改造,构建高效的合成途径生产番茄红素。不同物种来源的基因所编码的酶的催化性能往往具有显著差异,因此筛选不同物种来源的途径基因(CrtE、CrtB、和CrtI)进行组合优化是提高合成途径通量的有效手段。
文献报道曼地亚红豆杉来源的TmCrtE比其他来源的CrtE的底物(FPP)结合口袋更大,对FPP的亲和性更高[16],因此转入表达质粒后颜色较深。木鳖果来源McCrtB和三孢布拉霉氏菌来源BtCrtI组合后菌体呈浅黄色,而成团泛菌来源PaCrtB和BtCrtI组合后菌体呈黄色但较前者深,因此木鳖果来源McCrtB在酿酒酵母中表达并不是一个好的选择。作为虾青素生产菌的红法夫酵母能合成番茄红素,而文献已阐明CrtYB是一个双功能酶,包括八氢番茄红素合酶功能域和β-胡萝卜素环化酶功能域2个部分,因此当异源表达XdCrtB时,菌体合成的一部分番茄红素会被异构成β-胡萝卜素,最终产物不纯,因此最终筛选得到1株最优组合的菌株,即TmCrtE、PaCrtB、BtCrtI,摇瓶发酵最终产量为1.33 mg/g DCW,为进一步获得高产番茄红素细胞工厂提供基础。然而本研究发酵筛选时仅仅测定发酵结束时的产量,由于摇瓶发酵规模的限制和重组菌产量较低的问题,过程中间产量并未测定。同时为了快速高通量检测番茄红素的含量,本研究优化了传统的分光光度法,用丙酮振荡提取细胞破碎混合物,再用正己烷溶解番茄红素并用酶标仪检测。这种检测方法始终基于紫外分光光度法,产物中β-胡萝卜素对番茄红素的干扰始终是消除的,为快速检测和高通量检测提供了思路。
[1] MASCIO D P, KAISER S, SIES H. Lycopene was the most efficient biological carotenoid singlet oxygen quencher[J]. Archivers of Biochemistry and Biophysics, 1989, 274(2): 523-538.
[2] RAO A V, AGARWAL S. Role of antioxidant lycopene in cancer and heart disease[J]. Journal of the American College of Nutrition, 2000, 19(6): 563-569.
[3] ASSAR E A, VIDALLE M C, CHOPRA M, et al. Lycopene acts through inhibition of IκB kinase to suppress NF-κB signaling in human prostate and breast cancer cells[J]. Tumor Biology, 2016, 37(7): 1-11.
[4] CHOUDHARI S M, ANANTHANARAYAN L, SINGHAL R S. Use of metabolic stimulators and inhibitors for enhanced production of β-carotene and lycopene by Blakeslea trispora, NRRL 2895 and 2896[J]. Bioresource Technology, 2008, 99(8): 3 166-3 173.
[5] YE V M, BHATIA S K. Pathway engineering strategies for production of beneficial carotenoids in microbial hosts[J]. Biotechnology Letters, 2012, 34(8): 1 405-1 414.
[6] LIN Y, JAIN R, YAN Y. Microbial production of antioxidant food ingredients via metabolic engineering[J]. Current Opinion in Biotechnology, 2014, 26(7): 71-78.
[7] MA T, DENG Z, LIU T. Microbial production strategies and applications of lycopene and other terpenoids[J]. World Journal of Microbiology and Biotechnology, 2016, 32(1): 15.
[8] PADDON C J, WESTFALL P J, PITERA D J, et al. High-level semi-synthetic production of the potent antimalarial artemisinin[J]. Nature, 2013, 496(7 446): 528-532.
[9] ZHOU Y J, GAO W, RONG Q, et al. Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production[J]. Journal of the American Chemical Society, 2012, 134(6): 3 234-3 241.
[10] SYDOR T, SCHAFFER S, BOLES E. Considerable increase in resveratrol production by recombinant industrial yeast strains with use of rich medium[J]. Applied and Environmental Microbiology, 2010, 76(10): 3 361-3 363.
[11] DAI Z, LIU Y, ZHANG X, et al. Metabolic engineering of Saccharomyces cerevisiae for production of ginsenosides[J]. Metabolic Engineering, 2013, 20: 146-156.https://doi.org/10.1016/j.ymben.2013.10.004.
[12] BLOCH K, CHAYKIN S, PHILLIPS A H, et al. Mevalonic acid pyrophosphate and isopentenyl pyrophosphate[J]. Journal of Biological Chemistry, 1959, 234: 2 595-2 604.https://doi.org/10.1002/jbmte.390010408.
[13] ZHAO J, LI Q, SUN T, et al. Engineering central metabolic modules of Escherichia coli for improving beta-carotene production[J]. Metabolic Engineering, 2013(17):42-50.https://doi.org/10.1016/j.ymben.2013.02.002.
[14] CHANG J J, THIA C, LIN H Y, et al. Integrating an algal β-carotene hydroxylase gene into a designed carotenoid-biosynthesis pathway increases carotenoid production in yeast[J]. Bioresource Technology, 2015, 184: 2-8.https://doi.org/10.1016/j.biortech.2014.11.097.
[15] SARRIA S, WONG B, GARC A M H, et al. Microbial synthesis of pinene[J]. ACS Synthetic Biology, 2014,3(7): 466-475.
A M H, et al. Microbial synthesis of pinene[J]. ACS Synthetic Biology, 2014,3(7): 466-475.
[16] DING M Z, YAN H F, LI L F, et al. Biosynthesis of taxadiene in Saccharomyces cerevisiae: Selection of geranylgeranyl diphosphate synthase directed by a computer-aided docking strategy[J]. Plos One, 2014, 9(10): e109 348.
[17] 邸进申, 王燕燕, 郑辉杰, 等. 番茄红素的层析分离[J]. 精细化工, 2003, 20(4): 215-217.
[18] 孙国新, 王德才, 孙长颢. 反相高效液相色谱法测定番茄红素[J]. 中国公共卫生, 2003, 19(12): 1 517.
[19] 侯纯明, 何美, 周鑫. 番茄红素检测方法的建立[J]. 食品科学, 2007, 28(5): 295-298.
[20] 薛颖, 武兴德, 陈杭. 高效液相色谱法测定番茄及其制品中的番茄红素[J]. 中国食品卫生杂志, 2002, 14(5): 17-19.
[21] KIM Y S, LEE J H, KIM N H, et al. Increase of lycopene production by supplementing auxiliary carbon sources in metabolically engineered Escherichia coli[J]. Applied Microbiology and Biotechnology, 2011, 90(2): 489-497.
[22] 陈艳. 高产番茄红素酿酒酵母的设计构建与发酵过程优化[D]. 天津: 天津大学, 2017.
[23] YOON S H, KIM J E, LEE S H, et al. Engineering the lycopene synthetic pathway in E.coli, by comparison of the carotenoid carotenoid genes of Pantoea agglomerans and Pantoea ananatis[J]. Applied Microbiology and Biotechnology, 2007, 74(1): 131-139.