D-甘露醇是一种六碳线型多元醇,为白色粉末结晶,其分子式是C6H14O6,分子量是182.17,天然存在于许多植物中,例如海藻、南瓜、蘑菇、芹菜等[1-2],同时,许多微生物在体内也可以生成甘露醇[3]。由于甘露醇具有许多特性,可以被广泛应用于食品、医药、化工等行业[4-5],因此具有较大的商业价值。根据中国产业信息网发布的《2016—2022年中国甘露醇行业分析及未来前景预测报告》,目前世界甘露醇年产量约为17 000 t,年总需求量为20 000~25 000 t,缺口3 000~8 000 t,中国年生产能力约为5 000 t,国内需求量约为3 000 t,主要用于医药方面,但随着甘露醇应用领域的不断拓宽,今后几年甘露醇的需求量依然会有较大的增长,发展前景很乐观。
本文比较了生产甘露醇的方法,详细介绍了其中更具有发展前景的微生物发酵法,并提出切实可行的发展策略以期其在工业生产中早日应用。
1 甘露醇的应用
1.1 在食品领域的应用
甘露醇一般被用作功能性食品,在食品中加入甘露醇,可以使产品具有额外的营养价值[6]。由于甘露醇[7-8]的甜度约是蔗糖的一半,但是热量值比蔗糖低6.69 kJ/g,因此可以作为很好的低热量甜味剂,适合想要改善身材的肥胖人群。同时,在人体中,甘露醇的代谢过程与胰岛素无关,几乎不会引起血糖水平的变化,适合糖尿病人群[9]。甘露醇还具备一个独特的性质,由于它不具有还原基的特性,在高温条件下不会进行美拉德反应,因此可以将它涂抹在烘焙食品表面以保持食品良好的色泽。此外,在制作口香糖时,常常加入甘露醇充当增塑剂,且加入了甘露醇的口香糖往往不易与包装纸发生粘黏[10-11]。
1.2 在医药领域的应用
甘露醇可以作为一种很好的药物赋形剂[12]。一方面,它具有一定的化学惰性,不易与药品的活性成分或患者的身体发生反应;另一方面,它还具有非常低的吸湿性与抗氧化性[13-14],可以延长药品的保质期;而且其清凉的甜味也可以掩盖药品的不良味道[1]。
此外,甘露醇具有较强的渗透性[15],是效果较好的利尿剂,也可作为减少大脑和细胞水肿的渗透剂[16]。
2 甘露醇的生产方法
2.1 植物提取法
甘露醇广泛存在于自然界中,许多植物都含有甘露醇,可以一些植物为原材料,对甘露醇进行提取。其中提取效果较明显的是海藻,尤其是褐藻,褐藻中含有10%~20%(质量分数)的甘露醇[1],夏季和秋季时,褐藻内的甘露醇含量甚至能高达20%(质量分数)以上[17]。海带属于大型海生褐藻植物,从海带中提取甘露醇是中国甘露醇生产的传统手段,工业上常用的提取方法是结晶法,将提碘后的海带浸泡液多次除杂、蒸发浓缩、冷却结晶以获得甘露醇。随着科技的发展,目前科学家还对其他的一些提取方法进行探索、优化,例如利用超临界二氧化碳从植物中提取甘露醇已被证明是一种可行的手段[18];利用超声波辅助醇提技术,可以减少溶剂的使用量、缩短提取时间[19]。
海带提取法具有简单易行的优点,但同样也存在着一些缺点,例如原料受地域和季节的限制、对环境造成一定的污染、提取收率较低等。
2.2 化学合成法
目前,工业上生产甘露醇最常用的方法是化学合成法。它主要以果糖/葡萄糖混合物为底物,在高温和高压的条件下,通过镍的催化作用,对果糖/葡萄糖混合物进行加氢从而得到甘露醇。但是在这一过程中,葡萄糖和β-果糖会导致山梨醇的产生,一般情况下,果糖/葡萄糖(质量比50∶50)混合物经加氢后会产生甘露醇/山梨醇(质量比25∶75)混合物。因此需要额外的手段对甘露醇/山梨醇混合物进行分离提纯,这一过程提高了甘露醇的生产成本、降低了甘露醇的产量[20-21]。同时化学合成法还有其他的缺点,例如高温高压的条件会提高生产成本、金属催化剂的浸出会对产品造成污染等[22]。
但是与植物提取法相比,化学合成法耗时较短、生产时不受原料和季节的限制。
2.3 酶转化法
在还原型辅酶Ⅱ(nicotinamide adenine dinucleoitde phosphate,NADPH)的帮助下,果糖可以被甘露醇脱氢酶(mannitol dehydrogense,MDH)催化为甘露醇。在这个过程中,酶对NADPH的依赖性成为该方法主要的局限性。由于天然的烟酰胺辅因子难以进行生物提取和化学合成[23],所以辅酶价格昂贵,在生产过程中直接连续加入NADPH显然并不经济。为了解决这一难题,科学家开始关注辅酶再生问题。
传统手段运用了双酶体系。一种方法以葡萄糖/果糖(质量比1∶1)混合物为底物,利用MDH和葡萄糖脱氢酶(glucose dehydrogenase,GDH)同时催化果糖和葡萄糖,MDH催化果糖转化为甘露醇并使NADH转化为NAD,而GDH则催化葡萄糖生成葡萄糖酸盐并使NADH再生[24]。另一种方法利用MDH和甲酸盐脱氢酶(formate dehydrogenase,FDH)同时催化果糖和甲酸,MDH催化果糖转化成甘露醇,在这一过程中,NADH转化成NAD;与此同时FDH利用NAD将甲酸转化成CO2,并使NAD再生为NADH,二者形成一个循环,使反应可以持续地进行下去[25]。与前一种方法相比,第二种方法操作更简单且所得甘露醇纯度更高,这主要是因为CO2易与甘露醇分离。此外,辅酶再生的方法还有3种:化学法、电化学法、光化学法[26]。
总之,由于酶转化法需要考虑辅酶再生、酶保留/失活、甘露醇的可逆转化等一系列问题,所以目前没有应用于工业生产过程中。
2.4 微生物发酵法
2.4.1 真菌发酵
真菌可以通过发酵生产甘露醇,目前已报道的可产甘露醇的真菌有粗糙青霉(Penicillium scabrosum)、产黄青霉(Penicillium chrysogenum)、斜卧青霉(Penicillium decumbens)、亮白曲霉(Aspergillus candidus)等。JENNINGS[27]指出,包括甘露醇在内的许多多元醇在真菌中发挥着较重要的作用,如储存碳水化合物,作为易位化合物,调节渗透压,调节辅酶,储存还原力。SAHA等[1]筛选了11株可以产甘露醇的青霉菌属,其中P.scabrosum IBT MILA 4的产量最高,为43 g/L。但是与其他微生物相比,目前关于真菌产甘露醇的研究较少。这主要是因为利用真菌生产甘露醇的容积生产率较低(丝状真菌在分批培养产甘露醇的过程中,其容积生产率往往不超过2 g/(L·h)[8],生产过程不易控制[28],不易实现工业化。
而遗传学表明,当真菌以孢子的方式繁殖时,后代DNA与亲本DNA间没有变异,因此很难通过自然进化的方式提高真菌的甘露醇生产率[29]。DUAN等[30]通过紫外线照射及亚硝基胍将Penicillium sp.T2-8诱导生成稳定菌株Penicillium sp.T2-M10,在优化的培养条件下,突变菌株甘露醇产量是亲本菌株的2.25倍,同时,分离和纯化过程也得到了简化,这个实验为真菌发酵产甘露醇提供了一种新思路。
2.4.2 细菌发酵
2.4.2.1 乳酸菌发酵
关于细菌发酵甘露醇的研究,主要集中在乳酸菌上。近几年关于乳酸菌发酵产甘露醇的研究较多[31],主要菌属有乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、酒球菌属(Oenococcus)等。一方面,与真菌、酵母菌等其他菌株相比,许多乳酸菌发酵产甘露醇的生产力较高,例如,SAHA[32]从72种细菌中筛选了1株乳杆菌NRRL B-3693,通过糖化和发酵可以较轻松地生产超过180 g/L的甘露醇,最大产量甚至高达(227.9±1.8) g/L,而当甘露醇质量浓度达到180 g/L时,可以比较容易地被冷却结晶,减少了分离提纯的难度;另一方面,乳酸菌是食品级微生物,食品级微生物及其产物可以直接加入到食品中。将具有高甘露醇生产力的酵母菌加入到特定食品中,会使食品具有额外的营养价值,即成为功能性食品[6]。
根据己糖在乳酸菌中代谢途径的不同,往往把乳酸菌发酵分为同型发酵和异型发酵,这里分别对它们展开论述。
同型乳酸发酵通过糖酵解途径(embden meyerhof parnas pathway,EMP途径)发酵己糖,合成甘露醇。在进入EMP途径以前,葡萄糖和果糖等单糖往往先通过磷酸转移酶系统(phosphotransferase system,PTS),在相关酶的作用下被磷酸化,然后才进入EMP途径,具体代谢途径如图1所示。在同型发酵过程中,果糖-6-磷酸在甘露醇-1-磷酸脱氢酶的催化作用下转化成甘露醇-1-磷酸,然后在甘露醇-1-磷酸酶的作用下,生成甘露醇。目前关于同型乳酸发酵生产甘露醇的研究较少,这主要是因为大多数进行同型发酵的乳酸菌通常不产生甘露醇,只有当乳酸脱氢酶存在缺陷不能再生NAD,氧化还原失衡时,才会生成一些甘露醇[33],且甘露醇产量往往不如异型乳酸发酵。而且在这种条件下,可能会造成混合酸发酵,不利于甘露醇的分离纯化。NEVES等[34]报道过乳酸脱氢酶缺陷突变的植物乳杆菌积累甘露醇的过程,尽管同型乳酸发酵产甘露醇效果不大理想,但是仍被广泛用于乳品行业[35]。
异型乳酸发酵涉及磷酸戊糖途径,具体代谢途径如图2所示。一部分果糖可以在MDH的作用下消耗NADPH直接生成甘露醇,另一部分果糖/葡萄糖先转化成葡萄糖-6-磷酸,再通过葡萄糖-6-磷酸进入磷酸戊糖途径,生成多余的NADPH,使甘露醇持续产出。一般来说,1 mol果糖消耗1mol NADPH生成1 mol甘露醇,而1 mol NADPH再生需要消耗0.5 mol额外的果糖/葡萄糖,因此总糖中甘露醇的最大理论产率约为66.7%。反应中可以将果糖作为单独的底物,既用于菌体生长,又可以作为电子受体转化成甘露醇,但是由于葡萄糖价格低于果糖,所以利用葡萄糖再生NADPH是一种更经济的方法[36],在这一过程中,葡萄糖作为能量源,果糖作为电子受体[37],共同发酵。与同型乳酸发酵相比,异型乳酸发酵的生产途径明显不同,且它的甘露醇生产量远大于同型乳酸发酵[28]。OTGONBAYAR等[38]评估9种异型发酵乳酸菌,发现从泡菜中分离的柠檬明串珠菌KACC 91348P在最佳培养条件下,最大容积生产率可达14.83 g/(L·h),总产率为86.6%。
尽管乳酸发酵是一种很好的产甘露醇方法,但它同样存在着许多问题,例如生产过程中需要富含营养素(肽、氨基酸、生长因子等)的培养基,使生产成本较高[8]、容积生产率有待提高。
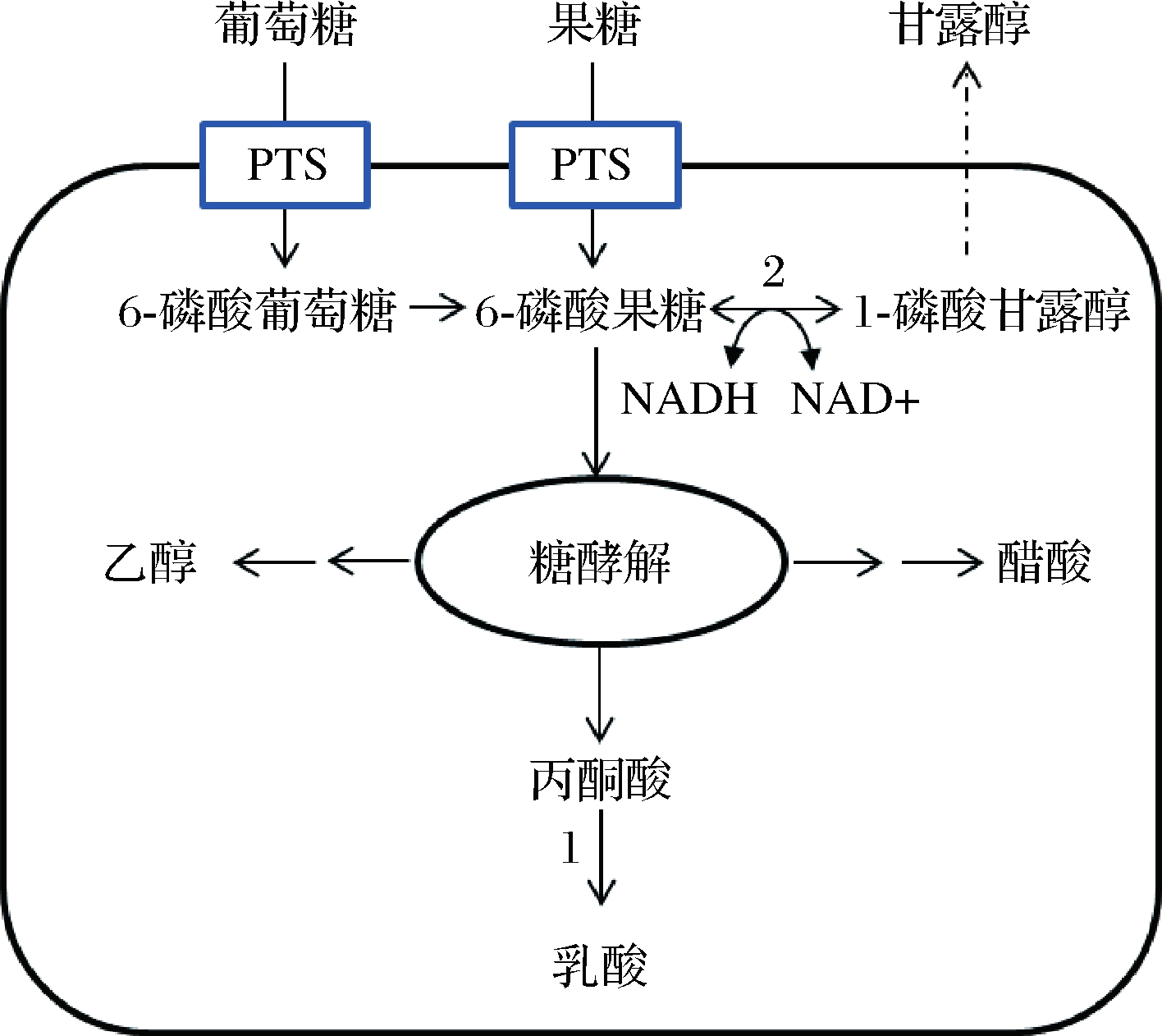
1-乳酸脱氢酶;2-甘露醇-1-磷酸脱氢酶
图1 同型乳酸发酵
Fig.1 Homologous lactic acid fermentation
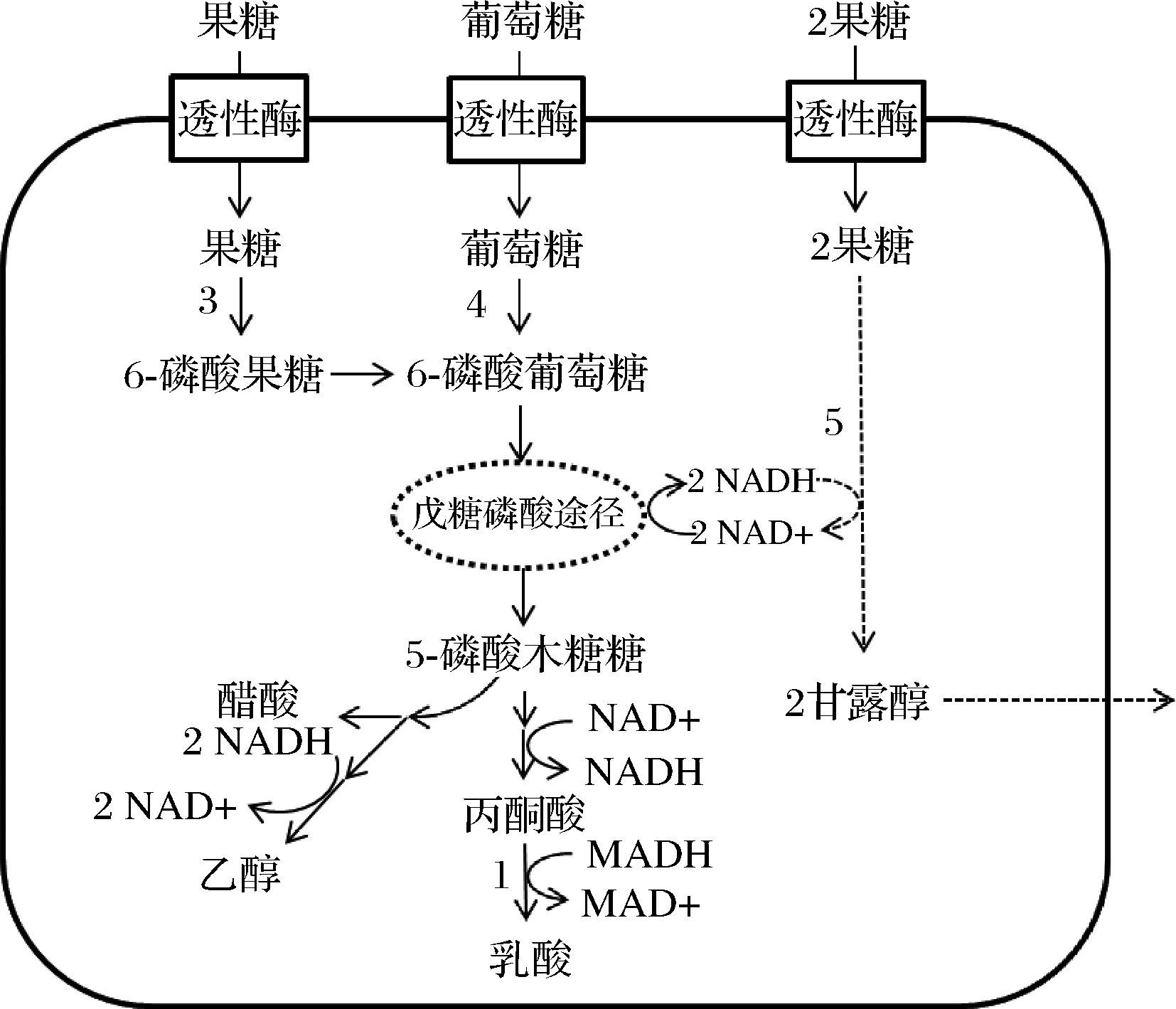
3-果糖激酶;4-葡糖激酶;5-甘露醇脱氢酶
图2 异型乳酸发酵
Fig.2 Heterolactic acid fermentation
2.4.2.2 非乳酸菌发酵
一些非乳酸菌的细菌也可以通过发酵反应产甘露醇。王海燕[39]发现霍乱弧菌的流行株与非流行株对甘露醇的发酵快慢有着显著差异,进而探讨其甘露醇发酵快慢机制。
2.4.3 酵母菌发酵
酵母菌通过发酵也可以产生甘露醇,报道中常见的菌株有木兰假丝酵母(Candida magnolias)、兽氏结合酵母(Zygosacca romycesrouxi)、球拟酵母(Torulopsis)等。SONG等[40]从1 000多株菌株中发现了1株木兰假丝酵母,在150 g/L果糖中摇床培养168 h可以产生67 g/L甘露醇,如果在发酵过程中进行补料,200 h后甘露醇的产量甚至可以高达209 g/L。由于酵母菌对高渗透压具有很好的耐受性,它们可以相对容易地存活在高浓度糖溶液中。为了抵消较高的胞外渗透压,酵母菌在生长期间会积累各种胞内多元醇,使得甘露醇的产量大大提高,多元醇的积累会略微降低水分活度,但不会对酶活性造成影响[5]。利用这一原理,MENG等[41]从甘蔗汁中分离出1株近平滑假丝酵母,该菌株可以在不添加果糖的情况下由高浓度的葡萄糖生产甘露醇,在优化发酵条件下摇瓶培养,甘露醇质量浓度可达68.5 g/L,分批补料时,终质量浓度可高达97.1 g/L,葡萄糖消耗284 g/L。该实验以高浓度葡萄糖为底物,大大降低了生产成本,为酵母菌发酵产甘露醇应用于未来的工业中提供了较好的思路。
目前,酵母菌的甘露醇容积产率总体比不上乳酸菌异型发酵[1],且在发酵过程中会再次利用甘露醇,需要继续进行改进。
3 微生物发酵产甘露醇的发展策略
综上可知,目前工业上生产甘露醇主要用的是化学合成法,与其他方法相比,微生物发酵法具有很多优点,例如不易产生副产物山梨醇、条件温和能耗低、不需要高度纯化的底物、不受原料和季节的限制、适宜大规模生产等。因此微生物发酵法具有巨大的发展潜力,有望在未来用于工业生产中。本文针对微生物发酵法,提出一些发展策略,以供参考。
3.1 菌株的选育
3.1.1 诱变
从自然界中分离得到的野生菌株在发酵性能和功能上往往具有一定的局限性,因此诱变被广泛应用于菌株的选育[42]。通常将紫外线照射与化学试剂联合使用对产甘露醇菌株进行诱变。SAVERGAVE等[21]通过使用紫外线与甲基磺酸乙酯、N-甲基-N’-硝基-N-亚硝基胍选育出1株木兰假丝酵母NCIM 3470,通过生长和生产阶段组成的两步发酵过程,甘露醇的产量最高可达240 g/L。HELANTO等[43]通过化学诱变构建了明串球菌ATCC12291突变株,经过诱变,突变体中果糖激酶活性降低10%,甘露醇产率得到了较大的提高。
3.1.2 基因工程
基因工程技术也是改善甘露醇产量的好方法。通过基因工程技术,可以改变菌体中的某些代谢途径[44],其通用原理是提高氧化还原平衡和底物利用率[35]。COSTENOBLE等[45]对酿酒酵母的甘油缺陷菌株进行了基因工程改造,将大肠杆菌mtlD人基因(编码NADH依赖性甘露醇-1-磷酸脱氢酶)转化到甘油缺陷型的酿酒酵母中,使原本不生甘露醇的野生型酿酒酵母最终可以产生甘露醇;在菌株未经历NADH失衡的条件下,即有氧条件下,如果甘油代谢未受损,甘露醇的产量会十分低,此文证明了氧化还原失衡是该突变体中形成甘露醇的驱动力。PAPAGIANNI等[46]对罗伊氏乳杆菌ATCC 55730进行研究,该菌株将磷酸酮酶途径(phosphoketolase pathway,PKP)和EMP途径同时用作具有较小通量的次级途径,通过将黑曲霉NRRL 2270菌株的6-磷酸-1-果糖激酶(6-phosphofruc tokinase-1,PFK)基因及其激活剂引入罗伊氏乳杆菌中,使得转化菌株中PFK活性增加4倍,糖酵解通量增加2.3倍,提高了菌株利用葡萄糖再生NADH的能力,使得甘露醇的产量提高至56 g/L(亲本菌株为10 g/L)。
此外,还可以通过构建工程菌生产甘露醇[47],其中较常用的工程菌是大肠杆菌。HEUSER等[48]用大肠杆菌BL21(DE3)表达了mdh、fdh、glf基因(分别编码了甘露醇脱氢酶、甲酸脱氢酶和糖促进剂),可以将果糖转化成甘露醇,为了让重组大肠杆菌具有长期稳定性,还克隆表达了甘露醇通透酶,将甘露醇的产量提高了20%。
3.2 培养条件的优化
3.2.1 使用更低成本的底物
在微生物发酵生产甘露醇的过程中,常常使用大量的果糖,其成本几乎占总生产成本的50%[49],因此有必要寻找一些低成本底物代替果糖。对于异型发酵的乳酸菌,它主要是依靠MDH催化果糖生成甘露醇,SAHA等[50]研究发现,果糖的浓度可以影响发酵的时长,而与甘露醇的产量关系不密切,可以用富含果糖成分的物质替换一部分果糖。目前具有此特点且产率较高的低成本底物有菊粉和糖蜜[49, 51]。SAHA筛选的中间乳杆菌NRRL B-3693以果糖/菊粉(质量比3∶5,总计400 g/L)混合物为底物,通过同时糖化和发酵,可以生成甘露醇(227.9±1.8) g/L[32];以糖蜜/果糖糖浆(质量比1∶1,总计150 g/L)混合物为碳源底物,用更廉价的大豆蛋白(5 g/L)和玉米浆(50 g/L)替代昂贵的细菌蛋白胨(5 g/L)与酵母提取物(5 g/L)作为氮源底物,可以生成104 g/L甘露醇。对于酵母菌,MENG等[41]直接利用含高浓度葡萄糖的选择培养基筛选了1株近平滑假丝酵母,该酵母可直接以葡萄糖为底物生成甘露醇。
3.2.2 加入金属盐离子
一些金属盐离子会影响某些糖醇的生产以及糖醇合成中涉及的酶活性,在培养基中加入适量金属盐离子,是一种经济的手段。LEE等[52]指出Ca2+可以改变木兰假丝酵母中甘露醇的渗透性,增加细胞内甘露醇的释放量,而Cu2+可以增加细胞内MDH的活性,两者一起加入,可以产生协同效应,增大甘露醇的产量。MENG等[41]从甘蔗汁筛选出1株新菌株Candida parapsilosis SK26.001,经研究发现,0.1 g/L的CaCl2提高了甘露醇的产量,验证了前者的观点;但此实验中Cu2+并没有增加甘露醇的产量,这表明不同菌株之间甘露醇的合成机理或许有差异;同时添加适量的Fe3+也对甘露醇的生产有利,这可能是因为Fe3+在氧化还原反应中起着重要的电子载体的作用。SAHA[53]报道了几种盐离子对中间乳杆菌NRRL B-3693的影响,发现MnSO4对甘露醇的生产是必须的,其质量浓度达到0.033 g/L时,可达到最大产量,同时MgSO4对甘露醇的产生也有促进作用,但两者同时加入没有协同作用。
3.2.3 选择合适的溶解氧浓度
溶解氧浓度可以通过控制摇床过程中培养基的体积和摇床转速来改变。对于乳酸菌来说,在有限的溶解氧浓度下可以达到最大的甘露醇产量,但是对于酵母菌和真菌这类好氧菌来说,往往在溶解氧浓度最大时,甘露醇的产量才达到最高值[9]。
4 展望
甘露醇是一种有益的多元醇,在食品、医药、化工等领域被广泛使用。随着经济的发展,甘露醇的需求量会越来越大。但是目前甘露醇的生产量还无法满足其需求量,因此,需要对现有的甘露醇生产方法进行改进。微生物发酵法具有众多优点,例如不易产生副产物山梨醇、条件温和能耗低、不需要高度纯化的底物、不受原料和季节的限制、适宜大规模生产等,有着应用于工业的巨大潜力,在未来,必然越来越受人们关注。异型发酵乳酸菌具有较高的生产率,酵母菌具有以高浓度葡萄糖为底物从而大大降低成本的潜力,值得科研人员进一步研究探索。
[1] SAHA B C, RACINE F M. Biotechnological production of mannitol and its applications[J]. Applied Microbiology and Biotechnology, 2011, 89(4): 879-891.
[2] STOOP J M H, WILLIAMSON J D, CONKLING M A, et al. Characterization of nad-dependent mannitol dehydrogenase from celery as affected by ions, chelators, reducing agents and metabolites[J]. Plant Science, 1998, 131(1): 43-51.
[3] YUN J W, KIM D H. A comparative study of mannitol production by two lactic acid bacteria[J]. Journal of Fermentation and Bioengineering, 1998, 85(2): 203-208.
[4] SOETAERT W. Production of D-mannitol and D-lactic acid by fermentation with leuconostoc mesenteroides[J]. Agro Food Industry Hi-Tech,1995, 6: 41-44.
[5] GROLEAU D, CHEVALIER P, YUEN T. Production of polyols and ethanol by the osmophilic yeast zygosaccharomyces-rouxii[J]. Biotechnology Letters, 1995, 17(3): 315-320.
[6] WISSELINK H, WEUSTHUIS R, EGGINK G, et al. Mannitol production by lactic acid bacteria: A review[J]. International Dairy Journal, 2002, 12(2-3): 151-161.
[7] SCHIWECK H, B R A, VOGEL R, et al. Sugar Alcohols in Ullmann’s Encyclopedia of Industrial Chemistry[M]. Weinheim:Verlag Chemie, 1994: 413.
R A, VOGEL R, et al. Sugar Alcohols in Ullmann’s Encyclopedia of Industrial Chemistry[M]. Weinheim:Verlag Chemie, 1994: 413.
[8] WEYMARN F N W, KIVIHARJU K J, J
 SKEL
SKEL INEN S T, et al. Scale-up of a new bacterial mannitol production process[J]. Biotechnology Progress, 2003, 19(3): 815-821.
INEN S T, et al. Scale-up of a new bacterial mannitol production process[J]. Biotechnology Progress, 2003, 19(3): 815-821.
[9] DAI Y, MENG Q, MU W, et al. Recent advances in the applications and biotechnological production of mannitol[J]. Journal of Functional Foods, 2017, 36: 404-409.
[10] GHOREISHI S M, SHAHRESTANI R G. Innovative strategies for engineering mannitol production[J]. Trends in Food Science & Technology, 2009, 20(6-7): 263-270.
[11] GREMBECKA M. Sugar alcohols-their role in the modern world of sweeteners: A review[J]. European Food Research and Technology, 2015, 241(1): 1-14.
[12] OHREM H L, SCHORNICK E, KALIVODA A, et al. Why is mannitol becoming more and more popular as a pharmaceutical excipient in solid dosage forms?[J].Pharmaceutical Development and Technology, 2014, 19(3): 257-262.
[13] LI X, GILMOUR P S, DONALDSON K, et al. Free radical activity and pro-inflammatory effects of particulate air pollution (pm10) in vivo and in vitro[J]. Thorax, 1996, 51(12): 1 216-1 222.
[14] ANDRÉ P, VILLAIN F. Free radical scavenging properties of mannitol and its role as a constituent of hyaluronic acid fillers: A literature review[J]. International Journal of Cosmetic Science, 2017, 39(4): 355-360.
[15] RICHTER D F E, KIRST G. D-mannitol dehydrogenase and d-mannitol-1-phosphate dehydrogenase in platymonas subcordiformis: Some characteristics and their role in osmotic adaptation[J]. Planta, 1987, 170(4): 528-534.
[16] VRANCKEN G, RIMAUX T, DE VUYST L, et al. Low-Calorie Sugars Produced by Lactic Acid Bacteria[M]. Biotechnology of Lactic Acid Bacteria: Novel Applications, 2010: 193-209.
[17] KIRK R E, OTHMER D F, MANN C A. Encyclopedia of chemical technology[J]. The Journal of Physical Chemistry, 1949, 53(4): 591.
[18] GHOREISHI S M, SHARIFI S. Modeling of supercritical extraction of mannitol from plane tree leaf [J]. Journal of Pharmaceutical and Biomedical Analysis, 2001, 24(5-6): 1 037-1 048.
[19] 陈莉, 王洁, 陈继承, 等. 响应面优化超声辅助酸解醇提海带甘露醇工艺研究[J]. 食品工业, 2017, 38(3): 1-4.
[20] RACINE F M, SAHA B C. Production of mannitol by Lactobacillus intermedius NRRL B-3693 in fed-batch and continuous cell-recycle fermentations[J]. Process Biochemistry, 2007, 42(12): 1 609-1 613.
[21] SAVERGAVE L S, GADRE R V, VAIDYA B K, et al. Two-stage fermentation process for enhanced mannitol production using Candida magnoliae mutant R9[J]. Bioprocess and Biosystems Engineering, 2013, 36(2): 193-203.
[22] BHATT S M, MOHAN A, SRIVASTAVA S K. Challenges in enzymatic route of mannitol production[J]. ISRN Biotechnol, 2013:914 187.
[23] NISHISE H, NAGAO A, TANI Y, et al. Further characterization of glycerol dehydrogenase from Cellulomonas sp. NT3060[J]. Agricultural and Biological Chemistry, 1984, 48(6): 1 603-1 609.
[24] HOWALDT M, GOTTLOB A, KULBE K D, et al. Simultaneous conversion of glucose/fructose mixtures in a membrane reactor[J]. Annals of the New York Academy of Sciences, 1988, 542: 400-405.
[25] PARMENTIER S, ARNAUT F, SOETAERT W, et al. Enzymatic production of D-mannitol with the Leuconostoc pseudomesenteroides mannitol dehydrogenase coupled to a coenzyme regeneration system[J]. Biocatalysis and Biotransformation, 2005, 23(1): 1-7.
[26] CHENAULT H K, WHITESIDES G M. Regeneration of nicotinamide cofactors for use in organic synthesis[J]. Applied Biochemistry and Biotechnology, 1987, 14(2): 147-197.
[27] JENNINGS D H. Polyol metabolism in fungi[J]. Advances in Microbial Physiology, 1985, 25: 149-193.
[28] VON WEYMARN N. Process development for mannitol production by lactid acid bacteria[D]. Helsinki: Helsinki University of Technology, 2002.
[29] PAREKH S, VINCI V A, STROBEL R J. Improvement of microbial strains and fermentation processes[J]. Applied Microbiology and Biotechnology, 2000, 54(3): 287-301.
[30] DUAN R, LI H, LI H, et al. Enhancing the production of D-mannitol by an artificial mutant of Penicillium sp. T2-M10[J]. Applied Biochemistry and Biotechnology, 2018, 186(4): 990-998.
[31] 郑琳, 金铁, 崔福顺, 等. 乳酸菌生产甘露醇的研究进展[J]. 食品工业, 2017, 38(1): 226-229.
[32] SAHA B C. Production of mannitol from inulin by simultaneous enzymatic saccharification and fermentation with Lactobacillus intermedius NRRL B-3693[J]. Enzyme and Microbial Technology, 2006, 39(5): 991-995.
[33] LEE J K, SONG J Y, KIM S Y. Controlling substrate concentration in fed-batch Candida magnoliae culture increases mannitol production[J]. Biotechnology Progress, 2003, 19(3): 768-775.
[34] NEVES A R, RAMOS A, SHEARMAN C, et al. Metabolic characterization of Lactococcus lactis deficient in lactate dehydrogenase using in vivo 13C-NMR[J]. European Journal of Biochemistry, 2000, 267(12): 3 859-3 868.
[35] PARK Y C, OH E J, JO J H, et al. Recent advances in biological production of sugar alcohols[J]. Current Opinion in Biotechnology, 2016, 37: 105-113.
[36] BAEK H, SONG K H, PARK S M, et al. Role of glucose in the bioconversion of fructose into mannitol by Candida magnoliae[J]. Biotechnology Letters, 2003, 25(10): 761-765.
[37] AXELSSON L. Lactic acid bacteria: Classification and physiology[J]. Food Science and Technology New York Marcel Dekker, 2004, 139: 1-66.
[38] OTGONBAYAR G E, EMO H J, KIM B S, et al. Mannitol production by Leuconostoc citreum KACC 91348P isolated from Kimch[J]. Journal of Mocrobiology and Biotechnology, 2011, 21(9): 968-971.
[39] 王海燕. 霍乱弧菌两类菌株甘露醇PTS基因簇功能研究及甘露醇发酵快慢机制探讨[D]. 苏州:苏州大学, 2007.
[40] SONG K H, LEE J K, SONG J Y, et al. Production of mannitol by a novel strain of Candida magnoliae[J]. Biotechnology Letters, 2002, 24(1): 9-12.
[41] MENG Q, ZHANG T, WEI W, et al. Production of mannitol from a high concentration of glucose by Candida parapsilosis SK26.001[J]. Applied Biochemistry and Biotechnology, 2017, 181(1): 391-406.
[42] WANG P M, ZHENG D Q, LIU T Z, et al. The combination of glycerol metabolic engineering and drug resistance marker-aided genome shuffling to improve very-high-gravity fermentation performances of industrial Saccharomyces cerevisiae[J]. Bioresource Technology, 2012, 108: 203-210.
[43] HELANTO M, AARNIKUNNAS J, VON WEYMARN N, et al. Improved mannitol production by a random mutant of Leuconostoc pseudomesenteroides[J]. Journal of Biotechnology, 2005, 116(3): 283-294.
[44] 赵雅童, 何光明, 瓮茹茹, 等. 甘露醇磷酸化酶基因的敲除对d-甘露醇合成的影响[J]. 生物技术通报, 2019, 35(5): 118-124.
[45] COSTENOBLE R, ADLER L, NIKLASSON C, et al. Engineering of the metabolism of Saccharomyces cerevisiae for anaerobic production of mannitol[J]. FEMS Yeast Research, 2003, 3(1): 17-25.
[46] PAPAGIANNI M, ![]() M. Increased mannitol production in Lactobacillus reuteri ATCC 55730 production strain with a modified 6-phosphofructo-1-kinase[J]. Journal of Biotechnology, 2014, 181: 20-26.
M. Increased mannitol production in Lactobacillus reuteri ATCC 55730 production strain with a modified 6-phosphofructo-1-kinase[J]. Journal of Biotechnology, 2014, 181: 20-26.
[47] YU C, CAO Y J, ZOU H B, et al. Metabolic engineering of Escherichia coli for biotechnological production of high-value organic acids and alcohols[J]. Applied Microbiology and Biotechnology, 2011, 89(3): 573-583.
[48] HEUSER F, MARIN K, KAUP B, et al. Improving d-mannitol productivity of Escherichia coli: Impact of NAD, CO2 and expression of a putative sugar permease from Leuconostoc pseudomesenteroides[J]. Metabolic Engineering, 2009, 11(3): 178-183.
[49] ZHANG M, GU L, CHENG C, et al. Recent advances in microbial production of mannitol: Utilization of low-cost substrates, strain development and regulation strategies[J]. World Journal of Microbiology and Biotechnology, 2018, 34(3): 41.
[50] SAHA B C, NAKAMURA L K. Production of mannitol and lactic acid by fermentation with Lactobacillus intermedius NRRL B-3693[J]. Biotechnology and Bioengineering, 2003, 82(7): 864-871.
[51] 罗希, 曹海龙, 张卉妍, 等. 以菊粉为底物全细胞催化生产甘露醇[J]. 大连工业大学学报, 2017, 36(4): 235-239.
[52] LEE J K, OH D K, SONG H Y, et al. Ca2+ and Cu2+ supplementation increases mannitol production by Candida magnoliae[J]. Biotechnology Letters, 2007, 29(2): 291-294.
[53] SAHA B C. Effect of salt nutrients on mannitol production by Lactobacillus intermedius NRRL B-3693[J]. Journal of Industrial Microbiology and Biotechnology, 2006, 33(10): 887-890.