抗性淀粉(resistant starch,RS)是近年来兴起的一类新型膳食纤维,又称抗酶解淀粉[1]。是一种在健康人体小肠内不能被消化吸收,但能在大肠中被细菌发酵或部分发酵代谢,产生短链脂肪酸、乳酸和少量气体的淀粉。RS具有改变结肠微生物群落,促进肠道有益菌繁殖,改善炎症反应等潜生理功能。此外,RS在改善胰岛素敏感性,调节糖脂代谢基因的表达等方面也发挥重要作用。近年来,由于其特殊生理功能, RS受到食品科学和营养学界的广泛关注。
1 抗性淀粉的分类及形成机理
1.1 抗性淀粉的来源和分类
RS存在于某些天然食品中,如马铃薯、玉米、莲子、大米等。这种淀粉较其他淀粉难降解,在小肠中不能被消化吸收,吸收和进入血液都较缓慢;类似于溶解性纤维的性质,具有一定的瘦身作用,而且可以预防多种疾病。根据其抗性机理的不同,一般可将RS分为5类:物理包埋淀粉(RS1)、抗性淀粉颗粒(RS2)、回生淀粉(RS3)、化学改性淀粉(RS4)及直链淀粉-脂肪复合淀粉(RS5)。
1.2 抗性淀粉的制备和形成机理
抗性淀粉RS1和RS2属于天然抗性淀粉,而RS3、RS4和RS5一般为人为制备而得。如表1所示,RS3的制备方法主要包括脱支酶解法、热液处理法、微波法、超声波法等。RS4是淀粉分子结构的改变以及一些化学基团的引入而产生的抗酶解淀粉片段,主要有乙酰化RS、磷酸化交联RS、羟丙基RS、酯化RS等。直链淀粉可以与脂质发生作用,产生具有抗消化性的复合物RS5,RS5的形成方式多样化,并可基于不同反应条件对所制复合物进行分析。
表1 抗性淀粉制备方法及形成机理
Table 1 Preparation methods and formation mechanism of resistant starch
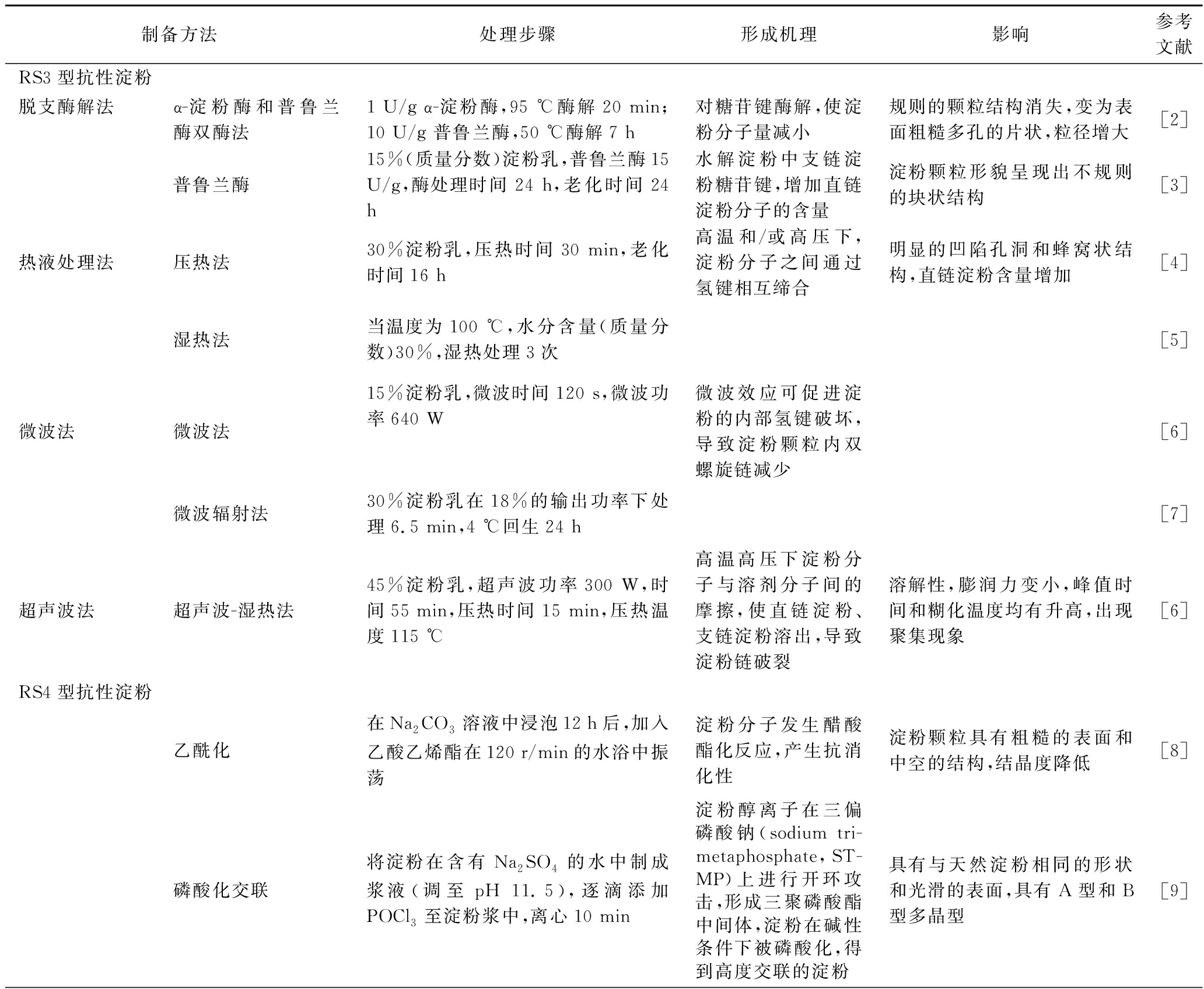
制备方法处理步骤形成机理影响参考文献RS3型抗性淀粉脱支酶解法α-淀粉酶和普鲁兰酶双酶法1 U/g α-淀粉酶,95 ℃酶解20 min;10 U/g 普鲁兰酶,50 ℃酶解7 h对糖苷键酶解,使淀粉分子量减小规则的颗粒结构消失,变为表面粗糙多孔的片状,粒径增大[2]普鲁兰酶15%(质量分数)淀粉乳,普鲁兰酶15 U/g,酶处理时间24 h,老化时间24 h水解淀粉中支链淀粉糖苷键,增加直链淀粉分子的含量淀粉颗粒形貌呈现出不规则的块状结构[3]热液处理法压热法30%淀粉乳,压热时间30 min,老化时间16 h高温和/或高压下,淀粉分子之间通过氢键相互缔合明显的凹陷孔洞和蜂窝状结构,直链淀粉含量增加[4]湿热法当温度为100 ℃,水分含量(质量分数)30%,湿热处理3次[5]微波法微波法15%淀粉乳,微波时间120 s,微波功率640 W微波效应可促进淀粉的内部氢键破坏,导致淀粉颗粒内双螺旋链减少[6]微波辐射法30%淀粉乳在18%的输出功率下处理6.5 min,4 ℃回生24 h[7]超声波法超声波-湿热法45%淀粉乳,超声波功率300 W,时间55 min,压热时间15 min,压热温度115 ℃高温高压下淀粉分子与溶剂分子间的摩擦,使直链淀粉、支链淀粉溶出,导致淀粉链破裂溶解性,膨润力变小,峰值时间和糊化温度均有升高,出现聚集现象[6]RS4型抗性淀粉乙酰化在Na2CO3溶液中浸泡12 h后,加入乙酸乙烯酯在120 r/min的水浴中振荡淀粉分子发生醋酸酯化反应,产生抗消化性淀粉颗粒具有粗糙的表面和中空的结构,结晶度降低[8]磷酸化交联将淀粉在含有Na2SO4的水中制成浆液(调至pH 11.5),逐滴添加POCl3至淀粉浆中,离心10 min淀粉醇离子在三偏磷酸钠(sodium tri-metaphosphate,ST-MP)上进行开环攻击,形成三聚磷酸酯中间体,淀粉在碱性条件下被磷酸化,得到高度交联的淀粉具有与天然淀粉相同的形状和光滑的表面,具有A型和B型多晶型[9]
续表1

制备方法处理步骤形成机理影响文献羟丙基化将10%Na2SO4添加到20%淀粉浆料中并搅拌(调至pH 10.5),加入环氧丙烷至淀粉干重的10%,搅拌30 min后,用10%HCl调节至pH 5.5羟丙基能破坏分子间和分子内的氢键,从而削弱淀粉的颗粒结构,增加非晶区淀粉链的自由度溶解度显著增加,颗粒呈折叠结构,其外侧向内拉,呈甜甜圈状[10]酯化40 ℃下干燥淀粉2 h,添加NaOH(10 mL,0.25 mol/L)至淀粉中,室温下300 r/min搅拌,滴加脂肪酸到反应容器中10 min以长链脂肪酸为原料,在温和反应条件下,用二环已基碳二亚胺(dicyclohexyl-carbodiimide,DCC)和4-二甲基吡啶(dimethyl aminopy-ridine,DMAP)对羟乙基淀粉进行酯化反应淀粉的颗粒结构被完全破坏,变性淀粉的颗粒在500~800 nm[11]RS5型抗性淀粉溶剂法HCl/KOH沉淀法加90 ℃硬脂酸溶液至直链淀粉溶液中,HCl调节体系酸度后离心(2 000 r/min 15 min),取沉淀洗涤,室温下真空干燥由于分子内氢键发生相互作用,使得直链淀粉的链状结构发生旋转,形成了易与一些疏水基团发生内络合作用的左手螺旋空腔结构直链淀粉-脂质复合物的形成降低了淀粉的溶解性,阻碍了淀粉的吸水膨胀能力,抑制了淀粉的溶胀,增加了淀粉的硬度,降低了糊化能力抑制老化,影响了淀粉体系的黏度[12]二甲亚砜/水溶液法直链淀粉加入到90 ℃下预热好的质量浓度为20 mg/mL二甲亚砜中,加入共轭亚油酸,搅拌15 min,加入NaCl溶液,3 000 r/min离心20 min,真空干燥[13]碱液分散法A 液600 mg直链淀粉溶于40 mL浓度为0.1 mol/L的KOH,B液60 mg脂肪酸溶于60 mL浓度0.1 mol/L的KOH混合,调节至30、50和70 ℃下反应[14]蒸煮法蒸汽喷射蒸煮法向1 000 mL质量浓度为12.5~100 g/L的淀粉悬浮液中加入10%(体积分数)油酸,将分散液注入蒸汽喷射蒸机,冷却脂质分子的非极性部分进入直链淀粉的螺旋空腔,螺旋内部和螺旋层之间产生了范德华力以及大量的氢键,稳定复合物结构[15]挤压蒸煮法用螺杆挤压机对玉米淀粉与棕榈酸的混合物在螺杆转速140 r/min,模孔直径12 mm,挤压温度60 ℃下进行处理[16]高压处理法超高压处理法在静水压力为500 MPa,温度为20 ℃和40 ℃的条件下与癸酸混合处理20 min极高的静压导致物料被液体介质剧烈压缩,使直链淀粉暴露出来并与脂质反应形成复合物[17]高压均质法玉米淀粉与棕榈酸混合,加热至95 ℃保持30 min后冷却70 ℃,之后将混合液置于高压均质机中(0~120 MPa)制得高压液流产生的强烈的剪切撞击和空穴作用使淀粉的颗粒结构被破坏,直链淀粉从淀粉颗粒中释放出来并与脂质形成复合物[18]
2 抗性淀粉的结构性质及分析手段
2.1 抗性淀粉的结构性质概述
不同食物来源和不同条件加工后的RS功能和营养价值,特别是其生理意义,都取决于其结构和构象特征。当前,针对RS的结构测定和分析已达到分子水平,其检测手段涉及光谱学、色谱学及热力学等多学科技术,并可通过这些技术进行各类RS结构表征的分析。RS1和RS2为天然淀粉, 其抗消化性因结晶结构、密度大等特点而产生;大颗粒淀粉的比表面积小,与酶接触的机会相对较少,从而较难消化吸收;另外,淀粉颗粒表面有一层光滑的致密层,是阻碍酶与淀粉接触、降低淀粉水解率的重要原因[19]。RS3为淀粉颗粒完全凝胶化后提取的随机线圈状直链淀粉,经冷却后高聚链重组形成由氢键连接的致密左旋双螺旋结构。螺旋单链每圈20.8 Å重复内包含6个葡萄糖单体,通过持续老化,双螺旋形成六边形晶胞[20]。RS4淀粉颗粒通常具有粗糙的表面和中空的结构,淀粉颗粒包括固体结晶区域和无定形区域。颗粒表面不如天然淀粉光滑,但是仍保持相对完整的颗粒结构,随着化学基团增加,其分子间氢键被逐渐破坏[21]。RS5是淀粉在外加条件的作用下,由于分子内氢键发生相互作用,使得直链淀粉的链状结构发生旋转,形成了具有一定热力学稳定结构的V-型晶体的左手螺旋结构。直链淀粉每包埋一个脂质分子,就需要18~24个葡萄糖单元,这些葡萄糖单元构成了每个螺旋层含有6~8个葡萄糖残基的螺旋体结构[22]。
2.2 抗性淀粉的结构性质分析方法
2.2.1 X射线衍射技术测定抗性淀粉的结晶程度
X射线衍射技术(X-ray diffraction,XRD)是一种用于测定RS结晶度及晶相组成的技术,该技术能够通过检测螺旋而反映淀粉结晶程度[23]。但是,该技术对不规则堆积的结构,小链聚集体和单螺旋结构不敏感,因此,需要与其他技术结合使用,来测定RS的完整结构。任何淀粉颗粒的物态组成都可以看成是由亚微晶、微晶和非晶态三者中的1种、 2种或3种结构组合而成。这些结晶结构呈现出特定的XRD图样,即结晶型结构呈尖峰衍射峰特征,非晶型结构呈弥散衍射峰特征,亚结晶的弥散衍射与非晶的弥散衍射存在本质上的差别,亚微晶形成的弥散衍射峰是由于晶体结晶不完全而形成的。淀粉的结晶结构呈现出特定的XRD图谱,即结晶型结构呈尖峰衍射峰特征,非晶型结构呈弥散衍射峰特征。XRD图谱由一系列离散衍射峰和几个宽峰组成,离散峰越高代表样品的结晶度越高[24]。淀粉颗粒一般表现出4类晶体结构(A、B、C和V型),主要取决于淀粉中葡聚糖链双螺旋的排列方式;通常使用Cu Kα辐射在2°~40°(2θ)内扫描样品,并通过分析演化模式及X射线衍射图上2θ处出现的峰来确定每种晶型。
结晶度的变化受RS的晶体大小、结晶量、双螺旋的取向以及双螺旋之间的相互作用程度的影响[25]。根据RS形成的工艺条件,可以得到不同的晶体结构。当在较高的温度和浓度下,存在水溶性醇和有机酸以及存在高性致溶性盐的情况下,可以形成A型晶体;较短链长的直链淀粉也容易形成A型晶体;不同的重结晶条件也对RS的多晶型类型产生影响,当淀粉凝胶在室温或更低温度下回生时,会形成B型晶体,而在70 ℃以上时淀粉凝胶会形成A型晶体结构。在通过脱支和不同重结晶方法制备RS3的过程中,发现温度循环和热湿处理有利于A型结晶形成;而由于较温和的重结晶条件,回生样品中B型晶体的含量明显增加。同样,在温度循环和加热湿气处理的样品中,发现V型结晶物质明显更高,这表明较高的温度条件能够使大量的单螺旋链变为能够使用XRD检测到的物质。但是,产生A型或B型多晶型物所需的确切的物质浓度和结晶温度取决于特定的原料。在30 ℃、50%热水溶液中结晶得到的脱支糖原也可以得到A型多晶型物,而较低的浓度或较低的温度会产生B型或C型多晶型物;与A型XRD图谱相对应的A型多晶型物具有排列紧密的单斜晶胞,由平行的左手双螺旋链组成。与B型XRD图谱相对应的B型多晶型物具有六角形晶胞,由平行的左手双螺旋链组成,其结构中包含更多的水;一些淀粉的XRD图谱为C型多晶型物,如豌豆和绿色香蕉淀粉,是A型和B型多晶型物的复合物;而V型多晶型不同于A型和B型晶体结构的双螺旋性质,由许多复杂片段的单个直链淀粉螺旋与内源性脂质复合而成[26]。
2.2.2 红外光谱技术测定抗性淀粉的分子顺序
红外光谱技术(infrared spectroscopy,IR)可用来测定链构象、螺旋度和双螺旋的结构变化[27],因此可用于测定淀粉短链分子的顺序,比较常用的是经过傅里叶变换的红外光谱检测技术(Fourier transform infrared spectroscopy,FT-IR)。在进行FT-IR测定时,通常在400~4 000 cm-1扫描RS样品,并使用溶解了RS样品的溶剂作为空白。根据实验数据将谱图的吸光度与不同化学键的振动进行比对分析,峰值强度的变化说明由于链长、范围顺序和结晶度的改变而引起淀粉结构构象变化[28]。红外光谱对淀粉构象和水合过程的变化敏感,尤其是在900~1 300 cm-1,这通常反映了C—C,C—OH和C—H的拉伸振动[29] 在995、1 047 cm-1处的能带峰反映了淀粉分子顺序和结晶度,其强度随淀粉结晶度的增加而增加。另外,1 022 cm-1处带强度的振动模式与无定形或无序相有关,1 022 cm-1处峰强度的降低表现为淀粉结晶度的降低。然而在大多数情况下,经常用1 047/1 022的强度比来表征有序度,用995/10 22的强度比来描述双螺旋结构的内部变化。其中,1 047/1 022和995/1 022的值越高,说明淀粉颗粒中结晶区比例越高[30]。ZENG等[31]研究表明,莲子RS在800~1 200 cm-1C—C,C—OH和C—H的拉伸振动弱于天然淀粉,表明莲子RS构象发生变化;ZHOU等[32]发现,与消化前的淀粉相比,在1 047/1 022 cm-1强度比下,高直链淀粉中的RS含量更高。不论水分含量如何,热处理淀粉的RS比未煮熟玉米淀粉的RS具有更大的结构组织,与在较低水分含量下处理的淀粉相比,在较高水分含量下处理的淀粉分子倾向于重组,然后形成更有组织的结构。从回生的玉米淀粉中分离出的RS中—OH基团带比天然淀粉更明显,这表明由于双螺旋的形成,结晶区以更加复杂的双螺旋顺序增加在链的末端。
研究表明,从回生玉米中分离出的RS中比天然淀粉中的羟基含量更多,这表明,无论是在链的末端,在螺旋链中,在聚集物中,还是在脂质复合物中,双螺旋结构的形成使得RS中的晶体区域增大,且双螺旋的螺旋数较高。与玉米淀粉的光谱相比,RS中的羧基带的峰更多,这表明RS中羧基的面积增加。莲子RS在1 367.22 cm-1处的吸收带对应于—CH2OH的弯曲振动比天然淀粉的吸收带窄,在3 100~3 700 cm-1的吸收带中,莲子RS的振幅也与天然淀粉的振幅不同,表明在RS形成过程中氢键组合发生了变化。对于化学修饰的RS4,在1 724 cm-1处发现乙酰化淀粉C![]() O键的拉伸振动;在玉米淀粉与柠檬酸酯化制备的RS4中也发现了1 724 cm-1的吸收峰。溴乙酰化淀粉和辛酸淀粉中还发现在1 746 cm-1的吸收峰,这可能是酯羰基的特征峰。
O键的拉伸振动;在玉米淀粉与柠檬酸酯化制备的RS4中也发现了1 724 cm-1的吸收峰。溴乙酰化淀粉和辛酸淀粉中还发现在1 746 cm-1的吸收峰,这可能是酯羰基的特征峰。
2.2.3 气相色谱-质谱技术测定抗性淀粉的糖苷键
通过气相色谱-质谱技术(gas chromatography-mass spectrometer,GC-MS)可以分析确定衍生自不同植物来源RS的糖苷键连接方式,但在应用GC-MS之前需要制备合适的衍生物[33]。GC-MS法可通过将糖转化为邻甲基化醛二醇醋酸酯来分析RS糖苷键的组成,2,3,6-三-O-甲基-D-葡萄糖的GC-MS谱峰的存在表明,RS存在一个1,4糖苷键连接的D-葡聚糖主链;2,3-二甲基-D-葡萄糖的图谱表明,RS样品中存在1,6糖苷键连接的分支,GC-MS谱图表明,2,3,4,6-四甲基-d-葡萄糖的峰来自于RS的非还原性部分。过甲基化后的GC-MS分析结果表明,从豆科植物中分离出来的纯化的RS具有1,4和1,6糖苷键分支;MAHADEVAMMA等[34]发现从加工过的鸭脚稗中纯化得到的RS是线性的a-1,4-D葡聚糖,可能是从其淀粉的直链淀粉中提取的;MAMGALA等[35]发现2,3,6-三-O-甲基-D-葡萄糖的主峰和2,3,4,6-四-O-甲基-D-葡萄糖的次峰,它们来源于1,4键相连的主链葡萄糖残基和非还原糖基。NUNES等[36]也报道了类似的结果,这些RS来源于高压灭菌的大米和小麦,其结构大多由线性a-1,4-D-葡聚糖组成。通过甲基化和GC-MS分析,发现在干燥加热后,通过甲基化分析检测到的RS中1,4糖苷键连接的葡聚糖的减少可能对还原端1,6-脱水葡萄糖形成有益,并由此得出其体外消化抗性可能是由于形成了新的糖苷键,而非多糖α-1,4和α-1,6键的结论。
2.2.4 固态13C核磁共振技术测量抗性淀粉的结构构象
固态13C核磁共振技术(solid-state 13C nuclear magnetic resonance,solid-state 13C-NMR)是一种新兴的技术,已被用于淀粉的结构分析。不同区域中的光谱信号反映了α-1,4-D-葡聚糖的碳核C1~C6的信息,C1碳化学位移为99~106 ppm;C2、C3和C5为70~79 ppm;C4的为80~84 ppm;C6的为59~62 ppm[37]。除了提供有关RS样品中双螺旋含量的信息外,固态13C-NMR还可以测定有关淀粉内部无定形和有序成分的结构特征,糖苷键的2个碳核C1和C4对聚合物构象的变化最敏感,在非晶态和结晶态材料之间通常显示出较大的化学位移[38];还可以根据晶体多晶型物的变化提供不同的信息,例如,在A型晶体多晶型物中,在100、101和102 ppm处分别存在一个峰;在B型多晶型物中,C1共振在100和101 ppm处显示双峰,这对应于直链淀粉和支链淀粉的不同糖残基[39]。在A型RS晶体结构中存在双重对称性,因此相对于相邻的双螺旋,C1位点的3个不同位点与在NMR谱上观察到的多重性是一致的;C2、C3和C5区主要显示游离直链淀粉残基产生的B型双螺旋的信息,而C4区代表无定形结构域上的信息,C4在82 ppm处出现2个宽共振峰,可能是由于非晶态引起的。
研究发现,固态13C -NMR和XRD测得的结果存在一定差异,通过固态13C-NMR测得的天然淀粉中的双螺旋含量明显高于X射线衍射测定的结晶度的含量,这表明含有不参与晶体排列的双螺旋分子存在于淀粉颗粒中。研究发现,通过13C -NMR得到的双螺旋含量和X射线衍射得到的A型或B型结晶度的范围,可以观察到粒状和挤压的玉米淀粉之间的差异,表明大多数双螺旋是微晶的一部分。经过大量消化处理后,测得挤压的样品双螺旋含量要比结晶度高,这表明许多双螺旋结构一开始就具有抗性或在消化过程中形成非晶结构。在重结晶的木薯淀粉中,双螺旋晶体的NMR值比XRD测得的结晶度高10%,表明某些双螺旋的重复性较差或排列不整齐,因此无法在XRD下衍射。根据固态13C-NMR的结果,与天然淀粉相比,莲子RS倾向于形成双螺旋结构,并且相对结晶度更高,表明重结晶在RS形成过程中获得稳定结构发挥重要作用。早期研究发现,稻米抗性淀粉C1的峰值在99~102 ppm较高,而在93~99 ppm和102~106 ppm则较低,这可能是由于稻米RS中的双螺旋含量较高。
2.2.5 扫描电子显微镜观察RS的表面特性
扫描电子显微镜(scanning electron microscope,SEM)通常用来观察RS的颗粒形态。与天然淀粉在SEM下的形态不同,未纯化的RS粉末往往具有不规则、粗糙、不均匀的形态,且结构相对松散;而通过不同处理制备的酶纯化RS的SEM图像则通常具有紧凑、致密的特点,这可能是由于糊化淀粉的再结晶所致,直链淀粉和支链淀粉分子通过氢键紧密重排,增加了RS的结晶度[40]。研究发现,在经过加热、酸或酶水解等不同处理后,纯化RS或高RS含量原淀粉中的颗粒状态会随非晶结构的消失而消失。FAN等[41]研究了香蕉果实成熟后RS的微观结构变化,与成熟初期表面光滑的淀粉颗粒相比,由于酶的作用,在果实成熟过程中,RS表现为淀粉颗粒表面粗糙皱缩。莲子RS的SEM图像显示,与天然淀粉颗粒的光滑表面相比,由于存在紧密的块状结构,原来的椭圆形消失了。在莲子RS的表面上还观察到分层条带,与在酶解纯化后的莲子RS的粗糙的表面所观察到的片状和沟壑状相比,其结构更为紧凑。
RS的制备和贮存条件对RS颗粒表面也有影响,由压热和脱支处理获得的香蕉RS在4 ℃下贮存24 h时比在较高温度下保存的样品具有更致密的结构,这可能是由于高温贮存的淀粉基质中存在较多的空腔或通道。研究发现,经压热法及老化处理制备的RS3已经消失了多孔结构,很可能是通过酶处理去除的[42]。在玉米改性RS残留物中观察到破碎,中空和半壳状颗粒,很可能是球形颗粒外层的残留物,因此发现RS更集中在球形淀粉颗粒的外层或纤维状淀粉颗粒中。由于回生使颗粒结构消失,芋头RS的结构显示出连续网状和不规则结构,并且晶体结构的增加大大提高了其对酶攻击的抵抗力。通过化学修饰制备的RS也表现出不同的SEM图像。POLESI等[42]发现柠檬酸等化学试剂可以通过通道和腔直接进入淀粉中心的松散组织区域,从而导致颗粒形态发生变化;他们的研究结果还表明,通过柠檬酸盐替代产生RS4可以防止颗粒膨胀和糊化。
3 抗性淀粉的结构对其生理功能的影响
RS具有多种潜在的生理功能,其对人体健康的作用方式主要有2种:(1)在糖代谢方面的作用,防止糖尿病、肥胖等疾病。RS在人体内的消化速度缓慢,血糖指数(glycemic index,GI)值明显低于葡萄糖。研究发现,RS能有效提高糖尿病小鼠的葡萄糖耐量,通过干预糖尿病小鼠体内的基因表达提高外周组织对胰岛素的敏感性,以达到改善胰岛素敏感性并调节糖脂代谢的目的[43]。(2)RS经肠道菌群发酵后,产生丁酸、丙酸等短链脂肪酸(short chain fatty acid,SCFAs),可参与细胞代谢,调控基因表达;同时参与肠道菌群的调节,通过对肠道微生物菌群的调控作用,促进益生菌的生长,保护肠道上皮细胞,进而预防肠道炎症。
研究发现,RS结构对肠道菌群调节功能具有一定的影响。RS可以影响结肠微生物的发酵,通过益生菌代谢产生SCFAs,使肠道不易患恶性肿瘤,并有助于改善结肠健康[44]。RS的化学和物理结构可以极大地影响发酵的速率和程度及SCFAs生成量,A型结晶比例较高的RS3,发酵性能较差,降解速度较慢,细菌产生的SCFAs和丁酸盐较少;而仅具有B型结晶的RS3具有较高的发酵能力,可以产生更高的SCFA和丁酸盐含量。具体来说,To和Tp值>110 ℃,可使体外SCFA水平在2 000~2 500 mmol/g,丁酸盐含量达30~60 mol/g;B型多晶型物也能使丁酸盐产量增加到0.79 mmol/L。RS的分子结构是决定SCFAs生成的关键因素之一,具有支链淀粉组分的RS比不具支链淀粉组分的RS具有更大的丁酸盐产量[45]。张岩[46]比较了RS2、干热法RS和压热法RS3发现,干热处理可提高SCFAs总浓度,并产生更多的丁酸,这可能是由于干热法RS的颗粒表面光滑,具有酶解孔径,该结构可能更利于微生物的利用与增殖。此外,研究者还发现,薏苡仁RS可以促进双歧杆菌的增殖,保护双歧杆菌在模拟胃肠道逆环境下的耐受性等都与其结构特性有关。比较了高直链玉米淀粉和多种方法制备的薏苡仁RS后,发现微波法制备的薏苡仁抗性淀粉(MP-SRS3)具有更粗糙的颗粒表面结构,更有利于双歧杆菌的黏附繁殖。结构和物性分析结果显示,MP-SRS3分子链具有更高的有序程度和双螺旋比例,有更稳定、更完整的结晶结构,这些均为MP-SRS3具有更好益生元功效的原因[47]。说明RS的结构对其改善肠道菌群的生理功能具有重要影响。杨春丰等[48]研究了板栗RS及消化RS,板栗RS及抗消化RS对双歧杆菌和乳酸杆菌都有显著的增殖作用,对大肠杆菌和产气荚膜梭菌有强抑制作用,而对粪肠球菌、梭状杆菌、兼性细菌无明显影响,这可能与板栗抗性淀粉表面粗糙不平的叠层结构有关。
而RS对糖代谢的调节相关机制可能是通过增加丙酸盐和醋酸盐含量从而提高胰岛素敏感性,并通过改变肠道微生物菌群提高机体抗氧化能力和减轻炎症反应。HARAZAKI等[49]实验发现,RS2能降低脂肪组织中菌脂多糖受体(CD11c)被补体受体4(CR4)的表达,CR4促进致炎因子的释放导致机体发生胰岛素抵抗从而影响餐后血糖水平和胰岛素分泌。由此推断RS的结构对糖代谢的调节机制可能存在一定影响,但是相关报道较少,仍需进一步研究。
4 结论与展望
本文综述了RS的分类、制备方法和形成机制,适合RS结构表征的几种现代检测技术的主要原理以及RS结构在肠道微生物菌群调节等生理功能方面的作用。通过RS的结构表征方法及进展的比较发现,截至目前,多数研究集中在RS结构对肠道微生物发酵及肠道微生物菌群等生理功能方面的研究,而对糖代谢机制的研究仅限于RS对糖代谢相关基因的调节,而对RS的结构对其调节的相关性探讨还比较缺乏,这是研究者在未来更应关注的问题。
[1] CHARALAMPOPOULOS D, WANG R, PANDIELLA S S, et al. Application of cereals and cereal components in functional foods: A review[J]. International Journal of Food Microbiology, 2002, 79(1-2):131-141.
[2] 李蒙娜. 小麦抗性淀粉的制备及结构性质研究[D]. 合肥: 合肥工业大学, 2019.
[3] 方桂红, 陶宇, 邓小宝, 等.酶法制备菠萝蜜籽抗性淀粉的工艺优化及特性研究[J]. 粮食与油脂, 2019, 32(4): 28-32.
[4] 冷志富. 玉米抗性淀粉的制备及其理化性质研究[D]. 杨凌: 西北农林科技大学, 2014.
[5] 黄婷婷. 复合湿热处理对甘薯慢消化淀粉形成及结构性质的影响[D]. 合肥: 合肥工业大学, 2016.
[6] 吴小婷. 不同方法制备的莲子抗性淀粉性质及其体外益生元作用的研究[D]. 福州: 福建农林大学, 2015.
[7] 潘元风, 唐书泽, 戴远威, 等. 微波辐射制备蚕豆抗性淀粉研究[J]. 食品研究与开发, 2008, 29(5): 15-18.
[8] SHA X S, XIANG Z J, BIN L, et al. Preparation and physical characteristics of resistant starch (type 4) in acetylated indica rice[J]. Food Chemistry, 2012, 134(1): 149-154.
[9] SANG Y, PRAKASH O, SEIB P A, et al. Characterization of phosphorylated cross-linked resistant starch by 31P nuclear magnetic resonance (31P NMR) spectroscopy[J]. Carbohydrate Polymers, 2007, 67(2): 201-212.
[10] EBIHARA K, SHIRAISHI R, OKUMA K, et al. Hydroxypropyl-modified potato starch increases fecal bile acid excretion in rats[J]. The Journal of Nutrition, 1998, 128(5): 848-854.
[11] NAMAZI H, FATHI F, DADKHAH A, et al. Hydrophobically modified starch using long-chain fatty acids for preparation of nanosized starch particles[J]. Scientia Iranica, 2011, 18(3): 439-445.
[12] 杨英, 顾正彪, 张根义, 等. 直链淀粉-共轭亚油酸分子间复合特性的研究[J]. 中国粮油学报, 2009, 24(4): 50-54.
[13] LALUSH I, BAR H, ZAKARIA I, et al. Utilization of amylose lipid complexes as molecular nanocapsules for conjugated linoleic acid[J]. Biomacromolecules, 2005, 6(1): 121-130.
[14] MARINOPOULOU A, PAPASTERGIADIS E, RAPHAELIDES S N, et al. Structural characterization and thermal properties of amylose-fatty acid complexes prepared at different temperatures[J]. Food Hydrocolloids, 2016, 58: 224-234.
[15] FANTA G F, KENAR J A, KELKER F C, et al. Nanoparticle formation from amylose-fatty acid inclusion complexes prepared by steam jet cooking[J]. Industrial Crops and Products, 2015, 74: 36-44.
[16] 马成业, 李宏军, 陈善峰, 等. 脱胚玉米和淀粉挤出物中淀粉-脂热特性分析[J]. 中国粮油学报, 2013, 28(7): 23-28.
[17] BAIL P L, CHAVVET B, SIMONIN H, et al. Formation and stability of amylose ligand complexes formed by high pressure treatment[J]. Innovative Food Science & Emerging Technologies, 2013, 18: 1-6.
[18] MENG S, MA Y, SUN D W, et al. Properties of starch-palmitic acid complexes prepared by high pressure homogenization[J]. Journal of Cereal Science, 2014, 59(1): 25-32.
[19] 范媛媛, 毛联凯, 夏雨, 等. 香蕉天然抗性淀粉测定方法的比较[J]. 食品科技, 2011, 36(5): 255-259.
[20] HARALAMPU S G. Resistant starch—A review of the physical properties and biological impact of RS3[J]. Carbohydrate polymers, 41(3): 285-292.
[21] 赵凯, 雷鸣, 刘丽艳, 等. 乙酰化羟丙基复合改性玉米淀粉物化特性研究[J]. 中国粮油学报, 2019, 34(10): 29-35.
[22] 贾祥泽, 陈秉彦, 赵蓓蓓, 等. 直链淀粉-脂质复合物的形成及其结构性质研究进展[J]. 食品与发酵工业, 2017, 43(3): 276-284.
[23] GIDLEY M J, BOCKIEK S M. Molecular organization in starches: A carbon 13CP/MAS NMR study[J]. Journal of the American Chemical Society, 1985, 107(24): 7 040-7 044.
[24] MANGALA S L, MALLESHI N G, THARANATHAN R N. Resistant starch from differently processed rice and ragi (finger millet)[J]. European Food Research and Technology, 1999, 209(1): 32-37.
[25] SONG Y, JANE J. Characterization of barley starches of waxy, normal, and high amylose varieties[J]. Carbohydrate Polymers, 2000, 41(4): 365-377.
[26] MORRISON W, LAW R V, SNAPE C E. Evidence for inclusion complexes of lipids with V-amylose in maize, rice and oat starches[J]. Journal of Cereal Science, 1993, 18(2): 107-109.
[27] GOODFELLOW B J, WILSON R H. A fourier transform IR study of the gelation of amylose and amylopectin[J]. Biopolymers: Original Research on Biomolecules, 1990, 30(13-14): 1 183-1 189.
[28] SMITS A L, RUHNAU F C, VLIEGENTHART J F, et al. Ageing of starch based systems as observed with FT-IR and solid state NMR spectroscopy[J]. Starch-Stärke, 1998, 50(11-12): 478-483.
[29] OGAWA K, YAMAZAKI I, YOSHIMURA T, et al. Studies on the retrogradation and structural properties of waxy corn starch[J]. Bulletin of the Chemical Society of Japan, 1998, 71(5): 1 095-1 100.
[30] 罗曦, 吴方喜, 谢鸿光, 等. 近红外光谱的水稻抗性淀粉含量测定研究[J]. 光谱学与光谱分析, 2016, 36(3): 697-701.
[31] ZENG S, WU X,SHAN L,et al.Structural charateristics and physicochemical properties of lotus seed resistant starch prepared by different methods[J].Food Chemisty,2015,186:213-222.
[32] ZHOU Z K, CAO X H, ZHOU J Y H. Effect of resistant starch structure on short-chain fatty acids production by human gut microbiota fermentation in vitro[J]. Starch-Stärke, 2013, 65(5-6): 509-516.
[33] RUIZ-MATUTE A I, HERNANDEZ-HERNANDEZ O, RODRIGUEZ-SANCHEZ S, et al. Derivatization of carbohydrates for GC and GC-MS analyses[J]. Journal of Chromatography B, 2011, 879(17): 1 226-1 240.
[34] MAHADEVAMMA S, PRASHANTH K V, THARANATHAN R. Resistant starch derived from processed legumes-purification and structural characterization[J]. Carbohydrate Polymers, 2003, 54(2): 215-219.
[35] MANGALA S L, RAMESH H P, UDAYASANKAR K, et al. Resistant starch derived from processed ragi (finger millet, Eleusine coracana) flour: Structural characterization[J]. Food Chemistry, 1999, 64(4): 475-479.
[36] NUNES F M, LOPES E S P, MOREIRA A S, et al, Formation of type 4 resistant starch and maltodextrins from amylose and amylopectin upon dry heating: A model study[J]. Carbohydrate Polymers, 2016, 141: 253-262.
[37] ZHANG Juan, CHEN Feng, LIU Feng, et al. Study on structural changes of microwave heat-moisture treated resistant Canna edulis Ker starch during digestion in vitro[J]. Food Hydrocolloids, 2010, 24(1): 27-34.
[38] THERI ENAUBIN H, JANVIER F, BAILLE W E, et al. Study of hydration of cross-linked high amylose starch by solid state 13C NMR spectroscopy[J]. Carbohydrate research, 2007, 342(11): 1 525-1 529.
[39] BAIK M Y, DICKINSON L C, CHINACHOTI P. Solid-state 13C CP/MAS NMR studies on aging of starch in white bread[J]. Journal of Agricultural & Food Chemistry, 2003, 51(5): 1 242-1 248.
[40] SIEVERT D, POMERANZ Y. Enzyme-resistant starch. I. characterization and evaluation by enzymatic, thermoanalytical, and microscopic methods[J]. Cereal Chemistry, 1989, 66: 342-347.
[41] FAN D, MA W, WANG L, et al. Determining the effects of microwave heating on the ordered structures of rice starch by NMR[J]. Carbohydrate Polymers, 2013, 92(2): 1 395-1 401.
[42] POLESI L F, SARMENTO S B S. Structural and physicochemical characterization of RS prepared using hydrolysis and heat treatments of chickpea starch[J]. Starch-Stärke, 2011, 63(4): 226-235.
[43] FORST G, LEEDS A A, DORÉ C J, et al. Glycaemic index as a determinant of serum HDL-cholesterol concentration[J]. The Lancet, 1999, 353(9 158): 1 045-1 048.
[44] SHARMA A, YADAV B S, RITIKA B S. Resistant starch: Physiological roles and food applications[J]. Food Reviews International, 2008, 24(2):193-234.
[45] 杨玥熹,陈晴,曹一丹,等. 不同种B型抗性淀粉对肠道菌群发酵产短链脂肪酸的影响[C]. 北京: 中国食品科学技术学会, 2019: 68-69.
[46] 张岩. 不同热处理对抗性淀粉结构及相关功能的影响[D]. 天津:天津科技大学, 2015.
[47] 包辰. 薏苡仁抗性淀粉结构特性及其对肠道菌群调节机制的研究[D]. 福州:福建农林大学,2017.
[48] 杨春丰, 亢灵涛, 唐正辉, 等. 板栗抗性淀粉消化前后的益生作用及结构变化[J]. 湖南工程学院学报(自然科学版), 2014, 24(2): 61-65.
[49] HARAZAKI T, INOUE S, IMAI C, et al. Resistant starch improves insulin resistance and reduces adipose tissue weight and CD11c expression in rat OLETF adipose tissue[J]. Nutrition, 2014, 30(5): 590-595.