紫外线(ultraviolet,UV)照射是引起皮肤光老化的重要因素。一方面,UV照射产生活性氧(reactive oxygen speccies,ROS),启动级联反应,从而提升皮肤中基质金属蛋白酶(matrix metalloproteinases,MMPs)的分泌;另一方面, UV照射加速了促炎症细胞因子的产生,刺激MMPs的产生[1-2]。MMPs含量的增加加速了皮肤中胶原蛋白基质的降解[3],易引发皮肤的光老化。目前,抑制皮肤光老化的途径主要集中在紫外线屏蔽、紫外线吸收和各种抗氧化剂和抗炎因子等。
辣木(Moringa oleifera Lam.)是辣木科辣木属植物[4]。研究发现,辣木叶中多酚类物质含量丰富,具有较好的生物活性[5-9]。
先前我们对云南产辣木叶多酚提取物(Moringa oleifera leaves extracts,MLE)进行了提取和体外活性研究[10]。研究发现,MLE中多酚类物质的含量为20.16 mg/g干重, 其中39种化合物被分离鉴定;同时,MLE显示了较好的体外抗氧化、抑菌和抗炎作用。根据MLE的体外生物活性,本文进一步研究MLE对光老化小鼠皮肤的影响。通过分析MLE对光老化皮肤主要组成、氧化应激、MMPs及形态结构的影响,评价MLE对光老化小鼠中皮肤的潜在保护作用,旨在为辣木叶多酚生理活性的深入挖掘及产品应用开发提供思路。
1 材料与方法
1.1 材料与试剂
无毛小鼠(雄性,BALB/c,体重20~22 g),购自北京维通利华实验动物技术有限公司;辣木叶,由云南天佑科技开发有限公司提供;蛋白质(protein,Prot)浓度、超氧化物歧化酶(superoxide dismutase,SOD)活性、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性、过氧化氢酶(catalase,CAT)活性、谷胱甘肽(glutathione,GSH)和丙二醛(malondialdehyde,MDA)含量等测定试剂盒购于南京建成生物工程研究所;透明质酸(hyaluronic acid,HA)含量、MMPs(MMP-1、MMP-3、MMP-9)含量等测定ELISA试剂盒,购于R&D公司。
1.2 仪器与设备
AL204电子天平,上海梅特勒-托利多仪器有限公司;TGL-20B高速台式离心机,上海安亭科学仪器厂;TU-1901紫外可见分光光度计,北京普析通用仪器有限公司;SpectraMax Ms多功能酶标仪,美国Molecular Devices公司;Olympus DP70光学电子显微镜,日本Olympus公司。
1.3 试验方法
1.3.1 辣木叶多酚提取物的制备
准确称取20 g辣木叶样品,加入100 mL提取混合液[V(丙酮)∶V(水)∶V(乙酸)=70∶29.7∶0.3],混匀,超声波处理5 min,静置20 min,再超声5 min,5 000 r/min离心15 min,取上清液,重复以上步骤2次,混合提取的上清液,45 ℃旋蒸浓缩,冷冻干燥,所得样品(MLE)储存于干燥器中备用。
1.3.2 动物分组及处理
无毛小鼠30只,动物饲养按照标准认证的饮食和水处理,所有小鼠适应新环境1周。将实验小鼠分为3组,每组有10只,包括:正常对照组(normal control group,NC),无UV照射,灌胃生理盐水;模型对照组(model control group,MC),UV照射,灌胃生理盐水;MLE组,UV照射,灌胃MLE提取物,样品剂量为150 mg/(kg·d)。
1.3.3 UV照射
动物实验前,测定UVA和UVB照射小鼠皮肤的最小红斑剂量(minimal erythema dose,MED),确定了UVA和UVB的MED分别为127.84和18.36 mJ/cm。实验小鼠进行UV照射,每周3次,共10周。第1周的照射强度为0.5 MED,每周增加0.5 MED,最高达到4 MED,以4 MED照射小鼠3周。
1.3.4 皮肤的定量指标分析
对皮肤中HYP含量、HA含量、蛋白质浓度,SOD活性,GSH-Px活性,CAT活性,GSH含量、MDA含量及MMPs含量进行测定,测定方法严格按照相关试剂盒的要求。
1.3.5 皮肤的形态结构分析
将小鼠背部皮肤标本(约1 cm×1 cm)在中性缓冲福尔马林溶液(40 g/L)中固定24 h。利用苏木素-伊红(H&E)染色和Van Gieson(VG)染色对小鼠皮肤的一般组织形态和胶原结构进行分析。
1.4 数据统计与分析
实验设定10个平行,数据表示为平均值±标准偏差;使用SPSS 17.0进行数据处理,以最小显著差异法进行两两比较。
2 结果与分析
2.1 皮肤中HYP和HA含量
长期暴露在紫外线照射下会导致皮肤成分发生变化。胶原蛋白和HA是皮肤中的2种重要成分,在皮肤功能中起着关键作用。胶原降解和损伤是光老化的主要特征。抑制胶原蛋白的产生和促进胶原蛋白的降解是UV照射破坏皮肤胶原蛋白基质的2个主要途径[11]。HYP是胶原蛋白中的一种特殊氨基酸,因此HYP含量经常被用作衡量皮肤胶原蛋白含量的指标[12]。如图1-A所示,UV照射可极显著降低皮肤中HYP含量(P<0.01),相对于NC组,MC组小鼠皮肤的HYP含量下降了51.21%。摄入MLE后,小鼠皮肤中HYP含量显著增加(P<0.05),说明MLE可以有效地增加皮肤中胶原蛋白的含量。HA的基本结构是由D-葡萄糖醛酸和N-乙酰葡糖胺组成的大分子,不含硫多糖。HA具有良好的结合水能力,对皮肤的水分维持和弹性保持有重要作用;同时,HA能够支撑皮肤的扩张结构,有助于营养物质和代谢物在皮肤中的扩散[13]。如图1-B所示,UV照射导致皮肤中HA含量显著下降(P<0.01),表明光老化皮肤的表皮层存在损伤。摄入MLE后,小鼠皮肤中HA含量显著增加(P<0.05)。相对于MC组,MLE组小鼠皮肤的HA提高了39.16%,该结果显示,光老化小鼠的表皮层得到一定程度的修复。
2.2 皮肤中抗氧化酶的活性
氧化应激是UV诱导皮肤光老化过程中的关键因素。UV照射导致皮肤损伤常常来自于活性氧的产生[14-17]。皮肤中存在抗氧化防御系统,包括酶(例如SOD、CAT和GSH-Px)和非酶小分子(例如GSH)。SOD是生物体内存在的一种抗氧化金属酶,能够催化超氧阴离子自由基歧化生成氧和过氧化氢;CAT是存在于细胞的过氧化物体内,能够催化过氧化氢分解成氧和水;GSH-Px可以促进过氧化氢与GSH反应生成H2O和氧化型谷胱甘肽。小鼠皮肤中抗氧化酶活性的变化如图2所示。与NC组相比,UV照射使皮肤中SOD和GSH-Px的活性极显著降低(P<0.01),CAT活性显著降低(P<0.05)。结果表明,UV照射降低了皮肤中SOD、CAT和GSH-Px的活性,从而降低了ROS的清除能力,增加了皮肤的氧化应激。与MC组相比,MLE组的小鼠皮肤中SOD活性极显著增加(P<0.01),CAT和GSH-Px活性显著增加(P<0.05)。这些结果表明,MLE可抑制UV照射导致的SOD、CAT和GSH-Px活性的下降,从而有效地提升皮肤抑制ROS所产生氧化应激的能力。
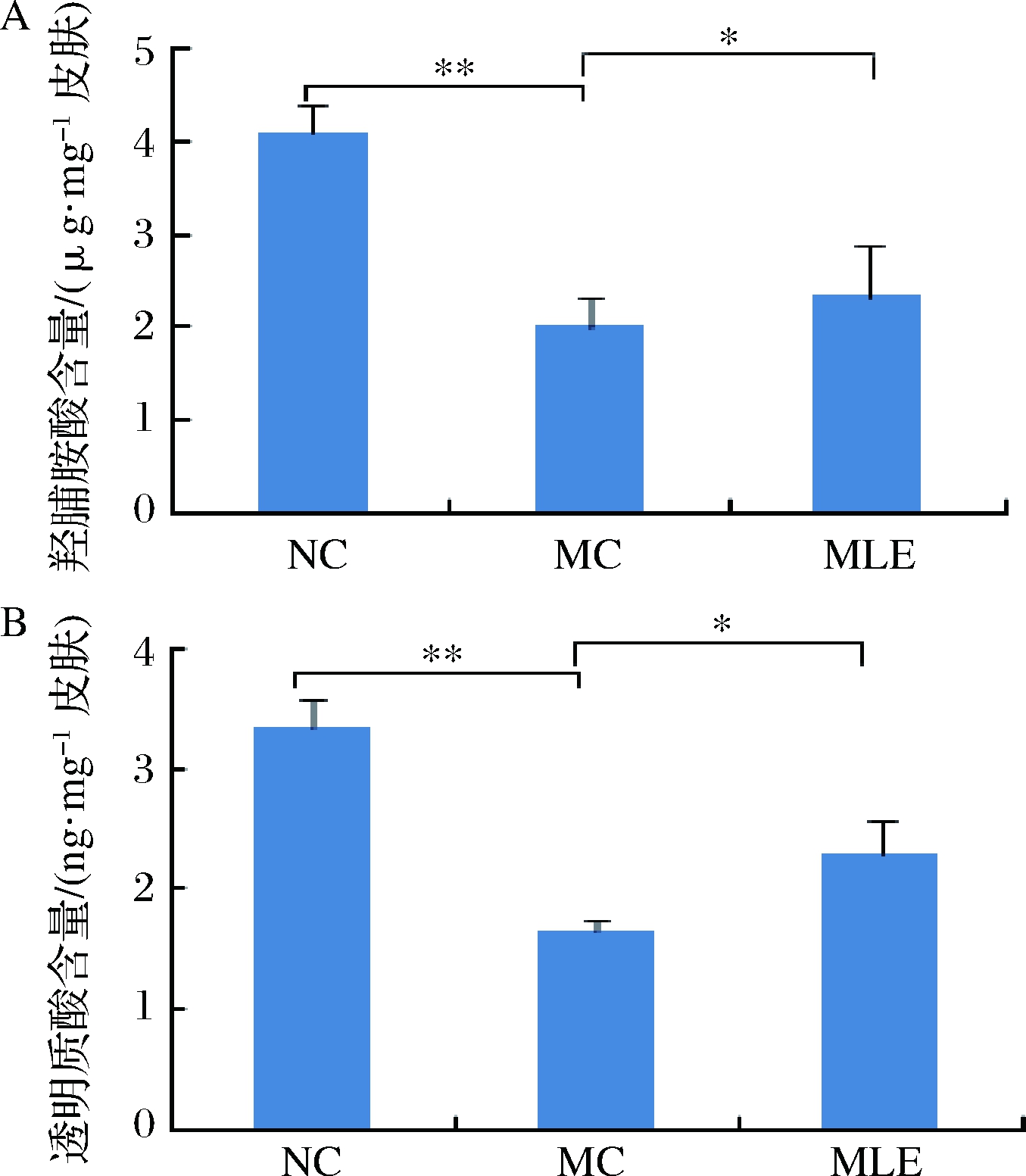
A-HYP含量;B-HA含量
图1 MLE对小鼠皮肤中HYP和HA含量的影响
Fig.1 Effects of MLE on contents of HYP and HA in mice skin
注: *表示组间差异显著(P<0.05);**表示组间差异极显著
(P<0.01)(下同)

A-SOD活性;B-CAT活性;C-GSH-Px活性
图2 MLE对小鼠皮肤中抗氧化酶活性的影响
Fig.2 Effects of MLE on antioxidant enzyme activities in mice skin
2.3 皮肤中GSH和MDA含量
GSH是皮肤中具有抗氧化能力的非酶小分子物质,GSH浓度的提高可以有效地缓冲皮肤的抗氧化能力。小鼠皮肤中GSH含量的变化如图3-A所示,与NC组相比,UV照射极显著地降低了GSH含量(P<0.01),MC组小鼠皮肤中GSH含量为NC组的57.32%。与MC组相比,MLE组的小鼠皮肤中GSH含量显著增加(P<0.05)。
MDA是脂质过氧化过程的典型产物,因此,MDA经常被用来评估脂质过氧化的程度[18]。小鼠皮肤中MDA含量的变化如图3-B所示,与NC组相比,UV照射极显著地提高了MDA含量(P<0.01),MC组小鼠皮肤中MDA含量为NC组的2.42倍。MLE可以降低MDA含量,相对于MC组,MLE组小鼠皮肤的MDA下降了42.24%。我们先前的研究表明,MLE富含有多酚类物质,具有较好的体外抗氧化能力,可抑制自由基的形成[10]。因此,MLE对光老化皮肤抗氧化体系的保护原因可归结为MLE的多酚组成及其较高的抗氧化能力。
2.4 皮肤中MMPs含量
MMPs是一类结构相关的锌依赖性内肽酶。根据结构和底物特异性差异可分为不同的亚组[19]。MMP-1、MMP-3和MMP-9分别属于胶原酶、间质溶解素和明胶酶。研究表明,MMPs是导致皮肤胶原降解的主要分解酶,MMPs水平可有效反映皮肤中胶原蛋白的损伤程度。MMPs的表达可由UV照射产生的氧化应激和促炎细胞因子产生[20]。小鼠皮肤中MMPs含量的变化如图4所示。UV照射诱发皮肤中MMPs的含量极显著增加(P<0.01),与NC组相比,MC组小鼠皮肤中MMP-1,MMP-3和MMP-9的含量分别增加了87.55%,65.31%和274.57%。与MC组相比,MLE对光老化小鼠皮肤中MMP-1的含量有极显著的降低作用(P<0.01),对MMP-3和MMP-9的含量有显著的降低作用(P<0.05)。这些结果表明,摄入MLE后,皮肤中的MMPs的水平显著降低,从而有效地保护了皮肤中的胶原蛋白。结合先前的研究[10],MLE的体外抗氧化活性和抗炎作用介入对光老化皮肤MMPs含量的抑制作用。
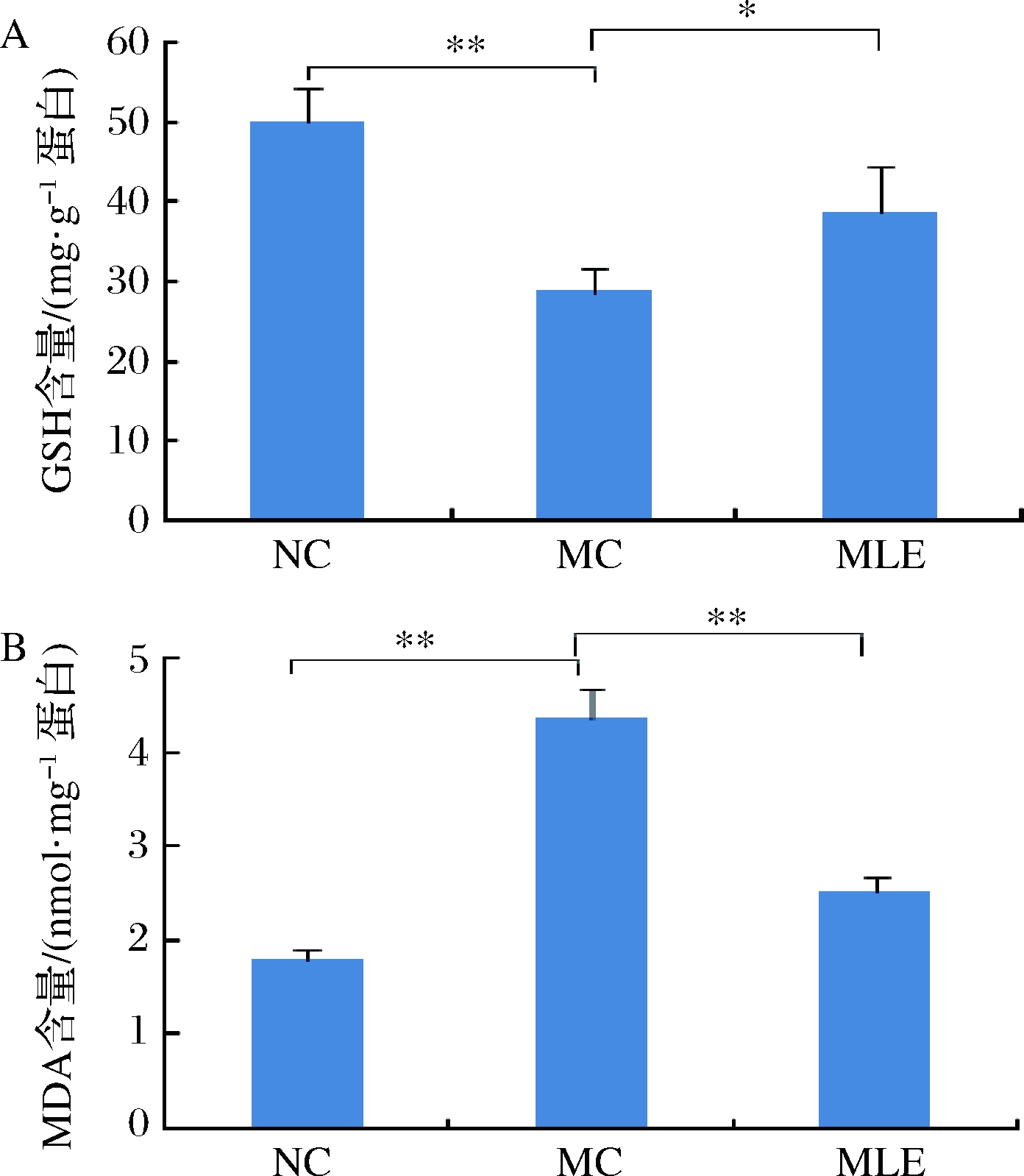
A-GSH含量;B-MDA含量
图3 MLE对小鼠皮肤GSH和MDA含量的影响
Fig.3 Effects of MLE on the contents of GSH and
MDA in mice skin

A-MMP-1含量;B-MMP-3含量;C-MMP-9含量
图4 MLE对小鼠皮肤中MMPs含量的影响
Fig.4 Effects of MLE on MMPs contents in mice skin
2.5 皮肤的组织形态和胶原结构
表皮层和真皮层是皮肤的2个主要部分[21]。表皮层是机体高效的物理屏障,保护皮肤免受环境影响的关键组织;胶原蛋白是真皮层的主要组成部分。形态组织学分析表明,表皮厚度和胶原结构变化是UV诱导皮肤光老化的主要特征。UV照射可以通过激活表皮生长因子受体以诱导角质形成细胞增殖,表现为表皮增生;同时,表皮增生可以保护皮肤抵制UV照射,这可作为皮肤对UV照射的适应性反应[22]。H&E染色可表达小鼠皮肤的一般形态结构。如图5-A所示,在H&E染色图中,NC组小鼠中表皮结构完整,真皮层纤维组织呈波浪状且分布均匀,方向与表皮平行。与NC组相比,MC组小鼠的光老化皮肤存在表皮层厚度增加伴有角化过度、真皮层组织稀疏、皮脂腺不规则增生等现象。与MC组相比,MLE一定程度上修复了光老化小鼠皮肤的形态结构,真皮层中的纤维更加组织和致密,皮脂腺增生有效改善。结果表明,经UV照射后,小鼠皮肤的表皮层显著增厚。经MLE干预后,光老化皮肤的表皮增厚得到有效的恢复。
UV照射可导致真皮层组织稀疏、纤维分布不均、胶原纤维被破坏等。VG染色可以看出皮肤中胶原蛋白的结构变化。如图5-B所示,在VG染色图中,NC组小鼠皮肤胶原排列致密有序、分布均匀、呈波浪状。与NC组相比,MC组小鼠皮肤胶原纤维排列松弛无序,存在一定的胶原蛋白断裂沉积现象。与MC组相比,MLE组小鼠皮肤胶原纤维分布均匀、出现波浪形状、排列呈现一定的有序化。这些结果表明,MLE可有效的修复因UV照射导致的真皮层组织破碎、胶原纤维稀疏等,从而改善了胶原蛋白纤维基质在皮肤的存在状态。这一结果与皮肤中HYP含量上升(图1-A)和MMPs含量下降(图4)的变化相一致。因此,MLE可明显地降低和修复UV照射引起的外在表皮层和内在真皮层的光老化损伤,这与MLE中多酚物质具有的抗氧化、抗炎和抑制MMPs产生等生物活性相关。

A-H&E染色;B-VG染色
图5 小鼠皮肤的组织形态和胶原结构染色
Fig.5 Tissue morphology and collagen structure
staining of the mouse skin
3 结论
本文建立了UV照射小鼠皮肤光老化模型,评价MLE对光老化皮肤的保护作用。MLE可以有效地增加光老化皮肤的胶原蛋白和透明质酸含量,提升抗氧化系统的活力、抑制MMPs含量的增加,修复皮肤表层和保护胶原蛋白的结构稳定。MLE对UV照射引起的皮肤光老化具有明显的保护作用,其作用机制与MLE较好的体外抗氧化和抗炎活性相关。因此,MLE具有抑制皮肤光老化的潜在作用,在食品营养和医学美容等领域具有一定应用前景。
[1] HALLIDAY G M. Inflammation, gene mutation and photoimmunosuppression in response to UVR-induced oxidative damage contributes to photocarcinogenesis [J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2005, 571: 107-120.
[2] BASHIR M M, SHARMA M R, WERTH V P. UVB and proinflammatory cytokines synergistically activate TNF-α production in keratinocytes through enhanced gene transcription [J]. Journal of Investigative Dermatology, 2009, 129: 994-1 001.
[3] INOMATA S, MATSUNAGA Y, AMANO S, et al. Possible involvement of gelatinases in basement membrane damage and wrinkle formation in chronically ultraviolet B-exposed hairless mouse [J]. Journal of Investigative Dermatology, 2003, 120: 128-134.
[4] 吴頔, 蔡志华, 魏烨昕, 等. 辣木作为新型植物性蛋白饲料的研究进展 [J]. 动物营养学报, 2013(3): 503-511.
[5] WANG Y,GAO Y,DING H, et al. Subcritical ethanol extraction of flavonoids from Moringa oleifera leaf and evaluation of antioxidant activity [J]. Food Chemistry, 2017, 218:152-158.
[6] COPPIN J P, XU Y, CHEN H, et al. Determination of flavonoids by LC/MS and anti-inflammatory activity in Moringa oleifera[J]. Journal of Functional Foods, 2013, 5:1 892-1 899.
[7] SREELATHA S, PADMA P R. Antioxidant activity and total phenolic content of Moringa oleifera leaves in two stages of maturity [J]. Plant Foods for Human Nutrition, 2009, 64: 303.
[8] ABDEL-DAIM M M, KHALIL S R, AWAD A, et al. Ethanolic extract of Moringa oleifera leaves influences NF-kappaB signaling pathway to restore kidney tissue from cobakt-mediated oxidative injury and inflammation in rats [J]. Nutrients, 2020, 12: 12 041 031.
[9] MABROUKI L, RJEIBI I, TALEB J, et al. Cardiac ameliorative effect of Moringa oleifera leaf extract in high-fat diet-induced obesity in rat model[J]. Biomed Research International, 2020, 2020: 6 583 603.
[10] GUO Y, SUN L, ZHANG Y. UPLC-Q-Orbitrap-MS2 analysis of Moringa oleifera leaves extract and its antioxidant, antibacterial and anti-inflammatory activities [J]. Natural Product Research, 2020,34:2 090-2 094.
[11] KIM S, CHUNG J H. Berberine prevents UV-induced MMP-1 and reduction of type I procollagen expression in human dermal fibroblasts [J]. Phytomedicine, 2008, 15: 749-753.
[12] MILLER E J,MARTIN G R,PIEZ K A.The utilization of lysine in the biosynthesis of elastin crosslinks [J]. Biochemical Biophysical Research Communications, 1964,17:248-253.
[13] 杜平中. 透明质酸的皮肤保健功能[J].中国生化药物杂志, 1998, 19: 283-284.
[14] HOU H, LI B, ZHANG Z, et al. Moisture absorption and retention properties, and activity in alleviating skin photodamage of collagen polypeptide from marine fish skin [J]. Food Chemistry, 2012, 135: 1 432-1 439.
[15] ISHIIY, SUGIMOTOS, IZAWA N, et al. Oral administration of Bifidobacterium breve attenuates UV-induced barrier perturbation and oxidative stress in hairless mice skin [J]. Archives of Dermatological Research, 2014, 306: 467-473.
[16] CHUNG J H, SEO J Y, CHOI H R, et al. Modulation of skin collagen metabolism in aged and photoaged human skin in vivo[J]. Journal of Investigative Dermatology, 2001, 117: 1 218-1 224.
[17] QUAN T, QIN Z, XIA W, et al. Matrix-degrading metalloproteinases in photoaging [J]. Journal of Investigative Dermatology Symposium Proceedings, 2009, 14: 20-24.
[18] 马立文, 赵宏伟, 周炳荣, 等. 大豆低聚肽对中波紫外线诱导的光老化小鼠皮肤的保护作用[J]. 中国皮肤性病学杂志, 2014, 28: 119-122.
[19] EGEBLAD M, WERB Z. New functions for the matrixmetalloproteinases in cancer progression [J]. Nature Reviews Cancer, 2002, 2: 161-174.
[20] CHIANG H M, CHEN C W, LIN T Y, et al. N-phenethyl caffeamide and photodamage: protecting skin by inhibiting type I procollagen degradation and stimulating collagen synthesis [J]. Food and Chemical Toxicology, 2014, 72:154-161.
[21] BRINCAT M P. Hormone replacement therapy and the skin [J]. Maturitas, 2000, 35: 107-117.
[22] El-ABASERIT B, PUTTA S, HANSEN L A. Ultraviolet irradiation induces keratinocyte proliferation and epidermal hyperplasia through the activation of the epidermal growth factor receptor [J]. Carcinogenesis, 2006, 27: 225-231.