食品致病菌的污染和繁殖是食品安全的主要问题之一[1]。传统的食品抑菌方式主要有超高压杀菌、辐射杀菌、热杀菌和添加其他生物抑菌剂等[2]。然而超高压杀菌、辐射杀菌、热杀菌等方式对食品品质造成一定的影响。同时,食品添加剂的过量添加与潜在残留也使得消费者对食品安全产生担忧[3]。因此亟需寻求新型抑菌物质来抑制食品致病菌的残存,确保食品安全。细菌素是由细菌核糖体内合成的一类抗菌肽,具有高效、安全、绿色、热稳定性强,易被蛋白酶分解等特性。因此,细菌素被认为是有效代替传统抑菌方式的抑菌物质之一,受到广泛的关注[4]。
目前,乳酸链球菌素(Nisin)和片球菌素是被食品与药品管理局和世界卫生组织(Food and Drug Administration/World Health Organization,FDA/WHO)允许在食品中添加的细菌素[5]。相关研究表明,片球菌素抑菌谱较窄,只对单增李斯特菌和部分乳酸菌有抑制作用[6];Nisin较片球菌素的抑菌谱广,对大部分革兰氏阳性菌有抑制作用。然而,Nisin对耐热性的芽孢菌,特别是蜡样芽孢杆菌的抑制效果不明显[5]。这也限制了Nisin在热加工食品中的应用。且蜡样芽孢杆菌在温和加工产品中易残留,具有较大的危害性[7]。因此,筛选、鉴定对耐热性芽孢菌有抑制作用的新型细菌素十分必要。
本研究利用细菌素对亲缘细菌有高效抑制作用的特性,使用实验室前期自牡蛎中分离的1株具有广谱抑菌效果的枯草芽孢杆菌(B. subtillis DH8403),对其所产细菌素(Subtillicin L)开展系统分离纯化研究,并利用全基因组测序数据分析其产细菌素的潜在结构基因和氨基酸信息。最后,将粗提的细菌素与Nisin的抑菌活性进行比对,探讨其对蜡样芽孢杆菌的抑菌特性,旨在为新型细菌素在抑制蜡样芽孢杆菌的应用提供基础数据。
1 材料与方法
1.1 实验菌种
蜡样芽孢杆菌LMG2805(Bacillus cereus LMG2805)和产细菌素的枯草芽孢杆菌DH8043(B. subtilis DH8043),由中国水产科学院东海水产研究所提供。
1.2 试剂与仪器
脑心浸液肉汤(brain heart infusion, BHI)培养基,Oxoid 英国;磷酸盐缓冲溶液(0.01 mol/L,pH 6.8),北京贝洛生物科技有限公司;(NH4)2SO4、三氟乙酸(Trifluoroacetic acid,TFA)、DEAE纤维素(DE-32)、葡聚糖凝胶G50(Sephadex G-50),国药集团化学试剂有限公司;细菌DNA提取试剂盒,美国Thermo Scientific公司。
Multiskan MK3酶标仪,Thermo Scientific公司;MIR-153低温恒温培养箱,日本三洋(SANYO)电机公司;SEX-TJ超净工作台,上海整新电子设备;YXQ-LS-SLL立式压力蒸汽灭菌器、酶标板,上海生工生物工程有限公司;恒温振荡器CHA-S,国华电器有限公司;CF 16RXII低温离心机,日立(Hitachi)有限公司;Nanodrop 2 000超微量分光光度计,Thermo Scientific公司。
1.3 试验方法
1.3.1 (NH4)2SO4粗提Subtillicin L
将B. subtilis DH8043按照1%的接种量接种到1 L的BHI液体培养基中,37 ℃在摇床中过夜培养至少12 h,将菌液在4 ℃,10 000 r/min条件下离心30 min,将上清液经过0.22 μm的滤膜后添加不同浓度的饱和(NH4)2SO4(饱和度10%~80%)至上清液中[8],充分混匀后,在4 ℃条件下静置至少4 h。将不同浓度的饱和(NH4)2SO4溶液在10 000 r/min条件下离心30 min。将沉淀溶于2.5 mL 0.1%(体积分数)TFA中备用。
1.3.2 最小半抑菌活性的测定
采用CHI等方法[9],利用96孔板微量稀释法测定Subtillicin L的最小半抑菌浓度(minimum inhibition concentration, MIC50)。细菌素的抑菌浓度(bacteriocin union, BU)以对照组的OD600nm为0.4~0.5时抑制50%的蜡样芽孢杆菌的最低用量表示。
1.3.3 阴离子交换分离纯化
选取5 mL最佳饱和度(NH4)2SO4沉淀的细菌素粗提物,通过DE-32阴离子交换柱进行进一步纯化。以PBS缓冲溶液冲洗(流速为5 mL/min),再分别用0.5、1 mol/L的NaCl进行梯度洗脱,控制流速为5 mL/min。在OD280nm条件下检测和收集出峰的洗脱液,利用1.3.2的方法测试收集管的抑菌活性。将有抑菌活性的溶液收集后进行冷冻干燥,收集备用。
1.3.4 Sephadex G-50层析分离纯化
将1.3.3中收集的冷冻干燥样品复溶到4 mL的0.1%TFA中,通过Sephadex G-50层析柱进行进一步分离纯化。以10倍体积柱效的0.1%TFA冲洗层析柱,控制流速为1 mL/min。在OD280nm条件下检测和收集出峰的洗脱液。
1.3.5 细菌素质量浓度确定
参考张宁等[10]的方法,采用紫外分光光度计法对细菌素的质量浓度进行测定,结果用mg/mL表示。
1.3.6 三甲基甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(tricine-sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,Tricine-SDS-PAGE)
根据PERVMAL等[11]的方法,对分级纯化后的Subtillicin L进行Tricine-SDS-PAGE凝胶电泳。
1.3.7 枯草芽孢杆菌DH8043的全基因组测序及分析
枯草芽孢杆菌DH8043的DNA提取方法参照试剂盒说明进行。利用纳米孔测序标准方法[12-13](DNA样品进行质量检测、文库构建、文库质量检测和文库测序,对测序后的数据进行统计分析和基因组组装)对枯草芽孢杆菌DH8043进行全基因组测序。
对组装后的基因组数据通过CLC Genomics Workbench 20.0.2软件读取基因组数据,读取后的基因组经RAST进行注释后用BAGEL4进行细菌素结构基因的比对[14-16]。
1.3.8 Subtillicin L结构基因的扩增及鉴定
以枯草芽孢杆菌DH8043的基因组学DNA为模板,根据其全基因组测序结果,设计扩增其所产细菌素结构基因的上游引物(PsubF:5′-TCTTTATGCTGCCGCAGGAA-3′)和下游引物(PsubR:5′-TTACCAAGCAGCTGCGTATT-3′)。建立25 μL扩增体系,扩增条件为94 ℃预变性3 min;进入聚合酶链式反应(polymerase chain reaction,PCR)循环阶段后,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸20 s,共30个循环;72 ℃延伸5 min,4 ℃保存。取5 μL PCR扩增产物在10 g/L琼脂糖凝胶下进行电泳实验,一定时间后观测并记录PCR扩增产物,并将剩余的PCR扩增产物送生工(上海)生物有限公司测序。
1.3.9 Subtillicin L抑菌性质的研究
参照CHI等[9]方法,利用96孔板微量稀释法,利用不同的最小半抑菌浓度(MIC50和4 MIC50),在一定时间间隔(8 h)内比较不同浓度枯草杆菌素Subtillicin L和Nisin对蜡样芽孢杆菌的抑制性质,并利用Origin绘制两者的时间-杀菌曲线。
2 结果与分析
2.1 (NH4)2SO4粗提Subtillicin L试验
图1是不同饱和浓度的(NH4)2SO4对细菌素Subtillicin L抑菌能力的影响。结果显示,上清液经不同饱和度(NH4)2SO4沉淀后(10%~80%),沉淀产物复溶溶液的抑菌能力与(NH4)2SO4浓度变化相关。随(NH4)2SO4浓度增加,抑菌效果也增加。经低饱和度(NH4)2SO4(饱和度10%~30%)沉淀的复溶物对蜡样芽孢杆菌没有抑制能力;添加40%饱和度(NH4)2SO4与50%、60%条件下的抑菌孔分别为3个和5个;70%和80%饱和度(NH4)2SO4沉淀下的抑菌孔均为7个。因此,最终选择70%饱和度(NH4)2SO4对Subtillicin L进行粗提。在此条件下的Subtillicin L对蜡样芽孢杆菌的MIC50为5 BU/mL。同时,Nisin对蜡样芽孢杆菌的MIC50为20 μg/mL。这说明在一定时间内,单位抑菌浓度条件下的Subtillicin L对于蜡样芽孢杆菌的抑菌能力相当于20 μg的Nisin。
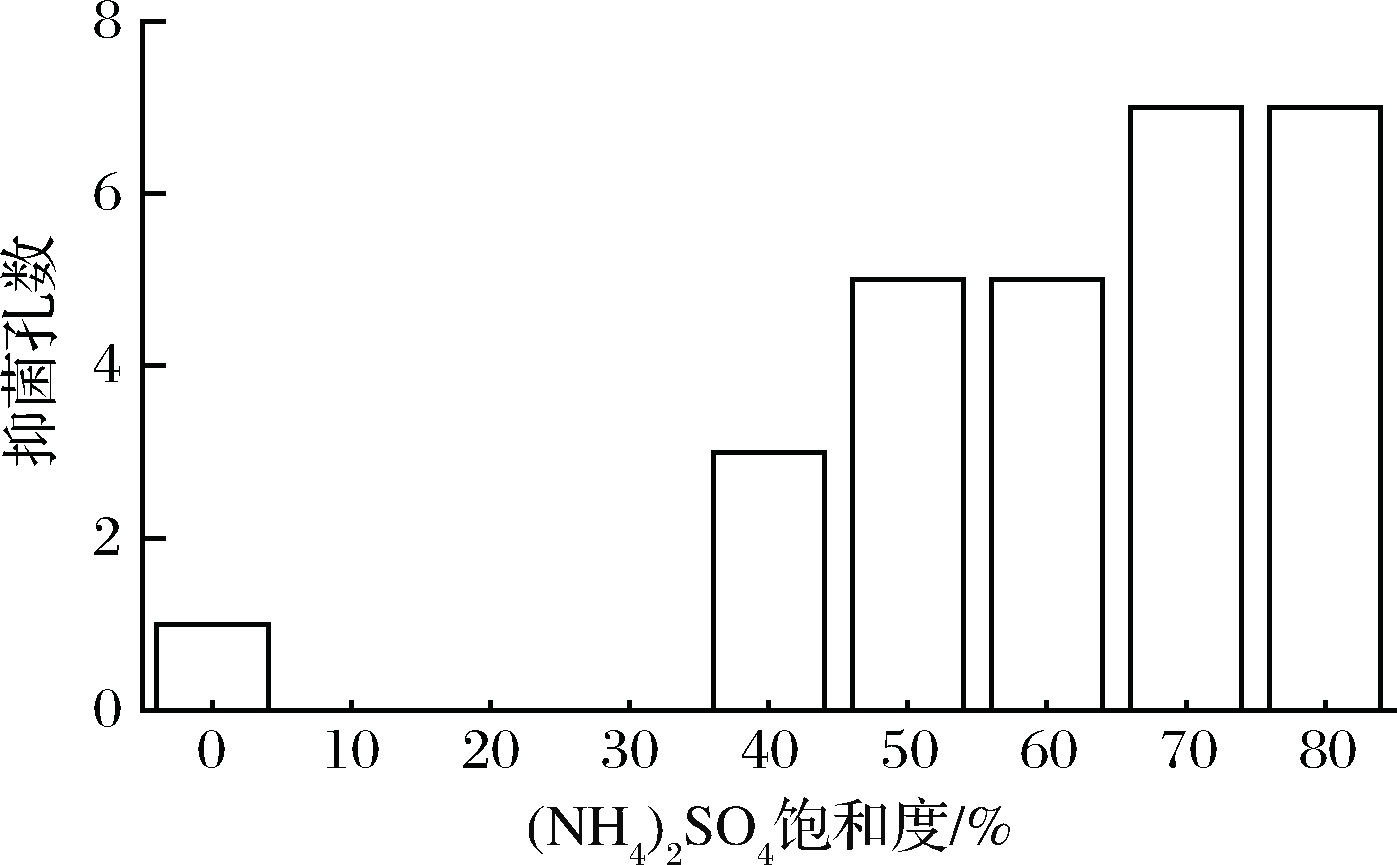
图1 不同(NH4)2SO4饱和度沉淀下的Subtillicin L对蜡样
芽孢杆菌抑菌能力的影响
Fig.1 Inhibition activities of Subtillicin L at different ammonium
sulfate precipitated concentration against B. cereus
2.2 Subtillicin L分级纯化
经70% 饱和度的(NH4)2SO4粗提后的枯草杆菌素Subtillicin L,经阴离子交换柱分离纯化后,粗提液在0.5、1 mol/L NaCl条件下洗脱后对蜡样芽胞杆菌有抑菌活性。洗脱后的Subtillicin L抑菌活性分别为20 BU/mL和5 BU/mL。出现这种情况的原因可能是低浓度的NaCl未能完全洗脱细菌素,而高浓度条件下的NaCl将未洗脱的细菌素完全洗脱。低浓度的细菌素溶于高浓度的NaCl造成其抑菌活性的降低[17]。因此本实验只将0.5 mol/L的NaCl洗脱液进行收集,冻干后进行后续研究。
如图2所示,将冷冻干燥后的Subtillicin L经Sephadex G-50层析柱洗脱后得到2个蛋白峰(F1和F2)。经过抑菌活性测定后,只有F2所对应的收集液具有抑菌效果,抑菌活性为20 BU/mL。
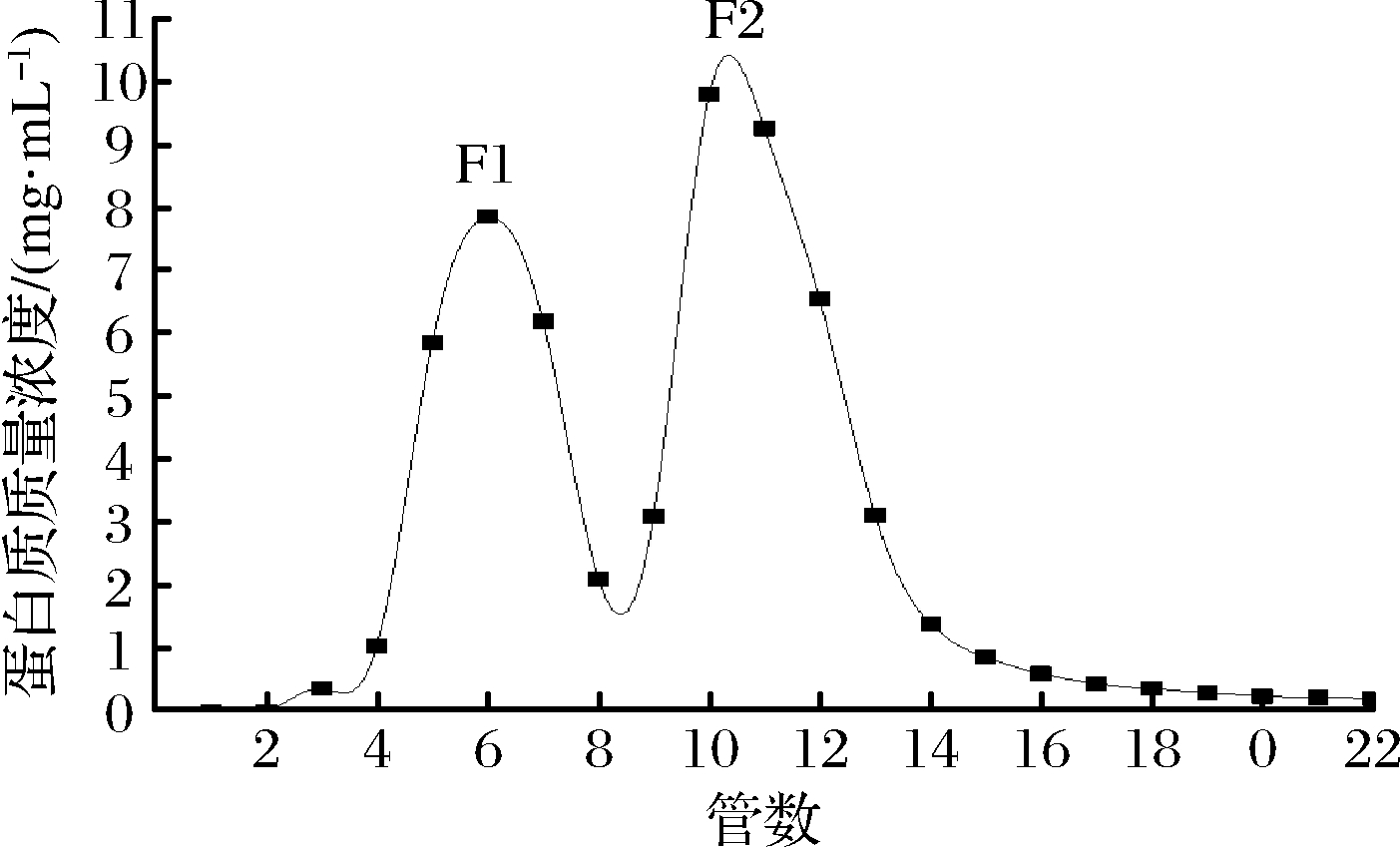
图2 不同收集管数的细菌素浓度
Fig.2 Bacteriocin concentrations in different tubes
2.3 Subtillicin L分子质量确定
将经过分级纯化的Subtillicin L进行分子量测定(图3)。结果显示,经提纯后的Subtillicin L在电泳条件下呈现出1条条带,其分子质量为12.0~13.0 kDa。目前由芽孢杆菌属产的细菌素有多种类型,其中Amylocyclisin科的细菌素分子质量约为12.3 kDa[18]。这类细菌素多为环形细菌素,且有较为广泛的抑菌谱,其中Amylocyclisin作为其中代表研究最为透彻[19]。利用细菌素具有自身免疫系统的特点,本实验利用Subtillicin L抑制1株产Amylocyclisin的解淀粉芽孢杆菌。结果发现Subtillisin L对其有抑制作用(结果未列出),这说明本实验发现的Subtillisin L不同于已知发现的Amylocyclisin。因此,对产Subtillisin L的菌株进行后续的全基因组测序,并通过全基因组测序预测产Subtillicin L的结构基因,对结构基因进行PCR扩增进而判断Subtillisin L与Amylocyclisin的相似程度。
2.4 潜在抑菌物质结构基因比较及分析
将产Subtillicin L细菌的全基因组完成图上传到BAGEL4,并对比现有细菌素数据库信息。分析结果显示,Subtillicin L结构基因由转运蛋白,免疫蛋白等典型的细菌素结构基因组成(图4)。对比数据显示共有3个潜在相似结果,其中Subtillicin L与Amylocyclisin潜在相似度最高,相似度为99.11%。利用全基因组测序结果设计扩增引物并对扩增序列进行测序,结果发现Subtillicin L与Amylocyclisin在第88个氨基酸上存在差别。其中Subtillicin L为苏氨酸而Amylocyclisin为丙氨酸(图5)。该结果也与全基因组测序结果一致。这说明Subtillicin L可能为新型的环形细菌素,推测其分子质量与Amylocyclisin一样为12.3 kDa。
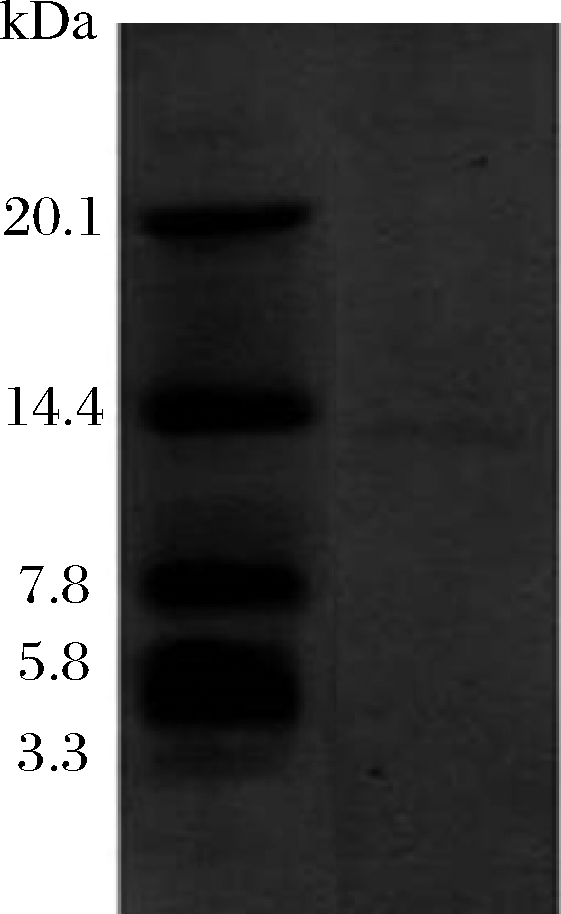
图3 Subtillicin L的 tricine-SDS-PAGE电泳
Fig.3 Tricine-SDS-PAGE electrophoresis of Subtillicin L
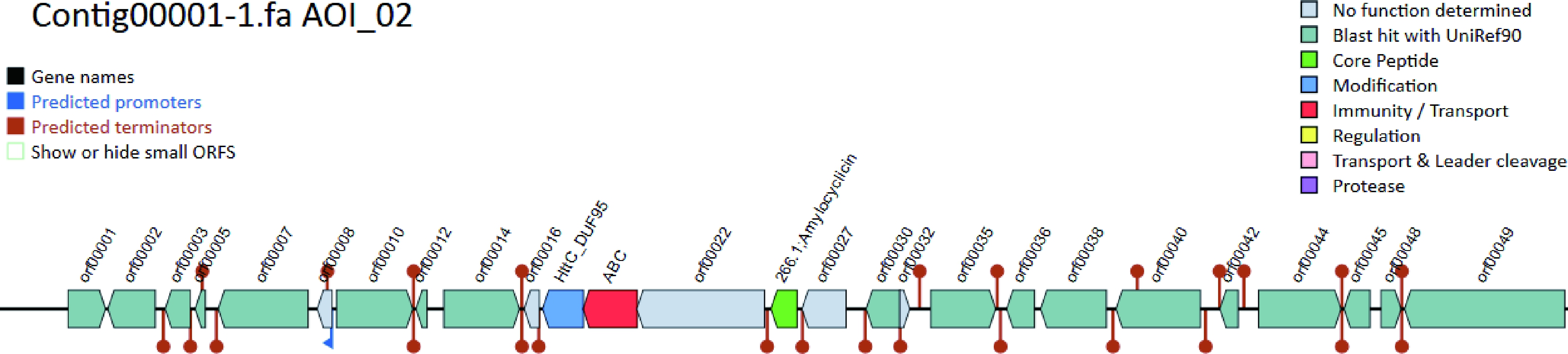
图4 Subtillcin L潜在结构基因比对结果
Fig.4 Predictive structure genes of Subtillicin L at BAGEL4

图5 Subtillcin L与Amylocyclisin氨基酸比对
Fig.5 Amino acids Alignment between subtillcin L and Amylocyclisin
2.5 Subtillicin L抑菌性质研究
图6为不同浓度的Subtillicin L和Nisin对蜡样芽孢杆菌8 h内的时间-杀菌曲线。结果显示,MIC50条件下Subtillcin L与Nisin在4 h内均可以完全抑制蜡样芽孢杆菌的生长,而后抑菌效果减弱导致蜡样芽孢杆菌生长。4 MIC50条件下的Subtillcin L在8 h可以完全抑制蜡样芽孢杆菌的生长,而4 MIC50条件下的Nisin抑制蜡样芽孢杆菌5 h后开始缓慢生长,但生长速度低于MIC50条件下的Nisin。这说明高浓度条件下的Subtillicin L对于蜡样芽孢杆菌属于完全抑制(bacteriocide),Nisin属于阻止生长(bacteriostatic)。同时,在相同MIC50条件下,Subtillicin L对蜡样芽孢杆菌的抑菌效果要强于Nisin,这也为Subtillicin L在抑制蜡样芽孢杆菌时提供除Nisin外更多的选择。
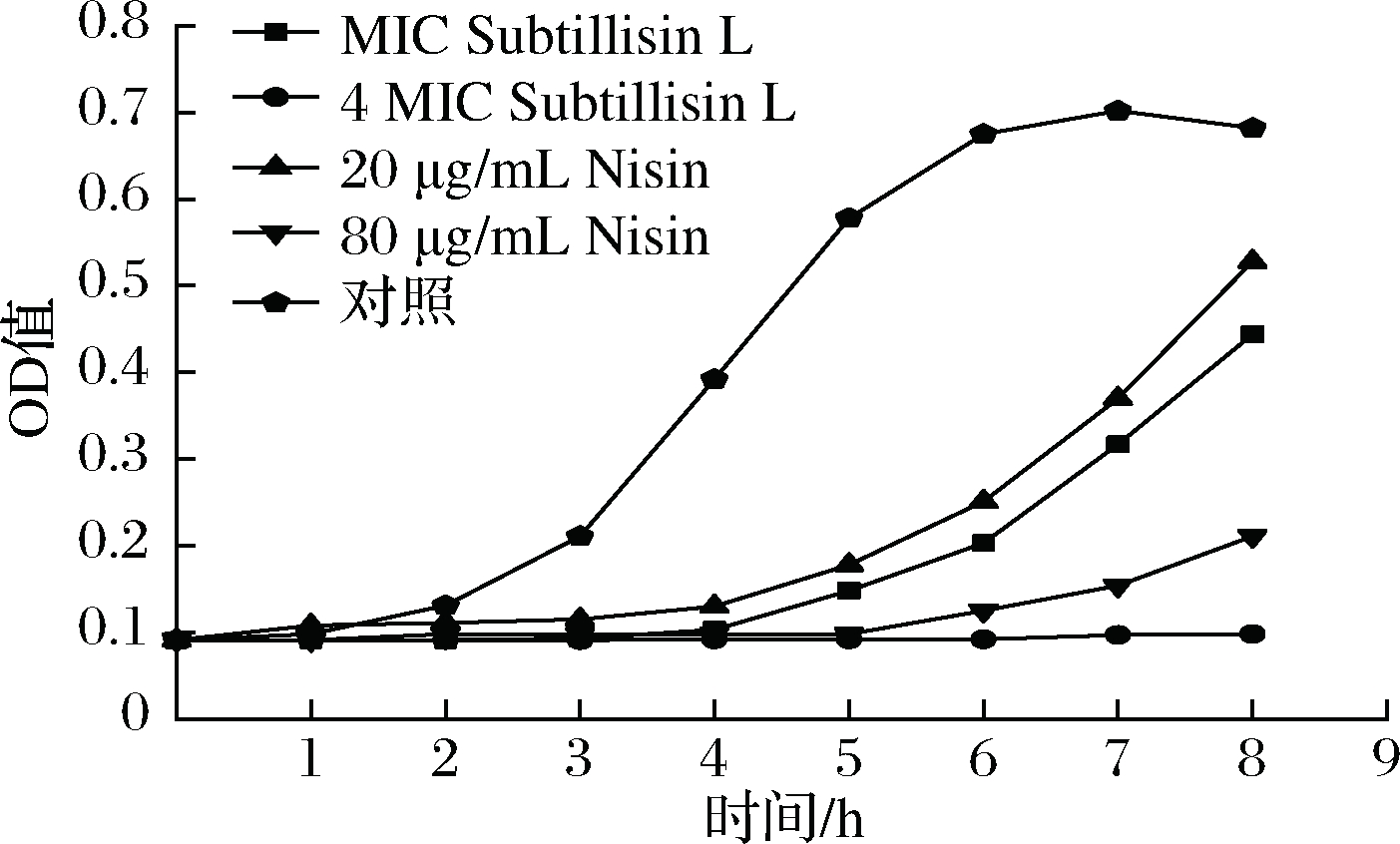
图6 不同浓度的Subtillicin L和Nisin对蜡样芽孢杆菌
的时间-杀菌曲线
Fig.6 Time-killing curve of Subtillisin L and Nisin against
B. cereus at different concentrations
3 结论
蜡样芽孢杆菌可以在热或其他极端条件下产生孢子从而残存。过量残存下的蜡样芽孢杆菌可以产生肠毒素,人们误食可引发呕吐、腹泻等症状[20]。因此,有效抑制蜡样芽孢杆菌的残存对解决由其引起的食品安全有促进作用。本文对实验室前期分离出的1株具有广谱抑菌效果的枯草芽孢杆菌(B. subtillis DH8403)所产的细菌素进行了系统分离纯化、全基因组数据比对和抑菌特性研究。实验结果显示,饱和度为70%和80%的(NH4)2SO4对枯草杆菌素(Subtillicin L)粗提效果最好,对其抑菌效果有明显的提高。将粗提后的Subtillicin L经过系统分离纯化(阴离子交换和层析分离),得到唯一的一个蛋白峰,其分子质量为12~13 kDa。结合全基因组测序结果,对Subtillicin L的结构基因进行预测分析。结果发现Subtillicin L与Amylocyclisin相似度最高,为99.11%,Subtillicin L与Amylocyclisin氨基酸序列在第88个氨基酸上存在差别,前者为苏氨酸,后者为丙氨酸。由此可以推断Subtillicin L可能为新型环状细菌素,其分子质量确定为12.3 kDa。最后,经过对比及分析一定时间内(8 h)的Subtillicin L粗提物与Nisin对蜡样芽孢杆菌的抑菌效果,结果发现高浓度(4 MIC50)条件下的Subtillicin L可以完全抑制蜡样芽孢杆菌生长,相同浓度条件下的Nisin只能对蜡样芽孢杆菌暂时阻止生长。
[1] KHOCHAMITN, SIRIPORNADULSILS,SUKON P, et al. Purification, characterization and mode of action of enterocin, a novel bacteriocin produced by Enterococcus faecium TJUQ1[J]. International Journal of Biological Macromolecules, 2020, 144:151-159.
[2] NALISA K, SURASAK S, PEERAPOL S, et al. Antibacterial activity and genotypic-phenotypic characteristics of bacteriocin-producing Bacillus subtilis KKU213:Potential as a probiotic strain[J]. Microbiological Research, 2015, 170:36-50.
[3] 侯养全. 超高压食品灭菌技术研究进展与应用[J]. 山西科技, 2018, 33(1):106-108.
[4] LEE S G, CHANG H C. Purification and characterization of mejucin, a new bacteriocin produced by Bacillus subtilis SN7[J]. LWT-Food Science and Technology, 2018, 87:8-15.
[5] 刘静, 杨富民, 白斌芳, 等. 产细菌素乳酸菌菌株的来源及所产细菌素的分类研究进展[J]. 中国酿造, 2018, 37(6):20-24.
[6] KOMORA N, BRUSCHI C, MAGALHSES R, et al. Survival of Listeria monocytogenes with different antibiotic resistance patterns to food-associated stresses[J]. International Journal of Food Microbiology, 2017, 245(20): 79-87.
[7] 王伟栋, 王丽娟, 刘晓琳, 等. 一起蜡样芽孢杆菌引起食物中毒的实验室检测[J]. 食品界, 2019(2):90-91.
[8] 赵圣明, 赵岩岩, 马汉军.植物乳杆菌JLA-9产细菌素的分离纯化[J].食品与发酵工业,2017,43(6):60-65.
[9] CHI H, HOLO H. Synergistic antimicrobial activity between the broad spectrum bacteriocin garvicin KS and nisin, farnesol and polymyxin b against gram-positive and gram-negative bacteria[J]. Current Microbiology, 2018, 75:272-277.
[10] 张宁, 于功明, 蒋万枫. 曹州木瓜超氧化物歧化酶(SOD)粗酶的提取工艺[J]. 食品安全导刊, 2018(6):105.
[11] PERVMAL V, VENKASTESAN A. Antimicrobial cytotoxic effect and purification of bacteriocin from vancomycin susceptible Enterococcus faecalis and its safety evaluation for probiotization[J]. LWT-Food Science and Technology, 2017,78:303-310.
[12] MAGI A, SEMERARO R, MINGRINO A, et al. Nanopore sequencing data analysis: State of the art, applications and challenges[J]. Brief Bioinform, 2018, 19(6):1 256-1 272.
[13] JAIN M, OLSEN H E, PATEN B, et al. The Oxford Nanopore MinION: Delivery of nanopore sequencing to the genomics community[J]. Genome Biology, 2016, 17(1):239-249.
[14] TARAILO G M, CHEN N. Using RepeatMasker to identify repetitive elements in genomic sequences[J]. Current Protocols in Bioinformatics, 2009, 25:1-14.
[15] HYATT D, CHEN G L, LOCASCIO P F, et al. Prodigal: Prokaryotic gene recognition and translation initiation site identification[J]. BMC Bioinformatics, 2010, 11(1): 119.
[16] HOS SAIN M S,AKHTER M Z,HOSSAIN M M, et al. Complete genome sequence of Bacillus subtilis strain MH1, which has a high level of bacteriocin-like activity, isolated from soil in Bangladesh[J]. Genomics Announcements, 2018, 6(25):1-2.
[17] PEI J J, JIN W G, ELATY A M A, et al. Isolation, purification, and structural identification of a new bacteriocin made by Lactobacillus plantarum found in conventional kombucha[J]. Food Control, 2019,110:106 923.
[18] SCHOLZ R, VATER J, BUDIHARJO A, et al. Amylocyclicin, a novel circular bacteriocin produced by Bacillus amyloliquefaciens FZB42[J]. Journal of Bacteriolog, 2014, 196(10):1 842-1 852.
[19] MOLINATTO G, PUOPOLO G, SONEGO P, et.al. Complete genome sequence of Bacillus amyloliquefaciens subsp plantarum S499, a rhizobacterium that triggers plant defences and inhibits fungal phytopathogens[J]. Journal of Biotechnology, 2016, 238:56-59.
[20] 唐广心,黄薇. 一起蜡样芽孢杆菌引起的持续交叉污染食物中毒流行病学调查[J]. 大家健康(中国版), 2013, 7(7):67-68.