胶原蛋白是动物体内重要的蛋白质,约占总蛋白含量的25%[1]。胶原蛋白肽,是胶原蛋白适度降解后形成的一种多肽,具有抗氧化、抑菌、免疫调节和降血糖等多种生理活性[2]。陆生生物组织曾是获取天然胶原肽的主要来源,但由于禽流感、疯牛病等疾病的潜在威胁和宗教习俗等原因,使得陆源性胶原肽无法大范围应用,开发水产胶原蛋白活性肽成为国内外热门课题之一[3-5]。罗非鱼是我国重要的养殖鱼类,其鱼皮中氨基酸组成合理且胶原蛋白含量较高,但在粗加工中通常被当作下脚料丢弃或制成廉价饲料,造成严重的环境污染和资源浪费[6]。充分利用现有的水产资源,最大限度地提高产品附加值,是水产品综合开发利用的一个重要方向,因此寻找新型加工技术突破产业发展瓶颈,对于罗非鱼和胶原蛋白肽产业具有极大的现实意义。
目前,制备胶原肽最常用的是微生物发酵法和酶法。与酶法相比,采用微生物发酵法制备胶原蛋白肽,微生物产酶和提取水解胶原得到胶原蛋白肽可以同步完成,无需使用化学试剂和昂贵的酶制剂,并且能够去除鱼皮中的腥臭味,提高样品感官质量,极大节约生产成本,提高生产效率[7]。固态发酵(solid-state fermentation,SSF)相对于液态发酵而言,能耗低,对生产设备要求不高,不易被杂菌污染,目标产物浓度高,对环境友好,具有大规模生产活性肽的优势[8-9]。
天然胶原分子具有独特的三股螺旋结构,只能经胶原酶水解破坏超螺旋结构后才可被其他蛋白酶裂解[10]。因此,本研究以胶原酶活力为评价指标,通过单因素及正交试验优化确定枯草芽孢杆菌固态发酵罗非鱼皮产酶的最佳条件,并对制备的胶原粗肽进行了超滤分离,研究不同分子质量肽段的胶原肽体外抗氧化活性,以期为水产品的深入开发利用提供技术参考。
罗非鱼鱼皮,雷州市龙之润水产品有限公司;Bacillus subtilis CCTCC AB 90008,中国典型培养物保藏中心;营养琼脂培养基(nutrient agar,NA),青岛海博生物有限公司;甘氨酸,Sigma公司;截流分子5、10 kDa Millipore再生纤维素超滤膜及其他分析纯试剂,国药化学试剂有限公司。
Heraeus Pico 17高速离心机,美国赛默飞世尔科技有限公司;UV-1800 PC型紫外可见分光光度计,上海美谱达仪器有限公司;L-8800氨基酸自动分析仪,日本Hitachi公司;Free Zone 2.5真空冷冻干燥机,美国Labconco公司。
1.3.1 鱼皮的预处理
将鱼皮去鳞除杂,洗净后充分沥干,切分成约1 cm×1 cm×1 cm的碎块并经打粉机粉碎,冷冻至-20 ℃,密封备用。
1.3.2 固态发酵及粗酶液的制备
将B.subtilis CCTCC AB 90008从甘油保藏管接种至营养琼脂培养基中,37 ℃恒温培养24 h,将活化好的菌种接至种子培养基(牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH 7.2~7.4)中,于37 ℃、120 r/min摇床培养一定时间,制得种子液。将10 g处理后鱼皮装入250 mL锥形瓶中,121 ℃高温灭菌20 min,在无菌条件下加入一定量的灭菌蒸馏水,作为固态发酵培养基。调节培养基初始pH,按菌种接种量50 g/L 接入培养好的发酵种子液,恒温静置培养,并每隔5 h摇瓶翻动1次,相应的发酵条件按照单因素试验设计实施。
发酵结束后,向鱼皮培养基中加入50 mL 0.1 mol/L柠檬酸钠缓冲液(pH 6.2),于5 000 r/min离心15 min,取上清液作为胶原酶粗酶液。
1.3.3 固态发酵产胶原酶条件的优化
单因素试验以胶原酶活力为评价指标,逐级优化,先后考察培养基初始pH(6、6.5、7、7.5和8)、菌龄(6、10、14、18、22和26 h)、加水量(5、10、15、20和25 mL)、发酵温度(20、25、30、35和40 ℃)、发酵时间(12、18、24、30和36 h)5个因素对菌株产酶的影响。
根据单因素试验结果,选取菌龄、加水量、发酵温度、发酵时间进行4因素3水平的正交试验,优化枯草芽孢杆菌固态发酵罗非鱼皮制备胶原蛋白肽的工艺条件。
1.3.4 罗非鱼皮胶原蛋白肽的制备工艺
罗非鱼皮粉→高温灭菌(121 ℃,20 min)→加水并调节pH→接种→发酵→加水过滤(纱布)→灭酶(90 ℃,10 min)→离心(8 000 r/min,15 min)→收集上清液→过滤(0.45 μm滤膜)→收集滤液冻干→固态发酵罗非鱼皮胶原蛋白粗肽(SSF-TSCP)
1.3.5 水解度的测定
采用甲醛滴定法测定SSF-TSCP中氨基氮的含量[11],参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[12]测定预处理好的罗非鱼皮中总氮含量,水解度(degress of hydrolysis,DH)计算如公式(1)所示:
(1)
式中:h1,氨基态氮含量,mg/mL;h2,总氮含量,mg/mL。
1.3.6 多肽含量的测定
称取样品2 g,加入10 mL 150g/L三氯乙酸溶液,混合均匀,静置5 min,在3 000 r/min下离心10 min后,取全部上清液,参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[12]测定上清液中多肽含量。
1.3.7 氨基酸分析
采用GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》[13]的方法,测定分析样品中氨基酸组成及含量。
1.3.8 胶原蛋白肽的分离制备
采用截留分子质量为5 k、10 kDa的超滤膜对SSF-TSCP进行超滤分离,物料进口压力为0.2 MPa。分离得到3个组分:TSCP-a(MW>10 kDa)、TSCP-b(MW 5 k~10 kDa)、TSCP-c(MW<5 kDa),收集各超滤组分冷冻干燥,测定其还原能力、羟自由基(·OH)清除能力、超氧阴离子自由基![]() 清除能力和1,1-二苯基-2三硝基苯肼(1,1-diphenyl-2-picrylhydrazy,DPPH)自由基清除能力。
清除能力和1,1-二苯基-2三硝基苯肼(1,1-diphenyl-2-picrylhydrazy,DPPH)自由基清除能力。
1.3.9 胶原酶活力的测定
将甘氨酸作为标准氨基酸,以Ⅰ型胶原蛋白为底物,采用茚三酮显色法[14]测定胶原酶活力。酶活力定义为:在37 ℃,pH 7.5的条件下,每分钟水解胶原蛋白产生1 μg甘氨酸所需的酶量为1个酶活力单位(U)。
1.3.10 还原能力的测定
参考OYAIZU[15]的方法并略作改动,以谷胱甘肽(glutathione,GSH)作为阳性对照。
1.3.11 ·OH清除能力的测定
参考SMIRNOFF等[16]的方法并略作改动:向2 mL样品溶液中加入2 mL 6 mmol/L FeSO4溶液和2 mL 6 mmol/L水杨酸-乙醇溶液混合,最后加入2 mL 8.8 mmol/L H2O2溶液,于37 ℃水浴保温20 min,在510 nm波长处测定,即为样品组的吸光度。空白对照组以蒸馏水代替样品溶液,本底组以蒸馏水代替H2O2溶液,以GSH作为阳性对照。·OH清除率的计算如公式(2)所示:
·OH清除率![]()
(2)
式中:A,样品组的吸光度;A1,本底组的吸光度;A0,空白组的吸光度。
![]() 清除能力的测定
清除能力的测定
采用邻苯三酚自氧化法测定,参考杜昕等[17]的方法并略作改动:取1 mL样品溶液与5 mL 50 mmol/L Tris-HCl缓冲液(pH 8.2)混匀,于25 ℃水浴保温20 min,加入1 mL 3 mmol/L邻苯三酚,混匀后于25 ℃精确反应5 min,最后加入1 mL 10 mol/L HCl溶液终止反应,在320 nm波长处测定,即为样品组的吸光度。空白对照组以蒸馏水代替样品溶液,本底组以蒸馏水代替邻苯三酚溶液,以GSH作为阳性对照。![]() 清除率的计算如式(3)所示:
清除率的计算如式(3)所示:
![]() 清除率
清除率![]()
(3)
式中:A,样品组的吸光度;A1,本底组的吸光度;A0,空白组的吸光度。
1.3.13 DPPH自由基清除能力的测定
DPPH可在有机溶剂中形成稳定的自由基[18]。参考NURDIANI等[19]的测定方法并略作改动,以GSH作为阳性对照。
所有实验均重复3次,采用SPSS 20、Origin 8.5等软件进行统计分析及绘图。
2.1.1 初始pH对产酶的影响
如图1所示,随着起始pH的增大,胶原酶酶活力和菌体生物量先升高后缓慢降低。环境偏酸或偏碱时,均不利于菌体生长,影响胶原酶的合成与积累。在初始pH接近7的中性环境中,菌株生长良好且产胶原酶活性最高,故本试验选择pH 7为培养基的最适pH。
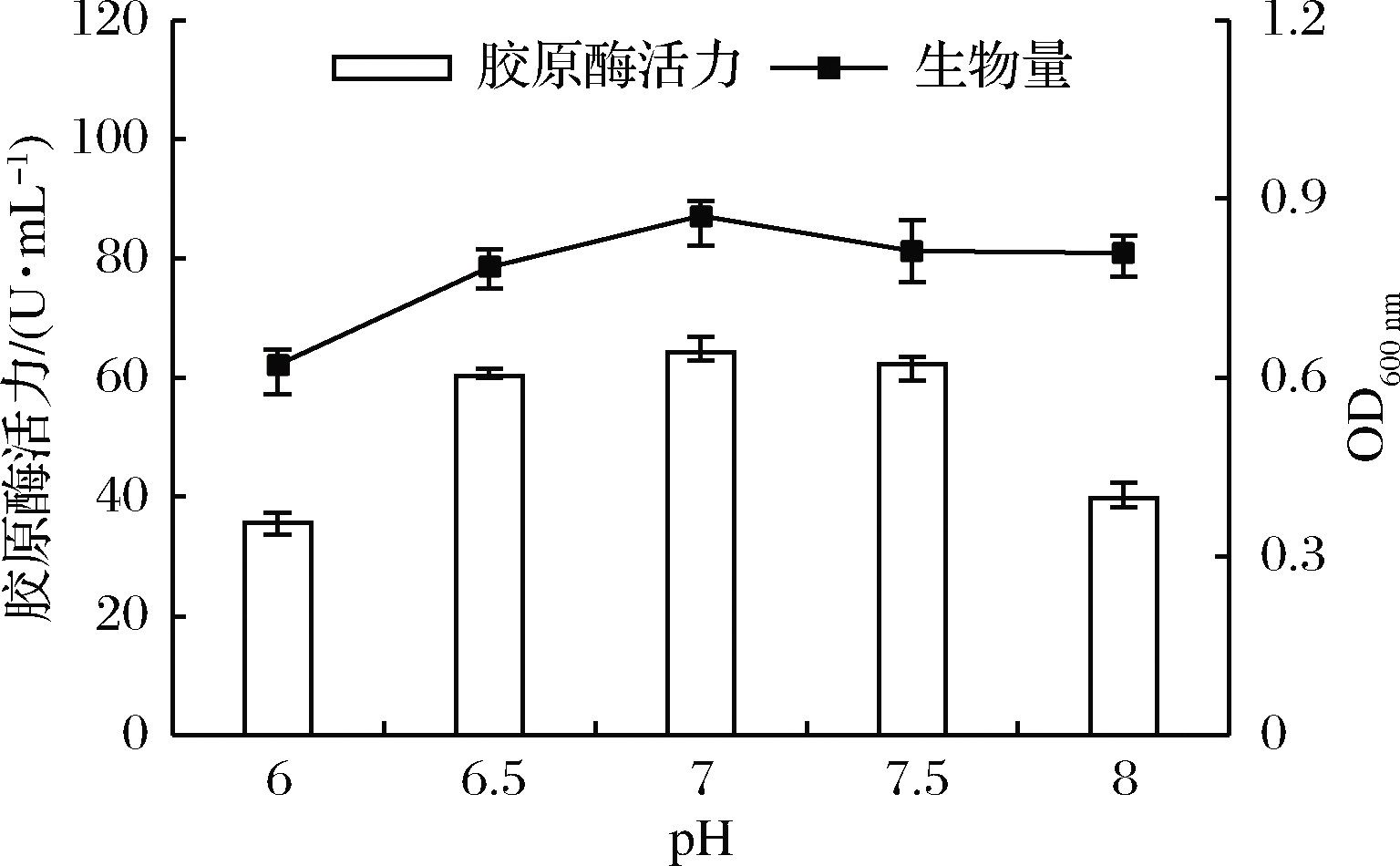
图1 初始pH对菌株产胶原酶的影响
Fig.1 Effect of initial pH on the production of collagenase
2.1.2 菌龄对产酶的影响
如图2所示,接入的种子液菌龄<18 h时,在培养一定时间后,检测到酶活力较低,生物量也偏低。当菌龄>18 h时,虽然菌体生长旺盛但衰老迅速,产胶原酶活性有下降趋势,故本试验选择18 h为种子液最适培养时间。
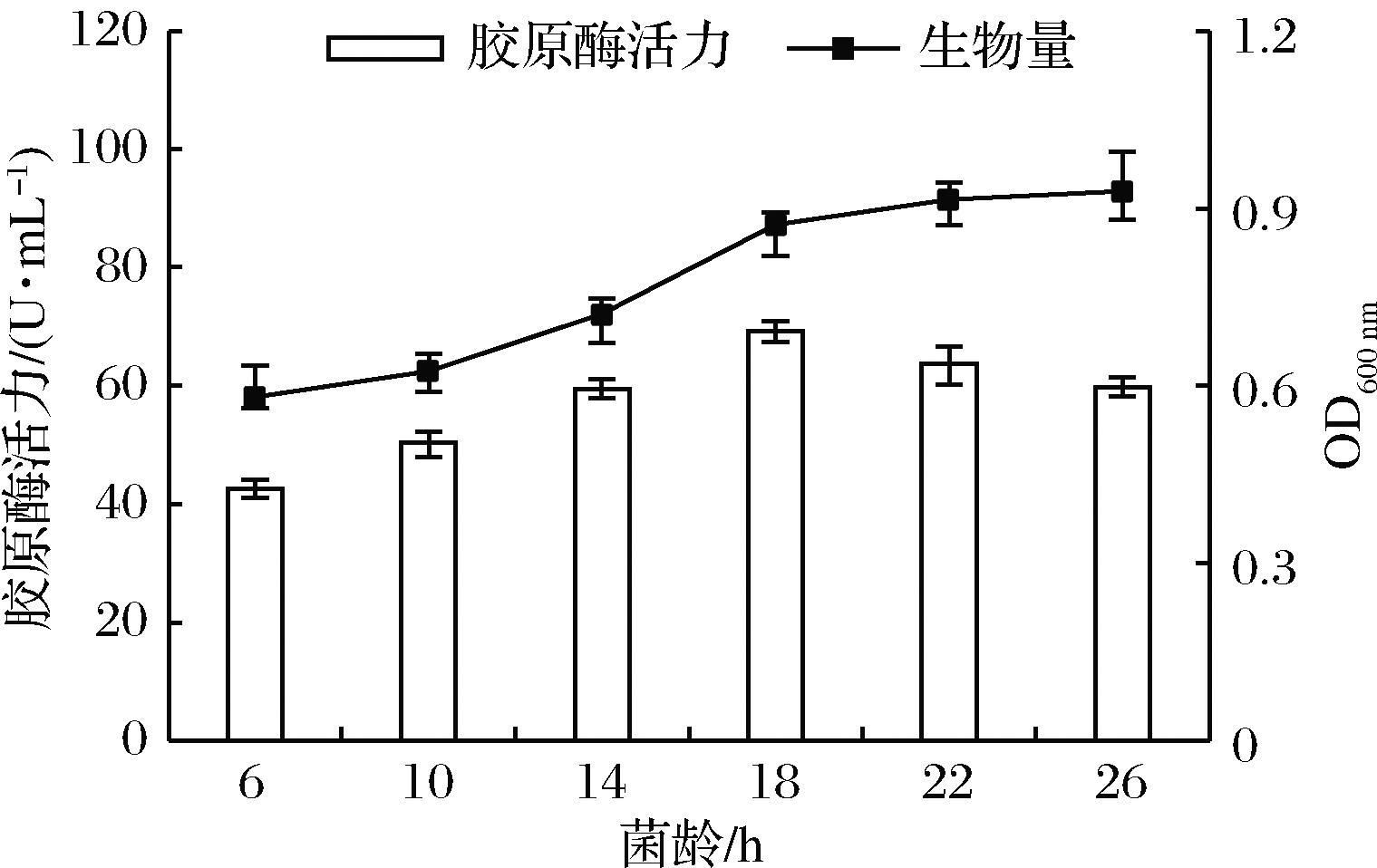
图2 菌龄对菌株产胶原酶的影响
Fig.2 Effect of cell age on the production of collagenase
2.1.3 加水量对产酶的影响
在固态发酵中,含水量过高会导致培养基质多孔性降低,发酵系统难以换气、降温,从而增加被杂菌污染的风险;而含水量过低时,基质膨胀程度低,菌体生长代谢受到抑制,导致目标物产量下降[20]。如图3所示,当加水量为10 mL时,菌株固态发酵罗非鱼皮产胶原酶活性最高,故本试验选择10 mL为最适加水量。
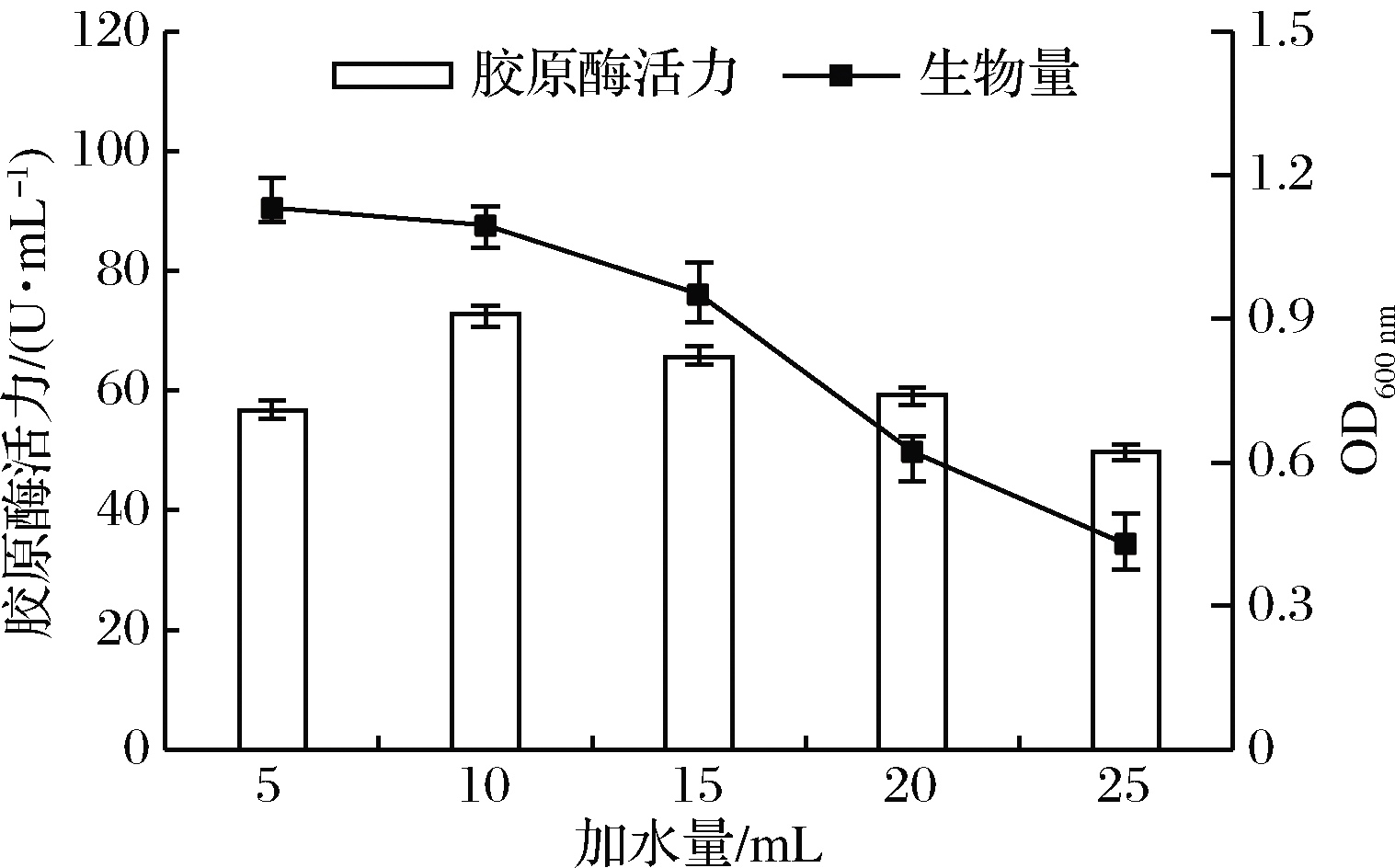
图3 加水量对菌株产胶原酶的影响
Fig.3 Effect of water addition on the production of collagenase
2.1.4 发酵温度对产酶的影响
最佳发酵温度受菌株生长状态和培养基理化性质等因素的影响而改变,适合微生物生长繁殖的温度不一定有利于某种代谢产物的合成[21]。如图4所示,在发酵温度<35 ℃时,菌体生物量较多,但产酶活性偏低。在35 ℃时,菌体生长代谢旺盛,胶原酶分泌增多,酶活力达到最大,此后温度继续上升,菌体生长受到抑制,酶活力也迅速下降,说明该菌最适生长温度与最适产酶温度不同,故本试验选择35 ℃为最适发酵温度。
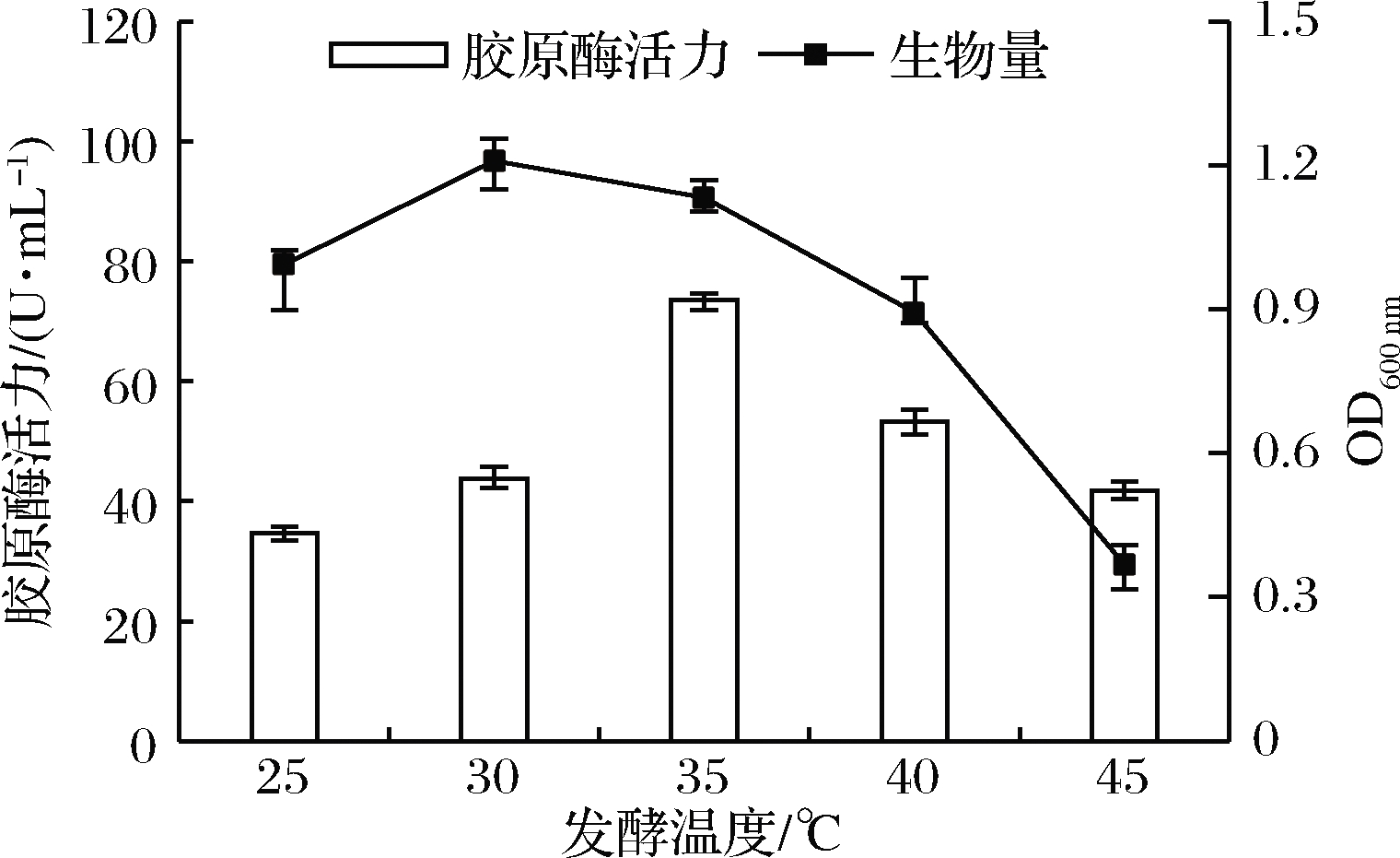
图4 发酵温度对菌株产胶原酶的影响
Fig.4 Effect of fermentation temperature on the production of collagenase
2.1.5 发酵时间对产酶的影响
如图5所示,延长发酵时间,菌体生物量随之增多,胶原酶的酶活力也逐渐增大,在发酵时间达到24 h时,胶原酶酶活力达到最大值。随着该菌生长进入稳定期,有害产物积累抑制菌株产酶,酶活力呈下降趋势。在生产实践中随着培养时间的延长,杂菌污染的机会相应增加,综合考虑生产成本和发酵效率,故本试验选择24 h为最适发酵时间。
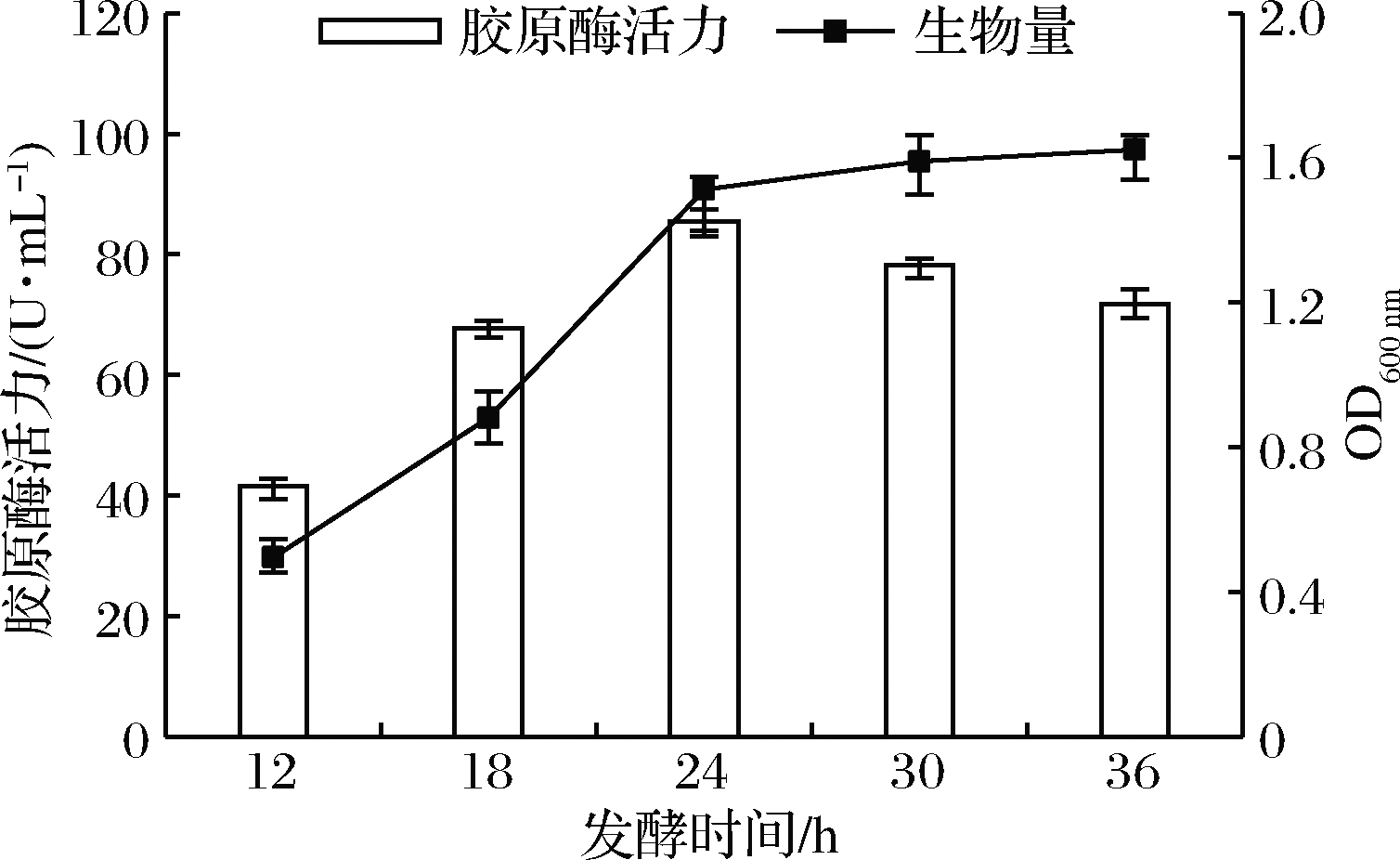
图5 发酵时间对菌株产胶原酶的影响
Fig.5 Effect of fermentation time on the production of collagenase
2.2.1 正交试验设计与结果
在单因素试验的基础上,选取对产酶活性影响较显著的菌龄(A)、加水量(B)、发酵温度(C)和发酵时间(D)4个因素,进行L9(34)正交试验,试验设计及结果见表1。
2.2.2 正交试验方差分析
由表1可知,各因素对胶原酶酶活力的影响程度大小依次是C>D>A>B,固态发酵罗非鱼皮产胶原酶的最优方案为A1B2C2D2,即种子液菌龄14 h,加水量10 mL,发酵温度35 ℃,发酵时间24 h。采用该条件进行3次平行实验,测得胶原酶的酶活力为90.05 U/mL,与优化前的64.27 U/mL相比,酶活力提高约40.1%。方差分析(表2)显示,发酵温度和发酵时间对胶原酶活性具有显著影响(P<0.05)。
表1 正交试验设计方案及结果
Table 1 Design scheme and results of orthogonal test
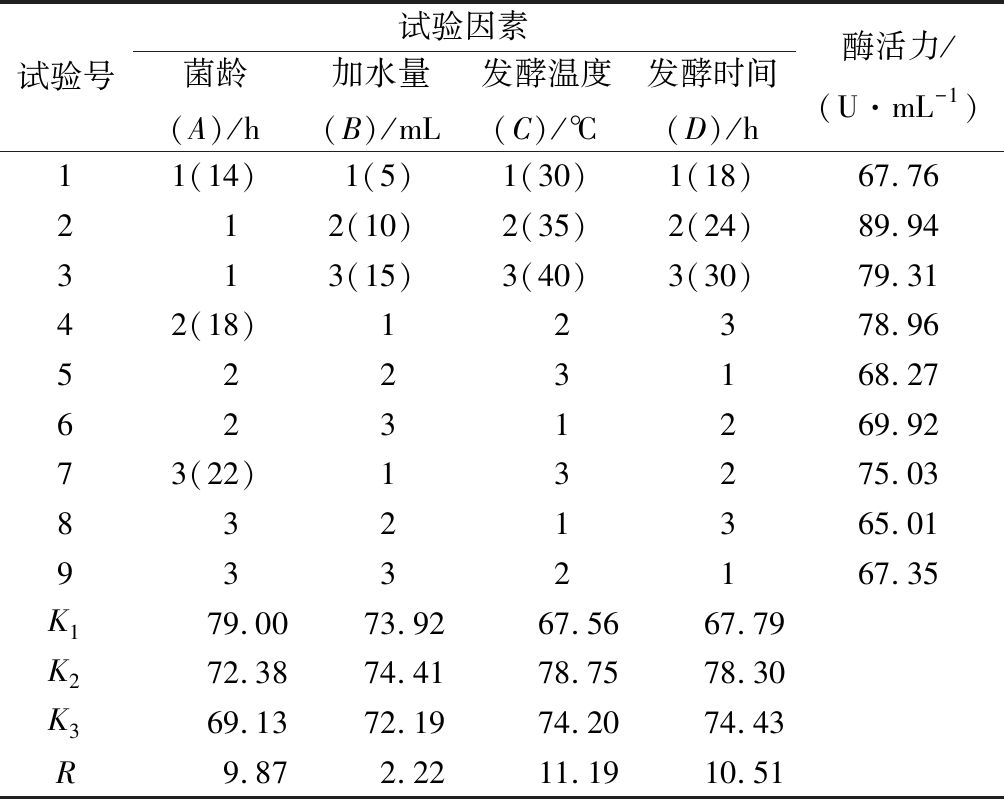
试验号试验因素菌龄(A)/h加水量(B)/mL发酵温度(C)/℃发酵时间(D)/h酶活力/(U·mL-1)11(14)1(5)1(30)1(18)67.76212(10)2(35)2(24)89.94313(15)3(40)3(30)79.3142(18)12378.965223168.276231269.9273(22)13275.038321365.019332167.35K179.0073.9267.5667.79K272.3874.4178.7578.30K369.1372.1974.2074.43R9.872.2211.1910.51
表2 方差分析结果
Table 2 Variance analysis of the orthogonal test
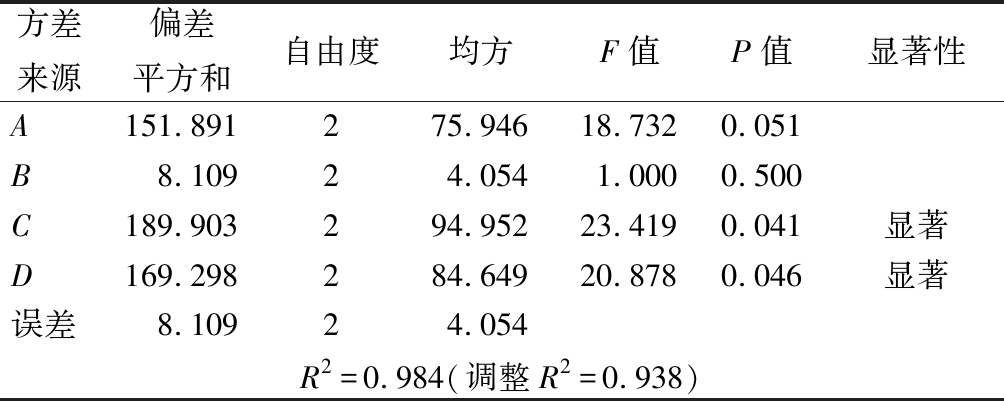
方差来源偏差平方和自由度均方F值P值显著性A151.891275.94618.7320.051B8.10924.0541.0000.500C189.903294.95223.4190.041显著D169.298284.64920.8780.046显著误差8.10924.054R2=0.984(调整R2=0.938)
在最佳产酶条件下制得SSF-TSCP,测其水解度可达41.73%,多肽含量为89.5%,对其进行氨基酸分析。由表3可知,SSF-TSCP含有7种人体必需氨基酸。脯氨酸的脂肪烃侧链能够加强多肽与多不饱和脂肪酸的相互作用,使肽与氧结合或抑制脂质中氢的释放,从而发挥抗氧化作用[22]。羟脯氨酸是胶原蛋白肽的特征氨基酸,其含量符合GB 31645—2018《食品安全国家标准 胶原蛋白肽》规定(≥3 g/100 g)[23]。研究表明,多肽中疏水性氨基酸的含量越高,其抗氧化能力越强[24]。UDENIGWE等[25]的研究发现,疏水性氨基酸在清除DPPH自由基和![]() 中起主要作用。SSF-TSCP中的疏水性氨基酸占总氨基酸含量的37.46%,高于酶解法制备的大鲵多肽(35.59%)[26]和草鱼皮蛋白肽(34.2%)[27],反映了其具有较好的抗氧化潜力。
中起主要作用。SSF-TSCP中的疏水性氨基酸占总氨基酸含量的37.46%,高于酶解法制备的大鲵多肽(35.59%)[26]和草鱼皮蛋白肽(34.2%)[27],反映了其具有较好的抗氧化潜力。
表3 SSF-TSCP的氨基酸组成
Table 3 Amino acid composition of SSF-TSCP

氨基酸种类含量/[g·(100 g)-1]氨基酸种类含量/[g·(100 g)-1]Asp 天冬氨酸5.54Leu 亮氨酸∗2.08Thr 苏氨酸∗2.25Tyr 酪氨酸0.34Ser 丝氨酸3.07Phe 苯丙氨酸∗2.21Glu 谷氨酸5.25Lys 赖氨酸∗3.18Gly 甘氨酸27.63His 组氨酸0.78Ala 丙氨酸13.21Arg 精氨酸8.24Val 缬氨酸∗2.19Hyp 羟脯氨酸8.51Met 蛋氨酸∗0.58Pro 脯氨酸13.84Ile 异亮氨酸∗1.1
注:*,必需氨基酸;疏水性氨基酸=Thr+Ala+Val+Met+Ile+Phe+Leu+Pro
2.4.1 还原能力
还原力是通过评价多肽得失电子和稳定自由基的能力来衡量抗氧化活性的重要指标[28]。如图6所示,SSF-TSCP及其分离组分TSCP-a、TSCP-b、TSCP-c均有一定的还原能力,且随着样品质量浓度的增加,各组分还原能力也逐渐增强。当质量浓度达到5 mg/mL时,组分TSCP-c的还原能力为0.962,高于SSF-TSCP(0.783),TSCP-a和TSCP-b的还原能力在该质量浓度下较弱,分别为0.588和0.621。马华威等[29]制备的鮟鱇鱼皮胶原蛋白肽在质量浓度10 mg/mL时测定还原能力,其OD700 nm仅为0.676。

图6 不同胶原肽组分和GSH的还原能力
Fig.6 Reducing power of different collagen peptide fractions and GSH
2.4.2 ·OH清除能力
·OH作为生物体内最活跃的活性氧自由基,可以降解DNA和细胞膜等,造成重要细胞的死亡和突变,危害机体健康[28]。如图7所示,在质量浓度为1~4 mg/mL时,随着质量浓度的提高,样品的·OH清除能力增强趋势明显,若质量浓度继续升高,其变化趋于平缓。在质量浓度为5 mg/mL时,组分TSCP-c的清除率为59.24%,低于GSH。对质量浓度和清除率之间作回归方程并计算半抑制浓度(half inhibitory concentration,IC50),得到SSF-TSCP、TSCP-a、TSCP-b和TSCP-c 4种样品的IC50值分别为9.01、7.41、7.92和3.83 mg/mL。MW<5 kDa的多肽组分TSCP-c清除·OH效果最好,其IC50值低于虎斑乌贼生殖腺多肽(19.4 mg/mL)[30]和金枪鱼多肽(28.81 mg/mL)[31]。

图7 不同胶原肽组分和GSH的·OH清除能力
Fig.7 Hydroxyl radical scavenging abilities of different collagen peptide fractions and GSH
![]() 清除能力
清除能力
如图8所示,与GSH相比,SSF-TSCP及其各分离组分的![]() 清除能力较弱,清除率随质量浓度的提高而逐渐增加,呈一定的量效关系。
清除能力较弱,清除率随质量浓度的提高而逐渐增加,呈一定的量效关系。
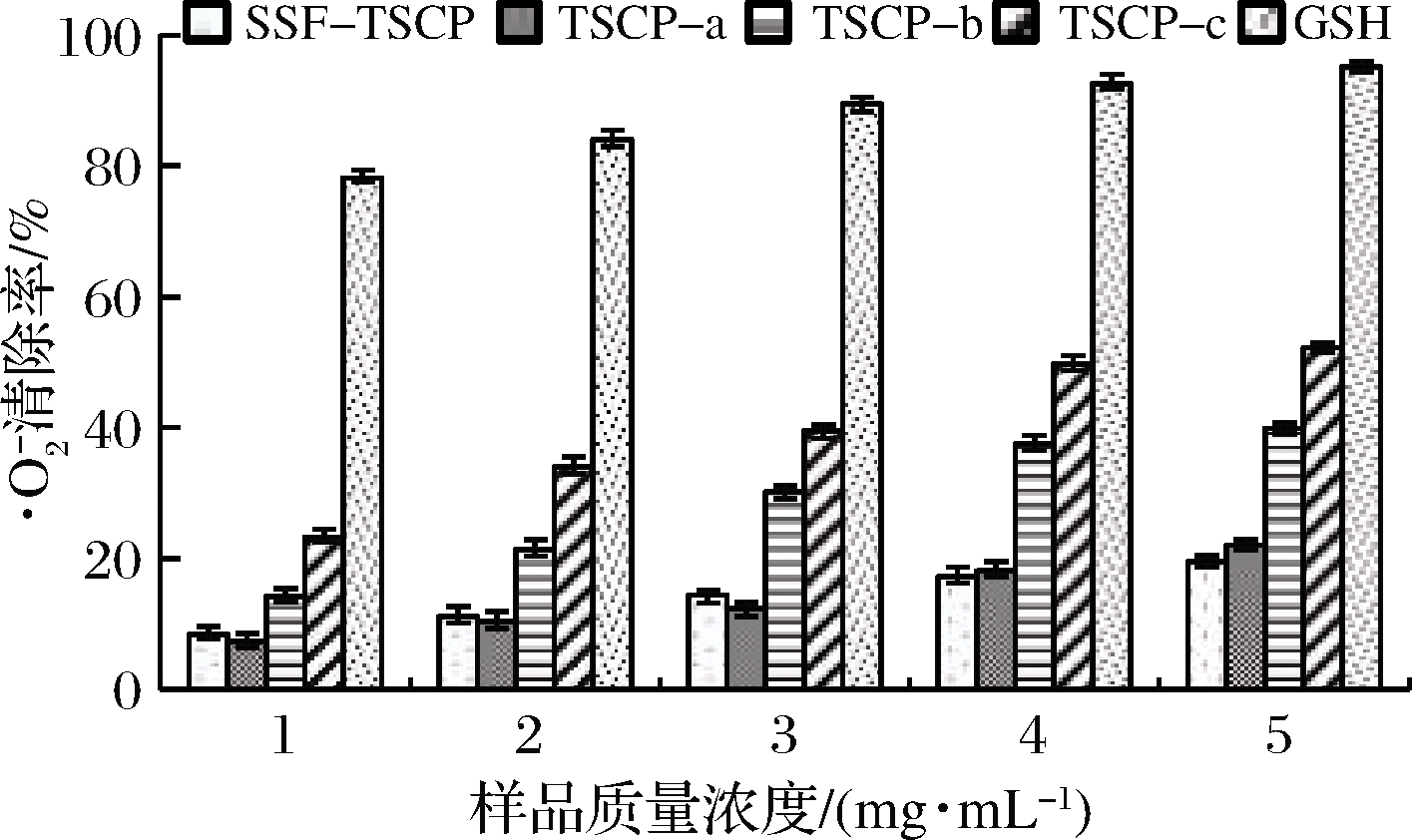
图8 不同胶原肽组分和GSH的![]() 清除能力
清除能力
Fig.8 Superoxide anion radical scavenging abilities of different collagen peptide fractions and GSH
对质量浓度和清除率之间作回归方程并计算得到SSF-TSCP、TSCP-a、TSCP-b和TSCP-c 4种样品的IC50值分别为15.63、12.58、6.28和4.19 mg/mL。这与蔡路昀等[27]确定MW<3 kDa的草鱼皮多肽组分具有较高的![]() 清除活性的结论相符,表明抗氧化基团可能主要存在于小分子肽段。胡小军等[32]制备的鱿鱼蛋白酶解肽,其清除
清除活性的结论相符,表明抗氧化基团可能主要存在于小分子肽段。胡小军等[32]制备的鱿鱼蛋白酶解肽,其清除![]() 的IC50值为10.3 mg/mL。李露园等[33]制备的鲟鱼皮胶原蛋白多肽,清除能力最强的组分(MW 1 k~5 kDa)的IC50值为5.938 mg/mL,均低于TSCP-c。
的IC50值为10.3 mg/mL。李露园等[33]制备的鲟鱼皮胶原蛋白多肽,清除能力最强的组分(MW 1 k~5 kDa)的IC50值为5.938 mg/mL,均低于TSCP-c。
2.4.4 DPPH自由基清除能力
如图9所示,SSF-TSCP及其分离所得的3个多肽组分均有较好的DPPH自由基清除能力,清除率与其质量浓度呈正相关。当质量浓度为5 mg/mL时,TSCP-c的清除率最高,可达到70.23%,TSCP-a的清除活性最低,为48.13%。这与2者还原能力的表现相同,可能是由于这2种判定抗氧化能力的方法均是基于多肽给电子能力的原理测定。

图9 不同胶原肽组分和GSH的DPPH自由基清除能力
Fig.9 DPPH radical scavenging abilities of different collagen peptide fractions and GSH
对质量浓度和清除率之间作回归方程并计算得到SSF-TSCP、TSCP-a、TSCP-b和TSCP-c 4种样品的IC50值分别为5.26、7.81、6.47和2.37 mg/mL。田裕心等[34]报道的鲍鱼内脏多肽(4.61 mg/mL)和CHI等[35]报道的绿鳍马面鲀鱼皮胶原肽(5.22 mg/mL)对DPPH自由基的清除活性均小于TSCP-c。SSF-TSCP的还原力高于TSCP-a、TSCP-b,但其清除DPPH自由基的能力却低于这两者,可能是由于多肽的自由基清除活性较还原力而言受到的影响因素更多也更为复杂,如pH、分子质量等[36]。
以罗非鱼鱼皮为原料,以胶原酶酶活力为评价指标,先后考察初始pH、菌龄、加水量、发酵温度和发酵时间5个因素对枯草芽孢杆菌固态发酵罗非鱼皮产酶的影响。设计正交试验优化培养条件,得到产酶的最佳条件为:培养基初始pH值为7,种子液菌龄为14 h,加水量为10 mL,发酵温度为35 ℃,发酵时间为24 h,在此条件下胶原酶酶活力可达90.05 U/mL,较优化前提高了约40.1%。在最佳产酶条件下制备SSF-TSCP,测定其产物水解度和多肽含量均较高,证明胶原酶酶活力作为评价指标,能够准确有效地反映目标产物胶原多肽的水解程度和产量。氨基酸组成分析表明,SSF-TSCP的疏水性氨基酸占总氨基酸的37.46%,具有胶原蛋白肽的特征氨基酸羟脯氨酸,且含量较高,表明样品纯度较高。体外抗氧化活性研究发现,罗非鱼皮胶原蛋白肽中的抗氧化基团主要存在于小分子肽段,组分TSCP-c(MW<5 kDa)的抗氧化能力最强,清除![]() 和DPPH自由基的IC50值分别为3.83、4.19和2.37 mg/mL,且具有较好的还原力。本研究建立了一种从罗非鱼下脚料中提取胶原蛋白肽的新型生物技术模型,所提出的发酵工艺简单、高效、经济、环保,为实现水产资源的高值化利用提供了新的思路和工业化的理论依据。
和DPPH自由基的IC50值分别为3.83、4.19和2.37 mg/mL,且具有较好的还原力。本研究建立了一种从罗非鱼下脚料中提取胶原蛋白肽的新型生物技术模型,所提出的发酵工艺简单、高效、经济、环保,为实现水产资源的高值化利用提供了新的思路和工业化的理论依据。
[1] GHAZANFARI S,KHADEMHOSSEINI A,SMIT T H.Mechanisms of lamellar collagen formation in connective tissues[J].Biomaterials,2016,97:74-84.
[2] HONG H,FAN H B,CHALAMAIAH M,et al.Preparation of low-molecular-weight, collagen hydrolysates (peptides): Current progress, challenges, and future perspectives[J].Food Chemistry,2019,301:125 222.
[3] 聂凌鸿,冯怡秋.鳝鱼皮胶原蛋白肽的制备及其抗氧化性能的研究[J].中国食品添加剂,2017(11):113-118.
[4] WU Ribang,WU Cuiling,LIU Dan,et al.Antioxidant and anti-freezing peptides from salmon collagen hydrolysate prepared by bacterial extracellular protease[J].Food Chemistry,2017,248:346-352.
[5] AHMED R,CHUN B S.Subcritical water hydrolysis for the production of bioactive peptides from tuna skin collagen[J].The Journal of Supercritical Fluids,2018,141:88-96.
[6] 杨树奇,曾少葵,周春霞,等.3种鱼皮的基本成分及氨基酸组成分析[J].广东海洋大学学报,2010,30(1):97-100.
[7] 曾少葵,杨萍,陈秀红.微生物发酵对罗非鱼下脚料蛋白酶解液脱腥去苦效果比较[J].南方水产,2009,5(4):58-63.
[8] 隋文杰,刘锐,吴涛,等.固态发酵在食品加工中的应用研究进展[J].生物产业技术,2018(3):13-23.
[9] HE Rong,JU Xingrong,Yuan Jian,et al.Antioxidant activities of rapeseed peptides produced by solid state fermentation[J].Food Research International,2012,49(1):432-438.
[10] CHUNG L,DINAKARPANDIAN D,YOSHIDA N,et al.Collagenase unwinds triple-helical collagen prior to peptide bond hydrolysis[J].The EMBO Journal,2004,23(15):3 020-3 030.
[11] 杨莉莉.鱼鳞胶原肽的分步酶解法制备及其特性研究[D].武汉:华中农业大学,2011.
[12] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.5—2016,食品安全国家标准 食品中蛋白质的测定[S].北京:中国标准出版社,2016.
[13] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.124—2016,食品安全国家标准 食品中氨基酸的测定[S].北京:中国标准出版社,2016.
[14] ZHANG Y F,FU Y,ZHOU S F,et al.A straightforward ninhydrin-based method for collagen proteolytic enzyme activity and inhibitor screening of collagen proteolytic enzyme using spectrophotometry[J].Analytical Biochemistry,2013,437(1):46-48.
[15] OYAIZU M.Studies on product of browning reaction prepared from glucose amine[J].Japanese Journal of Nutrition,1986,44(6):307-315.
[16] SMIRNOFF N,CUMBES Q J. Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1 057-1 060.
[17] 杜昕,李诚,肖岚,等.牦牛血抗氧化肽制备方法对比及分离纯化研究[J].食品与生物技术学报,2018,37(8):861-867.
[18] KANDI S,CHARLES A L.Statistical comparative study between the conventional DPPH, spectrophotometric and dropping DPPH, analytical method without spectrophotometer: Evaluation for the advancement of antioxidant activity analysis[J].Food Chemistry,2019,287:338-345.
[19] NURDIANI R,VASILJEVIC T,YEAGER T,et al.Bioactive peptides with radical scavenging and cancer cell cytotoxic activities derived from Flathead (Platycephalus fuscus) by-products[J].European Food Research & Technology,2017,243(4):627-637.
[20] SINGHANIA R R,PATEL A K,SOCCOL C R,et al.Recent advances in solid-state fermentation[J].Biochemical Engineering Journal,2009,44(1):13-18.
[21] 李星硕,朱玥明,管于平,等.产胶原酶菌株的筛选鉴定、发酵优化及胶原酶纯化[J].微生物学报,2016,56(6):1 034-1 043.
[22] 张晖,唐文婷,王立,等.抗氧化肽的构效关系研究进展[J].食品与生物技术学报,2013,32(7):673-679.
[23] 中华人民共和国国家卫生卫生委员会,国家食品药品监督管理总局.GB 31645—2018,食品安全国家标准 胶原蛋白肽[S].北京:中国标准出版社,2018.
[24] JE J Y,PARK S Y,HWANG J Y,et al.Amino acid composition and in vitro antioxidant and cytoprotective activity of abalone viscera hydrolysate[J].Journal of Functional Foods,2015,16:94-103.
[25] UDENIGWE C,ALUKO R.Chemometric analysis of the amino acid requirements of antioxidant food protein hydrolysates[J].International Journal of Molecular Sciences,2011,12(5):3 148-3 161.
[26] 胡廷,青维,李美凤,等.大鲵多肽体外抗氧化活性研究[J].食品科技,2018,43(6):254-259.
[27] 蔡路昀,冷利萍,李秀霞,等.草鱼鱼皮不同分子量肽段体外抗氧化性能的研究[J].食品工业科技,2017,38(12):58-64.
[28] 曾维才,石碧.天然产物抗氧化活性的常见评价方法[J].化工进展,2013,32(6):1 205-1 213;1 247.
[29] 马华威,杨会成,付万冬,等.鮟鱇鱼皮胶原蛋白肽的抗氧化活性[J].食品科学,2014,35(9):80-84.
[30] 陈敏,陈道海.虎斑乌贼生殖腺多肽的制备工艺优化及其体外抗氧化活性[J].食品与发酵工业,2019,45(11):129-135.
[31] 龚志强,王朋,赵玉谨,等.金枪鱼碎肉水解液喷雾干燥工艺优化及抗氧化活性研究[J].安徽农业科学,2015,43(4):297-299;303.
[32] 胡小军,江敏,莫秋远,等.鱿鱼肌肉蛋白肽的制备工艺优化及其抗氧化活性[J].食品工业科技,2017,38(5):191-195.
[33] 李露园,王升帆,朱有贵,等.酶法制备鲟鱼皮胶原蛋白多肽及其抗氧化活性研究[J].食品与发酵工业,2019,45(20):138-143.
[34] 田裕心,彭亚博,姚昱锟,等.响应面优化鲍鱼内脏抗氧化肽制备工艺及其活性[J].食品工业,2019,40(4):110-115.
[35] CHI C F,WANG B,HU F Y,et al. Purification and identification of three novel antioxidant peptides from protein hydrolysate of bluefin leatherjacket (Navodon septentrionalis) skin[J].Food Research International,2015,73:124-129.
[36] 蔡俊,陈季旺,王茹,等.多肽体外抗氧化活性测定方法的比较[J].食品科学,2016,37(11):52-57.
XING Hanwen,HAN Wei,SHI Wenzheng, et al. Tilapia skin collagen peptides prepared by solid-state fermentation and its antioxidant activity[J].Food and Fermentation Industries,2020,46(19):104-113.