红树莓(Rubus idaeus L.)是一种蔷薇科悬钩子属的浆果,果实多汁可口,营养丰富,富含多酚、超氧化物歧化酶 (superoxide dismutase,SOD)、水杨酸和树莓酮等多种生物活性成分[1-3],具有良好的药食同源性。树莓也是一种很好的多糖来源[4],有些品种多糖含量甚至高达12%[5]。目前,国内对于红树莓多糖的研究报道较少。
乳酸菌具有调节肠道菌群、增强机体免疫力、缓解过敏和降低胆固醇等作用[6-9],能够降低肠道中引发致癌的相关酶(如葡萄糖醛酸酶、硝基还原酶)活性[10]。双歧杆菌作为维持人体肠道菌群平衡的有益菌[11],一直广泛应用于饮料、乳制品等食品加工中[12]。研究表明,黑加仑果汁中的多糖可以抑制肠道沙门氏菌生长并促进乳杆菌增殖[13];低丛蓝莓果实中的多糖能够促进鼠李糖乳杆菌的肠道定植[14];枸杞多糖能促进乳酸菌增殖[15]。然而,有关红树莓多糖与乳酸菌生长关系的研究报道较少。
我国野生树莓资源丰富,树莓产量逐年提高[16],开发高值化加工方式有助于推进树莓种植业的发展。本研究以粗多糖得率为指标,通过单因素与响应面正文试验,探究树莓提取物的适宜制备参数;将树莓提取物加入MRS培养基,探讨树莓多糖与乳酸菌生长的关系。在此基础上,对乳酸菌制备发酵树莓饮料的理化与感官特性进行评估,旨在为树莓果实的进一步利用提供依据。
1 材料与方法
1.1 实验材料与处理
供试菌株植物乳杆菌(Lactobacillus plantarum)121、嗜酸乳杆菌(Lactobacillus acidophilus)NCFM,上海杜邦公司;长双歧杆菌(Bifidobacterium longum)1.218 6,北京林业大学生物学院林业食品加工与安全北京市重点实验室。首先,取1.0 g冷冻干燥菌粉到1.0 mL无菌蒸馏水中溶解,按照10%(体积分数)的接种量将乳杆菌和双歧杆菌分别接种于 MRS液体培养基和BBL液体培养基中,37 ℃厌氧培养18 h,传代2次恢复菌株活力。
红树莓果实品种为海尔特兹(Heritage),由陕西省榆林市林业工作站提供。
1.2 主要试剂和仪器
无水乙醇、苯酚,天津市永大化学试剂有限公司;浓H2SO4、石油醚,北京化工厂。以上试剂均为分析纯。乙腈(色谱纯),赛默飞世尔科技(中国)有限公司。
LC-20AT高效液相色谱仪,日本岛津公司;FD-1冷冻干燥机,北京德天佑科技发展有限公司;QsonicaQ700智能型超声波破碎仪,奥然科技有限公司;GL-20G-II高速冷冻离心机,武汉华科达实验设备有限公司;SHB-III循环水式多用真空泵,上海振捷实验设备有限公司;RE-2000A旋转蒸发器,上海亚荣生化仪器厂;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 树莓中主要营养成分含量测定
果实多糖含量采用高效液相色谱法测定。参照GB 5009.8—2016 《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》第一法,选用氨基色谱柱(250 mm×4.6 mm);流动相:V(乙腈)∶V(水)=70∶30;流速:1.0 mL/min;柱温:40 ℃;进样量:20 μL;示差折光检测器温度:40 ℃;蒸发光散射检测器温度:80~90 ℃;氮气压力:508 kPa。
果实中蛋白质含量采用凯氏定氮法测定。称取4.0 g树莓果浆于消化管中,再加0.4 g CuSO4、0.6 g K2SO4及20.0 mL浓H2SO4于消化炉中消化。消化炉温度达到420 ℃后,持续消化1 h,再取出冷却,加入50.0 mL蒸馏水于自动凯氏定氮仪上测定。
果实中脂肪的测定采用索氏抽提法。称量3.0 g树莓果浆,100 ℃烘箱中烘干后取出研细,全部移入滤纸筒内。将滤纸筒放入索氏抽提器的抽提筒内,连接已经干燥至恒定质量的接收瓶,使用石油醚不断回流抽提8 h。提取结束后取下接收瓶,待接收瓶内溶剂剩余2.0 mL时在水浴上蒸干,再于100 ℃干燥1 h,冷却后称量。重复以上操作直至2次称量差≤2 mg。
其余营养元素的具体测定方法见表2。
1.4 树莓提取物中多糖制备条件优化
树莓提取物制备工艺流程:
树莓果浆 →水浴浸提 →果渣超声 → 合并抽滤 →滤液浓缩 → 醇沉→ 离心(收集沉淀)→ 冷冻干燥 → 收集
树莓提取物收集后,测定其多糖含量。准确称取0.1 g树莓提取物溶解于适量蒸馏水中,吸取0.1 mL提取物溶液,分别加入1.9 mL蒸馏水,空白对照为2.0 mL蒸馏水,之后加入1.0 mL 60 g/L苯酚溶液,摇匀后迅速加5.0 mL浓H2SO4于试管中,摇匀后置于沸水浴中加热15 min,迅速冷却至室温,测定OD490 nm,按公式(1)计算糖含量:
糖含量![]()
(1)
式中:ρ,溶液质量浓度,mg/mL;D,稀释倍数;V,提取液体积,mL;m,样品干质量,g。
1.4.1 葡萄糖标准曲线制作
准确称取烘干至恒定质量的葡萄糖标准品25.0 mg,用蒸馏水定容至250 mL容量瓶中,即得到0.1 mg/mL的葡萄糖标准溶液。准确吸取0.2、0.4、0.6、0.8和1.0 mL葡萄糖标准溶液置于试管中,加蒸馏水至2.0 mL,空白对照加2.0 mL蒸馏水,再各加入1.0 mL 60 g/L的苯酚溶液,摇匀后再迅速加入5.0 mL浓H2SO4,摇匀后沸水浴中加热15 min,迅速冷却至室温,测定OD490 nm,以葡萄糖质量浓度为x,吸光值为y,得到标准方程y=13.25x-0.006 7,相关系数R2=0.998 7。
1.4.2 料液比选择
准确称取树莓果浆每份50 g,按照料液比1∶2、1∶3、1∶4和1∶5(g∶mL)分别加入蒸馏水,在300 W、40 kHz超声水浴处理40 min,取出后8 000 r/min离心10 min,冷却至室温取出上清液,将沉淀置于超声波破碎仪中破碎15 min(工作5 s,间隔5 s),之后与上清液合并抽滤,将滤液在60 ℃、40 r/min下旋转蒸发得到浓缩滤液后,按照滤液体积保证乙醇体积分数为85%,在4 ℃下醇沉24 h,然后8 000 r/min离心10 min收集沉淀物,冷冻干燥即得到树莓提取物。
1.4.3 提取时间选择
准确称取树莓果浆每份50 g,按照料液比1∶3(g∶mL)分别加入蒸馏水,在300 W、40 kHz超声水浴中分别处理30、40、50和60 min,后续步骤与1.4.2方法一致。
1.4.4 乙醇体积分数选择
准确称取树莓果浆每份50 g,按照料液比1∶3(g∶mL)分别加入蒸馏水,在300 W、40 kHz超声水浴中处理40 min,醇沉前步骤与1.4.2方法一致,之后按照滤液体积保证乙醇体积分数为65%、75%、85%和95%,在4 ℃下醇沉24 h,8 000 r/min离心10 min收集沉淀物,冷冻干燥即得到树莓提取物。
1.4.5 响应面分析
以料液比A、超声时间B和乙醇体积分数C为自变量,粗多糖提取率Y为因变量,设计响应面实验,因素水平设置如表1所示。
表1 响应面实验因素水平表
Table 1 Factors and levels for optimizing extraction of raspberry polysaccharide via response surface analysis
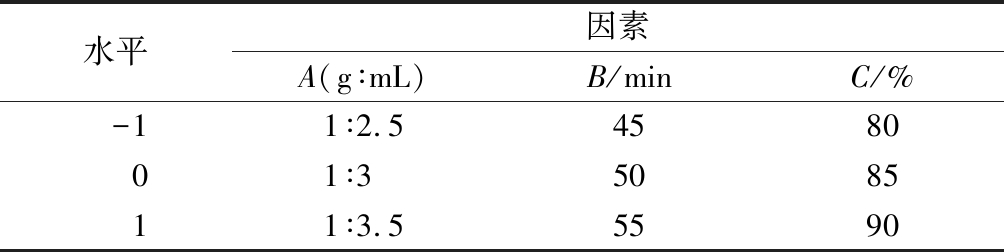
水平因素A(g∶mL)B/minC/%-11∶2.5458001∶3508511∶3.55590
1.5 乳酸菌生长状况的评价
配制MRS培养基和BBL培养基[17],同时按照每升MRS液体培养基中20 g葡萄糖+5 g树莓提取物、15 g葡萄糖+5 g树莓提取物的比例分别配制树莓改良MRS液体培养基,按照每升BBL液体培养基中20 g葡萄糖+5 g树莓提取物的比例配制树莓改良BBL液体培养基。其中树莓提取物溶液使用0.22 μm针头式过滤器过滤以达到除菌目的。其余组分则使用高压灭菌锅在121 ℃灭菌20 min。接着在无菌环境中混合并使用灭菌的NaOH溶液(1 mol/L)调节改良培养基pH至6.5。
将活化好的植物乳杆菌121、嗜酸乳杆菌NCFM和长双歧杆菌1.2186分别按照5%(体积分数)接种量接入MRS培养基、BBL培养基及对应的改良培养基中,在37 ℃培养12 h,其中BBL培养基与BBL改良培养基置于无氧环境中培养,然后进行平板计数[18]。
1.6 双歧杆菌发酵树莓果汁的理化性质探究
取树莓鲜果分为等质量的2份,将其中一份树莓鲜果打浆,依次用普通滤纸、0.80、0.45和0.22 μm超滤膜减压真空抽滤,过滤出澄清果汁。然后将另一份树莓鲜果提取物与已过滤除菌的树莓果汁混合。将混合后的果汁搅拌均匀,分为等体积的2组,一组按照108 CFU/100 mL的接种量接入长双歧杆菌1.2186,置于37 ℃静置发酵12 h,接着转入4 ℃贮藏 24 h。另一组果汁则一直贮藏于4 ℃。
依据GB/T 15038—2006《葡萄酒、果酒通用分析方法》[19]测定2组树莓果汁中的总酸、挥发性酸和pH等指标,依据GB/T 12143—2008《饮料通用分析方法》[20]测定2组树莓果汁中的总黄酮。花色苷含量的测定则采用吸光光度法测定矢车菊-3-葡萄糖苷(树莓中的主要花色苷)的浓度,分别在pH值为1.0和4.5的条件下,测定OD510 nm计算获得花色苷含量[21]。单宁和总酚的测定方法分别参考陈国刚等[22]和郎惠云等[23]的方法。
取2组果汁各2.0 mL,加入2.0 mL 0.1 mmol/L 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazy1,DPPH)无水乙醇溶液,摇匀,静置20 min。以无水乙醇作为空白,测定OD517 nm值记为A样品;将样品果汁稀释,按照相同方法测得吸光度得A对照;将2.0 mL的DPPH溶液与无水乙醇混合,静置20 min后按照相同方法测得吸光度得A空白[24-25]。再按公式(2)计算出DPPH自由基清除率:
DPPH自由基清除率![]()
(2)
用0.45 μm的针头式过滤器过滤样品果汁,用分光光度计测定OD450 nm、OD520 nm、OD570 nm和OD630 nm,根据公式计算出三色值X、Y、Z,从而得出CIE1976Lab参数L*、a*、b*[26]。
1.7 双歧杆菌发酵树莓果汁的风味评价
将接种长双歧杆菌1.2186的树莓果汁与未接种的树莓果汁随机编码,放在通风良好、无任何气味的房间内,选择20名受过感官评价训练的人员,从外观(包括颜色熟悉度、颜色深浅和澄清度)、香气(包括香气熟悉度、香气强度和香气浓郁度)、口感(包括口感熟悉度、甜度、酸度、苦度、涩度和余味强度)方面进行感官评价。感官评价打分均以7分为标准,并统计分析20位评价人员的打分结果。
1.8 数据处理
本研究中所有试验均重复3次,数据采用Origin 2018软件进行统计分析,响应面设计采用 Design Expert 11.0软件完成。实验数据均为平均值±标准差。
2 结果与分析
2.1 树莓营养元素检测
海尔特兹树莓中的营养成分构成如表2所示。结果表明,海尔特兹树莓鲜果中Ca、Fe、K和P等微量元素含量明显较其他品种高[27]。树莓鲜果中主要的单糖组分为果糖及葡萄糖,而粗多糖在没有优化提取工艺时得率仅为0.21%,与延海莹等[27]的研究有较大差异。因此,后续实验对树莓粗多糖的提取工艺进行优化。综合对比树莓鲜果的营养构成与MRS培养基[18],可知树莓鲜果中有充足的碳源,微量元素与维生素可以供微生物利用,但是蛋白质比较匮乏。此外,树莓鲜果中总酸(以柠檬酸计)含量为(1.557±0.002) g/100 g,酸度较高,因此,若使用树莓提取物培养乳酸菌时需要调节pH。
2.2 树莓粗提物制备条件的优化结果
2.2.1 单因素试验分析
图1-a、图1-b、图1-c分别是按照不同料液比、体积分数和超声时间制备树莓提取物后,提取物中粗多糖得率的变化。
表2 树莓鲜果营养成分表
Table 2 Raspberry nutrition facts
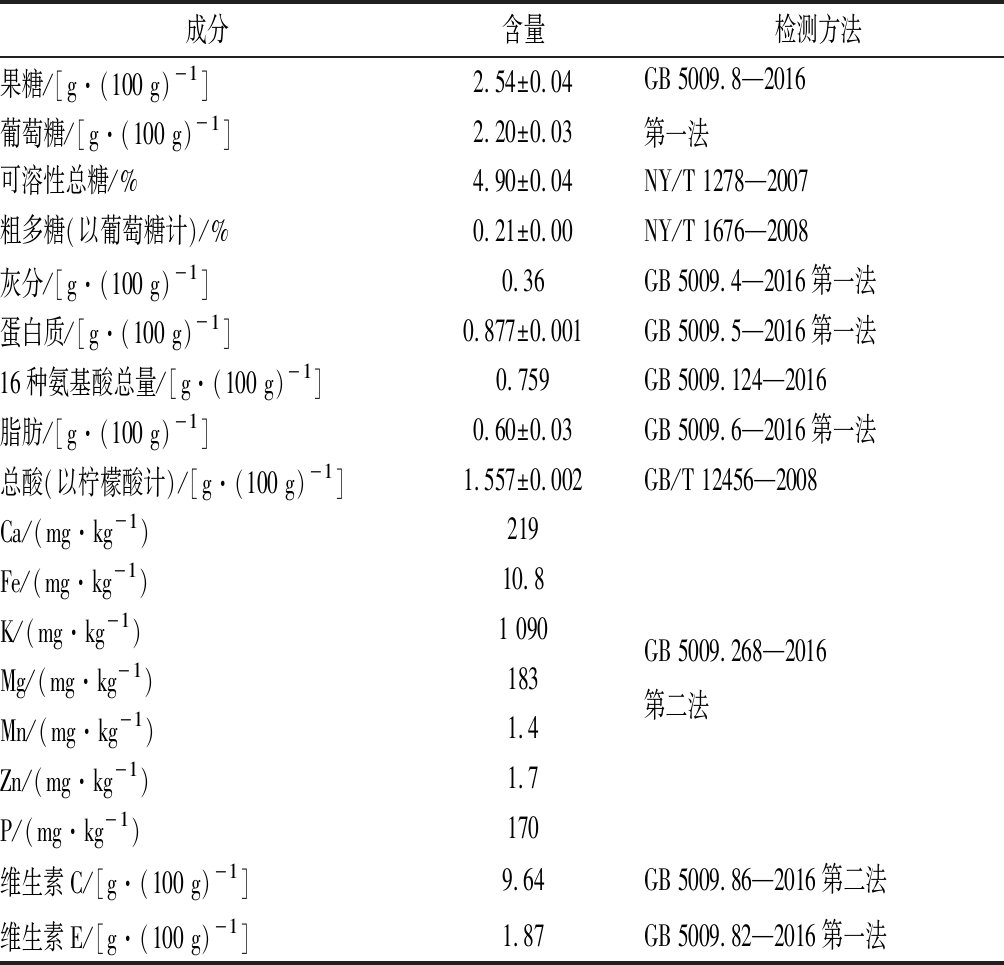
成分含量检测方法果糖/[g·(100 g)-1]2.54±0.04葡萄糖/[g·(100 g)-1]2.20±0.03GB 5009.8—2016第一法可溶性总糖/%4.90±0.04NY/T 1278—2007粗多糖(以葡萄糖计)/%0.21±0.00NY/T 1676—2008灰分/[g·(100 g)-1]0.36GB 5009.4—2016第一法蛋白质/[g·(100 g)-1]0.877±0.001GB 5009.5—2016第一法16种氨基酸总量/[g·(100 g)-1]0.759GB 5009.124—2016脂肪/[g·(100 g)-1]0.60±0.03GB 5009.6—2016第一法总酸(以柠檬酸计)/[g·(100 g)-1]1.557±0.002GB/T 12456—2008Ca/(mg·kg-1)219Fe/(mg·kg-1)10.8K/(mg·kg-1)1 090Mg/(mg·kg-1)183Mn/(mg·kg-1)1.4Zn/(mg·kg-1)1.7P/(mg·kg-1)170GB 5009.268—2016第二法维生素C/[g·(100 g)-1]9.64GB 5009.86—2016第二法维生素E/[g·(100 g)-1]1.87GB 5009.82—2016第一法
由图1可知,当提取的料液比为1∶3(g∶mL)时,粗多糖得率达到最大值2.794%。当超声时间达到50 min时,粗多糖得率达到最大值2.859%;在醇沉过程中,当乙醇体积分数为85%时,粗多糖得率最大,为3.611%。
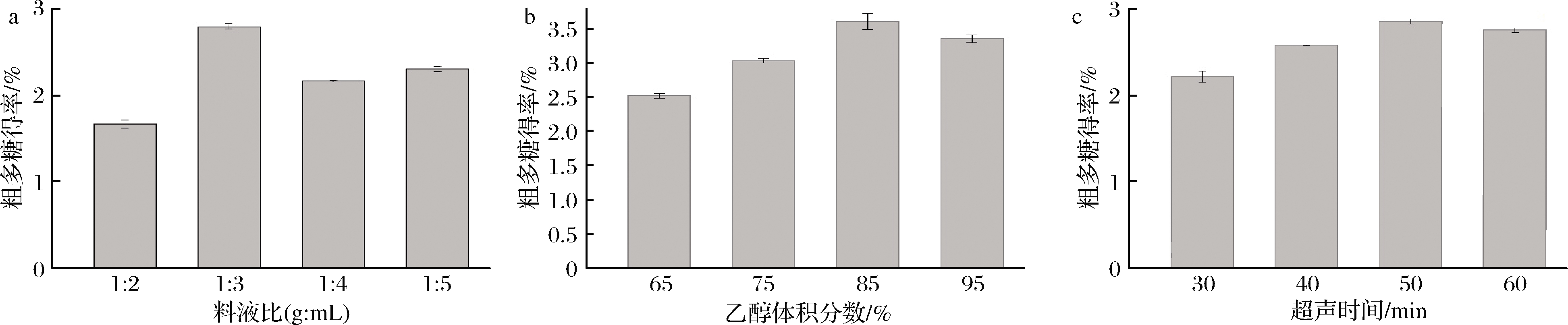
a-料液比;b-乙醇体积分数;c-超声时间
图1 提取因素对粗多糖得率的影响
Fig.1 Effect of extraction factors on extraction rate of crude polysacoharide
2.2.2 响应面设计分析
响应面模型F值为25.24,置信区间达99.8%,且P<0.01,说明该模型具有显著性[28],且失拟项P<0.01,失拟项显著,模型构建成功。利用 Design Expert 11 软件进行多元拟合,获得提取工艺对料液比(A)、超声时间(B)和乙醇体积分数(C)的二次多项回归模型方程为:Y=3.38+0.145 9A+0.267 6B+0.341C+0.089AB+0.055 3AC+0.116 2BC-0.561 6A2+0.037 9B2-0.109 3C2。图2为响应曲面图,结合方差分析结果可知,3个因素对树莓粗多糖提取率的影响程度由大到小依次是乙醇体积分数、超声时间、料液比。由图2可知,在料液比约为1∶3(g∶mL)时,树莓粗多糖得率最高,树莓粗多糖得率随超声水浴时间变长而升高,随乙醇体积分数升高而升高。树莓提取物制备的理论最佳工艺为料液比1∶3.191(g∶mL)、超声时间53.85 min、乙醇体积分数85.64%,最优工艺条件下树莓粗多糖的得率理论值为3.66%。在此条件下进行3次平行验证试验,树莓粗多糖的得率为3.88%,与理论值接近,表明响应曲面优化的工艺条件可行。

a-A,B互相影响; b-B,C 互相影响;c-A,C 互相影响
图2 提取因素对粗多糖得率影响的响应面图
Fig.2 Response surface plots of the effect of extraction factors on extraction rate of crude polysaccharide
2.3 树莓提取物对乳酸菌生长数量的作用
由图3可知,对于植物乳杆菌121和嗜酸乳杆菌NCFM,改良树莓MRS培养基对于菌株的增殖作用并不明显,甚至加入树莓提取物之后,菌株生长反而受到了抑制。但是对于长双歧杆菌1.218 6,添加5 g树莓提取物的BBL改良培养基活菌数高于普通BBL培养基,说明树莓提取物对于长双歧杆菌1.218 6生长有较好的促进作用。

图3 各培养基乳酸菌生长情况
Fig.3 Growth of lactic acid bacteria in different media
2.4 树莓果汁的理化指标
表3对比了接种长双歧杆菌1.2186树莓果汁与未接种树莓果汁之间的理化指标。未接种树莓果汁中挥发酸高达1.349 g/L,而接种菌的树莓果汁挥发酸含量更高,达2.280 g/L,但是其pH之间差异不显著。接种菌的树莓果汁的花色苷、单宁和黄酮等活性物质含量更高,同时也有着更高的DPPH自由基清除率,达94.20%。一般来说,乳酸菌的抗氧化机制主要包括自身产生抗氧化物质[如谷胱甘肽(glutathione,GSH)、叶酸],参与调节抗氧化信号通路从而下调活性氧自由基的产生[29]。此外,已有研究表明,植物中的黄酮(如荷叶黄酮)可以提高2种益生菌的胞内SOD和GSH酶活力,对保加利亚乳杆菌的抗氧化能力有明显协同增效作用[30],这可能是加入长双歧杆菌的树莓果汁表现出更强DPPH自由基清除能力的原因。CIELab值分析表明,L*、a*、b*和Cab饱和度值均存在显著性差异,Hab色调角不存在显著性差异,并且接种长双歧杆菌1.2186的树莓果汁饱和度较高、明亮度高,而未接种菌株的树莓果汁偏红色色调的趋势更加明显。显然,2种果汁在上述指标上存在显著差异。
表3 两种树莓果汁的理化指标
Table 3 Physical and chemical indexes of two kinds of raspberry juice

样品果汁+双歧果汁总酸含量/(g·L-1)28.323±1.414a18.279±0.412bpH3.17±0.14a3.27±0.01a挥发酸含量/(g·L-1)2.280±0.201a1.349±0.147b花色苷含量/(mg·L-1)33.070±2.160a15.591±0.923b单宁含量/(mg·L-1)46 22±170a2572±19b总黄酮含量/(mg·L-1)244.923±6.944a168.100±8.777b总酚含量/(mg·L-1)1 766±44a1397±69bL∗69.004±0.445a36.754±2.627ba∗31.642±0.709a59.495±0.148bb∗25.344±1.009a48.401±2.275bCab/%96.00±6.93a45.33±1.53bHab/°60.75±4.72a58.39±1.55aDPPH自由基清除率/%94.20±1.77a86.71±0.25b
注:每一行数字上标不同字母代表了显著性差异,P<0.05为显著
2.5 红树莓果汁感官品质评估
进一步对2种树莓果汁进行感官评价,由外观、香气评价雷达图(图4)可知,2种果汁的颜色评分均较高,果汁的颜色偏浅;在香气浓郁度方面,整体打分较低,说明香气较淡。整体来看,结合显著性差异分析,2种果汁在香气上无显著性差异,但在外感描述上,颜色熟悉度、颜色深浅和澄清度3方面均存在显著性差异。

图4 外观、香气评价雷达图
Fig.4 Radar map about appearance and aroma evaluation of raspberry juice
由口感评价数据分析结果(图5)可知,在甜度、酸度、涩度和余味强度这4项评价指标上,2种果汁无显著性差异,而在口感熟悉度、苦度这2个评价指标上,两者存在显著性差异。接种长双歧杆菌1.2186的果汁口感熟悉度较差,苦度相对较低。因此,在果汁开发过程中应该注意调节苦度。
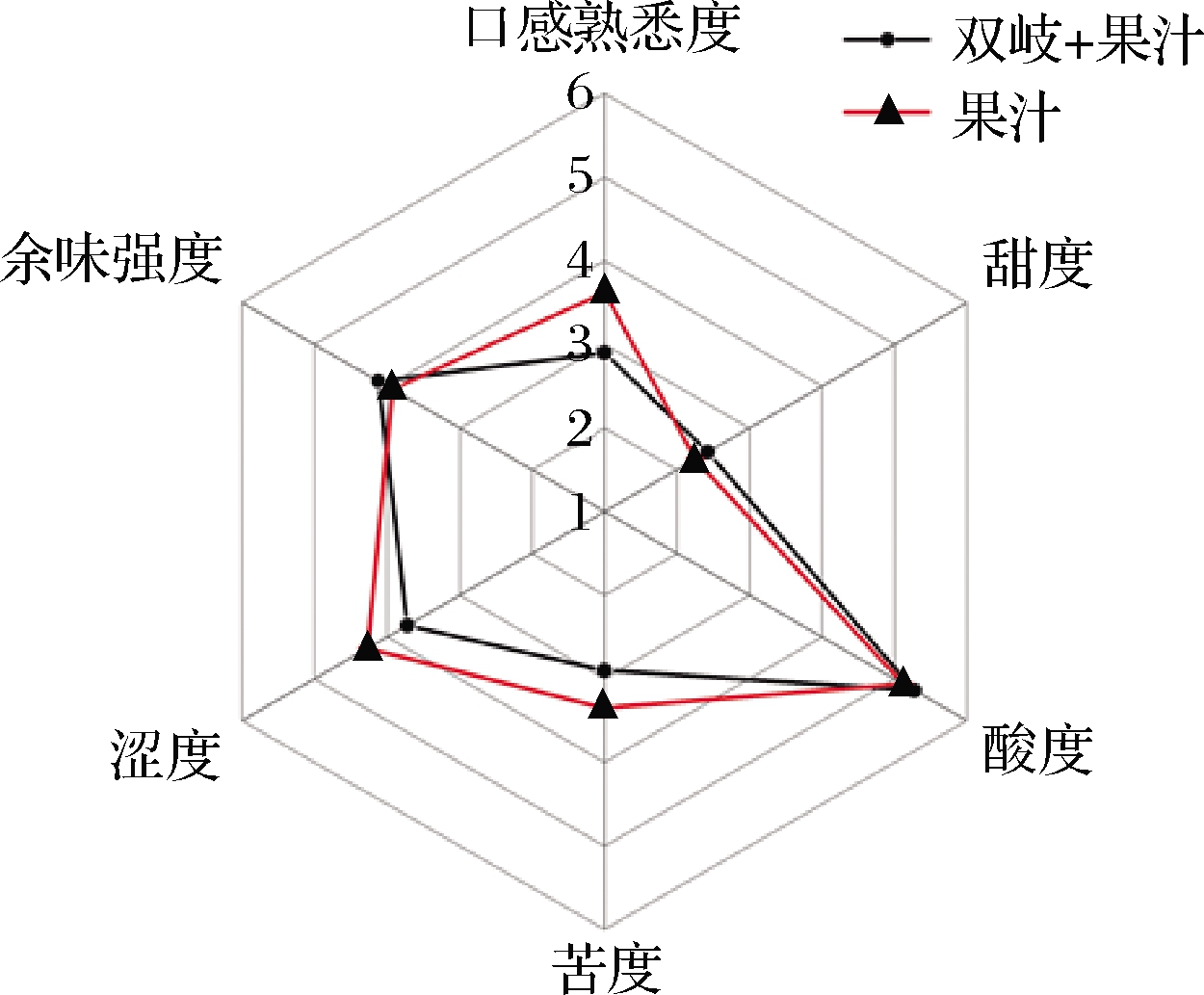
图5 口感评价雷达图
Fig.5 Radar map about taste evaluation of raspberry juice
3 结论
(1)本研究以海尔特兹品种的红树莓为原料,确定其粗多糖提取工艺为料液比1∶3.191(g∶mL)、超声时间53.85 min、乙醇体积分数85.64%,粗多糖得率为3.88%;体外培养乳酸菌实验证实树莓提取物可以被一些乳酸菌利用,如长双歧杆菌1.218 6,这可能是由于树莓多糖可用于补充碳源支持、促进乳酸菌生长。
(2)本研究制备的树莓提取物对长双歧杆菌1.218 6生长有较明显的促进作用,采用长双歧杆菌发酵的含有树莓提取物的果汁,与对照相比,其DPPH自由基清除率高、抗氧化能力强、果汁饱和度、明亮度好,发酵树莓果汁的理化及感官特性均有改善。
(3)近年来,我国树莓种植规模逐年扩大,树莓鲜果存在易损伤和腐坏问题,大部分果实只能以冻果原料销售,附加值低,本文开发的树莓与乳酸菌复配产品工艺,为树莓产品进一步利用提供了一种新思路。
[1] CHEN L, XIN X L, ZHANG, H C, et al. Phytochemical properties and antioxidant capacities of commercial raspberry varieties[J]. Journal of Functional Foods,2013,5(1):508-515.
[2] KAFKAS E, ÖZGEN M, ÖZOGUL Y, et al. Phytochemical and fatty acid profile of selected red raspberry cultivars: A comparative study[J]. Journal of Food Quality,2008,31(1):67-78.
[3] BOBINAITE R, VISKELIS P, VENSKUTONIS P R. Variation of total phenolics, anthocyanins, ellagic acid and radical scavenging capacity in various raspberry (Rubus spp.) cultivars[J]. Food Chemistry,2012,132(3):1 495-1 501.
[4] 于泽源,滕歆,徐雅琴,等.复合酶法提取树莓果实多糖工艺优化的研究[J].东北农业大学学报,2014,45(3):52-58.
[5] YANG Y, XU H, SUO Y. Raspberry pulp polysaccharides inhibit tumor growth via immunopotentiation and enhance docetaxel chemotherapy against malignant melanoma in vivo[J]. Food & Function,2015,6(9):3 022-3 034.
[6] LIN M Y, CHEN T W. Reduction of cholesterol by Lactobacillus acidophilus in culture broth[J]. Journal of Food & Drug Analysis,2000,8(2):97-102.
[7] OUWEHAND A C,NERMES M,COLLADO M C,et al.Specific probiotics alleviate allergic rhinitis during the birch pollen season[J].World Journal of Gastroenterology,2009,15(26):3 261-3 268.
[8] ANDREASEN A S, LARSEN N, PEDERSENSKOVSGAARD T, et al. Effects of Lactobacillus acidophilus NCFM on insulin sensitivity and the systemic inflammatory response in human subjects[J]. British Journal of Nutrition,2010,104(12):1 831-1 838.
[9] EJTAHED H S, MOHTADINIA J, HOMAYOUNIRAD A, et al. Probiotic yogurt improves antioxidant status in type 2 diabetic patients[J]. Nutrition,2012,28(5):539-543.
[10] NAGPAL R, KUMAR A, KUMAR M, et al. Probiotics, their health benefits and applications for developing healthier foods: A review[J]. FEMS Microbiology Letters,2012,334(1):1-15.
[11] MASCOL, VANHOUTTE T, TEMMERMAN R, et al. Evaluation of real-time PCR targeting the 16S rRNA and recA genes for the enumeration of bifidobacteria in probiotic products[J]. International Journal of Food Microbiology,2007,113(3):351-357.
[12] YI C W, ROCH C Y, CHENG C C. Growth and survival of bifidobacteria and lactic acid bacteria during the fermentation and storage of cultured soy milk drinks[J]. Food Microbiology,2002,19(5):501-508.
[13] PARKAR S G, REDGATE E L, MCGHIE T K, et al. In vitro studies of modulation of pathogenic and probiotic bacterial proliferation and adhesion to intestinal cells by blackcurrant juices[J]. Journal of Functional Foods,2014,8:35-44.
[14] SCHMIDT B M, HOWELL A B, MCENIRY B, et al. Effective separation of potent antiproliferation and antiadhesion components from wild blueberry (Vaccinium angustifolium alit.) fruits[J]. Journal of Agricultural and Food Chemistry,2004,52(21): 6 433-6 442.
[15] ZHOU F, JIANG X, WANG T, et al. Lycium barbarum polysaccharide (LBP): A novel prebiotics candidate for Bifidobacterium and Lactobacillus[J]. Frontiers in Microbiology, 2018, 9: 1 034.
[16] 于洋.树莓叶果中黄酮类化合物含量及其生理活性研究[D].哈尔滨:东北农业大学,2014.
[17] MAN J C D, ROGOSA M, SHARPE M E. A medium for the cultivation of lactobacilli[J]. Journal of Applied Bacteriology, 1960, 23(1):130-135.
[18] KANAGAWA S, OHSHIMA C, TAKAHASHI H, et al. Evaluation of petrifilm lactic acid bacteria plates for counting lactic acid bacteria in food[J]. Journal of Food Protection,2018,81(6):1 030-1 034.
[19] 中华人民共和国质量监督检测检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[20] 中华人民共和国质量监督检测检疫总局,中国国家标准化管理委员会.GB/T 12143—2008 饮料通用分析方法[S].北京:中国标准出版社,2008.
[21] 霍琳琳,苏平,吕英华.分光光度法测定桑葚总花色苷含量的研究[J].酿酒,2005,33(4):88-89.
[22] 陈国刚,邓志祥,江英,等.葡萄梗中单宁的提取及含量测定[J].石河子大学学报(自然科学版),2007,25(6):749-752.
[23] 郎惠云,廖晓玲,董发昕,等.间接原子吸收法测定茶叶中茶多酚的含量[J].西北大学学报(自然科学版),2003,33(6):683-685.
[24] LARRAURI J A, S NCHEZ-MORENO C, SAURA-CALIXTO F. Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J]. Journal of Agricultural and Food Chemistry, 1998,46(7):2 694-2 697.
NCHEZ-MORENO C, SAURA-CALIXTO F. Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J]. Journal of Agricultural and Food Chemistry, 1998,46(7):2 694-2 697.
[25] YOKOZAWA T, DONG E, NAKAGAWA T, et al. In vitro and in vivo studies on the radical-scavenging activity of tea[J]. Journal of Agricultural and Food Chemistry, 1998,46(6):2 143-2 150.
[26] 王宏,陈晓艺,张军翔.贺兰山东麓年轻红葡萄酒的CIELab颜色空间特征[J].食品科学, 2014,35(9):20-23.
[27] 延海莹,乔乐克,张京良,等.树莓营养及活性研究进展[J].食品工业, 2018,39(7):281-284.
[28] WANG B, LAN C Q. Optimising the lipid production of the green alga Neochloris oleoabundans using Box-Behnken experimental design[J]. Canadian Journal of Chemical Engineering,2011,89(4):392-939.
[29] 朱宗涛,赵鹏昊,ABDELAZEZ A,等. 两株动物双歧杆菌的潜在干预糖尿病作用[J].食品工业科技,2018,39(13):136-141;149.
[30] 刘双环,李欢,王聪,等.荷叶黄酮对乳酸杆菌和双歧杆菌抗氧化能力的协同作用研究[J].天然产物研究与开发,2015,27(10):1 712-1 716;1 800.