1,3-丙二醇(1,3-propanediol,1,3-PDO)作为一种重要的高附加值化工原料,主要用于合成新型聚酯纤维聚对苯二甲酸丙二醇酯(polytrimethyleneterephthalate, PTT)[1]。作为1,3-PDO的天然生产菌株,克雷伯氏菌(Klebsiella pneumoniae)因其高效的甘油代谢途径而备受关注[2-3]。
K.pneumoniae通过甘油还原途径合成1,3-PDO,通过氧化途径获得细胞生长所需的能量和还原力,同时产生乙酸、乳酸、2,3-丁二醇和乙醇等副产物[4-7]。其中乙酸和乳酸的合成不仅造成碳源浪费,还会使培养基酸化,抑制菌体生长[8]。乙酸的合成伴随着ATP产生,直接阻断乙酸的合成途径,往往会抑制细胞生长,不利于1,3-PDO的合成[9]。乙酸溢流通常是由底物摄取和下游途径合成分解代谢之间的不平衡引起的[10]。许多研究通过增加乙酰辅酶A节点的碳流和提高TCA循环的活性来提高1,3-PDO的产量,并取得一定成效[11-13],但鲜有改变乙醛酸循环代谢途径对1,3-PDO合成影响的研究报道。
作为TCA循环的代谢支路,乙醛酸循环的适当加强,可能会增加乙酰辅酶A节点流向草酰乙酸等下游路径的碳流,进而缓解甘油氧化途径中碳源的溢出。敲除乙醛酸循环抑制因子iclR基因会强化乙醛酸循环,同时降低乙酸的积累,缓解乙酸溢流问题[13-14]。研究表明, TCA循环活性增强,琥珀酸脱氢酶基因sdhC转录水平明显提高,进而增加胞内还原力的供应[15]。在厌氧条件下,克雷伯氏菌中几个TCA循环相关基因异柠檬酸脱氢酶基因icd、富马酸酶基因fumA及苹果酸脱氢酶基因mdh的转录水平较低[16]。同时,mdh基因作为乙醛酸循环途径相关基因,过表达该基因可强化乙醛酸循环和TCA循环。基于此,本文以乳酸和磷酸转移酶系统共缺失的改造菌株K. p Lr为出发菌株,敲除iclR基因,并过表达sdhC和mdh基因,拟将乙酰辅酶A节点的碳流引入下游以探究乙醛酸和TCA循环的改造对K.pneumoniae合成1,3-PDO的影响。
1 材料与方法
1.1 实验材料
本研究使用的菌株和质粒见表1。壮观霉素、硫酸卡那霉素、异丙基-β-D-硫代半乳糖苷(isopropy-β-D-thiogalactoside,IPTG)、阿拉伯糖、氯霉素,生工生物工程(上海)股份有限公司;Taq DNA 聚合酶,大连宝生物有限公司;质粒提取试剂盒、DNA 凝胶回收试剂盒,上海捷瑞生物工程有限公司;HPLC高效液相色谱仪,美国戴安公司;液相色谱柱: Aminex HPX-87H column(300 mm×7. 8 mm; 9 μm), BioRad公司; 电转仪、PCR仪,Eppendorf 公司;1,3-PDO标准品,Sigma公司;其他试剂均为国产分析纯;发酵罐(BIOTECH 5 L),上海保兴生物设备工程有限公司;引物由上海亦欣生物科技有限公司合成。
表1 本文使用的菌株和质粒
Table 1 Strains and plasmids used in this study

菌株(质粒)相关特性来源E.coli JM109克隆宿主实验室E.coli W3110Source of sdhC and mdh实验室K. p LrKlebsiella pneumoniaeΔldhAΔcrr实验室K. p LricKlebsiella pneumoniaeΔldhAΔcrrΔiclR本研究K. p Lric-sdhCKlebsiella pneumoniaeΔldhAΔcrrΔiclR/ pRSFDuet-Ptac-shdC本研究K. p Lric-mdhKlebsiella pneumoniaeΔldhAΔcrrΔiclR/ pRSFDuet-Ptac-mdh本研究K. p Lric-sdhC-mdhKlebsiella pneumoniaeΔldhAΔcrrΔiclR/ pRSFDuet-Ptac-shdC-Ptac-mdh本研究pRSFDuet-Ptac克隆宿主, Cmr保存pRSFDuet-Ptac-sdhCpRSFDuet-Ptac containing E.coli W3110 sdhC gene, Cmr本研究pRSFDuet-Ptac-mdhpRSFDuet-Ptac containing E.coli W3110 mdh gene, Cmr本研究pRSFDuet-Ptac-sdhC- Ptac-mdhpRSFDuet-Ptac containing E.coli W3110 sdhC and mdh gene, Cmr本研究pCas9Pcas-cas9, Kanr 保存pTargetF-pMBpTarget added sgRNA, Sper本研究
1.2 引物
本研究所使用引物见表2。
1.3 培养基与培养方法
LB培养基(g/L):蛋白胨 10,NaCl 10,酵母粉 5。发酵培养基(g/L):甘油 40,酵母粉 6,葡萄糖 6,KH2PO4 7.5,MgSO4 2,(NH4)2SO4 2,FeSO4·7H2O 0.005,VB12 0.001 5,微量元素溶液 0.1 mL,KOH调pH至7.5。微量元素溶液(g/L):ZnCl2 0.07,MnCl2·4H2O 0.1,H3BO3 0.06,CoCl2·6H2O 0.2,CuCl2 0.02,NiCl2·6H2O 0.025,Na2MoO4·2H2O 0.035。
表2 本研究使用引物
Table 2 Primers used in this study

引物名称引物序列(5′→3′)iclR-F1CGGCGCGCCTGCAGGACGTAGCGCGGTTTTTCCG iclR-R1CCGCTCCGGTGGTTTATGCiclR-F2AAACCACCGGAGCGGGTAAGCCTGATAAGCGTAGCGCiclR-R2CGATTACTTTCTGTTCGACTTAAGCATTATGGAATGCTATCCGCCAGCTGsdhC-FCAGGTCGACGTGGGCGTTATTCATGATAAGAAATGTGsdhC-RCCAAGCTTGCTTACCATACGAGGACTCCTGmdh-FCAGGTCGACGGATGAAAGTCGCAGTCCTCGmdh-R1ATGCGGCCGCCATAACCCACGCCTTCCAGtac-FAAGTATAAGAAGGAGATATACGGAGCTTATCGACTGCACmdh-R2GCAGCGGTTTCTTTACCAGACATAACCCACGCCTTCCAG
注:下划线序列表示酶切位点,粗体序列表示靶基因的同源臂序列,F表示正向引物,R表示反向引物
种子培养:LB培养基用于种子培养,1%接种量(体积分数),37 ℃、150 r/min培养8 h。发酵培养:250 mL三角瓶中装液量为50 mL,4%接种量(体积分数),37 ℃、100 r/min培养48 h。分批补料发酵:5 L发酵罐装液量3 L,4%接种量(体积分数),初始甘油质量浓度为20 g/L,pH电极在线监控,用10 mol/L的KOH维持pH为7,37 ℃、100 r/min培养72 h。发酵过程中甘油质量浓度维持在5~30 g/L。
1.4 菌株构建
按照文献[17]的报道进行基因敲除。利用CRISPR-Cas9基因编辑技术,扩增目的基因上下游各500 bp的整合片段作为供体,构建带有目的基因sgRNA的pTargetF-pMB质粒。将带有卡那霉素抗性的质粒pCas9转入K. pneumoniae,转接到LB液体培养基中(含卡那霉素),加入阿拉伯糖诱导,制备K. pneumoniae电转感受态细胞。将供体和pTargetF-pMB质粒电转至K. pneumoniae感受态细胞,涂布于含有卡那霉素和壮观霉素的LB培养基上,PCR验证获得敲除菌株。敲除成功菌株在30 ℃,150 r/min条件下培养至OD600=0.4时,加入IPTG(终浓度0.5 mol/L)过夜诱导12 h消除pTargetF-pMB质粒;在42 ℃,150 r/min条件下培养消除pCas9质粒。
1.5 基因表达载体构建
以E.coli W3110基因组为模板,PCR扩增得到sdhC和mdh基因,经酶切连接至pRSFDuet-Ptac质粒中,得pRSFDuet-Ptac-sdhC 和pRSFDuet-Ptac-mdh质粒;再以pRSFDuet-Ptac-mdh质粒为模板,扩增得到Ptac-mdh片段,经同源重组连接得到pRSFDuet-Ptac-sdhC-Ptac-mdh质粒。质粒经酶切验证和基因测序正确后转入K. p Lric,得到菌株K. p Lric-sdhC、K. p Lric-mdh和K. p Lric-sdhC-mdh。
1.6 测定方法
生物量用600 nm波长处吸光值(OD600)表示。测定细胞干质量,计算得到:1 OD=0.36 g/L。1,3-PDO、乙酸和琥珀酸等代谢产物用HPLC法检测,色谱柱为Aminex HPX-87H,柱温60 ℃,使用示差检测器;5 mmol/L H2SO4为流动相,流速为0.6 mL/min,进样量为10 μL[18]。
2 结果与分析
2.1 iclR基因敲除对细胞生长和代谢的影响
乙醛酸循环抑制因子iclR基因通过抑制aceBAK操纵子的表达抑制乙醛酸循环[19-20]。敲除iclR可以激活乙醛酸循环,将乙酰辅酶A节点处碳流引入下游TCA循环和乙醛酸循环,进而合成细胞所需的能量和中间代谢物[13]。与出发菌株K. p Lr相比,K. p Lric的生物量提高了15%(图1-a),1,3-PDO产量由16.5 g/L提高到17.8 g/L(图1-b),表明敲除iclR有利于菌体生长。乙醛酸循环是乙酸同化的主要途径,抑制因子iclR的敲除可以提高从乙酸到乙酰辅酶A的转化。发酵8 h时,K. p Lric的乙酸积累量从2 g/L降低到1.1 g/L(图2-a),1,3-PDO产量由4.4 g/L提高到8.8 g/L(图1-b),表明前期乙酸积累量的降低减少了对细胞的毒害作用,1,3-PDO大量合成。此外,由于敲除iclR基因可以明显提高从磷酸烯醇式丙酮酸到乙酰辅酶A的碳流[21],从而使K. p Lric的琥珀酸产量提高了41%,2,3-丁二醇和乙醇的产量分别降低了21%和20%,且乙醇延迟8 h开始积累(图2)。副产物产量的降低减少了对碳源和还原力的竞争,使得部分碳流偏向甘油还原途径,更有利于1,3-PDO的合成。

a-生物量;b-甘油消耗量及1,3-丙二醇产量
图1 摇瓶发酵过程中重组菌的生物量、甘油消耗量 及1,3-丙二醇产量
Fig.1 Biomass,glycerol consumption and concertration of 1,3-PDO in recombinants in shake flasks
2.2 过表达sdhC或mdh基因对细胞生长和代谢的影响
sdhC基因编码琥珀酸脱氢酶,催化琥珀酸到富马酸的脱氢反应。过表达sdhC基因可以提高TCA循环活性,进一步促进乙酰辅酶A节点的碳流流向下游TCA循环和乙醛酸循环。如图3-a所示,K. p Lric-sdhC在18 kDa处有明显的重组蛋白条带,表明sdhC表达成功。与K. p Lric相比,重组菌K. p Lric-sdhC的生物量略有降低(图1-a),单位菌体甘油消耗量增加了6%,1,3-PDO的产量和摩尔转化率分别从17.8 g/L和0.55 mol/mol提高到了19 g/L和0.59 mol/mol,表明过表达sdhC基因提高了菌体的甘油利用能力,强化了1,3-PDO合成。同时,过表达sdhC基因会降低K. p Lric-sdhC中琥珀酸的积累,促使丙酮酸节点的碳流流向乙酰辅酶A。与K. p Lric相比,K.p Lric-sdhC中琥珀酸和2,3-丁二醇的产量分别减少了29%和47%,乙酸产量提高了21%(图2)。发酵16 h,琥珀酸积累量为0.5 g/L,比K. p Lric降低了38%,2,3-丁二醇在前期积累,后期作为还原力明显降低[22]。
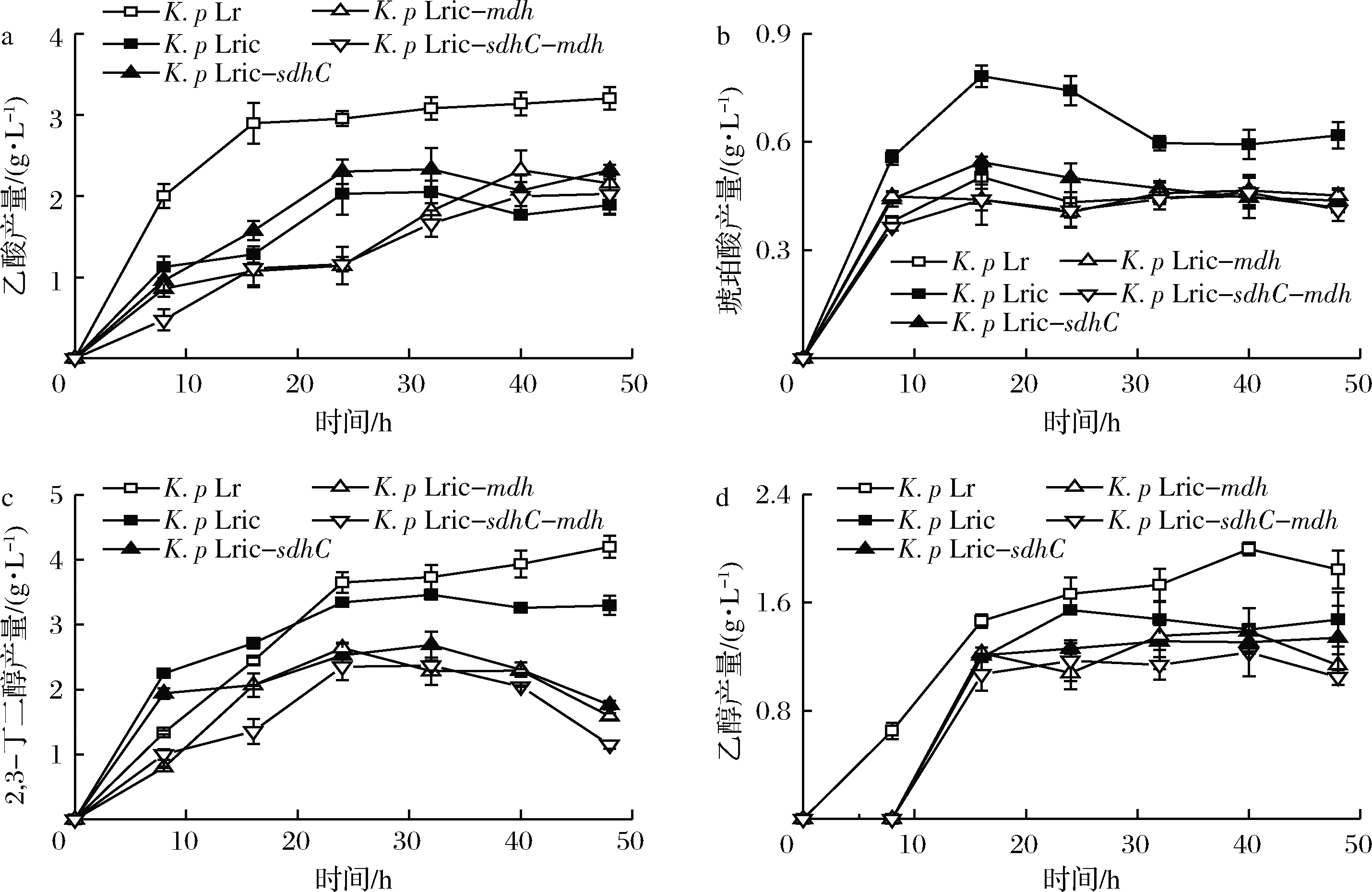
a-乙酸产量;b-琥珀酸产量;c-2,3-丁二醇产量;d-乙醇产量
图2 摇瓶发酵过程中重组菌的代谢产物产量
Fig.2 Concertration of metabolites in recombinants in shake flasks
mdh基因编码苹果酸脱氢酶,催化苹果酸和草酰乙酸之间的反应,该酶可以缓解丙酮酸节点处的碳流积累,增加乙酰辅酶A节点处的碳流流向TCA循环。如图3-a,K. p Lric-mdh在35 kDa处有明显的重组蛋白条带,表明mdh表达成功。与K. p Lric相比,重组菌K. p Lric-mdh的琥珀酸、2,3-丁二醇和乙醇的产量分别降低了27%、52%和22%(图2),但乙酸积累量增加了16%(图2-a)。乙酸的合成常常伴随着能量的产生[11],K. p Lric-mdh在发酵过程中菌体生长始终优于K. p Lric(图1-a),因此,乙酸积累也为细胞生长提供了能量。最终,K. p Lric-mdh的1,3-PDO产量达19.3 g/L(图1-b),摩尔转化率为0.59 mol/mol。
2.3 共表达sdhC和mdh基因对细胞生长和代谢的影响
结合2种策略,在K. p Lric中共表达sdhC和mdh基因,以期进一步增加乙醛酸循环和TCA循环的碳流。如图3-a所示,K. p Lric-sdhC-mdh在18 kDa和35 kDa处有明显的重组蛋白条带,表明sdhC和mdh共表达成功。如图1-a所示,K. p Lric-sdhC-mdh的生物量与K. p Lric-sdhC相比无明显变化,比K. p Lric和K. p Lric-mdh的生物量略有降低,但K. p Lric-sdhC-mdh的单位菌体甘油消耗量均高于单独过表达sdhC或mdh基因的菌株及K. p Lric,分别提高了5%、11%和11%(图1-b),表明共表达sdhC和mdh基因可以进一步强化乙醛酸循环和TCA循环,提高菌体的甘油利用能力。
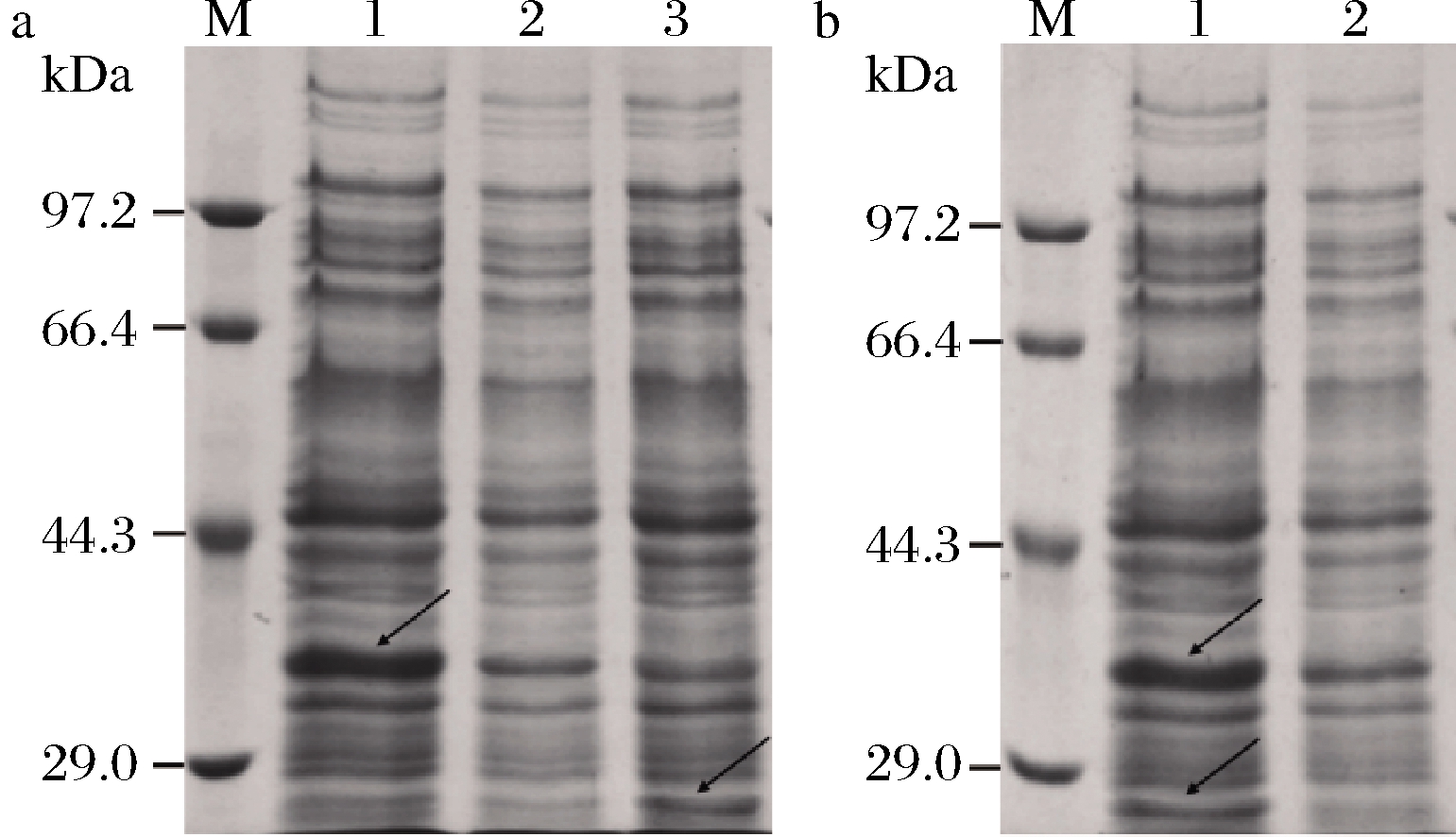
M-蛋白 Marker;1-K. p Lric-mdh胞内可溶蛋白; 2-K. p Lric胞内可溶蛋白;3-K. p Lric-sdhC胞内可溶蛋白
图3 重组菌的SDS-PAGE分析
Fig.3 SDS-PAGE analysis of recombinants
研究发现TCA循环相关基因的转录水平上调会增加TCA循环的碳流,弱化乙酸合成,提高胞内还原力[9]。与单独过表达sdhC或mdh基因相比,共表达sdhC和mdh基因进一步提高了TCA循环活性,为细胞生长提供了更多的能量,使得K. p Lric-sdhC-mdh的乙酸产量分别降低了13%和6%(图2-a)。此外,与K. p Lric相比,K. p Lric-sdhC-mdh中琥珀酸、2,3-丁二醇和乙醇的积累量分别降低了34%、65%和28%,发酵24 h乙酸积累量为1.2 g/L,降低了40%(图2-a),表明共表达sdhC和mdh基因进一步缓解了丙酮酸节点的碳流积累,促使乙酰辅酶A节点处的碳流流向TCA循环,弱化了2,3-丁二醇的合成和乙酰辅酶A节点处的碳流溢出,使更多碳流偏向1,3-PDO合成。最终,K. p Lric-sdhC-mdh的1,3-PDO产量达19.8 g/L(图1-b),摩尔转化率为0.6 mol/mol,分别比K. p Lric提高了20%和15%。
2.4 5 L发酵罐分批补料发酵
根据K. p Lric-sdhC-mdh改造菌株在摇瓶中取得的显著效果,进一步探究K. p Lric-sdhC-mdh在5 L发酵罐分批补料发酵中细胞生长和1,3-PDO合成的情况。如图4-a所示,出发菌株K. p Lr中乙酸积累量高达12.6 g/L,而K. p Lric-sdhC-mdh中乙酸积累量降低了27%(图4-b)。此外,K. p Lric-sdhC-mdh的生物量提高了14%,2,3-丁二醇积累量降低了17%,表明乙醛酸循环的激活促使溢出碳流经乙酰辅酶A流向TCA循环,同时TCA循环的强化为细胞生长和1,3-PDO的合成提供了ATP和还原力。
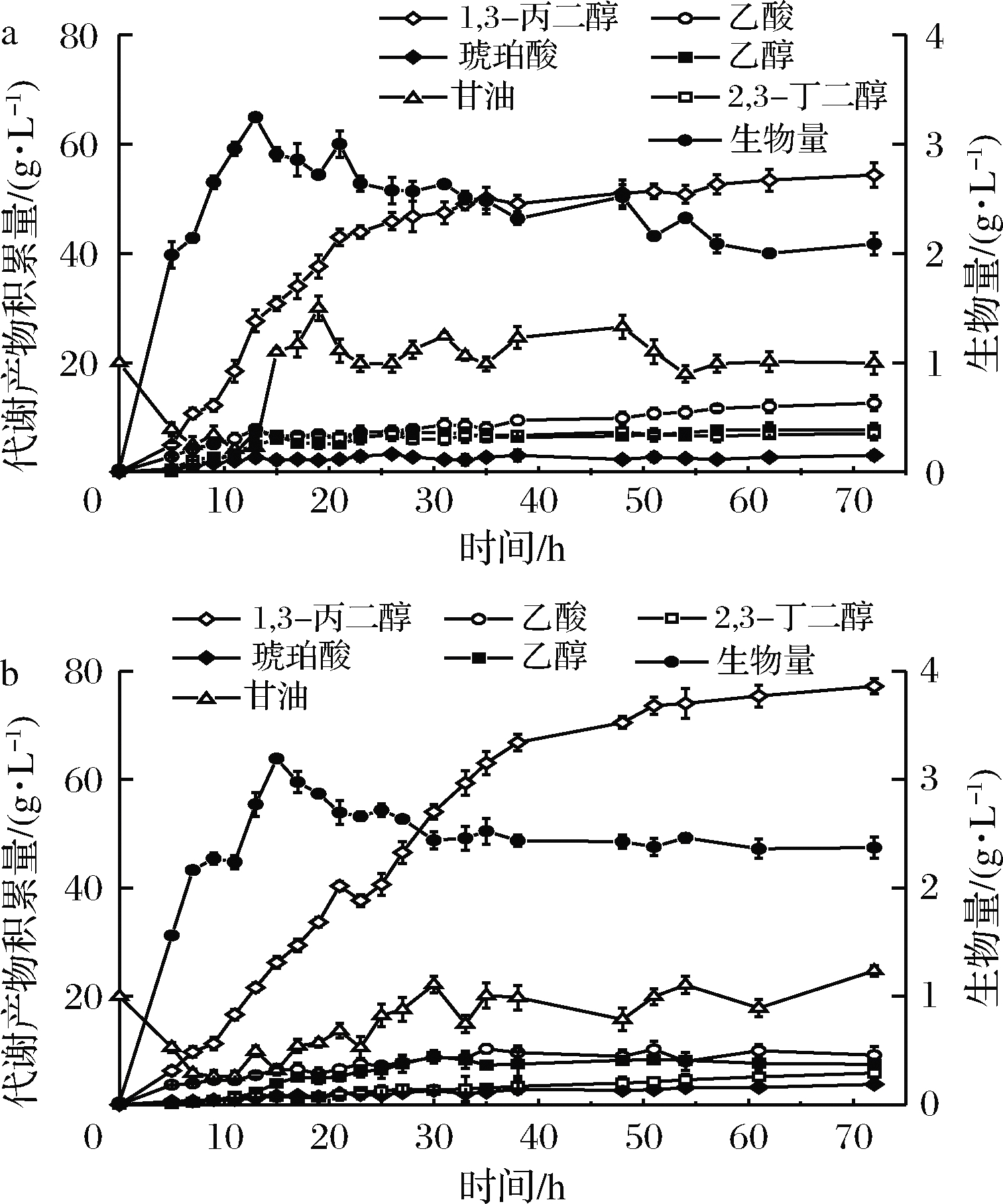
a-K. p Lr;b-K. p Lric-sdhC-mdh
图4 K. p Lr 和K. p Lric-sdhC-mdh在5 L发酵罐中 分批补料发酵情况
Fig.4 5 L Fed-batch fermentations of K. p Lr and K. p Lric-sdhC-mdh
有研究通过在K.pneumoniae中敲除乙酰辅酶A再生抑制因子pdhR,但是仅将1,3-PDO产量提高到60.4 g/L[25]。敲除TCA循环抑制因子arcA,提高TCA循环活性,1,3-PDO产量为78.1 g/L,提高了28%[15]。在K.pneumoniae中敲除poxB、pta-ackA基因以降低乙酸合成提高1,3-PDO产量,结果重组菌中1,3-PDO产量和转化率分别为76.8 g/L和0.66 mol/mol[23]。此外,有研究考察了丙酮酸乙酰辅酶A开关对1,3-PDO合成的影响,结果表明,提高1,3-PDO产量和转化率2者不可兼得[26]。目前尚未有乙醛酸改造对K.pneumoniae合成1,3-PDO影响的报道,乙醛酸作为TCA循环的代谢支路,适当加强可以有效缓解乙酸溢流,提高1,3-PDO合成。最终,K. p Lric-sdhC-mdh在5 L发酵罐分批补料发酵中1,3-PDO的产量达77.2 g/L,摩尔转化率为0.69 mol/mol,分别高于出发菌株42%和11%。
3 结论
本研究对K. p Lric中乙醛酸循环抑制因子iclR进行了敲除,并考察了过表达TCA循环相关基因琥珀酸脱氢酶基因sdhC和苹果酸脱氢酶基因mdh对K.pneumoniae细胞生长和1,3-PDO合成的影响。结果表明,iclR基因的敲除可以激活乙醛酸循环,明显降低乙酸的积累;过表达sdhC或mdh基因可以降低2,3-丁二醇和乙醇的合成,缓解丙酮酸和乙酰辅酶A节点处的碳流积累。共表达sdhC和mdh基因可以提高菌株的甘油利用能力,弱化副产物合成,进一步提高碳流流向乙醛酸循环和TCA循环,为细胞生长和1,3-PDO的合成提供能量和还原力。最终,在5 L发酵罐分批补料发酵中,K. p Lric-sdhC-mdh的1,3-PDO产量提高了42%。综上可知,激活乙醛酸循环和强化TCA循环可以弱化乙酸溢流问题,有利于细胞生长和1,3-PDO的合成,为改造K.pneumoniae合成1,3-PDO提供了研究思路。
[1] 祃栋猛,陆信曜,陈文强,等.发酵后期补加2种氮源对克雷伯氏菌合成1,3-丙二醇的影响[J].食品与发酵工业, 2016, 42(8): 8-12.
[2] VIVEK N, CHRISTOPHER M, KUMAR M K, et al. Pentose rich acid pretreated liquor as co-substrate for 1,3-propanediol production [J]. Renewable Energy, 2018, 129:794-799.
[3] TANG T, QI F, LIU H J, et al. Recent developments in the microbial production of 1,3-propanediol[J]. Biofuels, 2013, 4(6): 651-667.
[4] RHIE M N, KIM H T, JO S Y, et al. Recent advances in the metabolic engineering of Klebsiella pneumoniae: a potential platform microorganism for biorefineries [J]. Biotechnology and Bioprocess Engineering, 2019, 31(6): 945-961.
[5] KUMAR V, SANKARANARAYANAN M, DURGAPAL M, et al. Simultaneous production of 3-hydroxypropionic acid and 1,3-propanediol from glycerol using resting cells of the lactate dehydrogenase-deficient recombinant Klebsiella pneumoniae overexpressing an aldehyde dehydrogenase [J]. Bioresource Technology, 2013, 135: 555-563.
[6] XU Y Z, GUO N N, ZHENG Z M, et al. Metabolism in 1,3-propanediol fed-batch fermentation by a D-lactate deficient mutant of Klebsiella pneumoniae [J]. Biotechnology & Bioengineering, 2009, 104(5): 965-972.
[7] CELINSKA E. Klebsiella spp as a 1, 3-propanediol producer: the metabolic engineering approach [J]. Critical Reviews in Biotechnology, 2012, 32(3):274-288.
[8] ZHOU S, LI L L, PERSEKE M, et al. Isolation and characterization of a Klebsiella pneumoniae strain from mangrove sediment for efficient biosynthesis of 1,3-propanediol [J]. Science Bulletin, 2015, 60(5): 511-521.
[9] KO Y, SEOL E, SUNDARA S B, et al. Metabolic engineering of Klebsiella pneumoniae J2B for co-production of 3-hydroxypropionic acid and 1,3-propanediol from glycerol: Reduction of acetate and other by-products [J]. Bioresource Technology, 2017, 244(1):1 096-1 103.
[10] PEEBO K, VALGEPEA K, NAHKU R, et al. Coordinated activation of PTA-ACS and TCA cycles strongly reduces overflow metabolism of acetate in Escherichia coli [J]. Applied Microbiology and Biotechnology, 2014, 98(11): 5 131-5 143.
[11] 梁川,王洁茹,诸葛斌,等.基于回补途径的TCA循环改造对克雷伯氏菌生长和甘油代谢的影响[J].应用与环境生物学报, 2019, 25(4):972-976.
[12] ANAND P,SAXEAN R K,MARWAH R G.A novel downstream process for 1,3-propanediol from glycerol-based fermentation[J].Applied Microbiology and Biotechnology,2011,90(4):1 267-1 276.
[13] LIU M, DING Y M, CHEN H L, et al. Improving the production of acetyl-CoA-derived chemicals in Escherichia coli BL21(DE3) through iclR and arcA deletion[J]. BMC Microbiology, 2017, 17(1):10.
[14] DING Z X, FANG Y, ZHU L F, et al. Deletion of arcA, iclR, and tdcC in Escherichia coli to improve L-threonine production [J]. Biotechnology and Applied Biochemistry, 2019, 66(5): 794-807.
[15] LU X Y, REN S L, LU J Z, et al. Enhanced 1,3-propanediol production in Klebsiella pneumoniae by a combined strategy of strengthening the TCA cycle and weakening the glucose effect [J]. Journal of Applied Microbiology, 2018, 124(3): 682-690.
[16] KUMAR V, PARK S. Potential and limitations of Klebsiella pneumoniae as a microbial cell factory utilizing glycerol as the carbon source [J]. Biotechnology Advances, 2018, 36 (1): 150-167.
[17] JIANG Y, CHEN B, DUAN C L, et al. Multigene editing in the Escherichia coli genome via the CRISPR-Cas9 system [J]. Applied and Environmental Microbiology, 2015, 81(7): 2 506-2 514.
[18] 刘情,王小婉,诸葛斌,等.基因敲除弱化产 1,3-丙二醇 Klebsiella pneumoniae 荚膜多糖的合成[J].化工进展, 2017, 36(9): 3 447-3 452.
[19] MOLINA-HENARES A J, KRELL T, GUAZZARONI M E, et al. Members of the IclR family of bacterial transcriptional regulators function as activators and/or repressors [J]. FEMS Microbiology Reviews, 2006, 30(2):157-186.
[20] YAMAMOTO K, ISHIHAMA A. Two different modes of transcription repression of the Escherichia coli acetate operon by IcIR [J]. Molecular Microbiology, 2003, 47(1):183-194.
[21] WAEGEMAN H, BEAUPREZ J, MOENS H, et al. Effect of iclR and arcA deletions on physiology and metabolic fluxes in Escherichia coli BL21(DE3) [J]. Biotechnology Letters, 2012, 34(2): 329-337.
[22] YANG T H, RATHANSINGH C, LEE H J, et al. Identification of acetoin reductases involved in 2,3-butanediol pathway in Klebsiella oxytoca [J]. Journal of Biotechnology, 2014, 172(1): 59-66.
[23] LIN J, ZHANG Y Q, XU D F, et al. Deletion of poxB, pta, and ackA improves 1,3-propanediol production by Klebsiella pneumoniae [J]. Applied Microbiology and Biotechnology, 2016, 100(6):2 775-2 784.
[24] LEE J H, JUNG H M, JUNG M Y, et al. Effects of gltA and arcA mutations on biomass and 1,3-propanediol production in Klebsiella pneumoniae[J]. Biotechnology and Bioprocess Engineering, 2019, 24(1): 95-102.
[25] BAO W, WEI R, LIU X, et al. Regulation of pyruvate formate lyase-deficient Klebsiella pneumoniae for efficient 1,3-propanediol bioproduction[J]. Current Microbiology, 2020, 77(1): 55-61.
[26] ZHOU J D, WANG D X, WANG C H, et al. The role of the pyruvate acetyl-CoA switch in the production of 1,3-propanediol by Klebsiella pneumoniae[J]. Applied Biochemistry and Biotechnology, 2017, 181(3): 1 199-1 210.