鲜切果蔬以其新鲜、方便和营养等特点受到广大消费者青睐,被誉为“二十一世纪把人们从厨房中解放出来”的果蔬消费时尚,并已成为销售增长最快的零售食品之一。在欧美、日本等发达国家迅速发展,已形成完整、先进、系统的加工销售体系,表现为技术规范化、产品标准化、设备先进化、市场网络化和管理现代化[1]。目前,国内鲜切果蔬正处于发展阶段,一些发达城市超市内已有销售,这种安全、快捷、方便的果蔬产品逐渐进入了老百姓的视野。我国鲜切果蔬产品大多经过简单清洗、切分处理后进行托盘薄膜包装,目前尚缺少先进的保鲜技术[2],货架期只有3~5 d,在日本则为4~7 d,在欧美能达到7~10 d。因此,如何提高品质、延长货架期是我国鲜切果蔬发展中亟待解决的问题。
随着生活水平的提高,人们对食品的健康、安全和绿色有了更高的要求。因此,鲜切果蔬保鲜技术向安全、绿色的方向发展。乙醇是果蔬次生代谢物,是一种常见的具有强效抗菌活性的食品添加剂,价格低廉,对人体无毒副作用,已被美国食品和药物管理局公认为安全性物质。研究表明,乙醇通过抑制乙烯的生物合成[3],可降低呼吸强度,延缓衰老[4]。乙醇可以杀灭果蔬表面的部分微生物,减缓腐烂变质[5-6]。乙醇对抑制鲜切甘蔗[7]、莲藕[8]、苹果[9]、马铃薯[10]和荸荠[11]的酶促褐变具有显著效果。然而,乙醇在应用上存在剂量效应,高浓度乙醇反而会加速果蔬成熟、衰老与腐烂,原因可能是高浓度乙醇对植物细胞膜造成损伤[12]。高氧(21%~100% O2)处理是近年来开发的一种新型果蔬保鲜技术。研究发现,高氧可抑制某些细菌和真菌的生长[13]、减少乙烯合成、降低呼吸作用[14]、减缓组织褐变[15]、减少乙醛、乙醇等异味物质的产生,从而提高果蔬贮藏品质。此外,高氧可弥补传统气调低O2和高CO2对果蔬的不利影响。但高氧处理的效果因果蔬种类、氧浓度、温度及乙烯含量等因素的不同而不同。因此,研究乙醇熏蒸与高氧处理对鲜切果蔬的作用条件与保鲜效果,对开发2种保鲜技术,提升鲜切果蔬品质具有重要意义。本文采用乙醇熏蒸和高氧预处理鲜切苹果,研究了鲜切苹果在冷藏过程中生理和品质的变化,为鲜切苹果的加工与保鲜提供理论指导和技术支持。
1 材料与方法
1.1 材料与试剂
富士苹果,八成熟,购于山东省栖霞市。于0~1 ℃冷库贮藏。选取大小、成熟度一致、无机械损伤和病虫害的果实备用。一次性保鲜盒与保鲜膜等包装材料均为食品级聚乙烯。
体积分数95%乙醇、冰醋酸、无水醋酸钠均为分析纯,TritonX-100(化学纯),国药集团化学试剂有限公司;聚乙烯吡咯烷酮、邻苯二酚、三氯乙酸、愈创木酚,均为分析纯,天津市大茂化学试剂厂。
1.2 仪器与设备
CR-400型色差计,杭州柯盛行仪器有限公司;T9型紫外可见分光光度计,北京普析通用仪器有限责任公司;D-78532型高速冷冻离心机,德国Hettich科学仪器公司;DK-4100型便携式顶空气体分析议,丹麦PBI公司。
1.3 实验方法
1.3.1 乙醇熏蒸方法
将苹果清洗、去皮,四等分切块,均匀摆放在一次性保鲜盒内,每个保鲜盒放置约250 g,将保鲜盒放入乐扣盒中,同时在乐扣盒中放入展开的四层纱布(远离苹果),分别取一定量的体积分数95%乙醇均匀滴在纱布上,密封乐扣盒,室温下分别熏蒸2 h、4 h。乙醇溶液体积与乐扣盒体积比分别为200、400、600 μL/L,以未放置乙醇组为对照。2-2、4-2、6-2分别表示200、400和600 μL/L乙醇熏蒸2 h,2-4、4-4、6-4分别表示200、400、600 μL/L乙醇熏蒸4 h。处理结束后,将乐扣盒打开通风30 min,用保鲜膜封口,于0~1 ℃、相对湿度90%~95%条件下贮藏,每3 d测定1次指标。
1.3.2 高氧预处理方法
将苹果清洗、去皮、切分、装入保鲜盒,将保鲜盒置于乐扣盒中,充入O2,用气体分析仪测定盒内O2体积分数,使其体积分数保持在95%~100%,分别于0~1 ℃下分别处理12、24和36 h,以空气处理组为对照。处理结束后,用保鲜膜封口,于0~1 ℃贮藏,每3 d测定1次指标。
1.3.3 呼吸速率的测定
称取200 g鲜切苹果,置于5 L磨口试剂瓶中,密封3 h后,用气体分析仪测定CO2含量,并计算呼吸速率,以单位时间单位质量鲜切苹果释放CO2的量计,单位:mg/(g·h)。
1.3.4 菌落总数的测定
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[16]规定的方法测定。取10 g样品,剪碎置于含90 mL无菌水的锥形瓶中,充分振摇,制成不同稀释度的稀释液。选择3个适宜稀释度,取0.1 mL稀释液于灭菌冷却凝固的培养基中,将菌悬液涂布均匀,每个稀释度做3个平行。37 ℃培养24 h后进行菌落计数,单位为lg CFU/g。
1.3.5 褐变度的测定
采用消光值法测定。取样品与冷却蒸馏水1∶10(g∶mL)混合匀浆后于0 ℃、5 000 r/min离心20 min,取上清液于25 ℃水浴锅内5 min,在410 nm波长下测定吸光值(A410),结果以10×A410表示褐变度。
1.3.6 多酚氧化酶(polyphenol oxidase, PPO)酶活力测定
参考LIU等[17]的方法,采用邻苯二酚法测定,略作改动。称取3 g果肉,加入10 mL 0.05 mol/L pH 7.8的磷酸盐缓冲液(phosphate buffer saline,PBS),冰浴研磨成匀浆,于4 ℃下5 000 r/min离心10 min,上清液备用。取1.5 mL 0.05 mol/L pH 7.8的PBS缓冲液、1.0 mL 0.1 mol/L邻苯二酚,加入0.5 mL酶提取液,测定反应混合液在420 nm波长处吸光值的变化,每隔30 s记录1次,共记录3 min。以PBS缓冲液调零。1个酶活力单位(U)为测定条件下1 g样品1 min引起吸光值改变0.01。按公式(1)计算PPO酶活力:
PPO酶活力![]()
(1)
式中:ΔA420,420 nm波长处吸光值变化值;V,样品提取液总体积,mL;Vs,测定时所取样品提取液体积,mL;m,样品质量,g;t,反应时间,min。
1.3.7 过氧化物酶(peroxidase, POD)酶活力测定
采用愈创木酚法测定[18]。称取3 g果肉,加入10 mL 0.05 mol/L pH 7.8的PBS溶液,冰浴研磨成匀浆,于4 ℃下5 000 r/min离心10 min,上清液备用。取2.5 mL 0.05 mol/L pH 7.8的PBS缓冲液,1.0 mL 体积分数2%H2O2溶液,1.0 mL 0.05 mol/L愈创木酚溶液,加入0.5 mL酶提取液,测定反应混合液在470 nm波长处吸光值的变化,每隔30 s记录1次,共记录3 min。以PBS缓冲液调零。1个酶活力单位(U)为测定条件下1 g样品1 min引起吸光值改变0.01。按公式(2)计算POD酶活力:
PPO酶活力![]()
(2)
式中:ΔA470,470 nm波长处吸光值变化值;V,样品提取液总体积,mL;Vs,测定时所取样品提取液体积,mL;m,样品质量,g;t,反应时间,min。
1.3.8 丙二醛(malondialdehyde, MDA)含量的测定
采用硫代巴比妥酸法测定[18]。称取3 g果肉,加入10 mL 100 g/L三氯乙酸溶液和少量石英砂,冰浴研磨成匀浆,于4 ℃下5 000 r/min离心10 min,上清液备用。取2 mL上清液(对照组加入2 mL 100 mg/mL三氯乙酸溶液),加入2 mL 6 mg/mL硫代巴比妥酸溶液,混匀后沸水浴15 min,迅速冷却后再离心。取上清液分别测定450、532和600 nm波长下的吸光值。按照公式(3)和公式(4)计算MDA含量:
c=6.45·(A532-A600)-0.56·A450
(3)
MDA含量![]()
(4)
式中:c,MDA浓度,μmol/L;A532、A600、A450分别为450、532和600 nm波长下的吸光值;V,提取液体积,mL;Vs,测定时所取样品提取液体积,mL;m,果肉质量,g。
1.3.9 感官评价方法
由10名经过训练的品评员组成感官评价小组,综合分析样品的外观形态、色泽、滋气味和口感,采用9分制进行评分(表1),其中9分为最好,1分为最差,5分为货架期终点。
表1 鲜切苹果感官评分标准
Table 1 Sensory scoring criteria for fresh-cut apples

感官项目分值/分7~94~61~3外观形态形态均匀,果外缘整齐,饱满形态较均匀,果外缘较整齐,较饱满形态不均匀,果外缘参差不齐,有皱缩色泽色泽均匀,无褐变,光泽度高,果肉呈有光泽的白色色泽较均匀,有轻微褐变,光泽度一般,果肉出现变黄色泽不均匀,褐变较严重,光泽度差滋气味甜酸适中,味道柔和,有苹果特有的香甜气味,无异味甜酸度不均衡,特定苹果香气不明显且有微酸味酸度失调,无香味,有较明显的酸臭气味口感果肉脆度高,水分饱满,质地硬度高质地较硬,果肉脆度一般,有轻微砂齿感果肉质地变软,有水渍现象出现,口感不均匀
1.3.10 数据处理
每个试验重复3次,结果以![]() 表示。用Origin 9.1软件绘图。采用SPSS 23.0进行数据分析,采用单因素方差分析进行差异显著性分析(P<0.05,显著;P<0.01,极显著)。
表示。用Origin 9.1软件绘图。采用SPSS 23.0进行数据分析,采用单因素方差分析进行差异显著性分析(P<0.05,显著;P<0.01,极显著)。
2 结果与分析
2.1 乙醇熏蒸对鲜切苹果生理与品质的影响
2.1.1 乙醇熏蒸对鲜切苹果呼吸速率的影响
呼吸速率反映果蔬营养物质消耗快慢以及机体的衰老程度,呼吸速率越大营养物质消耗越快,衰老也越严重,因此控制果蔬采后呼吸速率对保持其较高品质具有重要意义。采用乙醇熏蒸处理后,鲜切苹果贮藏过程中呼吸速率的变化如图1所示。各组呼吸速率呈先升后降的趋势,至第9天时对照组呼吸速率达到峰值,之后逐渐下降。乙醇熏蒸组于第12天时达呼吸高峰,峰值低于对照组(P<0.05)。
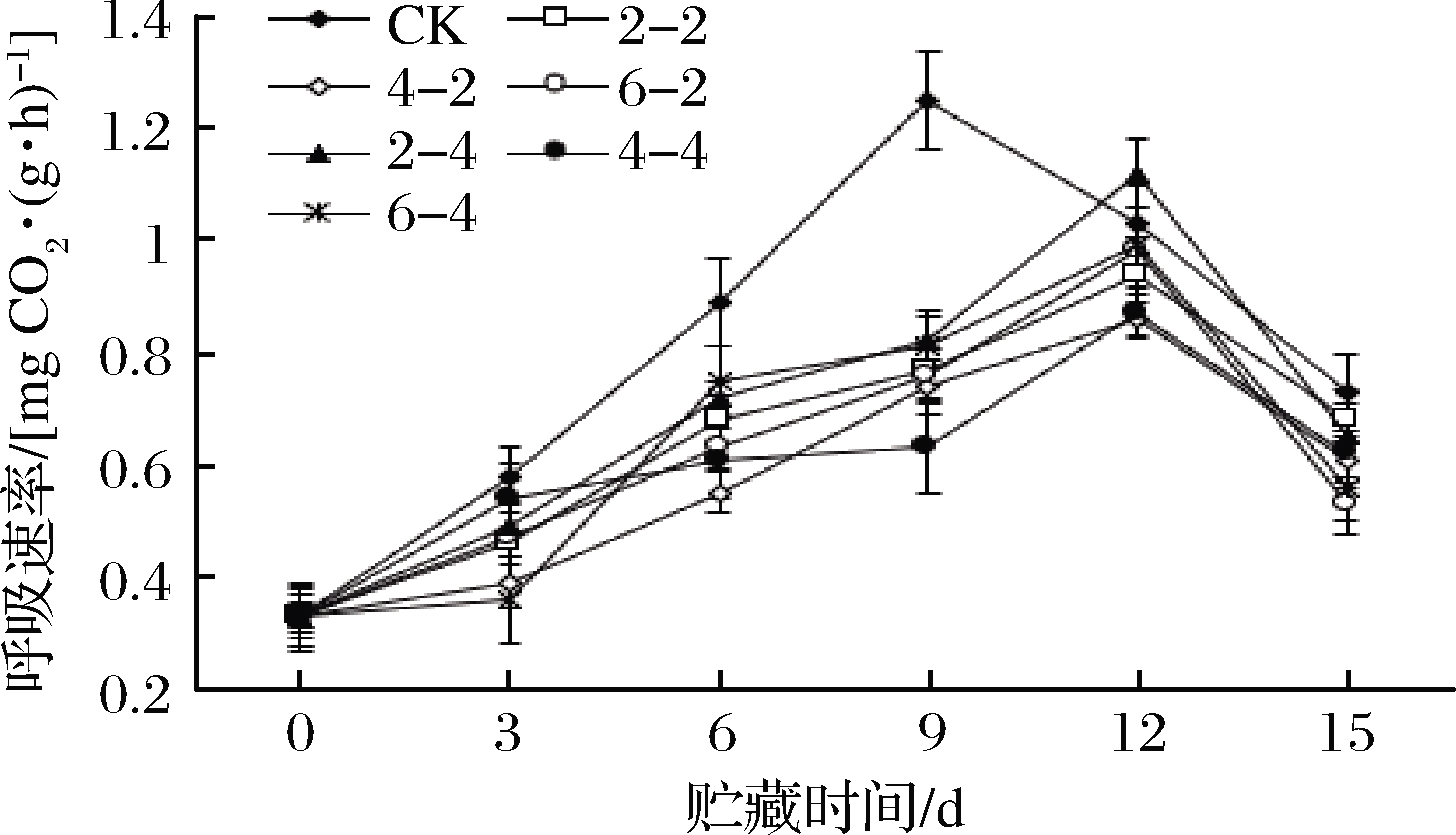
图1 乙醇熏蒸鲜切苹果呼吸速率变化
Fig.1 Changes in respiration rate of fresh-cut apples fumigated with ethanol
乙醇熏蒸处理推迟了鲜切苹果呼吸高峰的出现,降低了呼吸峰值,但不同乙醇含量和熏蒸时间的作用无差异。原因是乙醇能够延缓乙烯高峰的出现,抑制乙烯的合成。ASODA等[19]研究发现,乙醇不仅能降低青花菜呼吸速率,而且抑制了其在5 d贮藏期间呼吸高峰的出现,保持了青花菜较好的品质,认为乙醇是通过调节氨基环丙烷羧酸合成酶和氧化酶的活性从而达到抑制乙烯合成,并延迟衰老。
2.1.2 乙醇熏蒸对鲜切苹果菌落总数的影响
微生物数量超标是影响鲜切果蔬品质的重要因素,不仅造成产品感官品质下降,致病菌还会影响人体健康。不同乙醇含量分别熏蒸鲜切苹果2、4 h后,贮藏过程中菌落总数如图2所示。随贮藏时间延长,各组菌落总数均呈上升趋势。前3 d乙醇熏蒸组与对照组无显著差异,第6天后乙醇熏蒸组显著低于对照组(P<0.05)。至第15天时,乙醇含量400 μL/L、熏蒸2 h组菌落总数显著低于其他各组(P<0.05),其次为乙醇含量600 μL/L、熏蒸2 h组。可见乙醇杀菌效果与其含量和熏蒸时间有关。
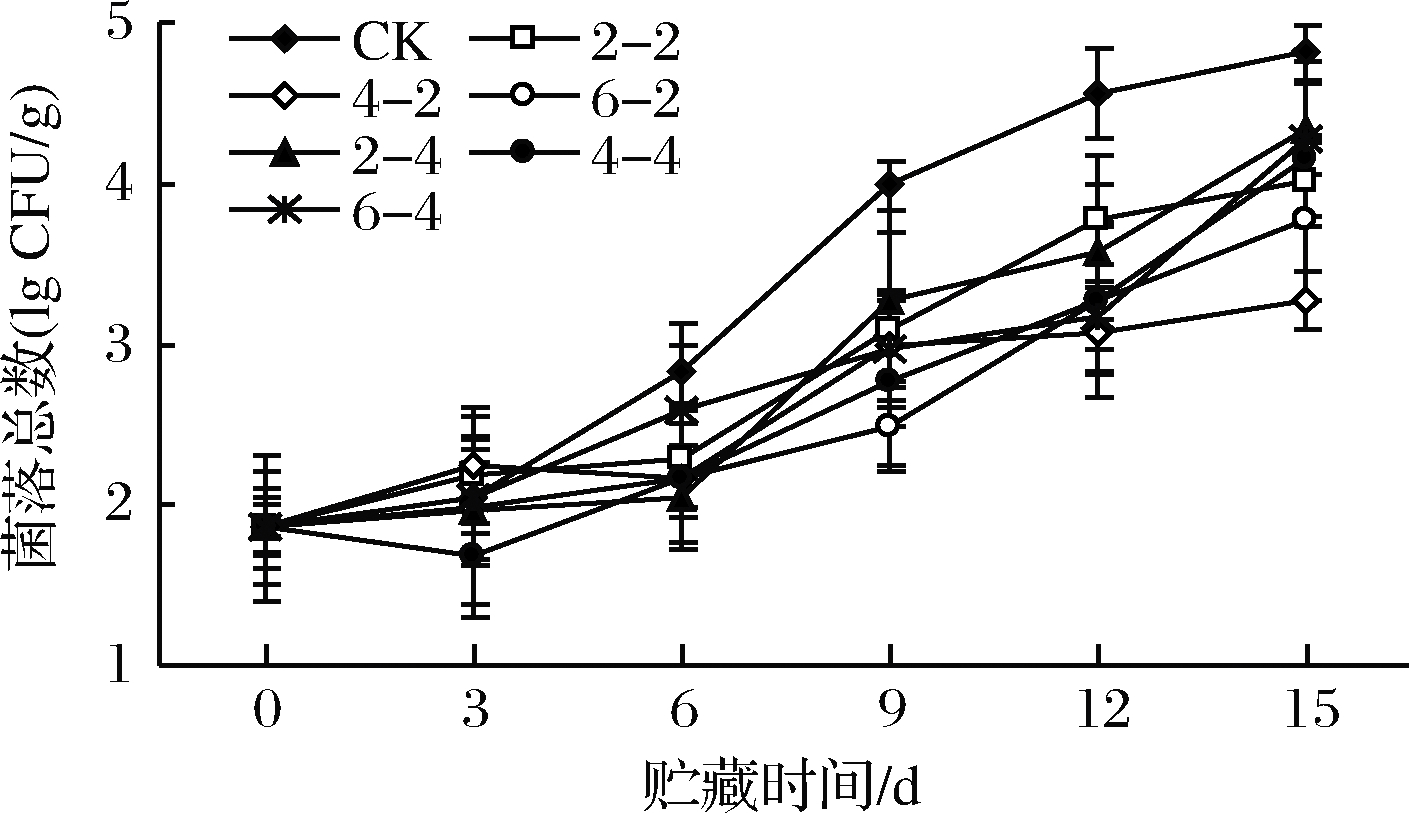
图2 乙醇熏蒸鲜切苹果菌落总数变化
Fig.2 Changes in total number colonies of fresh-cut apples fumigated with ethanol
2.1.3 乙醇熏蒸对鲜切苹果褐变度的影响
褐变是影响鲜切果蔬品质的重要因素之一。鲜切苹果采用乙醇熏蒸处理后褐变度的变化如图3所示。随贮藏时间延长,乙醇熏蒸组褐变度略有增加,但变化不明显,而对照组褐变度显著增加。乙醇熏蒸组褐变度显著低于对照组(P<0.05),贮藏前3 d乙醇熏蒸组之间无显著差异,第6~15天,乙醇含量400 μL/L、熏蒸2 h组褐变度明显低于其他乙醇熏蒸组(P<0.05)。乙醇对褐变的控制可能是对活性氧的形成和相关氧化酶活性的抑制作用[20]。
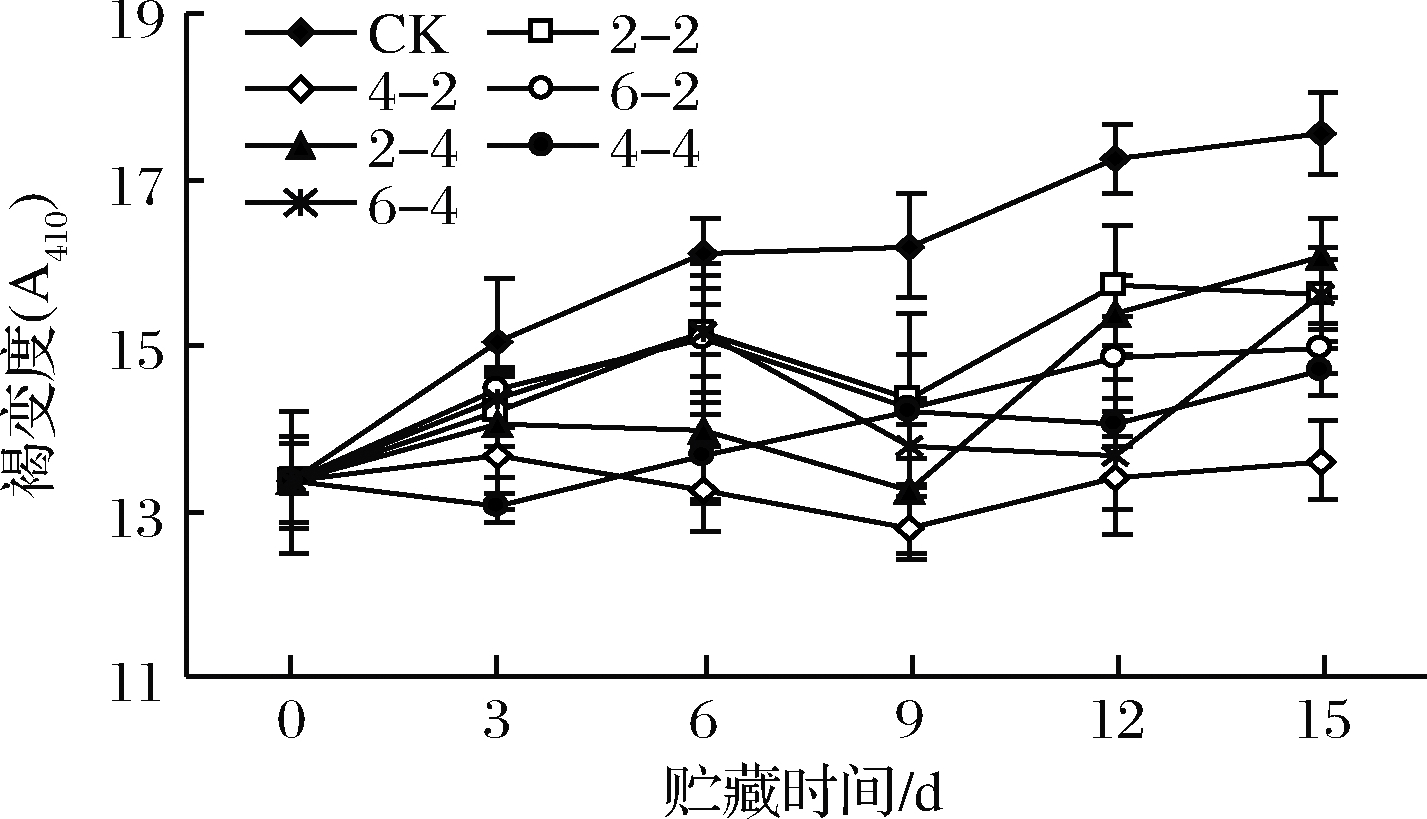
图3 乙醇熏蒸鲜切苹果褐变度变化
Fig.3 Changes in browning degree of fresh-cut apples fumigated with ethanol
2.1.4 乙醇熏蒸对鲜切苹果PPO酶活力的影响
鲜切苹果中的酚类底物在PPO催化作用下氧化成邻醌,邻醌是一种不稳定的物质,与植物体内的氨基酸、金属离子和蛋白质等发生脱水、加成或聚合等反应,最后形成黑色物质,严重影响其感官品质[21]。PPO酶活力越高,越利于酶促褐变的发生,故抑制PPO酶活力是降低鲜切苹果酶促褐变的有效方法。乙醇熏蒸后鲜切苹果PPO酶活力变化如图4所示,各处理组PPO酶活力呈先上升后下降的趋势,对照组在第9天达到峰值,之后逐渐下降。乙醇熏蒸组在贮藏12 d时达峰值,峰值低于对照组,说明乙醇熏蒸处理延缓鲜切苹果PPO峰值的到达时间,且降低PPO峰值,其中乙醇含量400 μL/L、熏蒸2 h组PPO值最低(P<0.05)。
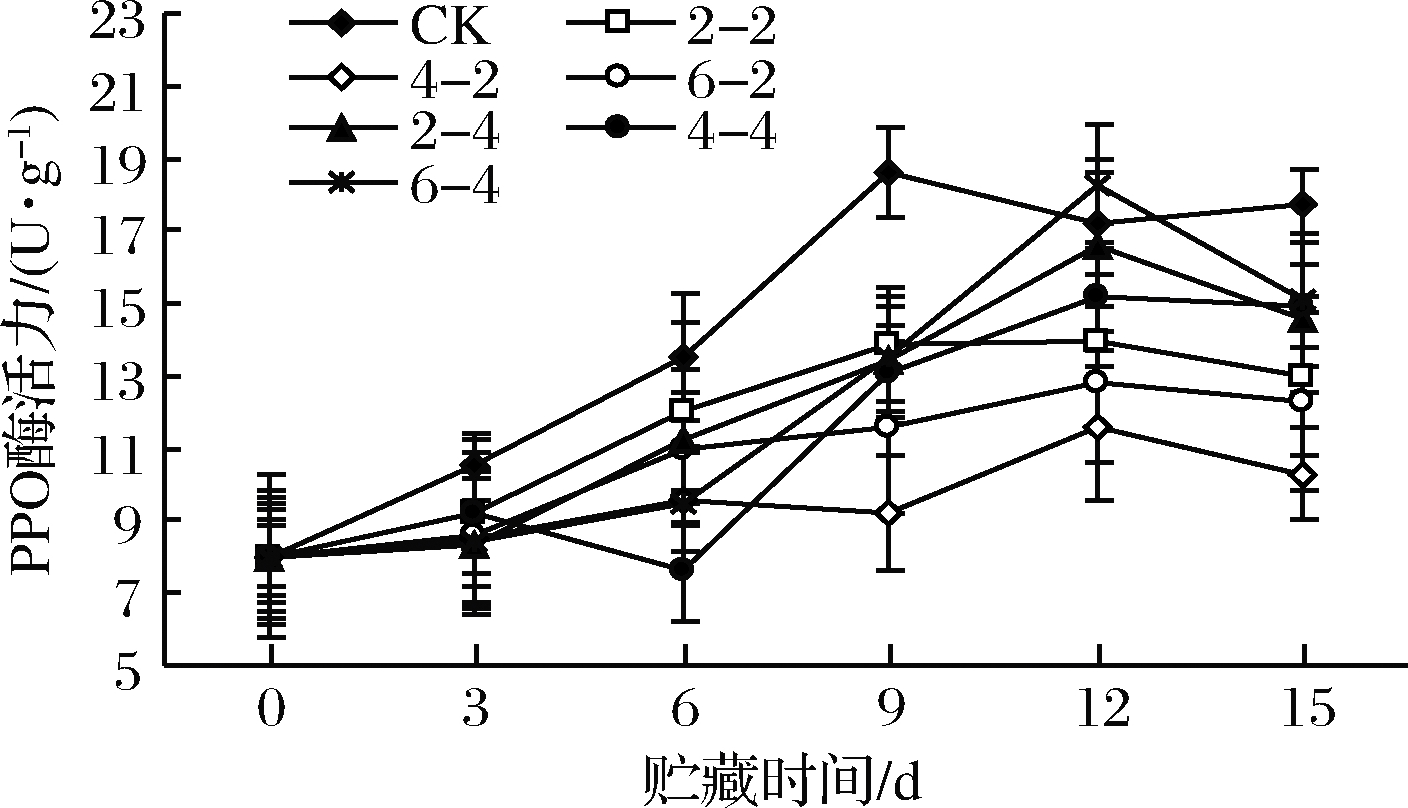
图4 乙醇熏蒸鲜切苹果PPO酶活力变化
Fig.4 Changes in PPO activity of fresh-cut apples fumigated with ethanol
2.1.5 乙醇熏蒸对鲜切苹果POD酶活力的影响
POD是鲜切果蔬酶促褐变的关键酶之一。POD可通过催化植物体内的H2O2产生O2,进而氧化酚类物质生成醌类化合物,再通过一系列脱水、聚合等反应生成黑色物质[22]。乙醇熏蒸鲜切苹果贮藏过程中POD酶活力变化如图5所示。各组POD酶活力随贮藏时间延长而升高,对照组POD酶活力与乙醇熏蒸组相比一直处于较高水平,说明乙醇熏蒸处理能够抑制POD活性,而乙醇熏蒸组间无差异。
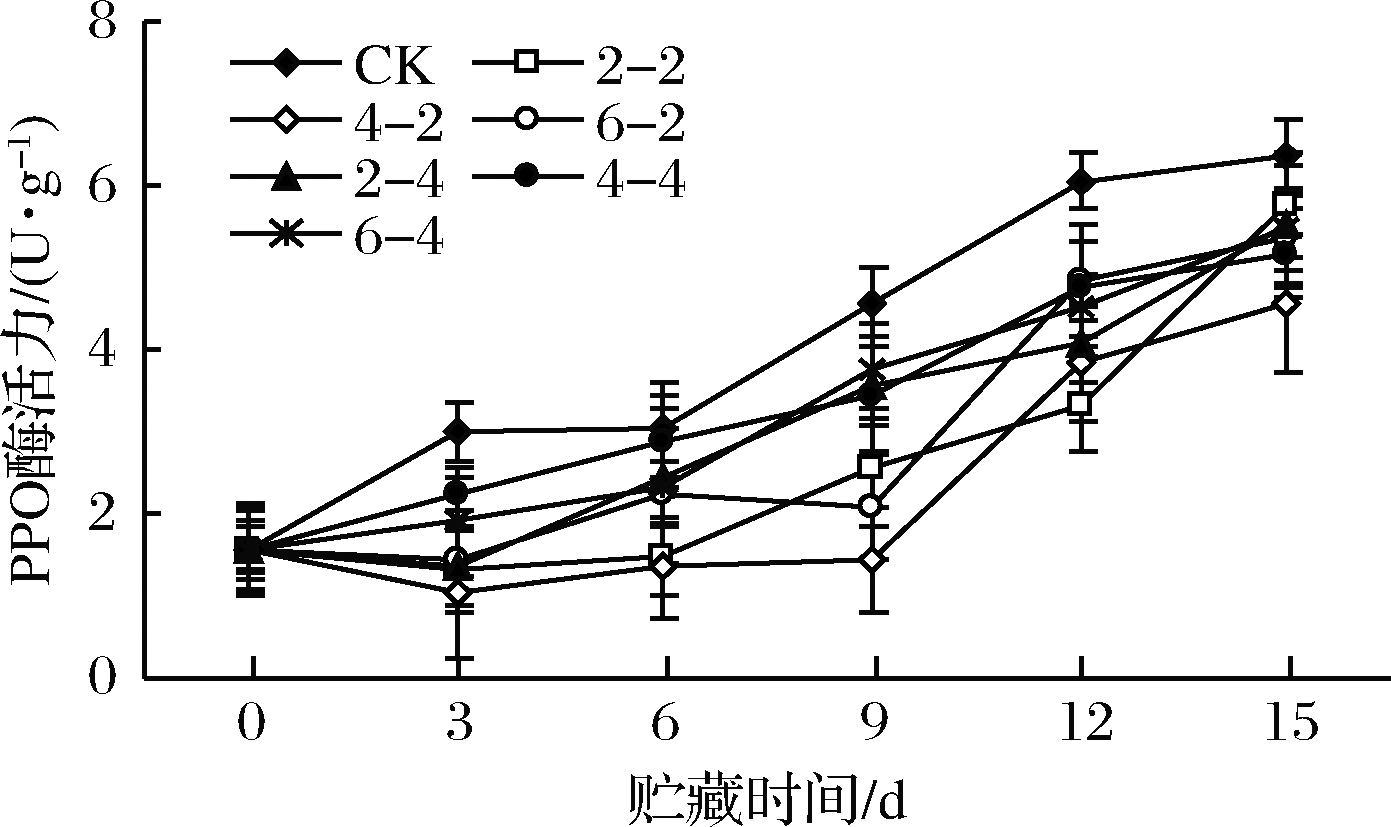
图5 乙醇熏蒸鲜切苹果POD酶活力变化
Fig.5 Changes in POD activity of fresh-cut apples fumigated with ethanol
2.1.6 乙醇熏蒸对鲜切苹果MDA含量的影响
MDA是膜脂过氧化作用的产物,其含量是反映细胞膜脂过氧化作用强弱和细胞膜破坏程度的重要指标。MDA含量越高说明细胞膜遭受破坏越严重,鲜切苹果的衰老程度越高[23]。乙醇熏蒸鲜切苹果MDA含量如图6所示。各处理组MDA含量随贮藏时间延长而增加,乙醇熏蒸组MDA含量低于对照组(P<0.05),说明乙醇熏蒸处理可延缓衰老。在贮藏后期,乙醇熏蒸组之间的MDA含量差异逐渐明显,其中乙醇含量400 μL/L、熏蒸2 h组MDA含量上升最为缓慢,抑制鲜切苹果衰老效果最显著。
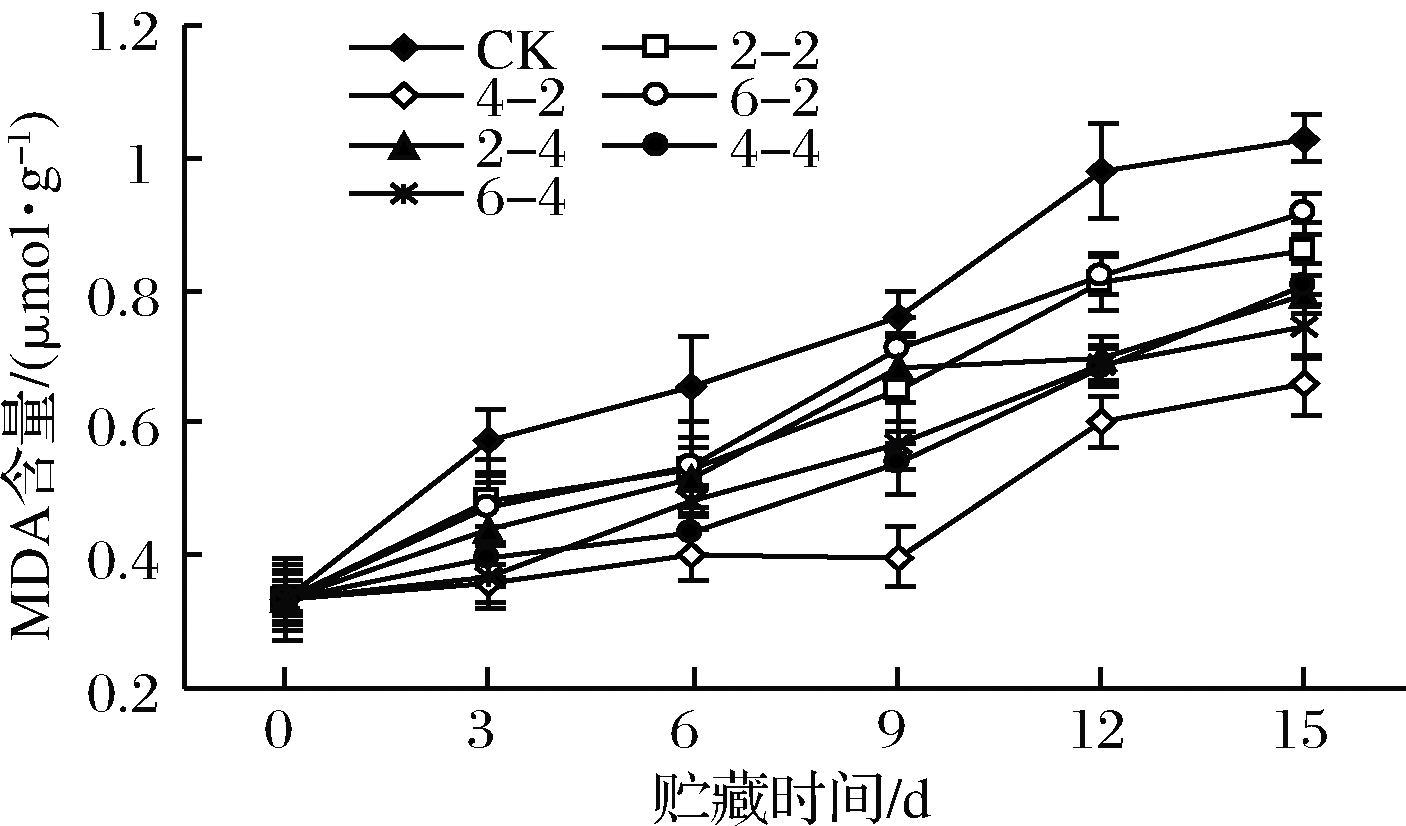
图6 乙醇熏蒸鲜切苹果MDA含量变化
Fig.6 Changes in MDA content of fresh-cut apples fumigated with ethanol
2.1.7 乙醇熏蒸对鲜切苹果感官评价的影响
鲜切苹果外观形态、色泽、滋气味和口感等感官品质是影响其货架期的主要因素。由图7可知,贮藏期间,实验各组感官评分逐渐降低,其中以对照组下降速度最快,感官评分显著低于乙醇熏蒸组,且在第10天时感官评分接近5分,到达货架期终点。乙醇熏蒸组中,乙醇含量400 μL/L、熏蒸2 h组感官评分明显高于其他各组(P<0.05),贮藏至第15天时感官评分接近对照组第6天,其他乙醇熏蒸组贮藏至第15天时接近货架期终点,且组间无差异。
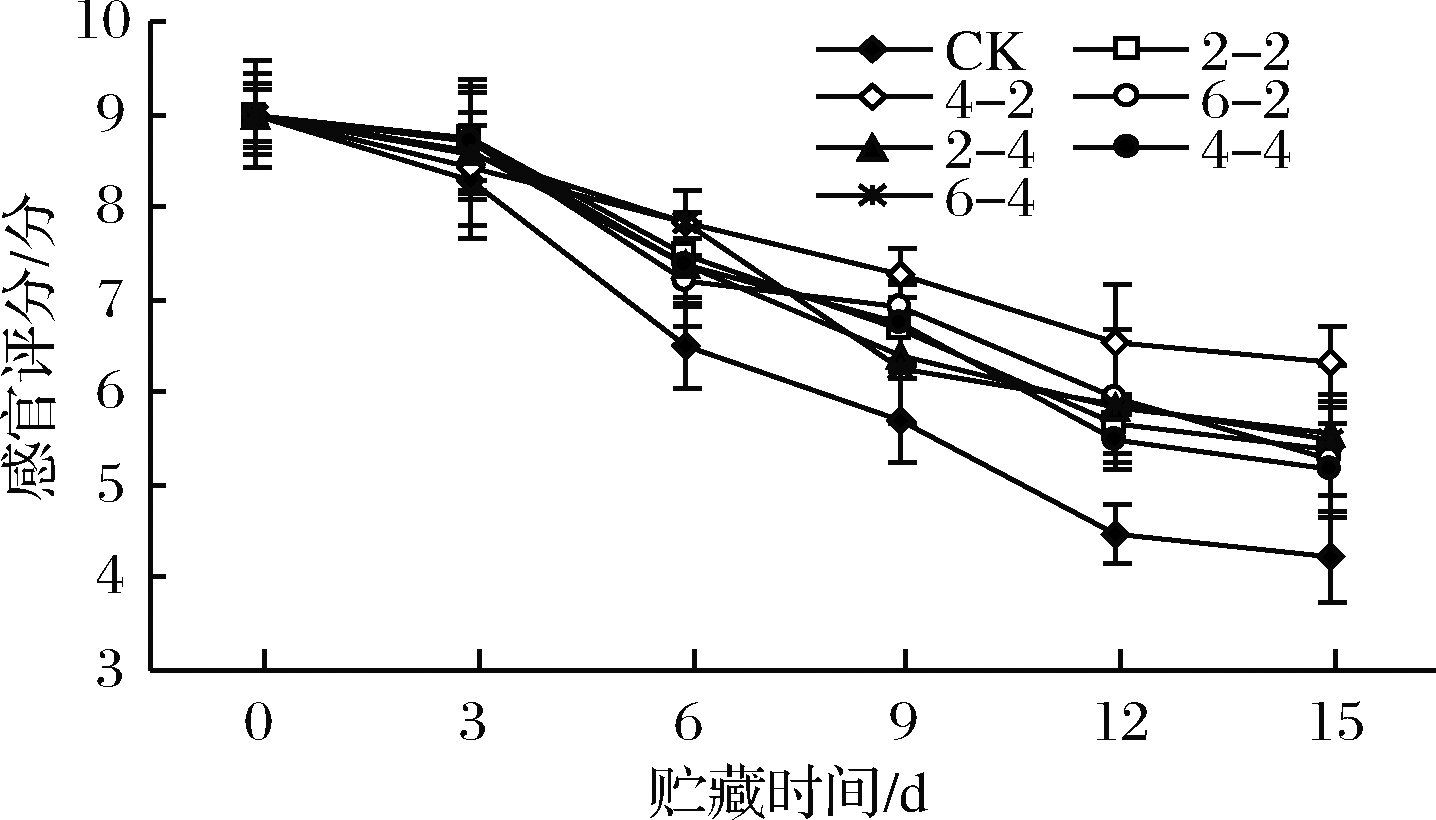
图7 乙醇熏蒸鲜切苹果感官评分变化
Fig.7 Changes in sensory scores of fresh-cut apples fumigated with ethanol
2.2 高氧预处理对鲜切苹果生理与品质的影响
2.2.1 高氧预处理对鲜切苹果呼吸速率的影响
高氧对果蔬呼吸速率的影响因果蔬种类、成熟度、氧浓度、处理时间、温度以及环境中CO2和乙烯含量不同而不同[24-25]。研究表明,高氧可以提高葡萄柚、柠檬、鲜切蘑菇、草莓、香蕉和荔枝等的呼吸速率[26],抑制桃、苹果、黄瓜、鲜切梨、枇杷和马铃薯片等的呼吸速率[27],鲜切芹菜和菊苣则对高氧不敏感[28]。LU等[29]研究发现,经纯氧短期前处理的苹果加工成的鲜切苹果片,在低氧气调贮藏期间,呼吸速率受到显著抑制,这表明高氧预处理对呼吸的抑制作用有后续效应。由图8可知,鲜切苹果贮藏过程中呼吸速率先升高,到达峰值后降低,高氧预处理组呼吸高峰出现的时间较对照组晚,且峰值低于对照组(P<0.05),组间无差异,表明高氧预处理延迟了鲜切苹果呼吸高峰,降低呼吸速率。高氧抑制呼吸作用可能与其对三羧酸循环中某些酶的抑制作用有关[26]。
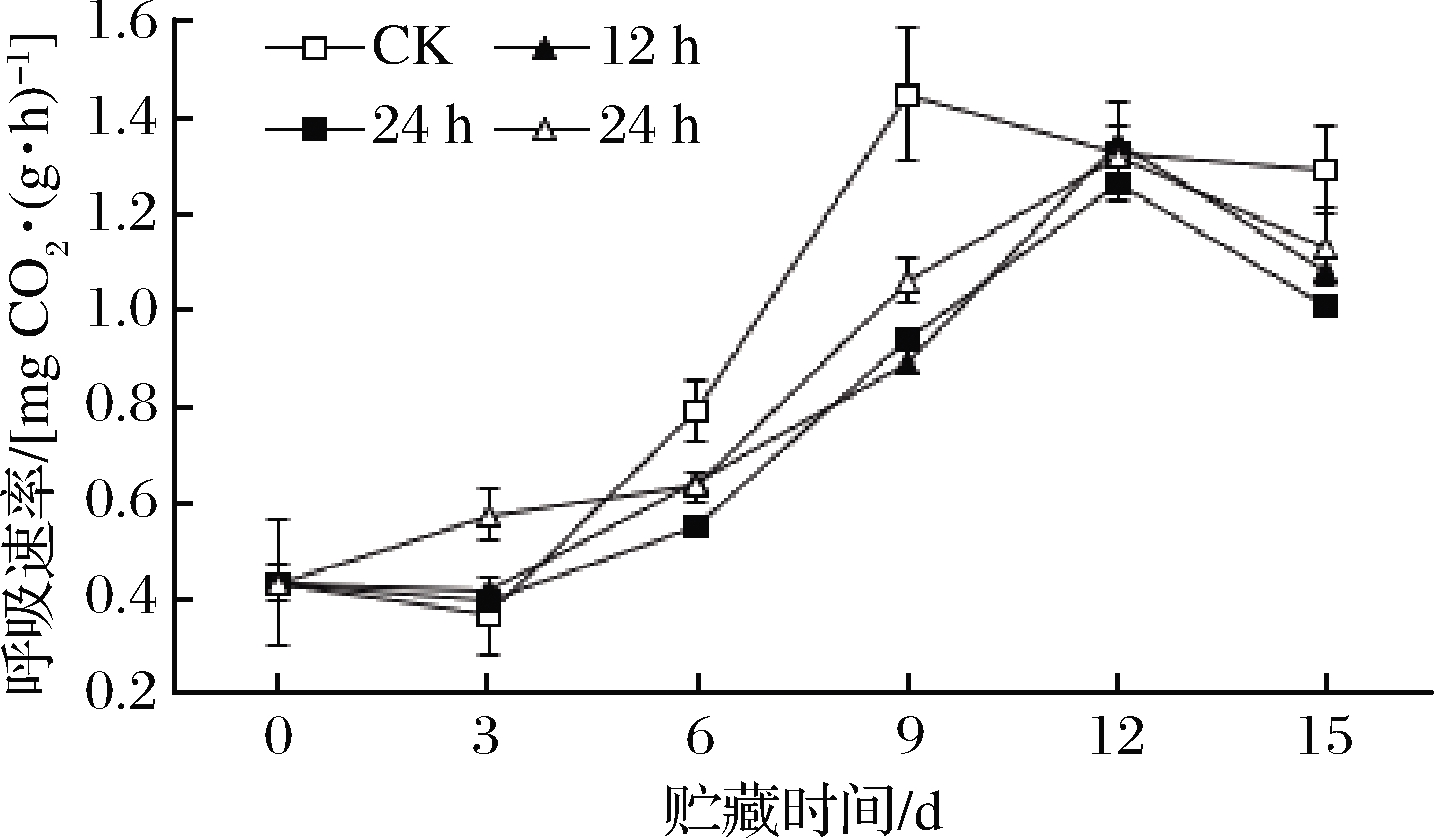
图8 高氧预处理鲜切苹果呼吸速率变化
Fig.8 Changes in respiration rate of fresh-cut apples pretreated with high-oxygen
2.2.2 高氧预处理对鲜切苹果菌落总数的影响
鲜切苹果经高氧预处理后菌落总数变化如图9所示。贮藏期间,菌落总数不断上升。贮藏前6 d,高氧预处理各组菌落总数均低于对照组(P<0.05),其中高氧预处理24 h组菌落数最低(P<0.05),之后高氧预处理组菌落总数迅速增长。第12~15天,各实验组菌落数无显著差别。说明高氧预处理仅在鲜切苹果贮藏前6 d发挥出一定的抑菌效果,之后无作用。高氧处理对微生物的抑制作用可能是因为高氧胁迫诱导了微生物细胞内活性氧的生成,从而对细胞产生毒害作用[30]。
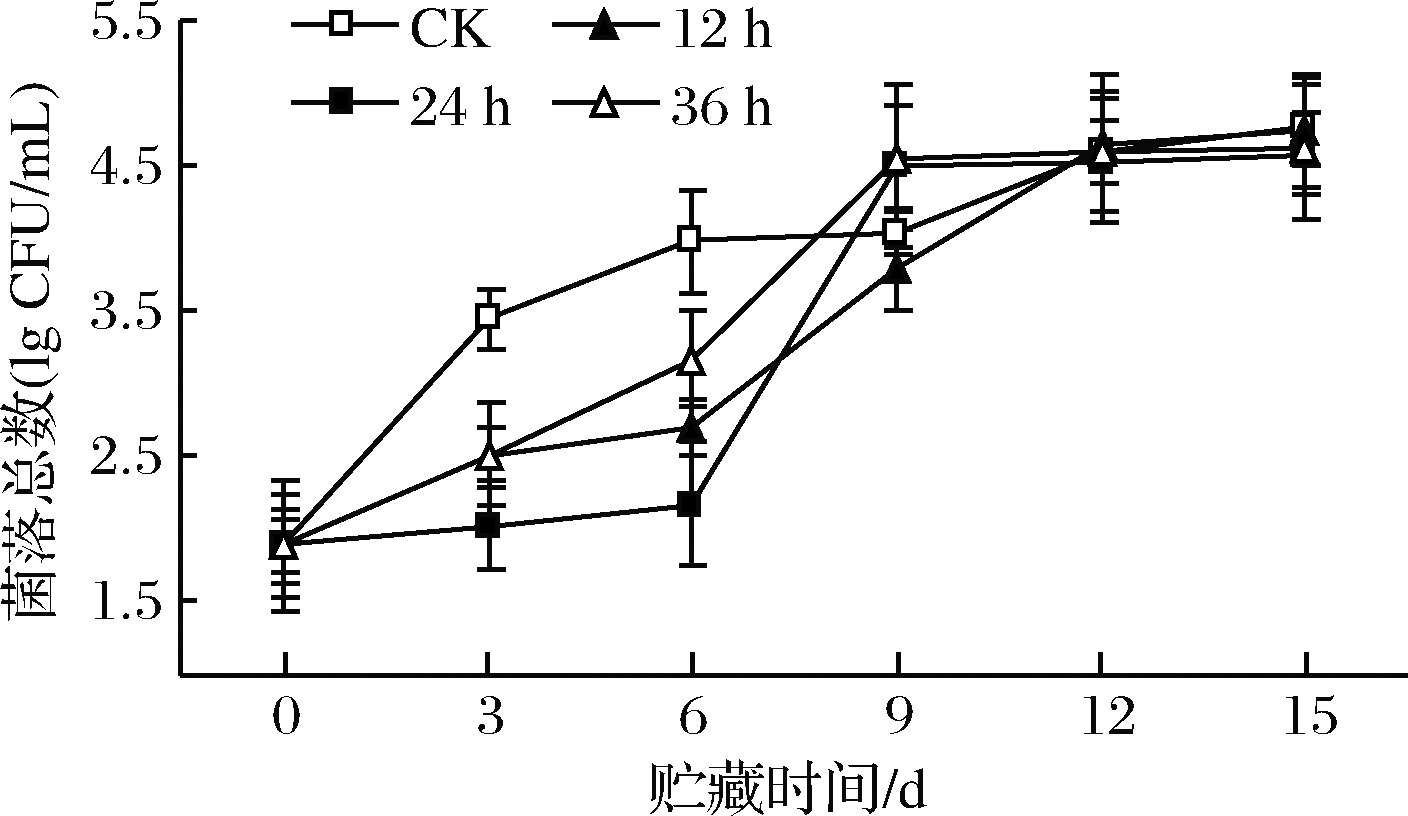
图9 高氧预处理鲜切苹果菌落总数变化
Fig.9 Changes in total number of colonies of fresh-cut apples pretreated with high-oxygen
2.2.3 高氧预处理对鲜切苹果褐变度的影响
研究表明,高氧预处理或高氧包装能够抑制苹果[29]、芹菜、马铃薯[31]和混合蔬菜沙拉[32]等鲜切果蔬的褐变。本研究采用体积分数为95%~100% O2,分别处理12、24和36 h后,鲜切苹果贮藏期间褐变度变化如图10所示。各处理组随贮藏时间延长褐变度上升,贮藏前期上升幅度较小,第9~15天褐变较前期严重,且高氧预处理组与对照组出现差异,前者褐变程度明显低于后者(P<0.05),其中高氧预处理24 h组褐变度最低。高氧处理能抑制酶促褐变,并具有后续效应,但高氧抑制酶促褐变的机制仍不清楚。
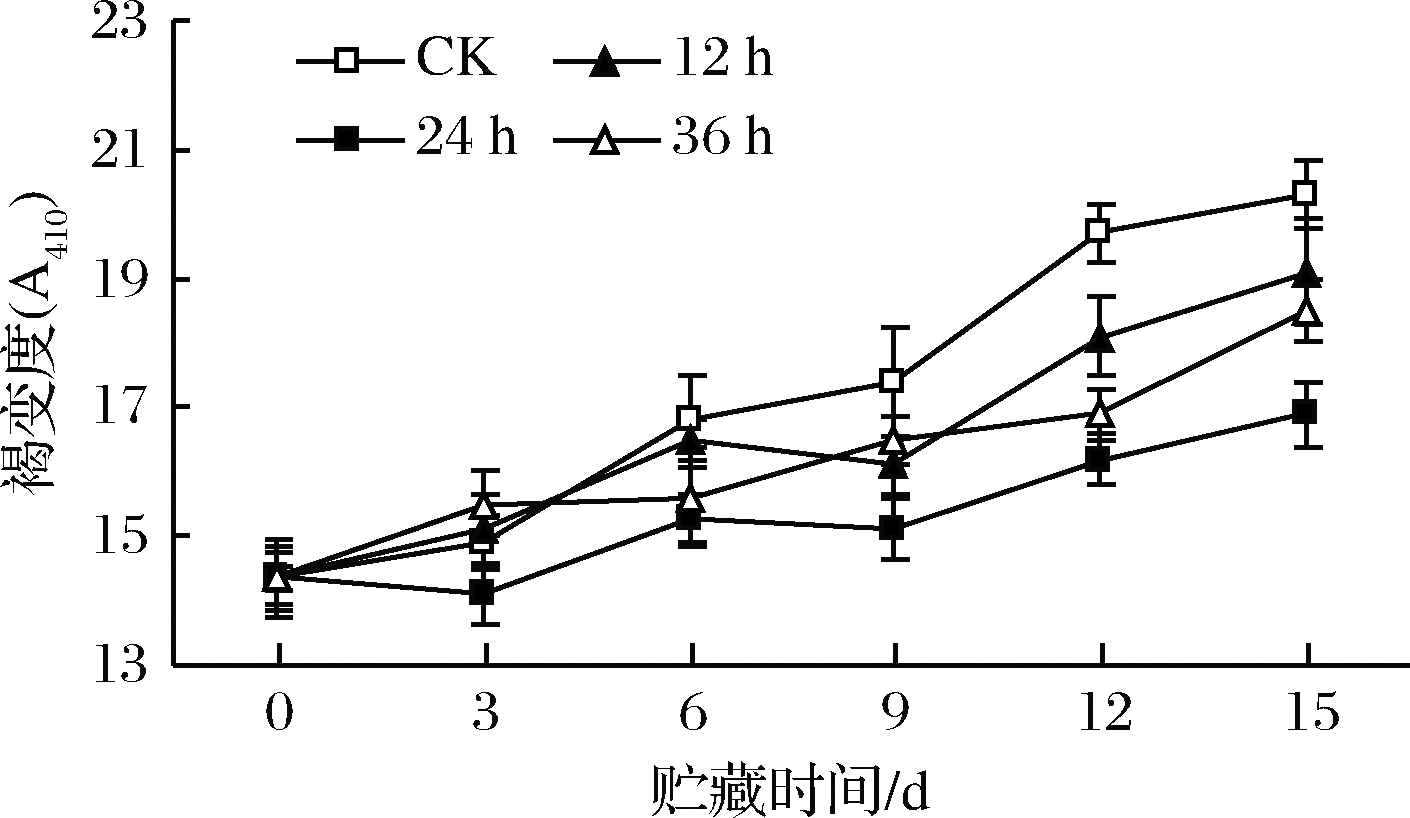
图10 高氧预处理鲜切苹果褐变度变化
Fig.10 Changes in browning degree of fresh-cut apples pretreated with high-oxygen
2.2.4 高氧预处理对鲜切苹果PPO酶活力的影响
通过高氧预处理一定时间后,鲜切苹果贮藏过程中PPO酶活力逐渐提高(图11),前9 d高氧预处理组与对照组无显著差异,第9天后对照组PPO酶活力迅速上升,至第12天时达最高值,之后缓慢下降。高氧预处理组第9天后PPO酶活力变化不明显,显著低于对照组(P<0.05),而高氧组间无显著差异。DAY[33]研究发现,大于70%的高氧处理能有效抑制果蔬褐变, 并认为高氧抑制PPO底物的产生, 或高浓度的醌可以反馈抑制PPO酶活力。
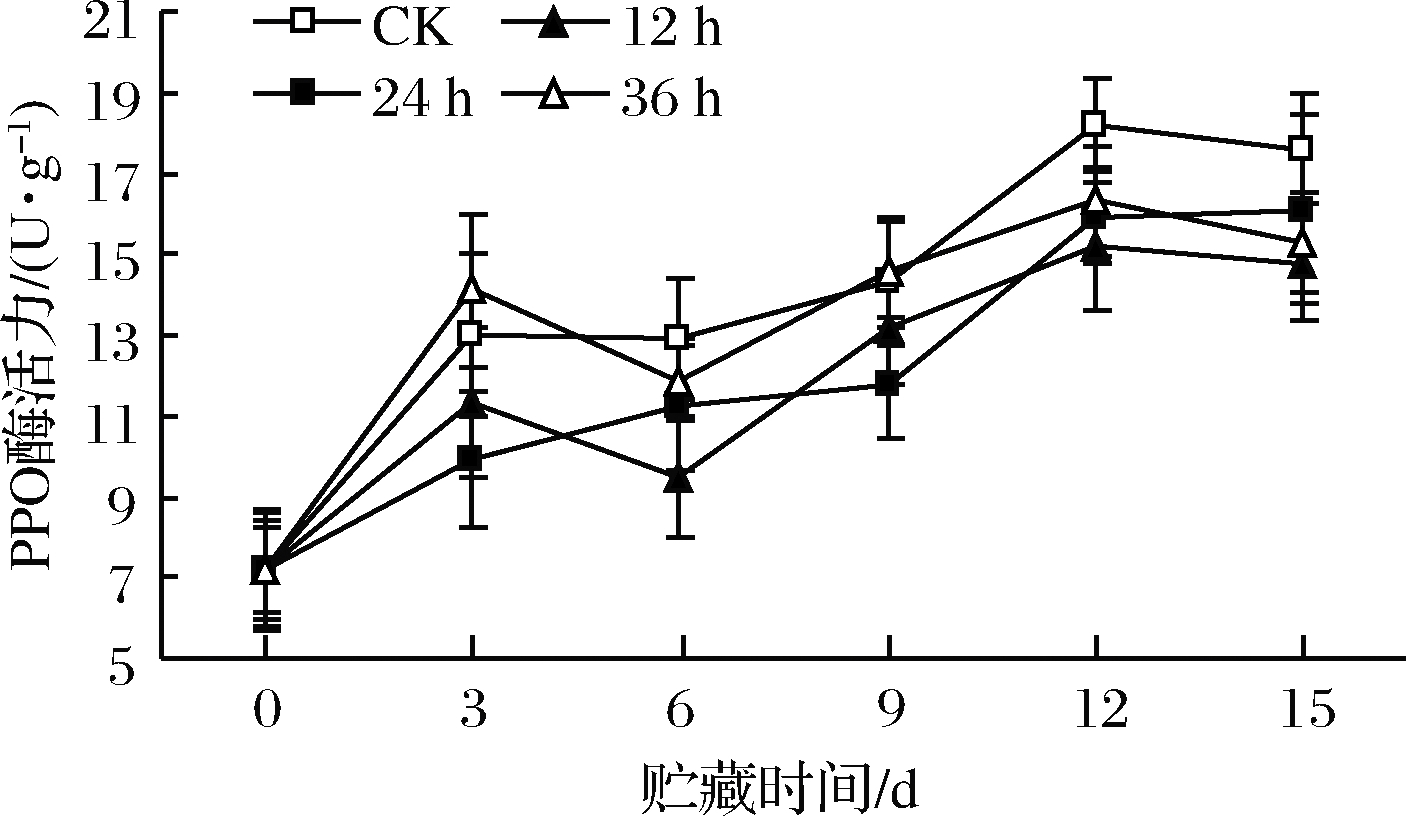
图11 高氧预处理鲜切苹果PPO酶活力变化
Fig.11 Changes in PPO activity of fresh-cut apples pretreated with high-oxygen
2.2.5 高氧预处理对鲜切苹果POD酶活力的影响
由图12可知,鲜切苹果POD酶活力随贮藏时间延长而升高,贮藏前期高氧预处理组与对照组无显著差异,贮藏后期高氧预处理组低于对照组(P<0.05),说明高氧预处理降低了POD酶活力,高氧预处理不同时间对POD酶活力影响无差异。
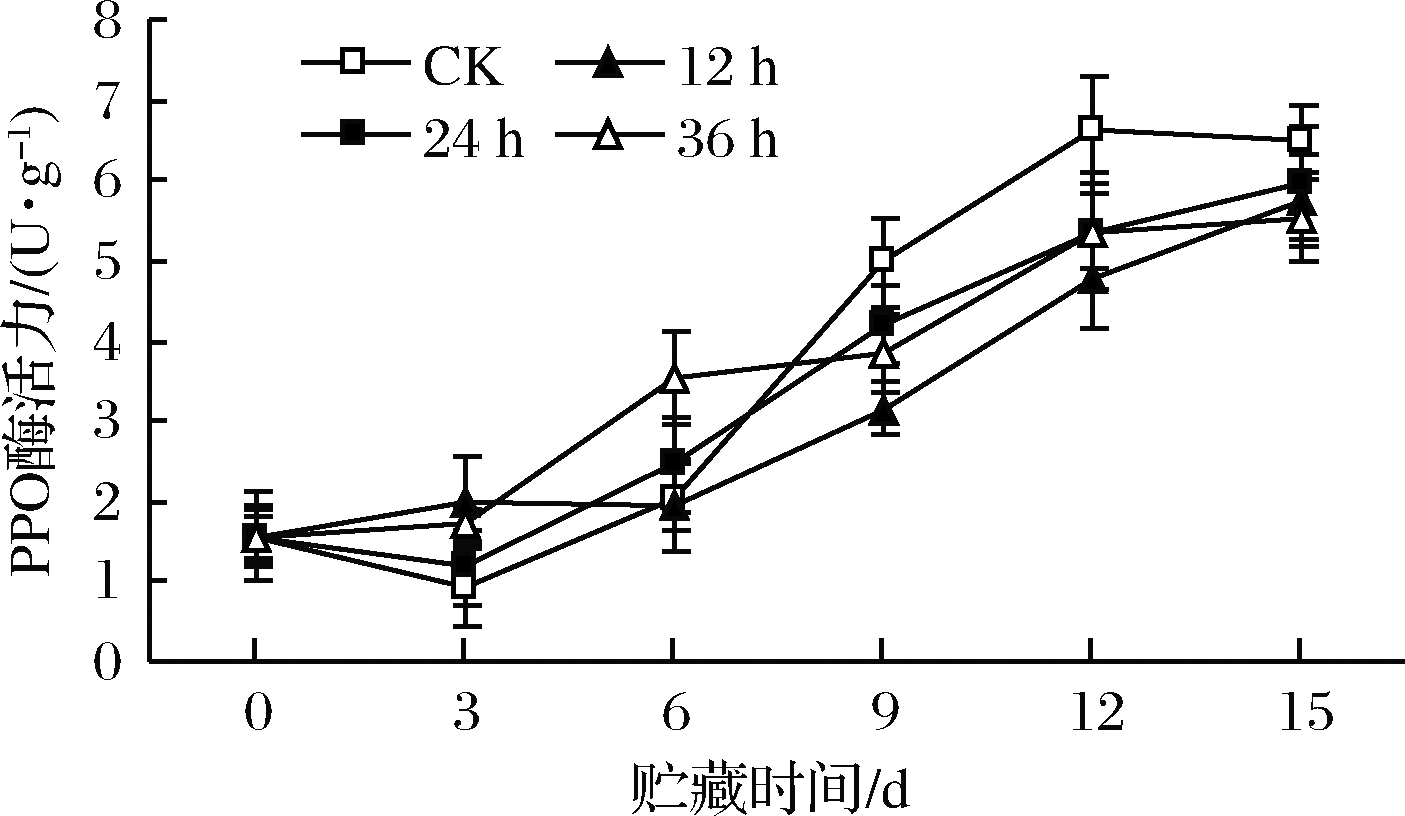
图12 高氧预处理鲜切苹果POD酶活力变化
Fig.12 Changes in POD activity of fresh-cut apples pretreated with high-oxygen
2.2.6 高氧预处理对鲜切苹果MDA含量的影响
高氧预处理对鲜切苹果MDA含量变化如图13所示。各处理组在贮藏过程中MDA含量逐渐增加,前3 d增幅缓慢,贮藏后期增幅加快。第9天后高氧预处理组MDA含量明显低于对照组(P<0.05),说明高氧预处理延缓了鲜切苹果的衰老,其中高氧预处理24 h组MDA含量最低(P<0.05),延缓衰老效果最显著。许多研究表明[29,34],高氧处理可抑制果蔬膜脂过氧化,延缓衰老,但其抑制机理尚不清楚。
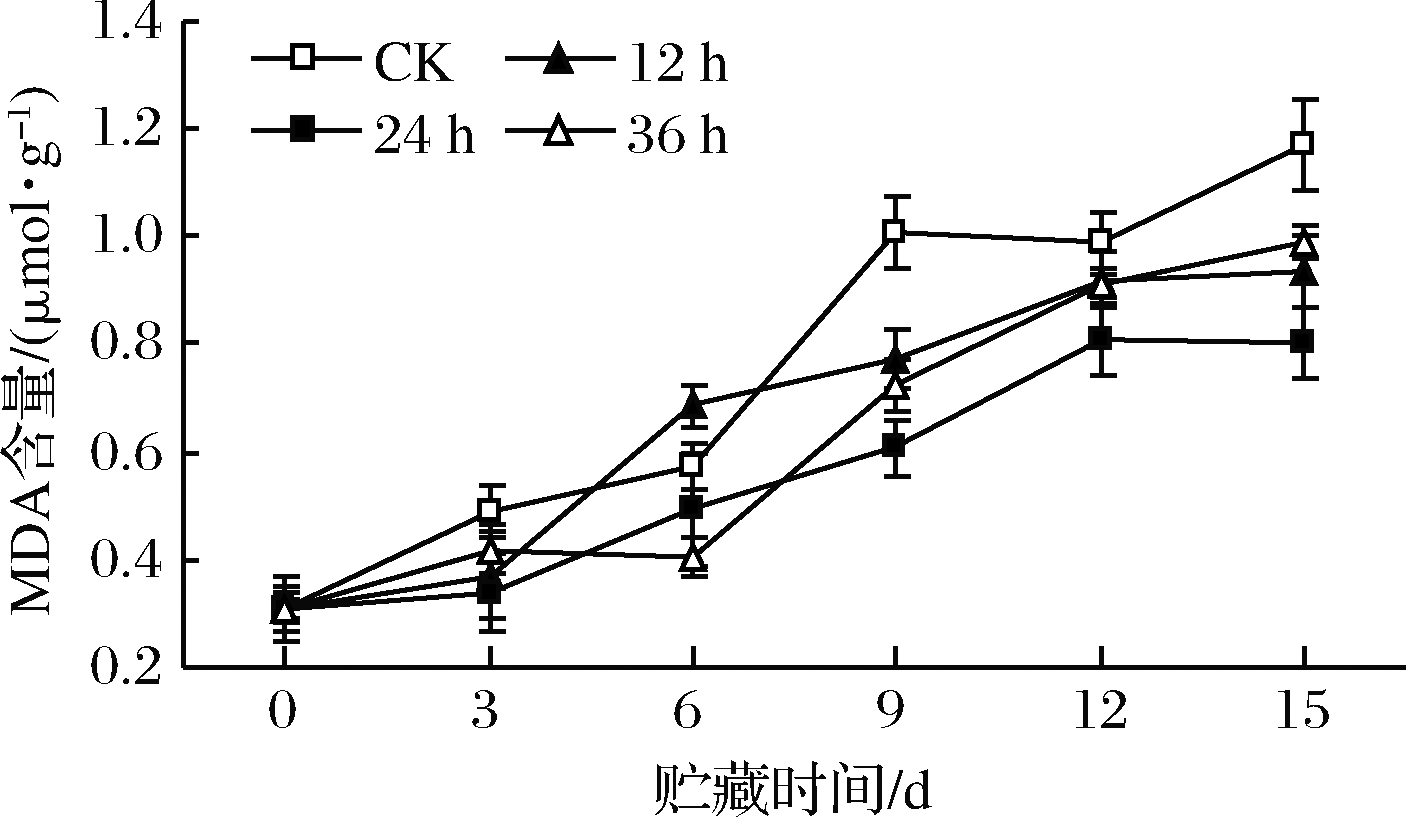
图13 高氧预处理鲜切苹果MDA含量变化
Fig.13 Changes in MDA content of fresh-cut apples pretreated with high-oxygen
2.2.7 高氧预处理对鲜切苹果感官评价的影响
高氧预处理对鲜切苹果在贮藏期间感官评分变化如图14所示,各组感官评分逐渐降低,贮藏前6 d感官评分下降缓慢,6 d后下降迅速。对照组下降速度最快,感官评分显著低于高氧预处理组(P<0.05),在第9天时感官评分达到货架终点临界值5分。高氧预处理组中,前6 d无显著差异,第9天开始高氧预处理24 h组感官评分明显高于其他2组(P<0.05)。
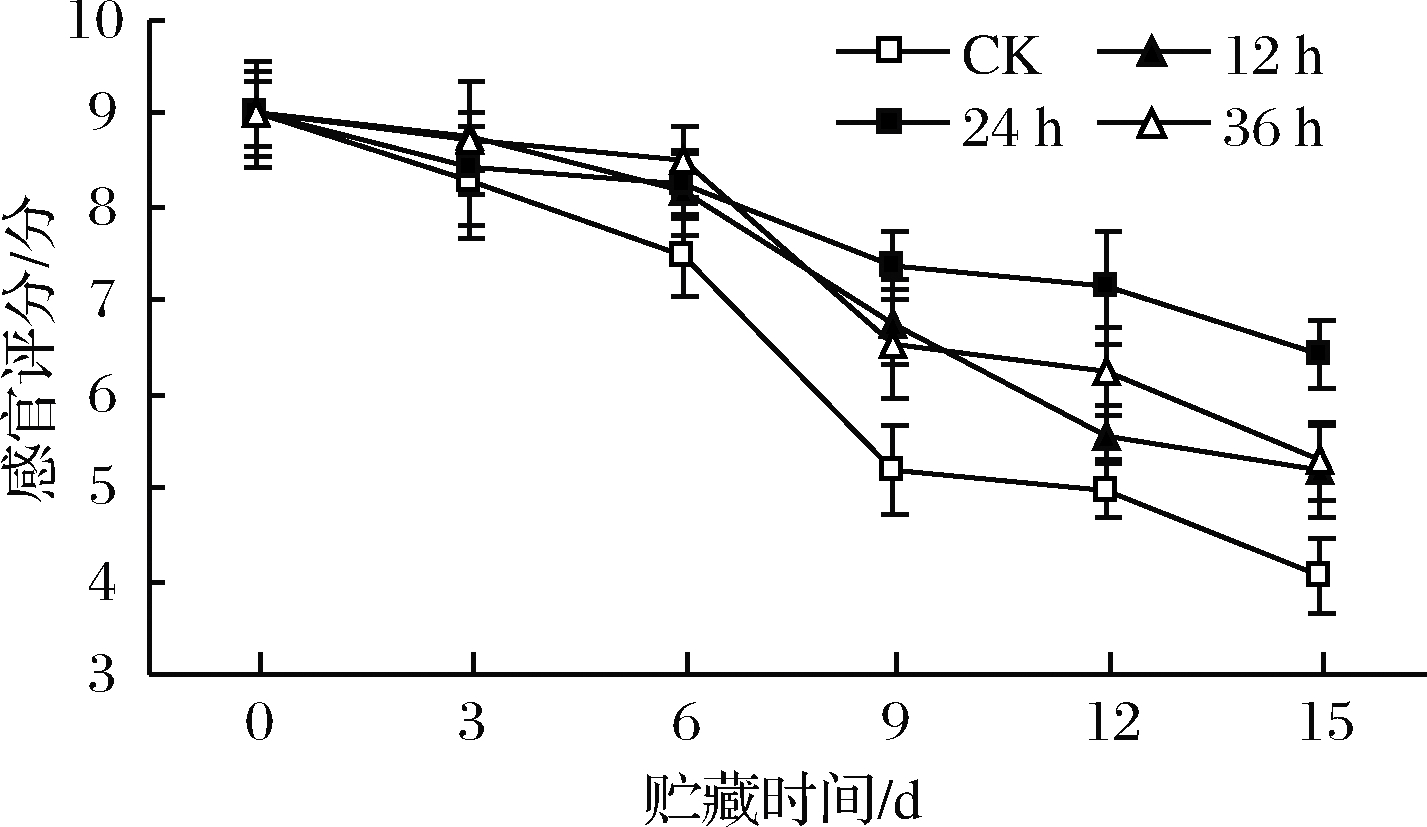
图14 高氧预处理鲜切苹果感官评分变化
Fig.14 Changes in sensory scores of fresh-cut apples pretreated with high-oxygen
3 结论
乙醇熏蒸与高氧预处理可抑制微生物生长、降低呼吸速率、减缓衰老、减轻褐变,从而保持鲜切苹果较高的生理特性与品质。乙醇熏蒸效果与乙醇含量和熏蒸时间有关,乙醇体积分数为400 μL/L,熏蒸2 h效果最佳。高氧预处理效果与处理时间有关,当采用体积分数为95%~100% O2时,处理24 h效果最好。乙醇熏蒸与高氧预处理鲜切苹果方法简单,成本低廉,对人体无毒副作用。因此,乙醇熏蒸与高氧预处理是安全有效的保鲜方法,可应用于鲜切苹果的加工与贮藏过程。
[1] OLIVEIRA M, ABADIAS M, USALL J, et al. Application of modified atmosphere packaging as a safety approach to fresh-cut fruits and vegetables-A review[J]. Trends in Food Science & Technology, 2015,46(1):13-26.
[2] 张慜, 马良. 对我国鲜切果蔬微加工行业及安全性的思考[J].江南大学学报(人文社会科学版),2016,15(5):110-114.
[3] HERPPICH W B, HUYSKENS-KEIL S, HASSENBERG K. Impact of ethanol treatment on physiological and micro-biological properties of fresh white asparagus(Asparagus officinalis L.) spears[J]. LWT-Food Science and Technology, 2014,57(1):156-164.
[4] BEAULIEU J C, SALTVEIT M E. Inhibition or promotion of tomato fruit ripening by acetaldehyde and ethanol is concentration-dependent and varies with initial fruit maturity[J]. Journal of American Society for Horticulture Science,1997,122(3):392-398.
[5] AHGN W, LI X, WANG X, et al. Ethanol vapour treatment alleviates postharvest decay and maintains fruit quality in Chinese bayberry[J]. Postharvest Biology and Technology,2007,46(2):195-198.
[6] 李佳格, 胡文忠. 乙醇处理对鲜切生菜品质保持与抑菌的作用机理[D].大连:大连工业大学,2017.
[7] HOMAIDA M A, YAN S L, YANG H. Effects of ethanol treatment on inhibiting fresh-cut sugarcane enzymatic browning and microbial growth[J]. LWT-Food Science and Technology,2017,77(4):8-14.
[8] GAO J, LUO Y G, TURNER E, et al. Mild concentration of ethanol in combination with ascorbic acid inhibits browning and maintains quality of fresh-cut lotus root[J]. Postharvest Biology and Technology,2017,128:169-177.
[9] YAN S L, LUO Y G, ZHOU B, et al. Dual effectiveness of ascorbic acid and ethanol combined treatment to inhibit browning and inactivate pathogens on fresh-cut apples[J]. LWT-Food Science and Technology,2017,80:311-320.
[10] 王雅, 邹红梅, 刘聪美, 等. 乙醇冷藏处理对鲜切马铃薯酶促褐变的抑制及其机理研究[J]. 中国食品添加剂, 2019,30(4):80-85.
[11] 牛丽芳, 杨颖, 易阳, 等. 紫外线照射及乙醇处理对鲜切荸荠褐变的影响[J]. 食品科技, 2019,44(11):41-46.
[12] CHERVIN C, WESTERCAMP P, MONTEILS G. Ethanol vapors limit Botrytis development over the postharvest life of table grapes[J]. Postharvest Biology and Technology,2005,36(3):319-322.
[13] MUHAMMAD R K, WANNEE C, AMPORN S, et al. Combined effects of natural substances and modified atmosphere packaging on reducing enzymatic browning and postharvest decay of longan fruit[J]. International Journal of Food Science & Technology,2020,55(2):500-508.
[14] LU H Y, WANG K D, WANG L, et al. Effect of super-atmospheric oxygen exposure on strawberry (Fragaria×ananassa Fuch.) volatiles, sensory and chemical attributes[J]. Postharvest Biology and Technology,2018,142:60-71.
[15] ALLENDE A, LUO Y, MCEVOY J L, et al. Microbial and quality changes in minimally processed baby spinach leaves stored under super atmosphere oxygen and modified atmosphere conditions[J]. Postharvest Biology and Technology,2004,33(1):51-59.
[16] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理局.GB 4789.2—2016 食品安全国家标准 食品微生物学检验 菌落总数测定[S]. 北京:中国标准出版社,2016.
[17] LIU C H, MA T, HU W Z, et al. Effects of aqueous ozone treatments on microbial load reduction and shelf life extension of fresh-cut apple[J]. International Journal of Food Science & Technology, 2016, 51 (5):1 099-1 109.
[18] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007: 176.
[19] ASODA T, TERAI H, KATO M, et al. Effects of postharvest ethanol vapor treatment on ethylene responsiveness in broccoli[J]. Postharvest Biology and Technology,2009,52(2):216-220.
[20] HU W Z, JIANG A L, TIAN M X, et al. Effect of ethanol treatment on physiological and quality attributes of fresh-cut eggplant[J]. Journal of the Science of Food and Agriculture, 2010(90):1 323-1 326.
[21] TINELLO F, LANTE A. Recent advances in controlling polyphenol oxidase activity of fruit and vegetable products[J]. Innovative Food Science & Emerging Technologies, 2018,50:73-83.
[22] TAO R, ZHANG F, TANG Q J, et al. Effects of curcumin-based photodynamic treatment on the storage quality of fresh-cut apples[J]. Food Chemistry, 2019,274(15): 415-421.
[23] CHEN J R, HU Y F, WANG J M, et al. Combined Effect of ozone treatment and modified atmosphere packaging on antioxidant defense system of fresh-cut green peppers[J]. Journal of Food Processing and Preservation, 2016,40(5):1 145-1 150.
[24] ZINASH A B, OLUWAFEMI J C, UMEZURUIKE L O. Influence of initial gas modification on physicochemical quality attributes and molecular changes in fresh and fresh-cut fruit during modified atmosphere packaging[J]. Food Packaging and Shelf Life,2019,21:1-11.
[25] 段学武, 蒋跃明. 高氧对果蔬采后生理影响研究进展[J]. 热带亚热带植物学报,2005, 13(6): 543-548.
[26] SRILAONG V, TATSUMI Y. Oxygen action on respiratory processes in cucumber fruit (Cucumis sativus) stored at low temperature [J]. Journal of Horticultural Science & Biotechnology, 2003, 78(5): 629-633.
[27] KADER A A, BEN-YEHOSHUA S. Effects of superatmospheric oxygen levels on postharvest physiology and quality of fresh fruits and vegetables [J]. Postharvest Biology and Technology, 2000, 20(1):1-13.
[28] JACXSENS L, DEVLIEGHERE F, VAN D S C, et al. Effect of high oxygen modified atmosphere packaging on microbial growth and sensorial qualities of fresh-cut produce [J]. International Journal of Food Microbiology,2001,71(2-3):197-210.
[29] LU C W, TOIVONEN P M A. Effect of 1 and 100 kPa O2 atmospheric pretreatments of whole ‘Spartan’ apples on subsequent quality and shelf life of slices stored in modified atmosphere packages [J]. Postharvest Biology and Technology, 2000, 18(2):99-107.
[30] AMANATIDOU A, SMID E J, BENNIK M H J, et al. Antioxidative properties of Lactobacillus sake upon exposure to elevated oxygen concentrations [J]. FEMS Microbiology Letters, 2001, 203(1):87-94.
[31] LIU X, WANG T, LU Y Z, et al. Effect of high oxygen pretreatment of whole tuber on anti-browning of fresh-cut potato slices during storage [J]. Food Chemistry,2019,31(15): 1 252-1 258.
[32] ALLENDE A, JACXSENS L, DEVLIEGHERE F, et al. Effect of super atmospheric oxygen packaging on sensorial quality, spoilage, and Listeria monocytogenes and Aeromonas caviae growth in fresh processed mixed salads [J]. Journal of Food Protection, 2002, 65(10):1 565-1 573.
[33] DAY B P F. High oxygen modified atmosphere packaging for fresh prepared produce[J]. Postharvest News and Information, 1996, 7(3):31-34.
[34] AMANATIDOU A, SMID E J, GORRIS L G M. Effect of elevated oxygen and carbon dioxide on the surface growth of vegetable-associated micro-organisms[J]. Journal of Applied Microbiology, 1999,86:429-438.