马齿苋为马齿苋科1年生肉质草本植物,在中国南北方均有分布[1]。作为一种药食同源的天然绿色植物,马齿苋资源十分丰富,且含有黄酮、多糖、多酚、生物碱等多种生物活性物质,具有较高的营养价值和独特的医疗保健作用,故又被称为“长寿菜”[2-3]。近年来,对马齿苋功能性成分的研究越来越受到国内外学者的关注。黄酮类化合物作为马齿苋的重要活性成分具有抗氧化[4]、抑菌[5]、抗病毒[6]、抗肿瘤[7]、降血糖[8]和增强机体免疫力[9]等多项功能。马齿苋黄酮类化合物具有清除自由基的抗氧化作用,且清除活性氧的能力在同等条件下要优于抗坏血酸、芦丁和β-胡萝卜素,表现出较强的体外抗氧化活性[4, 10]。但其在生物体内的抗氧化作用尚未见报道。在正常情况下,生物体处于氧化与抗氧化的动态平衡状态,活性氧自由基是一种高活性的分子[11],当机体遭受各种应激时,会引起抗氧化系统失衡,导致体内产生过量的活性氧(reactive oxygen species,ROS)[12],ROS水平的升高会引起体内脂肪、蛋白和核酸的氧化损伤[13],破坏机体正常代谢,从而导致各种疾病的发生。
斑马鱼是一种硬骨鱼,由于其个体小、繁殖能力强、发育快、胚胎透明易于观察、养殖成本低等优势,已成为仅次于小鼠的模式脊椎动物,被广泛应用于发育生物学,环境毒理学,免疫学等学科的研究[14]。近年来,斑马鱼已经成为一种热门的药学研究工具,被国内外学者用于建立各种疾病模型。在中草药领域,斑马鱼也被用于多种中草药及其生物活性物质如多糖、黄酮等功能的评价[15],特别是在抗氧化[16-17]和抗炎[18-20]功能评价方面斑马鱼已被广泛应用。但尚未见利用斑马鱼氧化应激模型评价马齿苋黄酮抗氧化活性的相关报道。
马齿苋黄酮的提取方法有溶剂提取法、超声波提取法、微波提取法、酶解法等[21]。黄酮类化合物在水中有一定的溶解度,水提法不仅成本低,产品安全,且无环境污染[22]。本研究在前期单因素试验的基础上,采用响应面法优化马齿苋黄酮的水提工艺,确定马齿苋黄酮的最佳水提条件。同时通过测定还原力,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基(·OH)的清除能力,评估马齿苋黄酮的体外抗氧化活性,并通过2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2′-azobis-2-methyl-propanimidamide, dihydrochloride,AAPH)诱导建立斑马鱼氧化应激模型,首次利用荧光显微镜分析马齿苋黄酮对AAPH诱导斑马鱼幼鱼体内ROS的产生率、细胞死亡率和脂质过氧化生成率的缓解作用,评估其体内抗氧化功能。
1 材料与方法
1.1 材料与试剂
马齿苋于2019年7~8月收获于内蒙古农业大学;斑马鱼成鱼,国家斑马鱼资源中心。
AAPH、2′, 7′-二氯荧光黄双乙酸(2′, 7′-dichlorodi-hydrofluorescein diacetate,DCFH-DA)、吖啶橙(acridine orange,AO)、1, 3-双(二苯膦)丙烷(1,3-bis(diphenyphosphino)propane,DPPP)、DPPH,美国Sigma公司,二甲基亚砜(dimethyl sulfoxide,DMSO)、间氨基苯甲酸乙酯甲磺酸盐(3-aminobenzoic acid ethyl ester methanesulfonate,MS-222)、丁基羟基茴香醚(butyl hydroxyanisole ,BHA)、水杨酸、磷酸盐缓冲液、六氰合铁酸钾、FeSO4、过氧化氢、三氯乙酸、FeCl3、芦丁标准液、NaOH、NaNO2、Al(NO3)3,上海国药集团化学试剂有限公司。
1.2 仪器与设备
TG16-WS台式高速离心机,湖南湘仪仪器开发有限公司;HH-2数显恒温水浴锅,中国鄄城华鲁电热电器有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;分析天平,梅特勒-托利多仪器有限公司;酶标仪,美国伯腾仪器有限公司;SZ61体式显微镜、正置荧光显微镜BX53,日本奥林巴斯。
1.3 试验方法
1.3.1 马齿苋黄酮的提取
采集后的马齿苋先用自来水清洗干净,再用蒸馏水冲洗,于40 ℃下烘箱烘干后,粉碎过60目筛获得马齿苋干粉。精确称取马齿苋干粉,按照一定的料液比加入蒸馏水,摇匀,置于水浴锅中水浴提取,提取过程中每隔15 min摇匀1次,待其冷却后将提取液摇匀,5 000 r/min下离心15 min,滤纸过滤,所得上清液于4 ℃保存,用于黄酮含量测定。
1.3.2 黄酮含量的测定
1.3.2.1 芦丁标准曲线的绘制
以芦丁为对照品采用亚硝酸钠-硝酸铝法绘制标准曲线,精确称取芦丁标准品100 mg置于100 mL避光容量瓶中定容,即得芦丁标准溶液。分别移取0.5、1.0、2.0、3.0、4.0、5.0 mL芦丁标准液置于10 mL容量瓶中,依次加入质量分数5% NaNO20.4 mL,摇匀,室温静置6 min,加入质量分数10%的Al(NO3)3 0.4 mL,摇匀,室温静置6 min;再加入质量分数4% NaOH 4 mL,室温静置15 min,加蒸馏水定容至10 mL。在波长510 nm下测定吸光度值。以芦丁浓度为横坐标,吸光度为纵坐标,绘制标准曲线得线性回归方程Y=0.578 9X+0.044 8,R2=0.999 6。
1.3.2.2 黄酮含量的测定
通过预实验调整马齿苋黄酮水提液的稀释倍数,使测定时其OD值落入标准曲线有效范围之内。在考察提取因素(料液比、温度、提取时间)时,准确移取5 mL马齿苋水提上清稀释液置于10 mL容量瓶中,按照1.3.2.1操作方法在510 nm下测定OD值,将所得OD值代入芦丁标准曲线计算黄酮含量。
马齿苋黄酮含量![]()
(1)
式中:c,芦丁质量浓度,mg/mL;D,稀释倍数;R,料水比(g∶mL);5,马齿苋水提液的体积,mL。
1.3.3 响应面试验设计
在前期单因素试验的基础上优化马齿苋黄酮水提工艺参数,利用Design-Expert.V8.0.6软件进行响应面优化设计,以提取时间(A)、提取温度(B)、料液比(C)为自变量,以黄酮含量为响应值,设计3因素3水平的响应面分析试验,共设计17个试验点,其中12个为分析点,5个重复试验为零点。试验因素与水平设计见表1。
表1 响应面分析试验因素与水平
Table 1 Factors and levels used in response surface analysis

水平A时间/minB温度/℃C料液比(g∶mL)-130401∶10060601∶20190801∶30
1.3.4 马齿苋黄酮体外抗氧化活性试验
1.3.4.1 还原力测定
还原力测定参照JIA等[23]方法,取0.75 mL不同浓度的马齿苋黄酮样品溶液,依次加入0.75 mL磷酸盐缓冲液(pH 6.6,200 mmol/L)和0.75 mL 质量分数为1%六氰合铁酸钾,混匀,于50 ℃反应20 min,加入质量分数为10%的三氯乙酸0.75 mL终止反应,然后取1.5 mL上清液,加入1.5 mL蒸馏水和400 μL质量分数为0.1%的FeCl3,充分混合,室温反应10 min。以BHA作为对照,在700 nm下测定吸光度值,吸光度值越大,表示其还原能力越强。
1.3.4.2 DPPH自由基清除能力测定
DPPH自由基清除能力测定参照ZHANG等[24]方法,取2 mL不同浓度马齿苋黄酮水提液和2 mL DPPH溶液(0.2 mmol/L,95%乙醇溶液)于试管中混匀,室温黑暗反应30 min,以BHA作为对照,517 nm下测定吸光度值。
DPPH自由基清除率![]()
(2)
式中:A0,样品吸光度;A1,乙醇代替DPPH溶液吸光度;A2,蒸馏水代替样品吸光度。
1.3.4.3 ·OH清除能力测定
·OH清除能力测定参照ZHANG等[24]方法,取0.5 mL不同浓度马齿苋黄酮水提液,依次加入0.5 mL FeSO4溶液(9 mmol/L)和0.5 mL过氧化氢溶液(8.8 mmol/L),室温反应10 min,加入0.5 mL水杨酸溶液(9 mmol/L),室温反应30 min,以BHA作为对照,于510 nm下测定吸光度值。
·OH清除率![]()
(3)
式中:A0,样品吸光度;A1,蒸馏水代替FeSO4溶液吸光度;A2,蒸馏水代替样品吸光度。
1.3.5 马齿苋黄酮体内抗氧化作用评价
1.3.5.1 斑马鱼的饲养及胚胎收集
斑马鱼亲鱼饲养于玻璃水族缸中,水温设置为(28.5±1)℃,光周期为14 h /10 h(光照/黑暗),饲养过程中每日投喂2次初孵丰年虾(12:00,19:00)和2次人工配合饲料(9:00,16:00)。试验前1天晚上选择体质健壮,产卵迹象明显的亲鱼,按照雌∶雄比例为1∶2分别放入孵化箱中用隔板分开,于次日清晨移出隔板使雌、雄亲鱼混合,受光照刺激,开始交配产卵。产卵后收集胚胎于干净的烧杯中并及时清洗胚胎。胚胎受精后约7~9 h在体式显微镜下观察胚胎发育情况,剔除未受精卵、死卵,畸形卵等不合格的卵,备用。
1.3.5.2 AAPH诱导斑马鱼氧化应激模型的建立及马齿苋黄酮抗氧化活性评价
根据文献报道,在AAPH浓度达到15 mmol/L时可使斑马鱼仔鱼体内氧化应激达到最高水平[16-17]。因此,本试验选择此浓度作为建立斑马鱼氧化应激模型的AAPH诱导浓度。试验设置6个处理组,分别为对照组(胚胎培养液)、AAPH诱导组、4个试验组分别为AAPH+终质量浓度为50、100、200、300 μg/mL的马齿苋黄酮水提液,每组4个重复(孔),每孔10枚胚胎。将受精后7~9 hpf(7~9 hour post fertilization)的胚胎分别移入装有胚胎培养液(对照组)、O(AAPH诱导组)、50、100、200、300 μg/mL马齿苋黄酮水提液的24孔板中,预处理1 h后,除对照组外,其余各组均加入50 μL的AAPH(15 mmol/L)进行氧化应激诱导,直到胚胎受精后24 hpf,将所有处理组溶液均更换为胚胎培养液继续培养。胚胎在控温水族缸〔(28.5±1) ℃〕中进行水浴孵化,每隔12 h更换1次胚胎孵化液。胚胎发育至72 hpf时大部分仔鱼已孵化出膜,从每一处理组随机选择数尾仔鱼对其进行荧光染色。其中ROS生成率测定使用DCFH-DA(20 μg/mL)荧光染料进行避光染色1 h;细胞死亡率测定使用吖啶橙(7 μg/mL)荧光染料避光染色30 min;脂质过氧化率测定使用DPPP(25 μg/mL)荧光染料避光染色1 h。荧光染色时将温度控制在(28.5±1) ℃,染色孵育后,用胚胎培养液清洗仔鱼3~5次,MS-222麻醉,将仔鱼置于倒置荧光显微镜下捕获荧光图片,用image J软件分析,统计相对荧光强度[25]。
(4)
式中:a,可表示活性氧自由基生成率,也可表示细胞死亡率,也可表示脂质过氧化率。
1.4 统计分析
采用SPSS 17.0统计软件进行单因素方差分析和Duncan氏法进行多重比较,P<0.05为差异显著,试验数据以“平均值±标准差”表示。采用Design-Expert.V 8.0.6软件根据Box-Bohnken设计试验进行响应面试验分析。通过Originpro 2017C软件进行作图。
2 结果与分析
2.1 响应面优化马齿苋黄酮提取试验结果
2.1.1 响应面实验结果
利用Design-Expert V8.0.6软件,根据Box-Behnken设计组合,对表2数据进行多元二次回归拟合,建立提取工艺参数回归模型,回归方程为:
Y=16.93-0.4A-0.043B-0.43C+0.37AB-1.49AC+0.14BC-A2-1.44B2-1.48C2
表2 Box-Bohnken响应面优化试验设计及结果
Table 2 Experimental design and results for Box-Behnken

试验点因素1A:时间/min因素2B:温度/℃因素3C:料水比(g∶mL)响应值黄酮/(mg·g-1)160601:2017.37260601:2017.47360801:3012.88490601:3012.21560801:1014.61690401:2014.05790601:1014.91830601:1013.72960401:3013.131060401:1015.41130601:3016.961260601:2017.171330401:2014.581430801:2014.21590801:2015.131660601:2016.091760601:2016.57
由回归模型方差分析结果可知(表3),该响应面模型的P=0.028 8<0.05,表示该数学模型达到显著水平;失拟项P=0.083 0>0.05,失拟项差异不显著,证明模型与实验拟合程度较好,具有统计学意义。
由回归方程和方差分析结果可知,模型中交互项AC的P值小于0.05说明提取时间和料液比交互作用对黄酮含量影响显著,二次项B2、C2的P值均小于0.05,说明提取温度和料液比对黄酮含量影响显著。由F值大小可知,这3个因素对马齿苋黄酮含量的影响大小依次为:C(料液比)>A(提取时间)>B(提取温度)。
表3 回归模型方差分析结果
Table 3 Analysis of variance for the fitted regression model
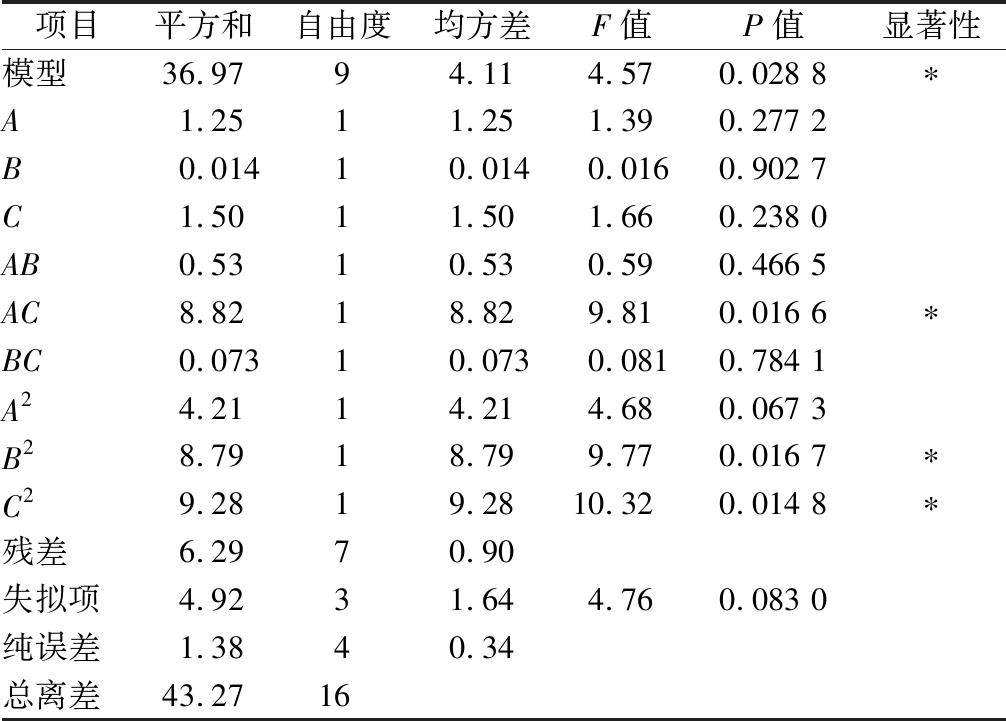
项目平方和自由度均方差F值P值显著性模型36.9794.114.570.028 8∗A1.2511.251.390.277 2B0.01410.0140.0160.902 7C1.5011.501.660.238 0AB0.5310.530.590.466 5AC8.8218.829.810.016 6∗BC0.07310.0730.0810.784 1A24.2114.214.680.067 3B28.7918.799.770.016 7∗C29.2819.2810.320.014 8∗残差6.2970.90失拟项4.9231.644.760.083 0纯误差1.3840.34总离差43.2716
注:*表示影响显著(P<0.05)
2.1.2 响应面分析及最佳工艺研究
响应面图可以直观地反映出对黄酮含量有影响的试验因素两两交互作用的显著程度,响应面坡度越陡峭,说明响应面值对操作条件的改变越敏感[26],利用Design-Expert V8.0.6软件对各因素之间的交互作用做出相应的响应面曲线图。如图1所示,提取时间和料液比之间的交互作用显著,这与方差分析结果一致。
利用Design-Expert V8.0.6软件分析计算出理论最佳提取工艺条件:提取时间55.5 min,提取温度59.27 ℃,料液比1∶19.28(g∶mL),此时黄酮含量达到16.98 mg/g。为了验证模型的有效性,同时结合实际操作将最佳工艺条件调整为提取时间56 min,提取温度60 ℃,料液比1∶20(g∶mL),在此工艺条件下进行5组平行试验,所得的黄酮含量的平均值约为16.13 mg/g,与预测值偏差不大,说明运用响应面法优化获得的模型参数准确可靠,能真实的反映各因素对马齿苋黄酮含量的影响。需要说明的是因本实验中单因素筛选所用马齿苋和响应面试验所用马齿苋材料来源于不同的月份,这可能直接影响马齿苋中黄酮的含量,使得响应面试验中马齿苋黄酮含量与单因素试验中黄酮含量相比偏低。
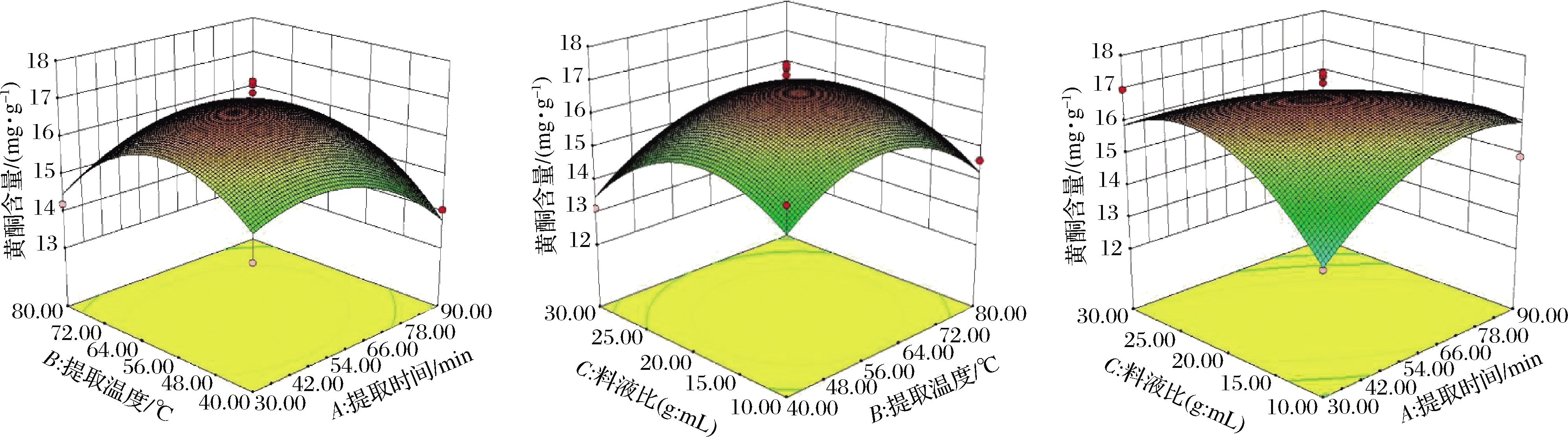
图1 三因素之间的相互作用对马齿苋黄酮含量的影响
Fig.1 Effect of interaction between factors on flavonoid content from P.oleracea L.
2.2 马齿苋黄酮体外抗氧化活性
2.2.1 还原力测定结果
由图2可知,不同浓度的马齿苋黄酮均表现出一定的还原力,且还原力随着马齿苋黄酮溶液质量浓度的增大而显著增强。当马齿苋黄酮质量浓度达到4 mg/mL时其还原力可达到1.05,但仍低于BHA,由此可知,马齿苋黄酮具有较好的抗氧化能力。
2.2.2 马齿苋黄酮对DPPH自由基的清除能力
由图3可知,随着马齿苋黄酮溶液质量浓度的升高,对DPPH自由基清除率逐渐升高;当马齿苋黄酮质量浓度在0~0.5 mg/mL时,清除率增加较快,此后清除率增加较为缓慢;当马齿苋黄酮浓度达到4 mg/mL时,DPPH自由基清除率达到73.65%,且显著高于其他浓度组(P<0.05),但其清除能力仍略低于BHA。
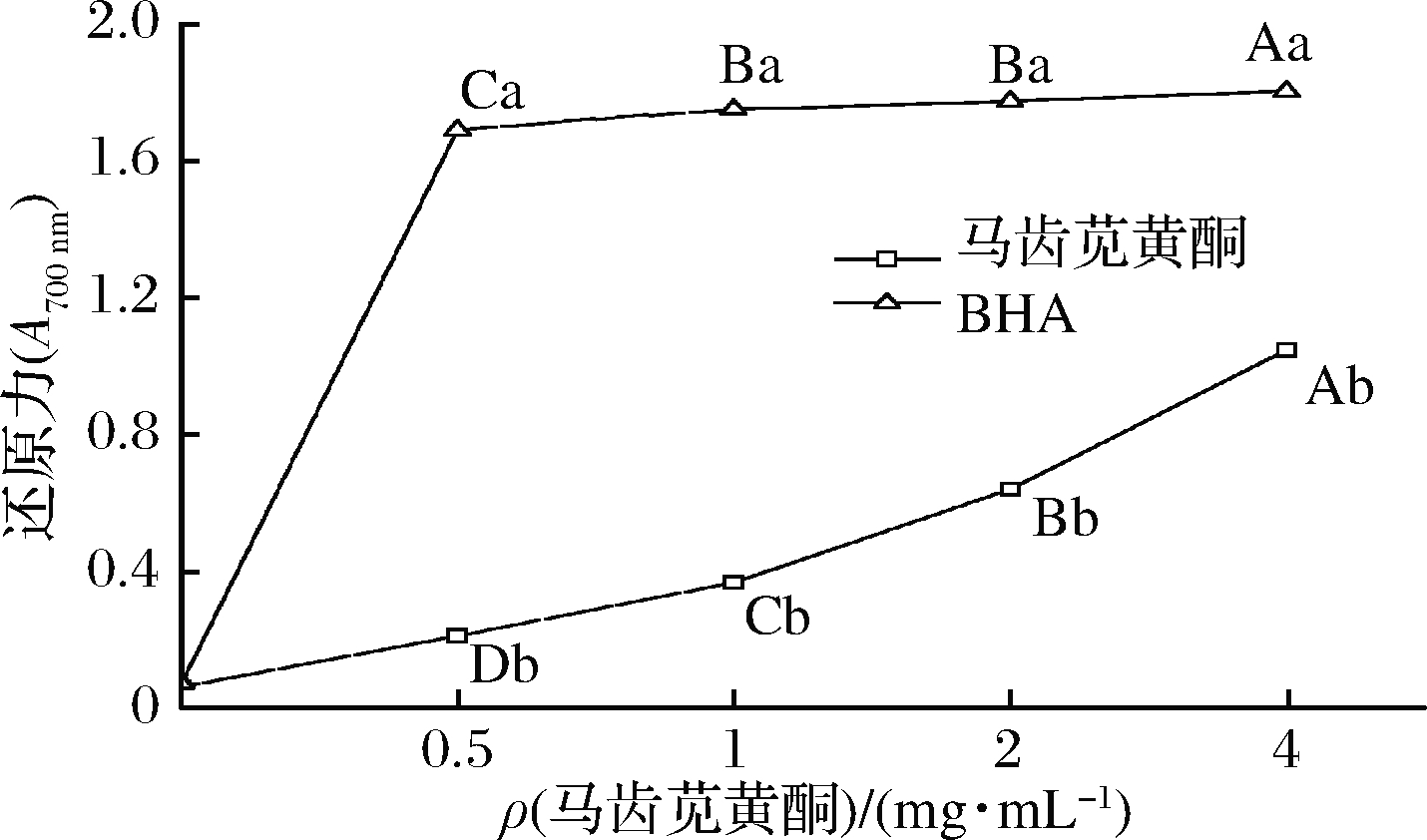
图2 马齿苋黄酮的还原力测定
Fig.2 Reducing power of flavonoids from P.oleracea L. 注:不同大写字母代表不同样品浓度的还原力差异显著, 不同小写字母代表不同样品的还原力差异显著(下同)

图3 马齿苋黄酮对DPPH 自由基的清除作用
Fig.3 Scavenging effect of flavonoids from P.oleracea L. on DPPH free radicals
2.2.3 对·OH的清除能力
由图4可知,马齿苋黄酮对·OH的清除率随着其溶液质量浓度的升高显著增强(P<0.05)。当马齿苋黄酮的质量浓度在0.5~1 mg/mL时,其·OH的清除能力低于BHA,当马齿苋黄酮的质量浓度达到2 mg/mL时,马齿苋黄酮对·OH的清除能力与BHA接近;而当马齿苋黄酮质量浓度升高到4 mg/mL时,其对·OH的清除率达到73.63%,显著高于BHA(P<0.05)。由此可知,马齿苋黄酮对·OH具有较强的清除作用。
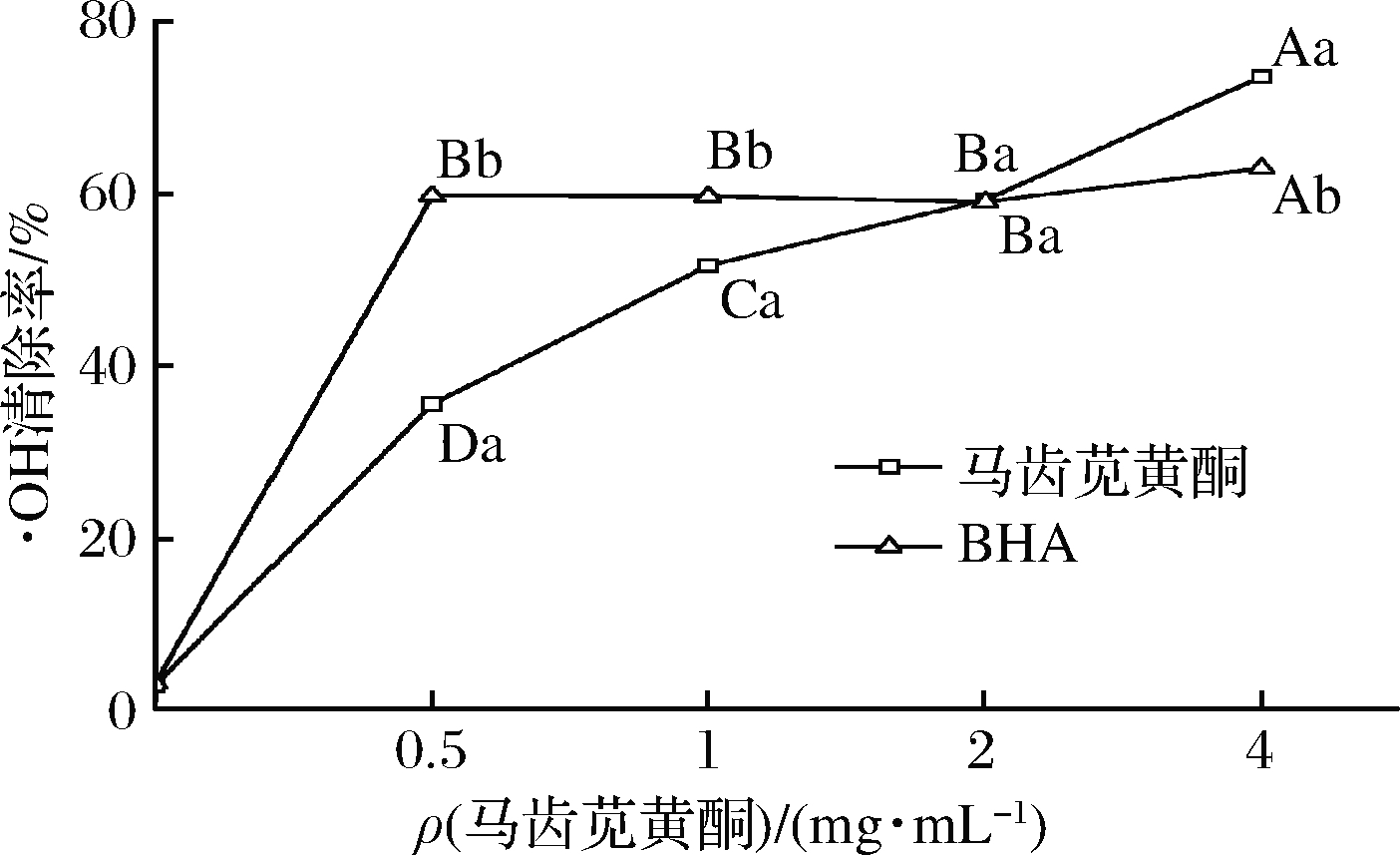
图4 马齿苋黄酮对·OH的清除作用
Fig.4 Scavenging effect of flavonoids from P.oleracea L. on hydroxyl radicals
2.3 马齿苋黄酮体内抗氧化活性
2.3.1 马齿苋黄酮对AAPH诱导的斑马鱼ROS产生率的影响
图5-a为不同处理组斑马鱼的荧光照片,绿色荧光越强表明细胞内ROS产生率越高,由图5-b可见,AAPH诱导后斑马鱼体内ROS产生率显著高于对照组(P<0.05),表明模型建立成功,马齿苋黄酮预孵育后斑马鱼体内ROS产生率显著降低(P<0.05),且显著低于对照组斑马鱼体内ROS产生率(P<0.05)。胚胎荧光照片显示,对照组斑马鱼荧光强度较弱,AAPH处理后可观察到显著增强的荧光强度,表明AAPH处理后斑马鱼仔鱼体内产生大量ROS,但当用马齿苋黄酮进行预暴露后,ROS产生率显著降低,表明马齿苋黄酮对AAPH诱导的斑马鱼ROS的产生具有显著的抑制作用,表明马齿苋黄酮具有较强的抗氧化作用。
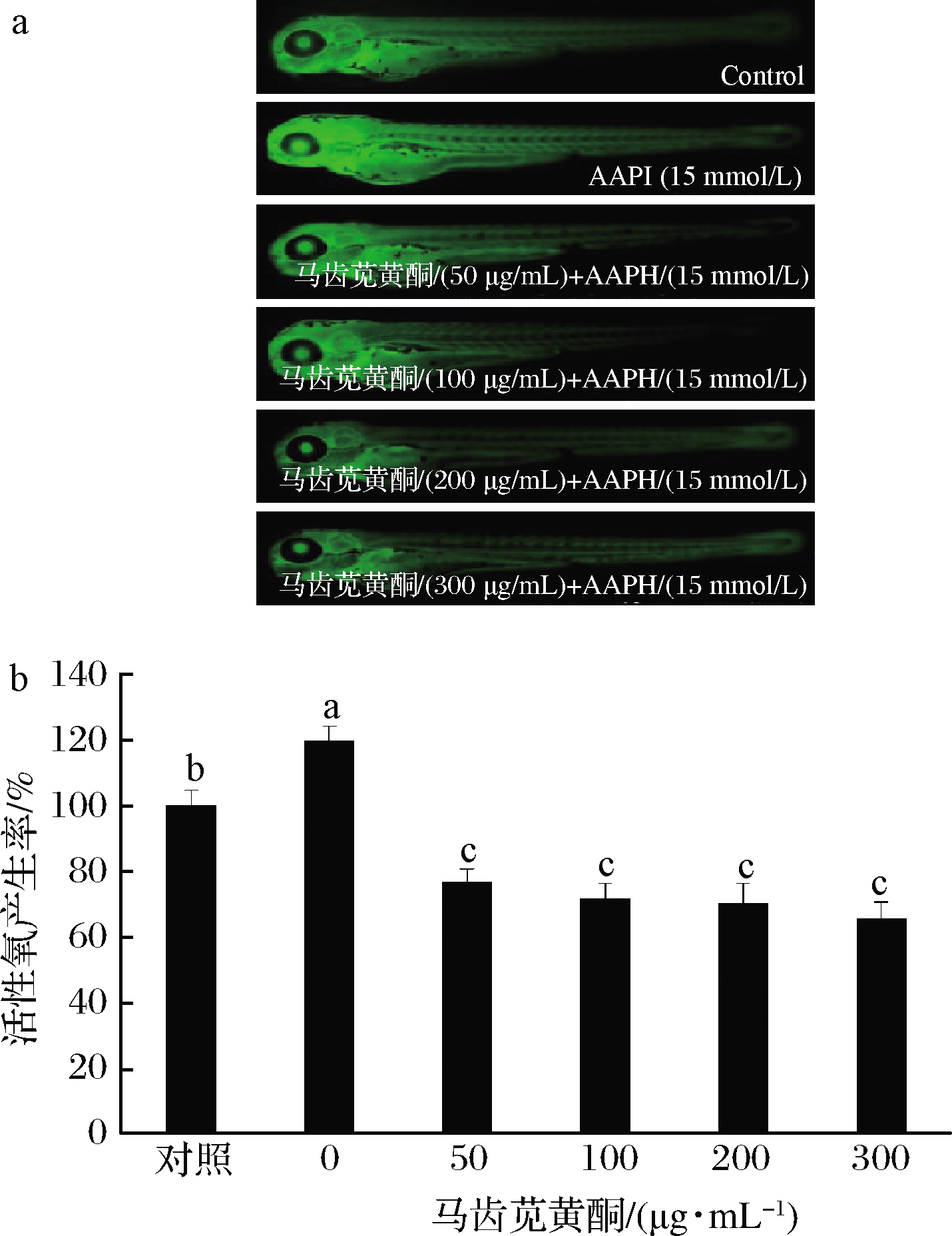
a-不同处理组斑马鱼荧光照片;b-不同处理组斑马鱼的活性氧产生率
图5 马齿苋黄酮对AAPH诱导的斑马鱼ROS 产生率的影响
Fig.5 Effect of flavonoids from P.oleracea L. on ROS production rate of zebrafish induced by AAPH
2.3.2 马齿苋黄酮对AAPH诱导的斑马鱼细胞死亡率的影响
图6-a为吖啶橙染色后不同处理组斑马鱼仔鱼的荧光照片,红色荧光越强表明细胞死亡率越高。由图6-b可知,对照组仔鱼仅有少量细胞死亡,而AAPH诱导组仔鱼体内死亡细胞数量显著增加(P<0.05),表明模型建立成功,马齿苋黄酮预孵育后斑马鱼仔鱼细胞死亡率显著降低(P<0.05),从斑马鱼仔鱼荧光图像也可明显看出,荧光强度随着马齿苋黄酮浓度的升高而明显降低,表明马齿苋黄酮可显著降低AAPH诱导的斑马鱼仔鱼细胞死亡率。
2.3.3 马齿苋黄酮对AAPH诱导的斑马鱼脂质过氧化生成率的影响
图7-a为不同处理组斑马鱼仔鱼的荧光照片,蓝色荧光越强表明细胞膜脂质过氧化产生率越高。由图7可知,对照组斑马鱼仔鱼仅有微弱荧光被检测到,AAPH诱导后斑马鱼仔鱼体内检测到较强的荧光强度,其脂质过氧化生成率显著增加(P<0.05),而马齿苋黄酮预孵育后斑马鱼仔鱼体内的脂质过氧化水平呈现浓度依赖性降低(P<0.05)。当马齿苋黄酮质量浓度达到200 μg/mL时,斑马鱼仔鱼脂质过氧化程度恢复到对照组水平。

a-不同处理组斑马鱼荧光照片;b-不同处理组斑马鱼的细胞死亡率
图6 马齿苋黄酮对AAPH诱导的斑马鱼细胞 死亡率的影响
Fig.6 Effect of flavonoids from P.oleracea L. on cell death rate of zebrafish induced by AAPH

a-不同处理组斑马鱼仔鱼的荧光照片; b-不同处理组斑马鱼脂质过氧化生成率
图7 马齿苋黄酮对AAPH诱导的斑马鱼脂质过氧化 生成率的影响
Fig.7 Effect of flavonoids from P.oleracea L. on the formation rate of lipid peroxidation induced by AAPH in zebrafish
3 结论
本研究在前期单因素实验的基础上,采用响应面法优化马齿苋黄酮的水提工艺条件,确定最佳水提时间为55.5 min,水提温度为59.27 ℃,料液比1∶19.28(g∶mL),在此条件下马齿苋黄酮含量可达到16.98 mg/g。对水提马齿苋黄酮进行体外抗氧化活性研究显示其具有一定的还原力,对DPPH自由基和·OH具有较强的清除能力,当马齿苋黄酮质量浓度达到4 mg/mL时,对·OH的清除率显著高于BHA,达到73.63%;体内抗氧化功能评价显示,马齿苋黄酮可显著降低AAPH诱导的斑马鱼仔鱼ROS产生率、细胞死亡率和脂质过氧化生成率,表现出显著的抗氧化保护作用,且呈现剂量依赖效应,该实验结果表明马齿苋黄酮具有较强的体内外抗氧化功能,可作为天然的抗氧化剂进行深度开发利用。
[1] 张晓艳, 王波, 黄攀, 等.马齿苋不同器官多糖提取物的抗氧化性研究[J]. 食品工业科技, 2017, 38(5): 130-133.
[2] 丁怀伟, 姚佳琪, 宋少江. 马齿苋的化学成分和药理活性研究进展[J]. 沈阳药科大学学报, 2008, 25(10): 831-838.
[3] 王波, 张晓艳, 黄攀, 等. 响应面法优化马齿苋黄酮超声波提取工艺[J]. 江苏农业学报, 2018, 34(1): 166-171.
[4] 苏锐, 张红. 马齿苋黄酮抗氧化活性研究[J]. 安徽农业科学, 2010, 38(8): 4 068-4 070.
[5] 陈国妮. 马齿苋黄酮类化合物的提取及抗菌特性研究[D]. 西安: 西安工程大学, 2016.
[6] 王毅兵, 马齿苋水煎液抗单纯疱疹病毒的实验研究[J]. 临床合理用药, 2011, 4(4B): 52-53.
[7] 梁艳妮, 唐志书, 张晓群, 等.马齿苋总黄酮的超声波辅助提取工艺优化及其抗氧化、抗肿瘤活性研究[J]. 中国农学通报, 2019, 35(4): 130-135.
[8] 郑智音, 贾晓斌, 舒娈, 等.鲜马齿苋多糖、生物碱和多酚类组分的制备及其降血糖活性研究[J]. 中草药, 2014, 45(18): 2 673-2 677.
[9] 葛一漫, 张朝明, 胡一梅, 等.马齿苋提取物对急性湿疹大鼠皮肤TNF-α与IL-4表达的影响[J]. 中国免疫学杂志, 2014, 30(12): 1 637-1 640.
[10] 章爱华, 邓斌, 蒋刚彪, 等.马齿苋黄酮提取液抗氧化活性的初步研究[J]. 食品科技, 2008, 29(8): 140-143.
[11] SI C L, SHEN T, JIANG Y Y, et al. Antioxidant properties and neuroprotective effects of isocampneoside II on hydrogen peroxide-induced oxidative injury in PC12 cells [J]. Food and Chemical Toxicology, 2013, 59: 145-152.
[12] JUN W J, SEONG H S, CHUN H, et al. Determination of antioxidative potentials of Acanthopanax sessiliflorus (Rupr. & Maxim.) Seem. in differentiated HL-60 cells[J]. Food Chemistry, 2007, 105(4): 1 557-1 563.
[13] KIM Y G, SUMIYOSHI M, SAKANAKA M, et al. Effects of ginseng saponins isolated from red ginseng on ultraviolet B-induced skin aging in hairless mice[J]. European Journal of Pharmacology, 2009, 602(1): 148-156.
[14] LAWRENCE C. The husbandry of zebrafish (Danio rerio): A review[J]. Aquaculture, 2007, 269(1-4): 1-20.
[15] SETO S W, KIAT H, LEE S M Y, et al. Zebrafish models of cardiovascular diseases and their applications in herbal medicine research[J]. European Journal of Pharmacology, 2015, 768: 77-86.
[16] KANG M C, KIM S Y, KIM E A, et al. Antioxidant activity of polysaccharide purified from Acanthopanax koreanum Nakai stems in vitro and in vivo zebrafish model[J]. Carbohydrate Polymers, 2015, 127: 38-46.
[17] KIM E A, LEE S H, KO C, et al. Protective effect of fucoidan against AAPH-induced oxidative stress in zebrafish model[J]. Carbohydrate Polymers, 2014, 102: 185-191.
[18] KIM S Y, KIM E A, KANG M C, et al. Polyphenol-rich fraction from Ecklonia cava (a brown alga) processing by-product reduces LPS-induced inflammation in vitro and in vivo in a zebrafish model[J]. Algae, 2014, 29(2): 165-174.
[19] 倪立颖, 邹娅雪, 付晓婷, 等. 利用LPS诱导胚胎期斑马鱼炎症模型研究羊栖菜多酚抗炎机制[J]. 食品工业科技, 2019, 40(21): 279-285.
[20] LEE S H, KO C I, JEE Y, et al. Anti-inflammatory effect of fucoidan extracted from Ecklonia cava in zebrafish model[J]. Carbohydrate Polymers, 2013, 92(1): 84-89.
[21] 翟硕莉, 付艳梅. 马齿苋黄酮提取方法研究进展[J]. 衡水学院学报, 2012, 14(4): 39-41.
[22] 赵华, 张慧明, 董银卯, 等.银杏叶黄酮类化合物水提工艺的响应面优化[J].北京工商大学学报(自然科学版), 2010, 28(3): 27-31;43.
[23] JIA X, DING C, YUAN S, et al. Extraction, purification and characterization of polysaccharides from Hawk tea[J]. Carbohydrate Polymers, 2014, 99: 319-324.
[24] ZHANG Z, WANG X, ZHANG J, et al. Potential antioxidant activities in vitro of polysaccharides extracted from ginger (Zingiber officinale)[J]. Carbohydrate Polymers, 2011, 86(2): 448-452.
[25] 邹娅雪, 付晓婷, 段德麟,等.利用斑马鱼模型研究琼胶寡糖抗氧化机制[J].食品工业科技, 2019, 40(4): 286-291;298.
[26] 陈红梅, 谢翎. 响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J]. 食品科学, 2016, 37(2): 45-50.