巨藻(Macrocystis pyrifera),属褐藻门(Phaeophyta)、褐藻纲(Phaeophyceae)、海带目(Laminariales)、巨藻科(Lessoniaceae),是目前发现的体型最大的海洋藻类,生活在潮下带,主要分布在大洋洲、北美洲太平洋沿岸和南美洲南部沿海等地[1]。巨藻具有个体大、生长快、产量高、价格低等特点,是提取碘、褐藻胶、甘露醇的重要原料[2]。目前对巨藻营养成分的分析仅见ORTIZ等[3]对智利沿海包括巨藻在内的3种海藻的脂肪酸、氨基酸成分和维生素、类胡萝卜素等进行的检测分析。
海洋巨藻(Durvillaea potatorum),属褐藻门(Phaeophyta)、圆子纲(Cyclosporeae)、墨角藻目(Fucales)、杜维拉科(Durvillaeaceae),俗称牛皮藻,主要分布于南半球寒冷温带的潮间带到浅潮下带,是近海海藻场及海底森林主要的组成部分,经济和生态价值较高[4]。目前对海洋巨藻的研究主要集中于吸收重金属[5-6]、生产海藻肥[7-8]和多糖[9]等。在营养成分分析评价方面,VIRTUE等[10]对海洋巨藻脂肪酸成分进行了分析,SKRZYPCZYK等[11]对包括海洋巨藻在内的9种海藻的基本营养成分和脂肪酸进行了分析,并对其食用适口性进行了评价。
边花昆布(Ecklonia radiata),属褐藻门(Phaeophyta)、褐藻纲(Phaeophyceae)、海带目(Laminariales)、翅藻科(Alariaceae),俗称澳洲昆布,主要分布于非洲西北部、西部大西洋沿岸、印度洋西南沿海和太平洋西南部澳大利亚、新西兰沿海,是潮下带岩礁上海藻森林的重要组成部分[12]。近年来对边花昆布的研究主要集中于其生态学[13-14]、活性物质提取及功效[9,15-17]和功能食品研制[18]等方面。在营养成分分析评价方面,STEWART等[19]对其海藻酸、甘露醇、海带蛋白和褐藻糖胶的季节变化进行了研究,SKRZYPCZYK等[11]也对边花昆布营养成分进行了研究。
本研究以3种大型热带经济褐藻为研究对象,对其营养成分和碘、褐藻胶及甘露醇(碘胶醇)含量进行分析检测,并对其营养价值进行评价,为深入挖掘其在海藻化工、食品和饲料等方面的加工潜力提供基础数据。
1 材料与方法
1.1 材料与试剂
巨藻,2017年10月采集自秘鲁沿海,自然风干;海洋巨藻和边花昆布,2017年11月采集自澳大利亚Beach Port,自然风干。3种藻均由聚大洋藻业集团提供,粉碎过40目筛,自封袋保存于干燥器中备用。
甲苯、石油醚、氯仿、无水乙醚、 NH4OH、盐酸、浓H2SO4、Na2SO4、CuSO4、K2SO4、硼酸、NaOH,均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
LA8080氨基酸自动分析仪,日立高新技术公司;安捷伦1100液相色谱仪、GC6890气相色谱仪,美国安捷伦有限公司;Kjeltec 8400全自动蛋白测定仪、Soxtec 8000全自动脂肪测定仪,丹麦FOSS公司;ICE3500石墨炉原子吸收光谱、ICE3000火焰原子吸收光谱,赛默飞世尔科技有限公司;AP-50-LC液相色谱-AFS9230原子荧光光谱仪,北京吉天仪器有限公司。
1.3 实验方法
1.3.1 基本营养成分的测定
水分测定采用直接干燥法(GB 5009.3—2016);灰分测定采用高温灰化法(GB 5009.4—2016);粗蛋白质测定采用凯氏定氮法(GB 5009.5—2016);粗脂肪测定采用索式抽提法(GB 5009.6—2016);碳水化合物测定采用减差法,即100-(水分+蛋白质+脂肪+灰分)。
1.3.2 膳食纤维
不溶性膳食纤维,可溶性膳食纤维按GB 5009.88—2014测定。
1.3.3 氨基酸分析
样品经6 mol/L 盐酸溶液水解,采用氨基酸分析仪测定17种氨基酸,另取样品用5 mol/L NaOH溶液水解后,测定其色氨酸含量。
1.3.4 脂肪酸分析
按GB 5009.168—2016 内标法测定。
1.3.5 无机元素含量测定
Cu、Ca、K和Na、Se、Zn、Fe、I测定:分别按照GB 5009.13—2017石墨炉原子吸收光谱法、GB 5009.92—2016火焰原子吸收光谱法、GB 5009.91—2017火焰原子吸收光谱法、GB 5009.93—2017荧光分光光度法、GB 5009.14—2017火焰原子吸收光谱法、GB 5009.90—2016火焰原子吸收光谱法和GB 5009.267—2016氧化还原滴定法进行测定。
无机As、甲基Hg、Pb、Cd含量的测定:分别按GB 5009.11—2014液相色谱-电感耦合等离子质谱法、GB 5009.17—2014液相色谱-原子荧光光谱联用法、GB 5009.12—2017石墨炉原子吸收光谱法和GB 5009.15—2014测定。
1.3.6 其他成分测定
维生素C按照GB 5009.86—2016高效液相色谱法测定;甘露醇按照《保健食品功效成分检测方法(2011年版)》测定;海藻酸钠参考尚德荣等[20]建立的质量法进行测定。
1.4 营养价值的评价
将所测得必需氨基酸换算成每克蛋白质中含氨基酸的质量(mg),与1973年联合国粮农组织和世界卫生组织(FAO/WHO)建议的氨基酸计分模式[21]和以鸡蛋蛋白质作为理想蛋白质[22]进行比较,按公式(1)(2)(3)分别计算3种褐藻的氨基酸分(amino acid score,AAS)、化学分(chemical score,CS)和必需氨基酸指数(essential amino acid index,EAAI)[23]:
(1)
(2)
(3)
式中:M1,待评蛋白质中必需氨基酸的含量,mg/g N;M0,FAO/WHO模式中蛋白质相应必需氨基酸的含量,mg/g N;M2,鸡蛋蛋白质中相应必需氨基酸的含量,mg/g N;n,比较的氨基酸种数;a、b、c …h,待评蛋白质的氨基酸含量,mg/g N;A、B、C…H,鸡蛋蛋白质的氨基酸含量,mg/g N。
1.5 数据处理
文中数据均为3份平行样品的检测值,采用EXCEL 2017进行数据处理,所有数据均以平均值±标准差表示。
2 结果与分析
2.1 基本营养成分
由表1可知,在巨藻、海洋巨藻和边花昆布中,含量最高的是碳水化合物,占干质量的50%(质量分数,下同)以上,其中海洋巨藻的碳水化合物含量高达70.96%;其次是灰分,占干质量的20%以上;再次为粗蛋白,巨藻和边花昆布的蛋白含量在12%以上,海洋巨藻的粗蛋白含量相对较低,仅为6.04%;含量最低的成分为粗脂肪,含量仅占干质量的1%左右。
表1 三种大型褐藻基本营养成分与其他几种藻类对比 单位:g/100 g
Table 1 Nutritional composition of three large brown algae and some other algae
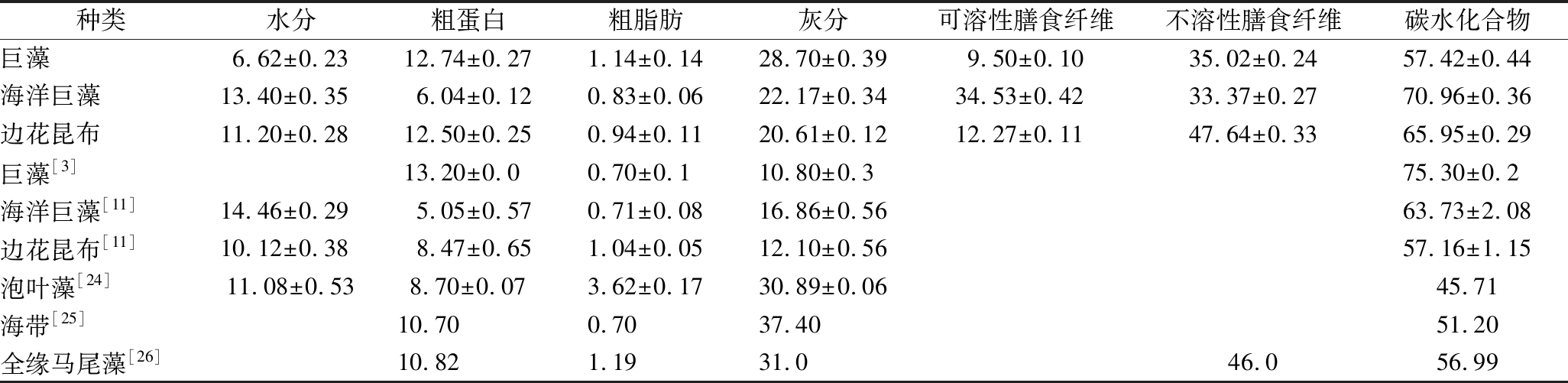
种类水分粗蛋白粗脂肪灰分可溶性膳食纤维不溶性膳食纤维碳水化合物巨藻6.62±0.2312.74±0.271.14±0.1428.70±0.399.50±0.1035.02±0.2457.42±0.44海洋巨藻13.40±0.356.04±0.120.83±0.0622.17±0.3434.53±0.4233.37±0.2770.96±0.36边花昆布11.20±0.2812.50±0.250.94±0.1120.61±0.1212.27±0.1147.64±0.3365.95±0.29巨藻[3]13.20±0.00.70±0.110.80±0.375.30±0.2海洋巨藻[11]14.46±0.295.05±0.570.71±0.0816.86±0.5663.73±2.08边花昆布[11]10.12±0.388.47±0.651.04±0.0512.10±0.5657.16±1.15泡叶藻[24]11.08±0.538.70±0.073.62±0.1730.89±0.0645.71海带[25]10.700.7037.4051.20全缘马尾藻[26]10.821.1931.046.056.99
本研究中巨藻的粗蛋白和粗脂肪含量与ORTIZ等[3]报道的较为相近,粗灰分含量偏高,碳水化合物含量偏低;海洋巨藻的粗蛋白和粗脂肪含量与VANESSA等[11]的报道相近,灰分和碳水化合物含量高于后者;边花昆布的脂肪含量与VANESSA等[11]的报道相近,粗蛋白、粗灰分和碳水化合物含量均高于后者。这些差异可能是由样品采集时间、地点、样品的生长阶段不同和检测方法的差异所造成的。与泡叶藻[24]、海带[25]和全缘马尾藻[26]相比,巨藻和边花昆布的粗蛋白含量相对较高,海洋巨藻的粗蛋白含量相对较低;3种褐藻的粗脂肪含量均小于泡叶藻,与海带和全缘马尾藻含量差别不大;粗灰分含量均低于泡叶藻、海带和马尾藻,碳水化合物含量均高于后3者。3种大型褐藻均为高碳水化合物、低脂肪的藻类。
海洋巨藻可溶性膳食纤维质量分数高达34.53%,远高于巨藻和边花昆布,赋予其良好的生理活性和营养价值,成为开发减肥、降血糖等功能食品和提取可溶性膳食纤维的理想原料;边花昆布的不溶性膳食纤维质量分数高达47.64%,可以作为良好的膳食纤维源和强化膳食纤维配方食品原料。
2.2 氨基酸组成、含量及营养评价
2.2.1 氨基酸组成及含量
由表2可知,3种褐藻中均检出18种氨基酸,包括8种必需氨基酸,2种半必需氨基酸和4种呈味氨基酸。从氨基酸组成上看,3种褐藻中含量较高的是Glu和Asp,Trp和Cys的含量较低,这与ORTIZ等[3]报道较为相似。巨藻、海洋巨藻和边花昆布中的必需氨基酸分别占氨基酸总量的35.83%、37.07%和37.08%,根据FAO/WHO的标准模式,EAA/NEAA(非必需氨基酸)在60%以上,EAA/TAA(氨基酸总量)在40%左右是质量好的蛋白质[27],3种海藻的EAA/TAA值接近40%,氨基酸的平衡效果较好,是较为优质的蛋白质。巨藻、海洋巨藻和边花昆布中的呈味氨基酸占氨基酸总量的比例分别为40.15%、43.39%和38.37%,赋予了3种海藻浓郁的鲜味。
表2 三种大型褐藻的氨基酸组成 单位:g/100 g 干质量
Table 2 Amino acids composition of three large brown algae

氨基酸巨藻海洋巨藻边花昆布天冬氨酸(Asp)∗1.29±0.070.47±0.021.62±0.08苏氨酸(Thr)#0.60±0.030.23±0.010.75±0.06丝氨酸(Ser)0.59±0.020.22±0.010.62±0.03谷氨酸(Glu)∗1.41±0.060.69±0.031.40±0.07脯氨酸(Pro)0.59±0.010.22±0.010.60±0.04甘氨酸(Gly)∗0.79±0.020.36±0.020.73±0.05丙氨酸(Ala)∗0.46±0.000.08±0.000.60±0.03缬氨酸(Val)#0.62±0.000.24±0.010.69±0.02半胱氨酸(Cys)0.13±0.010.07±0.000.18±0.01蛋氨酸(Met)#0.42±0.020.18±0.000.44±0.02异亮氨酸(Ile)#0.69±0.040.28±0.010.75±0.03亮氨酸(Leu)#0.31±0.010.08±0.000.37±0.01酪氨酸(Tyr)0.47±0.020.22±0.010.52±0.03苯丙氨酸(Phe)#0.65±0.030.24±0.010.81±0.05组氨酸(His)▲0.15±0.010.07±0.000.16±0.00色氨酸(Trp)#0.06 ±0.000.02±0.000.06±0.00赖氨酸(Lys)#0.43±0.020.18±0.010.44±0.02精氨酸(Arg)▲0.50±0.020.15±0.010.60±0.03氨基酸总量(TAA)10.164.0211.33必需氨基酸总量(EAA)3.641.494.20呈味氨基酸总量(DAA)4.081.744.35EAA/TAA(%)35.8337.0737.08DAA/TAA(%)40.1543.3938.37
注:#表示必需氨基酸;*表示呈味氨基酸;▲表示半必需氨基酸
2.2.2 氨基酸营养评价
AAS、CS和EAAI是评价蛋白质营养品质的常用指标。由表3可知,以AAS结果来看,3种褐藻中Trp评分均最低,其次为Leu,分别为第1和第2限制性氨基酸;巨藻和边花昆布的Cys+Met评分最高,分别为131.56和177.27,海洋巨藻的Thr评分最高,为95.20。边花昆布的Cys+Met、Thr、Lys、Tyr+Phe、Val评分均超过100分,高于FAO/WHO理想模式,可为人体提供丰富的半胱氨酸、甲硫氨酸、苏氨酸和赖氨酸等;氨基酸平均得分111.95分,说明其氨基酸组成较为均衡合理;同样地,巨藻的Cys+Met、Thr评分超过100分,可以成为补充半胱氨酸、甲硫氨酸和苏氨酸的优质蛋白源。
表3 三种大型褐藻必需氨基酸组成的评价
Table 3 Evaluation of essential amino acids composition of three large brown algae
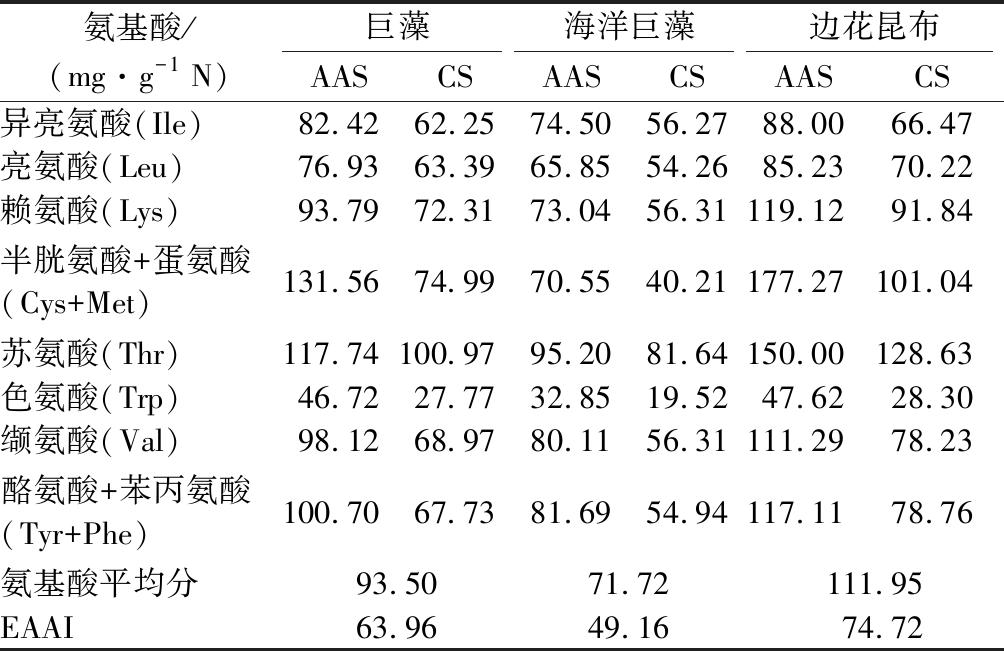
氨基酸/(mg·g-1 N)巨藻海洋巨藻边花昆布AASCSAASCSAASCS异亮氨酸(Ile)82.4262.2574.5056.2788.0066.47亮氨酸(Leu)76.9363.3965.8554.2685.2370.22赖氨酸(Lys)93.7972.3173.0456.31119.1291.84半胱氨酸+蛋氨酸(Cys+Met)131.5674.9970.5540.21177.27101.04苏氨酸(Thr)117.74100.9795.2081.64150.00128.63色氨酸(Trp)46.7227.7732.8519.5247.6228.30缬氨酸(Val)98.1268.9780.1156.31111.2978.23酪氨酸+苯丙氨酸(Tyr+Phe)100.7067.7381.6954.94117.1178.76氨基酸平均分93.5071.72111.95EAAI63.9649.1674.72
由CS结果进行分析,3种褐藻的Trp评分均最低,为第1限制性氨基酸;巨藻和边花昆布的Ile评分次低,为第2限制性氨基酸,海洋巨藻的Cys+Met评分次低,为第2限制性氨基酸。EAAI结果显示,必需氨基酸指数边花昆布>巨藻>海洋巨藻,边花昆布的蛋白营养价值更高;边花昆布的EAAI值高于裙带菜孢子叶[28](60.27)、琼枝麒麟菜[29](74.32)和羊栖菜[30](70.94),是良好的蛋白质来源。
考虑到色氨酸、亮氨酸和异亮氨酸为3种藻类共同的限制性氨基酸,在食用或使用其作为饲料添加剂时,应考虑搭配富含这3种氨基酸的食物,如花豆、小米、酸奶、红肉等,或添加色氨酸、亮氨酸和异亮氨酸以调整饲料的氨基酸组成。
2.3 脂肪酸组成及含量
3种褐藻的脂肪含量均较低,仅有1%左右,但其脂肪酸组成种类丰富。海洋巨藻中的脂肪酸含量关系为饱和脂肪酸(saturated fatty acid,SFA)>多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)>单不饱和脂肪酸(monounsaturated fatty acid, MUFA),巨藻和边花昆布中脂肪酸含量关系为SFA>MUFA> PUFA,这与ORTIZ等[3]的研究结果PUFA>MUFA>SFA有所不同,这种差异可能是由样品采集时间、地点,所处生长阶段的不同导致的,也可能是样品干制过程中不饱和脂肪酸发生了一定的氧化分解导致其检测数值偏低。PUFA分别占巨藻、海洋巨藻和边花昆布总脂肪酸含量的20.79%、28.81%、13.33%。PUFA是人体的必需脂肪酸,具有降低炎症、保护心脏、提高认知和抗癌等多种生理活性[30]。
表4 三种大型褐藻脂肪酸组成 单位:g/100 g 干质量
Table 4 Fatty acids composition of three large brown algae
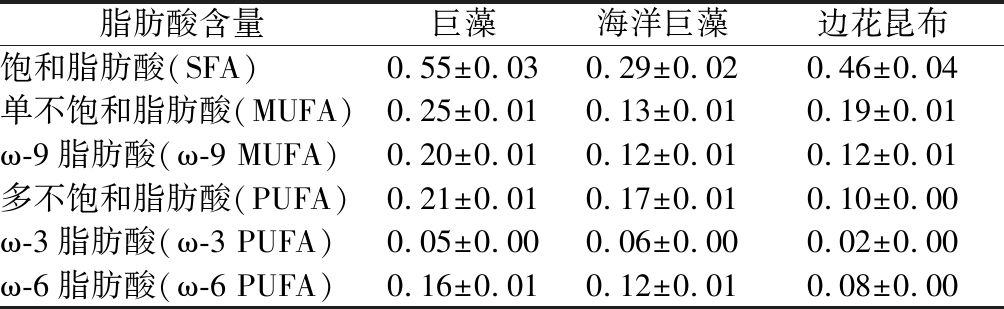
脂肪酸含量巨藻海洋巨藻边花昆布饱和脂肪酸(SFA)0.55±0.030.29±0.020.46±0.04单不饱和脂肪酸(MUFA)0.25±0.010.13±0.010.19±0.01ω-9脂肪酸(ω-9 MUFA)0.20±0.010.12±0.010.12±0.01多不饱和脂肪酸(PUFA)0.21±0.010.17±0.010.10±0.00ω-3脂肪酸(ω-3 PUFA)0.05±0.000.06±0.000.02±0.00ω-6脂肪酸(ω-6 PUFA)0.16±0.010.12±0.010.08±0.00
2.4 无机元素含量
3种大型褐藻中无机元素的含量差异较大。巨藻中含量最高的是K元素,其次为Na和Ca;海洋巨藻中Na元素含量最高,其次为Ca和K;边花昆布中Ca元素含量最高,其次为Na和K。巨藻、海洋巨藻和边花昆布中的Ca含量均较高,尤其是边花昆布中,含量高达37.99 mg/g,远高于泡叶藻[24]、厚叶海带[25]和裙带菜孢子叶[28],是良好的补钙食物来源。此外,3种褐藻中均含有丰富的微量元素Fe、Zn和 Se。Ca是动物不可或缺的常量元素,参与机体的许多生理活动及物质能量代谢;Fe有促进血红蛋白合成,运输氧气和缓解贫血等功能;Zn具有促进神经系统发育完善,提高食欲和增强免疫等功能;Se则是谷胱甘肽过氧化物酶的活性中心元素,是人体生长发育所必需的元素。
海藻具有富集海水中无机元素的特性,根据GB 2762—2017《食品中污染物限量》和NY/T 1709—2011《绿色食品 藻类及其制品》的规定,藻类及其制品中Pb、无机As和甲基Hg的限量分别为1.0、1.5、0.5 mg/kg(干重)。由表5可知,海洋巨藻的无机As含量超出了标准限量,其他2种藻的重金属含量均符合标准要求。海洋巨藻中的无机As含量超标,可能是由其生长环境中的As污染导致的,也可能是由海洋巨藻本身对重金属较强的吸附和富集所造成[5-6],在海洋巨藻的开发利用过程中应对此加以重视。
表5 三种大型褐藻与其他几种藻类中无机元素含量
Table 5 Inorganic elements contents in three large brown algae and some other algae
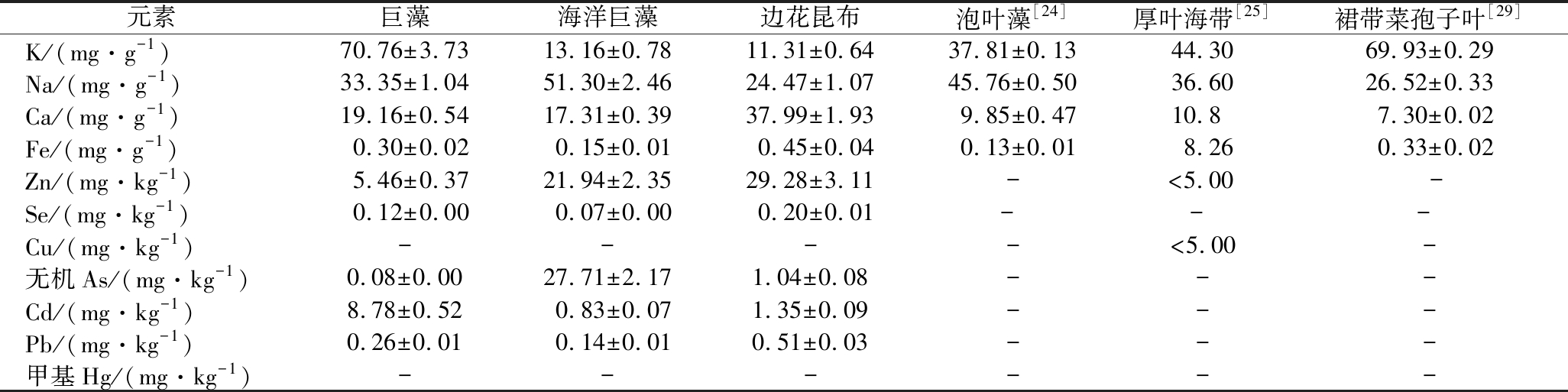
元素巨藻海洋巨藻边花昆布泡叶藻[24]厚叶海带[25]裙带菜孢子叶[29]K/(mg·g-1)70.76±3.7313.16±0.7811.31±0.6437.81±0.1344.3069.93±0.29Na/(mg·g-1)33.35±1.0451.30±2.4624.47±1.0745.76±0.5036.6026.52±0.33Ca/(mg·g-1)19.16±0.5417.31±0.3937.99±1.939.85±0.4710.87.30±0.02Fe/(mg·g-1)0.30±0.020.15±0.010.45±0.040.13±0.018.260.33±0.02Zn/(mg·kg-1)5.46±0.3721.94±2.3529.28±3.11-<5.00-Se/(mg·kg-1)0.12±0.000.07±0.000.20±0.01- - - Cu/(mg·kg-1)----<5.00-无机As/(mg·kg-1)0.08±0.0027.71±2.171.04±0.08---Cd/(mg·kg-1)8.78±0.520.83±0.071.35±0.09---Pb/(mg·kg-1)0.26±0.010.14±0.010.51±0.03---甲基Hg/(mg·kg-1)------
注:*表示未检出
2.5 碘胶醇含量
由表6可知,海洋巨藻中,褐藻胶质量分数高达52.20%,远高于鼠尾藻[30] 和海带[31],是非常理想的生产褐藻胶的原料,后续可加强此方面的研究。巨藻和边花昆布中碘和甘露醇含量相对丰富,高于海洋巨藻、鼠尾藻,低于海带;褐藻胶含量高于鼠尾藻和海带,在海藻化工方面也有较大的应用潜力。
表6 三种大型褐藻与其他几种海藻碘胶醇含量比较
Table 6 Iodine, alginate and mannitol contents in three large brown algae and some other algae
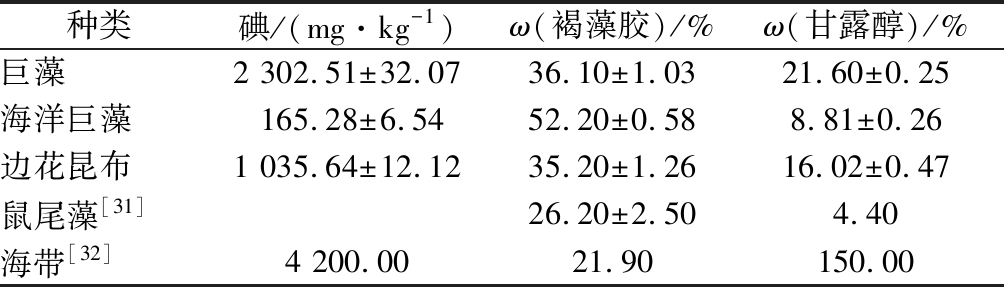
种类碘/(mg·kg-1)ω(褐藻胶)/%ω(甘露醇)/%巨藻2 302.51±32.0736.10±1.0321.60±0.25海洋巨藻165.28±6.5452.20±0.588.81±0.26边花昆布1 035.64±12.1235.20±1.2616.02±0.47鼠尾藻[31]26.20±2.504.40海带[32]4 200.0021.90150.00
3 结论
巨藻是一种高碳水化合物、低脂肪的大型褐藻,其粗蛋白质量分数12.74%,18种氨基酸中EAA/TAA为35.83%,DAA/TAA高达40.15%,海藻风味浓郁,氨基酸评分93.15分,氨基酸组成较为均衡合理;脂肪酸成分含量SFA>MUFA> PUFA;灰分含量高,K、Na、Ca、Fe和Zn等无机元素含量丰富;碘胶醇含量较高,是优质的海藻化工原料。
海洋巨藻碳水化合物质量分数高达70.96%,可溶性膳食纤维质量分数高达34.53%,是开发减肥、降血糖等功能食品和提取可溶性膳食纤维的理想原料;粗蛋白质量分数相对较低,EAA/TAA为37.07%,其氨基酸平均分71.72分,氨基酸营养不够均衡;脂肪酸成分含量SFA>PUFA>MUFA;灰分含量较高,K、Na、Ca和Zn等无机元素含量丰富;褐藻胶质量分数高达52.20%,是非常理想的褐藻胶提取原料,未来应当加强对海洋巨藻提取褐藻胶的应用研究。
边花昆布碳水化合物质量分数高达65.95%,不溶性膳食纤维质量分数47.64%,可以作为良好的膳食纤维源和强化膳食纤维配方食品原料;粗蛋白质量分数12.50%,18种氨基酸EAA/TAA为37.08%,氨基酸评分111.95分,EAAI为74.42,氨基酸组成均衡合理;脂肪酸组成SFA>MUFA> PUFA;无机元素中Ca含量突出,是良好的补钙食物来源,K、Na、Fe、Zn和Se等元素含量也十分丰富;碘胶醇含量均较高,在海藻化工行业有较大应用潜力。
[1] ALMANAZA V,BUSCHMANN A H,HERNARDEZ—GONZALEZ M C,et al.Can giant kelp (Macrocystis pyrifera) forests enhance invertebrate recruitment in southern Chile? [J].Marine Biology Research, 2012, 8(9): 855-864.
[2] 魏玉西,张虹,牛锡珍. 巨藻生产褐藻胶工艺改进方法的探讨[J]. 海洋科学,2002,26(6):10-12.
[3] ORTIZ J, UQUICHE E, ROBERT P, et al. Functional and nutritional value of the Chilean seaweeds Codium fragile, Gracilaria chilensis and Macrocystis pyrifera[J]. European Journal of Lipid Science and Technology, 2009, 111(4):320-327.
[4] FRASER C I, WINTER D J, SPENCER H G, et al. Multigene phylogeny of the southern bull-kelp genus Durvillaea (Phaeophyceae: Fucales)[J]. Molecular Phylogenetics and Evolution, 2010, 57(3): 1 301-1 311.
[5] MATHEICKAL J T, YU Q M, WOODBURN G M. Biosorption of cadmium(II) from aqueous solutions by pre-treated biomass of marine alga DurvillAaa potatorum[J]. Water Research, 1999, 33(2):335-342.
[6] 马卫东, 顾国维,Qinming Yu.海洋巨藻生物吸附剂对Hg2+吸附性能的研究[J].上海环境科学,2001,20(10):489-494;509.
[7] MATTNER S W, MILINKOVIC M, ARIOLI T. Increased growth response of strawberry roots to a commercial extract from Durvillaea potatorum and Ascophyllum nodosum[J]. Journal of Applied Phycology, 2018, 30(5):2 943-2 951.
[8] MATTNER S W, WITE D, RICHES D A, et al. The effect of kelp extract on seedling establishment of broccoli on contrasting soil types in southern Victoria, Australia [J]. Biological Agriculture & Horticulture, 2013, 29(4):258-270.
[9] LORBEER A J, CHAROENSIDDHI S, LAHNSTEIN J, et al. Sequential extraction and characterization of fucoidans and alginates from Ecklonia radiata, Macrocystis pyrifera, Durvillaea potatorum, and Seirococcus axillaris[J]. Journal of Applied Phycology, 2017, 29(3): 1 515-1 526.
[10] VIRTUE P, NICHOLS P D. Lipids from the bull kelp Durvillaea potatorump[J]. Phytochemistry, 1994, 37(3):673-676.
[11] SKRZYPCZYK V M, HERMON K M, NORAMBUENA F, et al. Is Australian seaweed worth eating? Nutritional and sensorial properties of wild-harvested Australian versus commercially available seaweeds [J]. Journal of Applied Phycology, 2019, 31(1):709-724.
[12] DOLMAN G, COLEMAN M A. Characterisation of microsatellite loci in the habitat-forming kelp, Ecklonia radiata (Phaeophyceae, Laminariales)[J]. Conservation Genetics, 2009, 10(3):657-660.
[13] BLAIN C O, SHEARS N T. Seasonal and spatial variation in photosynthetic response of the kelp Ecklonia radiata across a turbidity gradient [J]. Photosynthesis Research, 2019, 140(1):21-38.
[14] YOUNG M, IERODIACONOU D, WOMERSLEY T. Forests of the sea: Predictive habitat modeling to assess the abundance of canopy forming kelp forests on temperate reefs [J]. Remote Sensing of Environment, 2015, 170:178-187.
[15] CHAROENSIDDHI S, CONLON M A, METHACANON P, et al. Polysaccharide and phlorotannin-enriched extracts of the brown seaweed Ecklonia radiata influence human gut microbiota and fermentation in vitro[J]. Journal of Applied Phycology, 2017, 29(5):2 407-2 416.
[16] CHAROENSIDDHI S, LORBEER A J, LAHNSTEIN J, et al. Enzyme-assisted extraction of carbohydrates from the brown alga Ecklonia radiata: Effect of enzyme type, pH and buffer on sugar yield and molecular weight profiles [J]. Process Biochemistry, 2016, 51(10):1 503-1 510.
[17] CHAROENSIDDHI S, FRANCO C, SU P, et al. Improved antioxidant activities of brown seaweed Ecklonia radiata extracts prepared by microwave-assisted enzymatic extraction [J]. Journal of Applied Phycology, 2015, 27(5): 2 049-2 058.
[18] CHAROENSIDDHI S, LORBEER A J, FRANCO C M M, et al. Process and economic feasibility for the production of functional food from the brown alga, Ecklonia radiata[J]. Algal Research, 2018, 29:80-91.
[19] STEWART C M, HIGGINS H G, AUSTIN S. Seasonal variation in alginic acid, mannitol, laminarin and fucoidin in the brown alga, Ecklonia radiata[J]. Nature, 1961, 192(480):1 208.
[20] 尚德荣,宁劲松,赵艳芳,等. 海带中褐藻胶含量测定方法的建立[J]. 食品科技, 2011,36(8):252-254.
[21] PELLETT P L, YONG V R. Nutritional evaluation of protein foods [M]. Tokyo: The United National University, 1980: 26-29.
[22] 桥本芳郎.养鱼饲料学[M]. 蔡完其,译.北京: 中国农业出版社, 1980:114-115.
[23] 宋超, 庄平, 章龙珍, 等.野生及人工养殖中华鲟幼鱼肌肉营养成分的比较[J]. 动物学报, 2007, 53(3): 502-510.
[24] LORENZO J, AGREGAN R, PAULO M, et al. Proximate composition and nutritional value of three macroalgae: Ascophyllum nodosum, Fucus vesiculosus and Bifurcaria bifurcata[J]. Marine Drugs, 2017, 15(11):360-371.
[25] 姚海芹,王飞久,刘福利,等. 食用海带品系营养成分分析与评价[J]. 食品科学, 2016, 37(12):95-98.
[26] 卢虹玉, 杨小青, 谢恩义,等. 全缘马尾藻的主要营养成分分析与评价[J]. 食品研究与开发, 2013,34(7):120-122.
[27] FAO/WHO/UNU Expert Consultation. Protein and amino acids requirements in human nutrition[M]. FAO/WHO/UNU: Rome, Italy, 2007: 135-159.
[28] 李红艳, 王颖, 刘天红, 等. 裙带菜孢子叶营养成分分析及品质评价[J]. 南方农业学报, 2018, 49(9): 1 821-1 826.
[29] 李继伟,杨贤庆,潘创,等. 琼枝麒麟菜营养成分分析与评价[J]. 食品与发酵工业,2020,46(15):265-269.
[30] 张晓梅, 郭芮, 苏红, 等. 羊栖菜营养成分分析与安全性评价[J]. 食品工业科技, 2018,39(4): 296-300;311.
[31] 王萍,张银波,江木兰. 多不饱和脂肪酸的研究进展[J]. 中国油脂, 2008,33 (12):42-46.
[32] 詹冬梅,王翔宇,辛美丽,等. 三种马尾藻的营养组成分析[J]. 广西科学院学报,2016,32(3):221-225.
[33] 盛晓风,赵艳芳,尚德荣,等.海带不同生长时期营养成分和主要元素差异比较[J]. 食品科技, 2011, 36(12):66-68.