铁是生物体内不可或缺的元素,是许多酶发挥作用的辅助因子,参与体内氧气运输、电子传递、DNA合成以及细胞生长、分化等过程。缺铁可引起缺铁性贫血(iron deficiency anemia,IDA),降低体内多种含铁酶的活性,抑制T淋巴细胞功能,影响细胞代谢及机体生物氧化、组织呼吸等多种生理过程,使机体免疫功能受损,从而引发一系列并发症;而机体铁超载时,可导致体内氧自由基的产生,引起组织的氧化损伤或铁质沉着,也可导致肠道需铁致病菌增多,肠道菌群失衡[1]。通过膳食途径摄入的铁不能满足需求,是导致机体铁缺乏的主要因素,除此之外,慢性丙型肝炎、血色病等也可引起机体铁稳态失衡[2]。
缺铁主要会引起IDA以及相关伴随的诸多并发症。相比于其他年龄段人群,妊娠期妇女和儿童更容易患IDA。流行病学调查资料显示,中国华东和东北地区孕妇铁缺乏的标准化患病率高达57.37%和53.41%,而对全国儿童的调查显示,其铁缺乏症(iron deficiency, ID)发病率高达40.3%,IDA的发病率为7.8%[3-4]。缺铁不仅可导致IDA,也可导致免疫功能缺陷或下降[5]。铁缺乏不仅影响宿主的免疫系统和一系列维持生命的关键生化过程,而且会改变肠道菌群的定植模式及宿主对感染的敏感性,对宿主免疫系统功能产生影响[6]。摄入富含铁的食物(肉类、豆类等)可以提高机体铁水平,但不足以治疗IDA,口服补铁剂依然是目前铁缺乏及相关疾病的主要干预方式。本文综述了机体铁稳态和缺铁对肠道菌群、免疫的影响,以及新型补铁剂的开发,为缺铁相关疾病的预防和膳食干预提供了方向。
1 机体铁稳态调控
维持机体铁稳态平衡,即铁的摄取、转运、释放及贮存等过程,主要通过肠道调控铁的吸收实现(图1)[7]。
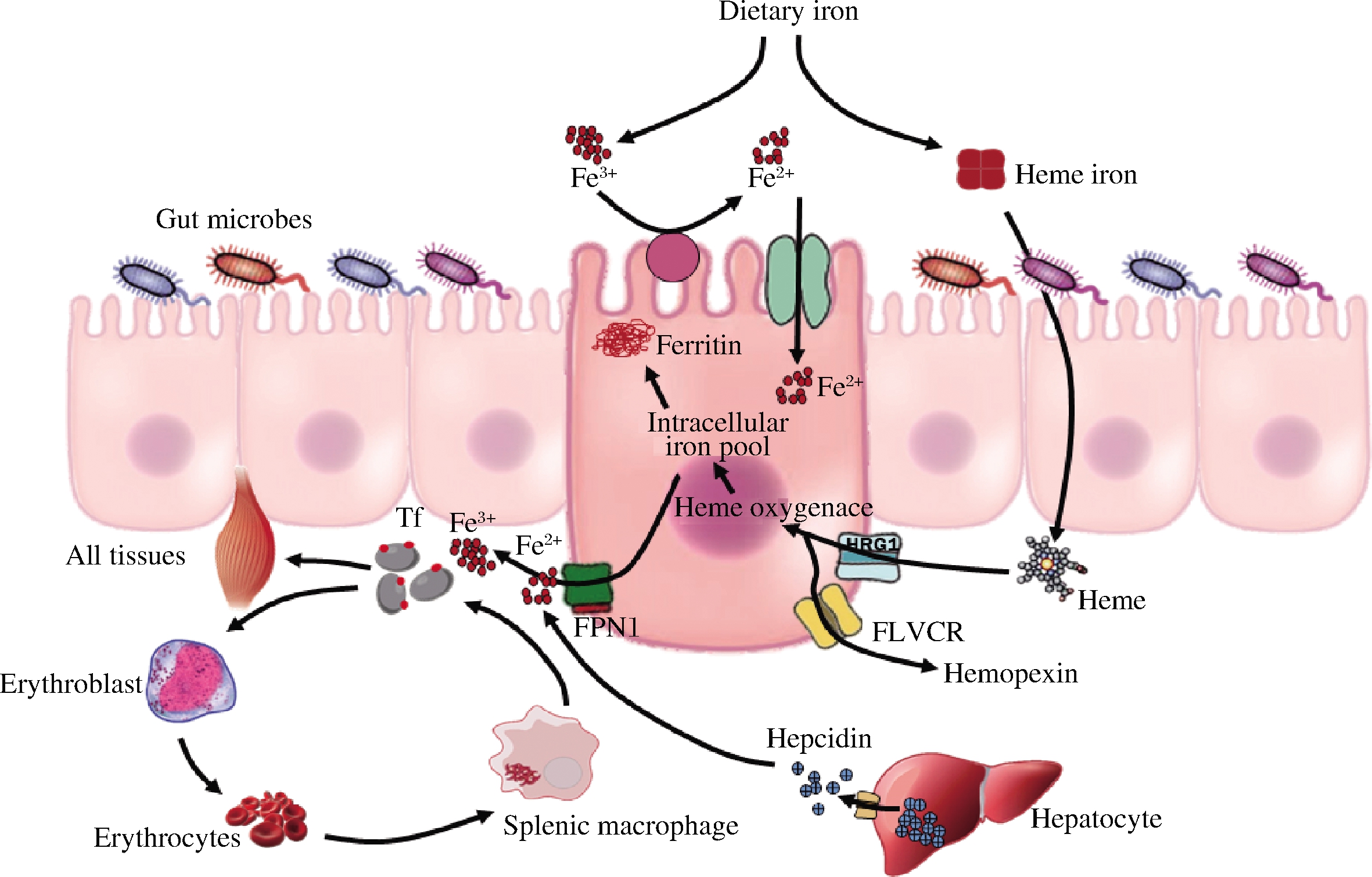
图1 机体铁稳态调控示意图
Fig.1 Regulation of systemic iron homeostasis
肠道铁吸收形式包括血红素铁和非血红素铁(>85%)2种,主要通过十二指肠部位吸收约15%的铁,剩余未吸收的铁运输到结肠,由肠道微生物摄取利用。血红素铁能以完整形式进入肠上皮细胞。首先,在肠道酶的作用下,血红蛋白降解为球蛋白和血红素,血红素以完整金属卟啉形式被肠黏膜上皮细胞摄取,经胞浆血红素氧化酶作用打开卟啉环,释放出游离的Fe(II),随后基底外侧转铁蛋白(circulating diferric Tf,Tf-Fe2)将胞质中的铁转出到非血红素铁池中,参与细胞内铁的代谢释放;非血红素铁通过二价金属转运蛋白1(divalent metal-ion transporter-1,DMT1)在十二指肠肠上皮的刷状缘被吸收,由于非血红素铁主要为氧化态Fe(III),因此必须首先通过与膜相关的铁还原酶(duodenal cytochrome B, DcytB),将Fe(III)还原成Fe(II),再由DMT1转入胞内[8]。
体内大部分的铁在骨髓中被消耗,其主要用于合成红细胞。血红蛋白的合成期间,细胞表达转铁蛋白受体(transferin receptor 1,TfR1)加速铁的吸收,因此TfR1水平与细胞铁需求量之间存在相关性。最近有研究发现,TfR2可能参与了线粒体铁传递过程[9],随后线粒体血红蛋白输出进入细胞浆,并与核糖体上形成的珠蛋白链结合产生血红蛋白,用于网状细胞合成。随着重复的细胞分裂,细胞核及RNA浓缩并最终丢失,网状细胞成熟为红细胞。脾巨噬细胞识别并吞噬衰老的红细胞,接着通过水解酶和活性氧降解以释放血红蛋白[10]。
血浆铁对铁调素具有反馈调节作用,以维持血浆铁浓度的相对稳定。有研究表明,人肝组织中铁调蛋白mRNA与铁存储之间以及血清铁蛋白和血清铁调素之间存在相关性[11],该结果证明人体铁储存系统可以独立于血浆铁浓度的短期影响而调节铁调素。直到最近才获得了组织铁储存和血浆铁浓度对铁调素双重调控的实验证据[12]。机体铁水平升高时,会促使肝脏加速表达铁调素,从而促使膜铁转运蛋白(ferroportin,FPN)降解,阻断铁从肠黏膜细胞转运到血浆中,因而血浆中的铁浓度降低;持续的高铁摄入可能导致脂质过氧化反应发生并影响胰岛素分泌和功能[13]。当机体铁缺乏时,体内多种含铁酶的活性降低,T淋巴细胞功能受到抑制,影响机体生物氧化、组织呼吸、神经介质的分解及合成等过程,从而降低机体免疫力,此时机体会抑制铁调素的表达,FPN将肠上皮细胞中的铁转运至血浆转运蛋白,通过血液循环运送到其他组织,使机体免疫恢复[14]。
此外,肠道微生物具有高效的铁摄取机制,会与肠黏膜上皮细胞竞争铁,对机体的铁吸收产生影响。在消化道的近端和远端,微生物定植导致铁摄取相关蛋白的减少,参与细胞内铁存储和铁输出蛋白的增加。微生物与上皮细胞之间的铁竞争会导致宿主消化道中铁代谢发生快速的适应性反应,即表现为出生时铁吸收高,断奶后铁减少,甚至在成年动物中,微生物也会改变铁相关蛋白的水平[15]。有研究表明,无菌小鼠的肠道DcytB和DMT1表达比普通小鼠增加了10倍,铁转运蛋白表达减少了2倍[16],表明肠道微生物可直接影响机体铁吸收转运过程。在肠道微生物存在的情况下,肠细胞具有适应分配和储存铁的能力,即在没有肠道微生物的情况下,肠细胞显示出非常低的铁储备,并且向人体的运输减少;然而,在肠道微生物的存在下,肠细胞获得了相当大的铁存储能力(以铁蛋白的形式),并通过增加铁蛋白的表达而促进其向身体的运输。微生物会通过代谢物信号传导途径调控系统铁稳态平衡。有研究发现,肠道菌群代谢产物(1,3-二氨基丙烷和罗伊氏素)可以通过抑制转录因子(hypoxia inducible factor-2, HIF-2α)的表达,导致肠道铁吸收降低[17]。因此,平衡宿主和肠道菌群对铁的需求,对维持机体整体健康具有重要意义,但目前未发现相关研究报道。
2 缺铁对机体免疫功能的影响
铁对机体免疫系统功能起着重要作用,其广泛参与特异性免疫系统(如免疫活性细胞及其细胞因子)以及非特异性免疫系统(如吞噬细胞补体系统等)功能调控[5]。在整个三羧酸循环中,铁缺乏会直接导致铁依赖酶活性降低,含铁酶无法合成,从而导致细胞色素含量及核糖核酸酶活性降低,DNA和蛋白质等生物大分子合成受阻,进一步影响机体细胞能量代谢及细胞免疫功能[18]。
缺铁会使机体T淋巴细胞数量发生改变,特别是CD4+Th1亚群的数量。IDA患儿的Th细胞成熟受到损害,补充铁后Th细胞得到恢复[19]。由于Th2细胞中铁的存储量及变动范围更大,使得Th2细胞对铁螯合剂和免疫球蛋白G抗转铁蛋白受体抗体的抵抗力更强,故缺铁对Th1淋巴细胞的影响比对Th2淋巴细胞的影响更大。这与铁缺乏的儿童和青少年中过敏症的患病率较高[20]的现象一致。余敏等[21]对IDA老年患者的研究表明,缺铁导致其T淋巴细胞亚群发生紊乱,致使细胞免疫功能降低,同时表现出血清铁调素水平下降,铁稳态失衡等现象,但对体液免疫影响相对较小。细胞内铁水平和表观遗传程序之间的联系表现为在细胞周期调节因子Cyclin E1的启动子区H3K9去甲基化水平上控制B细胞的激活、增殖和抗体反应,铁缺乏使抗原特异性抗体反应显著减弱[22]。
在单核巨噬细胞系统中,可通过调节铁代谢相关基因和蛋白的表达控制铁的摄取、储存和释放等过程[23]。细胞内铁稳态水平可调节巨噬细胞向M1(促炎性)和M2(抗炎,促组织愈合)巨噬细胞的分化,而低铁状态则促进M1巨噬细胞和Th1免疫应答的发展。关于人类巨噬细胞激活的铁依赖性免疫代谢的研究表明,急性降低巨噬细胞中的铁水平可重新编码其转录和代谢反应,通过ATF4增强糖酵解调控的基因并阻断线粒体的氧化磷酸化作用(通过降低含Fe-S的呼吸链酶NDUFS6和SDHB的活性),最终在巨噬细胞依赖的小鼠肾脏自身免疫模型中导致细胞增殖受损、促炎性细胞因子的产生减少和肾炎严重程度降低[24]。因此调控机体铁稳态对维持机体免疫至关重要,肠道菌群与免疫研究及在免疫相关疾病治疗中的应用具有广阔的前景,已成为免疫研究的新兴方向,近年来,铁稳态对肠道免疫影响方面的研究也逐渐受到人们的关注。
3 缺铁对肠道菌群及肠道免疫的影响
肠道免疫是机体抵御入侵的首道防线,肠道内分布了人体高达2/3的免疫系统。多种因素能够影响肠道通透性,如氧化应激、炎症和病原菌感染等。肠道微生物可在宿主的细胞间起到信息交流、贮藏、消耗和重新分配能量、化学代谢与转换等一系列作用。有害细菌入侵肠道导致炎症,免疫细胞调节紊乱,当肠道免疫细胞功能降低时,肠道上皮屏障防御功能会显著下降。肠道铁稳态失衡对肠道菌群的组成、丰度均有重要的影响。
铁缺乏显著影响肠道菌群的平衡和多样性[25]。当膳食摄入的铁含量差异较大时,小鼠肠道菌群的α多样性、β多样性和LEfSe分析表现出显著性差异,该结果表明肠道菌群平衡受到机体铁稳态的影响,铁稳态的改变会导致肠道菌群组成产生明显改变[26]。另外,不同组间小鼠肠道菌群除了相对丰度不同,还有肠道菌群代谢通路和功能的变化,也会导致肠道菌群多样性改变,而机体铁水平间的差异是导致该变化的重要因素[27]。
由于不同细菌对铁的依赖性不同,因而铁可以对肠道中的微生物多样性和潜在致病性产生重大影响[28]。一些益生菌的生长和繁殖并不严格依赖铁,易于在缺铁或低铁环境中生长,而致病菌几乎都要依赖铁才能大量繁殖[29]。植物乳杆菌是第1个被鉴定为非铁依赖性的微生物菌株,被认为是有益的肠道屏障维持菌,在抑制肠道病原体的黏膜定植中发挥重要作用[30]。对于其他细菌来说,铁的获取是关键毒力因子表达的重要步骤,包括肠道杆菌科的革兰氏阴性肠致病菌,如沙门氏菌、志贺氏菌和大肠杆菌等致病菌[31]。在低铁环境中,潜在的肠道致病细菌会减少,并且双歧杆菌和乳杆菌等细菌直接与大肠杆菌竞争资源。有研究关于缺铁对猪结肠微生物群发育过程的影响,发现缺铁猪中大肠杆菌和志贺氏菌的丰度更高,潜在致病菌(如类杆菌和梭状芽孢杆菌)的相对丰度较低,而有益菌(如双歧杆菌和乳杆菌)增多,在饮食中适量补充铁后,肠道菌群恢复正常水平[32]。因此,肠道中未吸收的膳食铁可能作为一类“抑生元”,促进条件致病菌而非有益菌种的生长,改变肠道菌群的组成。肠道未吸收铁浓度的提高是否影响肠黏膜微生物、化学及机械屏障,损伤肠道免疫功能,目前尚未充分阐明。
肠道免疫通过生物转化、防御反应等作用维持肠道菌群的相对稳定,肠道菌群失调将导致肠道免疫受到破坏,使得肠道免疫与肠道菌群相互促进。肠道微生物可以通过产生代谢产物,对肠黏膜产生有利影响,促进肠道屏障功能的成熟与完整。例如肠黏膜上的益生菌可以通过代谢产生乳酸、乙酸等产物,降低局部的pH,从而抑制外源性致病菌对宿主的侵染。专性厌氧菌(如双歧杆菌)会通过在肠上皮细胞表面形成菌膜屏障,从而控制外源性致病菌[33]。另一方面,肠道淋巴细胞是维持机体炎症反应与免疫耐受之间平衡的关键因素。肠道微生物在调节早期B淋巴细胞的发育和诱导T淋巴细胞的分化中起到重要作用[34]。有研究表明,肠道T、B淋巴细胞的分化和功能及细胞因子的产生受肠道菌群组成的影响;肠道微生物还参与调节宿主适应性免疫和先天免疫,当有致病因子入侵宿主时,立即激活免疫系统,启动炎症反应杀死致病因子。因此,缺铁可以引起肠道菌群平衡和多样性发生变化,进而对肠道菌群介导的肠道免疫产生潜在的影响。肠道菌群的免疫作用越来越被人们所重视,并在许多肠道疾病发展及治疗上取得了重要的研究成果。但目前关于缺铁对肠道免疫造成的直接影响研究还不全面,有研究表明缺铁引起的肠道菌群结构失衡会造成肠上皮通透性增加[26],但肠道菌群的数量变化对肠上皮通透性的影响仍有待研究。
4 新型补铁剂的开发
目前补铁剂已发展了3代,第1代补铁剂是以硫酸亚铁为主的无机铁盐;第2代为可溶性的小分子有机酸铁盐螯合物,如琥珀酸亚铁、富马酸亚铁、甘氨酸亚铁等[35]。除此之外,近年来一些新型大分子复合物如多肽铁螯合物、血红素铁、多糖铁、富铁酵母等相继被报道,补铁剂的种类和特点如表1所示。
表1 补铁剂的种类和特点
Table 1 Types and characteristics of iron supplements

特征第一代补铁剂第二代补铁剂新型补铁剂无机铁盐小分子有机酸铁盐氨基酸铁血红素铁多肽铁螯合物 多糖铁富铁酵母纳米材料补铁剂范例FeSO4、FeCO3、FeCl2、焦磷酸铁、焦磷酸亚铁、焦磷酸铁钠、磷酸铁钠等琥珀酸亚铁、富马酸亚铁、葡萄糖酸亚铁、乳酸亚铁、甘氨酸亚铁、乙二胺四乙酸铁钠、次氮基三乙酸螯合铁等甘氨酸亚铁螯合物、蛋氨酸亚铁螯合物、复合氨基酸亚铁螯合物等带鱼水解肽螯合铁、米渣水解蛋白肽铁等高/低分子右旋糖酐铁、蔗糖铁、葡萄糖酸钠铁、羧基麦芽糖铁、异麦芽糖酐铁等磷酸铁纳米颗粒、氢氧化己二酸铁酒石酸盐纳米颗粒等铁结合形式离子作用离子作用+配位作用配位作用配位作用配位作用配位作用酵母吸收离子作用铁吸收形式铁离子铁离子分子血红素铁分子分子铁离子优点成本低吸收率提高,胃肠道副作用较无机铁盐减小吸收率提高,无饮食禁忌生物铁,利用率高、不刺激肠胃,毒性低生物利用率较高、抗氧化、抑菌、免疫调节[36-38]静脉注射:铁的损失少,见效快;口服:吸收率较高, 胃肠道副作用小生物利用率高,不良反应少、补充其他营养因子[39]在血液中缓释,可控制非转铁蛋白结合铁的增加,利用率高[35]缺点铁腥味,生物利用度低,饮食禁忌,游离铁毒性,治疗周期长,恶心、呕吐、腹部不适等不良反应[35]铁腥味,饮食禁忌,胃肠道副作用,游离铁毒性,治疗周期长[35]纯度差,成本高,有游离铁存在,治疗周期长[40]用药成本高,纯度差,治疗周期长[40]成本高成本高,给药剂量必须严格控制,氧化应激和其他毒性反应,安全性有效性不确定[41]成本高成本高,毒性仍有待研究[35]
4.1 多肽铁螯合物
多肽铁螯合物可通过肽转运体系被机体吸收,直接进入血液循环系统。因为可从豆类、米渣、水产品等食品原料中提取多肽进行螯合,故相较于氨基酸螯合铁,多肽螯合铁具有更高的安全性和应用价值[35]。
多肽螯合物中的多肽与铁是通过共价键的作用进行螯合的,其中肽链中的羰基和氨基会形成五元环或六元环,因此产物性质稳定。汪婧瑜等[42]制备乌鳢短肽螯合铁,发现产物形成前后紫外、红外吸收光谱发生明显偏振,肽-铁之间形成螯合连接,表明多肽中的羧基和氨基等基团参与了螯合反应。使用电子显微镜对乌鳢短肽与铁螯合前后的微观结构进行表征,实验结果发现短肽与Fe2+之间有吸附作用,所形成的螯合物结构紧密。
多肽铁螯合物具有一定的抗氧化活性和较高的生物利用度。廉雯蕾[38]制备了米渣水解蛋白肽螯合物,发现与FeSO4相比,其溶解度和透过率都较高。无机铁盐会受到胃肠道中不同pH环境的影响,容易造成不良反应。而多肽铁螯合物可对离子体系起缓冲作用,减小不良反应的刺激,更好地促进胃肠道对铁的吸收。LIN等[36]用小鼠模型研究了带鱼肽-铁螯合物的抗贫血活性,发现分别饲喂了带鱼肽-铁螯合物和FeSO4的小鼠与健康小鼠在血红蛋白、平均红细胞体积、血红蛋白分布宽度和铁蛋白浓度方面存在显著差异,并且带鱼肽-铁螯合物对小鼠的生长和行为无负面影响,在肠道免疫方面表现出肠黏膜固有层无明显炎症反应,肠道菌群组成、数量良好。
然而,消化道中的pH不同,多肽铁螯合物的在不同部位的稳定性容易受到影响。廉雯蕾[38]的研究表明米蛋白肽亚铁螯合物受胃低pH环境的影响比FeSO4大。原因可能在于该肽铁螯合物的制备环境是pH 6.5,在消化初期,米蛋白多肽受pH 2.0的酸性环境影响,发生了较大程度的水解,致使多肽螯合物的结构被破坏。多肽铁螯合物研究开发中存在问题,如多肽铁螯合物的肽序列特征尚未明确,制约了此类产品的规模化开发。此外,多肽铁螯合物的制备成本更高,因此未得到广泛开发和应用。
4.2 多糖铁
多糖铁的制备原料包括枸杞、当归、黄芪等,经分离纯化得到植物多糖后与铁进行螯合即可制得多糖铁。多糖铁通常无异味,颜色为棕黑色,易溶于水。多糖铁具有静脉注射和口服2种给药方式,能以分子的形式被机体吸收,且对肠道黏膜的毒副作用较小,兼具补铁和营养补充双重功效[35]。
多糖铁具有良好的补血和抗氧化功效。刘文霞[43]研究发现多糖铁复合物可有效治疗IDA,并影响血清转铁蛋白及其受体。XU等[44]制备的灰树花多糖铁复合物可促使淋巴细胞增殖,提高机体免疫水平,具有一定的抗氧化能力,李世映等[45]制备的酸枣多糖铁复合物也具有相似功效。CHEN等[46]研究了大蒜多糖-Fe(III)配合物对![]() 和脂质过氧化的清除能力,结果表明,大蒜多糖-Fe(III)配合物对
和脂质过氧化的清除能力,结果表明,大蒜多糖-Fe(III)配合物对![]() 具有较强的清除能力,且对脂质过氧化反应的抑制作用随着浓度的增大而增大。
具有较强的清除能力,且对脂质过氧化反应的抑制作用随着浓度的增大而增大。
不同来源的多糖可以赋予多糖铁不同的化学性质和生物学活性,但目前针对多糖铁的相关研究尚不多见,多糖铁调控肠道菌群的研究尤为不足。多糖的消化性能不同,分别由易消化多糖和抗消化多糖螯合制备的多糖铁,其口服吸收动力学与机制必然存在差异。抗消化的多糖铁进入肠道,可能面临多糖作为益生元,而铁作为“抑生元”的矛盾,其对肠道健康及肠道免疫的调控作用值得深入研究。
4.3 富铁酵母
富铁酵母的制备工艺是使用FeSO4等无机铁盐培养经筛选过的酵母菌,培养后升温使酵母菌破裂,将酵母释放物质进行干燥制得富铁酵母。无机铁经酵母繁殖过程可被转化为有机形式,使得铁更容易被机体吸收富铁酵母作为一种良好的预防和治疗IDA的新型补铁剂在补铁的同时还可补充维生素、蛋白质等营养成分,具有营养和补铁双重功效[39]。
有研究表明,富铁面包酵母可以提高贫血小鼠的红细胞和血红蛋白水平,并能够减轻贫血对机体各器官所造成的损伤[47]。富铁酵母和人体中的铁存在形式相似,因此富铁酵母不存在游离铁离子富集所产生的铁毒性。研究显示,相较于FeSO4和氨基酸螯合铁,富铁酵母具有更高的生物利用度。耿倩[39]使用基因敲除方法筛选出胞内铁离子富集量最大可达26.59 mg/g干菌的富铁菌株,贫血小鼠服用该菌后红细胞计数和血红蛋白含量明显增加,表现出了良好的治疗IDA的效果。同样,关于富铁酵母对肠道菌群及肠道免疫的影响也尚未明确。
4.4 纳米型补铁剂
纳米型补铁剂具有粒径微小、易于被机体吸收转化的特点,表现出了新型补铁剂的潜在优势。在机体摄入铁的过程中,会出现铁毒性和生物利用率不高等问题,为了克服该问题,机体进化出可高效利用且无毒的铁储存形式,即铁蛋白储存。PEREIRA等[48]研制出了氢氧化己二酸铁酒石酸盐纳米颗粒(iron hydroxide adipate tartrate,IHAT),该补铁剂的新颖之处在于其吸收机制与铁蛋白相似,无需被溶解,可以通过内吞作用将纳米颗粒以整体形式吸收,接着借助溶酶体或核内体将铁释放出来。IHAT的补铁效果优于FeSO4,更有利于肠道健康。IHAT可以在血液中缓释,可控制非转铁蛋白结合铁的增加,且对肠上皮细胞无毒,具有成为新型口服补铁剂的潜在优势。然而,IHAT是否会对肠道菌群造成不利影响,其特有的吸收机制是否能减少肠道病原体对铁的摄取,降低肠道炎症和发病率等还有待深入研究。
纳米型补铁剂具有较高的生物利用度,可调节机体免疫。WANG等[49]制备了黄芪多糖包埋Fe3O4纳米颗粒,并证明其是一种有效的IDA体内治疗药物,该颗粒具有良好的水溶性和稳定性,特别是在模拟消化方面;大鼠病理实验和细胞毒性评估表明,该纳米颗粒具有较高的生物相容性和较低的细胞毒性,可有效治疗IDA。黄芪多糖包埋Fe3O4纳米颗粒表面有一定数量的黄芪多糖作为保护壳,可减少Fe3O4对胃肠道的刺激,副作用小。GU等[50]的研究证明,氧化铁纳米颗粒可调节干扰素调节因子5(interferon regulatory factor 5, IRF-5)信号传导途径,增强抗肿瘤M1巨噬细胞极化,同时下调M2相关精氨酸酶-1,IRF-5通路负责M1表型分化,有利于细胞毒性T淋巴细胞激活的抗肿瘤活性。纳米型补铁剂的安全性已得到初步证实,未引起不良反应,但仍需更深入的分析。
5 小结与展望
铁稳态对维持机体免疫系统功能正常具有重要作用,其广泛参与如免疫活性细胞及其细胞因子特异性免疫系统,以及吞噬细胞补体系统等非特异性免疫系统的功能调控。此外,铁可能作为一类“抑生元”,促进致病菌的生长,竞争性抑制有益菌的增殖。缺铁导致淋巴细胞功能受损,淋巴细胞数量和增殖应答能力显著下降,影响单核细胞和巨噬细胞的增殖分化以及细胞因子的活性。另一方面,缺铁改变了肠道菌群的定植模式以及宿主对感染的敏感性,削弱了肠道黏膜屏障功能,可能对肠道免疫造成一定的影响。
目前应用的补铁剂大部分是无机铁盐和小分子有机酸铁盐螯合物,但均有铁腥味,且会造成上消化道糜烂性黏膜损伤及恶心、呕吐、上腹不适、腹泻、便秘等不良反应。新型的补铁剂如多肽铁螯合物、血红素铁、多糖铁、富铁酵母等弥补了传统补铁剂的一些不足,在展现出较高生物利用度的同时减少了副作用,但是目前大多数处于基础理论研究阶段,在提高产品螯合率、安全性,降低产品成本等方面有待进一步研究。此外,值得注意的是,铁在免疫调节和肠道微生物调控起了重要作用。着眼于宿主、肠道菌群的整体平衡,补铁同时能维持肠道菌群平衡的补铁剂或将是新型补铁剂的开发方向。
[1] GANZ T. Iron and infection[J]. International Journal of Hematology, 2018, 107(1): 7-15.
[2] 张陆阳, 张丹凤, 潘崚. 铁代谢调节及其相关疾病[J]. 国际输血及血液学杂志 2017, 40(1): 67-71.
[3] 赵惠君. 关注儿童铁缺乏症的有效防治[J]. 临床儿科杂志, 2015, 33(5): 405-407.
[4] 李明明. 大连市1 562例孕妇中铁缺乏及缺铁性贫血患病率的调查研究[D].大连: 大连医科大学, 2019.
[5] HASSAN T H, BADR M A, KARAM N A, et al. Impact of iron deficiency anemia on the function of the immune system in children[J]. Medicine, 2016, 95(47): e5 395.
[6] NAIRZ M, SCHROLL A, SONNWEBER T, et al. The struggle for iron-a metal at the host-pathogen interface[J]. Cellular Microbiology, 2010, 12(12): 1 691-1 702.
[7] 王佳明, 安鹏, 王浩等. 铁稳态代谢分子机制及铁磁纳米颗粒研究进展[J]. 科学通报, 2019, 64(8): 788-801.
[8] CAMASCHELLA C, NAI A, SILVESTRI L. Iron metabolism and iron disorders revisited in the hepcidin era[J]. Haematologica, 2020, 105(2): 260-272.
[9] NAI A, LIDONNICI M R, RAUSA M, et al. The second transferrin receptor regulates red blood cell production in mice[J]. Blood, 2015, 125(7): 1 170-1 179.
[10] YIANNIKOURIDES A, LATUNDE-DADA G O. A short review of iron metabolism and pathophysiology of iron disorders[J]. Medicines (Basel, Switzerland), 2019, 6(3):85.
[11] TOMAS G. Systemic iron homeostasis[J]. Physiological Reviews, 2013, 4(93): 1 721-1 741.
[12] RAMOS E, KAUTZ L, RODRIGUEZ R, et al. Evidence for distinct pathways of hepcidin regulation by acute and chronic iron loading in mice[J]. Hepatology, 2011, 53(4): 1 333-1 341.
[13] 肖新才, 刘健, 罗不凡,等. 膳食铁摄入、机体铁负荷与代谢综合征相关性研究[J].卫生研究,2011,40(10): 32-35.
[14] GANZ T. Erythropoietic regulators of iron metabolism[J]. Free Radical Biology and Medicine, 2019, 133: 69-74.
[15] FRAZER D M, WILKINS S J, ANDERSON G J. Elevated iron absorption in the neonatal rat reflects high expression of iron transport genes in the distal alimentary tract[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2007, 293(3): G525-G531.
[16] DESCHEMIN J C, NOORDINE M L, REMOT A, et al. The microbiota shifts the iron sensing of intestinal cells[J]. Faseb Journal, 2016, 30(1): 252-261.
[17] DAS N K, SCHWARTZ A J, BARTHEL G, et al. Microbial metabolite signaling is required for systemic iron homeostasis[J]. Cell Metabolism, 2020, 31(1): 115-136.
[18] 张忠胜, 余炳坚. 成人贫血并发急性脑梗死的临床特点分析[J]. 卒中与神经疾病, 2016, 23(6): 423-428.
[19] ALY S S, FAYED H M, ISMAIL A M, et al. Assessment of peripheral blood lymphocyte subsets in children with iron deficiency anemia[J]. BMC Pediatrics, 2018, 18(1): 49.
[20] DRURY K E, SCHAEFFER M, SILVERBERG J I. Association between atopic disease and anemia in US children[J]. Jama Pediatrics, 2016, 170(1): 29-34.
[21] 余敏, 陈道平, 文静. 老年缺铁性贫血患者体液免疫和细胞免疫功能的变化[J]. 贵州医科大学学报, 2018, 43(6): 698-702.
[22] JIANG Y, LI C, WU Q, et al. Iron-dependent histone 3 lysine 9 demethylation controls B cell proliferation and humoral immune responses[J]. Nature Communications, 2019, 10(1): 2 935.
[23] THEURL I, HILGENDORF I, NAIRZ M, et al. On-demand erythrocyte disposal and iron recycling requires transient macrophages in the liver[J]. Nature Medicine, 2016, 22(8): 945-951.
[24] PEREIRA M, CHEN T D, BUANG N, et al. Acute iron deprivation reprograms human macrophage metabolism and reduces inflammation in vivo[J]. Cell Reports, 2019, 28(2): 498-511.
[25] PAGANINI D, ZIMMERMANN M B. The effects of iron fortification and supplementation on the gut microbiome and diarrhea in infants and children: A review[J]. American Journal of Clinical Nutrition, 2017, 106(6): 1688S-1693S.
[26] YILMAZ B, LI H. Gut microbiota and iron: The crucial actors in health and disease[J]. Pharmaceuticals, 2018, 11(4): 98.
[27] 姚立恒. 小鼠铁稳态失衡与肠道菌群变化的相关性研究[D]. 广州: 南方医科大学, 2019.
[28] JAEGGI T, KORTMAN G A M, MORETTI D, et al. Iron fortification adversely affects the gut microbiome, increases pathogen abundance and induces intestinal inflammation in Kenyan infants[J]. Gut, 2015, 64(5): 731-742.
[29] DUHUTREL P, BORDAT C, WU T D, et al. Iron sources used by the nonpathogenic lactic acid bacterium lactobacillus sakei as revealed by electron energy loss spectroscopy and secondary-ion mass spectrometry[J]. Applied and Environmental Microbiology, 2010, 76(2): 560-565.
[30] ARCHIBALD F. Lactobacillus plantarum, an organism not requiring iron[J]. FEMS Microbiology Letters, 1983, 19(1): 29-32.
[31] ALEXANDRA D. Iron depletion and repletion with ferrous sulfate or electrolytic iron modifies the composition and metabolic activity of the gut microbiota in rats. [J]. The Journal of nutrition, 2012, 2(142): 271-277.
[32] KNIGHT L C, WANG M, DONOVAN S M, et al. Early-life iron deficiency and subsequent repletion alters development of the colonic microbiota in the pig[J]. Frontiers in Nutrition, 2019, 6: 120.
[33] 胡红莲, 高民. 肠道屏障功能及其评价指标的研究进展[J]. 中国畜牧杂志, 2012, 48(17): 78-82.
[34] WU W, LIU H P, CHEN F, et al. Commensal A4 bacteria inhibit intestinal Th2-cell responses through induction of dendritic cell TGF-beta production[J]. European Journal of Immunology, 2016, 46(5): 1 162-1 167.
[35] 赵聪, 黄浩, 陈贵堂. 缺铁性贫血与补铁剂研究概况[J]. 食品安全质量检测学报, 2016, 7(8): 3 216-3 221.
[36] LIN H M, DENG S G, HUANG S B, et al. The effect of ferrous-chelating hairtail peptides on iron deficiency and intestinal flora in rats[J]. Journal of the Science of Food and Agriculture, 2016, 96(8): 2 839-2 844.
[37] 李文军, 王帅, 汪建明,等. 大豆多肽铁螯合物制备及其抗氧化性研究 [J]. 食品研究与开发, 2017, 38(15): 39-44.
[38] 廉雯蕾. 脱酰胺—酶解法制备米蛋白肽及其亚铁螯合物的研究[D]. 无锡: 江南大学, 2015.
[39] 耿倩. 富铁酵母细胞的培养及其在治疗缺铁性贫血中的应用[D]. 青岛: 中国海洋大学, 2014.
[40] 王方海, 赵维, 陈建芳,等. 补铁剂研究进展 [J]. 药学进展, 2016, 40(9): 680-688.
[41] AKSAN A, ISIK H, TUGAL D, et al. Safety profiles of different intravenous iron preparations for therapy of iron deficiency anemia: Preliminary results from the IBD subgroup analysis[J]. American Journal of Gastroenterology, 2019, 114: S1-S1.
[42] 汪婧瑜, 张业辉, 张友胜,等. 乌鳢短肽螯合铁的制备及其结构特性研究 [J]. 现代食品科技, 2018, 34(1): 188-194.
[43] 刘文霞. 研究多糖铁复合物治疗缺铁性贫血的疗效以及其对血清转铁蛋白受体和血清铁蛋白的影响[J]. 当代医学, 2019, 25(16): 57-59.
[44] XU L, MENG Y, LIU Y, et al. A novel iron supplements preparation from Grifola frondosa polysaccharide and assessment of antioxidant, lymphocyte proliferation and complement fixing activities[J]. International Journal of Biological Macromolecules, 2018, 108: 1 148-1 157.
[45] 李世映, 唐志书, 宋忠兴,等. 酸枣多糖铁药理活性初步研究[J]. 食品工业科技, 2019, 40(6): 37-43;48.
[46] CHEN X, HUANG G. Synthesis and antioxidant activities of garlic polysaccharide-Fe(III) complex[J]. International Journal of Biological Macromolecules, 2020, 145: 813-818.
[47] KYYALY M A,POWELL C,RAMADAN E.Preparation of iron-enriched baker’s yeast and its efficiency in recovery of rats from dietary iron deficiency[J].Nutrition,2015,31(9):1 155-1 164.
[48] PEREIRA D I A, MOHAMMED N I, OFORDILE O, et al. A novel nano-iron supplement to safely combat iron deficiency and anaemia in young children: The IHAT-GUT double-blind, randomised, placebo-controlled trial protocol[J]. Gates Open Research, 2018, 2: 48-48.
[49] WANG K, LI L, XU X, et al. Fe3O4@astragalus polysaccharide core-shell nanoparticles for iron deficiency anemia therapy and magnetic resonance imaging in vivo[J]. Acs Applied Materials & Interfaces, 2019, 11(11): 10 452-10 461.
[50] GU Z, LIU T, TANG J, et al. Mechanism of iron oxide-induced macrophage activation: The impact of composition and the underlying signaling pathway[J]. Journal of the American Chemical Society, 2019, 141(15): 6 122-6 126.