目前,高血压成为危害我国居民健康的常见疾病之一,我国成人高血压患者达2.45亿,高血压前期患者高达4.35亿[1]。为治疗高血压,研究者开发出抑制血管紧张素转化酶(angiotensin-I converting enzyme,ACE)活性的降压药物,尽管药物有明确药效,但会引发皮疹、咳嗽、味觉障碍等副作用[2-4]。由于食源ACE抑制肽具有高安全性、高耐受性等优点,因而成为预防与治疗高血压的研究热点[5]。
研究发现,氧化应激与高血压密切相关。氧化应激通过干扰血压调节的信号通路,加剧血管内皮功能障碍[6],攻击低密度脂蛋白导致胆固醇在血管壁沉积,促进高血压发生发展;另一方面,高血压加重血管损伤,促进细胞内自由基形成,加重氧化应激[7-8]。控制氧化应激对于缓解高血压有积极作用,因此,具有降压与抗氧化的双活性肽具有较高的研究价值。
目前,关于降压与抗氧化的双活性肽研究较少,多处于活性发现阶段,如GARCIA-MORA等[9]从扁豆蛋白水解物中发现具有降压与抗氧化的双活性肽;TANZADEHPANAH等[10]合成出具有降压与抗氧化的活性肽KDEDTEEVP和KDEDTEEVH。有关降压与抗氧化的双活性肽的构效关系与作用机制研究较少,有必要开展相关研究。
芝麻蛋白是抗氧化肽与ACE抑制肽的前体[11-12]。课题组前期从芝麻蛋白水解产生的多肽中,筛选出具有降血压与抗氧化的双活性肽QCKH。本文通过比较相似性指数分析法(comparative molecular similarity index analysis,CoMSIA)研究其降压与抗氧化活性的构效关系,并利用分子拼接分析其与人体血管紧张素蛋白转换酶(1O86)的结合位点,利用AdmetSAR和ToxinPred对其理化特性、代谢、安全性进行评价,随后开展环境稳定性研究,以期为后续结构修饰与应用提供理论参考,推动双活性肽构效关系研究。
1 材料与方法
1.1 材料与试剂
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid), ABTS)、2,4,6-三吡啶基三嗪(2,4,6-Tris(2-pyridyl)-S-triazine, TPTZ)、马尿酰-组氨酰-亮氨酸水合物(N-Hippuryl-His-Leu hydrate, HHL)、ACE、邻苯二甲醛(O-phthaldialdehyde, OPA),美国Sigma-Aldrich公司;超滤膜UE003(截留分子质量3000 Da)、反渗透膜RO4,中科瑞阳膜技术有限公司;其他试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
TGL20M-Ⅱ高速冷冻离心机,湖南凯达科学仪器有限公司;Infinite M酶标仪,瑞士Tecan集团有限公司;UV-6300双光束型紫外可见分光光度计,上海美谱达仪器有限公司;XS205电子天平,梅特勒-托利多仪器有限公司;LC-500型制备液相,杭州旭昱有限公司等。
1.3 试验方法
1.3.1 芝麻活性肽QCKH分离纯化与鉴定
低温芝麻饼粕采用索氏抽提脱油(溶剂为沸程30~60 ℃石油醚)后,按照袁东振等[13]方法从低温芝麻饼粕制备芝麻蛋白,参考周存山等[14]方法进行体外模拟消化,中和酶解液,冷却室温后,8 000 r/min离心30 min,取上清液采用UE003膜过滤,透过液随即利用反渗透膜RO4浓缩,采用LC-500制备液相分离并采用液质联用仪进行结构鉴定[11],获得QCKH,其含量为0.037 2%。经蛋白质信息库检索,发现该肽段是芝麻7S globulin (ID:Q9AUD0_SESIN)中的DPELKQCKHQCKAQ 32~35的片段。
1.3.2 多肽设计与合成
为揭示QCKH的活性中心与构效关系,将该多肽分成2个区域:N端和C端,设计QC和KH,比较抗氧化与降血压活性,初步确立活性中心位置。随后在控制肽链长度的前提下,考察N末端、C末端、C端第2位氨基酸类型对活性影响,设计下面多肽SCKH、ACKH、FCKH、RCKH、ECKH、QCKR、QCKE、QCKD、QCDH、QCEH、QCED、QCIV,并固态合成(无锡亚肽公司合成),纯度为95%。
1.3.3 构效关系建模
采用SYBYL-X软件中protein building模块将1.3.2中的多肽录入软件,多肽电荷模式采用MMFF94模拟,能量优化采用MMFF94力场的Powell共轭梯度算法(最大运算次数为10 000,能量优化终止标准0.000 5 kcal/mol Å)[11]。分别采用ACE抑制活性最高的SCKH、DPPH自由基清除能力最高的QCIV、ABTS阳离子自由基清除能力最高的QCKH为模板,C为骨架,构建CoMSIA模型,分子叠加图见图1。偏最小二乘法(partial least squares,PLS)和留一法交叉验证程序(leave-one-out cross validation,LOO)对构效模型进行评价,模型成立的标准是:交叉验证系数(Q2)>0.5,误差预测标准差(R2)>0.6[15]。
图1 QCKH及其衍生肽分子叠加图
Fig.1 Structural alignment of QCKH and derived peptides
1.3.4 分子拼接
为揭示QCKH抑制ACE活性的途径,通过分子拼接软件Molecular Operating Environment 2015 (MOE 2015)分析QCKH与人体血管紧张素蛋白转换酶中氨基酸残基结合情况。从RCSB PDB网站(https://www.rcsb.org/structure/1O86)下载含有赖诺普利的人体血管紧张素蛋白转换酶的PDB文件,导入MOE 2015软件,质子化后,除去水分子,作为模板,打开MOE 2015中Dock模块,将QCKH作为配体载入,拼接方法设置为Proxy Triangle,优化设置为Rigid Receptor,得分方式选用London dG和GBV/WSA dG,从30个构型中选取5个最佳构型[16]。
1.3.5 QCKH生理活性与安全性预测
QCKH的生理活性采用AdmetSAR2.0 (http://lmmd.ecust.edu.cn/admetsar2/)预测,选取人体肠道吸收(human intestinal absorption,HIA)和人体口服生物利用度(human oral bioavailability,HOB)表征吸收特性,选取血脑屏障(blood-brain barrier penetration,BBB)、血浆蛋白结合率(plasma protein binding,PPB)、P-糖蛋白底物与抑制剂来表征分布特性,选取细胞色素450(cytochrome P450,CYP)底物与抑制活性表征代谢特性,选取致癌性和急性经口毒性表征毒性[17]。此外,对毒性及理化特性还采用ToxinPred (https://webs.iiitd.edu.in /raghava/toxinpred/design.php)预测,预测方法基于Swiss-Prot[18]。
1.3.6 QCKH稳定性试验
1.3.6.1 热稳定试验
将QCKH配制成2 mg/mL的测试液,分别置于30、40、50、60、70、80、90和100 ℃水浴加热3 h,冷却至室温,测定DPPH自由基和ABTS阳离子自由基清除率、ACE抑制率。
1.3.6.2 酸、碱稳定性试验
配制2 mg/mL QCKH溶液,分别调节pH为2、4、6、8、10和12,在20 ℃静置3 h,测定其DPPH自由基和ABTS阳离子自由基清除率、ACE抑制率。
1.3.6.3 紫外线稳定性试验
配制2.0 mg/mL的QCKH溶液,置于15 W紫外灯(257 nm)下10 cm处,室温下照射48 h,每隔4 h,测定其DPPH自由基和ABTS阳离子自由基清除率、ACE抑制率[19]。
1.3.7 抗氧化活性测定
采用DPPH自由基和ABTS阳离子自由基自由基清除率来评价多肽抗氧化活性,参照LU等[11]的方法,测定多肽溶液的DPPH自由基和ABTS阳离子自由基清除率,利用SPSS 25中probit模块计算IC50,即自由基清除率达到50%对应的多肽浓度。
1.3.8 ACE抑制活性测定
参考LI等[20]的方法,取20 μL的多肽溶液与40 μL ACE(12.5 mU/mL)和40 μL 4.66 mmol/L HHL溶液(0.4 mmol/L pH 8.5磷酸缓冲液含0.6 mol/L NaCl)混合,在37 ℃反应1 h后,加入150 μL 1.2 mol/L NaOH溶液终止反应,再加入40 μL体积分数 2%的OPA甲醇溶液室温反应20 min,随后加入40 mL 6 mol/L HCl溶液终止反应。将反应液按体积比1∶15 加入蒸馏水稀释后,倒入荧光比色皿,设定激发波长340 nm,发射波长455 nm,狭缝宽度5 nm,测定荧光强度。按照公式(1)计算ACE抑制率:
ACE抑制率![]()
(1)
式中:a,含有多肽、ACE和HHL溶液的荧光强度;b,ACE和HHL溶液的荧光强度;c,多肽和HHL溶液的荧光强度;d,HHL溶液的荧光强度。
测定系列多肽浓度对应的ACE抑制率采用SPSS 25中probit计算IC50,即抑制ACE活性50%时,对应的多肽浓度。
1.3.9 数据处理
无特殊说明,所有试验平行测定3次。单因素方差分析由SPSS 25(Duncan算法)运算,显著水平0.05,高度显著水平0.01。同一曲线上带有相同小写字母的数据间在0.05水平无显著差异。
2 结果与分析
2.1 QCKH构效关系
结合前人研究,分析QCKH的氨基酸组成,推测Cys2与His4可能与QCKH的抗氧化活性相关,Cys的巯基与His的咪唑基提供孤对电子给自由基,中和自由基反应,起到抗氧化作用[21-22]。另外,前人报道ACE抑制肽![]() 等[23-26],表明QCKH中Lys3和His4对其降压活性可能起作用。
等[23-26],表明QCKH中Lys3和His4对其降压活性可能起作用。
为验证上述推测,合成QC与KH并检测活性,结果显示QC与KH均有ACE抑制与抗氧化活性,这表明以上2种多肽片段均对QCKH的活性有贡献(表1)。相较于QCKH的ACE抑制活性与抗氧化活性,QC与KH的抗氧化活性均弱于QCKH,上述结果说明QC与KH结合形成QCKH的空间结构与电荷分布提升了抗氧化活性。
表1 QCKH及衍生多肽的ACE抑制与抗氧化活性
Table 1 ACE-inhibitory and antioxidant activities of peptides derived from QCKH
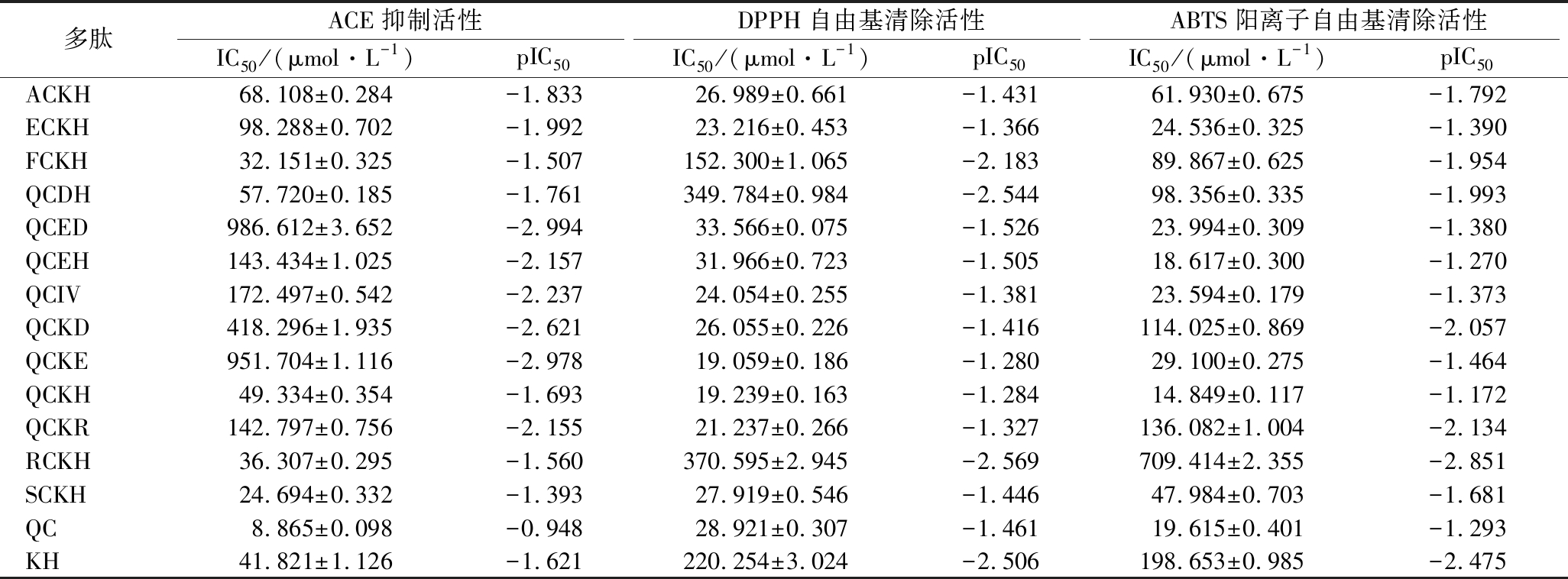
多肽ACE抑制活性DPPH自由基清除活性ABTS阳离子自由基清除活性IC50 /(μmol·L-1)pIC50IC50 /(μmol·L-1)pIC50IC50 /(μmol·L-1)pIC50ACKH68.108±0.284-1.83326.989±0.661-1.43161.930±0.675-1.792ECKH98.288±0.702-1.99223.216±0.453-1.36624.536±0.325-1.390FCKH32.151±0.325-1.507152.300±1.065-2.18389.867±0.625-1.954QCDH57.720±0.185-1.761349.784±0.984-2.54498.356±0.335-1.993QCED986.612±3.652-2.99433.566±0.075-1.52623.994±0.309-1.380QCEH143.434±1.025-2.15731.966±0.723-1.50518.617±0.300-1.270QCIV172.497±0.542-2.23724.054±0.255-1.38123.594±0.179-1.373QCKD418.296±1.935-2.62126.055±0.226-1.416114.025±0.869-2.057QCKE951.704±1.116-2.97819.059±0.186-1.28029.100±0.275-1.464QCKH49.334±0.354-1.69319.239±0.163-1.28414.849±0.117-1.172QCKR142.797±0.756-2.15521.237±0.266-1.327136.082±1.004-2.134RCKH36.307±0.295-1.560370.595±2.945-2.569709.414±2.355-2.851SCKH24.694±0.332-1.39327.919±0.546-1.44647.984±0.703-1.681QC8.865±0.098-0.94828.921±0.307-1.46119.615±0.401-1.293KH41.821±1.126-1.621220.254±3.024-2.506198.653±0.985-2.475
根据Q2和R2,基于ACE抑制活性与DPPH自由基清除能力构建的QCKH的CoMSIA模型成立,而基于ABTS阳离子自由基清除能力构建的CoMSIA模型的Q2值与0.5接近,其准确性较差,故不予考虑(表2)。
表2 QCKH降压与抗氧化的CoMSIA模型
Table 2 CoMSIA models for ACE-inhibitory and antioxidation of QCKH
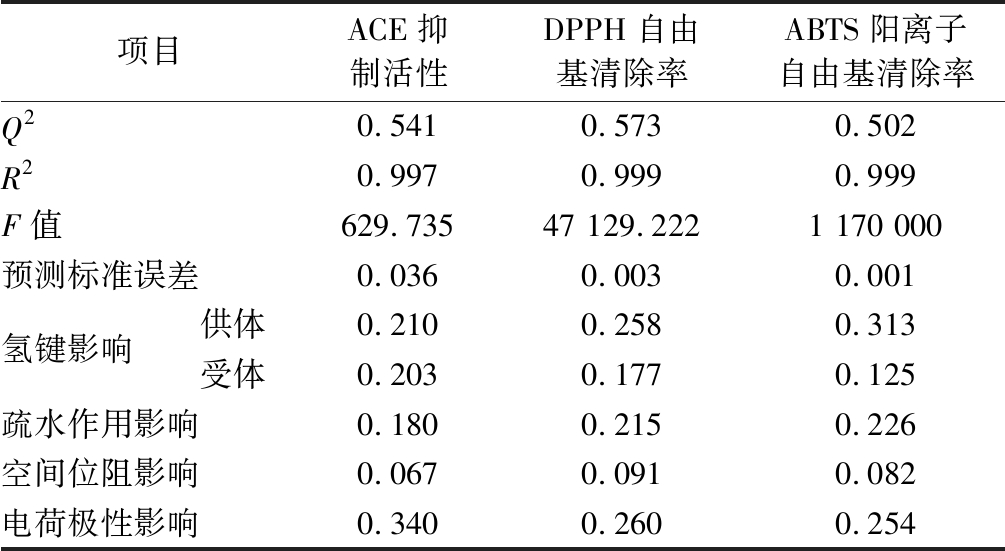
项目ACE抑制活性DPPH自由基清除率ABTS阳离子自由基清除率Q20.5410.5730.502R20.9970.9990.999F值629.73547 129.2221 170 000预测标准误差0.0360.0030.001氢键影响供体0.2100.2580.313受体0.2030.1770.125疏水作用影响0.1800.2150.226空间位阻影响0.0670.0910.082电荷极性影响0.3400.2600.254
分析结构因素对降压与抗氧化的影响发现,氢键是影响QCKH降压与抗氧化活性的首要因素,该结果与管骁等[27]研究结果部分相符。推测QCKH中氨基酸残基通过氢键与ACE的活性位点结合,改变其空间结构,造成ACE难以与人体血管紧张素1结合,起到抑制作用。同时,QCKH的氨基酸残基经氢键与自由基连接,通过共振稳定自由基结构,起到抗氧化作用[28]。电荷极性对QCKH的ACE抑制影响大于DPPH自由基清除,这可能是多肽的电荷极性会影响与ACE活性中心Zn2+结合,导致在ACE抑制活性上产生差异[29]。QCKH及其衍生肽均是4肽,分子尺寸较小,易于进入ACE与其活性位点结合,同时,由于结构简单,活性基团暴露,易于DPPH自由基结合,导致QCKH空间位阻的影响较低。
QCKH的氨基酸残基通过氢键、电荷极性、疏水作用、空间位阻对ACE抑制活性与DPPH自由基清除能力的影响见图2~图6。在图2中,氢键供体在绿色区域有利于提高ACE抑制活性与抗氧化活性,而氢键供体在红色区域不利于提高活性,由此推知,C末端氨基酸残基侧链被氢键供体基团取代可以提高ACE抑制(图2-a),这可能是QCKH的ACE抑制活性强于QCKE的原因,QCKE中Glu4的侧链上羰基是氢键受体,QCKH中His4侧链为咪唑基是氢键供体。在N端氨基酸残基侧链顶端有氢键供体,有利于提高DPPH自由基清除能力,这与DPPH自由基中氢键受体硝基有关。通过分子间氢键,多肽能更加稳定与DPPH连接,为后续发生电子转移提供有利条件。
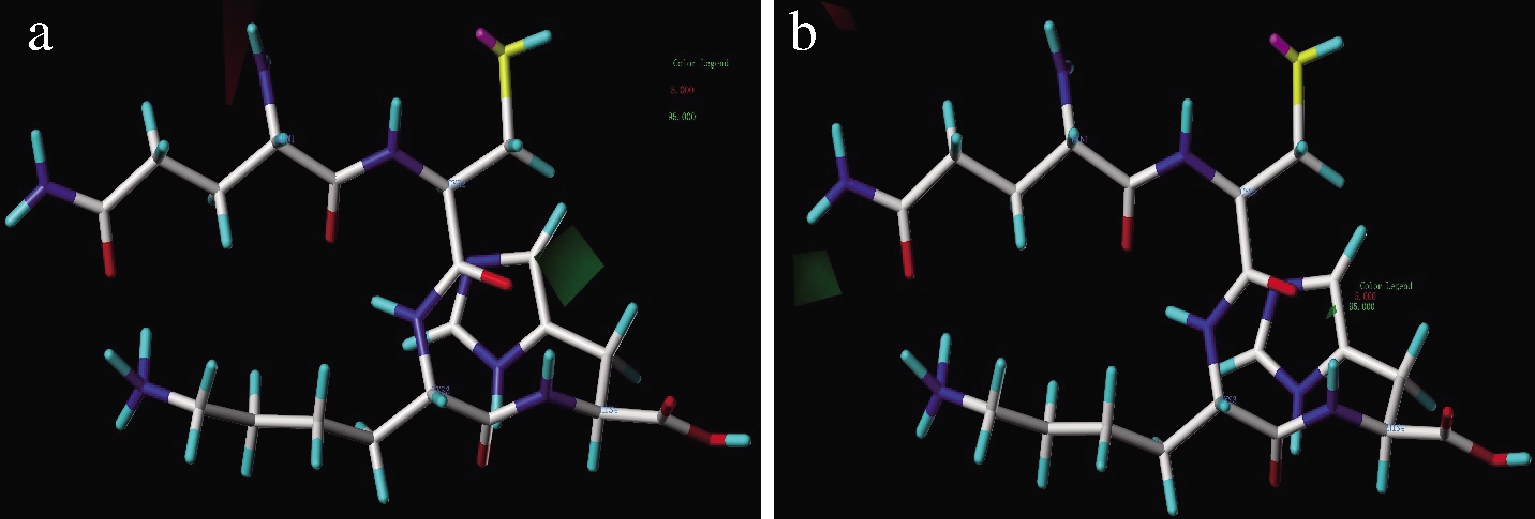
a-氢键供体对ACE抑制活性影响;b-氢键供体对DPPH自由基清除影响
图2 CoMSIA模型中氢键供体对QCKH的活性影响
Fig.2 Effect of hydrogen bond donor on activities of QCKH in CoMSIA model
在图3中,氢键受体在绿色区域有利于提高ACE抑制和DPPH自由基清除活性,反之,在红色区域不利于ACE抑制和DPPH自由基清除活性。C末端羧基中羰基对于提升QCKH的ACE抑制活性起到重要作用(图3-a)。
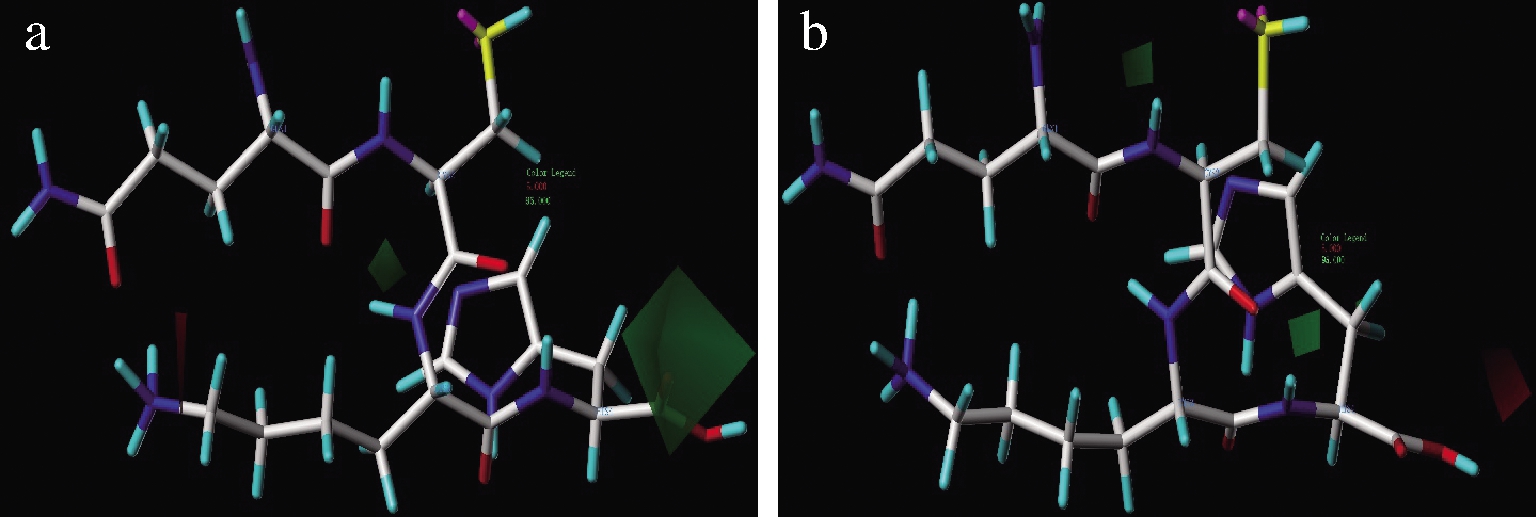
a-氢键受体对ACE抑制活性影响;b-氢键受体对 DPPH自由基清除影响
图3 CoMSIA模型中氢键受体对QCKH的活性影响
Fig.3 Effect of hydrogen bond acceptor on activities of QCKH in CoMSIA model
若要提高多肽的ACE抑制和DPPH自由基清除活性,绿色区域适宜带正电荷取代基,红色区域适宜带负电取代基。由图4可知,C端氨基酸的羧基被带正电基团取代会提高ACE抑制活性,推测通过阳离子-π相互作用,影响ACE中His383和Tyr523,增加抑制效果[30]。对于QCKH的抗氧化活性而言,Lys3侧链带正电荷是有利因素(图4-b),这可能是在电荷斥力的作用下,使缺电子带正电的自由基避开上述基团,接近Cys2的巯基,加速反应进行,显示更强的抗氧化能力。QCKH的DPPH自由基清除能力强于QCDH也证实上述结论。
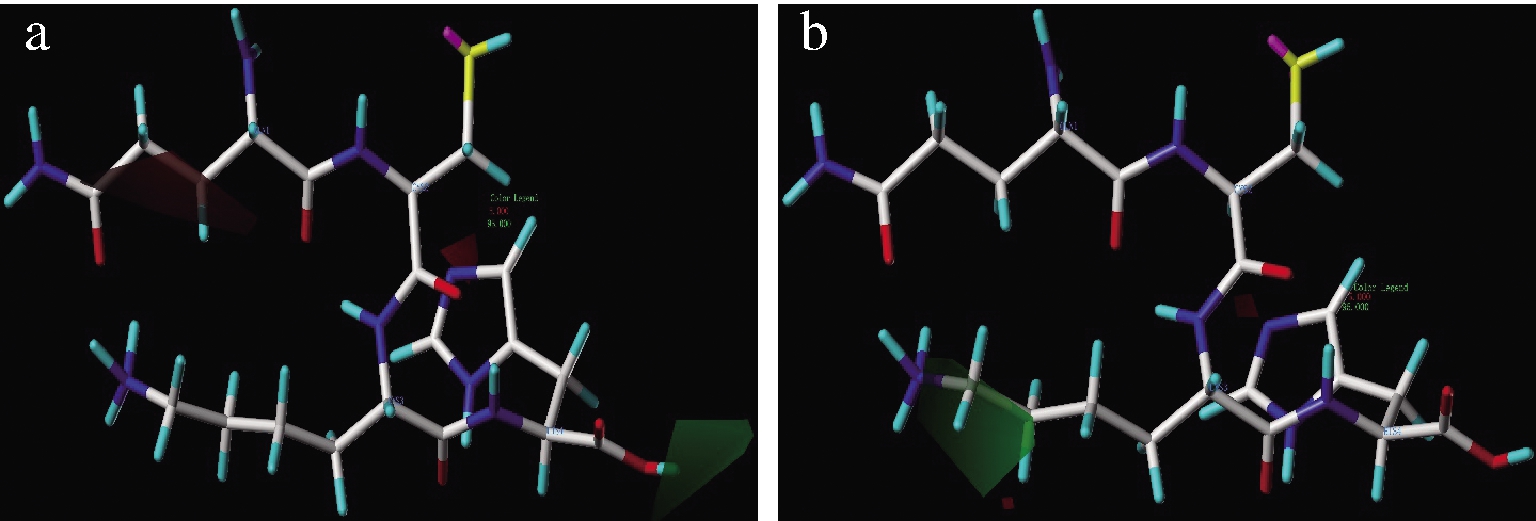
a-电荷极性对ACE抑制活性影响; b-电荷极性对DPPH自由基清除影响
图4 CoMSIA模型中电荷极性对QCKH的活性影响
Fig.4 Effect of electrostatic field on activities of QCKH in CoMSIA model
图5中,疏水基团出现在绿色区域内有利于提高ACE抑制和DPPH自由基清除活性,反之,在红色区域内出现会降低ACE抑制和DPPH自由基清除活性。由图5可知,N端和Lys3氨基酸残基侧链顶端含有疏水氨基酸有利于增强ACE抑制活性,这同前人报道N端为疏水性芳香氨基酸的ACE抑制肽活性较高的结论部分一致[31]。N端氨基酸残基的α-C附近区域为疏水基团有利于提升抗氧化活性,这可能是DPPH自由基为非极性自由基,当多肽N端有疏水基团时,更有利于两者通过疏水相互作用靠近,增加Cys2与DPPH反应机率。
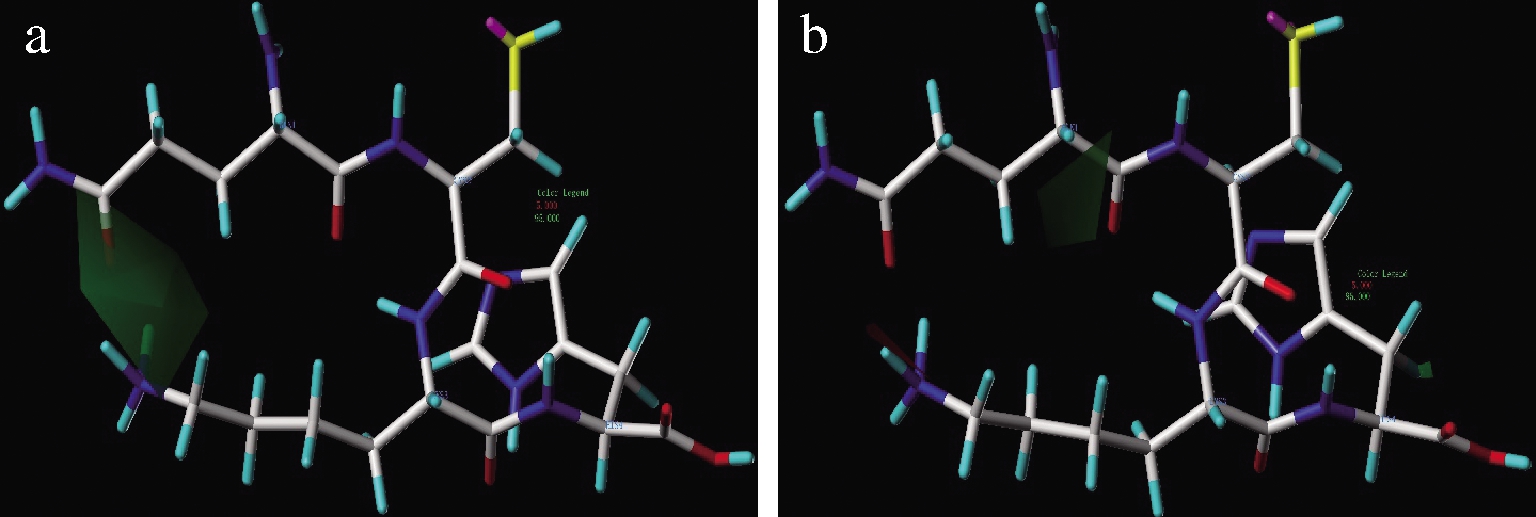
a-疏水作用对ACE抑制活性影响;b-疏水作用对DPPH 自由基清除影响
图5 CoMSIA模型中疏水作用对QCKH的活性影响
Fig.5 Effect of hydrophobicity on activities of QCKH in CoMSIA model
图6中,小体积取代基出现在红色区域、大体积取代基出现在绿色区域都有利于提高ACE抑制和DPPH自由基清除能力。由图6-a可知,增加C端氨基酸残基体积,有利于提高ACE抑制活性。上述结论同UDENIGWE等[32]报道C端为大侧链氨基酸的ACE抑制肽有较高活性的结论一致。适当减少N端氨基酸氨基体积,更容易暴露Cys2的巯基基团,有利于提高多肽DPPH自由基清除能力(图6-b)。
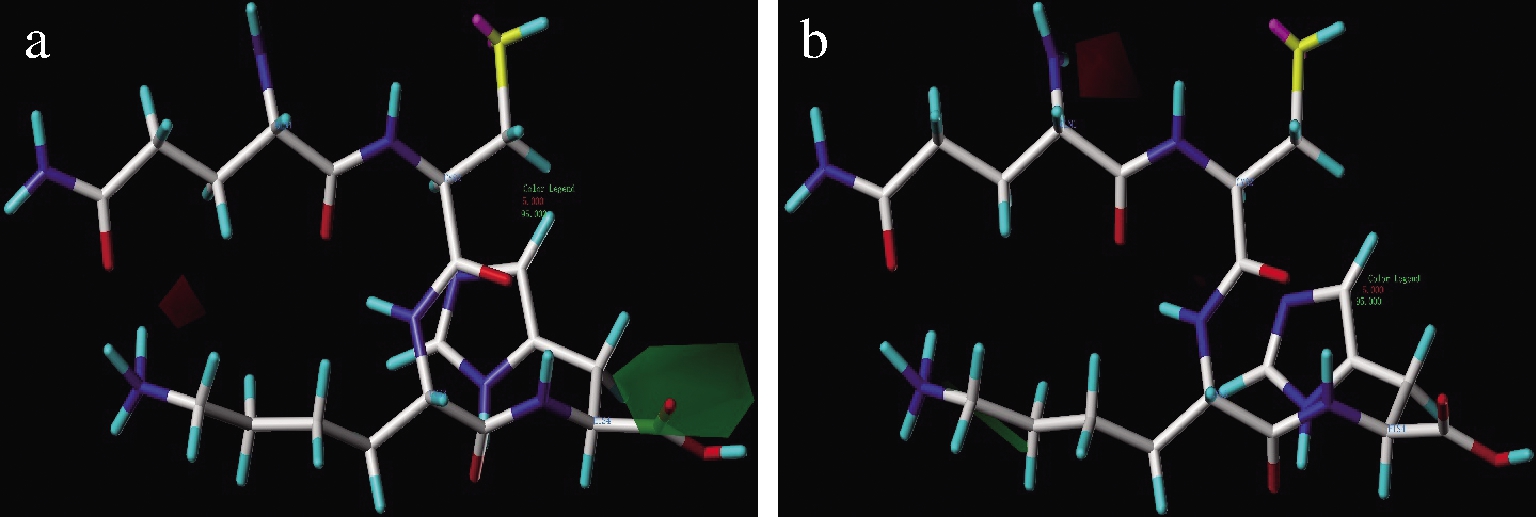
a-空间位阻对ACE抑制活性影响;b-空间位阻对DPPH自由基清除影响
图6 CoMSIA模型中空间位阻对QCKH的活性影响
Fig.6 Effect of steric field on activities of QCKH in CoMSIA model
2.2 QCKH的分子拼接
由图7-a可知,QCKH与降血压药物赖诺普利在ACE中的位置基本吻合。由图7-b可知,QCKH通过氢键与ACE上的Tyr520、Gln281、Lys511、His513、His353、Tyr523、Ala354、Ala356和Glu411结合,通过离子键同His387、Lys511、His353和Zn701结合,还通过芳烃键与Phe457、His353发生作用。前人报道,ACE催化活性受活性口袋S1(Ala354、Glu384、Tyr523)、S2(Gln281、His353、Lys511、His513、Tyr520)、S1′(Glu162)和活性中心Zn2+(His383、His387和Glu411)的影响[33]。由此可知,QCKH主要通过影响ACE活性口袋S1、S2和Zn2+的结构实现对ACE的抑制。His4的羧基作为氢键受体同Gln281,Tyr520,Phe512,Lys511发生作用,验证了2.1构效关系分析中C端适宜由氢键受体构成的结论。
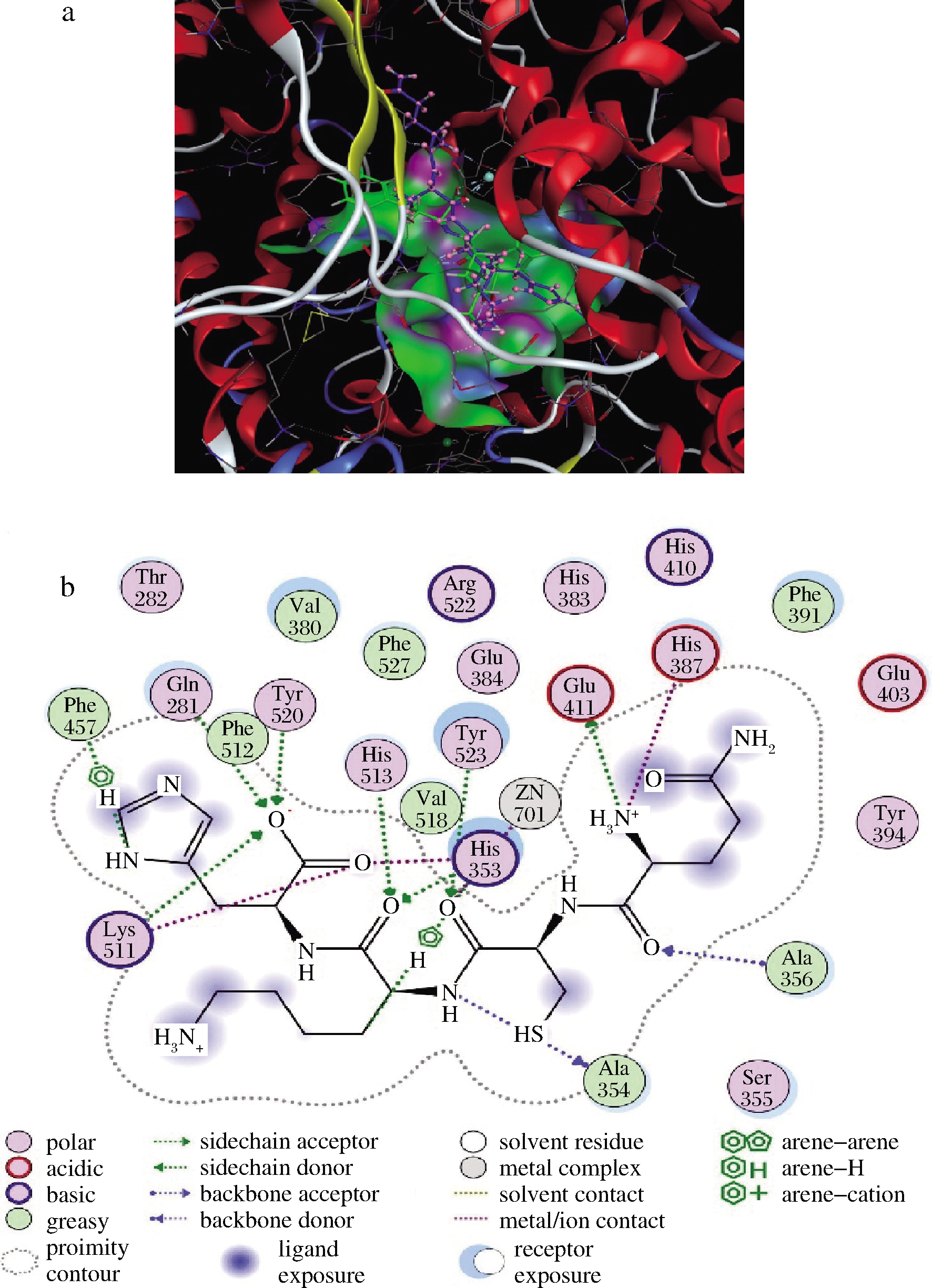
a-空间拼接图(蓝色分子为QCKH,绿色分子为赖诺普利); b-平面拼接图
图7 QCKH与ACE分子拼接图
Fig.7 Molecular docking for QCKH and ACE
2.3 QCKH生理活性与安全性预测
活性肽在体内产生有益功能,必须能被肌体吸收、输送与代谢,同时,还有低的毒副作用。因此,有必要评价QCKH的生理活性与安全性。由表3所示,QCKH可以经口吸收;在血液中,与血浆蛋白结合率低,这表明QCKH在血液中较稳定,有利于药效发挥;高血脑屏障、非细胞色素P450酶系底物(除CYP3A4)、无抑制细胞色素P450活性,这表明QCKH既不影响中枢神经,也不干扰正常的细胞活动;QCKH预测无致癌性与无毒性,安全性高。上述结果表明,QCKH可以作为功能因子应用于保健食品。然而,基于Lipinski类药五原则,QCKH氢键受体和可旋转键偏多,且脂水分配系数偏低,需要分子修饰以简化结构和提高脂溶性。
表3 QCKH生理活性、理化特性与安全性预测
Table 3 Prediction on physiological activity, physicoch- emical properties and safety of QCKH
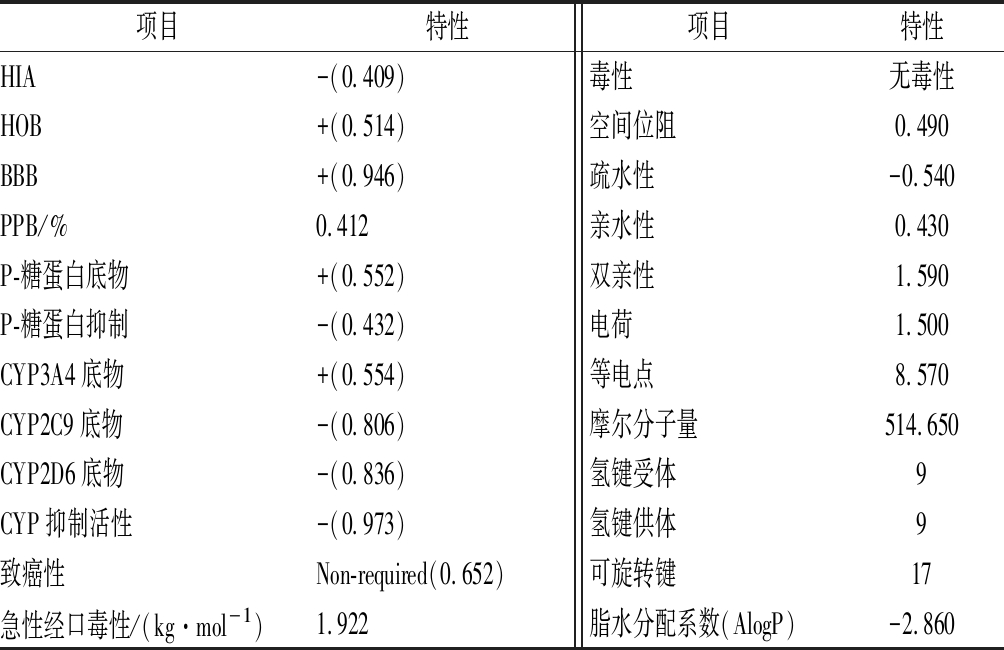
项目特性项目特性HIA-(0.409)毒性无毒性HOB+(0.514)空间位阻0.490BBB+(0.946)疏水性-0.540PPB/%0.412亲水性0.430P-糖蛋白底物+(0.552)双亲性1.590P-糖蛋白抑制-(0.432)电荷1.500CYP3A4底物+(0.554)等电点8.570CYP2C9底物-(0.806)摩尔分子量514.650CYP2D6底物-(0.836)氢键受体9CYP抑制活性-(0.973)氢键供体9致癌性Non-required(0.652)可旋转键17急性经口毒性/(kg·mol-1)1.922脂水分配系数(AlogP)-2.860
注:括号中数字为预测概率
2.4 QCKH的环境稳定性
由图8可知,温度会显著影响QCKH的活性,其中对于抗氧化活性的影响要大于降压活性的影响。随着加热温度升高,QCKH的DPPH自由基和ABTS阳离子自由基清除能力迅速下降,而降压活性下降较为平缓。产生上述变化的原因可能是QCKH的抗氧化活性主要受Cys2的影响,随着温度上升,性质活泼的巯基更易氧化脱氢,同时,还会形成分子间二硫键,从而降低抗氧化活性[34]。虽然QCKH的降压活性与巯基无关,但通过二硫键连接的二聚体,改变原有的空间结构并增加体积,从而削弱与ACE结合的能力,导致ACE抑制活性下降。
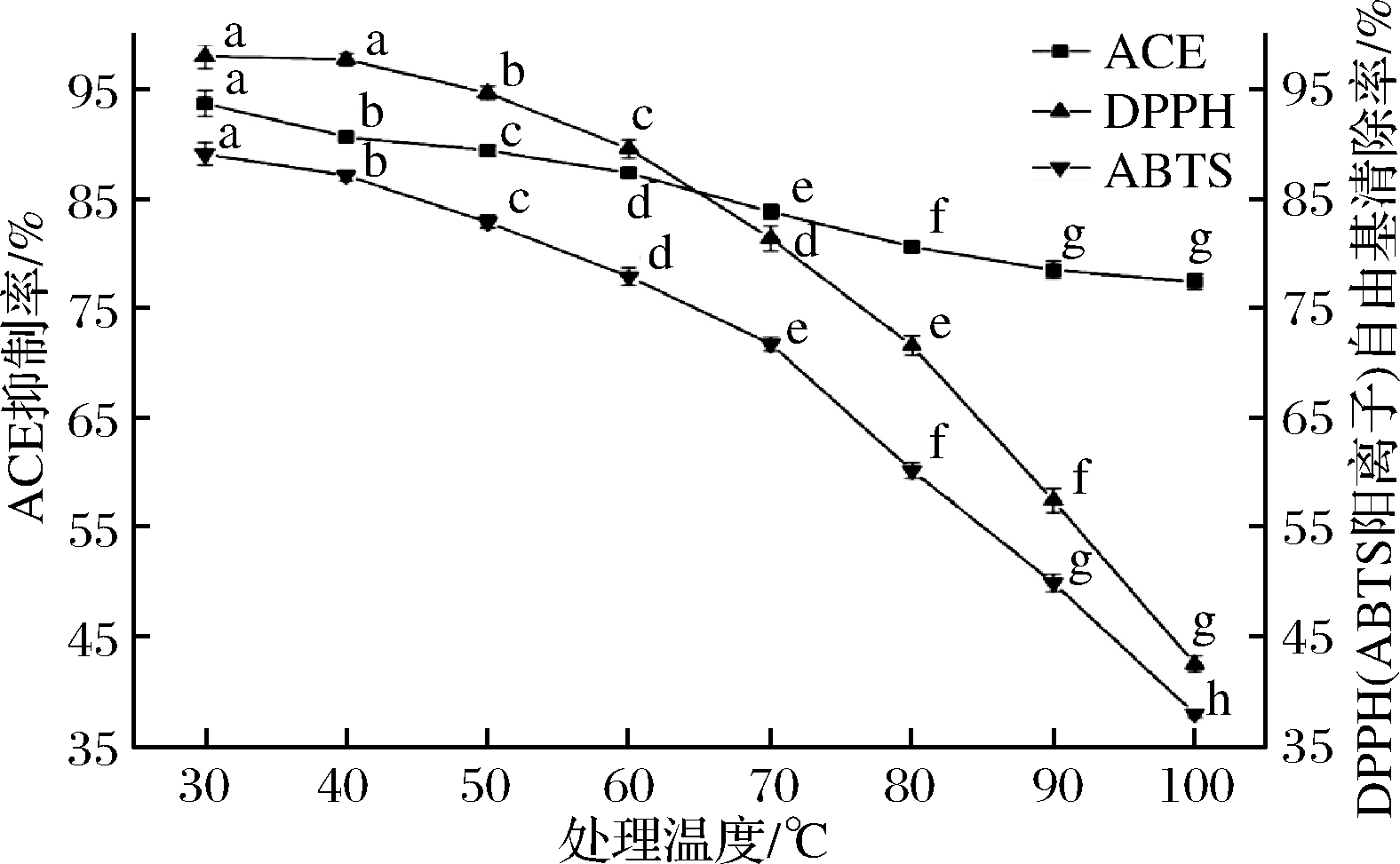
图8 温度对QCKH活性的影响
Fig.8 Effect of temperature on activities of QCKH
pH对QCKH活性影响的见图9。当pH<6时,QCKH的抗氧活性无显著差异,进入碱性环境时,QCKH的抗氧化活性显著下降。这可能是一方面QCKH在碱性条件下,发生消旋,从而引起肽链构象发生改变,影响活性[35];另一方面,QCKH中Cys2巯基发生解离,从而降低活性[36]。与抗氧化活性不同,QCKH的ACE抑制活性在pH 8达到最强,随后呈现下降趋势。这可能与QCKH的等电点有关,QCKH的等电点为8.57,在pH为8时,大部分QCKH中His羧基为负电荷,由2.2小节可知,这有利于QCKH抑制ACE活性,然而,随着pH的继续升高,Gln1的氨基失氢,不能作为氢键供体,减弱与ACE结合能力,从而降低ACE抑制活性;加之,碱性导致肽链消旋,改变空间结构,也影响ACE抑制活性。
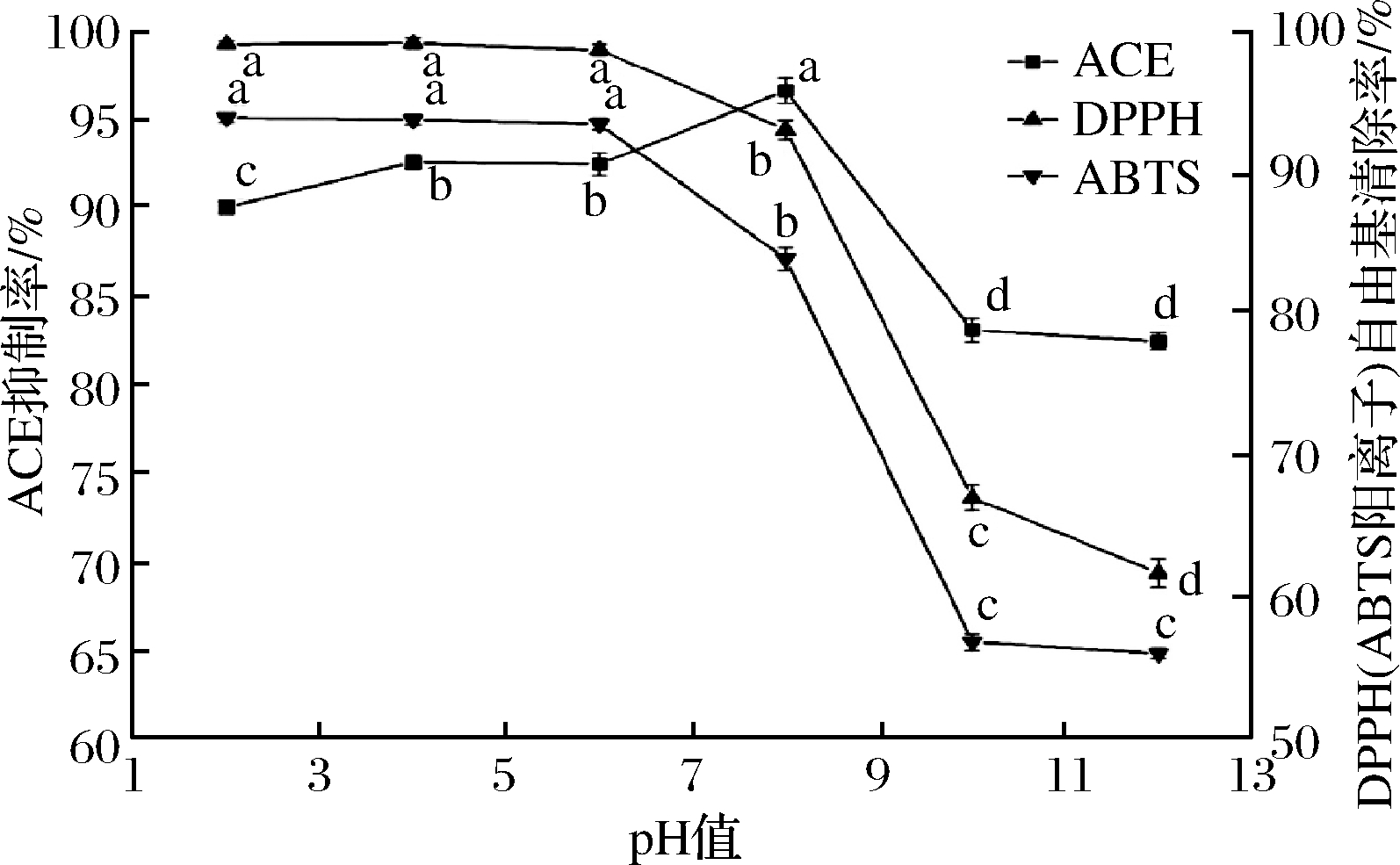
图9 pH对QCKH的影响
Fig.9 Effect of pH on activities of QCKH
紫外照射对QCKH的活性影响见图10。随着紫外照射时间延长,QCKH的ACE抑制活性与抗氧化活性均显著下降。紫外线作用导致多肽外层电子从基态跃迁到激发状态,导致羟基、巯基、氨基上的氢发生电离,从而改变原有结构,影响活性[37]。此外,紫外线照射导致水分子裂解产生羟自由基[19],也会加速QCKH抗氧化能力的消耗,从而导致出现抗氧化活性下降大于ACE抑制活性现象。
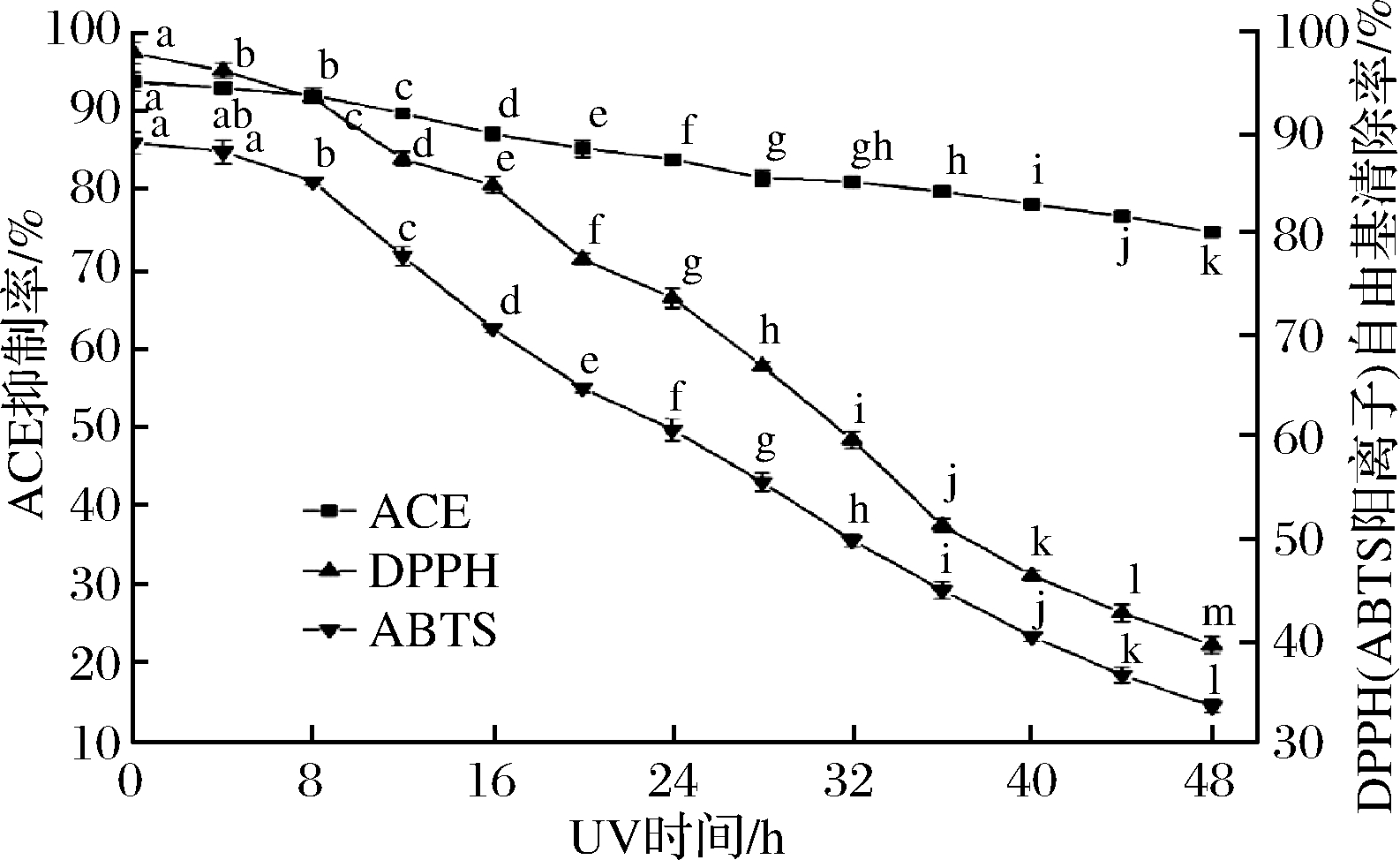
图10 UV照射对QCKH的影响
Fig.10 Effect of UV on activities of QCKH
3 结论
综上所述,QCKH的抗氧化与降血压活性与Cys2和His4有关,经CoMSIA建模发现,QCKH的抗氧化与降血压活性主要受氢键、电荷极性、疏水作用影响。QCKH通过氢键与离子键与ACE的活性口袋S1和S2、活性中心Zn2+发生作用,改变ACE空间结构,起到抑制ACE活性的作用。ADMET预测QCKH可以经口吸收,不会干扰人体正常的生理活动,安全性高。分析环境因素影响发现,在常温、中性、避光条件下,QCKH的抗氧化与降血压活性基本稳定,且在环境因素作用时,QCKH降血压活性比抗氧化活性稳定。
在后续研究中,QCKH应通过分子修饰,以达到简化结构、提高脂溶性、改善肠道吸收能力;在加工过程中,应避免高温、极端pH与光照,以减少损耗。
[1] WANG Z, CHEN Z, ZHANG L, et al. Status of hypertension in China: Results from the China hypertension survey, 2012-2015[J]. Circulation, 2018, 137(22): 2 344-2 356.
[2] BHAT Z F, KUMAR S, BHAT H F. Antihypertensive peptides of animal origin: A review[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(3): 566-578.
[3] GU Y C, WU J P. LC-MS/MS coupled with QSAR modeling in characterising of angiotensin I-converting enzyme inhibitory peptides from soybean proteins[J]. Food Chemistry, 2013, 141(3): 2 682-2 690.
[4] COOPER W O, HERNANDEZ-DIAZ S, ARBOGAST P G, et al. Major congenital malformations after first-trimester exposure to ACE inhibitors[J]. The New England Journal of Medicine, 2006, 354(23): 2 443-2 451.
[5] 田明慧, 林亲录, 梁盈, 等. 植物源性食物中活性肽氨基酸组成的研究进展[J]. 食品与发酵工业,2014, 40(6): 110-116.
[6] TOUYZ R M, BRIONES A M. Reactive oxygen species and vascular biology: implications in human hypertension[J]. Hypertension Research, 2011, 34(1): 5-14.
[7] POPOLO A, AUTORE G, PINTO A, et al. Oxidative stress in patients with cardiovascular disease and chronic renal failure [J]. Free Radical Research, 2013, 47(5): 346-356.
[8] CHEN K, XIE F, LIU S, et al. Plasma reactive carbonyl species: Potential risk factor for hypertension[J]. Free Radical Research, 2011, 45(5): 568-574.
[9] GARCIA-MORA P, PE AS E, FRIAS J, et al. High-pressure improves enzymatic proteolysis and the release of peptides with angiotensin I converting enzyme inhibitory and antioxidant activities from lentil proteins[J]. Food Chemistry, 2015, 171: 224-232.
AS E, FRIAS J, et al. High-pressure improves enzymatic proteolysis and the release of peptides with angiotensin I converting enzyme inhibitory and antioxidant activities from lentil proteins[J]. Food Chemistry, 2015, 171: 224-232.
[10] TANZADEHPANAH H, ASOODEH A, SAIDIJAM M, et al. Improving efficiency of an angiotensin converting enzyme inhibitory peptide as multifunctional peptides[J]. Journal of Biomolecular Structure and Dynamics, 2017, 36(14): 3 803-3 818.
[11] LU X, ZHANG L X, SUN Q, et al. Extraction, identification and structure-activity relationship of antioxidant peptides from sesame (Sesamum indicum L.) protein hydrolysate[J]. Food Research International, 2019, 116: 707-716.
[12] NAKANO D, OGURA K, MIYAKOSHI M, et al. Antihypertensive effect of angiotensin I-converting enzyme inhibitory peptides from a sesame protein hydrolysate in spontaneously hypertensive rats[J]. Bioscience Biotechnology and Biochemistry, 2006, 70(5): 1 118-1 126.
[13] 袁东振, 张国治, 黄纪念, 等. 用亚临界芝麻粕制备芝麻蛋白的工艺研究[J]. 河南工业大学学报(自然科学版), 2014, 35(6): 49-55.
[14] 周存山, 秦晓佩, 余筱洁, 等. 绿鳍马面鲀鱼皮蛋白抗氧化肽模拟胃肠消化制备[J]. 农业机械学报, 2015, 46(8): 211-216.
[15] VUKIC V R, VUKIC D V, MILANOVIC S D, et al. In silico identification of milk antihypertensive di-and tripeptides involved in angiotensin I-converting enzyme inhibitory activity[J]. Nutrition Research, 2017, 46: 22-30.
[16] SEKO T, IMAMURA S, ISHIHARA K. et al. Inhibition of angiotensin-converting enzyme by selenoneine[J]. Fisheries Science, 2019, 85: 731-736.
[17] 杨欣, 李亚辉, 钱海兵, 等. 基于网络药理学筛选结肠癌关键靶点及人参干预研究[J]. 贵阳中医学院学报, 2019, 41(6):24-30.
[18] LAFARGA T, WILM M, WYNNE K, et al. Bioactive hydrolysates from bovine blood globulins: Generation, characterisation, and in silico prediction of toxicity and allergenicity[J]. Journal of Functional Foods, 2016, 24: 142-155.
[19] 李致瑜, 张翀, 田玉庭, 等. 大黄鱼内脏抗氧化肽的稳定性研究[J]. 现代食品科技, 2016, 32(1): 151-158.
[20] LI F J, YIN L J, LU X, et al. Changes in angiotensin I-converting enzyme inhibitory activities during the ripening of Douchi (a Chinese traditional soybean product) fermented by various starter cultures[J]. International Journal of Food Properties, 2010, 13(3): 512-524.
[21] UDENIGWE C C, ALUKO R E. Chemometric analysis of the amino acid requirements of antioxidant food protein hydrolysates[J]. International Journal of Molecular Sciences, 2011, 12: 3 148-3 161.
[22] TIAN M, FANG B, JIANG L, et al. Structure-activity relationship of a series of antioxidant tripeptides derived from β-lactoglobulin using QSAR modeling[J]. Dairy Science and Technology, 2015, 95: 451-463
[23] G MEZ-RUIZ J A, TABORDA G, AMIGO L, et al. Identification of ACE-inhibitory peptides in different Spanish cheeses by tandem mass spectrometry[J]. European Food Research and Technology, 2006, 223: 595-601.
MEZ-RUIZ J A, TABORDA G, AMIGO L, et al. Identification of ACE-inhibitory peptides in different Spanish cheeses by tandem mass spectrometry[J]. European Food Research and Technology, 2006, 223: 595-601.
[24] TERASHIMA M, BABA T, IKEMOTO N, et al. Novel angiotensin-converting enzyme (ACE) inhibitory peptides derived from boneless chicken leg meat[J]. Journal of Agricultural and Food Chemistry, 2010, 58: 7 432-7 436.
[25] SAITO T, NAKAMURA T, KITAZAWA H, et al. Isolation and structural analysis of antihypertensive peptides that exist naturally in Gouda cheese[J]. Journal of Dairy Science, 2000, 83: 1 434-1 440.
[26] VILLEGAS J M, PICARIELLO G, MAMONE G, et al. Milk-derived angiotensin-I-converting enzyme-inhibitory peptides generated by Lactobacillus delbrueckii subsp. lactis CRL 581[J]. Peptidomics, 2014, 1: 22-29.
[27] 管骁, 刘静, 苏淅娜, 等. 血管紧张素转化酶抑制二肽抑制ACE作用的柔性分子拼接[J]. 食品科学, 2015, 36(5): 1-6.
[28] 张晖, 唐文婷, 王立, 等. 抗氧化肽的构效关系研究进展[J]. 食品与生物技术学报, 2013, 32(7): 673-679.
[29] ALUKO R E. Structure and function of plant protein-derived antihypertensive peptides[J]. Current Opinion in Food Science, 2015, 4: 44-50.
[30] LIU C L, FANG L, MIN W H, et al. Exploration of the molecular interactions between angiotensin-I-converting enzyme (ACE) and the inhibitory peptides derived from hazelnut (Corylus heterophylla Fisch.)[J]. Food Chemistry, 2018, 245: 471-480.
[31] WU J P, ALUKO R, NAKAI S. Structural requirements of angiotensin I-converting enzyme inhibitory peptides: Quantitative structure activity relationship modeling of peptides containing 4-10 amino acid residues[J]. QSAR & Combinatorial Science, 2006, 25(10): 873-880.
[32] UDENIGWE C C, LI H, ALUKO R E. Quantitative structure-activity relationship modeling of renin-inhibiting dipeptides[J]. Amino Acids, 2012, 42(4): 1 379-1 386.
[33] PINA A S, ROQUE A C A. Studies on the molecular recognition between bioactive peptides and angiotensin-converting enzyme[J]. Journal of Molecular Recognition, 2009, 22(2): 162-168.
[34] 朱义福. 还原型谷胱甘肽的稳定性研究[J]. 现代食品科技, 2011, 27(8): 919-923.
[35] 胡晓, 吴静, 杨贤庆, 等. 添加物和体外模拟胃肠道消化对鸢乌贼抗氧化肽稳定性的影响[J]. 食品与发酵工业, 2016, 42(11): 91-96.
[36] 王辉, 冯万祥. 含汞树脂分离提纯谷胱甘肽[J]. 华东理工大学学报, 1996, 22(6): 717-721.
[37] CHONDROGIANNI N, PETROPOULOS I, GRIMM S, et al. Protein damage, repair and proteolysis[J]. Molecular Aspects of Medicine, 2014, 35:1-71.