美国豆芋 (Apios americana Medikus) 为多年生豆科土圞儿属植物[1],别名美国花生、菜豆,地下块茎作为无性繁殖或食用,是天然的高蛋白、高钙食品[2-3]。美国豆芋具有抗肿瘤、抑制高血压[4]和降低患癌风险[5-6]等特殊功效,是一种用途广泛的保健食品原料。美国豆芋原产于北美洲,后流传至日本,于2009年成功引种至中国,经推广在浙江省杭州、温州、金华和宁波等地区有栽培种植。国内对其研究主要分析了美国豆芋生理生化特性[7-8];国外对美国豆芋的研究更为深入,不仅对营养成分方面有所探索,发现了具有抗糖尿病、调节心脑血管系统等功能的DDMP-皂苷[9],也对其降血压降血糖方面进行研究,研究表明美国豆芋具有降血糖、降血压的功效[10]。欧美及日本民间就有饮用美国豆芋花茶来预防高血压、高血糖等现代疾病的习惯。本课题组前期比较了美国豆芋茎、叶和花等地上部位的有效成分含量及α-葡萄糖苷酶抑制活性,发现美国豆芋花具有较强的α-葡萄糖苷酶抑制活性[11]。本试验在前期研究的基础上,对美国豆芋块茎的有效成分含量、抗氧化以及α-葡萄糖苷酶抑制能力进行探究,筛选出最佳活性部位,以期为美国豆芋资源的高效利用以及美国豆芋块茎作为抗氧化剂和降血糖降血脂功能性食品原料的开发和利用提供科学依据和理论基础。
1 材料与方法
1.1 材料与仪器
美国豆芋块茎于2018年9月采收于浙江省临安市浙江农林大学平山试验基地,洗净切片,晾干,粉碎,过40目筛,得美国豆芋块茎粉,备用。
葡萄糖、盐酸小檗碱、染料木苷、熊果酸,α-葡萄糖苷酶,上海源叶生物科技有限公司;芦丁标准品,BBI Life Sciences公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS),阿拉丁化学试剂有限公司;2,4,6-三(2-吡啶基)-1,3,5-三嗪(2,4,6-tri (2-pyridyl)-1,3,5-triazine,TPTZ),北京百灵威试剂有限公司;4-硝基苯基-α-D-吡喃葡萄糖苷(P-nitrophenyl-α-D-glucopyranoside,PNPG),Sigma公司。其他试剂均为国产分析纯。
SHB-Ⅲ-A型循环水式多用真空泵,杭州大卫科教仪器有限公司;IKA RV 3eco型旋转蒸发仪,艾卡仪器有限公司;UV-5500型紫外可见分光光度计,上海元析仪器有限公司;Multiskan spectrum型全波动酶标仪,Thermo fisher Scientific公司。
1.2 试验方法
1.2.1 化学成分定性、定量分析
参考陈玉婷等[12]和郝海燕等[13]方法,将美国豆芋块茎按照不同的方法(颜色反应和沉淀反应)进行化学成分的快速定性分析。
1.2.2 美国豆芋块茎提取物制备
精密称取美国豆芋块茎粉200 g,按料液比1∶3(g∶mL)分别用石油醚、甲醇、体积分数50%甲醇和蒸馏水提取,每种溶剂提取3次,合并提取液,减压浓缩干燥,得石油醚提取物、甲醇提取物、体积分数50%甲醇提取物和水提取物。计算得率和含量。
得率![]()
(1)
式中:m1,提取后美国豆芋块茎质量,g; m2,美国豆芋块茎粉末质量,g。
甲醇提取物用水溶解,采用石油醚、乙酸乙酯和正丁醇进行萃取,每种溶剂萃取3次,合并萃取液,减压浓缩干燥,得到石油醚相、乙酸乙酯相、正丁醇相和水相。计算得率和含量。
得率![]()
(2)
式中:m1,提取后美国豆芋块茎质量,g;ρ,代入标准曲线计算得到的提取液样品质量浓度,mg/mL;V,定容体积,mL。
1.2.3 有效成分含量测定
总生物碱的测定方法参考文献[14];总糖的测定方法参考文献[15];总皂苷的测定方法参考文献[16];总黄酮的测定方法参考文献[17];异黄酮的测定方法参考文献[18]。
1.2.4 体外抗氧化活性测定
DPPH自由基活性测定参考文献[19];ABTS阳离子自由基活性测定参考文献[20-21];总抗氧化能力测定参考文献[22-23],采用ferric reducing ability of plasma (FRAP)法测定。
1.2.5 α-葡萄糖苷酶抑制活性测定
α-葡萄糖苷酶抑制活性的测定参考文献[24-25]。
1.3 统计分析方法
试验数据采用SPSS 17.0统计软件进行方差分析,图形绘制用Origin 9.0制图。所有试验重复3次后取平均值。
2 结果与分析
2.1 美国豆芋块茎化学成分定性、定量分析
根据化学显色法,定性、定量分析美国豆芋块茎中的化学成分,结果见表1。由表1可知,美国豆芋块茎中含有生物碱类、黄酮类、皂苷类和糖类等化学成分。化学定量分析结果表明,美国豆芋块茎活性成分中总糖含量为0.85%,可能是淀粉类物质较多;总黄酮含量为0.44%,异黄酮含量为0.88%,其黄酮含量略低于银杏叶[26](2.4%)和竹叶[27](2.73%)中黄酮含量;其异黄酮含量较秦巴山区粉葛[28](0.68%)、黑豆[29](0.595%)和大豆[30](0.394%)中异黄酮含量高。目前异黄酮来源主要依靠于大豆,美国豆芋块茎中异黄酮含量是大豆的近3倍,因此,美国豆芋块茎可作为1种新型异黄酮来源食物;生物碱和皂苷含量较低,其皂苷含量比党参皂苷[31](1.638%)低了近1/5。
表1 美国豆芋块茎化学成分定性定量分析
Table 1 Qualitative and quantitative analysis of chemical composition of Apios americana Medikus

检测项目定性试验反应现象反应结果含量(占干基)/(mg·g-1)生物碱类I2-KI反应产生棕色沉淀即为阳性反应+1.299±0.851黄酮类(芦丁计)HCl-镁粉反应溶液呈紫色即为阳性反应+7.432±0.122异黄酮类(染料木苷计)--+8.808±0.112皂苷类醋酐浓H2SO4反应界面产生紫色环即为阳性反应+2.188±0.099糖类Molish反应界面产生紫色环即为阳性反应+8.532±1.023萜类三氯乙酸反应溶液呈红-紫色即为阳性反应-香豆素异羟肟酸铁反应产生蓝-紫色斑点即为阳性反应-醌类Borntrager‘s反应溶液呈樱红色即为阳性反应-
注:“+”表示阳性反应;“-”表示阴性反应
2.2 美国豆芋块茎不同提取物有效成分含量
采用紫外分光光度法对美国豆芋块茎石油醚提取物、甲醇提取物、体积分数50%甲醇提取物和水提取物的有效成分进行测定,结果见表2。由表2可知,利用不同极性溶剂来提取美国豆芋块茎中的有效成分,水提取物的得率较高,说明美国豆芋块茎中可能存在大极性物质,如淀粉等;水提取物总糖含量占比也证实了这一点。生物碱在体积分数50%甲醇提取物中含量最高。甲醇提取物中总皂苷、总黄酮和异黄酮含量均显著高于其他提取物(P<0.05)。
表2 美国豆芋块茎不同提取物有效成分含量 单位:%
Table 2 Active ingredient content of different extracts of Apios americana Medikus tuber

有效成分石油醚提取物甲醇提取物50%甲醇提取物水提取物得率1.59±0.00a6.57±0.03b6.69±0.01c14.35±0.02d总生物碱9.53±0.18a23.70±0.18b25.49±0.27c14.03±0.76d总糖1.18±0.02a12.46±0.13b15.34±0.22c24.70±0.20d总皂苷1.21±0.10a2.35±0.01b0.15±0.01c0.14±0.00d总黄酮(以芦丁计)9.34±0.21a13.32±0.11b0.77±0.00c0.80±0.00c异黄酮(染料木苷计)3.57±0.02a8.58±0.03b3.43±0.01c3.20±0.01d
注:同一行不同字母表示差异显著(P<0.05)(下同)
2.3 美国豆芋不同提取物抗氧化及α-葡萄糖苷酶抑制活性
利用不同的体外抗氧化体系,对美国豆芋块茎石油醚提取物、甲醇提取物、体积分数50%甲醇提取物和水提取物的抗氧化活性进行测定,同时测定其α-葡萄糖苷酶抑制活性能力,结果见表3。
表3 美国豆芋块茎不同提取物抗氧化及α-葡萄糖苷酶活性抑制能力
Table 3 Antioxidant properties and α-glucosidase activity of different extracts of Apios americana Medikus tuber
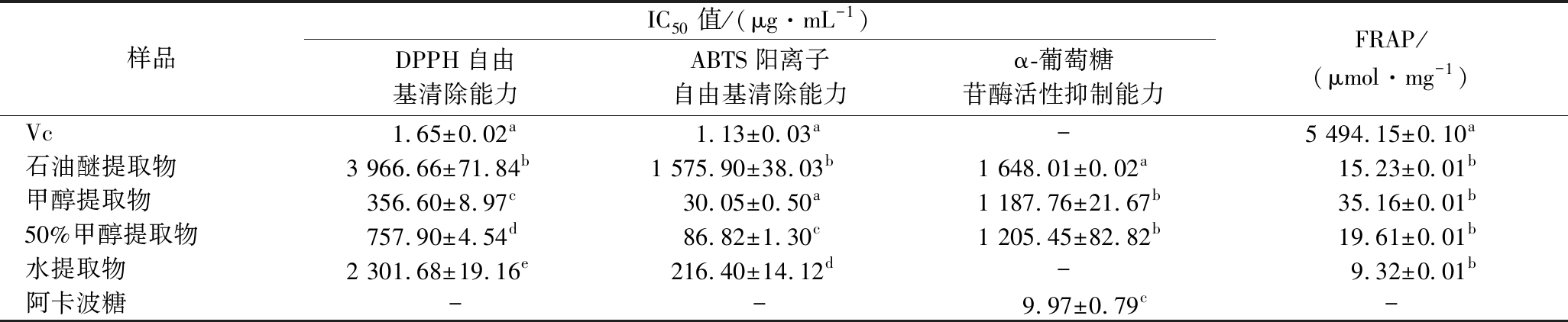
样品IC50值/(μg·mL-1)DPPH自由基清除能力ABTS阳离子自由基清除能力α-葡萄糖苷酶活性抑制能力FRAP/(μmol·mg-1)Vc1.65±0.02a1.13±0.03a-5 494.15±0.10a石油醚提取物3 966.66±71.84b1 575.90±38.03b1 648.01±0.02a15.23±0.01b甲醇提取物356.60±8.97c30.05±0.50a1 187.76±21.67b35.16±0.01b50%甲醇提取物757.90±4.54d86.82±1.30c1 205.45±82.82b19.61±0.01b水提取物2 301.68±19.16e216.40±14.12d-9.32±0.01b阿卡波糖--9.97±0.79c-
注:“-”表示未检出(下同)
在一定线性范围内,美国豆芋块茎不同提取物溶液的DPPH自由基和ABTS阳离子自由基清除率与其自身质量浓度呈正相关,先上升后趋于稳定。美国豆芋块茎不同提取物的抗氧化活性顺序为:VC>甲醇提取物>体积分数50%甲醇提取物>水提取物>石油醚提取物。对比美国豆芋花醇提物的抗氧化能力[32](DPPH自由基清除IC50为861.25 mg/L,ABTS阳离子自由基清除IC50为69.92 mg/L,FRAP值为929.06 mmol/L),美国豆芋块茎甲醇提取物表现出更高的活性。甲醇提取物抗自由基活性显著高于其他提取物(P<0.05),DPPH自由基清除能力的IC50为356.602 μg/mL,ABTS阳离子自由基清除能力的IC50为30.051 μg/mL。4个不同极性提取物中,甲醇提取物和体积分数50%甲醇提取物的α-葡萄糖苷酶活性抑制无显著性差异,石油醚提取物对α-葡萄糖苷酶活性抑制能力表现一般,水提取物未表现出α-葡萄糖苷酶活性抑制。
2.4 美国豆芋块茎甲醇提取物不同分极相有效成分含量
由上述结果可知,美国豆芋块茎甲醇提取物的抗氧化(DPPH自由基清除能力和ABTS阳离子自由基清除能力)活性明显强于其他提取物(P<0.05),甲醇提取物和体积分数50%甲醇提取物的α-葡萄糖苷酶活性抑制无显著差异(P<0.05)。综合考虑后对甲醇提取物进一步分离萃取得石油醚相、乙酸乙酯相、正丁醇相和水相。由表4可知,甲醇提取物不同分极相中正丁醇相得率最高,可能是糖类和生物碱类物质较多。乙酸乙酯相中总皂苷、总黄酮和异黄酮含量与其他分极相存在显著差异(P<0.05),因此,在提取美国豆芋豆芋块茎中总皂苷和黄酮类物质时,可选择乙酸乙酯作为萃取剂,提高提取率。
表4 美国豆芋块茎甲醇提取物不同分极相有效成分含量 单位:%
Table 4 Contents of different fractions of active constituents in methanol extract of Apios americana Medikus tuber

有效成分石油醚相乙酸乙酯相正丁醇相水相得率9.59±0.05a8.97±0.05a44.19±0.83b29.42±0.20c总生物碱24.11±0.17a32.52±0.10b33.68±0.29c9.10±0.20d总糖17.21±0.07a14.77±0.16b27.1±0.40c35.38±0.03d总皂苷3.26±0.00a5.30±0.00b2.98±0.00c1.16±0.00d总黄酮(以芦丁计)4.22±0.03a13.22±0.04b3.49±0.03c0.03±0.01d异黄酮(染料木苷计)5.97±0.02a15.89±0.21b4.71±0.08c3.93±0.07d
2.5 美国豆芋甲醇提取物抗氧化及α-葡萄糖苷酶抑制活性
由表5可知,甲醇提取物不同分极相的抗氧化活性顺序:VC>乙酸乙酯相>石油醚相>正丁醇相>水相。乙酸乙酯相的DPPH自由基清除能力的IC50值为55.573 μg/mL,ABTS阳离子自由基清除能力的IC50值为4.543 μg/mL,FRAP值为50.134 μmol/mg。陈石梅等[33]研究草果醇提物不同极性部位的抗氧化活性顺序与本文相同,乙酸乙酯相表现出最强的抗氧化活性。甲醇提取物不同分极相中,乙酸乙酯相表现出较强的α-葡萄糖苷酶活性抑制能力(IC50值为430.042 μg/mL)。邱珊莲等[34]探究嘉宝果嫩叶提取物不同极性部位的α-葡萄糖苷酶活性抑制能力的发现,乙酸乙酯相(IC50值为8.375 8 g/L)和正丁醇相(IC50值为16.894 3 g/L)的抑制活性最佳。
表5 美国豆芋块茎甲醇提取物不同分极相抗氧化及α-葡萄糖苷酶活性抑制能力
Table 5 Different fractional phase antioxidant and α-glucosidase activity of methanol extract from Apios americana Medikus tuber
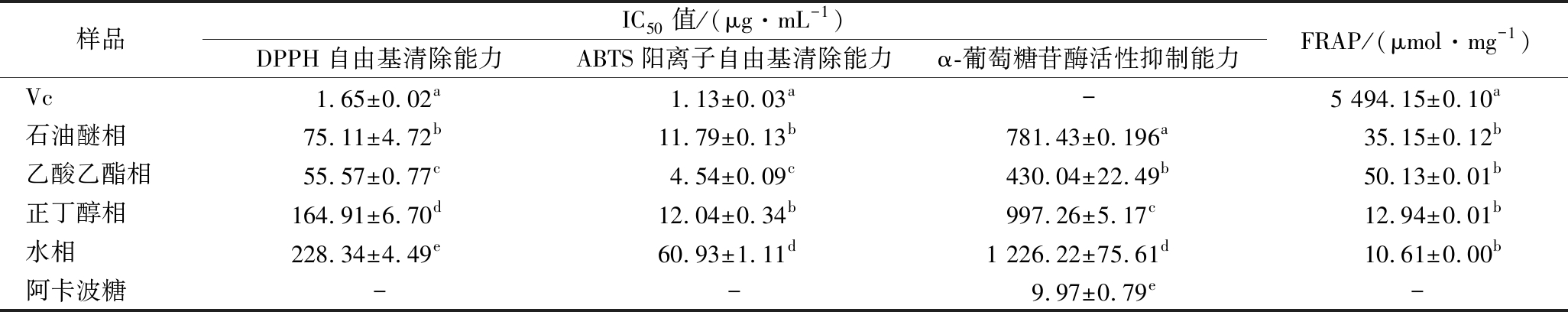
样品IC50值/(μg·mL-1)DPPH自由基清除能力ABTS阳离子自由基清除能力α-葡萄糖苷酶活性抑制能力FRAP/(μmol·mg-1)Vc1.65±0.02a1.13±0.03a-5 494.15±0.10a石油醚相75.11±4.72b11.79±0.13b781.43±0.196a35.15±0.12b乙酸乙酯相55.57±0.77c4.54±0.09c430.04±22.49b50.13±0.01b正丁醇相164.91±6.70d12.04±0.34b997.26±5.17c12.94±0.01b水相228.34±4.49e60.93±1.11d1 226.22±75.61d10.61±0.00b阿卡波糖--9.97±0.79e-
2.6 抗氧化和α-葡萄糖苷酶活性抑制能力的与有效成分的相关性分析
考察美国豆芋块茎甲醇提取物不同分极相中有效成分含量与抗氧化及α-葡萄糖苷酶活性抑制能力的相关性,结果见表6。由表6可知,通过相关性分析,DPPH自由基清除能力与总糖和总皂苷相关性较大,ABTS阳离子自由基清除能力和生物碱和总糖相关性较大。由此可见,总糖和总皂苷对清除DPPH自由基有着重要作用,ABTS阳离子自由基清除能力主要与生物碱和总糖有关。Fe3+还原力与总糖相关性较大。α-葡萄糖苷酶活性抑制能力主要与总糖、总皂苷、总黄酮和异黄酮相关,美国豆芋块茎具有较强的α-葡萄糖苷酶活性抑制能力是其有效成分综合作用所致。美国豆芋醇提物乙酸乙酯含有较多的总生物碱、总皂苷和黄酮类物质,说明美国豆芋块茎醇提物乙酸乙酯相是挖掘抗氧化活性及抑制α-葡萄糖苷酶活性物质的主要极性部位。
表6 抗氧化及α-葡萄糖苷酶活性抑制能力与有效 成分的相关性分析 单位:%
Table 6 Correlation between antioxidant and α-glucosidase inhibitory activity and active ingredients

有效成分DPPH自由基清除能力ABTS阳离子自由基清除能力Fe3+还原能力α-葡萄糖苷酶活性抑制能力总生物碱0.469 80.877 20.221 40.491 8总糖0.999 30.757 60.872 00.905 0总皂苷0.816 00.751 20.789 80.965 4总黄酮0.659 50.514 40.795 00.916 1异黄酮0.515 90.311 20.766 50.812 1
3 结论
美国豆芋块茎中含有丰富的生物碱、总糖、皂苷、黄酮和异黄酮等有效成分。美国豆芋块茎甲醇提取物乙酸乙酯相中总皂苷(5.30%)、总黄酮(13.22%)和异黄酮(15.89%)含量最高,抗氧化活性(DPPH自由基、ABTS阳离子自由基清除能力的IC50值分别为55.573和4.543 μg/mL,FRAP值为50.134 μmol/mg)及α-葡萄糖苷酶抑制活性最强(IC50值为430.042 μg/mL)。相关性分析表明,美国豆芋块茎醇提物乙酸乙酯相是挖掘抗氧化活性及抑制α-葡萄糖苷酶活性物质的主要极性部位。本文为美国豆芋资源的高效利用以及美国豆芋块茎作为天然抗氧化剂和降血糖降血脂功能性食品原料的开发和利用提供科学依据和理论基础。
[1] CARLISI JACKIE, WOLLARD DENNIS. History,culture,and nutrition of Apios americana[J].Journal of Nutraceuticals, Functional & Medical Foods, 2005, 4(3-4):85-92.
[2] ZHANG Y Z, ZHOU C S, TANG S M, et al. Effect of AATI,a Bowman-Birk type inhibitor from Apios americana,on proliferation of cancer cell lines[J].Food Chemistry, 2011, 128(4):909-915.
[3] MIZUKI T, KAZUHIRO N, ETSUO N. Evaluation of biological activities of a groundnut (Apios americana Medik) extract containing a novel isoflavone[J].Food Chemistry, 2013, 138(1):298-305.
[4] IWAI K, MAITSUEH. Ingestion of Apios americana Medikus tuber suppresses blood pressure and improves plasma lipids in spontaneously hypertensive rats[J].Nutrition Research, 2007, 27(4):218-224.
[5] ZHANG Y Z, KOUZUMA Y, MIUAJI T, et al. Purification,characterization,and cDNA cloning of a Bowman-Birk type trypsin inhibitor from Apios americana Medikus tubers[J].Bioscience Biotechnology & Biochemistry, 2008, 72(1):171-178.
[6] BAMES S, WANG C, KIRK M, et al. HPLC-mass spectrometry of isoflavonoids in soy and the American groundnut,Apios americana[J].Flavonoids in Cell Function, 2002, 505(2):77-88.
[7] 杨芸芸, 楚强, 阎芙洁, 等.美国豆芋的营养成分和生理功能[J].中国粮油学报, 2018, 33(6):141-146.
[8] 戚利潮, 杨芸芸, 郑子桓, 等.美国豆芋不同部位生化特征成分分析[J].浙江农业科学, 2016, 57(4):529-534.
[9] YOUSHIKI Y, OKUBO K. Active oxygen scavenging activity of DDMP (2,3-dihydro-2,5-dihydroxy-6-methyl-4 H-pyran-4-one) saponin in soybean seed[J]. Bioscience, Biotechnology, and Biochemistry, 1995, 59(8): 1 556-1 557.
[10] KUNISHISA I, MATSUE H J. Ingestion of Apios americana Medikus tuber suppresses blood pressure and improves plasma lipids in spontaneously hypertensive rats[J].Nutrition Research, 2007, 27(4):218-224.
[11] 安家炜,张有做,高前欣, 等.美国豆芋地上部位有效成分及α-葡萄糖苷酶抑制活性研究[J].核农学报, 2014, 28(12):2 275-2 282.
[12] 陈玉婷, 杨云, 王英华. 常用中药化学鉴定[M].北京:化学工业出版社, 2005.
[13] 郝海燕, 沙爱龙. 硬枝碱蓬化学成分的定性分析及生物碱含量的测定[J].食品科技, 2013, 38(1):244-247.
[14] 戴开金, 罗奇志, 罗佳波, 等.葛根芩连方药中黄连总生物碱的含量测定[J].第一军医大学学报, 2004, 24(4):437-438.
[15] 王晶, 王春国, 李冰, 等.苯酚-硫酸法测定慈姑中多糖的含量[J].吉林中医药, 2017, 37(12):1 258-1 260.
[16] YI C, MINGYONG X, XIAOFENGG. Microwave-assisted extraction used for the isolation of total triterpenoidsaponins from Ganodermaatrum[J].Journal of Food Engineering, 2007, 81(1):162-170.
[17] 郑燕菲, 覃小静, 蔡杰慧. 单性木兰总黄酮的含量测定及提取条件优化[J].南方农业, 2019, 13(14):124-126.
[18] 高燕. 不同大豆中异黄酮含量的差异性分析[J].化学工程与装备, 2019(5):9-11.
[19] PRASHANTKUMAR M, RAVINDRA S, PRIYANKA S, et al. Antifungal,anti-aflatoxigenic,and antioxidant efficacy of Jamrosa essential oil for preservation of herbal raw materials[J].International Biodeterioration & Biodegradation, 2012, 74:11-16.
[20] ROBERTA R, NICOLETTA P, et al. Antioxidant activity applying an improved ABTS radical cationdecolorizationassay[J].Free Radical Biology and Medicine, 1999, 26(9-10):1 231-1 237.
[21] 喻巧容, 黄锁义. 不同极性薏苡仁提取物抗氧化活性研究[J].中国医药导报, 2018, 15(19):20-23.
[22] 和焕香, 郭庆梅, 路欣荣. 忍冬果实抗氧化活性研究[J].山东农业科学, 2019, 51(4):61-64.
[23] TANEVA I, PETKOVA N, et al. Characterization of rose hip (Rosa canina L.) fruits extracts and evaluation of their in vitro antioxidant activity[J].Journal of Pharmacognosy and Phytochemistry, 2016, 5(2):35-35.
[24] DONG Q H, LI M, ZHU F. Inhibitory potentil of trilobatin from Lithocarpus polystachyus Rehd against α-glucosidase and α-amylase linked to type 2 diabetes [J].Food Chemistry, 2012, 130(2):261-266.
[25] 程艳刚, 李国艳, 谭金燕,等.分心木总黄酮体外抗氧化活性及对α-葡萄糖苷酶和α-淀粉酶抑制作用研究[J].辽宁中医药大学学报, 2018, 20(8):22-25.
[26] 冯靖,彭效明,李翠清,等.微波-超声辅助联合提取银杏叶中总黄酮的工艺研究[J].食品研究与开发,2019,40(9):68-75.
[27] 王希,刘水平,成琦,等.响应面法优化超声辅助提取竹叶黄酮工艺[J].广州化工,2018,46(12):75-78;105.
[28] 朱盼,谢娟平,向纪明.Box-Behnken响应面法优化秦巴山区粉葛中总异黄酮的提取工艺[J].食品工业科技,2020,41(1):165-170.
[29] 郭婕,胡利宗,李俐俐,等.黑豆豆芽中大豆异黄酮微波提取工艺研究[J].大豆科学,2015,34(3):493-496.
[30] 张红波,孙婕,申娟利,等.响应面法优化大豆异黄酮的提取工艺[J].食品研究与开发,2014,35(24):60-63.
[31] 乔婧,薛晶晶,高建德,等.星点设计-响应面法优化党参总皂苷提取工艺[J].中兽医医药杂志,2019,38(3):36-42.
[32] 张蕾,周萌,倪勤学,等.大越豆芋花醇提物抗氧化及α-葡萄糖苷酶抑制活性研究[J].浙江林业科技,2014,34(4):5-10.
[33] 陈石梅,黄比翼,黄锁义.草果醇提物不同极性部位的体外抗氧化活性研究[J].中国药房,2020,31(8):953-956.
[34] 邱珊莲,林宝妹,张少平,等.嘉宝果嫩叶提取物不同极性部位抗氧化及抑制α-葡萄糖苷酶活性研究[J].热带作物学报,2019,40(7):1 373-1 378.