核桃,胡桃科植物,又称羌桃、胡桃。其中含大量优质蛋白,人体必需ω-3脂肪酸,多种微量元素,矿物质以及叶酸 (维生素B)、维生素E、胡萝卜素、核黄素等多种维生素[1],营养价值高。核桃粕作为榨油副产物常被用作饲料或丢弃,本实验从核桃粕中提取核桃蛋白质,并进一步制备核桃多肽,同时选取大豆多肽、核桃蛋白等功能因子加入核桃乳中,制备具有抗氧化、抗疲劳功效的功能性核桃乳。
生物活性肽是一种对机体有益的肽类化合物,通常含有3~20个氨基酸残基,可以调节生物体的代谢和生理功能,对人体健康十分有益[2]。目前研究发现了抗菌肽[3]、降压肽[4]、抗氧化肽[5]、抗血栓肽[6]、免疫调节肽[7]、矿物质结合肽[8]、大豆多肽[9]等多种生物活性肽。核桃多肽和大豆多肽均为植物活性多肽,食用安全性高,具有抗疲劳、降血糖、抗氧化、免疫调节等多种生物学功能[10-18]。由于目前核桃多肽、大豆多肽、核桃蛋白等功能因子对小鼠运动耐力影响以及抗疲劳效果通常采用单一的负重游泳实验来进行分析评价,而其抗氧化活性多以体外实验为主,缺乏多途径且完备的分析评价机制,因此对其抗疲劳和抗氧化活性进行深入研究已迫在眉睫。
1 材料与方法
1.1 实验试剂
核桃仁、核桃粕,河北绿岭果业有限公司;大豆多肽粉(肽含量≥80%),北京中食海氏生物技术有限公司;碱性蛋白酶(200 U/mg)、木瓜蛋白酶(800 U/mg),上海源叶生物科技有限公司;乳酸测试盒、肝/肌糖原测试盒、尿素氮测试盒(脲酶法)、丙二醛(malondialdehyde,MDA)测试盒、总抗氧化能力(total antioxidant capacity,T-AOC)测试盒、过氧化氢酶(catalase,CAT)活性测试盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)测试盒、超氧化物歧化酶(superoxide dismutase,SOD)测试盒,南京建成生物工程研究所。
1.2 仪器与设备
Adventurer分析电子天平,美国奥豪斯仪器有限公司;QI-24高通量组织研磨仪,上海启前电子科技有限公司;DEL7A320 pH计,上海展仪仪器设备有限公司;EPOCH2全波长酶标仪,美国博腾仪器有限公司方法;H2050R-1型低温离心机,湖南湘仪仪器有限公司。
1.3 实验材料
核桃蛋白复配核桃乳、核桃多肽复配核桃乳、大豆多肽复配核桃乳由实验室制备。为简化不同种类核桃乳制备工艺,实验首先制备单一核桃乳,再将核桃蛋白粉、核桃多肽粉及大豆多肽粉分别按一定浓度添加到核桃乳中,均质处理后得到不同种类的核桃乳,制备工艺如下:
核桃乳制备:挑选颗粒饱满核桃仁50 g,按照料液比1∶20(g∶mL)加入质量分数为0.5% NaOH溶液,煮沸5 min去皮,胶体磨磨浆20 min,过滤后定容至1 L,调节pH至9,高压均质机均质2次,灌装到密闭玻璃瓶中,121 ℃灭菌20 min,冷却后得到核桃乳,备用。
核桃蛋白复配核桃乳制备:将核桃粕放入55 ℃烘箱烘干,按料液比1∶55(g∶mL)配制成核桃粕溶液,调节pH至8.5,50 ℃超声搅拌60 min,超声功率为150 W,4 500 r/min离心10 min,去油层及下层沉淀,上清液调节pH值至4.5,4 500 r/min离心10 min取沉淀层,将沉淀用去离子水洗至中性,冷冻干燥后得到核桃蛋白粉。根据GB 5009.5—2016测得核桃蛋白粉蛋白含量为83.15%。将核桃蛋白粉以核桃乳作为溶剂复溶,质量浓度为100 mg/mL,高压均质后得到核桃蛋白复配核桃乳。
核桃多肽复配核桃乳制备:称取一定量的核桃蛋白粉,配制成质量分数为2.5%核桃蛋白溶液,60 ℃摇床水浴30 min后,调节pH至7.5,按质量比2∶1的比例加入碱性蛋白酶与木瓜蛋白酶,使最终加酶量为9 000 U/g,60 ℃摇床酶解3 h,沸水浴灭酶10 min后离心取上清液,过分子质量为5 000 Da的透析袋,透析液旋转蒸发浓缩后,冷冻干燥制成核桃多肽粉。通过双缩脲法测得核桃多肽含量为75.43%。将核桃多肽粉用核桃乳作为溶剂复溶,质量浓度为100 mg/mL,高压均质后得到核桃多肽复配核桃乳。
大豆多肽复配核桃乳制备:将大豆多肽粉用核桃乳作为溶剂复溶,质量浓度为100 mg/mL,高压均质后得到大豆多肽复配核桃乳。
1.4 实验动物
昆明小鼠,SPF 级,体质量22~26 g,雄性,河北医科大学所提供。动物分组饲养于12 h明暗交替的鼠房中,鼠房温度为18~21 ℃,相对湿度为(50±5)%,标准饲料饲养,可自由摄食、饮水。
分组处理情况:取雄性小鼠50只,随机分为5组,每组10只,分别为空白组(NC),疲劳模型组(FC),实验组:核桃蛋白复配核桃乳组(WEP)、核桃多肽复配核桃乳组(WPP)、大豆多肽复配核桃乳组(SP)。WEP组、WPP组、SP组分别灌胃5 mL/(kg·d)(按照60 kg成人每天饮用300 mL核桃乳为标准)的核桃蛋白复配核桃乳、核桃多肽复配核桃乳、大豆多肽复配核桃乳,每天灌胃1次,NC组及FC组正常饮水进食,连续灌胃28 d后,小鼠开始进行悬挂、爬杆、游泳、负重游泳4种运动实验,每天完成1种,记录实验数据。各试验组进行游泳运动后,将各组小鼠捞出擦干,摘眼球取血,脱颈处死,测定疲劳与抗氧化等生理生化指标。
小鼠运动性疲劳模型的建立:小鼠采用游泳运动的方式进行疲劳模型的建立,除NC组小鼠,FC组、WEP组、WPP组和SP组小鼠每周进行6次游泳训练,周日休息,每天下午4点开始,每次训练60 min,避免小鼠在水上漂浮偷懒,不时用玻璃棒搅动水面,使小鼠产生疲劳。
1.5 方法
1.5.1 小鼠体质量及脏器指数测定
每周称量并记录小鼠体质量,4周后小鼠脱颈处死,取心、肝、脾、肾、肾周脂肪、睾丸、附睾脂肪称取质量,记录数据。通过公式(1)计算脏器指数:
脏器指数![]()
(1)
1.5.2 悬挂实验
参考文献[19]方法,将小鼠双前肢悬挂在水平电线上,观察小鼠,若2只后肢均能抓住电线,记3分;仅能用1只后肢抓住电线,记2分;2只后肢均不能抓住电线,记1分;小鼠跌落记为0分。
1.5.3 爬杆实验
参考文献[20]方法,小鼠灌胃30 min后,开始爬杆试验,将小鼠悬挂在一长30 cm,直径约0.6 cm的光滑铁杆上端,开始计时,当小鼠肌肉疲劳滑落下来,停止计时,记3次滑落时间之和作为爬杆时间。
1.5.4 游泳实验
参考文献[21]中游泳实验方法:小鼠灌胃30 min 后,放入一个水深约15 cm,水温约25℃的方形游泳箱中,让其自由游泳,若小鼠能够在1 min内持续游泳,记3.0分;30 s以上时间持续游泳仅偶尔漂浮,记2.5分;30 s以上时间漂浮,记2.0分;仅偶尔游泳,记1.5分;持续漂浮,记1.0分,取5次实验结果平均值为小鼠最终得分。
参考文献[22]中负重游泳实验方法:小鼠灌胃30 min后,每只小鼠尾部绑上占体质量5%的小玻璃珠,放入游泳箱开始负重游泳,游泳箱水深约30 cm,水温约25 ℃。将小鼠放入水中开始计时,至小鼠力竭结束计时,力竭标准为小鼠沉入水下7 s不上浮。
1.5.5 疲劳及抗氧化生理生化指标的测定
小鼠血清、骨骼肌或肝脏中乳酸含量,肝/肌糖原含量,尿素氮含量,MDA含量、T-AOC能力、CAT酶活力、GSH-PX酶活力、SOD酶活力均按相对应的试剂盒中的方法测定。
2 结果与分析
2.1 小鼠体质量及脏器指数
小鼠的体质量增长情况及脏器指数反应了小鼠的机体健康状态,小鼠的体质量增长情况见表1,小鼠脏器重质量及脏器指数见表2,在连续灌胃4周后,各组小鼠体质量均呈增长趋势,小鼠体质量增长在试验前、中、末期与NC组相比均无显著性差异(P>0.05,n=10),各脏器质量与脏器指数与NC组相比无显著性差异(P>0.05,n=10),表明灌胃的核桃多肽复配核桃乳、核桃蛋白复配核桃乳及大豆多肽复配核桃乳对小鼠机体均无毒副作用。
2.2 耐力实验
运动耐力的提高是评估抗疲劳活动的重要指标,通过小鼠的运动耐力直接证实了抗疲劳效果[23]。悬挂实验用来测定小鼠的肢体肌力,评分越高,小鼠肢体肌力越强,耐疲劳效果越好。爬杆实验考察了小鼠肌肉对静态力的持久能力,爬杆时间的越长,小鼠的肌肉持久力越长,耐疲劳程度越强。游泳实验考察了小鼠的运动耐力,若小鼠能在水中连续不断地游泳,评分越高,运动耐力越强,抗疲劳效果越显著[24]。负重游泳测试是评估抗疲劳实验运动的模型,用负重游泳时间长短来代表小鼠的疲劳程度[25]。
表1 小鼠体质量变化表 单位:g
Table 1 Body mass change of mice

组别0周1周2周3周4周NC22.84±0.6033.14±1.4936.80±1.3738.36±1.3838.36±1.38FC24.82±2.0933.36±2.6337.44±3.0939.53±2.5240.56±2.22WEP24.84±1.1732.58±2.6533.36±3.2835.73±3.4035.73±3.40WPP24.09±1.9133.98±4.1236.09±3.1139.95±4.4339.95±4.43SP24.73±1.4433.37±3.3537.02±3.1139.69±3.3639.69±3.36
注:表示与NC组比存在显著性差异(P<0.05),**表示与NC组比存在极显著性差异(P<0.01),无标注,表示与NC组比不存在显著性差异(P>0.05)(下同)
表2 小鼠脏器指数 单位:%
Table 2 Mouse organ index
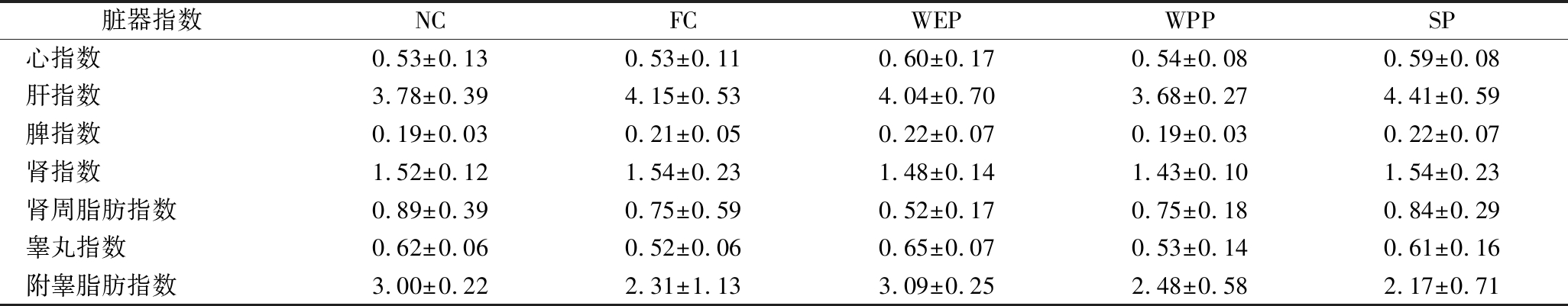
脏器指数NCFCWEPWPPSP心指数0.53±0.130.53±0.110.60±0.170.54±0.080.59±0.08肝指数3.78±0.394.15±0.534.04±0.703.68±0.274.41±0.59脾指数0.19±0.030.21±0.050.22±0.070.19±0.030.22±0.07肾指数1.52±0.121.54±0.231.48±0.141.43±0.101.54±0.23肾周脂肪指数0.89±0.390.75±0.590.52±0.170.75±0.180.84±0.29睾丸指数0.62±0.060.52±0.060.65±0.070.53±0.140.61±0.16附睾脂肪指数3.00±0.222.31±1.133.09±0.252.48±0.582.17±0.71
由图1-a可知,各组悬挂评分排序为:WPP组2.8分>SP组2.5分>WEP组2.4分>NC组2.3分>FC组2.1分。WPP组悬挂评分与FC组相比存在显著性差异(P<0.05,n=10),表明核桃多肽复配核桃乳有效提高了小鼠的肢体肌力。由图1-b可知, WEP、WPP、SP组与FC组相比显著延长了小鼠的爬杆时间,爬杆时间分别是FC组的2.15、2.70、2.28倍,表明3种复配核桃乳提高肌肉对静态力的持久能力效果显著,肌肉耐疲劳程度顺序为WPP组>SP组>WEP组。由图1-c可知,各组游泳评分排序为:WPP组2.60分>SP组2.40分>WEP组2.36分>NC组2.05分>FC组1.75分,WPP组相与NC组比差异极显著, WPP、SP组与FC组相比差异显著,3种复配核桃乳均在一定程度上提高了小鼠的运动耐力,核桃多肽及大豆多肽复配核桃乳耐疲劳效果更显著。由图1-d可知,WEP、SP组与NC组比差异不显著,WPP组与NC组比差异极显著,WEP、WPP、SP 组与FC组相比均能极显著延长小鼠的负重游泳时间,分别是FC组的2.57、3.53、2.69倍,3种复配核桃乳均能有效增强小鼠的抗疲劳能力,耐疲劳程度顺序为WPP组>SP组>WEP组。

a-小鼠悬挂评分;b-小鼠爬杆时间;c-小鼠游泳实验评分;d-鼠负重游泳时间,(x±s,n=10)
图1 耐力实验
Fig.1 Endurance test 注:*表示与FC组比存在显著性差异(P<0.05),**表示与FC组比存在极显著性差异(P<0.01); #表示与NC组比存在显著性差异(P<0.05),##表示与NC组比存在极显著性差异(P<0.01)(下同)
2.3 疲劳生理生化指标测定
在进行高强度、长时间运动时,机体中的糖进行无氧酵解产生大量的乳酸从而获得足够能量,乳酸的含量可以反映组织供氧和代谢状态,是评价机体疲劳的一个重要指标[26-27]。由表3可知,WEP、WPP、SP各实验组血清和骨骼肌中乳酸含量与FC组相比均极显著降低(P<0.01),血清中各组分别降低了32.60%、37.81%、35.20%,骨骼肌中各组分别降低了20.00%、37.20%、24.72%,说明各实验组均能够增强乳酸的有氧代谢活动[28],缓解机体的疲劳状态;血清尿素氮是评价机体疲劳的另一个重要的指标,由表3可知,WEP、WPP、SP组与FC组相比血清尿素氮的含量均极显著降低,分别降低了15.03%、39.40%、19.62%,表明3种复配核桃乳均能够有效清除血清尿素氮的累积,降低运动过程中对机体造成的损伤,乳酸和尿素氮代谢效果依次为:WPP组>SP组>WEP组。
表3 疲劳生理生化指标
Table 3 Fatigue physiological and biochemical indicators
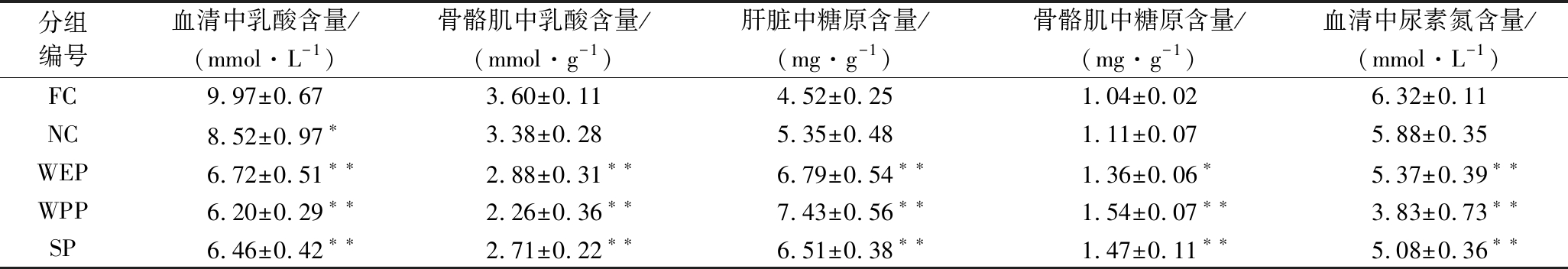
分组编号血清中乳酸含量/(mmol·L-1)骨骼肌中乳酸含量/(mmol·g-1)肝脏中糖原含量/(mg·g-1)骨骼肌中糖原含量/(mg·g-1)血清中尿素氮含量/(mmol·L-1)FC9.97±0.67 3.60±0.11 4.52±0.25 1.04±0.02 6.32±0.11NC8.52±0.97∗3.38±0.28 5.35±0.48 1.11±0.07 5.88±0.35 WEP6.72±0.51∗∗2.88±0.31∗∗6.79±0.54∗∗1.36±0.06∗5.37±0.39∗∗WPP6.20±0.29∗∗ 2.26±0.36∗∗7.43±0.56∗∗1.54±0.07∗∗3.83±0.73∗∗SP6.46±0.42∗∗2.71±0.22∗∗6.51±0.38∗∗1.47±0.11∗∗5.08±0.36∗∗
肝/肌糖原的储量是产生疲劳的决定性因素,当机体需要供能时,肝/肌糖原可以迅速供给以满足机体需求[29],两者含量的高低与机体抗疲劳能力成正相关。由表3可知,WEP、WPP、SP组中肝糖原含量与FC相比有极显著性差异,分别为FC组的1.50、1.64、1.44倍,说明高强度耐力运动使FC组小鼠肝糖原的消耗大于积累,导致运动组小鼠肝糖原的耗竭,而WEP、WPP、SP各实验组肝糖原含量充足,其中WPP组含量最高7.43 mg/g,差异最为显著,小鼠运动耐力最强;肌肉中的糖以肌糖原的形式储存,在机体剧烈运动大量消耗血糖时,肌糖原开始分解,提供能量[30]。WEP、WPP和SP组的肌糖原含量与FC组比有显著差异,分别提高了1.31、1.48、1.41倍,其中WPP组肌糖原含量最高达1.54 mg/g,肌糖原供应充足,有效提高了小鼠运动耐力。
2.4 抗氧化生理生化指标测定
2.4.1 SOD酶活力的测定
活性氧(reactive oxygen species,ROS)和抗氧化剂分子之间的不平衡引起氧化应激反应,氧化应激和ROS是引起机体运动疲劳最重要原因,尤其是骨骼肌中的氧化失衡会导致肌肉疲劳增加[31]。因此,提高体内抗氧化酶的活性,进而增强机体的防御机制,能够起到抗疲劳的作用[32]。SOD能够有效清理超氧阴离子自由基,通过抵消氧化应激来缓解疲劳[33]。由图2可知,小鼠血清、肝脏和骨骼肌中FC组与NC组比SOD酶活力均极显著降低,疲劳模型成立;小鼠血清、肝脏和骨骼肌中各实验组SOD酶活力与NC组相比,WEP、SP组均无显著性差异,WPP组SOD酶活力有极显著升高趋势,3组均有效提高了疲劳小鼠体内SOD酶活力,能有效清除超氧阴离子自由基。WEP、WPP、SP 组SOD酶活力与FC组相比均呈明显升高趋势,血清中分别升高0.24、0.37、0.30倍,肝脏中分别升高0.20、0.30、0.26倍,骨骼肌中分别升高0.37、0.48、0.39倍,均有极显著差异。表明3种复配核桃乳均可有效提高小鼠耐力运动后肝脏SOD酶活力,对提高SOD酶活力影响顺序依次为WPP>SP>WEP。
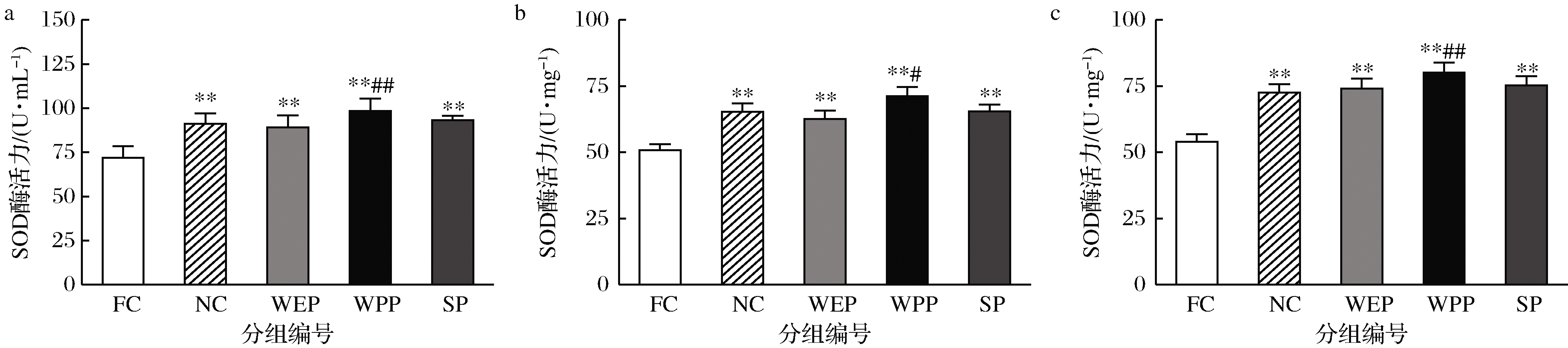
a-血清;b-肝脏;c-骨骼肌
图2 核桃蛋白乳、核桃多肽乳和大豆肽乳对小鼠SOD活力的影响
Fig.2 Effects of walnut protein milk, walnut polypeptide milk and soy peptide milk on SOD activity in mice
2.4.2 GSH-PX酶活力的测定
由图3可知,小鼠血清、肝脏和骨骼肌中FC组与NC组相比,GSH-PX酶活力均极显著降低,分别降低了51.3%、36.6%、52.0%,疲劳模型成立;小鼠血清、肝脏和骨骼肌中WEP、WPP、SP各实验组的 GSH-PX酶活力与NC组相比均有升高趋势,WPP组GSH-PX酶活力均有极显著差异,WEP组差异均不显著,SP组在血清及肝脏中GSH-PX酶活力差异显著,骨骼肌中差异不显著,3组均有效提高了疲劳小鼠体内的 GSH-PX酶活力。WEP、WPP、SP 组GSH-PX酶活力与FC组比均呈明显升高趋势,血清中GSH-PX酶活力分别提高2.13、2.70、2.48倍,肝脏中分别提高1.74、1.94、1.87倍,骨骼肌中分别提高2.16、2.58、2.27倍,均有极显著差异。表明3种复配核桃乳均可提高耐力运动后疲劳小鼠体内的 GSH-PX酶活力,有较强的清除ROS的能力,可以有效缓解机体运动后的疲劳感,对提高GSH-PX酶活力影响顺序依次为WPP>SP>WEP。
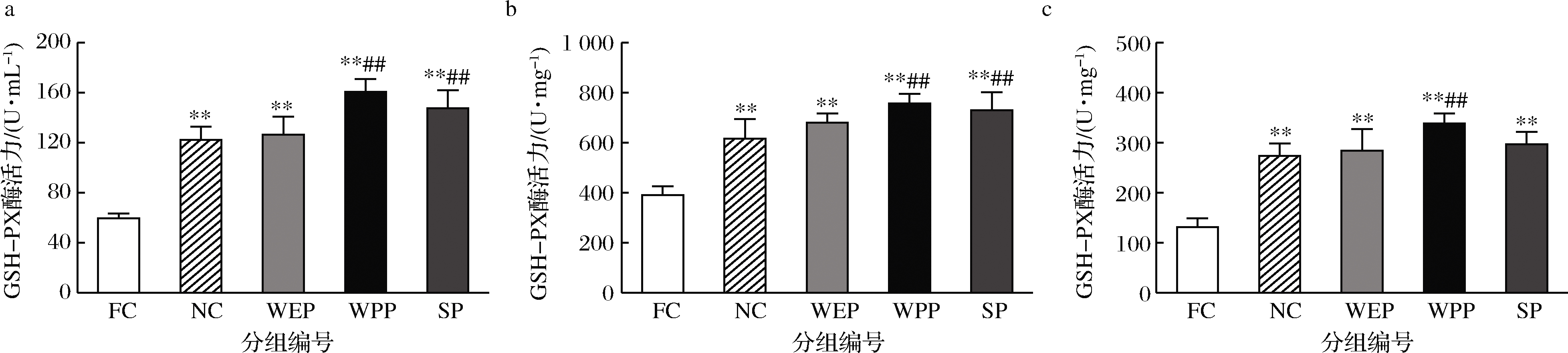
a-血清;b-肝脏;c-骨骼肌
图3 核桃蛋白乳、核桃多肽乳和大豆肽乳对小鼠GSH-PX活力的影响
Fig.3 Effects of walnut protein milk, walnut polypeptide milk and soy peptide milk on the activity of GSH-PX in mice
2.4.3 CAT酶活力的测定
由图4可知,小鼠血清、肝脏和骨骼肌中FC组与NC组相比,CAT酶活力均极显著降低,分别降低了38.0%、55.1%、61.8%,疲劳模型成立;小鼠血清、肝脏和骨骼肌中WEP组与NC组比CAT酶活力均无显著性差异,WPP组与NC组比CAT酶活力均有极显著升高趋势,SP组与NC组比CAT酶活力在血清中差异显著,肝脏和骨骼肌中差异不显著,WEP、WPP、SP 组对疲劳小鼠体内CAT酶活力的升高有明显促进作用。WEP、WPP、SP 组CAT酶活力与FC组相比均呈明显升高趋势,差异极显著,血清中GSH-PX酶活力分别提高1.86、2.13、2.00倍,肝脏中分别提高2.46、2.71、2.47倍,骨骼肌中分别提高3.01、3.99、2.63倍。表明3种复配核桃乳均能有效分解过氧化物,阻断过氧化链,缓解氧化应激导致的机体疲劳,对提高CAT酶活力影响顺序依次为WPP>SP>WEP。
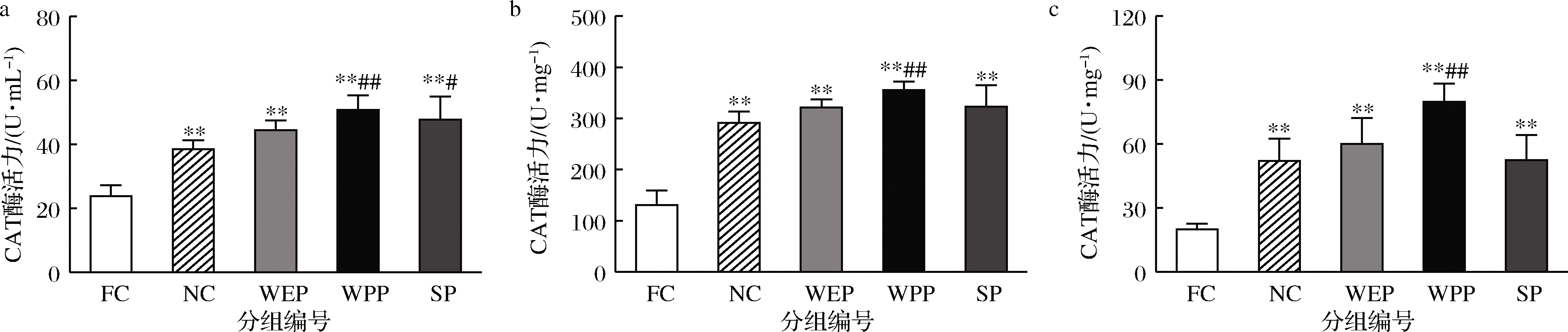
a-血清;b-肝脏;c-骨骼肌
图4 核桃蛋白乳、核桃多肽乳和大豆肽乳对小鼠CAT活力的影响
Fig.4 Effects of walnut protein milk, walnut polypeptide milk and soy peptide milk on CAT activity in mice
2.4.4 MDA含量的测定
MDA是自由基作用于脂质发生过氧化反应的氧化终产物,具有细胞毒性,自由基过量积累能够与核酸、膜脂、细胞蛋白等反应导致机体氧化损伤,因此细胞的受脂质氧化的损伤程度可以通过 MDA 的含量反映出来[34]。由图5可知,小鼠血清、肝脏和骨骼肌中FC组与NC组比MDA含量急剧上升,分别为NC组的2.02、2.95、1.81倍,有极显著性差异(P<0.01),疲劳模型成立;WEP、WPP、SP 各组MDA含量与NC组相比,WPP组在血清、肝脏及骨骼肌中均无显著性差异(P>0.05),SP组在肝脏和骨骼肌中无显著性差异。WEP、WPP、SP 3组MDA含量与FC组比均呈明显降低趋势,血清中分别下降34.1%、49.0%、43.1%,肝脏中分别下降49.8%、64%、61%,骨骼肌中分别下降20.8%、37.9%、34.3%,均有极显著差异。表明3种复配核桃乳均可降低小鼠剧烈运动后血清及脏器中 MDA的含量,加速MDA的及时清除,避免机体产生氧化损伤,对MDA清除效果强弱顺序依次为WPP>SP>WEP。
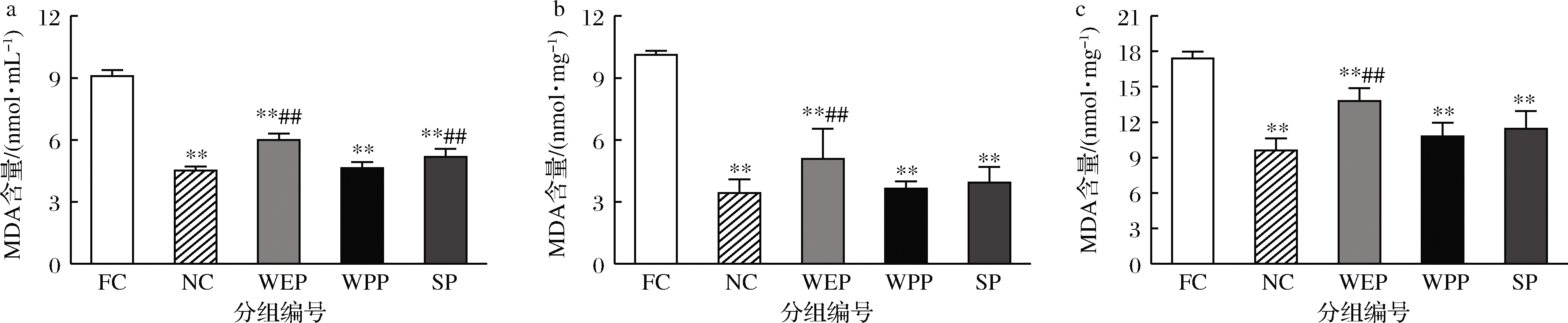
a-血清;b-肝脏;c-骨骼肌
图5 核桃蛋白乳、核桃多肽乳和大豆肽乳对小鼠MDA含量的影响
Fig.5 Effects of walnut protein milk, walnut polypeptide milk and soy peptide milk on MDA content in mice
2.4.5 T-AOC的测定
图6比较了各组在血清、肝脏及骨骼肌中的T-AOC。小鼠血清、肝脏和骨骼肌中FC组与NC组比T-AOC均极显著降低,分别降低了38.3%、77.4%、90.3%,疲劳模型成立;小鼠血清、肝脏和骨骼肌中WEP、WPP、SP 组与NC组比T-AOC均无显著性差异,表明3种复配核桃乳均有效提高了疲劳小鼠体内总抗氧化能力。WEP、WPP、SP 组T-AOC与FC组比呈明显升高趋势,血清中T-AOC分别提高1.76、2.04、1.64倍,肝脏中分别提高2.34、6.58、3.69倍,骨骼肌中分别提高8.35、14.31、12.22倍,对提高疲劳小鼠体内总抗氧化能力影响顺序依次为WPP>SP>WEP。
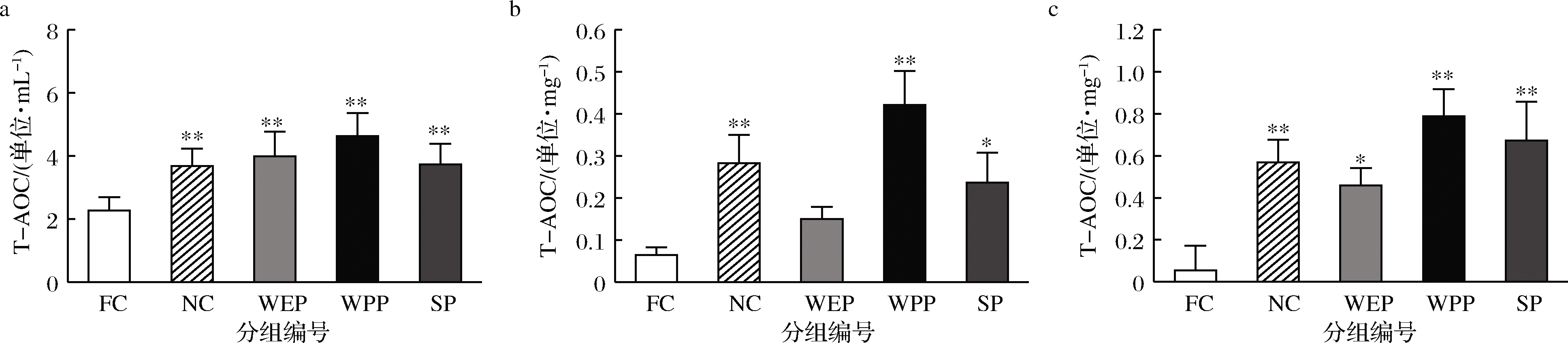
a-血清;b-肝脏;c-骨骼肌
图6 核桃蛋白乳、核桃多肽乳和大豆肽乳对小鼠T-AOC的影响
Fig.6 Effect of walnut protein milk, walnut peptide milk and soybean peptide milk on mouse T-AOC 注:在37 ℃时,每分钟每毫克血清或组织蛋白是反应体系的吸光度值每增加0.01时,为一个总抗氧化能力单位
3 结论
3种复配核桃乳均能一定程度上提高小鼠的运动耐力,有一定的抗疲劳效果,其中核桃多肽复配核桃乳的抗疲劳效果更为显著。3种复配核桃乳均能显著增强小鼠血清和骨骼肌中乳酸的有氧代谢活动,清除血清尿素氮的累积,提高肝糖原和肌糖原含量,其中核桃多肽复配核桃乳代谢乳酸效果最显著。3种复配核桃乳均可降低小鼠剧烈运动后血清及脏器中 MDA的含量,加速MDA的及时清除,均有较强的 GSH-PX,CAT及SOD酶活力,可以有效清除体内的ROS,其中WPP组抗氧化酶活力最强,总抗氧化能力最强,抗氧化效果最好。本研究结果将为未来功能性核桃乳的开发与应用奠定理论基础。
[1] 杨美娟,马宏.核桃饼粕质量指标的检测与分析[J].农产品加工,2019(18):46-48.
[2] CRAIK D J, FAIRLIE D P, LIRAS S, et al. The future of peptide-based drugs[J]. Chemical Biology and Drug Design, 2013,81(1): 136-147.
[3] CARRILLO W, LUCIO A, GAIBOR J, et al. Isolation of antibacterial hydrolysates from hen egg white lysozyme and identification of antibacterial peptides[J]. Journal of Medicinal Food, 2018, 21(8): 208-818.
[4] PENGYING L, XIONGDIAO L, DANKUI L, et al. Isolation and characterization of angiotensin I-converting enzyme (ACE) inhibitory peptides from the enzymatic hydrolysate of Carapax trionycis (the shell of the turtle Pelodiscus sinensis)[J]. Journal of Agricultural and Food Chemistry, 2018, 66(27):7 015-7 022.
[5] 周梅, 张敏. 米糠蛋白抗氧化活性肽的制备[J]. 天然产物研究与开发, 2012, 24(6): 793-799.
[6] NAGAOKA S. Mystery of cholesterol-lowering peptides, lactostatin and soystatin[J]. Journal of Agricultural & Food Chemistry, 2018, 66(16):3 993-3 994.
[7] HOU H, FAN Y, LI B, et al. Purification and identification of immunomodulating peptides from enzymatic hydrolysates of Alaska pollock frame[J]. Food Chemistry, 2012, 134(2):821-828.
[8] CHAROENPHUN N, CHEIRSILP B, SIRINUPONG N, et al. Calcium-binding peptides derived from tilapia (Oreochromis niloticus) protein hydrolysate[J]. European Food Research and Technology, 2013, 236(1): 57-63.
[9] 王升光,于帅,孟凡刚,等.酶法制备大豆肽的相对分子量分布及降压作用研究[J].食品工业科技, 2018, 39(1):46-51.
[10] 贾靖霖,蒲云峰,李虎,等.核桃多肽抗疲劳作用的研究[J].食品工业科技, 2014, 35(7): 340-342.
[11] 李丽,黄雪梦,杨璐嘉,等.采用2种降糖模型考察核桃蛋白及多肽的降糖作用[J].食品科技, 2017, 42(4):218-221.
[12] 许典,吕佼,于超,等.低分子质量核桃多肽抗氧化及抗肿瘤活性研究[J].中国粮油学报, 2015, 30(11):65-69;75.
[13] 李汉洋, 李建杰, 王帅,等. 核桃多肽的抗氧化活性及其分子量、氨基酸组成特性研究[J].食品工业科技, 2018,39(13): 1-7; 13.
[14] CHEN H, ZHAO M, LIN L,et al. Identification of antioxidative peptides from defatted walnut meal hydrolysate with potential for improving learning and memory[J]. Food Research International, 2015, 78: 216-223.
[15] KIM D I, KIM K S. Walnut extract exhibits anti-fatigue action via improvement of exercise tolerance in mice[J]. Laboratory Animal Research, 2013, 29(4): 190-195.
[16] FANG L,REN D, CUI L,et al. Antifatigue,antioxidant and immunoregulatory effects of peptides hydrolyzed from manchurian walnut(Juglans mandshurica Maxim.) on mice[J]. Grain & Oil Science and Technology,2018,1(1):44-52.
[17] 陈湘宁, 张艳艳, 范俊峰,等.大豆多肽的凝胶性及抗氧化性研究[J].食品科学,2005,26(5):71-75.
[18] 荣建华.大豆多肽及其生物活性的研究[D].武汉:华中农业大学,2001:30-31.
[19] WANG E S, ZHANG X P, YAO H B, et al. Tetranectin knockout mice develop features of parkinson disease[J]. Cellular Physiology and Biochemistry,2014,34(2):277-287.
[20] 李振宇,孙志新,舒尊鹏,等.三参颗粒对小鼠耐缺氧及抗疲劳能力的影响[J].中医药信息,2016,33(1):5-7.
[21] 韩英,刘楠,黄慧玲,等.康复训练对帕金森病小鼠运动能力的影响[J].河北医科大学学报,2013,34(5):559-561.
[22] LI J, SUN Q, MENG Q, et al. Anti-fatigue activity of polysaccharide fractions from Lepidium meyenii Walp. (maca)[J]. International Journal of Biological Macromolecules,2017,95:1305-1311.
[23] BELLUARDO N, WESTERBLAD H, MUD G, et al, et al.Neuromuscular junction disassembly and muscle fatigue in mice lacking neurotrophin-4[J]. Molecular and Cellular Neuroscience,2001,18(1):56-67.
G, et al, et al.Neuromuscular junction disassembly and muscle fatigue in mice lacking neurotrophin-4[J]. Molecular and Cellular Neuroscience,2001,18(1):56-67.
[24] TANAKA M, NAKAMURA F, MIZOKAWA S, et al. Establishment and assessment of a rat model of fatigue[J]. Neuroscience Letters, 2003,352:159-162.
[25] ZHANG Y, YAO X B, BAO B L, et al. Anti-fatigue activity of a triterpenoid-rich extract from Chinese bamboo shavings (Caulis bamfusae in taeniam) [J]. Phytotherapy Research, 2006,20(10):872-876.
[26] SHAHAB R L, LUTERBACHER J S, BRETHAUER S, et al. Consolidated bioprocessing of lignocellulosic biomass to lactic acid by a synthetic fungal-bacterial consortium.[J]. Biotechnology & Bioengineering, 2018, 115(5):1 207-1 215.
[27] HO C-S, TANG Y-T, KUNG W-M, et al. Effect of Coriolus versicolor mycelia extract on exercise performance and physical fatigue in mice[J]. International Journal of Medical Sciences, 2017, 14(11):1 110-1 117.
[28] HSU C C, HO M C, LIN L C,et al.American ginseng supplementation attenuates creatine kinase level induced by submaximal exercise in human beings[J].World Journal of Gastroenterology,2005,11(34):47-53.
[29] WANG M,AN L. Effects of Plantago major L.seeds extract on endurance exercise capacity in mice[J].Journal of Medicinal Plants Research,2011,5(9):1 659-1 663.
[30] KANG N, KIM S Y, RHO S, et al. Anti-fatigue activity of a mixture of seahorse (Hippocampus abdominalis) hydrolysate and red ginseng[J]. Fisheries and Aquatic Sciences, 2017, 20(1):3.
[31] FAN H, TAN Z, HUA Y, et al. Deep sea water improves exercise and inhibits oxidative stress in a physical fatigue mouse model[J]. Biomedical Reports,2016,4:751-757.
[32] WANG L, ZHANG H,LU R,et al. The decapeptide CMS001 enhances swimming endurance in mice[J]. Peptides,2008,29(7):1 176-1 182.
[33] NAM S Y, KIM H M, JEONG H J. Anti-fatigue effect by active dipeptides of fermented porcine placenta through inhibiting the inflammatory and oxidative reactions[J]. Biomedicine & Pharmacotherapy, 2016,84:51-59.
[34] KANG N, KO S C, SAMARAKOON K, et al. Purification of antioxidative peptide from peptic hydrolysates of Mideodeok (Styela clava) flesh tissue[J]. Food Science and Biotechnology,2013,22(2):541-547.