东海海参是中国常见可食用海参的一种,又称东海乌参、茄参、香参等,学名海地瓜(Acaudina molpadioidea),属于芋参目,尻参科,主要分布在我国的东海海域,储量大约为100万t[1-2],研究表明,东海海参基本营养成分和刺参相似[3],且含有硫酸多糖、皂苷、脑苷脂等多种生物活性成分[4-6],具有减肥、抑制胰岛素抵抗、抗肿瘤、改善阿尔兹海默症等功能活性[7-9]。然而由于东海海参皮质坚硬,难加工,外观不如刺参等因素导致长期未得到有效利用,甚至导致了区域性的海洋生物灾害问题[10],急需开发利用。
东海海参性腺是海参卵和精的组织部分,在海参加工过程中,大部分作为下脚料直接丢弃,造成了资源浪费和环境污染。海参性腺与海参体壁相比,不仅含有相同的活性物质,且部分营养成分含量更高,如多糖、精氨酸、虾青素、脑苷脂及多种微量元素等[11]。目前对海参性腺的研究较少,仅停留在海参性腺的酶解工艺优化及抗氧化活性方面[12-14],对东海海参性腺提取液的生物活性研究尚未见有报道。本文以利用丙酮对东海海参性腺进行提取,通过体外实验,研究丙酮提取物(Am-GE)对肿瘤细胞增殖和凋亡以及对巨噬细胞炎症反应的影响,以期为东海海参性腺的高值化利用和食品开发提供理论研究基础。
1 材料与方法
1.1 材料
1.1.1 海参和细胞株
东海海参由乐清市海洋生物保健品有限公司提供,捕捞于宁波至温州近海海域,24 h内冷藏运至实验室。人肝癌细胞HepG2、人结肠癌细胞Caco-2、小鼠巨噬细胞RAW264.7,购自中山大学实验动物中心,分别以RPMI-1640完全培养基(含10%新生牛血清、100 U/mL青霉素和100 μg/mL硫酸链霉素)培养。细胞均在37℃、5% CO2孵箱中培养。HepG2和Caco-2细胞以0.25%的胰蛋白酶消化传代,HepG2细胞平均2~3 d传代1次,Caco-2细胞平均4~5 d传代1次;RAW264.7细胞以冷PBS吹打后进行传代,平均2~3 d传代1次。
1.1.2 实验原料及试剂
PRMI-1640完全培养基、新生牛血清,购自美国Gibco公司;胰蛋白酶、MTT,购自美国Amresco公司;青霉素、硫酸链霉素,购自美国Sigma公司;Maxima SYBR Green qRT-PCR Master mix,购自加拿大Fermentas公司;TRIzol,购自美国Invitrogen公司;M-MLV,购自美国Promega公司;Annexin V-FITC凋亡检测试剂盒、PI细胞凋亡染色试剂盒,购自碧云天生物公司。其他试剂均为国产分析纯。
1.1.3 实验仪器
超净工作台(DL-CJ-1N型),北京东联哈尔仪器制造有限公司产品;GL-20M型高速冷冻离心机,上海卢湘离心机仪器有限公司产品; Model680型酶标仪、iCycler iQ5系统Real-Time PCR扩增仪,美国Bio-Rad产品; LABOROTA 4000型旋转蒸发仪,德国Heidolph产品;BD FACSCanto Ⅱ流式细胞仪,美国Becton Dickinson公司。
1.2 方法
1.2.1 东海海参性腺提取物(Am-GE)制备
新鲜东海海参清洗后,沿肛门用剪刀剖开机体,分离性腺,洗净,取东海海参性腺样品(以下提取步骤均按照1 g 样品计算),加入30 mL丙酮,利用高速匀浆机均质后,于室温下搅拌提取2 h,75 00×g离心15 min,取上清液,残渣加入20 mL丙酮在相同条件下重复提取1次,两次提取液合并,用旋转蒸发仪进行减压浓缩,冷冻干燥得Am-GE,置于4℃保存,备用。
1.2.2 HepG2和Caco-2细胞增殖检测
取对数生长期的HepG2和Caco-2细胞,以完全培养基调整为2×104个/mL后接种于96孔培养板。细胞贴壁培养24 h后,吸弃培养基,加入不同浓度的Am-GE(终浓度分别为0.1、0.2、0.4、0.6、0.8、1 mg/mL),每孔200 μL,每个浓度3个复孔。于37℃、5%CO2条件下分别培养24、48和72 h。培养结束后弃去培养基,加入0.5 mg/mL的MTT液。继续培养4 h,加入酸化异丙醇,吹打至蓝色结晶物完全溶解,测定570 nm处吸光值,以[(Am-GE组吸光值)/(空白对照组吸光值)]×100%表示不同浓度的Am-GE处理下细胞的存活率。并以拟合曲线求出半数抑制浓度(IC50),重复实验4次。
1.2.3 HepG2细胞凋亡检测
将Am-GE配制成质量浓度为0、0.25、0.5、0.75 mg/mL,以0 mg/mL为对照组,分别处理HepG2细胞24 h后,收集细胞利用Annexin V-FITC凋亡检测试剂盒进行检测,利用流式细胞仪测定,重复实验3次。
1.2.4 HepG2细胞周期检测
将Am-GE配制成质量浓度为0、0.25、0.5、0.75 mg/mL,以0 mg/mL为对照组,分别处理HepG2细胞24 h后,收集细胞,75%乙醇固定过夜,经PI细胞凋亡染色试剂盒染色后进行流式细胞仪测定,重复实验3次。
1.2.5 Caco-2细胞成瘤能力检测
将Am-GE配制成质量浓度为0、0.1、0.2、0.3 mg/mL,以0 mg/mL为对照组,分别处理Caco-2细胞7 d,用4%多聚甲醛固定细胞,用Gimsa染色后拍照,重复实验3次。
1.2.6 RAW264.7细胞炎症因子基因mRNA表达检测
取对数生长期的RAW264.7细胞,以完全培养基调整为2×104个/mL后接种于6孔培养板。细胞贴壁培养24 h后,吸弃培养基,1组细胞加入不含LPS的完全培养基,其他5组细胞均入LPS终浓度为100 ng/mL的完全培养基,在加入LPS的细胞中,同时加入终浓度分别为0.1、0.2、0.4、0.6、0.8、1 mg/mL的Am-GE,每个浓度3个复孔。于37℃、5%CO2条件下分别培养24、48 和72 h。
采用实时荧光定量PCR方法(quantitative real-time PCR, qRT-PCR)检测Am-GE对RAW264.7细胞TNF-α、IL-1β、IL-6和iNOS mRNA表达的影响。取小鼠肝脏0.1 g,加入150 mL TRIzol,低速匀浆破碎细胞,提取总RNA。取1 μg 总RNA逆转录成cDNA,之后于25 mL 的反应体系中进行PCR扩增,各反应物及用量为:cDNA模版 6 μL(稀释5倍),Maxima SYBR Green qRT-PCR Master mix 12.5 μL,上、下游引物各0.3 μL,超纯水5.9 μL。反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸30 s,共42个循环,炎症因子基因均以β-actin作为内参校正,将正常不添加LPS和Am-GE的RAW264.7细胞组定为1个单位。如表1所示,各目的基因引物序列使用Primer Premier 6.0设计,由上海生工生物工程有限公司合成。
表1 PCR研究中炎症信号因子基因引物序列
Table 1 PCR primers used in inflammatory factors gene for PCR research

基因上游引物下游引物TNF-α5'-CTGTGAAGGGAATGGGTGTT-3'3'-CTGGAAAGGTCTAAGAAGGGAC-5'IL-1β5'-CTCGGCCAAGACAGGTCGCTC-3'3'-GGATCGACAGTTGCACACCCCC-5'IL-65'-TTCTTGGGACTGATGCTG-3'3'-TTGTTCTTTCTGTTTCGGTC-5'iNOS5'-GGACCACCTCTATCAGGAA-3'5'-CCTCATGATAACGTTTCTGGC-3'β-actin5'-CAAGGCATTGCTGACAGGATG-3'3'-GGTCGTCTACACCTAGTCGT-5'
2 结果与分析
2.1 Am-GE对HepG2和Caco-2细胞增殖的影响
如图1所示,随着Am-GE浓度的增加,HepG2和Caco-2的细胞活性逐渐下降。对于HepG2细胞,当Am-GE浓度低于0.8 mg/mL时,24、48和72 h的时间处理对其活性影响不显著(P>0.05),当Am-GE浓度大于等于0.8 mg/mL时,72 h的时间处理比24 h和48 h对其活性的抑制更加显著(P<0.05),表明Am-GE显著抑制了HepG2细胞生长,且有明显的剂量效应关系,但总体来说Am-GE对其生长的抑制作用时间依赖性不显著。对于Caco-2,Am-GE浓度为0.1、0.2、0.4和0.5 mg/mL时,Caco-2细胞活性抑制率在72 h均显著高于24 h;Am-GE浓度为0.8和1.0 mg/mL时,Caco-2细胞活性抑制率72 h显著高于48 h,两者均显著高于24 h,具有时间依赖性,表明Am-GE显著抑制了Caco-2细胞生长,且有明显的剂量效应关系和时间效应关系。以上结果表明Am-GE能有效地抑制HepG2和Caco-2肿瘤细胞的增殖活性。
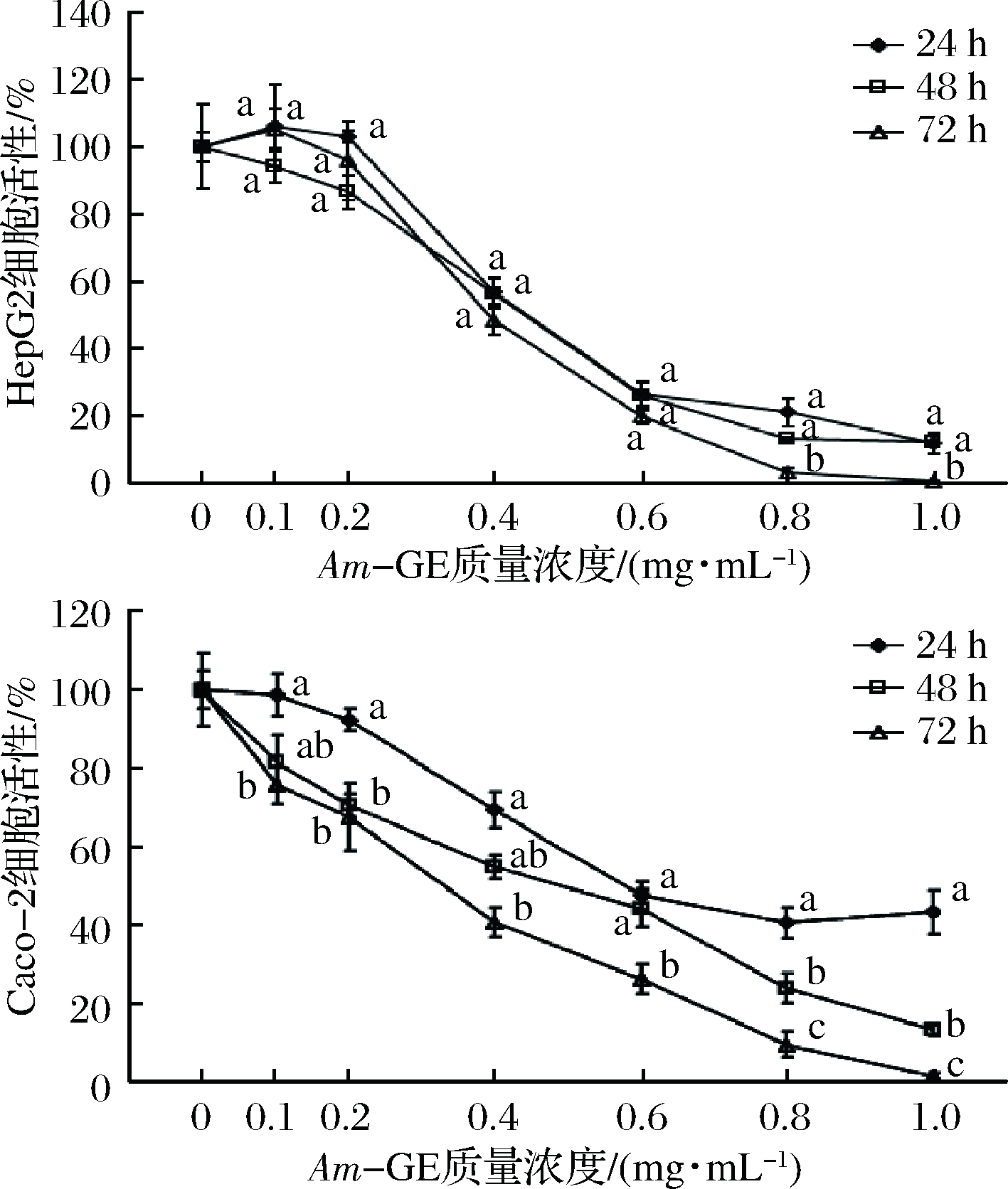
图1 Am-GE对HepG2细胞和Caco-2细胞活性的影响(n=4)
Fig.1 Effects of Am-GE on cell viability in HepG2 cell and Caco-2 cell
注:上标字母不同表示差异显著,P<0.05。下同。
2.2 Am-GE对HepG2细胞凋亡的影响
如图2所示,R4为活细胞,R5为早期凋亡细胞,R3为晚期凋亡细胞,R2为坏死细胞;R3+R5为凋亡细胞,其量化结果如表2所示。随着Am-GE质量浓度从0、0.25、0.50和0.75 mg/mL的增加,在每个浓度梯度点时,正常HepG2细胞数量均显著减少(P<0.05),具有较高的剂量效应关系;对于早期凋亡细胞,Am-GE质量浓度从0、0.25和0.50 mg/mL的增加,其细胞凋亡数量逐渐增加(P<0.05),但当Am-GE质量浓度为0.75 mg/mL,早期细胞凋亡数量显著减少,达到0 mg/mL的水平;对于晚期凋亡细胞,随着Am-GE质量浓度(0、0.25、0.50和0.75 mg/mL)的增加,在每个浓度梯度点时,晚期HepG2凋亡细胞数量均显著增加(P<0.05),呈现较高的剂量效应关系;对于死亡细胞,Am-GE在各浓度时,其数量变化不显著。结果显示,Am-GE能显著促进HepG2细胞的凋亡,具有显著的抗肿瘤活性。

图2 Am-GE对HepG2细胞凋亡的影响(n=3)
Fig.2 Effects of Am-GE on apoptosis in HepG2 cells
表2 Am-GE对HepG2细胞凋亡数量的影响
Table 2 Effects of Am-GE on number of apoptotic cells in HepG2 cells
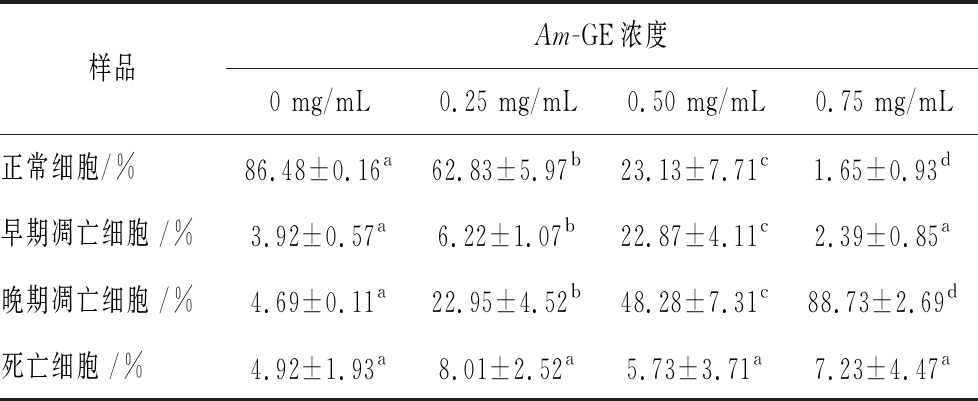
样品Am-GE浓度0 mg/mL0.25 mg/mL0.50 mg/mL0.75 mg/mL正常细胞/%86.48±0.16a62.83±5.97b23.13±7.71c1.65±0.93d早期凋亡细胞 /%3.92±0.57a6.22±1.07b22.87±4.11c2.39±0.85a晚期凋亡细胞 /%4.69±0.11a22.95±4.52b48.28±7.31c88.73±2.69d死亡细胞 /%4.92±1.93a8.01±2.52a5.73±3.71a7.23±4.47a
注:上标字母不同表示差异显著, P<0.05.
2.3 Am-GE对HepG2细胞周期的影响
如图3和表3所示,与Am-GE浓度0 mg/mL相比,0.25、0.50 和0.75 mg/mL的Am-GE均能显著减少G1期HepG2细胞的比例;同时显著增加G2期HepG2细胞的比例,其增加值分别为79.54%、96.10%和85.11%;但不同浓度的Am-GE彼此之间变化不显著;但对于S期细胞,随着Am-GE浓度(0、0.25、0.50和0.75 mg/mL)的增加,各组细胞的数量变化均不显著。表明东海海参性腺提取物处理引起了G2期阻滞,进而抑制HepG2细胞的增殖。
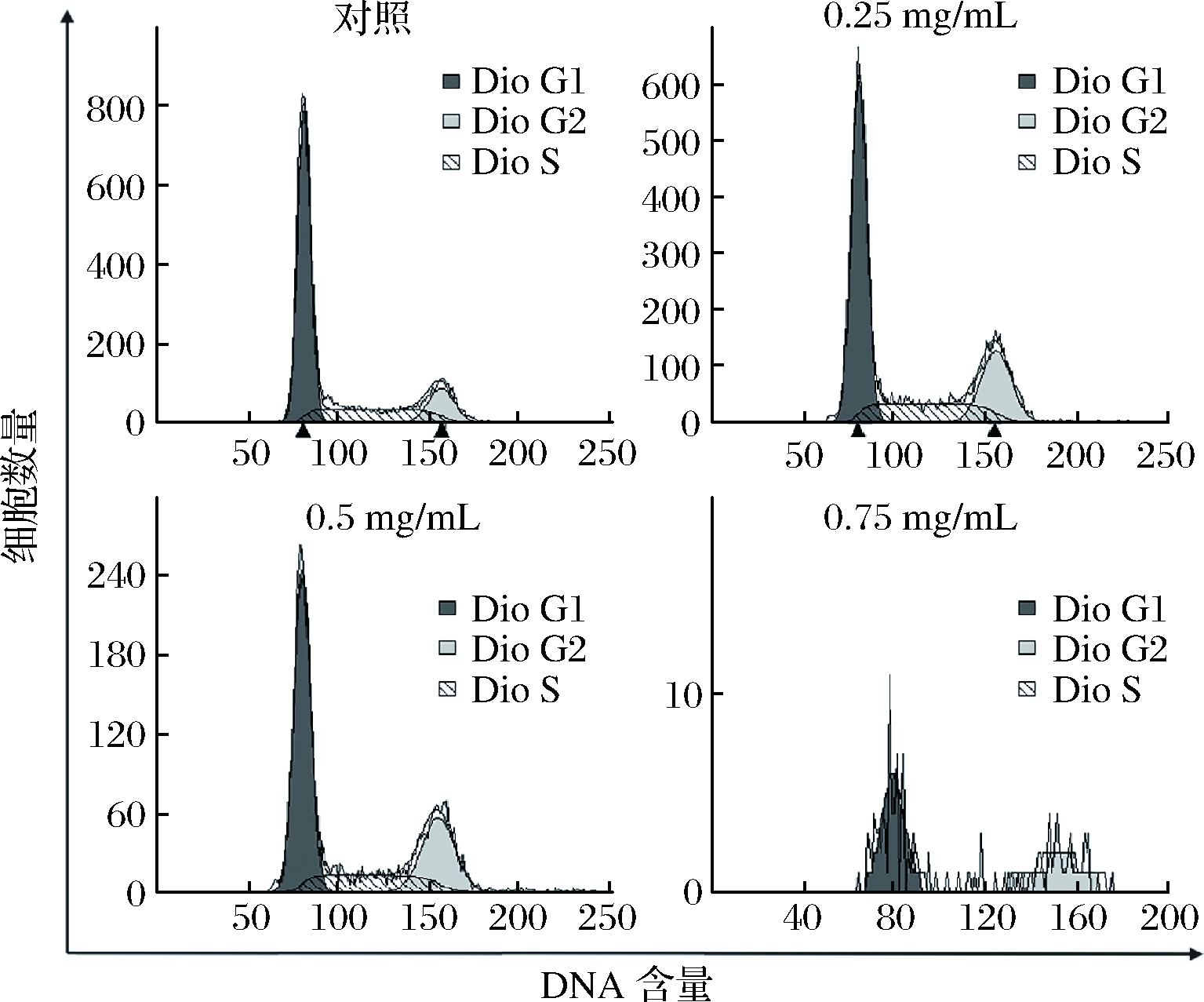
图3 Am-GE对HepG2细胞周期的影响(n=3)
Fig.3 Effects of Am-GE on cell cycle in HepG2 cells
表3 Am-GE对HepG2细胞周期量化值的影响(n=3)
Table 3 Effects of Am-GE on the quantized value of cell cycle in HepG2 cells

周期Am-GE浓度0 mg/mL0.25 mg/mL0.50 mg/mL0.75 mg/mLG1期 /%65.00±1.46a55.80±0.05b57.38±2.4b58.20±6.68bG2期 /%12.56±1.41a22.55±0.02b24.63±1.19b23.25±10.08bS期 /%22.44±0.54a21.61±0.94a18.00±1.22a18.57±3.39a
注:上标字母不同表示差异显著, P<0.05。
2.4 Am-GE对Caco-2细胞成瘤能力的影响
如图4所示,在不加入Am-GE的Caco-2细胞中,细胞瘤状体出现较密集,当加入Am-GE处理后,瘤状体密度和大小均有显著减小,且随着Am-GE浓度的增加,Caco-2细胞瘤状体的大小和密度呈现减小的趋势,具有显著的剂量效应关系,说明Am-GE能够显著抑制Caco-2细胞的成瘤能力。

图4 Am-GE对Caco-2细胞成瘤能力的影响(n=3)
Fig.4 Effects of Am-GE on tumorigenic ability in Caco-2 cells
2.5 Am-GE对RAW264.7细胞炎症因子mRNA表达的影响
如图5所示,与不加入LPS的RAW264.7细胞比较,加入LPS的细胞TNF-α、IL-1β、IL-6和iNOS mRNA的相对表达量均显著增加(图5),表明LPS引起了RAW264.7细胞的炎症反应。与加入LPS但未加入Am-GE的RAW264.7细胞比较,加入50和100 mg/mL的Am-GE并未引起TNF-α基因mRNA的显著变化,当Am-GE浓度增加至150和200 mg/mL时,TNF-α基因mRNA的相对表达量分别显著下降了35.92%和45.98%(图5-A)。对于IL-1β mRNA的相对表达量,50、100、150和200 mg/mL的Am-GE均显著降低了细胞IL-1β基因mRNA的转录水平,分别下降了30.51%、36.90%、44.44%和47.62%(图5-B)。100、150和200 mg/mL的Am-GE显著降低了IL-6 mRNA相对表达量21.71%、29.39%和36.84%(图5-C)。对于iNOS mRNA相对表达量,50、100、150和200 mg/mL的Am-GE分别显著降低了39.27%、35.02%、58.19%和75.14%(图5-D)。以上结果可知,加入Am-GE能够有效减少炎症因子mRNA的表达,从而起到抗炎作用。
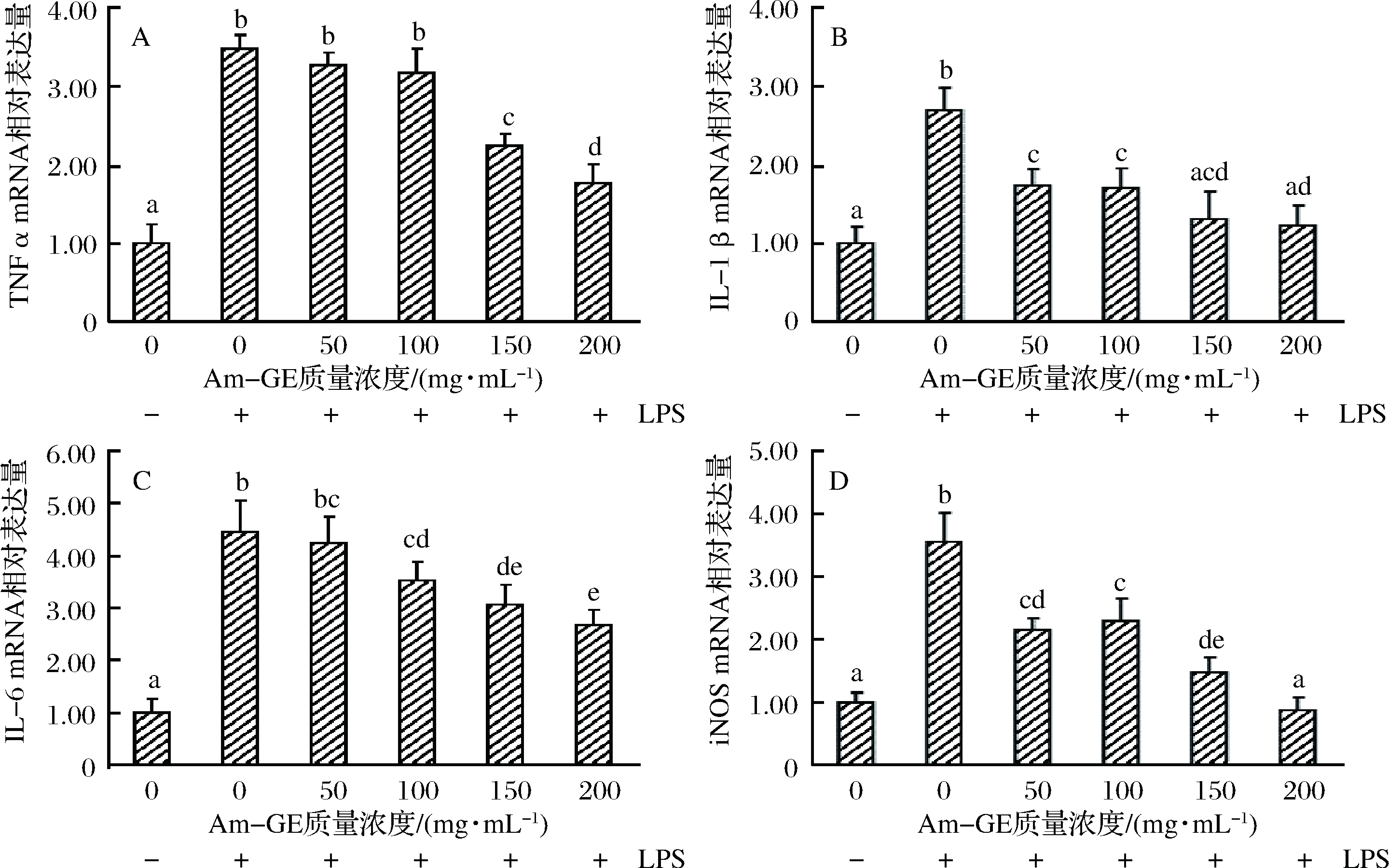
图5 Am-GE对RAW264.7细胞炎症细胞因子mRNA相对表达量的影响
Fig.5 Effects of Am-GE on proinflammaory cytokines mRNA relative expression in RAW264.7 cells
3 讨论
海参作为中国传统的营养食品和药食同源类生物资源,近年来得到了广泛的关注。本文利用丙酮对东海海参性腺进行提取,首次证明了丙酮提取物Am-GE能有效地抑制HepG2肝脏肿瘤细胞和Caco-2节肠肿瘤细胞的增殖,同时降低RAW264.7巨噬细胞炎症因子基因的表达水平,提示Am-GE具有较好的抗肿瘤和抗炎症的生物活性。
关于海参功能活性成分的研究,已证明海参有机溶剂提取物中含有丰富的脑苷脂、长链碱、神经节苷脂、EPA/DHA型磷脂等多种生物活性脂类[15]。研究发现,海参脑苷脂能显著抑制S180腹水瘤小鼠TNF-α、IL-1和IL-6的分泌[16],海参EPA型磷脂能有效地降低非酒精性脂肪肝大鼠肝脏脂质的堆积[17],抑制PC12细胞线粒体凋亡通路中关键基因Bax、Caspase-9、Caspase-3 mRNA的相对表达量,促进Bcl-2 mRNA的相对表达量[18],通过激活PI3K/Akt信号通路发挥降血糖的物物活性[19]。HU等证明海参长链碱能有效地降低肥胖小鼠血清TNF-α、IL-1β和IL-6浓度,并抑制其基因在脂肪组织中的表达,以此发挥抗炎症的作用[20]。本实验结果显示,Am-GE可以显著地抑制巨噬细胞TNF-α、IL-1β、IL-6和iNOS mRNA的相对表达量,具有较强的抗炎症作用;同时,Am-GE能显著抑制肝癌细胞的增殖,诱导细胞周期停滞和细胞凋亡,并将肿瘤细胞的细胞周期阻断在G2期,使之无法进入凋亡过程的关键限制点S期,提示Am-GE可以显著地通过抑制HepG2细胞的细胞周期(S期阻断)发挥抗肿瘤活性。因此,可以推测Am-GE在本实验中表现的生物活性,与提取物中含有的磷脂、脑苷脂、长链碱等生物活性脂质有密切的关系,但Am-GE中各类脂质的种类与相对含量尚未检测,在后续的实验过程中将进一步深入研究。
综上,东海海参性腺丙酮提取物具有显著的抗肿瘤和抗炎症生物活性,这将为东海海参的精深加工和高值化利用提供新的思路。
[1] 廖玉麟.我国的海参[J].生物学通报,2001,36(9):1-3;47.
[2] 苏来金,徐仰丽,林胜利,等.海地瓜胶原蛋白水提工艺的优化[J].食品与发酵工业,2014,40(9):185-192.
[3] 王磊,陆海霞,陈青.东海海参(Acaudina molpadioidea)营养成分分析及评价[J].食品与发酵工业,2014,40(8):215-218.
[4] BEN M M, BALTI R, OLLIVIER V, et al. Characterization and anticoagulant activity of a fucosylated chondroitin sulfate with unusually procoagulant effect from sea cucumber[J]. Carbohydr Polym, 2017,174:760-771.
[5] MOU J, LI Q, QI X, et al. Structural comparison, antioxidant and anti-inflammatory properties of fucosylated chondroitin sulfate of three edible sea cucumbers[J]. Carbohydr Polym, 2018,185:41-47.
[6] 王宁丽,于培良,赵立春,等.不同产地海地瓜活性物质检测及降糖活性评价[J].中国海洋药物,2019,38(2):11-16.
[7] 赵芹. 海参皂苷echinosideA和ds-echinoside A抗肿瘤活性及其作用机制的研究[D]. 青岛: 中国海洋大学, 2011.
[8] 胡世伟. 岩藻糖基化海参硫酸软骨素改善胰岛素抵抗及其作用机制的研究[D]. 青岛: 中国海洋大学, 2014.
[9] MENG J, HU X, ZHANG T, et al. Saponin from sea cucumber exhibited more significant effects than ginsenoside on ameliorating high fat diet-induced obesity in C57BL/6 mice[J]. Medchemcomm, 2018,9(4):725-734.
[10] 程宏. 海地瓜(Acaudina molpadioidea)堵塞核电冷源成因分析及防控措施研究[D].上海:上海海洋大学,2018.
[11] ZHONG C, SUN L C, YAN L J, et al. Production, optimisation and characterisation of angiotensin converting enzyme inhibitory peptides from sea cucumber (Stichopus japonicus) gonad[J]. Food Funct, 2018,9(1):594-603.
[12] 曹荣, 刘淇, 殷邦忠. 响应面法优化海参性腺酶解工艺[J]. 食品科学, 2012, 33(2): 29-33.
[13] 谢美琪. 海参性腺类胡萝卜素的分析与抗氧化活性研究[D]. 大连: 大连海洋大学, 2016.
[14] MALIKMA S A,ALJ S K, HARAKEH S M, et al. Review-Therapeutic implications of Nigella sativa against cancer metastasis[J]. Pak J Pharm Sci, 2016,29(5 Suppl):1 881-1 884.
[15] PANGESTUTI R, ARIFIN Z. Medicinal and health benefit effects of functional sea cucumbers[J]. J Tradit Complement Med, 2018,8(3):341-351.
[16] 杜磊. 海参和海星脑苷脂抗肿瘤及改善癌症恶病质作用的研究 [D]. 青岛: 中国海洋大学, 2012.
[17] LIU Y, SHI D, TIAN Y, et al. Eicosapentaenoic acid-enriched phosphatidylcholine attenuated hepatic steatosis through regulation of cholesterol metabolism in rats with nonalcoholic fatty liver disease[J]. Lipids, 2017,52(2):119-127.
[18] WU F J, XUE Y, LIU X F, et al. The protective effect of eicosapentaenoic acid-enriched phospholipids from sea cucumber Cucumaria frondosa on oxidative stress in PC12 cells and SAMP8 mice[J]. Neurochem Int, 2014,64:9-17.
[19] HU S, XU L, SHI D, et al. Eicosapentaenoic acid-enriched phosphatidylcholine isolated from Cucumaria frondosa exhibits anti-hyperglycemic effects via activating phosphoinositide 3-kinase/protein kinase B signal pathway[J]. J Biosci Bioeng, 2014,117(4):457-463.
[20] HU S, WANG J, WANG J, et al. Long-chain bases from sea cucumber mitigate endoplasmic reticulum stress and inflammation in obesity mice[J]. J Food Drug Anal, 2017,25(3):628-636.