红曲菌(Monascus sp.)是一种小型的丝状真菌,能产生多种重要的代谢产物,主要的包括红曲色素、Monacolin 类物质、γ-氨基丁酸以及多糖等[1-4]。其中红曲色素被广泛地用于食品着色,特别是在中国、日本以及其他东南亚国家[5]。红曲色素是包括红曲红色素、红曲黄色素、红曲橙色素在内的多种色素的混合物,作为与红曲红色素结构类似的同系物中的红曲橙色素和红曲黄色素这2种天然色素,尚未工业化生产[6]。目前天然色素仅占市场份额的30%,其余为合成与半合成色素[7]。但是由于合成与半合成色素潜在的毒性与致癌性,使得天然来源的色素受到了人们越来越多的关注和喜爱。红曲菌发酵生产色素又分为固态发酵和液态发酵。相比于固态发酵,液态发酵不易污染、培养条件易控制、生产效率高,更适合大规模工业化生产,但目前已工业化的液态发酵过程仅适用于红曲红色素,而具有广泛应用前景的红曲黄色素由于技术水平的限制,尚未工业化生产[8-10]。虽然早期主要是以红曲红色素的形式被大众接受,但随着红曲黄色素的研究深入,红曲黄色素产品凸显出了巨大的市场潜力[11]。因此,选育适合液态发酵生产红曲黄色素的高产菌株,优化培养条件,提高发酵水平,逐渐成为国内外研究的热点[12-14]。
近年来,红曲黄色素的研究越来越受到关注,国内外研究者通过发酵优化的方式不同程度上提高了红曲黄色素的产量。李瑞杰等使用红色红曲菌M-7为实验菌株,对液态发酵生产水溶性红曲黄色素的条件进行了优化,使得水溶性黄色素色价达到5.56 U/mL[15]。ZHOU等通过响应面的方法优化了红曲菌突变体MYM的培养基组成,使得水溶性黄色素色价达88.14 U/mL[16]。LV等使用紫色红曲菌进行液态发酵,通过在培养的第72 h添加5 g/L的司盘-80,醇溶性黄色素色价达到669.2 U/mL[12]。然而,已有的研究主要通过添加前体或效应因子等方式来提高黄色素产量,在成本或操作上存在一定的不足之处。
本研究利用前期研究室建立的双液相发酵方法为基础[17],主要通过设计合理的碳氮源种类和浓度、无机盐添加量,调控液态发酵过程的初始pH、培养温度等条件,来进一步提高醇溶性红曲黄色素的色价;此外,在优化发酵条件的基础上,通过分离纯化,液质联用和核磁共振等手段解析黄色素分子结构,本文在一定程度上为红曲黄色素发酵水平的提高以及工业化应用奠定了基础。
1 材料与方法
1.1 材料与试剂
紫色红曲菌 sjs-6,本实验室保藏菌种;玉米淀粉,上海塞翁福农业发展有限公司;中链甘油酯,上海佑创实业有限公司;耐高温α-淀粉酶,江苏锐阳生物科技有限公司;(NH4)SO4、NaNO3、KH2PO4、K2HPO4、无水CaCl2、MgSO4,国药集团化学试剂有限公司。
1.2 仪器与设备
HH-B11-360电热恒温培养箱,连云港医疗器械设备厂;HYL-C全温摇床柜,太仓市实验设备厂;GI100T高压蒸汽灭菌锅,上海申安医疗器械厂;GEX-9240MBE电热鼓风干燥箱,上海博讯医疗设备厂;CX31光学显微镜,日本奥林巴斯株式会社;waters 1525高效液相色谱,美国Waters公司。
1.3 实验方法
1.3.1 培养基条件
红曲菌,接种于PDA斜面,30 ℃避光培养7 d,4 ℃保藏。孢子悬浮液制备:利用无菌水将PDA斜面表层的孢子洗下,使孢子数达到1×107个/mL。种子培养基(g/L):玉米淀粉 60,(NH4)2SO4 4,NaNO3 2,MgSO4·7H2O 0.5,CaCl2 0.1,K2HPO4·3H2O 2,KH2PO4·3H2O 2,FeSO4 1,用乳酸调pH值至5.0。分装每瓶50 mL,121℃灭菌20 min。接种量为5 mL,30 ℃,180 r/min下培养2 d。
发酵培养基(g/L):玉米淀粉60, (NH4)2SO4 4,NaNO3 2, MgSO4·7H2O 0.5,CaCl2 0.1,K2HPO4·3H2O 2,KH2PO4·3H2O 2,FeSO4 1,用乳酸调pH值至5.0。分装每瓶50 mL,每瓶添加萃取剂20 mL,121℃灭菌20 min。接种量为10%,30 ℃、180 r/min下培养7 d。
1.3.2 培养条件的优化
在初始培养基的基础上,分别探讨了碳源、氮源的种类与添加浓度,金属离子Mg2+浓度以及初始pH和培养温度对红曲菌产黄色素的影响。
1.3.3 检测方法
1.3.3.1 色价检测方法
取适量发酵液进行离心,离心条件为 6 000 r/min、 10 min,使萃取相与发酵液及菌体分离。取1 mL萃取相置于50 mL比色管内,用无水乙醇进行稀释至适当倍数,进行全波长扫描,波长为300~600 nm,计算萃取相中色素色价及色调,如公式(1)、(2)所示(色价计算时,黄色素取OD410 nm,橙色素取OD460 nm, 红色素取OD510 nm):
发酵液色价/(U·mL-1)
=OD值×总稀释倍数![]()
(1)
黄色素色调值![]()
(2)
1.3.3.2 菌体量检测方法
将发酵液充分振荡摇匀后,取适量发酵液进行离心,离心条件为6 000 r/min、 10 min, 轻轻吸去上层萃取相,留下层。以适量蒸馏水洗涤后用烘干的滤纸进行抽滤,50℃烘干水分至恒重,计算如公式(3)所示:
(3)
式中:A为菌体量,g/L;V为所取的发酵液的体积,mL;m1为烘干后菌丝体与滤纸的总质量,g;m2为滤纸的质量,g。
1.3.3.3 发酵液pH测定
取适量发酵液进行离心,离心条件为6 000 r/min、10 min,轻轻吸去上层萃取相。用标准缓冲溶液校准精密数字酸度计,校准完成后,用去离子水清洗酸度计,擦净,测定待测发酵液的pH, 等读数稳定即可记录数据。
1.3.3.4 红曲黄色素提取与分析方法
取适量发酵液进行离心,离心条件为6 000 r/min、10 min,取上层萃取相与体积分数为85%乙醇以1∶4体积比混合,倒入分液漏斗中,剧烈振荡后静置,待分层后取上层。将上层液体倒入旋转蒸发仪的蒸馏烧瓶内,以温度50 ℃、转速100 r/min的条件进行旋转蒸干,直至无液体蒸出。取出蒸干后的黄色素粗品再次进行离心,离心条件为6 000 r/min、10 min,取上层,避光保存于-20 ℃。
将提取的黄色素用无水乙醇稀释适当的倍数后使用分析型高效液相色谱进行检测,并使用分析性高效液相色谱制取一定量的黄色素纯品。取2 mL制备型高效液相色谱收集液,通过液质联用分析红曲黄色素的相对分子质量,并采用核磁共振解析红曲黄色素的结构。
2 结果与分析
2.1 氮源种类对红曲菌液态发酵黄色素产量的影响
氮源作为微生物生长代谢必不可少的营养成分,在红曲菌发酵产色素过程中起着至关重要的作用。PISAREVA等通过研究发现,尿素是作为红曲菌发酵生产色素的最佳氮源[18]。而也有研究表示,蛋白胨在红曲菌发酵过程中显著促进了红曲色素的合成,是红曲色素合成的最有利的氮源之一[19-21]。由此可见,红曲菌发酵生产色素的最优氮源具有菌株特异性。我们分别选取(NH4)2SO4、NH4NO3、柠檬酸铵、NH4Cl、牛肉浸膏、鱼粉蛋白胨、酵母浸膏、酵母浸粉8种氮源进行优化,红曲黄色素色价及菌体量如图1-a所示。以无机氮源为唯一氮源时,黄色素色价因氮源种类不同而出现明显的差异,其中以NH4NO3为氮源时,黄色素色价仅为32.84 U/mL,菌体量也较低,仅为5.61 g/L;以(NH4)2SO4为氮源时,黄色素色价能够达到344.06 U/mL,在此条件下,红曲菌sjs-6菌体生长状况良好,菌体量超过20 g/L。以有机氮源为唯一氮源时,黄色素色价一般为200 U/mL左右,彼此间差距较小。由结果可知,以(NH4)2SO4为氮源时更有利于红曲黄色素生产。
图1-b中显示的是不同条件下,红曲菌色素产物在300~600 nm的吸收峰,其中黄色素的代表峰为(410±10)nm,橙色素的代表峰为(460±10)nm,红色素的代表峰为(510±10)nm。由此可见,红曲菌在不同氮源的条件下合成的主要色素成分是不一样的,以有机氮源(图1-a, 图1-b中E~H)为唯一氮源时,红曲菌sjs-6主要合成橙色素,其色价高于黄色素,黄色素的色调值小于1;无机氮源对红曲菌合成色素的影响不一致,当以无机氮源(NH4)2SO4(图1-a, 图1-b中A)为唯一氮源时,黄色素的色调超过1,此时红曲菌所产色素主要以黄色素为主。由此可见,通过调节氮源的种类能够显著改变红曲菌液态发酵产生色素的主要色调,本文以黄色素为研究目标,因此,选择(NH4)2SO4为氮源进行后续实验。
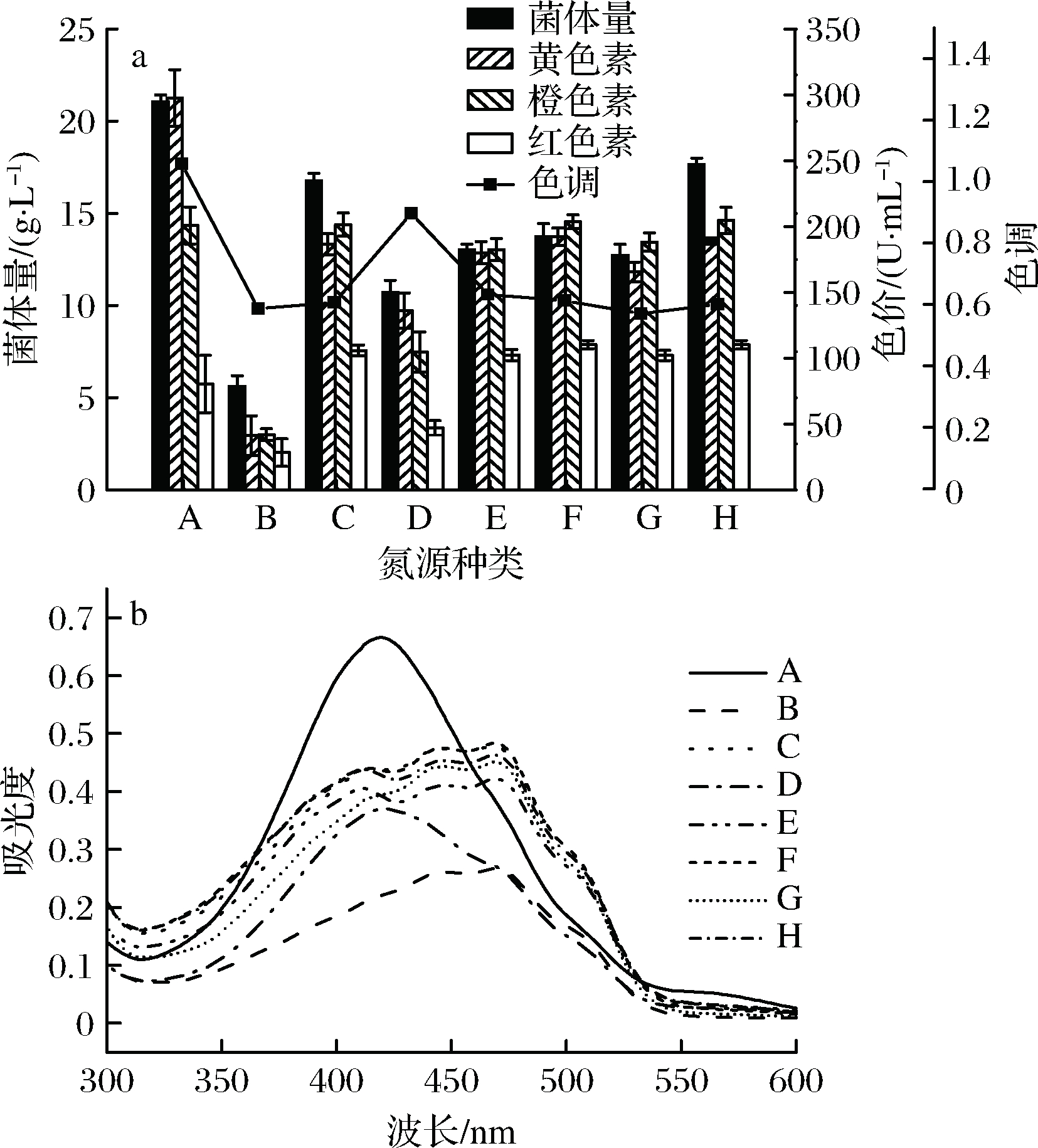
A-(NH4)2SO4;B-NH4NO3;C-柠檬酸铵;D-NH4Cl;E-牛肉浸膏;F-鱼粉蛋白胨;G-酵母浸膏;H-酵母浸粉a-氮源种类对红曲菌生长、色素产量及黄色素色调的影响;b-氮源种类对红曲色素萃取液吸收峰的影响
图1 氮源对红曲菌产红曲色素的影响
Fig.1 Effect of different nitrogen sources on Monascus and Monascus pigment
2.2 碳源种类对红曲菌液态发酵黄色素产量的影响
碳源与氮源一样是影响微生物发酵的重要因素,TZANN等通过研究发现,葡萄糖及其低聚糖和多糖在红曲菌生长和色素生成方面均优于其他碳源[22],而也有报导发现,半乳糖和乙醇更适合作为碳源用于红曲菌发酵产色素[1,23]。可见,与氮源类似,红曲菌发酵的最优碳源也具有菌株特异性。分别选取葡萄糖、果糖、麦芽糖、蔗糖、玉米淀粉、大米粉和甘油7种碳源进行优化,黄色素色价及红曲菌菌体量如图2-a所示。结果表明,不同碳源条件下菌体生长强度表现为:大米粉>玉米淀粉>麦芽糖>蔗糖>果糖>葡萄糖>甘油;不同碳源条件下黄色素合成能力为:麦芽糖>甘油>蔗糖>果糖>葡萄糖>大米粉>玉米淀粉。以多糖(大米粉、玉米淀粉)为碳源时,红曲菌的菌体量明显增加,但黄色素色价偏低,其中以玉米淀粉作为唯一碳源时,黄色素色价最低,仅为147.31 U/mL;以二糖(麦芽糖、蔗糖)为碳源时,黄色素色价较高,尤其是以麦芽糖为唯一碳源时,黄色素色价达到358.84 U/mL。这可能是因为麦芽糖为二糖,发酵过程中红曲菌自身能够合成相关酶类,催化麦芽糖缓慢分解生成单糖,使发酵液中单糖浓度持续维持在较适宜的水平,既避免了菌体大量生长,同时又促进了红曲黄色素的合成与积累。可知,红曲菌sjs-6生产红曲黄色素的最佳碳源为麦芽糖。
由图2-b可见,当使用不同种类的碳源时,红曲菌合成的色素吸收峰主要集中在420 nm左右,未发生明显的波峰迁移,说明与氮源影响因素相比,碳源种类只对黄色素的产量产生一定的影响,对产色素种类几乎无影响。为了研究碳源种类对红曲色素色调的影响,分别测定黄色素、红色素、橙色素的色价,计算色素色调,结果如图2-a所示。当以麦芽糖、大米粉为碳源时,色素色调值大于1,此时红曲菌sjs-6主要生产黄色素,其产量远高于其他色素成分;当以葡萄糖、果糖、蔗糖、玉米淀粉、甘油为碳源时,红曲菌sjs-6液态发酵得到的黄色素的产量低于其他色素之和;由此可见,当以麦芽糖为红曲菌发酵的碳源时,发酵产物以黄色素为主,且色价最高。
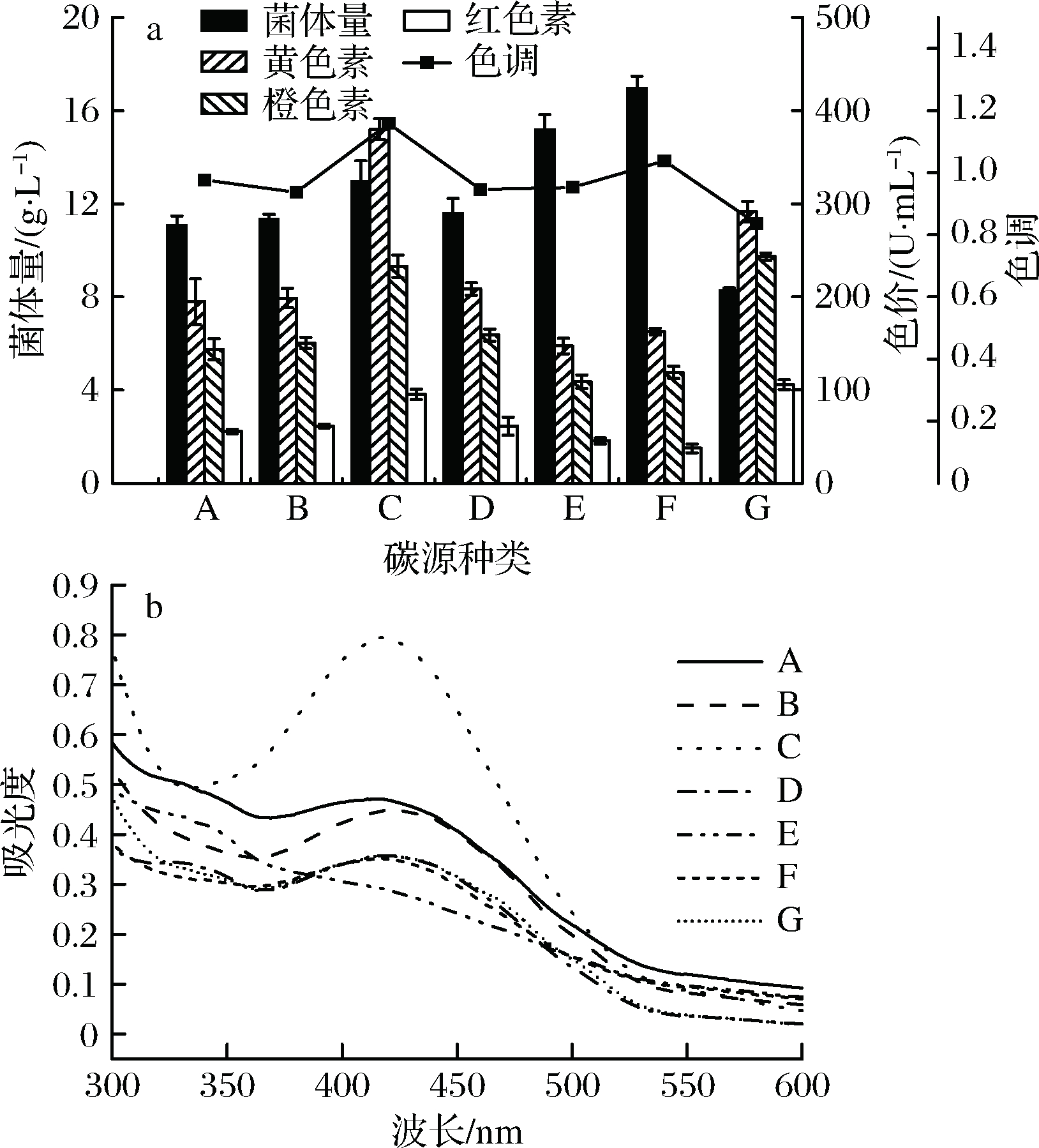
A-葡萄糖;B-果糖;C-麦芽糖;D-蔗糖;E-玉米淀粉;F-大米粉;G-甘油a-碳源种类对红曲菌生长、色素产量及黄色素色调的影响;b-碳源种类对红曲色素萃取液吸收峰的影响
图2 碳源对红曲菌产红曲色素的影响
Fig.2 Effect of different carbon sources on Monascusand Monascus pigment
2.3 氮源添加量对红曲菌液态发酵黄色素产量的影响
以(NH4)2SO4为唯一氮源,分别选择6种不同氮源添加量(2、4、6、8、10、12 g/L)进行实验。红曲菌菌体量及黄色素色价如图3所示,当氮源添加量由2 g/L 增长至6 g/L时,红曲菌的菌体量由8.28 g/L增长至13.28 g/L,相应的黄色素色价也呈现出上升趋势;当氮源添加量高于6 g/L,红曲菌菌体量趋于稳定状态,而黄色素色价持续上升,直至氮源添加量为10 g/L时,黄色素色价达到最高值;当氮源添加量继续由10 g/L增长至12 g/L时,黄色素色价反而降低。由此可知,(NH4)2SO4的最优添加量为10 g/L。
研究发现,发酵过程中氮源添加量不同,红曲菌色素的色调也会改变。图3中显示出红曲色素色调的相应变化,可见,当氮源添加量为2 g/L时,红曲菌合成其他色素量高于黄色素,色素色调值低于1;当氮源添加量从4 g/L增至10 g/L时,色素色调值由1.0增至1.2,红曲菌主要合成黄色素;当氮源添加量超过10 g/L时,色素色调值略有下降,红曲菌仍以黄色素为主产物,但其他色素的合成比率上升。由结果可知,10 g/L为红曲菌液态发酵的最佳氮源添加量。

图3 氮源添加量对红曲菌生长、色素产量及黄色素色调影响
Fig.3 Effect of nitrogen source addition on growth,pigment production and yellow pigment tone of Monascus
2.4 碳源添加量对红曲菌液态发酵黄色素产量的影响
以麦芽糖为唯一碳源,分别选择5种不同添加量20、40、60、80、100 g/L进行发酵优化实验,红曲菌菌体量及红曲黄色素色价如图4所示。当碳源添加量为20 g/L时,红曲菌菌体量及黄色素色价均处于较低水平;当碳源添加量由40 g/L增长至80 g/L时,红曲菌生长代谢过程得到充足的碳源,菌体量逐渐稳定于14 g/L左右,黄色素色价持续上升;当碳源添加量为80 g/L时,黄色素色价最高,达到427.65 U/mL;当碳添加量继续由80 g/L增长至100 g/L时,黄色素色价反而随之降低。
不同的碳源添加量对红曲黄色素色调有着一定影响,当碳源添加量由20 g/L增至100 g/L时,发酵产物中红、橙、黄3种色素的色价有所变化,但黄色素色调值始终大于1.0,表明红曲菌主要合成黄色素。综上结果,红曲菌生产黄色素的最佳碳源添加量为80 g/L。
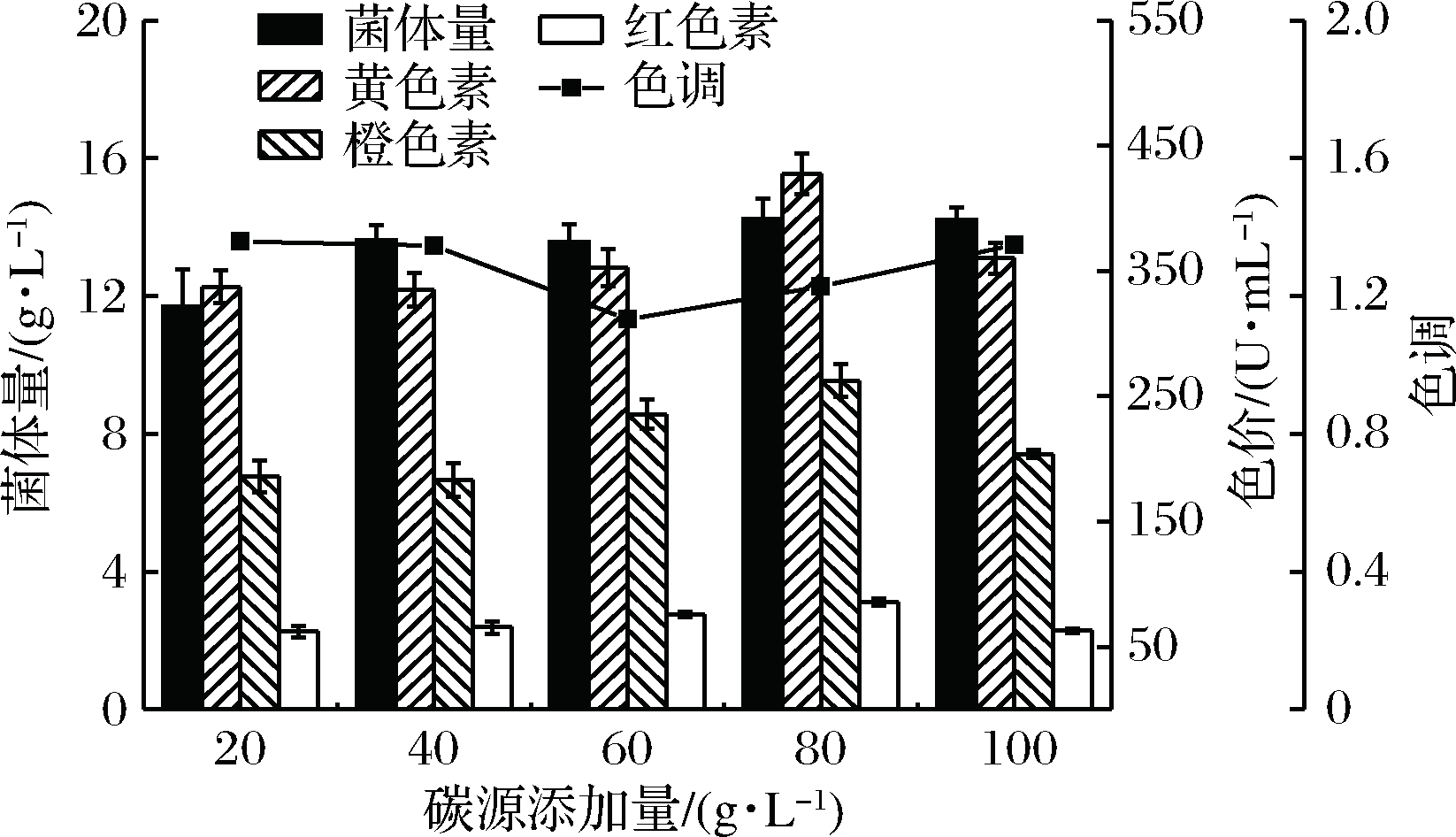
图4 碳源添加量对红曲菌生长、色素产量及黄色素色调的影响
Fig.4 Effect of carbon source addition on growth, pigment production and yellow pigment tone of Monascus
2.5 Mg2+添加量对红曲菌液态发酵黄色素产量的影响
金属离子,尤其是Mg2+,对红曲菌生长和色素生产有极大的影响,有研究表明,当Mg2+质量浓度在0.06~0.96 g/L时,随着Mg2+浓度的增加,红曲色素的产量也随之出现明显的提高[22]。本实验以MgSO4为Mg2+来源,分别选择4种不同添加量0.5、1.0、1.5、2.0 g/L,对Mg2+添加量进行优化,红曲菌菌体量及黄色素色价如图5所示。当Mg2+添加量由0.5 g/L增至1.0 g/L时,黄色素色价由244.14 U/mL增长至333.79 U/mL,红曲菌菌体量由9.94 g/L上升至11.31 g/L;当Mg2+添加量继续增加时,不利于红曲菌的生长及黄色素的合成,可能是由于此时Mg2+浓度过高,抑制了红曲色素相关合成酶的活力。由实验可知,最佳Mg2+添加量为1.0 g/L,在此条件下黄色素色价最高。
同时研究发现,Mg2+添加量能够影响红曲菌合成色素的色调。当Mg2+添加量由0.5 g/L增至2.0 g/L时,红曲黄色素的色调值有所下降,但始终大于1.0,表明红曲菌主要合成黄色素;当Mg2+添加量为0.5 g/L时,黄色素色调值最高,此时黄色素的产量约为其他两种色素产量的1.89倍。综合考虑色价的结果,选择Mg2+添加量为1.0 g/L。

图5 Mg2+添加量对红曲菌生长、色素产量及黄色素色调的影响
Fig.5 Effect of Mg2+ addition on growth, pigment production and yellow pigment tone of Monascus
2.6 初始pH对红曲菌液态发酵黄色素产量的影响
一般来说,红曲菌生长和色素生产的较适pH为4.0~7.0,不同pH的培养基可能会影响红曲色素组成,YONGSMITH等发现,在初始pH 7.0的条件下Monascus sp. KB 10合成橙红色的色素混合物,在初始pH低于4时Monascus sp. KB 10产生浅金色的色素混合物[24]。CHEN等也发现,当pH值低于4时,M. purpureus UQM 192F产黄色素ankaflavin的能力显著提高[19]。本实验以乳酸进行pH调节,分别选择6种不同初始pH(3、4、5、6、7、8),研究发酵培养基初始pH对红曲菌生长及黄色素产量的影响。红曲菌菌体量及黄色素色价如图6所示,当发酵液pH过低或过高(处于3或8)时,红曲菌生长受到抑制,菌体量偏低,对应的黄色素色价也较低。尤其是当pH为3时,黄色素色价仅为111.01 U/mL;当pH在4~7时,红曲菌生长状况较好,菌体量稳定于12 g/L左右,各实验组黄色素色价均大于400 U/mL。其中pH为6时,黄色素色价最高,达到444.44 U/mL。因此红曲菌液态发酵产黄色素的最佳初始pH为6。
不同初始pH的培养基会影响红曲黄色素色调,初始pH值为3时黄色素产量低于其他色素之和,黄色素色调小于1.0;当初始pH在4~8范围内时,黄色素色调均大于1.0,红曲菌主要合成黄色素,尤其是当初始pH值为7时,黄色素产量为其他色素产量的1.33倍,黄色素色调值最高。
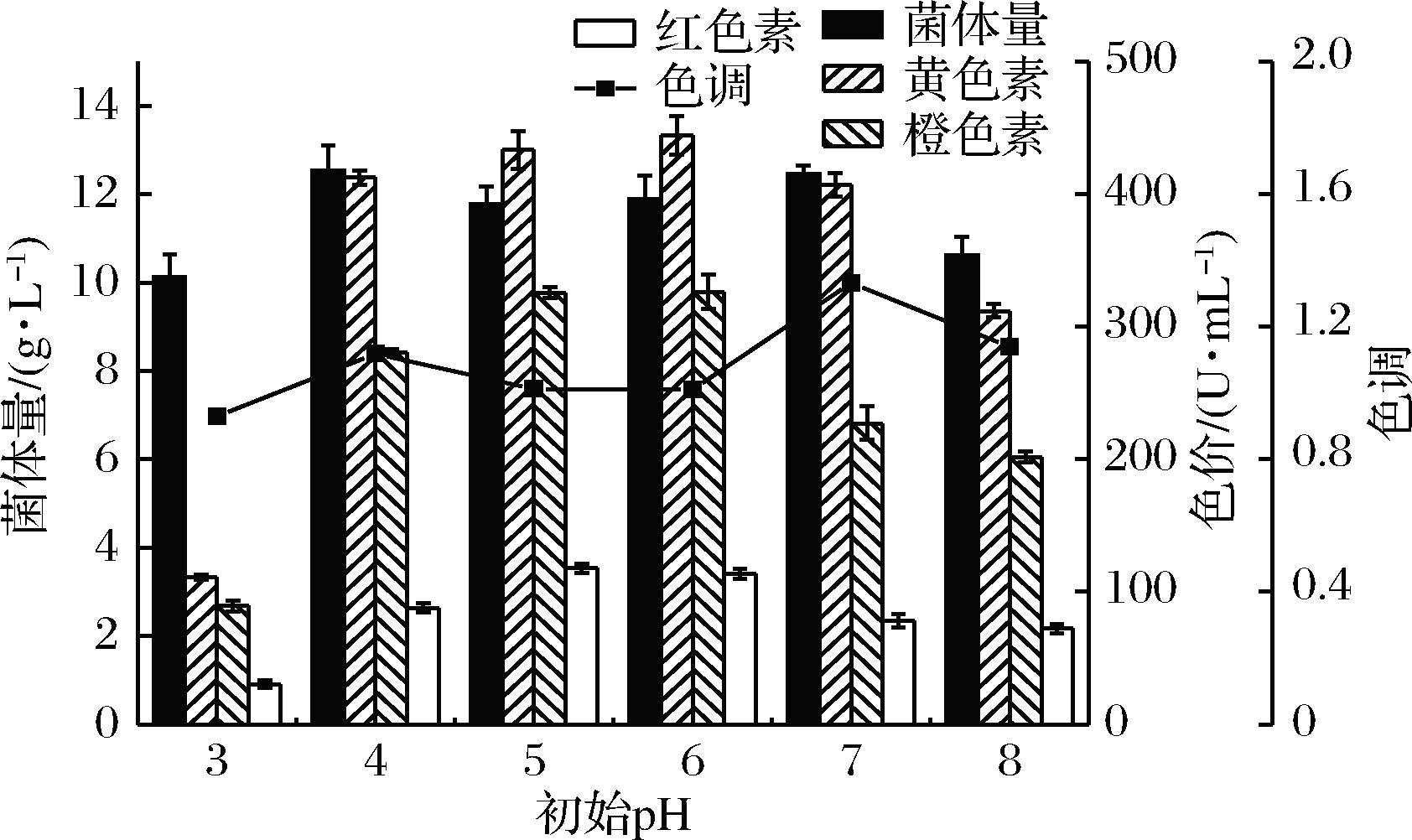
图6 初始pH对红曲菌生长、色素产量及黄色素色调的影响
Fig.6 Effect of initial pH on growth, pigment production and yellow pigment tone of Monascus
2.7 培养温度对红曲菌液态发酵黄色素产量的影响
一般来说,红曲菌在25~30℃下培养适合菌体的生长及色素的生产,不同的培养温度对红曲菌的色素合成有着显著的影响,如AHN等报道,当Monascus sp. J101在25 ℃下培养时,红曲红色素产量比30 ℃时高10倍[25]。本实验选取26、28、30、32、3 4℃5种培养温度,研究培养温度对红曲菌生长及黄色素产量的影响。红曲菌菌体量及黄色素色价如图7所示。当培养温度由26℃增至30℃时,红曲菌菌体量由6.81 g/L增至13.59 g/L,相应的黄色素色价由254.22 U/mL显著增至508.61 U/mL;当培养温度继续提高,红曲菌的菌体量仍较为稳定(13 g/L左右),而黄色素色价则呈现较为明显的下降趋势。因此,30℃为红曲菌sjs-6菌体生长和黄色素合成的最佳培养温度。
不同培养温度对红曲黄色素色调也有一定的影响,随着培养温度升高(26~34 ℃),黄色素色调值呈现上升趋势。当培养温度较低(<30 ℃)时,红曲色素色调值低于1.0;当培养温度超过30 ℃时,红曲色素色调值大于1.0,此时红曲菌合成黄色素量超过其他色素之和。由此可知,通过控制培养温度,能够有效减少其他色素合成,提高黄色素合成比例。
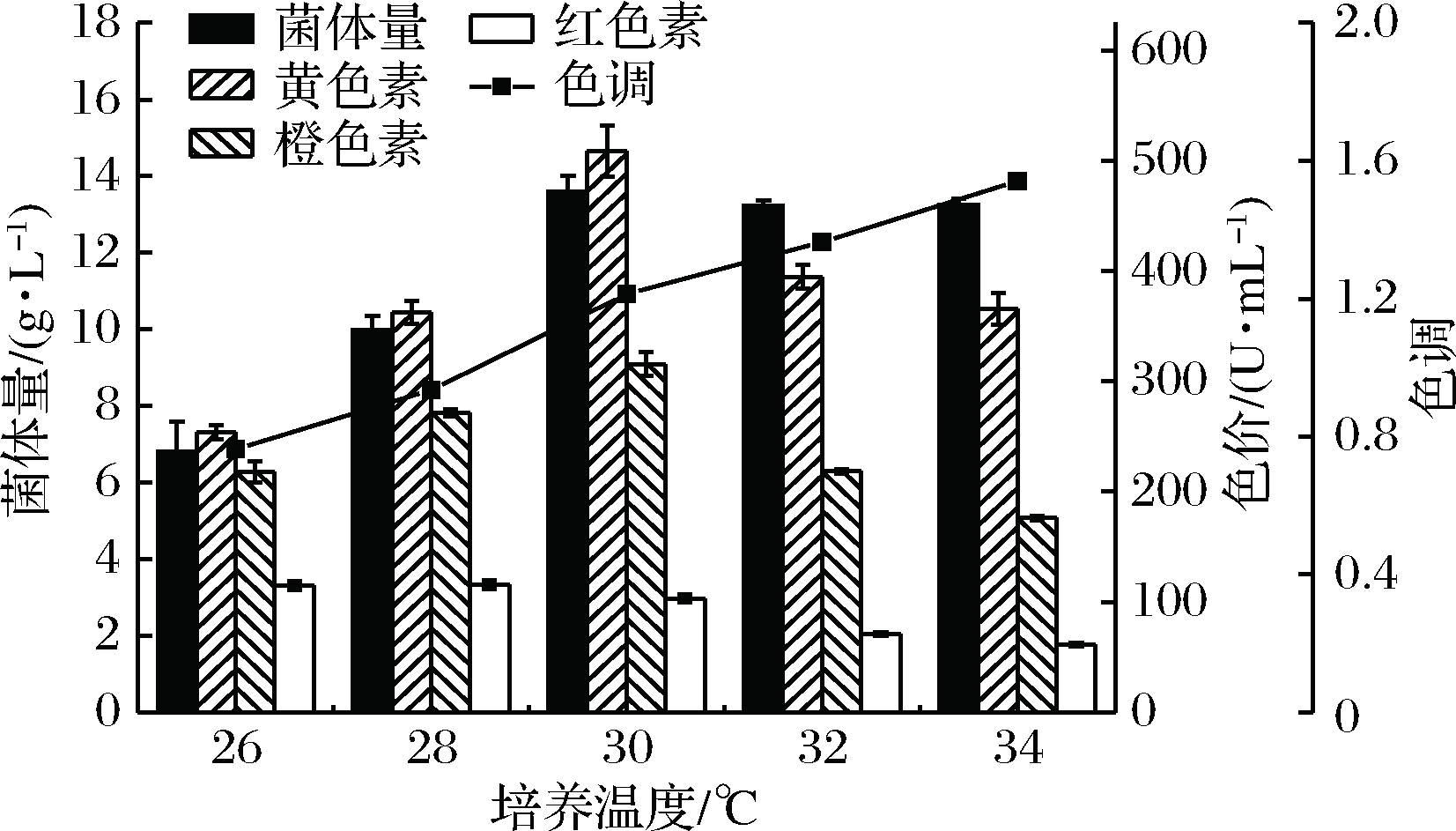
图7 培养温度对红曲菌生长、色素产量及黄色素色调的影响
Fig.7 Effect of temperature on growth, pigment production and yellow pigment tone of Monascus
2.8 红曲黄色素结构解析
将发酵结束后的红曲黄色素进行提取之后,使用分析型高效液相色谱进行检测,检测图谱如图8-b所示。其峰为单一组分,从峰面积归一化计,占样品总量的97.18%。之后使用制备型高效液相色谱对该组分进行纯化制备,以液质联用法对已纯化的红曲黄色素的相对分子质量进行测定,由图8-c可清晰地看出M+H(分子质量为359.1)的准分子离子峰,确定其相对分子质量为358 Da,与文献报道中的一种主要的红曲黄色素-红曲素(monascin)的分子质量一致。经核磁共振分析得知,该黄色素有26个氢,21个碳,包括3个羰基碳、3个甲基碳、3个亚甲基碳、5个次甲基碳以及4个季碳。以上信息与文献报道中的红曲素完全一致[26],确定红曲菌sjs-6在实验室条件下发酵生产的黄色素为红曲素,分子式为C21H26O5。
3 结论
本实验以高产黄色素的紫色红曲菌sjs-6为实验对象,通过优化使黄色素色价达到508.61 U/mL,较未优化前提高了52%。并通过计算黄色素色调值的方法,更直观地展示出黄色素的占比及其变化趋势。此外,在优化发酵条件的基础上,通过分离纯化、液质联用和核磁共振等手段解析黄色素分子结构。然而,目前的研究仍处于摇瓶水平,在发酵罐放大过程中仍有许多需要解决的问题。计划下阶段以目前优化的结果为基础,进一步通过代谢调控的方式,提高红曲黄色素的产量,并逐步在发酵罐中进行放大实验,为实现红曲黄色素的工业化应用奠定基础。
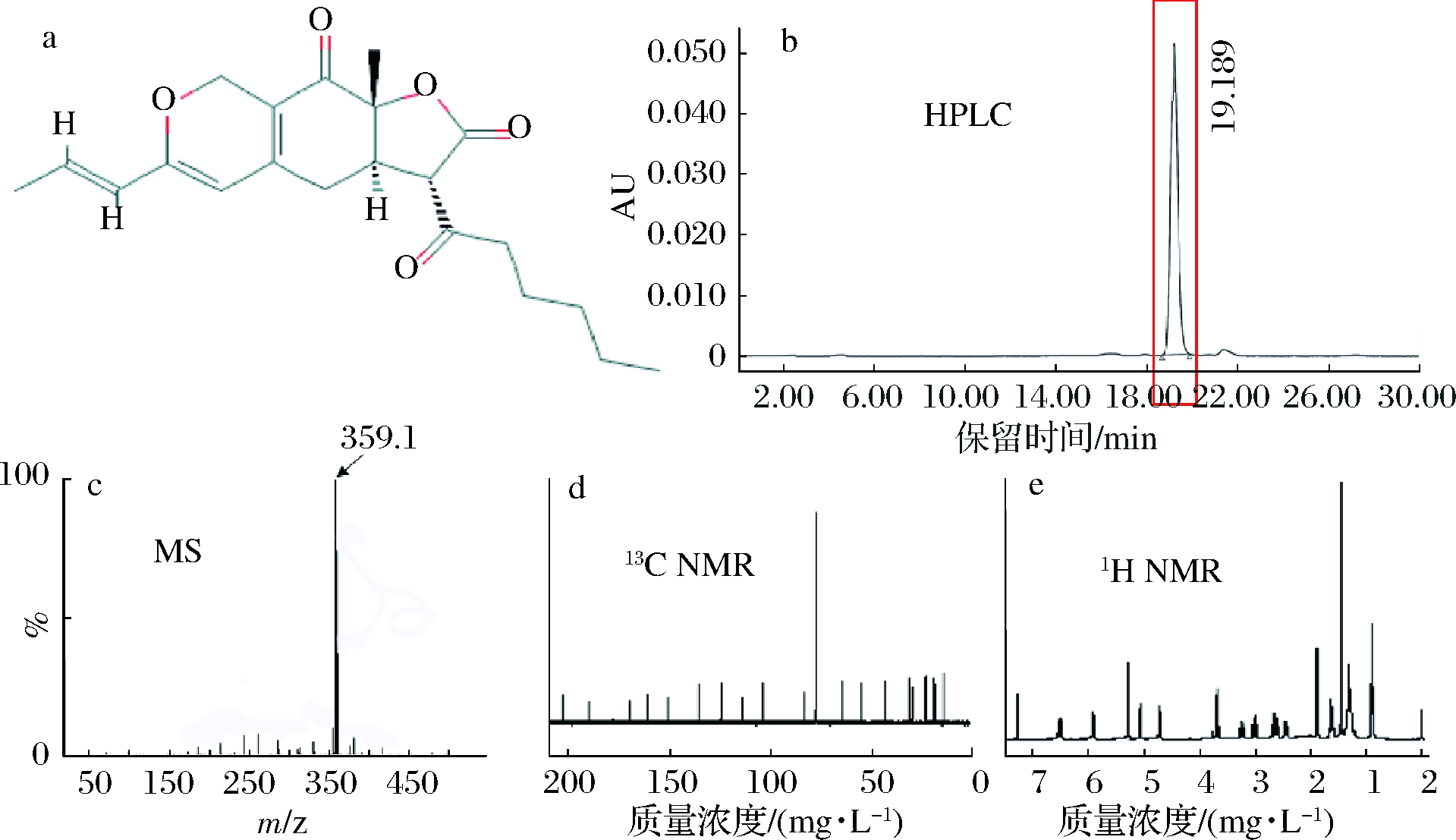
a-红曲素结构式;b-红曲色素高效液相图谱;c-纯化后的红曲黄色素质谱图;d-纯化后的红曲黄色素13CNMR;e-1HNMR
图8 红曲色素结构解析
Fig.8 Analysis of the structure of monascus pigment
[1] ![]() P, MART
P, MART NKKOV
NKKOV L, LOZINSKI J, et al. Ethanol as substrate for pigment production by the fungus Monascus purpureus[J]. Enzyme and Microbial Technology, 1994,16(11):996-1 001.
L, LOZINSKI J, et al. Ethanol as substrate for pigment production by the fungus Monascus purpureus[J]. Enzyme and Microbial Technology, 1994,16(11):996-1 001.
[2] KOHAMA Y, MATSUMOTO S, MIMURA T, et al. Isolation and identification of hypotensive principles in red-mold rice[J]. Chemical & Pharmaceutical Bulletin, 1987,35(6):2 484-2 489.
[3] ENDO A. Monacolin K, a new hypocholesterolemic agent produced by a Monascus species.[J]. Journal of Antibiotics, 1979,32(8):852-854.
[4] 田军, 李兆兰.红曲多糖的化学结构分析[J].南京中医药大学学报,1998(4):217.
[5] DUFOSS L, GALAUP P, YARON A, et al. Microorganisms and microalgae as sources of pigments for food use: A scientific oddity or an industrial reality?[J]. Trends in Food Science & Technology, 2005,16(9):389-406.
L, GALAUP P, YARON A, et al. Microorganisms and microalgae as sources of pigments for food use: A scientific oddity or an industrial reality?[J]. Trends in Food Science & Technology, 2005,16(9):389-406.
[6] 张薄博, 管宏伟, 陈磊, 等. 红曲黄色素的多样性及产品标准的讨论[J]. 食品与发酵工业, 2018, 44(12):261-266.
[7] MAPARI S A S, THRANE U, MEYER A S. Fungal polyketide azaphilone pigments as future natural food colorants?[J]. Current Trends in Biotechnology, 2010,28(6):300-307.
[8] WANG Y, ZHANG B, LU L, et al. Enhanced production of pigments by addition of surfactants in submerged fermentation of Monascus purpureus H1102[J]. Journal of the Science of Food and Agriculture, 2013,93(13):3 339-3 344.
[9] 丁海洋, 孟惠惠, 盛承承, 等.红曲霉JR摇瓶分批补料发酵产红曲色素的研究[J].中国酿造,2009,28(12):91-93.
[10] 熊晓辉, 沈昌, 高巍, 等.红曲色素液体深层发酵工艺研究[J].南京农业大学学报,1997,20(1):90-95.
[11] 谭海玲, 黄涛, 陈功, 等. 天然及还原型红曲黄色素的差异与国家标准改进思考[J]. 食品与发酵工业, 2019, 45(5):239-245.
[12] LV J, ZHANG B B, LIU X D, et al. Enhanced production of natural yellow pigments from Monascus purpureus by liquid culture: The relationship between fermentation conditions and mycelial morphology[J]. Journal of Bioscience and Bioengineering, 2017,124(4):452-458.
[13] HU Z, ZHANG X, WU Z, et al. Export of intracellular Monascus pigments by two-stage microbial fermentation in nonionic surfactant micelle aqueous solution[J]. Journal of Biotechnology, 2012,162(2-3):202-209.
[14] WANG M, HUANG T, CHEN G, et al. Production of water-soluble yellow pigments via high glucose stress fermentation of Monascus ruber CGMCC 10910[J]. Applied Microbiology and Biotechnology, 2017,101(8):3 121-3 130.
[15] 李瑞杰, 谢玉梅, 何思琴, 等. 液态发酵生产水溶性红曲黄色素的条件优化[J]. 中国酿造, 2016,35(11):73-77.
[16] ZHOU B, WANG J, PU Y, et al. Optimization of culture medium for yellow pigments production with Monascus anka mutant using response surface methodology[J]. European Food Research and Technology, 2009, 228(6):895-901.
[17] LV J, QIAN G F, CHEN L, et al. Efficient biosynthesis of natural yellow pigments by monascus purpureus in a novel integrated fermentation system[J]. Journal of Agricultural and Food Chemistry, 2018,66(4):918-925.
[18] PISAREVA E I, KUJUMDZIEVA A V. Influence of carbon and nitrogen sources on growth and pigment production by Monascus Pilosus C1 strain[J]. Biotechnology & Biotechnological Equipment, 2010,24(su-P1):501-506.
[19] CHEN M, JOHNS M. Effect of pH and nitrogen source on pigment production by Monascus purpureus[J]. Applied Microbiology and Biotechnology, 1993,40(1):132-138.
[20] SILVEIRA S T, DAROIT D J, BRANDELLI A. Pigment production by Monascus purpureus in grape waste using factorial design[J]. LWT-Food Science and Technology, 2008,41(1):170-174.
[21] SILVEIRA S T, DAROIT D J, BRANDELLI A. Pigment production by Monascus purpureus in grape waste using factorial design[J]. LWT - Food Science and Technology, 2008,41(1):170-174.
[22] LIN T F,DEMAIN A L. Effect of nutrition of Monascus sp. on formation of red pigments[J]. Applied Microbiology and Biotechnology, 1991,36(1):70-75.
[23] YOSHIMURA M, YAMANAKA S, MITSUGI K, et al. Production of Monascus-pigment in a submerged culture [J]. Journal of the Agricultural Chemical Society of Japan, 1975,39(9):1 789-1 795.
[24] YONGSMITH B, TABLOKA W, YONGMANITCHAI W, et al. Culture conditions for yellow pigment formation by Monascus sp. KB 10 grown on cassava medium[J]. World Journal of Microbiology & Biotechnology, 1993,9(1):85-90.
[25] AHN J, JUNG J, HYUNG W, et al. Enhancement of Monascus pigment production by the culture of Monascus sp. J101 at low temperature[J]. Biotechnology Progress, 2010,22(1):338-340.
[26] CHEN F C, MANCHARD P S, WHALLEY W B. The structure of monascin[J]. Journal of the Chemical Society D: Chemical Communications, 1969(3):130-131.