亚硝酸盐是常用的肉制品的发色剂,除了发色外,还具有抑菌、抗氧化、改善肉制品风味和品质等功效。但大量研究表明,产品中残留的亚硝酸盐具有较强的致癌作用[1-3],减少亚硝酸盐的使用、降低其残留量一直以来都是肉类科学研究的重要课题。目前,减少肉制品中亚硝酸盐含量的方法主要有以下几种:(1)减少亚硝酸盐用量;(2)在不改变亚硝酸盐用量的前提下,加入能够阻断亚硝胺形成的添加剂;(3)使用由着色剂、抗氧化剂、多价鳌合剂和抑菌剂等混合组成的添加剂来部分或完全替代亚硝酸盐。
红曲红色素作为红曲霉的次级代谢产物,不仅有良好的着色性能,而且安全性高,还具有抑菌等生理活性[4-7]。李燕萍等[8]发现添加红曲红能增加肉制品中氨基酸含量,赋予食品良好的风味。因此,红曲红已经成为发色剂替代研究中的重要材料。
MP是猪肌肉中重要的盐溶蛋白,约占其总蛋白的55%左右,对肉制品的持水、乳化和凝胶等功能特性具有重要作用,决定着肉制品的嫩度、质地、黏弹和咀嚼等食用性质[9]。MP在加工过程中容易被氧化、降解和发生变性,亚硝酸盐对MP的功能特性具有一定的保护作用[10-11],亚硝酸盐被替代或部分替代可能对MP的功能性质和产品品质带来不良的影响,但此类研究目前还处于起步阶段。本文以猪背最长肌为原料,研究低硝腌制条件下适量添加红曲红对猪肉MP功能性质的变化、探讨其变化机理,以期为高质量低硝肉制品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
猪背最长肌,购于北碚区天生农贸市场宰后约4 h内的原料肉,放在带冰袋的保湿箱中,在20 min内运回实验室;红曲红,食品级(色价为100),成都市科龙化工试剂厂;其他试剂均为分析纯。
1.2 仪器与设备
Avanti J-10高速冷冻离心机,美国贝克曼库尔特公司;XHF-D内切式匀浆机,宁波新芝生物科技股份有限公司;MCR302 流变仪,奥地利安东帕公司;SYNERGYH1MG全波长酶标仪,美国基因公司。
1.3 方法
1.3.1 试样处理
用消毒过的砧板和刀具在无菌操作台上将原料去除脂肪和结缔组织后分割成200 g左右块状,自封袋包装后于-20℃冻藏备用,使用前4 ℃解冻12 h。
将猪背最长肌与腌制液按质量比1∶1混合,于4℃腌制72 h后提取MP进行相关指标的测定。对照组腌制液配制,亚硝酸钠含量为肉重的0.01%,食盐2%;实验组,亚硝酸钠含量为肉重的0.005%,食盐2%,红曲红添加量分别为肉重的0%、0.1%、0.15%、0.2%、0.25%。
1.3.2 MP的提取及浓度的测定
参照HONG等[12]的方法。
1.3.3 溶解度的测定
参照KUNARAYAKUL等[13]的方法并修改。将配好的2.5 mg/mL MP溶液于4 ℃静置1 h,冷冻离心(5 500 r/min, 4 ℃,15 min)后取上清液,其浓度用双缩脲法测定,用磷酸缓冲液代替空白。按公式(1)计算MP的溶解度。
溶解度![]()
(1)
1.3.4 乳化活性和乳化稳定性的测定
参照AGYARE等[14]的方法测定。
1.3.5 蛋白流变学性质的测定
参照AMIRI等[15]的方法并修改。调整MP质量浓度为40 mg/mL的溶液,4℃的条件下2 800 r/min分散均匀后反应1 h。测定参数夹具改为40 mm,为了避免在加热过程中蒸干样品,应先擦干外露的样品,然后用凡士林将其密封起来。
1.3.6 蛋白羰基含量的测定
参照TOKUR等[16]的方法测定。
1.3.7 蛋白巯基含量的测定
参照YONGSAWATDIGUL等[17]的方法并修改。配制试样浓度为4 mg/mL,取1 mL MP溶液加入9 mL 0.02 mol/L缓冲溶液C(10 mmol/L EDTA,0.6 mol/L KCl与8 mol/L尿素,pH 7.0),2 800 r/min匀浆30 s。将0.1 %的DTNB 0.4 mL加入到4 mL混匀液中,对照组为10 mL缓冲液C与0.4 mL 0.1%的DTNB,在水浴锅中保温 (25 min,40 ℃),于412 nm处测定吸光值。总巯基含量按公式(2)计算。
巯基含量/(nmol·mg-1蛋白质![]()
(2)
式中:A,吸光值,nm;ε,吸光系数,13 600 mol/(cm·L);D,稀释倍数;C,上清液中蛋白质质量浓度,mg/mL。
1.3.8 表面疏水性的测定
参照CHELH等[18]的方法并对其进行改进。用磷酸盐缓冲液配制MP溶液浓度为5 mg/mL。室温振荡装有样液1 mL和质量浓度为1 mg/mL溴酚蓝溶液200 μL的离心管10 min,使其混合均匀后离心10 min(8 000 r/min)。将其1 mL上清液与9 mL磷酸盐缓冲液混合稀释10倍,于595 nm波长下测定吸光值A,用磷酸盐缓冲液代替空白,表面疏水性按式(3)计算:
溴酚蓝结合量![]()
(3)
式中:A0,空白对照组的吸光度值,nm; A1,MP溶液的吸光度值,nm。
1.3.9 SDS-PAGE分析
参照LAEMMLI[19]的方法测定。
1.3.10 红外光谱分析
参照林婉玲等[20]的方法并修改。取冻干后的MP试样3 mg与200 mg干燥的溴化钾(105℃烘箱中干燥48 h)置于玛瑙研钵中,充分研磨后,装样,手动压片。采用红外光谱仪Spectrun100进行测定,扫描24 次,分辨率为4 cm-1作为测定条件。用Peakfit 4.12对所得的图谱进行去卷积和曲线拟合分析。
1.3.11 数据处理
每个样品做3次平行实验,用Excel处理数据,SPSS Statistics 20.0软件进行单因素方差分析,Origin 8.5绘图,结果以平均值±标准差(X±SD)形式表示。
2 结果与分析
2.1 红曲红添加量对MP功能特性的影响
2.1.1 表面溶解度的变化
蛋白质的溶解性作为蛋白质功能特性的重要指标,与其乳化性、表面疏水性、凝胶特性等其他特点关系密切,这些关系特征只有在蛋白质高度溶解时才出现,对肉制品加工有着重要意义。红曲红添加量对MP溶解度的影响如图1所示。红曲红添加量增加,MP溶解度呈先增大后减小的趋势。添加红曲红后各处理组的溶解度均显著大于红曲红添加量为0时的溶解度(P<0.05),且在红曲红添加量为0.15%时出现峰值,表明在较低亚硝酸钠添加量条件下添加红曲红仍可以提高MP的溶解度,改善蛋白质的功能特性。红曲红添加量从0增加至0.15%时,溶解度从29.26%增加到47.67%,溶解度增大了18.41%,可能是由于红曲红分子结构中具有羰基、氨基、羟基、羧基等极性基团,当其添加至蛋白溶液后体系中极性和非极性残基的电荷平衡发生改变,在静电斥力的作用下促进了蛋白质与水分子之间的相互作用,从而使蛋白质的溶解度增加[21]。同时反映红曲红本身可能具有一定的抗氧化性质,抑制了腌制过程中因蛋白质氧化而导致的溶解度的降低。在红曲红添加量从0.15%增大至0.2%时,蛋白质溶解度明显下降(P<0.05),当红曲红添加量进一步增大时,较0.2%的蛋白样品相比溶解度变化不明显(P>0.05),这可能是红曲红添加量过高,红曲红分子结构中的羰基等极性基团与蛋白质的亲水基团发生竞争,通过疏水相互作用促使蛋白质周围的水分子发生了重排,减小了蛋白质与水分子之间的结合作用,从而使蛋白质发生凝聚,降低了溶解度。
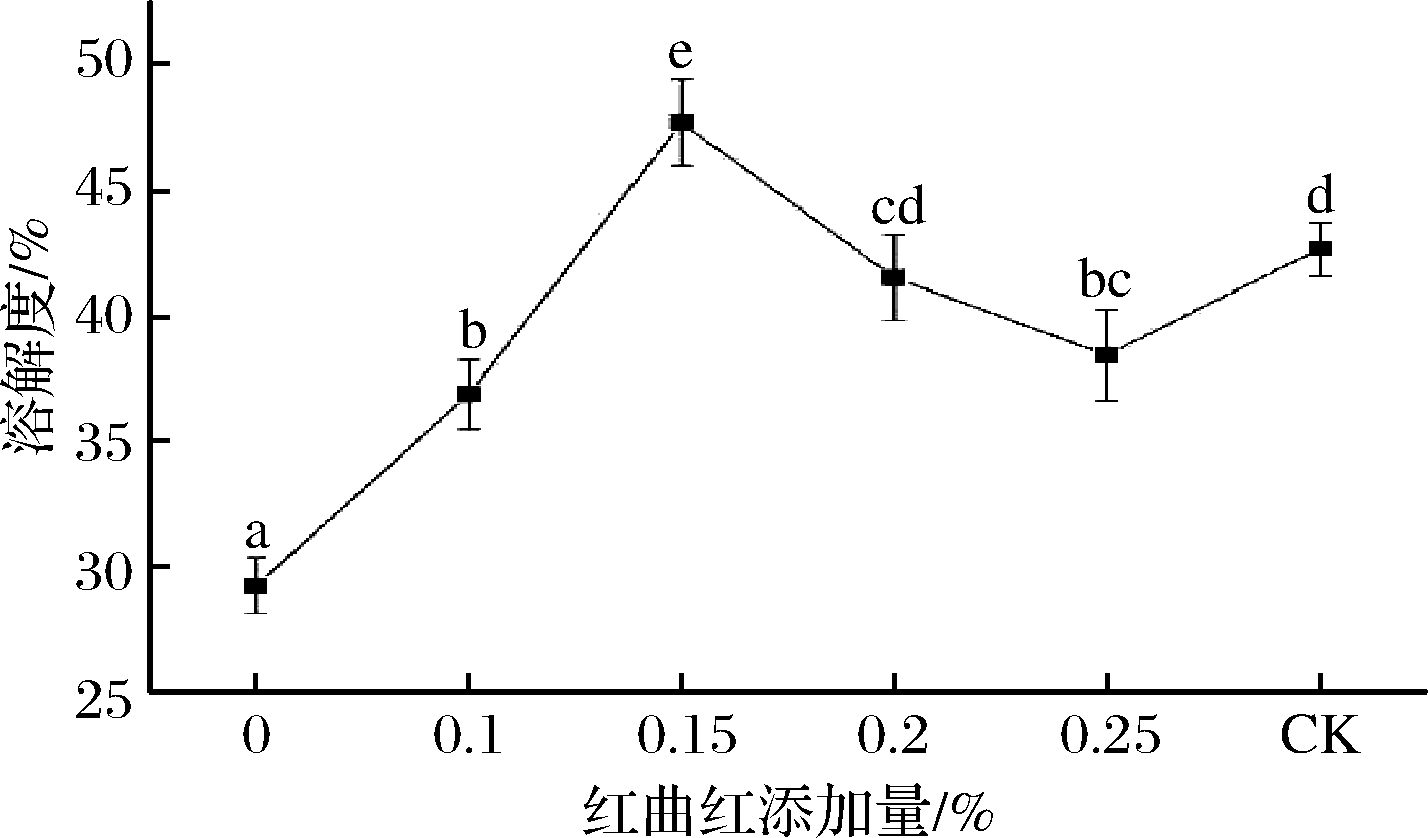
图1 红曲红添加量对MP溶解度的影响
Fig.1 Effects of monascus red addition on myofibrillar protein solubility
注:图中不同小写字母代表差异显著。P<0.05。下同。
2.1.2 乳化性的变化
乳化性是评价蛋白质保持乳化体系油水界面能力的重要指标[22]。红曲红添加量对MP乳化活性和乳化稳定性的影响如图2所示。红曲红添加量增加,MP的乳化活力指数(EAI,emulsfication activity index)值和乳化稳定性(ESI,endsystem idenifier)值均呈先增大后减小的趋势。在红曲红添加量小于0.15%时,ESI值及其EAI值都先增大后减小。随着红曲红添加量的增大显著增大(P<0.05);在红曲红浓度为0.15%时,EAI值和ESI值都出现峰值,即乳化效果最好,与红曲红添加量为0时相比,EAI值增大了77.68%,ESI值增大了37.22%;在红曲红添加量大于0.15%时,EAI值和ESI值均显著降低(P<0.05)。添加红曲红后各处理组的EAI值和ESI值均显著大于红曲红添加量为0时的EAI值和ESI值(P<0.05),表明在亚硝酸钠含量较低时间添加红曲红仍可以提高MP的乳化性,改善蛋白质的功能特性。而当红曲红继续增加时,EAI值和ESI值均显著降低(P<0.05),这可能是当红曲红过量时蛋白质与水分子之间的静电斥力会被破坏,使得脂肪球大量聚集,产生油水分离的现象,导致蛋白质的乳化性能降低。与未添加红曲红、亚硝酸钠含量较高的对照组相比,低亚硝酸钠含量下添加0.2%红曲红时的EAI值和ESI值与其接近(P>0.05);添加0.15%红曲红时的EAI值和ESI值均显著高于对照组(P<0.05),表明添加适量红曲红可以显著提高MP的乳化性能,这对提高肉在加工过程中维系脂肪的能力、降低损失及改善产品品质是有益的。
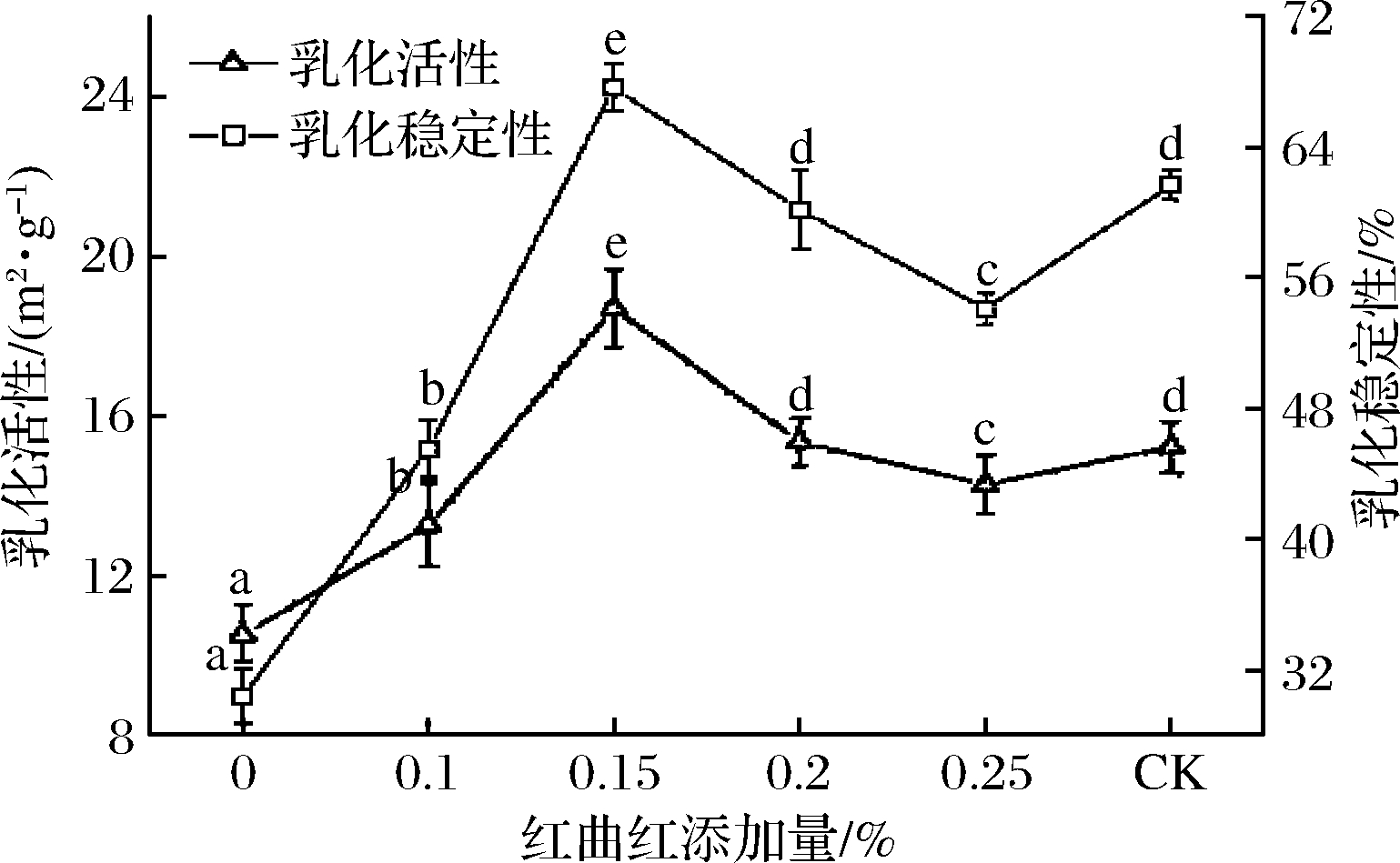
图2 红曲红添加量对MP乳化性的影响
Fig.2 Effects of monascus red addition on emulsifying of myofibrillar protein
2.1.3 流变性质分析
肉制品的口感、质构及其风味与其黏弹性即流变性密切相关。在加热过程中,MP蛋白质分子性质和形态的变化可由MP的动态流变学性质可以表现出来,储能模量(storage modulus,G′)是衡量蛋白质凝胶能力的一个重要指标,能够反映出不同温度下蛋白质的展开和聚集过程,蛋白质凝胶能力越强,G′值越高[23]。
红曲红添加量对MP流变学性质的影响变化如图3所示。红曲红和空白对照组、处理组猪肉MP的G′值大体上呈先缓慢上升后下降再显著上升最后趋于平稳的趋势,0%、0.1%、0.15%、0.2%、0.25%红曲红处理组和对照组MP 的G′最大值分别为41 100.1、59 532、413 128.4、305 216.3、136 287.7和263 567 Pa。第一阶段,首先随着温度不断升高,G′值缓慢增大,在44~47 ℃下出现首次峰值,这主要是因为肌球蛋白结构发生变化,导致蛋白质之间相互交联,初步形成了较弱的三维网状结构;第二阶段是随着温度的升高,G′值逐渐减小,在50~52 ℃时出现第2个峰值,随着维持网络结构的氢键在加热过程中大量断裂,蛋白质开始发生变性,肌球蛋白尾部的螺旋结构发生转变,破坏了已形成的三维网络结构,导致凝胶弱化;第三阶段是随着温度的升高,G′值迅速增大最后趋于稳定,在69~75 ℃时出现第3个峰值,这主要是因为在二硫键和疏水相互作用下,蛋白质发生交联或凝聚,最终形成了稳定的、不可逆的三维网状结构凝胶[24]。添加红曲红后各处理组G′的最大值均显著大于红曲红含量为%0时G′的最大值(P<0.05),表明在较低亚硝酸钠质量分数条件下添加红曲红仍可以提高MP的凝胶能力,抑制蛋白质的变性和降解。与未添加红曲红、含有较高质量分数亚硝酸钠的对照组相比,低亚硝酸钠含量下添加0.2%红曲红时G′的最大值与其接近(P>0.05),而红曲红质量分数为0.15%时G′的最大值明显较高(P<0.05)。表明适量添加红曲红可以显著提高MP的凝胶能力,进而可以提高肉制品品质。
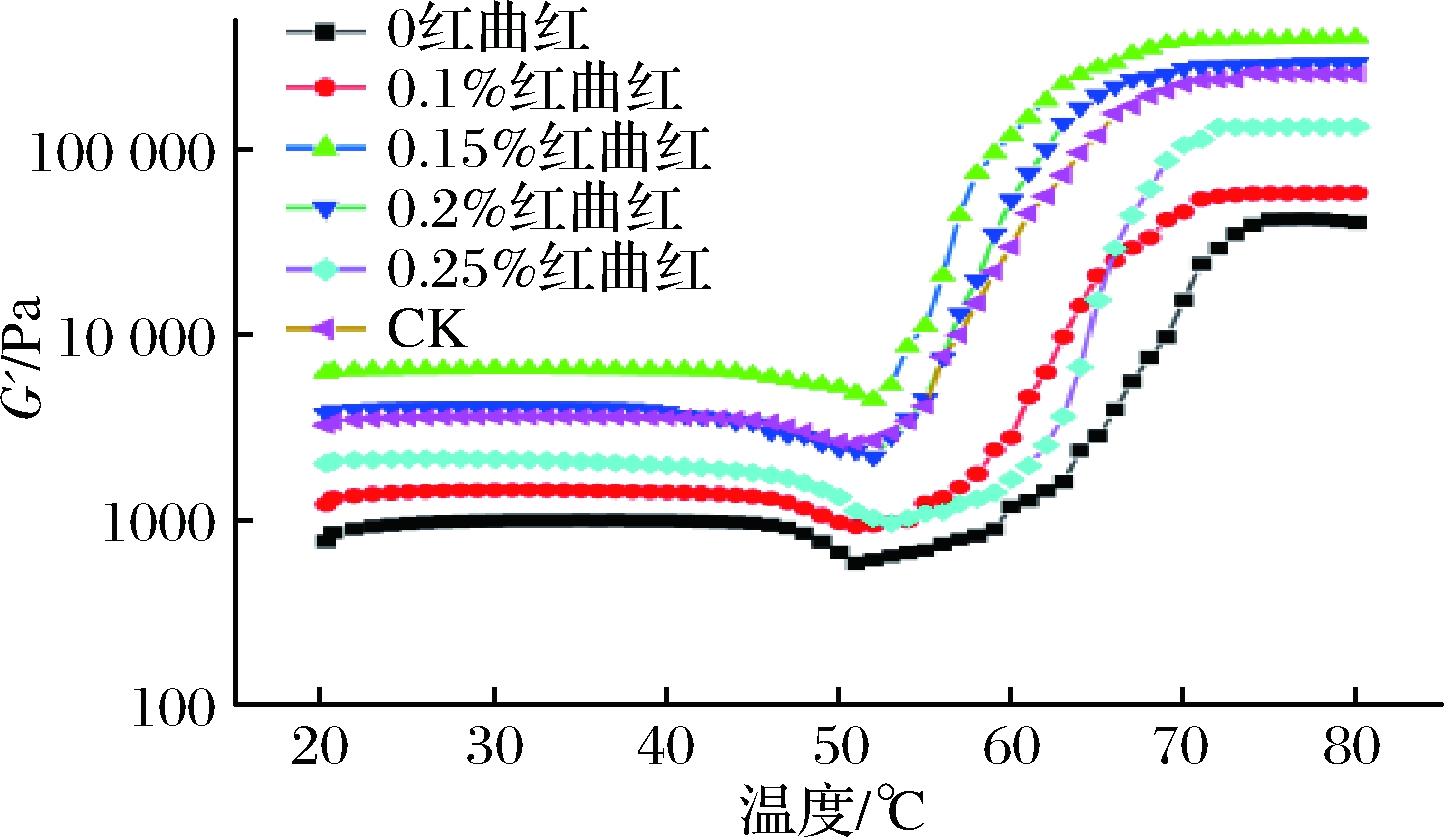
图3 红曲红添加量对MP凝胶弹性的影响
Fig.3 Effects of monascus red on the elasticity of myofibrillar protein gel
2.2 红曲红添加量对MP结构的影响
2.2.1 羰基含量的变化
羰基常通过直接氧化氨基酸侧链、结合非蛋白羰基化合物、与还原糖反应和肽骨架断裂等方式产生,其含量可反映出蛋白质的氧化程度[25]。红曲红添加量对MP羰基含量的影响如图4所示。随着红曲红添加量的不断增大,羰基含量呈先减小后增大的趋势。当添加量为0.15%时,羰基含量显著降低达到最小值3.03 nmol/mg蛋白质(P<0.05),与红曲红添加量为0时相比减少了57.8%,可能是因为红曲红分子结构中的羰基等极性基团与蛋白质相互作用,降低了氨基酸侧链被氧化的程度,使得羰基含量减少。当红曲红添加量大于0.15%时,其含量反而明显增高(P<0.05),可能是因为红曲红添加量过高,造成蛋白质分子结构进一步变性。添加红曲红后各处理组的羰基含量均显著小于红曲红添加量为0时的羰基含量(P<0.05),表明在较低亚硝酸钠含量条件下添加红曲红仍可以降低MP的羰基含量,抑制MP氧化变性。与未添加红曲红、较高含量亚硝酸钠的对照组相比,低亚硝酸钠含量下添加0.2%红曲红时的羰基含量与其接近(P>0.05),添加0.15%红曲红时的羰基含量显著低于对照组(P<0.05)。表明适量添加红曲红可以显著降低MP的巯基含量,使MP的氧化变性和降解得到扼止,进而可以提高肉制品品质。
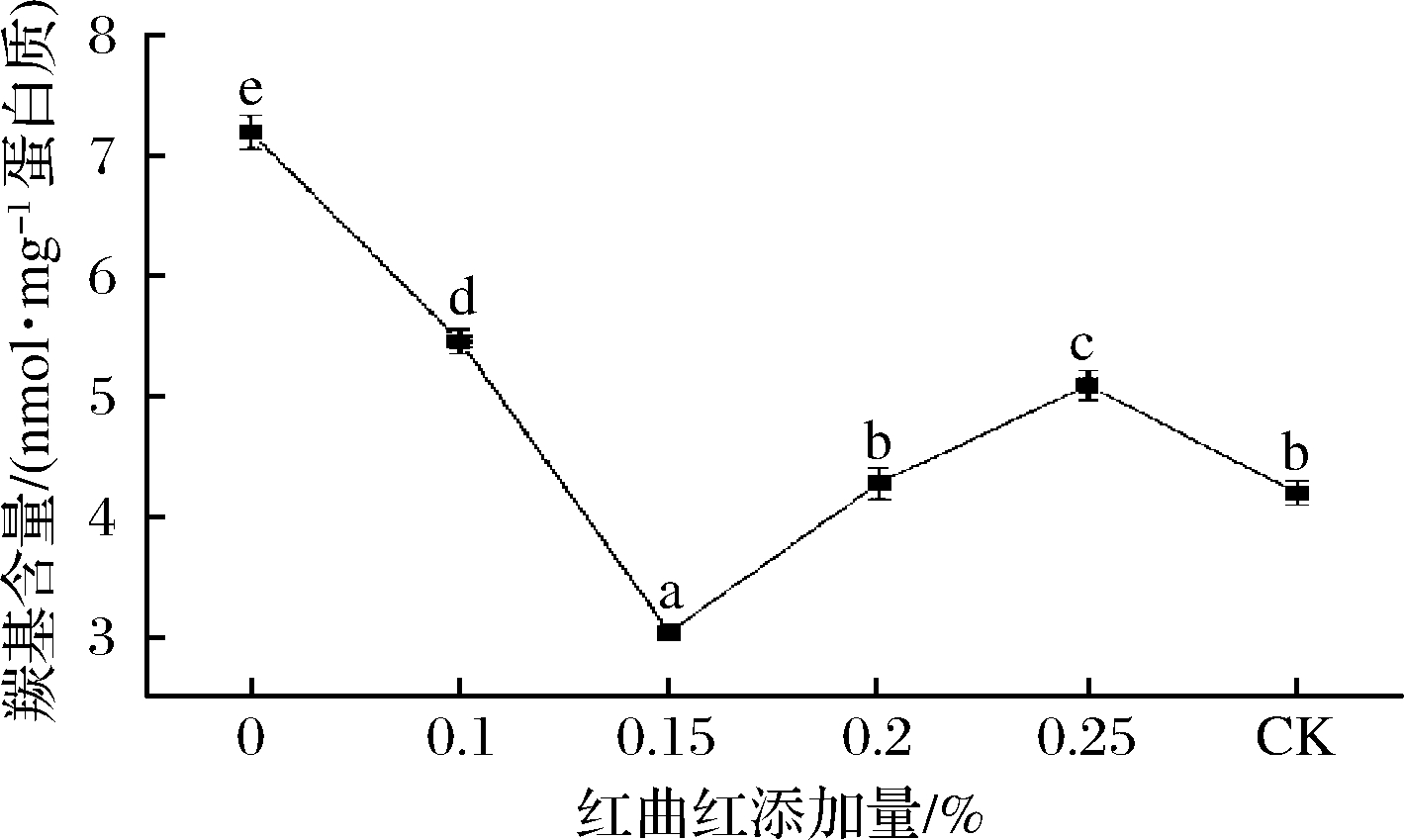
图4 红曲红添加量对MP羰基含量的影响
Fig.4 Effects of monascus red addition on myofibrillar protein carbonyl content
2.2.2 巯基含量的变化
巯基基团是MP中最活泼、最具反应活性的功能基团,对于蛋白质空间结构的稳定有重要意义,当MP变性后结构发生改变,导致巯基暴露,容易被氧化形成二硫键,使MP中巯基含量减少。巯基含量的变化可以显示出蛋白质氧化变性的水平,也关乎着其功能特性[26]。红曲红添加量对MP巯基含量的影响如图5所示。随着红曲红添加量的不断增大,MP的巯基含量呈先增大后减小的趋势。在红曲红添加量增加至0.15%时巯基含量达到最大值7.73×10-5 mol/g蛋白质,比红曲红添加量为0%时的巯基含量增大了42.1%,这可能是由于红曲红添加至蛋白溶液后体系的电荷平衡发生改变,蛋白质分子变性展开,使得分子内部的巯基部分暴露出来,巯基含量增加,以及红曲红本身可能就具有一定的抗氧化能力。随着红曲红添加量的进一步增大,巯基含量明显减小(P<0.05),这可能是因为红曲红添加量过高时,红曲红分子结构中的羰基等极性基团与蛋白质相互作用,使巯基含量下降。添加红曲红后各处理组的巯基含量均显著大于红曲红添加量为0时的巯基含量(P<0.05),表明在较低亚硝酸钠含量条件下添加红曲红仍可以提高MP的巯基含量,抑制MP氧化变性。与未添加红曲红、亚硝酸钠含量较高的对照组相比,低亚硝酸钠含量下添加0.2%红曲红时的巯基含量与其接近(P>0.05),而添加0.15%红曲红时的巯基含量显著高于对照组(P<0.05)。表明用适量添加红曲红可以显著提高MP的巯基含量,对MP的氧化变性和降解有更有效的抑制作用。

图5 红曲红添加量对MP巯基含量的影响
Fig.5 Effects of monascus red addition on myofibrillar protein sulfhydryl content
2.2.3 表面疏水性的变化
蛋白分子表面存在疏水性氨基酸,它的相对含量反映蛋白质表面的疏水性,表面疏水性基团暴露数量与蛋白质的疏水性成正比关系,MP的蛋白分子聚集在一起,从而导致蛋白质发生不可逆的变性,因此蛋白质的变性程度可以用表面疏水性来衡量[27-28]。溴酚蓝可以与蛋白质的疏水位点相结合,因此可以根据蛋白质与溴酚蓝的结合量来测定表面疏水性[29]。
红曲红添加量对MP表面疏水性的影响如图6所示。随着红曲红添加量的不断增大,溴酚蓝含量呈先减小后增大的趋势。当红曲红添加量为0.15%时,溴酚蓝含量显著降低达到最小值17.59 μg(P<0.05),与红曲红添加量为0%时相比减少了11.89 μg,可能是因为红曲红的加入促进了蛋白质与水分子之间的缔合作用,疏水性基团暴露得较少,降低了溴酚蓝含量[30];另一方面与蛋白发生疏水相互作用可能会导致疏水基团的掩蔽。当红曲红添加量大于0.15%时,溴酚蓝含量呈上升趋势(P<0.05),这可能是因为添加的红曲红添加量较高,导致蛋白质二级结构里的α-螺旋含量、无规卷曲含量发生变化,α-螺旋含量呈下降趋势,无规卷曲含量持续增加,蛋白分子结构的逐渐展开造成包埋在分子内的疏水性基团逐渐大量暴露出来,增加了溴酚蓝含量[31]。MP与溴酚蓝的结合程度表明疏水性强弱,两者成正比关系,疏水性越强,MP的变性程度越大。添加红曲红后各处理组的溴酚蓝含量均显著小于红曲红添加量为0时的溴酚蓝含量(P<0.05),表明在亚硝酸钠含量较低时添加红曲红仍可以降低MP的表面疏水性,从而抑制蛋白质变性,使其功能特性得到改善。与未添加红曲红、亚硝酸钠含量较高的对照组相比,低亚硝酸钠含量下添加0.15%红曲红时的溴酚蓝含量与其接近(P>0.05),表明用适量添加红曲红不会对MP的表面疏水性产生显著影响。
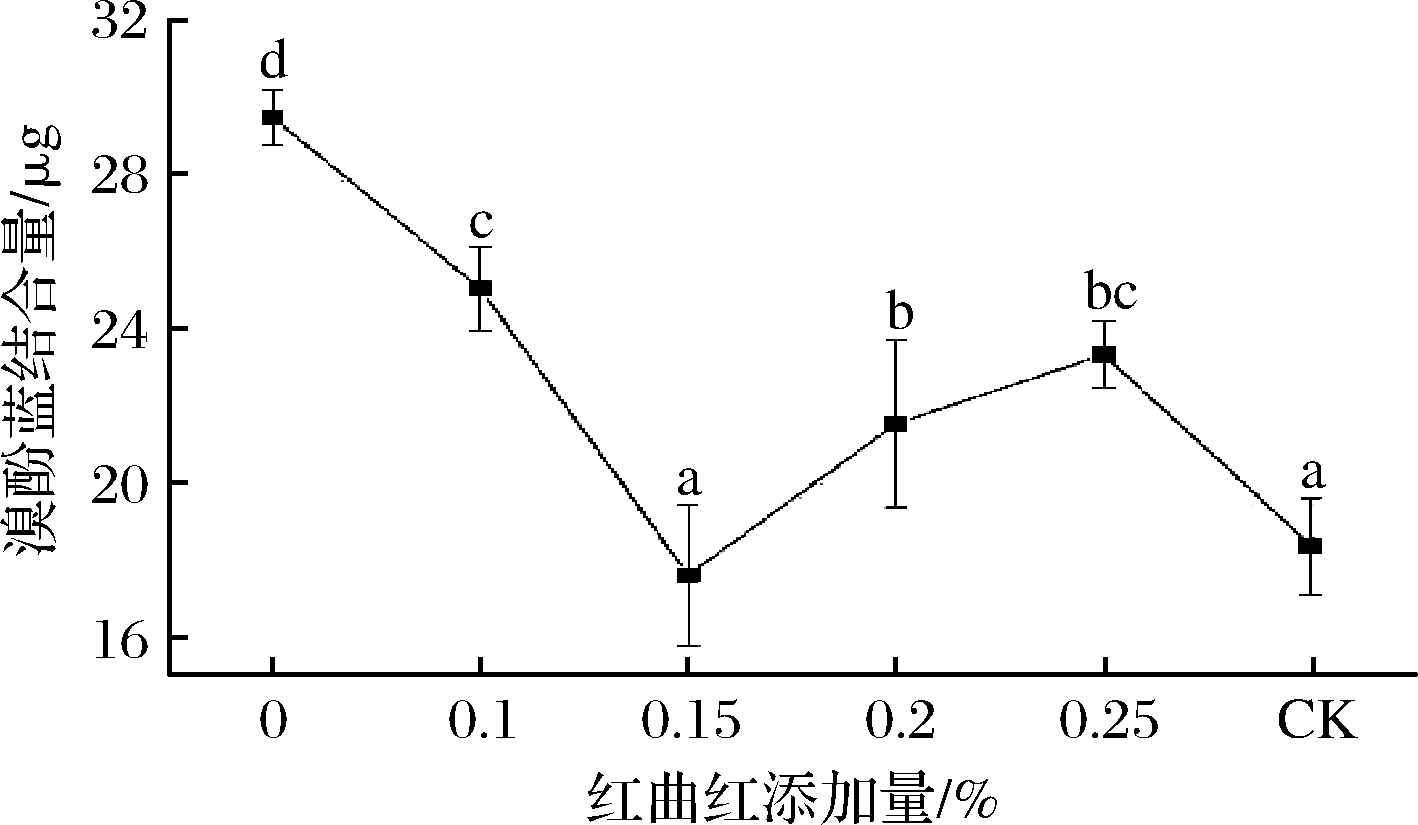
图6 红曲红添加量对MP表面疏水性的影响
Fig.6 Effects of monascus red addition on hydrophobicity of myofibrillar protein surface
2.2.4 SDS-PAGE分析
MP由多种蛋白质构成,在蛋白溶液样品中加入不同浓度的红曲红后其电泳条带的变化会有所不同。红曲红部分替代亚硝酸钠对MP的SDS-PAGE图谱的影响如图7所示。通常,蛋白质氧化的主要产物就是发生聚集或者形成蛋白质片断[32]。氧化后的MP很可能产生一些高分子化合物,聚集在一起,在分离胶顶部聚积,甚至存在于浓缩胶中,无法进入分离胶。由图中可以看出,在凝胶顶部存在着一些颜色很深的条带,很可能就是蛋白质形成的聚集体,因其分子质量超过200 kDa,不能透过凝胶网络,从而聚积在凝胶顶部。分子间二硫键和二聚酪氨酸的形成,以及蛋白质自由基间的聚集等都可能引起高分子质量聚集体的形成。由此推断,氧化后的蛋白质结构发生了很大变化,可能是通过蛋白分子共价交联或亚基片断重组产生了高分子质量聚集体。添加红曲红后各处理组的蛋白样品其肌球蛋白重链(分子质量为200 kDa)条带和肌动蛋白(分子质量为43 kDa)条带都明显低于红曲红添加量为0%时的蛋白样品,表明在较低亚硝酸钠含量条件下添加红曲红能够在不同程度上抑制MP的氧化变性。与未添加红曲红、亚硝酸钠含量较高的对照组相比,低亚硝酸钠含量下添加0.2%红曲红时蛋白的肌球蛋白重链(分子质量为200 kDa)条带和肌动蛋白(分子质量为43 kDa)条带颜色与其接近,添加0.15%红曲红时蛋白的肌球蛋白重链(分子质量为200 kDa)条带和肌动蛋白(分子质量为43 kDa)条带明显减弱。表明用适量红曲红替代一部分亚硝酸钠可以更有效抑制MP的氧化变性和降解,进而可以提高肉制品品质。

M-标准蛋白(marker);图中1~6分别代表红曲红为0、0.1%、0.15%、0.2%、0.25%、CK,MHC-肌球蛋白重链;Actin-肌动蛋白
图7 红曲红添加量对MP SDS-PAGE图谱的影响
Fig.7 Effects of monascus red addition on the SDS-PAGE map
2.2.5 红外光谱分析
红曲红添加量对MP二级结构的影响如图8所示。随着红曲红添加量的不断增加,MP二级结构中α-螺旋含量呈先增大后减小的趋势,而β-折叠、β-转角以及无规则卷曲含量变化与之相反。β-螺旋是依靠MP分子内氢键形成的,β-折叠是依靠蛋白质分子间氢键形成的,蛋白质分子间的展开程度和聚集程度可分别由α-螺旋含量和β-折叠含量表现出来。当蛋白质氧化程度增加时,蛋白分子中的氢键作用被破坏,导致蛋白质分子展开,蛋白质结构遭到破坏,MP凝胶的疏水相互作用发生变化,形成了更多的蛋白质聚集体,使得MP二级结构发生变化,导致α-螺旋含量下降,β-折叠、β-转角、无规则卷曲含量上升。当红曲红添加量为0.15%时α-螺旋含量达到最大值22.73%,表明红曲红本身就具有一定的抗氧化能力。之后随着红曲红添加量的继续增加,α-螺旋含量明显减小(P<0.05),导致这一结果的原因可能是由于红曲红添加量过高时,蛋白溶液后体系的电荷平衡发生改变,蛋白质分子变性展开,改变了蛋白质二级结构里的α-螺旋、β-折叠含量,α-螺旋含量逐渐降低,β-折叠含量逐渐上升。添加红曲红后各处理组蛋白的α-螺旋含量均显著大于红曲红添加量为0%时的α-螺旋含量(P<0.05),β-转角、β-折叠以及无规则卷曲含量明显降低,表明在较低亚硝酸钠含量条件下添加红曲红对维持蛋白质的二级结构具有一定作用,能够抑制MP氧化变性。与未添加红曲红、有较高亚硝酸钠含量的对照组相比,低亚硝酸钠含量下添加0.2%红曲红时蛋白的二级结构含量与其接近(P>0.05),与对照组相比,添加0.15%红曲红时的α-螺旋含量明显增多(P<0.05),β-折叠、β-转角以及无规则卷曲含量降低。表明适量添加红曲红可以更有效地抑制MP的氧化变性和降解。
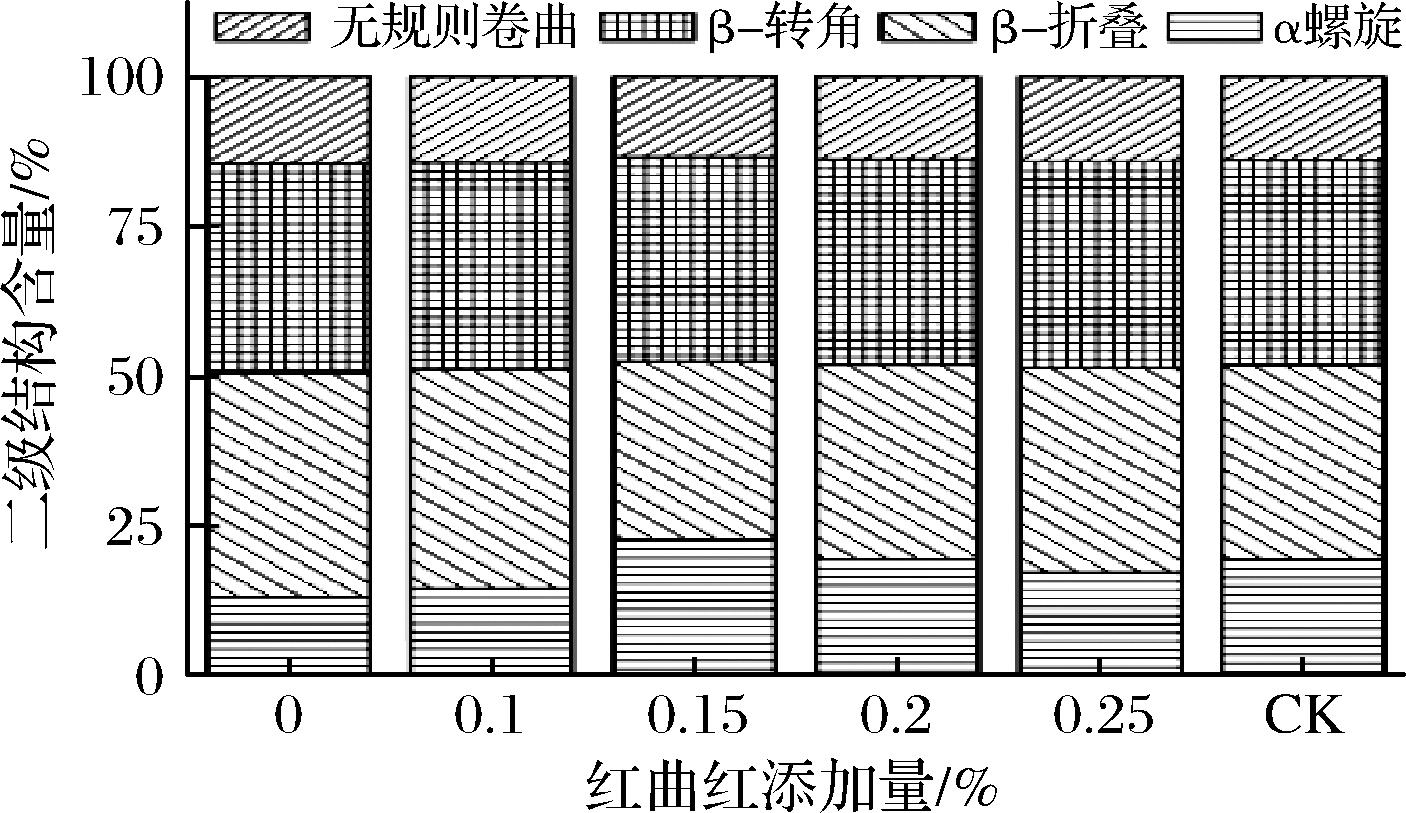
图8 红曲红添加量对MP二级结构含量的影响
Fig.8 Effects of monascus red addition on secondary structure content of myofibrillar protein
3 结论
在腌制过程中,亚硝酸钠对MP的功能性质影响极为显著,单纯地降低亚硝酸钠使用量会严重影响MP的功能性质。
对猪肉MP羰基含量、巯基含量、表面疏水性和红外光谱分析表明,红曲红能有效抑制MP分子结构的变化,维持其二级结构的稳定性;对猪肉MP溶解度、乳化性和流变学性质的分析表明,红曲红能有效改善MP的亲水性质、表面性质和凝胶性质。
从MP功能特性的角度考虑,低亚硝酸钠含量(0.005%)条件下,红曲红的最适添加量为0.15%,此时猪肉MP的功能性质优于高亚硝酸钠含量(0.01%)实验组,红曲红添加量浓度过高或过低都会影响低硝肉制品的加工性能。
[1] KUROIWA Y, OKAMURA T, ISHII Y, et al. Enhancement of esophageal carcinogenesis in acid reflux model rats treated with ascorbic acid and sodium nitrite in combination with or without initiation[J]. Cancer Science,2008, 99(1):7-13.
[2] KUTAMURA Y, UMEMURA T, OKAZAKI K, et al. Enhancing effects of simultaneous treatment with sodium nitrite on 2-amino-3-methylimidazo[4,5-f]quinoline-induced rat liver, colon and Zymbal′s gland carcinogenesis after initiation with diethylnitrosamine and 1,2-dimethylhydrazine[J]. International Journal of Cancer, 2010, 118(10):2 399-2 404.
[3] LINSEISEN J,ROHRMANNS,NORATT, et al. Dietary intake of different types and characteristics of processed meat which might be associated with cancer risk--results from the 24-hour diet recalls in the European Prospective Investigation into Cancer and Nutrition (EPIC)[J]. Public Health Nutrition, 2006, 9(4):449-464.
[4] 谢珍珍, 李建英. 红曲色素稳定性的研究[J]. 食品科学, 1994, 15(7):15-17.
[5] 赵燕, 温辉梁, 胡晓波. 红曲色素及其在食品工业中的应用[J]. 中国食品添加剂, 2004(4):90-93.
[6] 唐雪燕, 任丽影, 王丽莎,等. 不同腌制方式对猪肉品质的影响[J]. 食品研究与开发, 2016, 37(23):114-119.
[7] 陈星.酸辣猪肉干加工工艺及产品特性研究[D].武汉:华中农业大学, 2016.
[8] 李燕萍, 许杨, 徐尔尼,等. 红曲霉的抑菌活性物质与桔青霉素[J]. 卫生研究, 1998,27(S1):77-80.
[9] 王敏. 肉制品中亚硝酸盐的作用、安全性及代替物的讨论[J]. 肉品卫生, 2001(9):24-25.
[10] CROSS A J, LEITZMANN M F, GAIL M H, et al. A prospective study of red and processed meat intake in relation to cancer risk.[J]. PloS Medicine, 2007, 4(12):e325.
[11] FALOWO A B, FAYEMI P O, MUCHENJE V. Natural antioxidants against lipid-protein oxidative deterioration in meat and meat products: A review[J]. Food Research International, 2014, 64: 171-181.
[12] HONG G P, XIONG Y L. Microbial transglutaminase-induced structural and rheological changes of cationic and anionic myofibrillar proteins[J]. Meat Science, 2012, 91(1): 36-42.
[13] KUNARAYAKUL S, THAIPHANIT S, ANPRUNG P, et al. Optimization of coconut protein deamidation using protein-glutaminase and its effect on solubility, emulsification, and foaming properties of the proteins[J]. Food Hydrocolloids, 2017, 79:197-207.
[14] AGYARE K K, ADDO K, XIONG Y L. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1):72-81.
[15] AMIRI A, SHARRIFIAN P, SOLTANIZADEH N. Application of ultrasound treatment for improving the physicochemical, functional and rheological properties of myofibrillar proteins[J]. International Journal of Biological Macromolecules, 2018, 111:139-147.
[16] TOKUR B, KORKMAZ K. The effects of an iron-catalyzed oxidation system on lipids and proteins of dark muscle fish[J]. Food Chemistry, 2007, 104(2):754-760.
[17] YONGSAWATDIGUL J, PARK J W. Thermal denaturation and aggregation of threadfin bream actomyosin[J]. Food Chemistry, 2003, 83(3):409-416.
[18] CHELH I, GATELLIER P, SANT -LGOUTELLIER V. Technical note: A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4):681-683.
-LGOUTELLIER V. Technical note: A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4):681-683.
[19] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage-T4[J].Nature, 1970, 227(5 259): 680-685.
[20] 林婉玲, 杨贤庆, 李来好,等. 浸渍冻结对调理草鱼冻藏过程中肌原纤维蛋白特性的影响[J]. 南方水产科学, 2016, 12(3):67-73.
[21] 周洁, 谢晓琼. 不同溶解性红曲红色素的稳定性比较[J]. 化学工程与装备, 1997(4):25-27.
[22] XIONG Yao, LI Qianru, MIAO Song, et al. Effect of ultrasound on physicochemical properties of emulsion stabilized by fish myofibrillar protein and canthan gum[J]. Food Weekly News, 2019,54:225-234.
[23] HATTORI A, TAKAHASHI K. Calcium-induced weakening of skeletal muscle Z-Disks[J]. Journal of Biochemistry, 1982, 92(2):381-390.
[24] WU Fan,SHI Xiaojie, ZOU Henan,et al.Effects of high-pressure homogenization on physicochemical, rheological and emulsifying properties of myofibrillar protein[J]. Journal of Food Engineering, 2019, 263: 272-279.
[25] 崔旭海, 孔保华. 蛋白质氧化及其对乳蛋白结构与功能性的影响[J]. 中国乳品工业, 2008, 36(1):44-47.
[26] BENJAKUL S, VISESSANGUAN W C, THONGKAEW C,et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J]. Food Research International, 2003, 36(8):787-795.
[27] COFRADES S, CARBALLO J, CARECHE M, et al. Emulsifying properties of actomyosin from several species[J]. Foodence & Technology Lebensmittel Wissenschaft & Technologie, 1996, 29(4):379-383.
[28] 李学鹏, 刘慈坤, 周明言,等. 羟自由基氧化对草鱼肌原纤维蛋白结构和凝胶性质的影响[J]. 食品科学, 2017, 38(21):30-37.
[29] 李艳青, 孔保华, 杨赫鸿,等. 自由基氧化引起鲤鱼肌原纤维蛋白结构的变化[J]. 食品科学, 2012, 33(13):70-74.
[30] MOURE A, SINEIRO J, DOM NGUEZ H, et al. Functionality of oilseed protein products: A review[J]. Food Research International, 2006, 39(9):945-963.
NGUEZ H, et al. Functionality of oilseed protein products: A review[J]. Food Research International, 2006, 39(9):945-963.
[31] CHEFTL J C, CULIOLI J. Effects of high pressure on meat: A review[J]. Meat Science, 1997, 46(3):211-236.
[32] LIU G, XIONG Y L, BUTTERFIELD D A. Chemical, physical, and gel-forming properties of oxidized myofibrils and whey- and soy-protein isolates[J]. Journal of Food Science, 2010, 65(5):811-818.