乳酸菌是一类能够通过发酵糖类产生乳酸的细菌总称[1]。具有维持肠道微生态平衡、抑制肠道有害菌的生长繁殖等益生功能[2];同时调节消化免疫系统,延缓机体衰老。苹果营养价值高,生态适应性强,耐贮性好,供应周期长,世界上相当多的国家都将其列为主要消费果品。中国是苹果种植大国,产量占世界的40%以上,我国苹果总产量居其他水果之首,占水果总产量的27%[3]。苹果含有VC、VE和β-胡萝卜素等多种维生素类成分以及人体必需的微量元素如钙、铁、钾、锰、锌、镁、铜、硫等[4],同时苹果中含有17种氨基酸,其中7种为人体必需但自身又无法合成的氨基酸。苹果中含有鞣质和多种果酸,帮助食物消化,并促进胃收敛,加速食物的消化吸收[5]。长期以来,由于加工条件等的限制,导致了我国大量的苹果资源浪费,造成了经济损失。
近年来,采用益生菌发酵果蔬生产的果蔬汁饮料受到许多消费者的青睐,许多国内外学者也致力于益生菌发酵果蔬汁的研究。利用乳酸菌混合发酵香梨-黄瓜果蔬汁[6];利用干酪乳杆菌和植物乳杆菌复合发酵出营养价值高、风味浓郁蓝莓发酵饮料[7];对胡萝卜汁乳酸发酵技术进行了研究[8];以柚子和菊芋为原料研制果蔬汁发酵饮料[9];叶盼[10]对植物乳杆菌发酵苹果汁的生理活性进行研究;严成[11]以鲜乳为原料,添加番茄汁、草莓汁、橙汁得到复合果蔬汁进行乳酸菌发酵,发酵所得果蔬汁口感细腻,酸甜适中,具有果蔬特有的滋味和芳香。成晓霞等[12]将胡萝卜原汁分别与草莓汁、桃汁、菠萝汁等进行了按适当比例混合,制成胡萝卜混合汁,风味独特。以苹果为原料,通过乳酸菌发酵,不仅能够高效利用苹果资源,解决因各种原因导致的苹果资源浪费现象,还能够研制出一款兼具苹果风味和乳酸发酵风味的苹果汁发酵饮料,满足人们日益增长的消费需求[13]。
1 材料与方法
1.1 试验材料
1.1.1 试验原料
红富士苹果采摘于洛川,成熟度好,大小均一,无机械损害,无腐烂或病害。
1.1.2 发酵菌种
短乳杆菌(Lactobacillus brevis)YM13011,于陕西师范大学食品工程与营养科学学院实验室保存。
1.1.3 主要试剂
蛋白胨、牛肉粉、酵母粉、葡萄糖、吐温80、K2HPO4、乙酸钠、MnSO4、MgSO4、柠檬酸三铵、琼脂粉、蔗糖、抗坏血酸、果胶酶等,所有试剂均为国产分析纯,西安博晶生物科技有限公司。酒石酸,苹果酸,乳酸,乙酸,琥珀酸,柠檬酸,富马酸,己二酸(均为标准品),美国 Sigma 公司;甲醇,磷酸均为色谱纯。
1.2 仪器与设备
Ultimate3000高效液相色谱仪,Thermo公司;SW-CJ-1F超净工作台,上海跃进医疗器械厂;SZCL磁力搅拌器,巩义市宇翔仪器有限公司;BDW1-FW-200高速万能粉碎机,北京科伟永兴仪器有限公司;HWS智能恒温恒湿培养箱,宁波江南仪器厂;LX-B75 L灭菌锅,合肥华泰医疗设备有限公司。
1.3 试验方法
1.3.1 短乳杆菌的活化与扩大培养
菌种的活化:将冷冻保藏的短乳杆菌菌种解冻至室温,接种至10 mL MRS液体培养基中,37 ℃、静置培养24 h。反复活化2~3次,备用。
菌种的驯化:将活化好的短乳杆菌菌种按接种量10%分别接种于50 mL的苹果汁原汁中,于37 ℃静置培养48 h。
1.3.2 苹果汁发酵
苹果挑选、去核、清洗,切成块状后迅速用榨汁机榨汁,将果汁和果渣混合形成果浆,加入3‰的抗坏血酸进行护色处理,然后用电磁炉将果浆加热至90 ℃左右进行灭菌处理3~5 min,当果浆冷却至50 ℃左右时,加入适量的果胶酶,搅拌均匀后,放入50 ℃的水浴锅中酶解3 h,使果肉组织细胞中的果汁充分流出;用离心机分离果汁,巴氏杀菌法进行杀菌获得澄清的苹果原汁。
1.3.3 发酵苹果汁培养基
选择短乳杆菌菌株进行发酵,选取菌浓度为考察指标,经单因素试验筛选出最优碳源、氮源和缓冲盐等因素及其最适浓度。
1.3.3.1 培养基碳源的筛选
不同碳源对LB菌株生长的影响:向含有3 g/L K2HPO4、8 g/L蛋白胨的苹果汁中分别加入30 g/L的葡萄糖、蔗糖、乳糖、果糖以及水苏糖,121 ℃灭菌20 min,待苹果汁冷却至30 ℃时,于无菌操作台中,接入5%的LB菌株,37 ℃下连续培养,测OD600。
葡萄糖浓度对LB菌株生长的影响:向含有3 g/L K2HPO4、8 g/L蛋白胨的苹果汁中分别加入10、30、50、70、90 g/L葡萄糖,试验操作同上,研究葡萄糖浓度对LB菌株生长的影响。
1.3.3.2 培养基氮源的筛选
不同氮源对LB菌株生长的影响:向含有3 g/L K2HPO4、50 g/L葡萄糖的苹果汁中分别加入8 g/L蛋白胨、胰蛋白胨、(NH4)2SO4、NH4Cl,121 ℃灭菌20 min,待苹果汁冷却至30 ℃时,于无菌操作台中,接入5%的LB菌株,37 ℃下连续培养,测OD600。
蛋白胨浓度对LB菌株生长的影响:向含有3 g/L K2HPO4、50 g/L葡萄糖的苹果汁中分别加入5、7、9、11、13 g/L的蛋白胨,试验操作同上,研究蛋白胨浓度对LB菌株生长的影响。
1.3.3.3 培养基缓冲盐的筛选
不同缓冲盐对LB菌株生长的影响:向含有9 g/L蛋白胨、50 g/L葡萄糖的苹果汁中分别加入3 g/L的CaCO3、K2HPO4、KH2PO4、NaH2PO4、Na2HPO4,121 ℃灭菌20 min,待苹果汁冷却至30oC时,于无菌操作台中,接入5%的LB菌株,37 ℃下连续培养,测OD600,测定菌株浓度。
K2HPO4浓度对LB菌株生长的影响:向含有9 g/L蛋白胨、50 g/L葡萄糖的苹果汁中分别加入1、2、3、4、5 g/L的K2HPO4,试验操作同上,研究K2HPO4浓度对LB菌株生长的影响。
1.3.4 发酵苹果汁工艺的优化
1.3.4.1 单因素试验
选取总酸、还原糖为考察指标,选取接种量、发酵温度、发酵时间中某一个为单因素变量,其他因素为固定因素进行试验。具体条件如下:
(1)接种量:设定发酵温度为37 ℃,发酵时间为4 d,菌株接种量分别设定为4%、6%、8%、10%、12%。
(2)发酵温度:设定接种量为8%,发酵时间为4 d,发酵温度分别设定为30、33、36、39、42 ℃。
(3)发酵时间:设定接种量为8%,发酵温度为36 ℃,每隔1 d测定1次。
1.3.4.2 苹果汁乳酸发酵响应面优化
在上述单因素试验的基础上,应用中心组合设计Box-Benhnken对苹果汁发酵工艺进行优化。选取具有显著性影响的接种量(A)、发酵温度(B)和发酵时间(C)3个因素,进行响应面分析,因素水平编码表见表1。
1.3.5 有机酸的测定
HPLC法测发酵苹果汁中各种有机酸含量的变化。色谱条件:DiamonsilC18柱 (250 mm×4.6 mm, 5 μm),柱温30 ℃,进样量10 μL,紫外检测波长210 nm。流动相的配置:0.01 mol/L (NH4)3PO4,用H3PO4调pH值至2.70,等度洗脱20 min。流速0.7 mL/min,样品过0.45 μm有机系滤膜。
表1 因素水平编码表
Table 1 Experimental factors and coding levels in response surface design

编码值接种量(A)/%发酵温度(B)/℃发酵时间(C)/d-1633408365110396
1.3.6 测定方法
总酸的测定按GB/T 12456—2008[14]执行,酸碱滴定法测定(以乳酸计);还原糖的测定:按GB 5009.7—2016[15]执行;有机酸的测定:参照GB5009.157—2016[16-17]等的方法并略作改进。
2 结果与分析
2.1 短乳杆菌发酵苹果汁培养基
2.1.1 碳源对短乳杆菌菌株生长的影响
由图1可知,苹果汁中添加不同碳源对LB菌株生长的影响程度不同,葡萄糖为最适碳源,其次为水苏糖和果糖,因此在苹果汁发酵液中添加葡萄糖作为其碳源补充剂。
由图2可知,苹果汁中不同葡萄糖浓度对LB菌株的影响情况也呈现差异性,当葡萄糖质量浓度为50 g/L时,LB菌株的OD600最高,继续添加葡萄糖浓度时,OD600下降,因此确定在苹果汁培养液中的葡萄糖质量浓度为50 g/L。
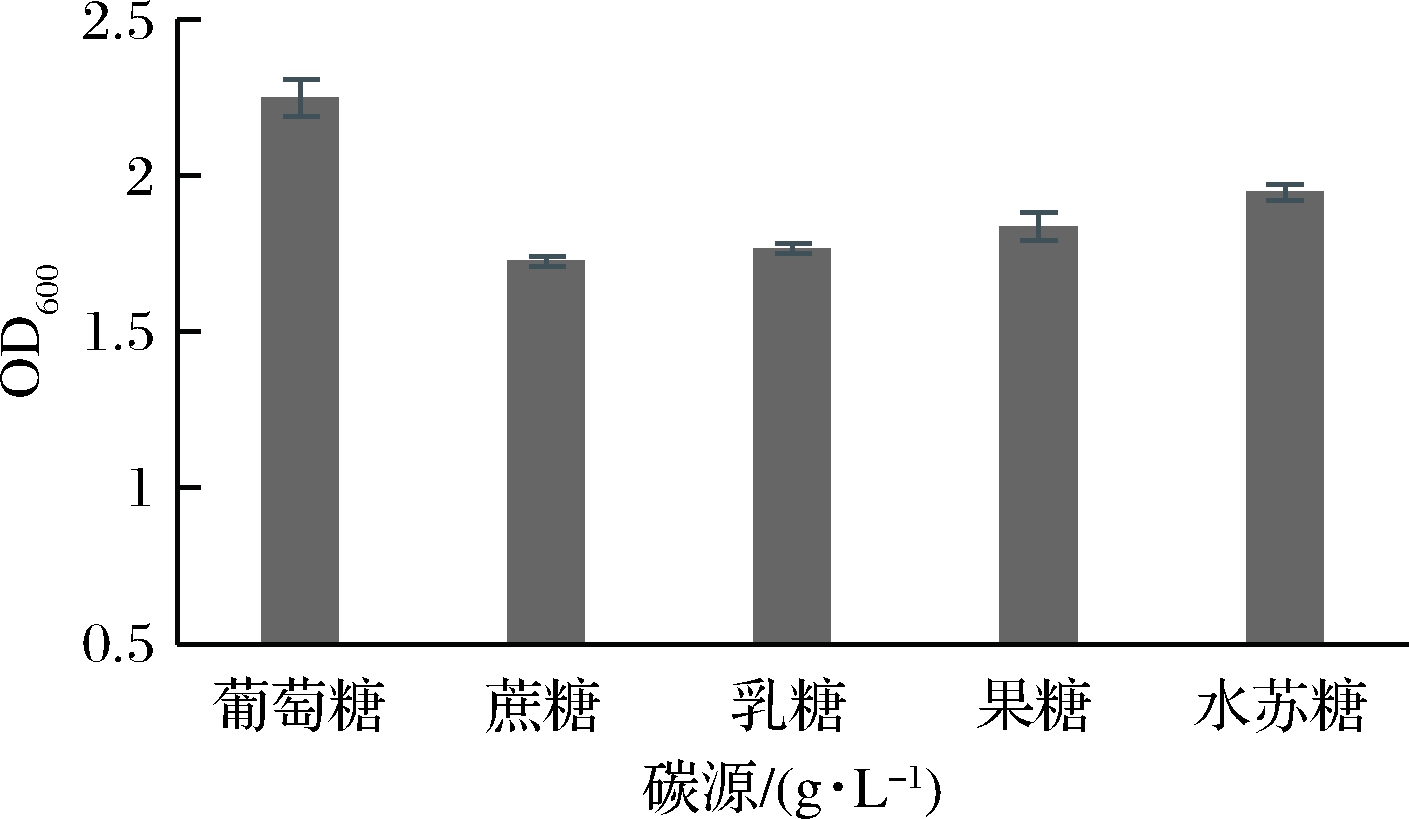
图1 不同碳源对菌株生长的影响
Fig.1 Effects of different carbon sources on bacterial growth
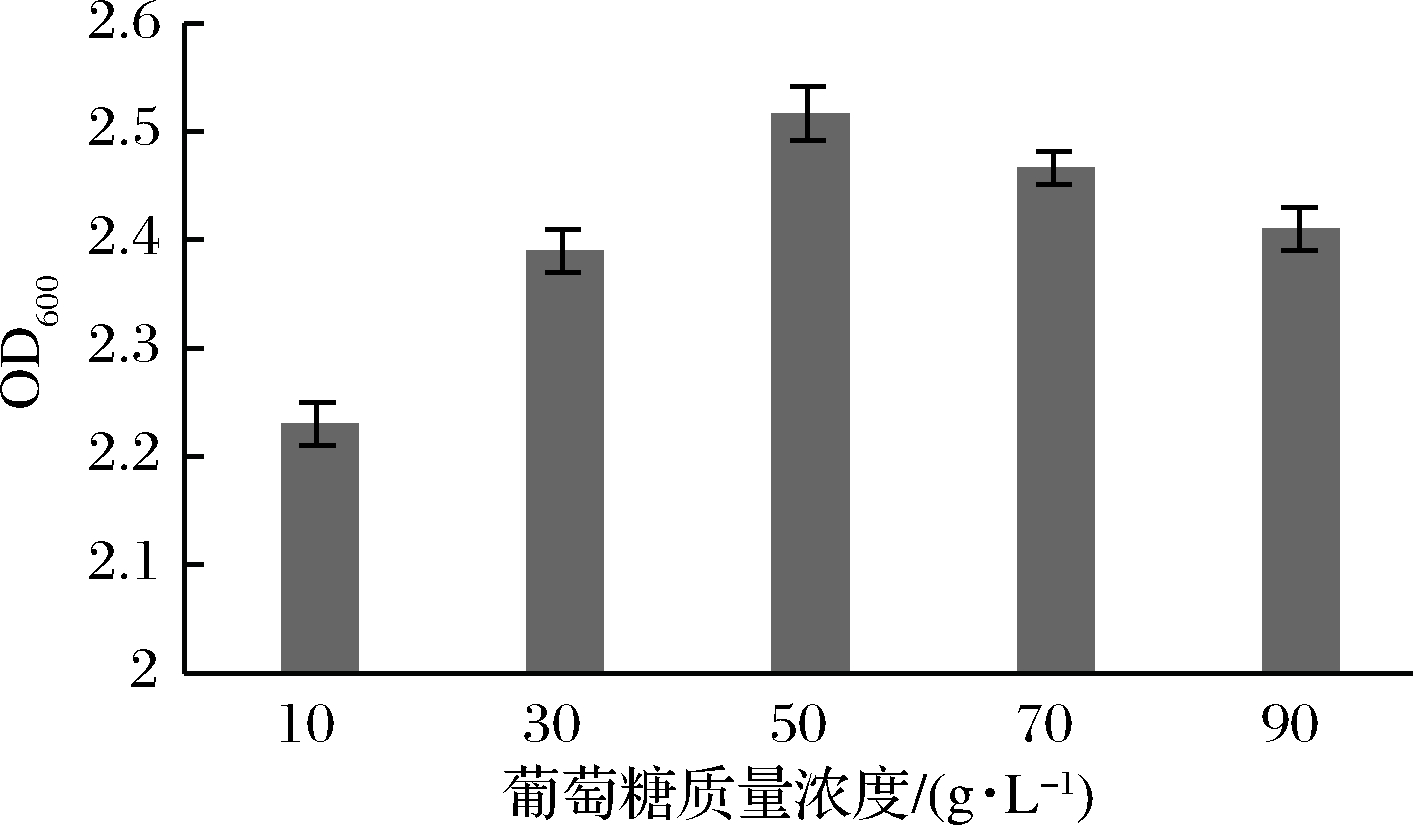
图2 葡萄糖浓度对菌株生长的影响
Fig.2 Effects of glucose concentration on bacterial growth
2.1.2 氮源对短乳杆菌菌株生长的影响
由图3可知,对苹果汁中不同氮源LB菌株生长的影响程度不同,蛋白胨为最适氮源,其次为氯化铵和胰蛋白胨,因此在苹果汁发酵液中添加蛋白胨作为其氮源补充剂。
由图4可知,苹果汁中不同蛋白胨质量浓度对LB菌株的影响情况也呈现差异性,当蛋白胨质量浓度为9 g/L时,LB菌株的OD600最高,继续添加蛋白胨浓度时,OD600下降,因此确定在苹果汁培养液中的蛋白胨质量浓度为9 g/L。

图3 不同氮源对菌株生长的影响
Fig.3 Effects of different nitrogen sources on bacterial growth
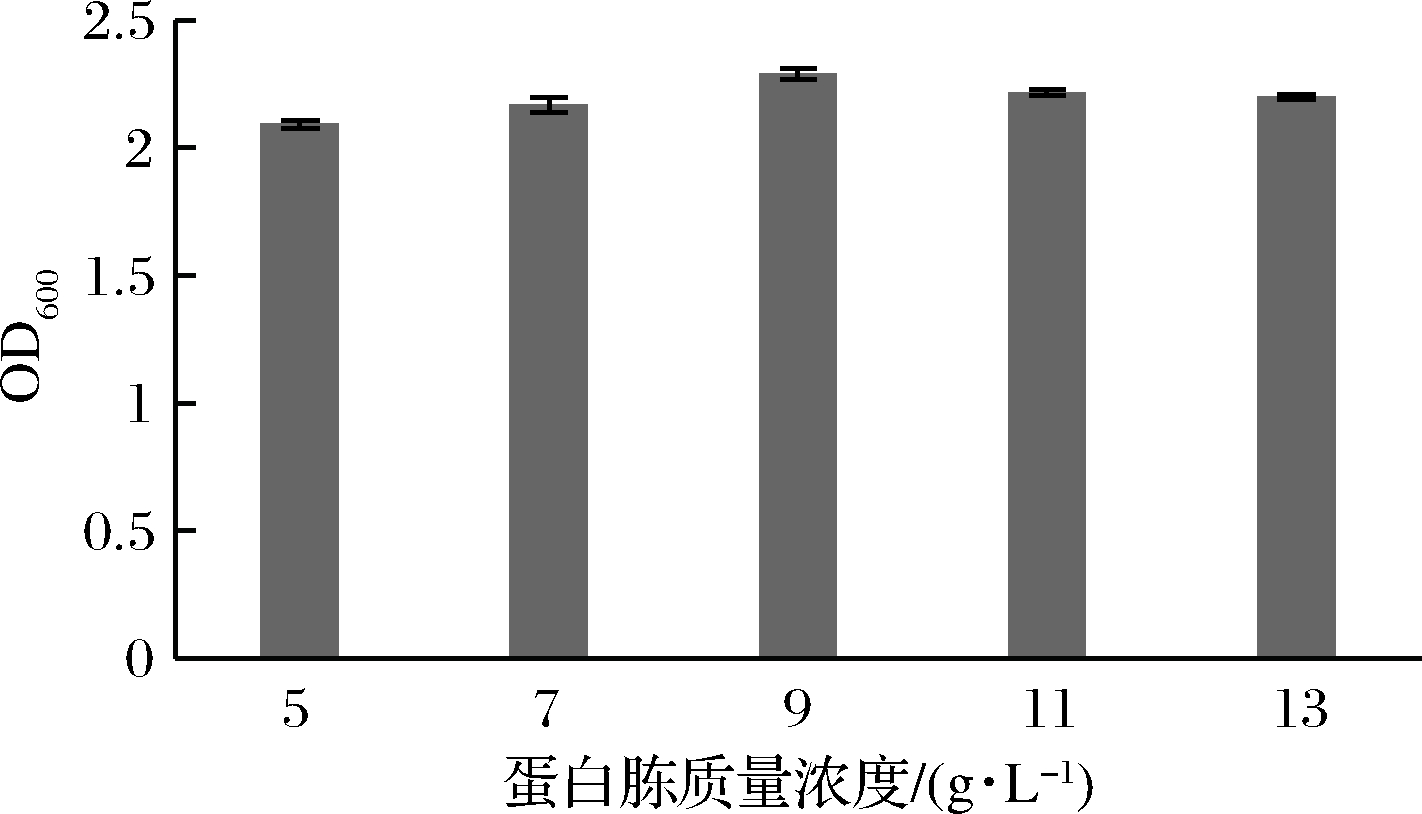
图4 蛋白胨浓度对菌株生长的影响
Fig.4 Effect of peptone concentration on strain growth
2.1.3 缓冲盐对短乳杆菌菌株生长的影响
由图5可知,苹果汁中不同缓冲盐对LB菌株生长的影响程度不同,KH2PO4为最适缓冲盐,其次为K2HPO4和CaCO3,因此在苹果汁发酵液中添加KH2PO4作为其缓冲盐补充剂。
由图6可知,苹果汁中不同KH2PO4浓度对LB菌株的影响情况也呈现差异性,当KH2PO4质量浓度为4 g/L时,LB菌株的OD600最高,继续添加KH2PO4浓度时,OD600下降,因此确定在苹果汁培养液中的KH2PO4浓度为4 g/L。
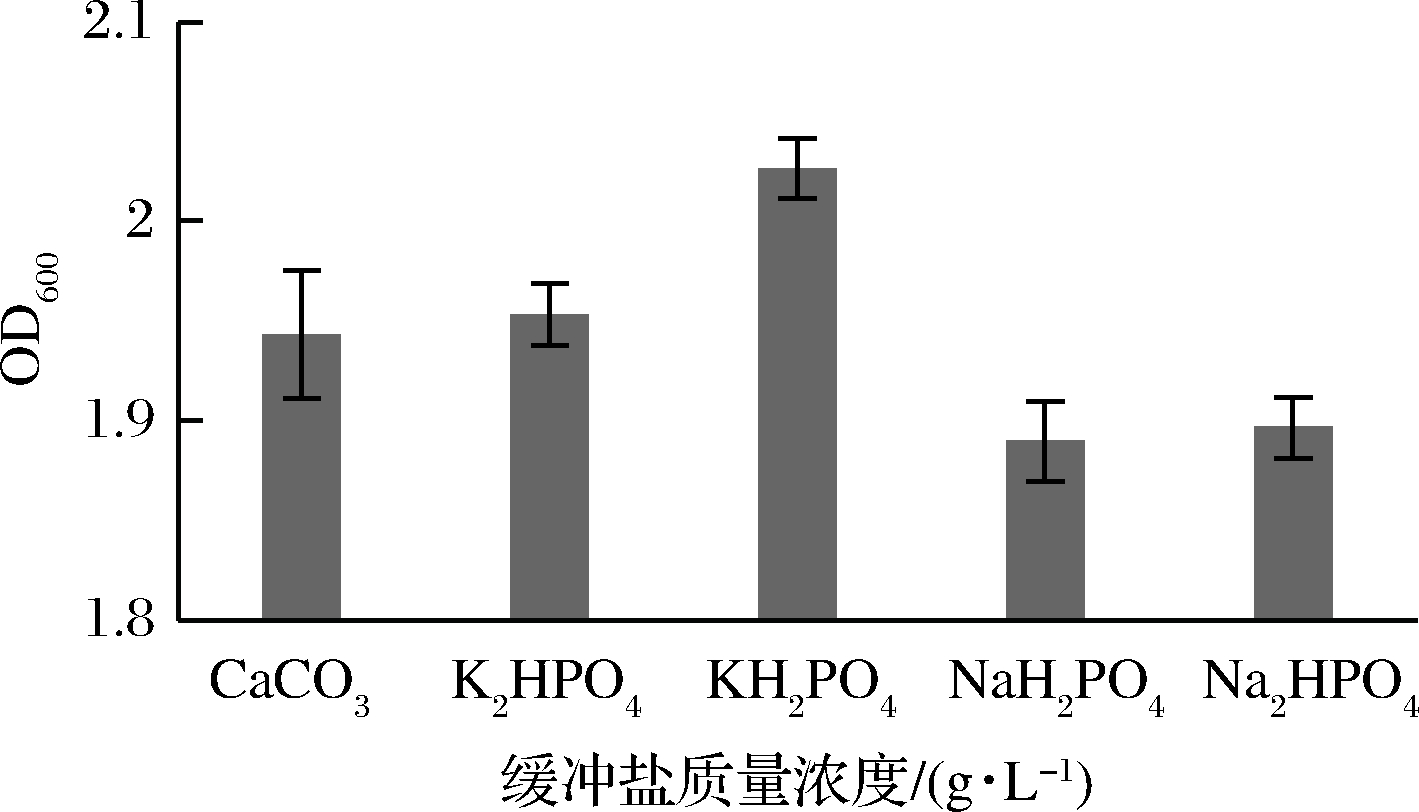
图5 不同缓冲盐对菌株生长的影响
Fig.5 Effects of different buffer salts on bacterial growth

图6 K2HPO4质量浓度对菌株生长影响
Fig.6 Effect of K2HPO4 concentration on strain growth
2.2 短乳杆菌发酵苹果汁工艺的优化
2.2.1 接种量对苹果汁乳酸发酵总酸和还原糖含量的影响
由图7和图8可知,随着苹果汁发酵时间的延长,苹果汁的总酸含量先迅速上升,后逐步趋于平缓。接种量由4%增大到8%,总酸含量显著增加;从整体来看,还原糖含量呈现先持续下降,后趋于平稳的趋势。当接种量达到8%时,产酸效果最好,此时还原糖含量也最低;而再增加接种量至12%,总酸与还原糖含量无明显变化。这可能因为当增大接种量,乳酸菌数目急剧增多,乳酸菌消耗糖速率加快,产酸量增加[18],但是,由于发酵苹果汁中的糖含量有限,当菌种数量过多时,生长和繁殖速度会减缓甚至下降,所以选取混合菌种的最佳接种量为8%。
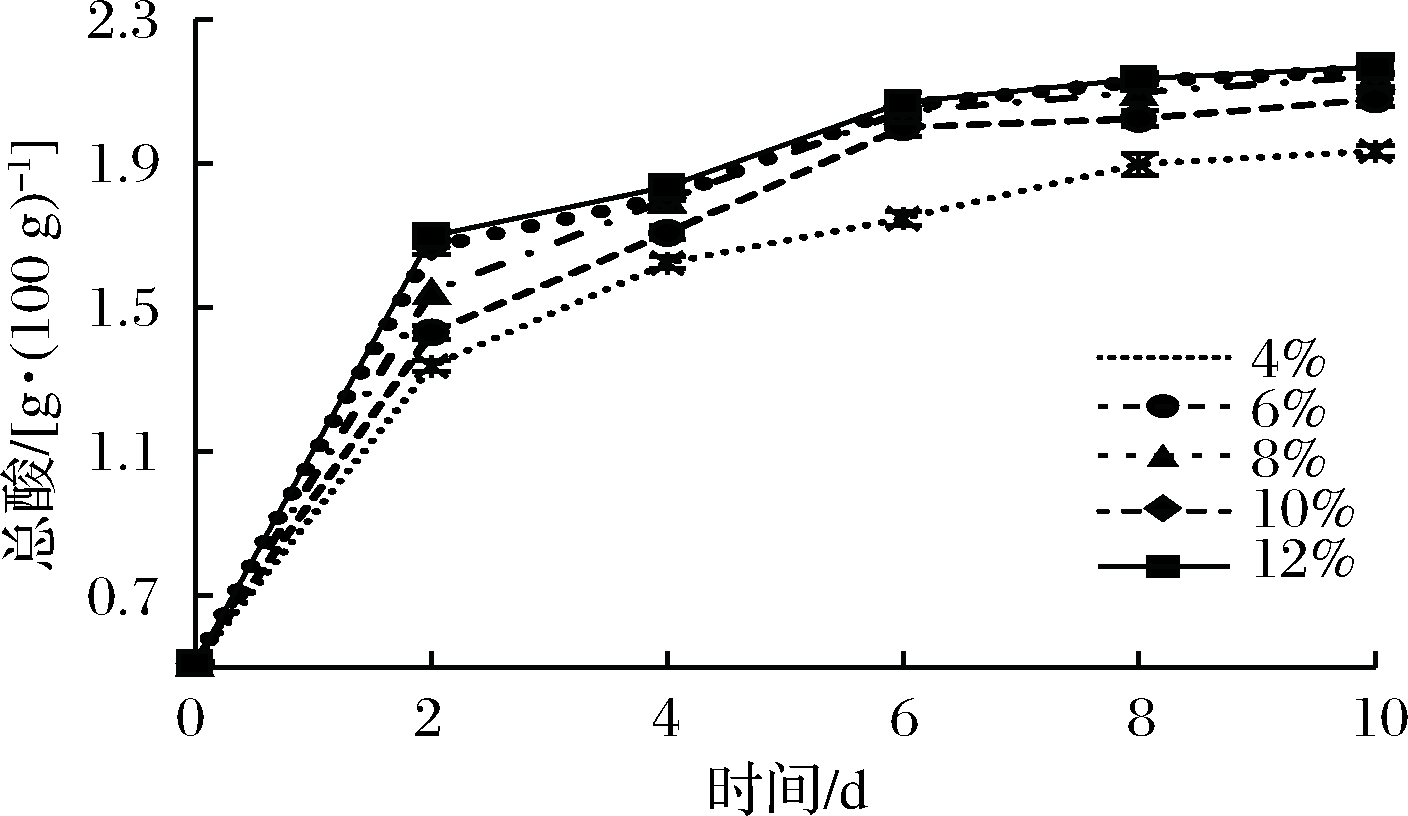
图7 接种量对总酸含量的影响
Fig.7 Effect of inoculation amount on total acid content
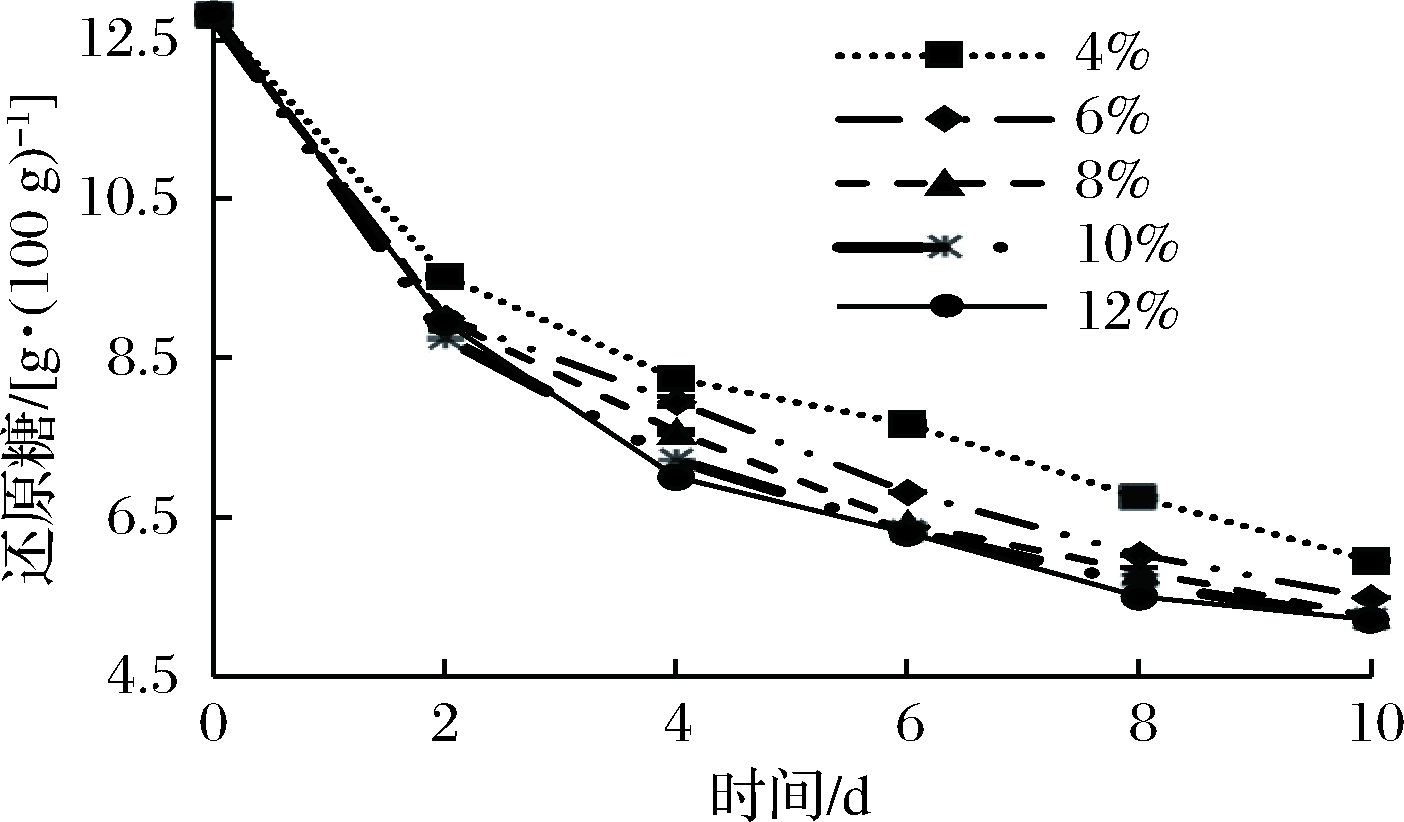
图8 接种量对还原糖含量的影响
Fig.8 Effect of inoculation amount on reducing sugar content
2.2.2 发酵温度对苹果汁乳酸发酵总酸和还原糖含量的影响
由图9和图10可知,温度不同,乳酸菌的产酸能力也略有不同。在33 ℃条件下,乳酸菌的产酸较少,在36 ℃条件下,乳酸菌的产酸能力最好,35、40 ℃总酸含量低于36 ℃条件下。这种现象主要是基于不同的温度梯度,不同的乳酸菌生长的最适温度是不同的,短乳杆菌的最适生长温度为35~39 ℃,因此越靠近这个温度其产酸效果越好。只有菌种处在最适温度时其发酵产酸效果才能达到最好[19]。当发酵温度较低时,菌生长和繁殖速度较慢,温度过高对苹果汁的风味和口感也会有所影响。因此,选择最适发酵温度为36 ℃。

图9 发酵温度对总酸含量的影响
Fig.9 Effect of fermentation temperature on total acid content
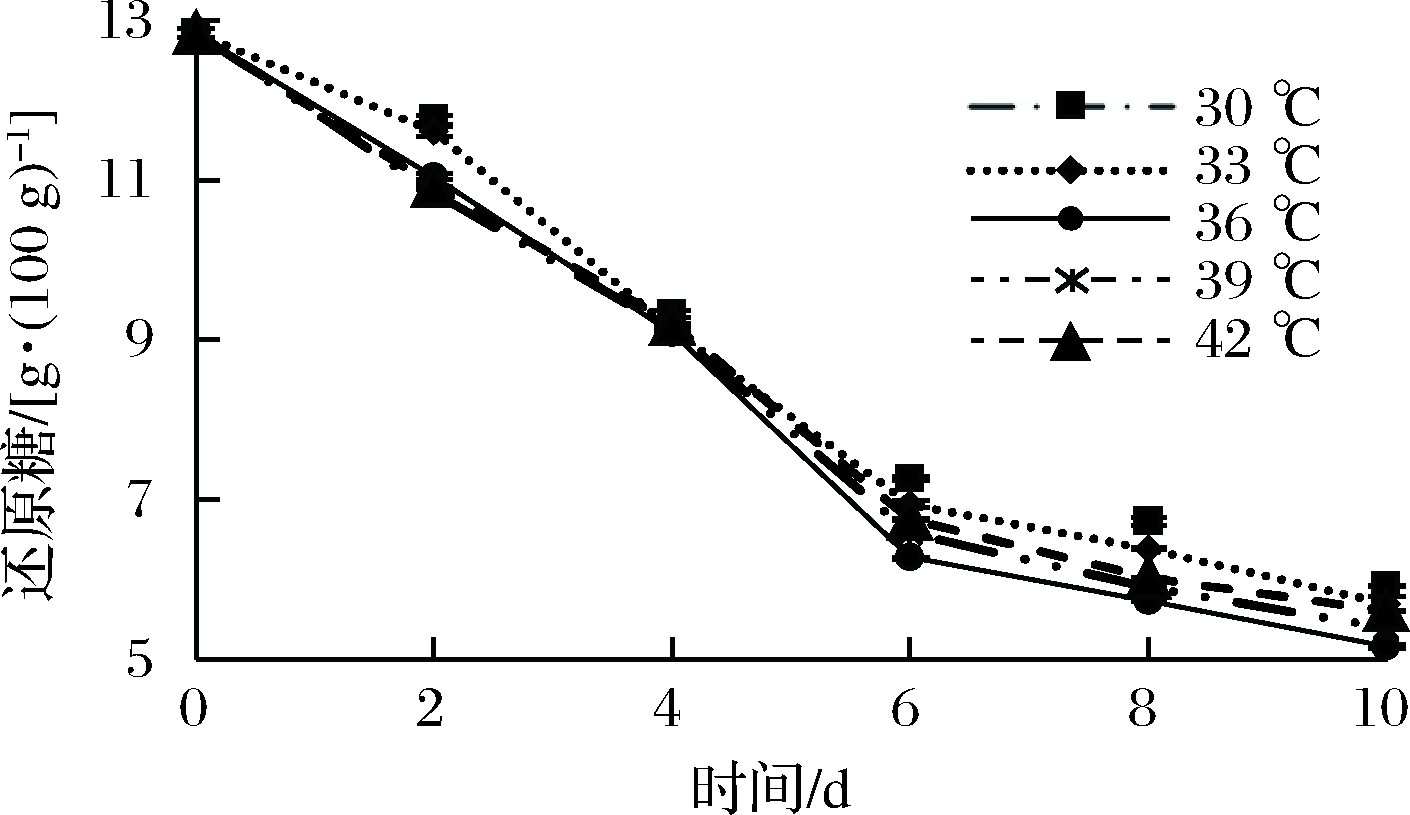
图10 发酵温度对还原糖含量的影响
Fig.10 Effect of fermentation temperature on sugar content reduction
2.2.3 发酵时间对苹果汁乳酸发酵总酸和还原糖含量的影响
由图10和图11可知,发酵液中的总酸含量随发酵时间先递增后逐步趋于平稳,还原糖含量先下降后逐渐稳定。在6 d后总酸含量基本不变,同时还原糖含量下降趋势不明显。可能是因为发酵时间的延长,乳酸菌发酵苹果汁中的碳水化合物越来越充分,产酸增加[20];同时发酵前期菌种繁殖量大,发酵产酸效果良好,发酵后期菌种老化,代谢能力减弱,所以选取最适发酵时间为6 d。
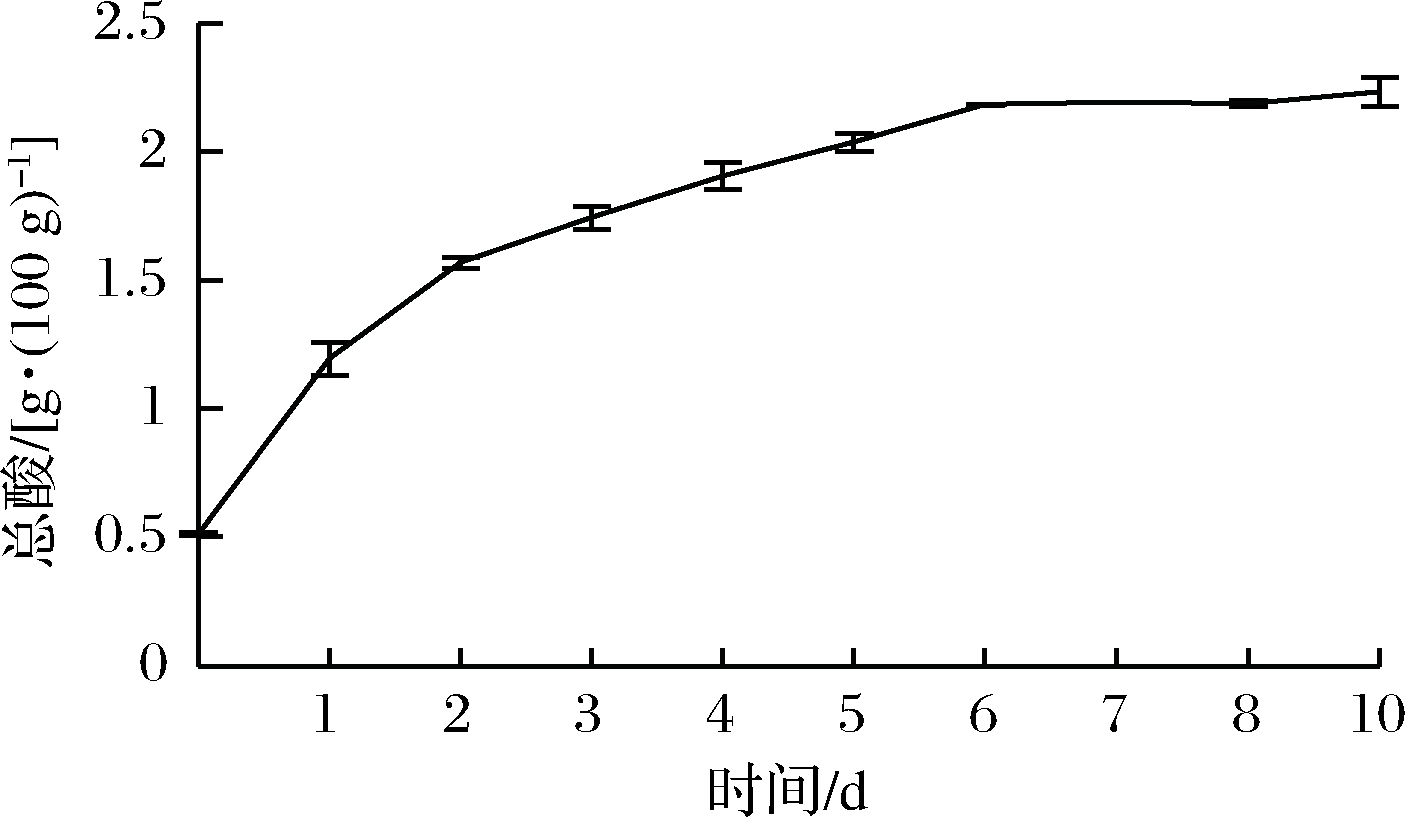
图11 发酵时间对总酸含量的影响
Fig.11 Effect of fermentation time on total acid content
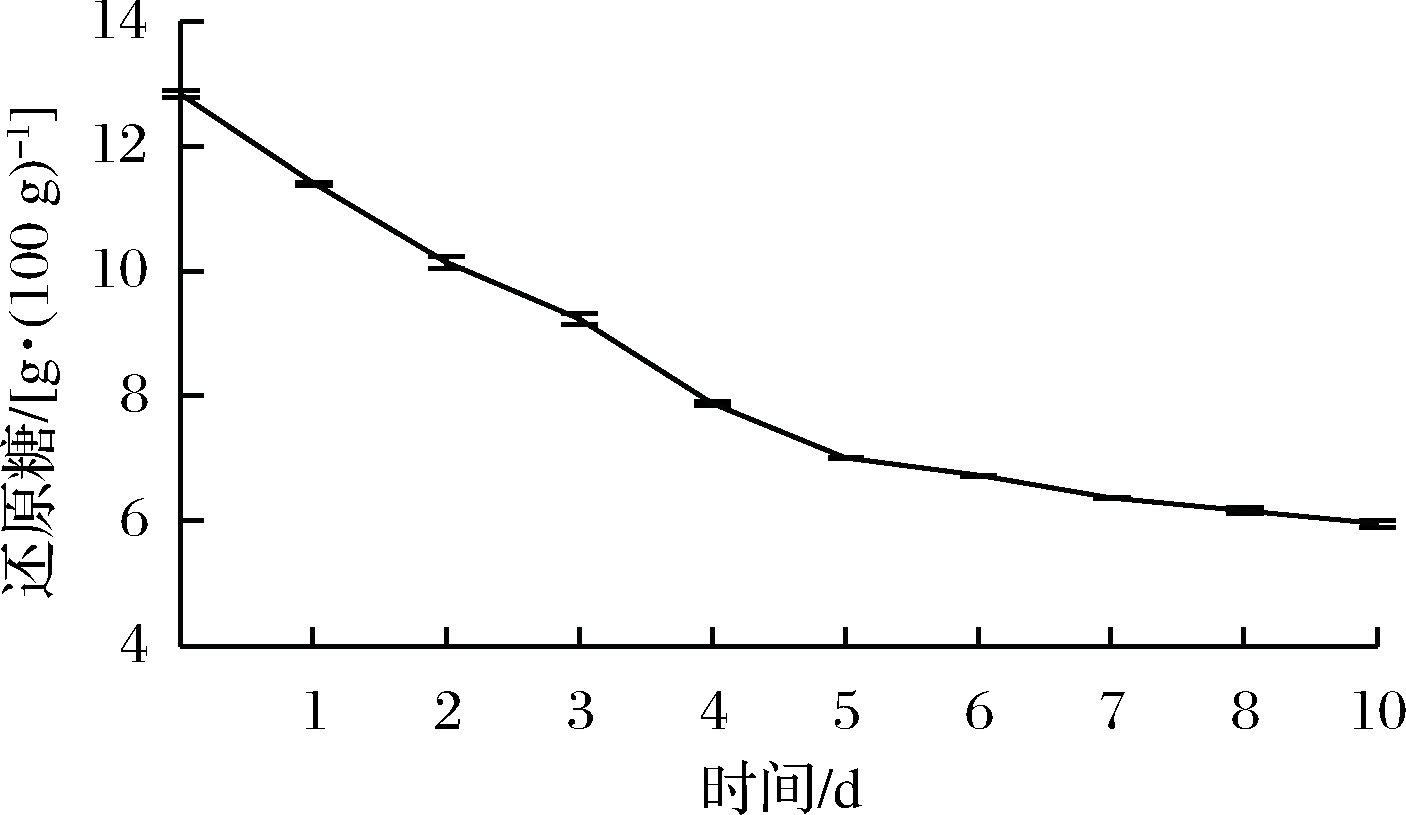
图12 发酵时间对还原糖含量的影响
Fig.12 Effect of fermentation time on sugar content reduction
2.2.4 响应面回归模型的建立与分析
设计BBD响应面试验,以接种量、发酵时间和发酵温度为3个响应面变量,总酸含量为响应值进行试验(表2)。每组试验测定3次,取平均值。得到回归方程为Y=-12.66+0.836A+0.435B+1.318 8C-0.016 1AB-0.025 7BC-0.017 5AC-0.006 6A2-0.002 7B2-0.040 7C2。
表2 响应面试验设计与结果
Table 2 Experimental design and results of response surfac
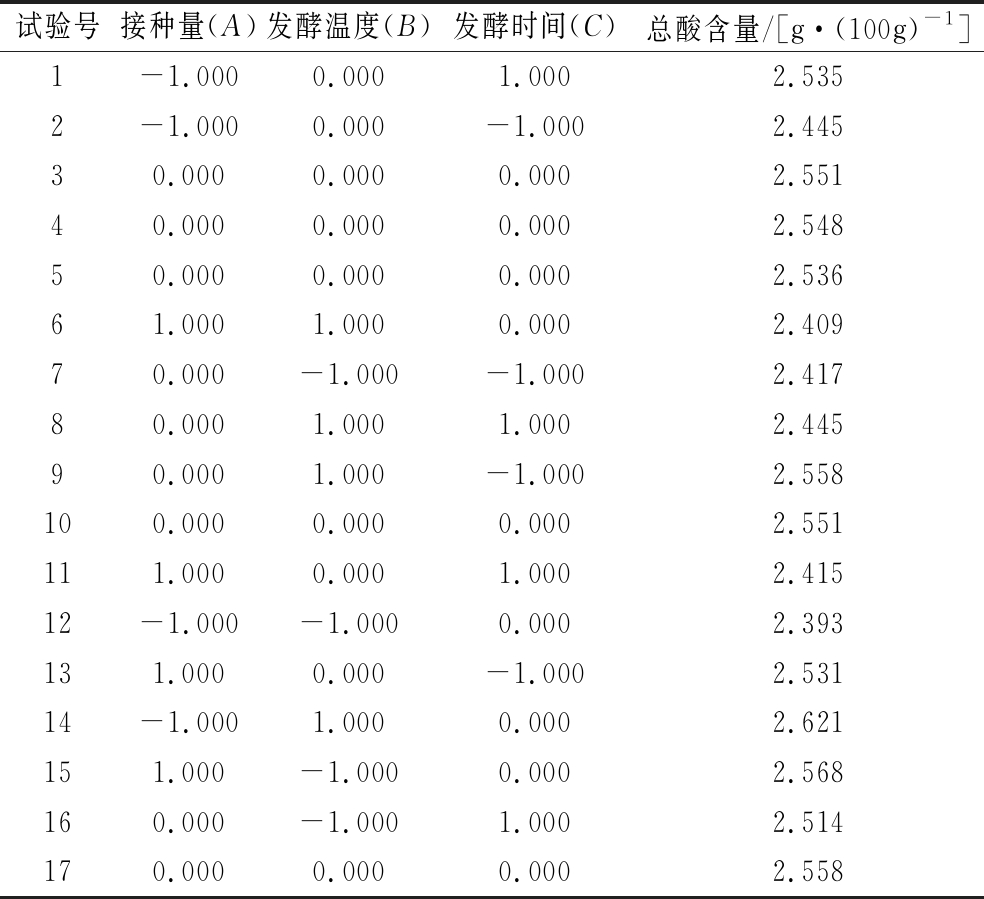
试验号接种量(A)发酵温度(B)发酵时间(C)总酸含量/[g·(100g)-1]1-1.0000.0001.0002.5352-1.0000.000-1.0002.44530.0000.0000.0002.55140.0000.0000.0002.54850.0000.0000.0002.53661.0001.0000.0002.40970.000-1.000-1.0002.41780.0001.0001.0002.44590.0001.000-1.0002.558100.0000.0000.0002.551111.0000.0001.0002.41512-1.000-1.0000.0002.393131.0000.000-1.0002.53114-1.0001.0000.0002.621151.000-1.0000.0002.568160.000-1.0001.0002.514170.0000.0000.0002.558
由表3可以看出,该模型达到极显著水平(P<0.000 1),各因素中一次项接种量(A)、发酵温度(B)、发酵时间(C)和二次项AB、AC、BC、A2、B2、C2模型影响极显著;失拟误差的P值为0.969 1,表明该模型相对于绝对误差不显著;![]() 表明回归方程与试验值具有高度拟合性,可以利用该回归方程确定短乳杆菌发酵苹果汁的最佳工艺条件。
表明回归方程与试验值具有高度拟合性,可以利用该回归方程确定短乳杆菌发酵苹果汁的最佳工艺条件。
在此最佳条件下,总酸含量的理论值为2.632 g/100g。为进一步验证响应面分析结果的可靠性,对最优条件进行实际调整,在接种量为8%、发酵温度为36 ℃、发酵时间为6 d的条件下进行3次平行试验。得到提取效果的实测平均值为2.613 g/100g,与预测值仅相差0.72%。因此响应面优化得到的短乳杆菌发酵苹果汁的参数准确可靠,为准确分析苹果汁中总酸含量提供理论依据。
表3 响应面试验方差分析
Table 3 The variance analysis of response surface test

变异来源平方和自由度均方F值P值模型0.07690.008 4219.49< 0.000 1接种量(A)0.000 6310.000 6316.340.004 9发酵温度(B)0.0024 8510.002 48564.44< 0.000 1发酵时间(C)0.000 2210.000 225.720.048 1AB0.03710.037970.9< 0.000 1AC0.01110.011275.1< 0.000 1BC0.01110.011285.89< 0.000 1A20.002 9410.002 9476.24< 0.000 1B20.002 51210.002 51265.14< 0.000 1C20.006 96610.006 966180.64< 0.000 1残差0.000 269 970.000 038 56失拟0.000 014 7530.000 004 9170.0770.969 1纯误差0.000 255 240.000 063 8总和0.07616R2=0.971 8, R2Adj=0.935 6
2.3 苹果汁乳酸发酵前后总酸、还原糖、乳酸菌数的变化
将短乳杆菌按8%的接种量接入杀菌后的苹果汁中,在36 ℃下发酵6 d,测定发酵前后总酸、还原糖和乳酸菌数,结果见表4。
表4 发酵前与发酵后总酸、还原糖、乳酸菌数的变化
Table 4 Changes in total acid, reducing sugar, and the counts of lactic acid bacteria before and after fermentation

苹果汁基质测定指标总酸含量/[g·(100g)-1]还原糖/[g·(100g)-1]发酵前0.514 40±0.0157b12.832 7±0.046 6a发酵后2.543 4±0.024 0a5.227 3±0.074 9b
注:表中不同小写字母代表差异显著(P<0.05)。下同。
由表看出,苹果汁发酵前后相比,总酸含量显著提高(P<0.05),增加了2.029 g/100g,达到了2.543 4 g/100g;还原糖含量显著降低(P<0.05),减少了7.605 4 g/100g;乳酸菌数由初始的0.72×109CFU/g达到了1.84×109CFU/g,显著增加(P<0.05)。
2.4 苹果汁发酵前后有机酸含量的变化
有机酸混合标准品的分离图谱如图13所示。由表5可知,所测的8种有机酸的R2>0.99,说明相关性好,拟合置信度高。

1-酒石酸;2-苹果酸;3-乳酸;4-乙酸;5-奎宁酸; 6-琥珀酸;7-富马酸;8-草酸
图13 有机酸混合标品分离图谱
Fig.13 Organic acids mixed separation maps
表5 不同有机酸的标准曲线
Table 5 The standard curve of mixed organic acids

名称公式R2苹果酸y=1.201 5x-0.100 30.999奎宁酸y=0.754 2x-0.096 90.999 4乳酸y=9.459 3x-1.121 60.998 4乙酸y=14.555x-0.203 10.999 1酒石酸y=2.031 3x+0.875 20.999 5琥珀酸y=0.839 7x-0.100 90.999 1富马酸y=1 375.7x+7.676 90.999 5草酸y=16.013x-1.61 80.997 4
将短乳杆菌按8%的接种量接入优化后的苹果汁发酵基质中,在36 ℃下发酵,2 d后测有机酸组成及含量,之后每隔24 h测定,结果见表6。
果汁中的有机酸,对果汁的感官特性、营养品质有重要影响[21]。利用HPLC法对苹果汁发酵过程中的8种有机酸进行分析,苹果酸是苹果汁在乳酸发酵过程中含量最高的一种有机酸,发酵液中除苹果酸外,还有草酸、奎宁酸等副产物[22]。如表6所示,苹果汁中苹果酸的起始浓度为2.918 g/L,在72 h后苹果酸的含量达到了最大值5.445 g/L,之后又迅速下降,因为在苹果汁在乳酸发酵期间进行了三羧酸循环,苹果酸作为三羧酸循环的中间体,其含量随参与的生化反应进行动态变化。奎宁酸在苹果汁中的含量仅次于苹果酸,发酵后含量显著升高[23],在发酵开始时,奎宁酸的含量为0.203 9 g/L,随发酵时间增加,在72 h间奎宁酸的含量急剧增多,之后增加趋势平缓,于发酵结束达到其最大质量浓度0.737 1 g/L。乳酸也是苹果汁发酵过程中重要的有机酸,在发酵初期,乳酸的含量增加不大,但是在发酵后期,随着苹果汁中的葡萄糖经糖降解变成丙酮酸,在乳酸脱氢酶的作用下丙酮酸被还原成为乳酸,导致乳酸含量不断增加[24],在发酵结束后达到最大质量浓度0.187 5 g/L,这与ELLENDERSEN等[25]利用干酪乳杆菌发酵苹果汁过程中乳酸的变化趋势相似。乙酸在发酵过程中含量显著上升,至发酵结束浓度达到最大值0.326 5 g/L,因为在苹果酸—乳酸发酵过程中,在厌氧条件下,所有的乳酸菌都能代谢丙酮酸而产生乙酸等产物。酒石酸在发酵72 h时达最高值,之后呈下降趋势,酒石酸能够被乳酸菌降解生成乳酸和乙酸,使挥发酸含量增加[26]。发酵结束较发酵前含量升高0.004 3 g/L。琥珀酸一方面可通过酒石酸分解而生成,但生成量较少,另一方面在苹果酸-乳酸途径中,可通过部分丙酮酸氧化为乙酸和H+,H+再将延胡索酸还原得到琥珀酸[27]。表5中琥珀酸的起始质量浓度为0.173 4 g/L,发酵结束后的质量浓度为0.091 7 g/L,较发酵前含量显著降低。富马酸在苹果汁中的含量较低,在发酵开始时候其含量为0.029 1 g/L,发酵过程变化趋势平缓,与酒石酸的变化趋势相近,发酵结束时含量为0.049 2 g/L,较发酵前含量显著升高。草酸的含量在整个发酵过程中大幅度上升,发酵结束后含量可达到0.248 1 g/L。通过短乳杆菌发酵苹果汁,扩大了苹果汁利用率,开发具有保健功能的新型饮品具有很好的指导意义。
表6 发酵期间有机酸变化 单位:g/L
Table 6 Changes of organic acids during fermentation

发酵时间/h苹果酸奎宁酸乳酸乙酸酒石酸琥珀酸富马酸草酸02.918 0±0.002 2a0.203 9±0.002a0.062 7±0.002 1a0.009 2±0.001 6a0.087 5±0.001 5b0.173 4±0.001c0.029 1±0.003 5c0.097 3±0.008 5d484.438±0.001 6a0.445 1±0.003 2b0.081 25±0.001 5b0.186 5±0.003c0.087 9±0.003 9b0.156 4±0.001 7c0.030 2±0.000 1d0.172 1±0.000 5a725.445±0.003 9a0.695 3±0.008 6c0.167 9±0.057a0.286 3±0.008 7b0.158 1±0.004 3b0.121 96±0.003 2c0.035 7±0.004 1a0.196 0±0.006 9d961.506±0.001a0.701 2±0.001 5b0.171 8±0.001 4c0.302 7±0.002 5ab0.091 5±0.003 6bc0.095 83±0.000 1a0.040 9±0.000 9b0.237±0.001 2d1201.734 9±0.004 5a0.736 9±0.000 1d0.187 1±0.003 5a0.326 2±0.001 7ab0.091 7±0.002 8d0.092 5±0.000 9a0.048 5±0.000 6c0.246±0.006 4b1441.734 8±0.000 36a0.737 1±0.005 8d0.187 5±0.006 4a0.326 5±0.006 9a0.091 8±0.001 2c0.091 7±0.000 1d0.049 2±0.000 3a0.248 1±0.001 6b
注:同一列不同小写字母表示具有显著性差异(P<0.05)。
3 结论
本研究以苹果汁为原料,确定了苹果汁乳酸发酵的最佳培养基以及苹果汁乳酸发酵的最适工艺条件为:接种量8%,发酵温度36 ℃,发酵时间6 d。发酵后的苹果汁中的总酸含量显著升高,还原糖含量显著下降。发酵期间苹果酸、琥珀酸含量均持续减少,乳酸,乙酸、琥珀酸、奎宁酸含量显著增多,富马酸、酒石酸含量无明显变化;通过乳酸菌发酵极大的改善了苹果汁的口感,酸度有了较大的提高,以上结果为开发苹果汁发酵饮品提供一定的理论依据。
[1] 尹胜利, 杜鉴, 徐晨. 乳酸菌的研究现状及其应用[J]. 食品科技, 2012,37(9):25-29.
[2] 王刚,朱慧越,俞赟霞,等.乳酸菌合成细菌素及对肠道菌群的影响[J/OL].食品与发酵工业:1-8[2019-12-25].https://doi.org/10.13995/j.cnki.11—1802/ts.021579.
[3] 翟衡, 赵政阳, 王志强,等. 世界苹果产业发展趋势分析[J]. 果树学报, 2005, 22(1):44-50.
[4] 刘铁铮, 付雅丽, 秦立者,等. 红富士苹果果实中Vc含量的研究[J]. 烟台果树, 2005(4):6-7.
[5] 李鑫. 不同品种苹果多酚组分分析及其相关生物活性研究[D]. 杭州:浙江大学, 2015.
[6] 周强, 刘蒙佳. 乳酸菌混合发酵香梨-黄瓜果蔬汁的工艺优化研究[J]. 食品工业, 2017,38(12):68-72.
[7] 张玉慧. 乳酸菌发酵蓝莓果汁的工艺研究[D]. 沈阳:沈阳农业大学,2016.
[8] 贺小贤. 胡萝卜汁乳酸发酵饮料的研究[J]. 陕西科技大学学报, 1998(1):84-89.
[9] 管章瑞, 田裕, 夏小乐,等. 柚子菊芋果蔬发酵饮料的制备及其抗氧化活性[J]. 食品工业科技, 2017,38(19):136-141.
[10] 叶盼. 植物乳杆菌发酵苹果汁的生理活性探究[D]. 上海:华东理工大学,2016.
[11] 严成. 复合果蔬汁益生菌发酵乳的工艺研究[J]. 食品科学, 2007, 28(9):401-404.
[12] 成晓霞, 郑志波. 果汁和胡萝卜汁混合型果蔬汁的加工工艺[J]. 农牧产品开发, 1999(10):20-21.
[13] 李汴生, 卢嘉懿, 阮征. 植物乳杆菌发酵不同果蔬汁风味品质研究[J]. 农业工程学报, 2018, 34(19):293-299.
[14] 中华人民共和国卫生部. GB/T 12456—2008《食品安全国家标准 食品中总酸的测定》[S].北京:中国标准出版社,2008.
[15] 中华人民共和国卫生部. GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》[S].北京:中国标准出版社,2016.
[16] 中华人民共和国卫生部. GB 5009.157—2016《食品安全国家标准 食品中有机酸的测定》[S].北京:中国标准出版社,2016.
[17] YE M, YUE T, YUAN Y. Evolution of polyphenols and organic acids during the fermentation of apple cider[J]. Journal of the Science of Food and Agriculture, 2014, 94(14):2 951-2 957.
[18] 邓泽丽, 李洪军, 甘奕,等. 山楂饮料发酵工艺[J]. 食品与发酵工业, 2015, 41(10):86-89.
[19] 熊素玉, 姚新奎, 谭小海,等. 不同温度及pH条件对乳酸菌生长影响的研究[J]. 新疆农业科学,2006,43(6):533-538.
[20] 梁莉, 程晨, 张柳茵,等. 乳酸菌和酵母菌复合发酵南瓜汁工艺研究[J]. 食品研究与开发, 2016, 37(13):88-92.
[21] SHUI G, LEONG L P. Separation and determination of organic acids and phenolic compounds in fruit juices and drinks by high-performance liquid chromatography[J]. Journal of Chromatography A, 2002, 977(1):89-96.
[22] 郭燕, 梁俊, 李敏敏,等. 高效液相色谱法测定苹果果实中的有机酸[J]. 食品科学, 2012, 33(2):227-230.
[23] 胡小露, 刘卉, 鲁宁,等. HPLC法同时测定蓝莓汁及其发酵酒中9种有机酸[J]. 食品科学, 2012, 33(16):229-232.
[24] 李维妮, 张宇翔, 魏建平,等. 益生菌发酵苹果汁工艺优化及有机酸的变化[J]. 食品科学, 2017, 38(22):80-87.
[25] LUCIANA D S N E,DANIEL G,KARLA B G.Development and sensory profile of a probiotic beverage from apple fermented with Lactobacillus casei[J]. Engineering in Life Sciences, 2012, 12(4):475-485.
[26] RADIN L, PRONZATO C, CASARETO L, et al. Tartaric acid in wines may be useful for preventing renal calculi: Rapid determination by HPLC[J]. Journal of Liquid Chromatography, 1994, 17(10):2 231-2 246.
[27] 李华. 葡萄酒化学[M]. 北京:中国青年出版社,2005.