泡菜是以各种新鲜蔬菜为原料,利用其表面乳酸菌主导发酵而成,其营养丰富、风味优雅、富含功能菌群,可增食欲、助消化、促健康,是我国传统的发酵蔬菜制品[1]。涪陵青菜头、红心萝卜,都是重庆市涪陵区地方特色蔬菜,用青菜头和红心萝卜制作的泡菜具有色泽艳丽、开胃解油腻、爽口增食欲等特点,是本地人们最喜爱的佐餐小菜,但绝大多数都是本地农户依靠自然发酵自制而成,其发酵时间长、受外界因素影响大、产品质量波动大,很难大规模生产。随着分子生物学技术的快速发展,泡菜发酵微生物群落组成、分布及其动态变化的神秘面纱也逐渐被揭开。近年来研究发现,传统四川泡菜盐水中主要优势菌群有乳杆菌属、片球菌属、链球菌属、肠杆菌属等,随着泡菜盐水的持续循环使用,优势菌群越来越单一,但乳杆菌属始终是优势菌群[2-3]。通过分离筛选优良菌株制作发酵剂,利用人工接种发酵已成为传统泡菜工业化生产的发展趋势,张梦梅等[4]采用人工接种植物乳杆菌和肠膜明串珠菌发酵白菜发现人工接种可以增加泡菜必需氨基酸含量,赋予泡菜更鲜美的滋味,提高感官品质。XIA等[5]研究发现短乳杆菌可降低泡菜pH值和亚硝峰,提高食用安全性。JANG等[6]研究发现人工接种乳酸链球菌可以降低乳酸含量,延长最佳发酵期。肠膜明串珠菌是发酵初期到中期的主要菌株,接种肠膜明串珠菌能在泡菜发酵初期快速启动发酵,代谢产物多于未接种发酵泡菜,具有高产酸、迅速降低pH值和拮抗致病菌的能力[7-9]。朴泓洁等[10]研究表明,接种肠膜明串珠菌可以缩短发酵周期、增进泡菜滋味、提高泡菜整体品质。但人工接种发酵在涪陵青菜头泡菜中的应用还未见报道,因此,本研究从农家自制老盐水中分离筛选乳酸菌,并将筛选出的优势乳酸菌结合肠膜明串珠菌制备复合发酵剂接种到泡菜中,分析接种发酵对泡菜发酵过程中理化性质、感官的影响,为复合发酵剂的研制及其工业化应用提供理论数据。
1 材料与方法
1.1 材料、菌种与试剂
新鲜青菜头、红心萝卜、香辛辅料,重庆市涪陵区南门山农贸市场。老盐水,涪陵区农户家陈年泡菜水。
肠膜明串珠菌(Leuconostoc mesenteroides),中国工业微生物菌种保藏管理中心 (CICC 21861),分离自泡猪耳朵。
MRS培养基,北京陆桥技术有限责任公司;NaOH、硼砂、亚铁氰化钾、乙酸锌(均为分析纯),成都市科龙化工试剂厂;对氨基苯磺酸盐酸萘乙二胺(分析纯),天津市光复精细化工研究所;NaNO2(分析纯),广州市全华大化学试剂有限公司;冰乙酸、HCl(分析纯),重庆川东化工(集团)有限公司;CuSO4、亚甲蓝、溴甲酚紫、水杨酸、酒石酸钾钠(分析纯),上海麦克林生化科技有限公司;细菌基因组DNA提取试剂盒、2 × Taq PCR MasterMix,天根生化科技有限公司;DNA Marker、溶菌酶,宝生物工程(大连)有限公司;通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTTACGACTT-3′),上海立菲生物技术有限公司(北京)。
1.2 仪器与设备
LDZH-150L 立式高压蒸汽灭菌器,上海申安医疗器械厂;PHSJ-3F 酸度计,上海精密科学仪器有限公司;L5S 紫外可见分光光度计,上海仪电分析器有限公司;DHP-9162 电热恒温培养箱,上海齐欣科学仪器有限公司;LA8080 日立全自动氨基酸自动分析仪,天美(中国)科学仪器有限公司。
1.3 乳酸菌的分离筛选
采用梯度稀释涂布法对样品中乳酸菌进行分离筛选,吸取25 mL老盐水加入到225 mL无菌生理盐水中,用涡旋振荡器摇匀,制得10-1的稀释液,再从中吸取1 mL稀释液到9 mL无菌生理盐水中制得10-2的稀释液,按此法依次制得10-3、10-4、10-5、10-6的稀释液。分别取100 μL稀释液于改良MRS培养基(在MRS培养基中添加0.4 g/L的溴甲酚紫)涂布,置于37 ℃下培养48 h。挑取黄色的单菌落[11]进行反复平板划线纯化3次,再挑取单菌落分别进行革兰氏染色和过氧化氢酶实验,观察并记录结果。将分离纯化后的单菌落接种在MRS肉汤中于37 ℃下培养48 h后,与25%甘油按体积比1∶1混合后于-20℃冰箱保存并编号。
1.4 乳酸菌的鉴定
1.4.1 生理生化鉴定
参照潘晓倩等[12]的方法,采用VITEK 2 Compact机器配套CBC鉴定卡进行鉴定。
1.4.2 16S rDNA分子生物学鉴定
采用细菌基因组提取试剂盒提取细菌基因组DNA,利用通用引物对16S rDNA序列进行扩增,PCR反应体系(50 μL):上下游引物各1 μL、DNA模板2 μL、2×Taq PCR MasterMix 25 μL、超纯水21 μL;PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,循环35次;72 ℃延伸10 min。PCR产物由中国食品发酵研究院有限公司进行序列测定。
1.5 接种发酵泡菜
1.5.1 复合发酵剂制备
将-20℃冰箱保存的菌株于MRS培养基上活化后,挑取单菌落于MRS肉汤中37 ℃培养48 h,4 500 r/min离心10 min,弃去上清液,加无菌生理盐水离心洗涤2次,弃去上清液,再加入原培养基体积1/2的无菌生理盐水制得菌悬液(浓度107~108CFU/mL),肠膜明串珠菌与乳酸菌ZP11-2菌悬液以体积比1∶1混均得复合乳酸菌发酵剂,混合后立刻接种。
1.5.2 接种发酵青菜头
青菜头、红心萝卜清洗沥干水分后切块,按m(青菜头):m(红心萝卜):m(凉开水)(盐质量浓度40 g/L)=1∶0.2∶1入坛,再添加冰糖、姜、大蒜、辣椒、花椒,分别按1%接种量添加肠膜明串珠菌、乳酸菌ZP11-2和复合乳酸菌发酵剂,于25 ℃密封发酵。对照组为未接种的自然发酵组,其他工艺和配方与接种发酵组相同。在发酵第0、1、2、3、5、7、9天取泡菜水进行各项指标的检测。
1.6 理化分析
1.6.1 乳酸菌测定
参照GB 4789.35—2016《食品微生物学检验 乳酸菌检验》中的方法。
1.6.2 pH值和总酸测定
pH值采用pH计测定,总酸参照GB/T 12456—2008 《食品中总酸的测定》中的酸碱滴定法。
1.6.3 亚硝酸盐测定
参照国标GB/5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》中的分光光度法。
1.6.4 游离氨基酸测定
准备取泡菜水样品1 mL于2 mL塑料离心管中,加入0.5 mL 100 g/L磺基水杨酸溶液振荡摇匀。冰箱静置12 h后于13 000 r/min离心2 min,用0.22 μm滤膜过滤,取滤液采用氨基酸自动分析仪进行测定。
氨基酸分析仪色谱分析条件:日立专用离子交换树脂,4.6 mm ID×60 mm;检测器:紫外;流速:0.25 mL/min;进样量:20 μL;柱温度:55 ℃;反应温度:135 ℃;柱压:50 kg/cm2。
1.6.5 感官评价
参照文献[1, 13]的方法略有改动,总分100分,色泽、香气、滋味、质地4个项目各占25分,选择10位专业人员组成感官评定小组,通过盲评计分,对泡菜色泽、香气、滋味、质地进行打分,具体评分标准见表1。
表1 感官评分标准
Table 1 The standard of sensory score

项目评分标准/分16~256~151~5色泽色泽均匀,鲜亮色泽较均匀,略有光泽色泽不正常,发黑发黄香气浓郁的泡菜香,香气宜人香气一般,无异味酸甜鲜味一般香气不正常,有酸腐味滋味酸甜鲜味适宜无过酸过鲜过苦味味道淡薄,或过酸过苦质地清脆爽口嫩脆一般,无软腐嫩脆差,软腐
1.7 数据分析
数据平均测定3次,结果以(平均值±标准差)表示,并采用SPSS 17.0进行方差分析,Origin 8.1进行相关图的绘制。
2 结果与分析
2.1 菌株ZP11-2的鉴定
2.1.1 形态学与生理生化鉴定
菌株ZP11-2,分离自川渝地区农户家自制老盐水,在MRS培养基上30 ℃培养48 h后长势良好,菌落呈白色,圆形,表面湿润,不透明,边缘不整齐;接触酶阴性,革兰氏染色阳性,菌体呈杆状,(0.3~0.5) μm×(1.1~2.1) μm,单个或成对排列,并进一步做了生理生化鉴定,结果如表2所示。
表2 菌株ZP11-2的生理生化结果
Table 2 Identification of strain ZP11-2 by CBC card

项目结果项目结果项目结果项目结果丙氨酸-苯丙氨酸-脯氨酸芳胺酶-D-半乳糖+鸟氨酸脱羧酶-苯丙氨酸芳胺酶+精氨酸 GP+丙酮酸盐-β-半乳糖苷酶+wL-吡咯烷酮芳胺酶-琥珀酸盐碱化-酪氨酸芳胺酶-D-葡萄糖+β-葡糖苷酶+D-麦芽糖+D-甘露醇-β-木糖苷酶+O/129 耐药 +L-脯氨酸芳胺酶-脂肪酶-α-甘露糖苷酶-D-松三糖-尿素酶-蔗糖-D-海藻糖-柠檬酸盐(钠)-5-溴-4-氯-3-吲哚基-β-葡萄糖醛酸甙-L-乳酸盐碱化-α-葡糖苷酶-D-山梨醇-α-半乳糖苷酶+甘氨酸芳胺酶-D-苹果酸盐-D-核糖+麦芽三糖+L-谷氨酰胺-苯基磷酸盐-β-D-岩藻糖苷酶-香豆酸盐+2-酮基-D-葡萄糖酸盐-七叶苷水解-ELLMAN 试剂-D-木糖+
注:“+”表示阳性;“+w”表示弱阳性;“-”表示阴性。
2.1.2 16S rDNA分子生物学鉴定
经PCR扩增和序列测定,获得菌株ZP11-2的16S rDNA序列片段,与GenBank中Lactobacillus brevis ATCC 14869T登录号为 KI271266的序列同源性达到99.93%,并采用MEGA5.0软件,邻位连接法显示与相关种的16S rDNA序列系统发育树(如图1所示),进行1 000次的相似度重复计算,因此确定菌株ZP11-2为短乳杆菌(Lactobacillus brevis)。

图1 基于菌株ZP11-2 16S rDNA序列构建的系统发育树
Fig.1 Phylogenetic tree based on 16S rDNA sequences of strain ZP11-2
注:图中发育树节点只显示Bootstrap值大于50%数值,上标的“T”表示模式菌株。
2.2 乳酸菌、pH值和总酸变化
乳酸菌是泡菜发酵的主要优势菌群,其菌落数的动态变化能直观反映整个发酵过程[14]。由图2-A可知,乳酸菌在发酵第0~5天增长较快,5~9 d相对比较平稳,人工接种发酵泡菜中乳酸菌含量始终高于自然发酵。发酵初期0~2 d,人工接种复合发酵剂和单一菌株发酵泡菜中乳酸菌增长速率差异不大,但人工接种复合发酵剂乳酸菌数量在第2天数量达到最高9.45 lg CFU/mL,而自然发酵后期还在缓慢增长。乳酸菌发酵产酸,其数量的变化直接影响pH值和总酸的变化。一般以为,泡菜液pH值达到3.5~3.8时,即为发酵成熟,此时风味在理论上达到最佳[15]。由图2-B、图2-C可看出,青菜头泡菜在整个发酵过程中,随发酵时间的延长pH值呈下降趋势,总酸呈上升趋势,7 d后均趋于稳定。在发酵初期,人工接种复合发酵剂发酵pH值、总酸变化幅度较大,第5天时分别为3.47、2.08 g/kg,基本达到稳定,但人工接种单一菌株和复合发酵剂之间差异不大;自然发酵pH值、总酸变化幅度相对缓慢,在第7天(3.48、2.34 g/kg)才趋于稳定,这与乳酸菌菌落数的变化规律相符。因为在人工接种发酵泡菜水中乳酸菌初始含量较多,生长成优势菌群较快,产酸也较多;自然发酵泡菜水中乳酸菌开始比较少,繁殖所需周期较长,形成优势菌群所需时间也越长[16],所以产酸速率和产酸量都要低于人工接种发酵,这也说明人工接种发酵能加快青菜头泡菜成熟速度,缩短其发酵周期。

a-乳酸菌菌落数;b-pH值;c-总酸含量
图2 青菜头泡菜发酵过程中乳酸菌、pH值、总酸的变化
Fig.2 Changes in lactic acid bacteria, pH value and total acid during tumor stem mustard fermentation
注:CK表示自然发酵;Leu表示人工接种肠膜明串珠菌;Lac表示人工接种短乳杆菌;CMA表示人工接种复合发酵剂;文中所有图表同。
2.3 亚硝酸盐变化
如图3所示,人工接种发酵与自然发酵青菜头泡菜中亚硝酸盐含量均呈先增加后降低的趋势,亚硝峰均出现在发酵第2天,其中人工接种复合发酵剂亚硝峰最低,含量仅为1.53 mg/kg,明显低于接种单一菌株肠膜明串珠菌(3.75 mg/kg)、短乳杆菌(2.60 mg/kg)和自然发酵亚硝峰(7.52 mg/kg)。因为在发酵初期,在硝酸还原酶的作用下,青菜头本身带有的硝酸盐被还原成亚硝酸盐形成亚硝峰[17],而人工接种发酵初始乳酸菌含量较多并迅速生长,乳酸菌中含有亚硝酸还原酶能分解亚硝酸盐,降低亚硝酸盐的含量;自然发酵杂菌多,乳酸菌相对较少,含硝酸盐还原酶的菌将硝酸盐还原成亚硝酸盐,形成亚硝峰[18-19]。这说明人工接种乳酸菌发酵可以降低青菜头泡菜的亚硝峰,提高其食用安全性,且采用复合发酵剂接种发酵更有利于青菜头泡菜的使用安全。

图3 青菜头泡菜发酵过程中亚硝酸盐变化
Fig.3 Changes in nitrite during tumor stem mustard fermentation
2.4 游离氨基酸分析
表3中显示发酵成熟时泡菜中游离氨基酸含量。依据氨基酸的呈味特性可将氨基酸分为鲜味氨基酸(天门冬氨酸、谷氨酸、甘氨酸、丙氨酸、赖氨酸)、甜味氨基酸(丝氨酸、苏氨酸、组氨酸、脯氨酸)、苦味氨基酸(精氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸)和芳香族氨基酸(半胱氨酸、酪氨酸、苯丙氨酸)[20]。由表3可知,人工接种发酵泡菜中共检测出游离氨基酸16种,比自然发酵泡菜多检测出1种人体必需氨基酸(组氨酸),组氨酸为小儿生长发育期间必须氨基酸。人工接种发酵泡菜中游离氨基酸总量、必需氨基酸含量均高于自然发酵;人工接种复合发酵剂泡菜中游离氨基酸总量、必需氨基酸含量分别高达68.8、17.36 mg/100mL,均显著高于人工接种单一菌株和自然发酵(P<0.05)。游离氨基酸可被人体直接吸收,是人体VE、叶酸的营养来源,其含量和多样的味感能反应食品的营养价值和味觉感受[21]。这说明人工接种复合发酵剂发酵能赋予青菜头泡菜更好的营养价值和较好的口感,这与感官评价结果一致。
所有呈味氨基酸中,鲜味氨基酸﹥苦味氨基酸﹥甜味氨基酸﹥芳香族氨基酸,其中贡献较大的是谷氨酸和丙氨酸,在人工接种复合发酵剂泡菜中的含量分别为18.61和11.29 mg/100mL,共占游离氨基酸总量的43.46%,且都显著高于人工接种单一菌株和自然发酵(P<0.05),这两种呈味物质的阈值也相对较低[22],易被品尝出;虽然人工接种复合发酵剂发酵泡菜中苦味氨基酸含量也显著高于单一菌株和自然发酵(P<0.05),但并非所有的苦味都是不好的,相关研究表明,有些苦味肽具有促进生长发育、免疫调节、抗病毒、抗高血压、预防慢性疾病等生理功能[23],且大部分苦味氨基酸的阈值较高,不易被品尝出。
表3 青菜头泡菜中游离氨基酸组成 单位:mg/100 mL
Table 3 free amino acids composition in tumor stem mustard pickles

英文缩写中文名称味道不同处理方式CKLeuLacCMAAsp天门冬氨酸鲜酸1.38±0.09a2.17±0..06b1.47±0.08a2.29±0.08bSer丝氨酸甜味2.30±0.09a3.05±0.06b2.23±0.12a3.24±0.12cGlu谷氨酸鲜酸9.34±0.20a15.71±0.12c10.76±0.05b18.61±0.12dGly甘氨酸甜鲜1.95±0.12a2.21±0.12bc2.07±0.08ab2.32±0.15cAla丙氨酸甜鲜6.48±0.09a10.52±0.03b6.56±0.12a11.29±0.08cCys半胱氨酸苦0.27±0.09a0.27±0.05a0.28±0.05a0.30±0.06aVal缬氨酸*甜苦3.54±0.13a4.17±0.05b3.55±0.11a4.91±0.07cMet蛋氨酸甜苦0.49±0.09a0.55±0.04a0.50±0.02a0.71±0.09bIle异亮氨酸*苦1.68±0.18ab1.87±0.06b1.58±0.06a2.12±0.06cLeu亮氨酸*苦2.34±0.15a2.67±0.08b2.34±0.05a3.56±0.08cTyr酪氨酸苦0.31±0.13a0.76±0.08b0.48±0.10a0.86±0.05bPhe苯丙氨酸*苦1.73±0.08a1.86±0.11a1.83±0.09a2.92±0.07bLys赖氨酸*甜苦3.49±0.16a3.61±0.07a3.57±0.07a3.86±0.07bHis组氨酸甜苦-1.15±0.10b0.82±0.12a1.17±0.09bArg精氨酸苦甜0.24±0.07a3.53±0.10c1.08±0.06b4.67±0.09dPro脯氨酸甜3.61±0.12a4.33±0.08b3.66±0.09a5.98±0.05c必需氨基酸12.78±0.55a14.17±0.22b12.88±0.36a17.36±0.11c甜味氨基酸5.91±0.03a8.53±0.12c6.72±0.32b10.39±0.08d鲜味氨基酸22.64±0.25a34.21±0.21c24.43±0.32b38.37±0.39d苦味氨基酸8.30±0.59a12.79±0.18c9.05±0.27b15.95±0.13d芳香族氨基酸2.31±0.17a2.89±0.25b2.59±0.23ab4.08±0.06c总量39.16±0.88a58.43±0.72c42.79±1.15b68.80±0.43d
注:同行肩标不同字母表示差异显著(P<0.05)。表4同。“﹣”表示未检测出;“*”表示必需氨基酸。
2.5 感官分析
由表4可知,人工接种发酵对青菜头泡菜感官品质具有一定的影响,且人工接种复合发酵剂发酵的成熟青菜头泡菜感官评价总分高于接种单一菌株和自然发酵,两种单一菌株间差异不显著(P<0.05),但都高于自然发酵。人工接种复合发酵剂能显著提高青菜头泡菜的色泽和质地(P<0.05),赋予其较浓郁的滋味,接种复合发酵剂的青菜头泡菜色泽均匀艳丽、酸甜适中、清脆爽口,具有青菜头泡菜特有的香气,更受大家喜欢。
表4 感官评价结果
Table 4 Results of sensory evaluation
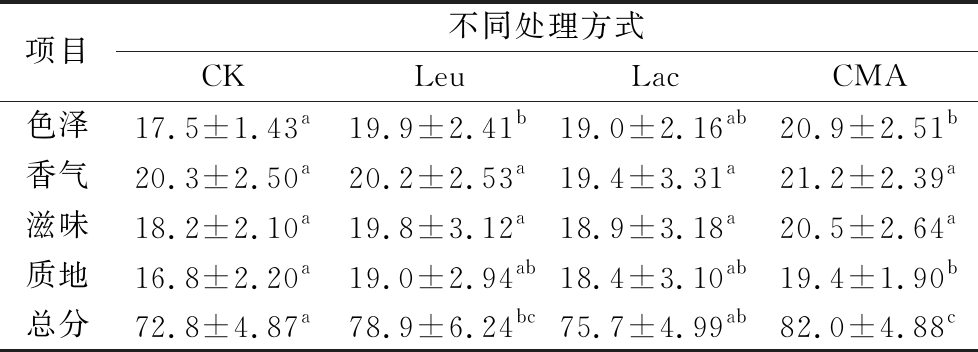
项目不同处理方式CKLeuLacCMA色泽17.5±1.43a19.9±2.41b19.0±2.16ab20.9±2.51b香气20.3±2.50a20.2±2.53a19.4±3.31a21.2±2.39a滋味18.2±2.10a19.8±3.12a18.9±3.18a20.5±2.64a质地16.8±2.20a19.0±2.94ab18.4±3.10ab19.4±1.90b总分72.8±4.87a78.9±6.24bc75.7±4.99ab82.0±4.88c
3 结论
从本地农户家自制的老盐水中分离筛选出1株优势乳酸菌,通过形态学、生理生化和分子鉴定确定该菌株为短乳杆菌。结合肠膜明串珠菌制备复合发酵剂接种发酵青菜头泡菜,以自然发酵作为实验对照组,结果发现,人工接种发酵在发酵初期能快速启动发酵,增加乳酸菌和总酸含量、降低pH值,人工接种单一菌株和复合发酵剂之间差异不大,但人工接种复合发酵剂降亚硝峰能力优于单一菌株,使亚硝酸盐含量控制在1.53 mg/kg以内;人工接种复合发酵剂能显著增加青菜头泡菜中游离氨基酸总量、必需氨基酸和呈味氨基酸含量(P<0.05),且其含量显著高于单一菌株和自然发酵(P<0.05),赋予青菜头泡菜较浓郁的滋味;感官评价结果显示,人工接种发酵在色泽、质地方面显著优于自然发酵(P<0.05),酸甜适中,滋味浓郁,清脆爽口,具有青菜头泡菜特有的香气,整体更受欢迎。
综上所述,人工接种复合发酵剂能够快速启动青菜头泡菜发酵,缩短发酵周期,增加游离氨基酸含量,降低亚硝峰,提高食用安全性,为以后复合发酵剂的研制在泡菜上的应用提供一定的实验基础。由于泡菜微生物发酵是一个复杂体系,其作用机理和各微生物之间的相互作用还有待进一步研究。
[1] 陈功. 中国泡菜的品质评定与标准探讨[J]. 食品工业科技, 2009, 30(2):335-338.
[2] 曹佳璐. 传统四川泡菜盐水乳酸菌多样性的研究[D]. 北京:中国农业大学,2017.
[3] 李恒,陈功,伍亚龙,等. 高通量测序方法研究传统四川泡菜母水中微生物群落的动态变化[J]. 食品科学, 2018, 39(24):131-138.
[4] 张梦梅,李小艳,胡露,等. 低温乳酸菌发酵泡白菜有机酸和游离氨基酸含量分析[J]. 食品与发酵工业, 2015, 41(11):137-142.
[5] XIA Y J, LIU X F, WANG G Q, et al. Characterization and selection of Lactobacillus brevis starter for nitrite degradation of Chinese pickle[J]. Food Control, 2017, 78:126-131.
[6] JANG J Y, LEE M E, LEE H W, et al. Extending the shelf life of kimchi with Lactococcus lactis strain as a starter culture[J]. Food Science and Biotechnology, 2015, 24(3):1 049-1 053.
[7] SHIN S Y, HAN N S. Leuconostoc spp. as Starters and Their Beneficial Roles in Fermented Foods[M]// Beneficial Microorganisms in Food and Nutraceuticals. Springer International Publishing, 2015:111-132.
[8] JUNG J Y, LEE S H, LEE H J, et al. Effects of Leuconostoc mesenteroides starter cultures on microbial communities and metabolites during kimchi fermentation[J]. International of Journal of Food Microbiology, 2012, 153(3):378-387.
[9] CHO S K, EOM H J, MOOM J S, et al. An improved process of isomaltooligosaccharide production in kimchi involving the addition of a Leuconostoc starter and sugars[J]. International Journal of Food Microbiology, 2014, 170(3):61-62.
[10] 朴泓洁,黄存辉,金清. 肠膜明串珠菌发酵对四川泡菜品质的影响[J]. 食品科技, 2018, 43(8):31-35.
[11] RYU E H, YANG E J, WOO E R, et al. Purification and characterization of antifungal compounds from Lactobacillus plantarum HD1 isolated from kimchi[J]. Food Microbiology, 2014, 41(8):19-26.
[12] 潘晓倩,成晓瑜,张顺亮,等. 腌腊肉制品中乳酸菌的筛选鉴定及其在腊肠中的应用[J]. 食品科学, 2017, 38(16):57-63.
[13] 侯爱香,王一淇,黄晴,等. 自然发酵与人工接种发酵湖南芥菜的挥发性风味组分和品质分析[J]. 食品科学, 2018, 39(6):237-245.
[14] 吴伟杰,郜海燕,陈杭君,等. 白萝卜泡菜发酵菌株乳酸肠球菌WJ03的分离筛选与应用[J]. 中国食品学报, 2017, 17(12):86-94.
[15] 李文斌,宋敏丽,唐中伟,等. 自然发酵泡菜微生物群落变化的研究[J]. 中国食物与营养, 2008(11):22-24.
[16] 刘洪. 自然发酵与人工接种泡菜发酵过程中品质变化规律的动态研究[D]. 成都:西华大学, 2012.
[17] 段先兵,钟叶芳,杨维占. 泡菜中硝酸盐和亚硝酸盐含量及pH值变化规律[J]. 中国卫生检验杂志, 2019, 29(4):481-482;486.
[18] 钱志伟,郭淼. 泡菜腌制过程中总酸、Vc和亚硝酸盐含量的动态观察[J]. 江苏调味副食品, 2000(1): 16-18.
[19] 李南薇,李宁,廖贵全. 乳酸菌发酵泡菜的特性研究[J]. 陕西科技大学学报, 2008, 26(5):68-71;75.
[20] 侯娜,赵莉莉,魏安智,等. 不同种质花椒氨基酸组成及营养价值评价[J]. 食品科学, 2017, 38(18):113-118.
[21] 刘伟,张群,李志坚,等. 不同品种黄花菜游离氨基酸组成的主成分分析及聚类分析[J]. 食品科学, 2019, 40(10):243-250.
[22] 周秀琴. 日本天然调味料开发现状[J]. 中国调味品, 1993(11):3-10.
[23] 任建敏,吴四维. 功能食品苦味功能因子生理活性及其掩苦技术的研究进展[J]. 食品工业科技, 2013, 34(3):396-400.