鲢鱼(Hypophthalmichthys molitrix)俗称为白鲢、水鲢等[1],具有生长迅速、产量高、营养价值高等特点,在2017年我国淡水养殖鱼类产量中位居第二,达到385.28万t[2-3]。在鲢鱼的加工过程中,产生大量的鱼骨、鱼皮、鱼鳞等副产物。其中,鱼骨中含有丰富的蛋白、不饱和脂肪酸、钙、磷等营养成分,是一种优良的营养食物资源[4]。
近年来,利用鱼骨制备胶原多肽尤其是抗氧化肽成为了研究热点[5-10]。相比陆生动物来源的胶原多肽而言,水产动物来源的胶原多肽没有疯牛病、猪瘟、禽流感等动物疾病的威胁[11];同时与市场上常见二丁基羟基甲苯、丁基羟基茴香醚等存在致癌风险的抗氧化剂相比[12],水产动物来源的天然抗氧化肽对人体更加安全、有效,其在食品、化妆品和医疗等领域中具有广阔的应用前景。
目前,以鲢鱼骨为原料制备高抗氧化活性的胶原多肽的研究鲜有报道。本文以鲢鱼骨为原材料,采用单因素实验、响应面优化实验确定鲢鱼骨胶原多肽的最佳制备工艺,然后采用Sephadex G-25凝胶色谱对制备得到的胶原多肽进行分离纯化,得到高抗氧化活性的多肽组分。
1 材料与方法
1.1 材料与试剂
新鲜鲢鱼骨,由丹江口市优优水产开发有限公司提供。
中性蛋白酶、碱性蛋白酶、风味蛋白酶、胰蛋白酶,北京索莱宝科技有限公司;复合蛋白酶,江苏锐阳生物科技有限公司;细胞色素C、抑肽酶、羟脯氨酸(色谱纯),北京索莱宝科技有限公司;L-氧化型谷胱甘肽、三氟乙酸(色谱纯),上海阿拉丁生化科技有限公司; 2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)(分析纯),北京索莱宝科技有限公司;三氯乙酸(trichloroacetic acid,TCA)、K3[Fe(CN)6]、FeCl3(分析纯),上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
电子分析天平(FA1104N型),上海丙林电子科技有限公司;SevenCompact台式pH计(S220),梅特勒-托利多仪器(上海)有限公司;数显恒温水浴锅(HH-6型),国华电器有限公司;自动凯氏定氮仪(SKD-800型),上海沛欧分析仪器有限公司;立式压力蒸汽灭菌锅(YXQ-LS-100SII),上海博迅实业有限公司医疗设备厂;实验喷雾干燥塔(MDR-5型),无锡市现代喷雾干燥设备有限公司;冷冻干燥机(SR-AON-50),上海舍岩仪器有限公司;紫外可见分光光度计(U-2910型),Hitachi High-Tech Science Corporation;HSM高效液相色谱(D-2000),日本Hitachi公司;氨基酸分析仪(L-8900),日本Hitachi公司;紫外检测仪(HD-21-88),上海琪特分析仪器有限公司;全自动部分收集器(BSZ-160),上海青浦沪西仪器厂;精密蠕动泵(BT100-2J),保定兰格恒流泵有限公司;酶标仪(Synergy H1),美国Bio Tek公司。
1.3 方法
1.3.1 鲢鱼骨预处理
鲢鱼骨粉制备工艺:
鲢鱼骨→解冻→沸水煮5 min→剔除鱼肉和膜性组织→冲洗→高压蒸煮(124 ℃、1.5 h)[4]→去上层脂肪→胶体磨→喷雾干燥→鲢鱼骨粉
1.3.2 酶解提取工艺
胶原多肽提取工艺:
鲢鱼骨粉→按一定料液比加水→调节pH→加酶→水浴酶解→灭酶(100 ℃,10 min)→离心→胶原多肽溶液→冻干→胶原多肽粉末
1.3.3 蛋白酶的筛选
分别选用中性蛋白酶、碱性蛋白酶、风味蛋白酶、胰蛋白酶和复合蛋白酶对鱼骨粉进行水解,其酶解条件如表1所示[13-14]。以胶原多肽得率结合水解度为指标,筛选出合适的蛋白酶。
表1 5种蛋白酶的酶解条件
Table 1 The enzymatic hydrolysis conditions of five proteases
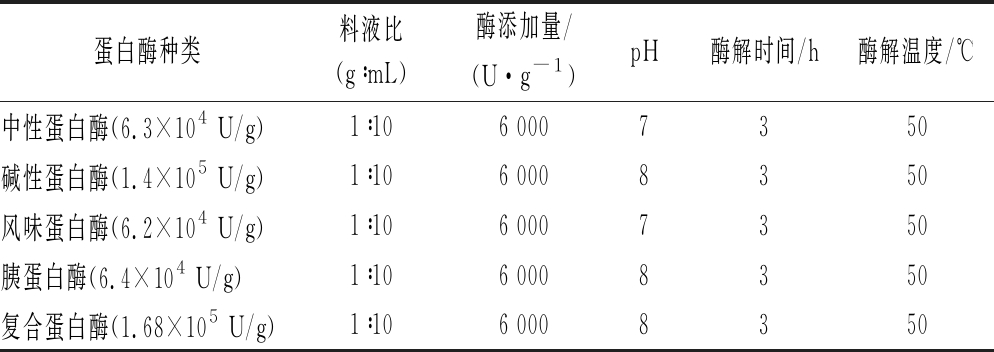
蛋白酶种类料液比(g∶mL)酶添加量/(U·g-1)pH酶解时间/h酶解温度/℃中性蛋白酶(6.3×104 U/g)1∶106 0007350碱性蛋白酶(1.4×105 U/g)1∶106 0008350风味蛋白酶(6.2×104 U/g)1∶106 0007350胰蛋白酶(6.4×104 U/g)1∶106 0008350复合蛋白酶(1.68×105 U/g)1∶106 0008350
注:5种蛋白酶酶活力参照SB/T 10317—1999《蛋白酶活力测定法》中福林酚法测定[15]。
1.3.4 鱼骨胶原多肽提取工艺优化
1.3.4.1 单因素试验设计
采用复合蛋白酶水解鱼骨粉制备胶原多肽,以胶原多肽得率结合水解度为指标进行单因素试验设计。分别固定其他因素,依次评价料液比(1∶20、1∶15、1∶10、1∶8、1∶6、1∶4,g∶mL)、酶添加量(2 000、4 000、6 000、8 000、10 000、12 000 U/g)、pH值(5.0、6.0、7.0、8.0、9.0、10.0)、酶解温度(30、40、50、60、70、80 ℃)、酶解时间(1、2、3、4、5、6 h)对鱼骨粉酶解效果的影响。
1.3.4.2 响应面试验设计
在单因素试验的基础上,以胶原多肽得率为响应值(Y),选取酶添加量(A)、酶解温度(B)、酶解时间(C)对鱼骨粉酶解影响较强的3个因素为自变量,利用Box-Behnken中心组合原理设计3因素3水平的响应面试验,探索从鱼骨中制备胶原多肽的最佳条件。
1.3.5 评价指标的测定
1.3.5.1 胶原多肽得率的测定
参照贾瑞波等[16]的方法略作修改,采用Folin-酚法测定酶解液中胶原多肽的含量。以质量浓度为 0~200 μg/mL的牛血清白蛋白为横坐标(X),650 nm处的吸光值为纵坐标(Y),绘制牛血清白蛋白的标准曲线:Y=0.001 6X-0.005 8(R2=0.998 5)。取1 mL稀释到适宜浓度的酶解液进行测定,其结果代入标准曲线计算酶解液中胶原多肽的含量。参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法进行测定原料中总蛋白含量[17]。按公式(1)计算酶解液中胶原多肽得率:
胶原多肽得率![]()
(1)
1.3.5.2 水解度的测定
采用甲醛滴定法[18]测定酶解液中游离氨基氮含量,参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法进行测定原料中总氮含量[17]。按公式(2)计算酶解液的水解度:
水解度![]()
(2)
1.3.6 酶解液中胶原多肽分子质量分布的测定
按照GB 31645—2018《食品安全国家标准 胶原蛋白肽》中高效体积排阻色谱法(high performance size exclusion chromatography,HPSEC)进行测定酶解液中胶原多肽分子质量的分布情况[19]。按照上述最优条件制备鱼骨胶原多肽溶液,离心取上清液冻干,配制成2 mg/mL的溶液,过0.22 μm水系滤膜后,使用高效液相色谱仪(high performance liquid chromatograph,HPLC)上样分析。以质量浓度为2 mg/mL的细胞色素C(12 384 Da)、抑肽酶(6 511.51 Da)、L-氧化型谷胱甘肽(612.63 Da)和羟脯氨酸(131.13 Da)为标准品绘制相对分子质量校正曲线。色谱柱:XBridge BEH 125Å SEC(3.5 μm,(7.8×300) mm);流动相:V(乙腈)∶V(水0.1%TFA)=40∶60;流速:0.5 mL/min;柱温:30 ℃;进样量:10 μL。
1.3.7 Sephadex G-25分子筛层析
填料预处理:称量30 g Sephadex G-25干凝胶于300 mL烧杯中,加入适量的超纯水并搅拌,于室温下浸泡24 h后使其充分溶胀。
装柱:选取规格16 mm×80 cm的层析柱,超纯水洗净后固定在铁架台上。出口接上乳胶管,先往层析柱内加入少量的超纯水,将预先准备好的Sephadex G-25填料混匀,缓慢倒入层析柱至液面高度为2~3 cm。连接进水口并打开恒流泵,用超纯水进行平衡至液面高度不再发生改变。
上样:将冻干的胶原多肽粉末用超纯水配制成浓度为100 mg/mL,过0.22 μm水系滤膜后取2 mL上样。
洗脱收集:洗脱液:超纯水;流速:0.4 mL/min;紫外检测波长:220 nm;每管收集量:4 mL。将同一组分合并收集,冻干并称其质量。
1.3.8 不同分子质量多肽氨基酸组成分析
参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》[20],采用氨基酸分析仪对样品中氨基酸的含量进行测定。
1.3.9 体外抗氧化活性的测定
1.3.9.1 ABTS+·清除能力的测定
采用KETNAWA等[21]方法以ABTS+·清除能力实验评价不同分子质量多肽的抗氧化能力:称取38.4 mg ABTS和6.623 mg过硫酸钾混合,蒸馏水溶解后并定容至10 mL配成ABTS+·母液。室温避光反应12~16 h后用0.2 mol/L,pH 7.4的磷酸缓冲液(phosphate buffer saline,PBS)稀释ABTS+·母液至在734 nm处的吸光值为0.7±0.2左右。分别移取50 μL稀释到适宜浓度的样品溶液与150 μL ABTS+·溶液于96孔酶标板上混匀,室温下避光反应6 min后于734 nm处测定吸光值(Ai)。以50 μL蒸馏水代替样品的反应体系为控制组(Ac),以150 μL PBS代替ABTS+·溶液的反应体系为样品空白组(Aj),以50 μL蒸馏水和150 μL PBS分别代替样品和ABTS+·溶液的反应体系为空白组(Ab)。以谷胱甘肽(glutathione,GSH)为阳性对照,结果用百分抑制率表示,采用Origin 8.6软件中的多项拟合计算样品清除50%的自由基所需样品的浓度。按公式(3)计算ABTS+·清除能力:
清除率![]()
(3)
1.3.9.2 还原能力的测定
采用贾韶千等[22]方法测定不同分子质量多肽之间的还原能力。分别移取0.2 mL不同浓度的样品溶液与0.5 mL 1 % K3[Fe(CN)6]混合,50 ℃水浴20 min后,加入0.5 mL 10% TCA终止反应。将反应液以5 000 r/min离心5 min,取上清液0.5 mL于离心管中,分别加入0.5 mL蒸馏水和0.2 mL 0.1 % FeCl3,摇匀后置于50 ℃水浴10 min。取200 μL溶液于700 nm处测定吸光值。0.2 mL蒸馏水代替FeCl3作为空白对照。以GSH为阳性对照,OD1.0值表示使反应体系的吸光值为1.0时所需要的样品浓度。
1.4 数据处理
所有实验均重复3次,实验数据均以![]() 表示。采用Design-Expert 8.1软件进行响应面试验设计和数据分析。采用Origin 8.6软件作图,SPSS 22.0软件对数据进行单因素方差分析(ANOVA),使用Tukey HSD程序进行差异显著性分析。P <0.05表示差异性显著,P<0.01表示差异性极显著。
表示。采用Design-Expert 8.1软件进行响应面试验设计和数据分析。采用Origin 8.6软件作图,SPSS 22.0软件对数据进行单因素方差分析(ANOVA),使用Tukey HSD程序进行差异显著性分析。P <0.05表示差异性显著,P<0.01表示差异性极显著。
2 结果与分析
2.1 最优酶的筛选
在蛋白酶的作用下,鱼骨中的胶原蛋白会进行水解形成胶原多肽,过度水解则会进一步将胶原多肽水解成小分子质量的短肽和游离氨基酸,导致胶原多肽含量的降低[23]。5 种不同蛋白酶对鲢鱼骨的酶解效果如图1所示。其中,风味蛋白酶的水解度最高,然后依次是复合蛋白酶、中性蛋白酶、碱性蛋白酶和胰蛋白酶。经复合蛋白酶酶解之后,酶解液中胶原多肽得率最高,达到43.72 %(P<0.05),风味蛋白酶与复合蛋白酶相比,其胶原多肽含量低,是由于水解度高,比其他酶水解更加彻底,由于部分胶原多肽水解形成氨基酸所致。而碱性蛋白酶、中性蛋白酶和胰蛋白酶水解鲢鱼骨中胶原蛋白的能力弱于复合蛋白酶,水解度较低,故胶原多肽含量低于复合蛋白酶。由此可见,在酶活力和酶解时间相同的情况下,复合蛋白酶酶解鲢鱼骨制备胶原多肽的效率最高。本次实验使用的复合蛋白酶是由多种酶混合复配而成,主要以碱性蛋白酶和风味蛋白酶为主,其主要作用位点是疏水氨基酸[24],与其他蛋白酶相比,可以获得更多的抗氧化肽。经酶活力测定,复合蛋白酶的酶活力高于碱性蛋白酶(单酶),且风味蛋白酶的存在又可以降低苦味肽的形成[25],适用于骨、肉副产物的水解和骨胶原多肽的生产。为了更好地制备高抗氧化活性胶原多肽,节约成本,综合考虑选择复合蛋白酶用于后续鱼骨胶原多肽制备工艺的优化。
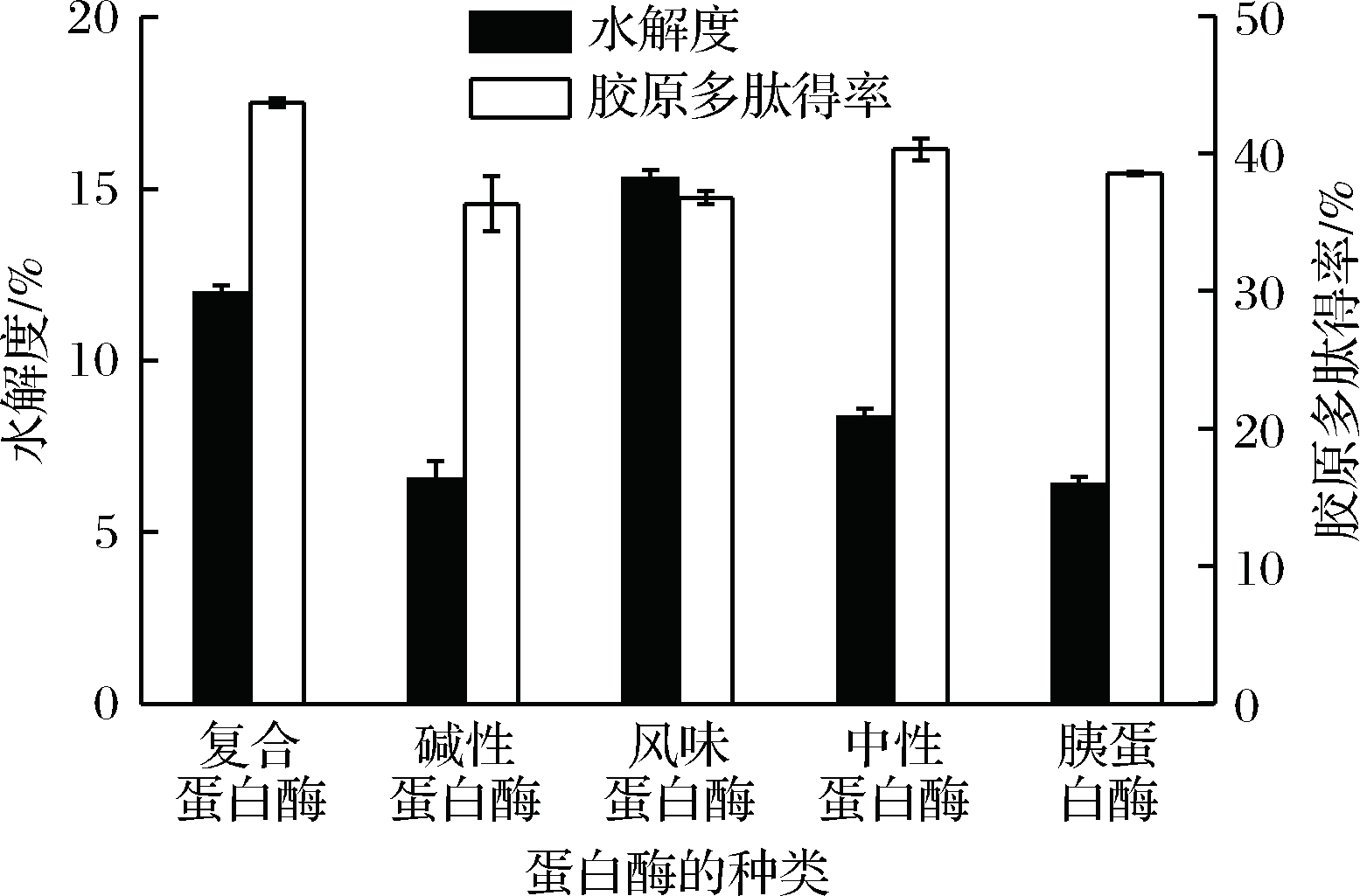
图1 5种蛋白酶的酶解效果
Fig.1 Enzymatic hydrolysis effect of five proteases
2.2 单因素试验结果
复合蛋白酶酶解鲢鱼骨制备胶原多肽的单因素试验结果如图2-a~图2-e所示。由图2-a可知,胶原多肽得率随料液比的增大呈下降的趋势,水解度先上升后趋于平稳,在料液比为1∶10(g∶mL)时,其胶原多肽含量和水解度都较高,当料液比继续增大,胶原多肽得率反而下降。由图2-b可知,胶原多肽得率和水解度随着酶添加量的增加而呈现先上升后下降的趋势,当酶添加量为8 000 U/g时,胶原多肽得率最高,达49.00 %(P<0.05),继续增大酶添加量,胶原多肽得率反而下降。由图2-c可知,胶原多肽得率和水解度随着pH的增加而呈现先上升后下降的趋势,当pH为8.0时,胶原多肽得率最高,达44.38 %(P<0.05)。图2-a~图2-c的结果与刘静[26]的报道相一致,原因在于底物浓度随着料液比的增大而增大,但一定量的酶无法酶解过多的底物,导致胶原多肽增加的比例小于底物增加的比例,这也是底物浓度越大其胶原多肽得率越小的主要原因;在适宜温度的条件下,复合蛋白酶含量增加,使底物和蛋白酶更加充分反应,水解度和胶原多肽得率增大,当酶量增加到一定量的时候,酶和底物结合位点达到饱和,此时再增加酶量也不会促进底物的水解,反而造成酶的浪费;pH过低或过高都会影响复合蛋白酶的活性,进而影响酶解效果。
由图2-d可知,随着酶解温度的升高,胶原多肽得率呈现先上升后下降的趋势,当酶解温度为50 ℃时,胶原多肽得率达到最大值40.72 %(P<0.05),其原因是温度过高会导致复合蛋白酶的酶活力下降甚至失活,产物形成的方向发生改变[22],这与图2-c中过低或过高的pH会导致胶原多肽得率和水解度降低的解释相一致。由图2-e可知,随着酶解时间的增加,胶原多肽得率呈现先上升后下降的趋势,而水解度呈现先上升后趋于平稳的趋势,在当酶解时间为4 h时,胶原多肽得率达到最大值(49.59%)(P<0.05)。当酶解反应开始后,酶与底物激烈反应,使原料的水解度和胶原多肽得率增大,但随着酶解时间的延长,胶原多肽会被过度水解成氨基酸,使得胶原多肽得率下降[27]。
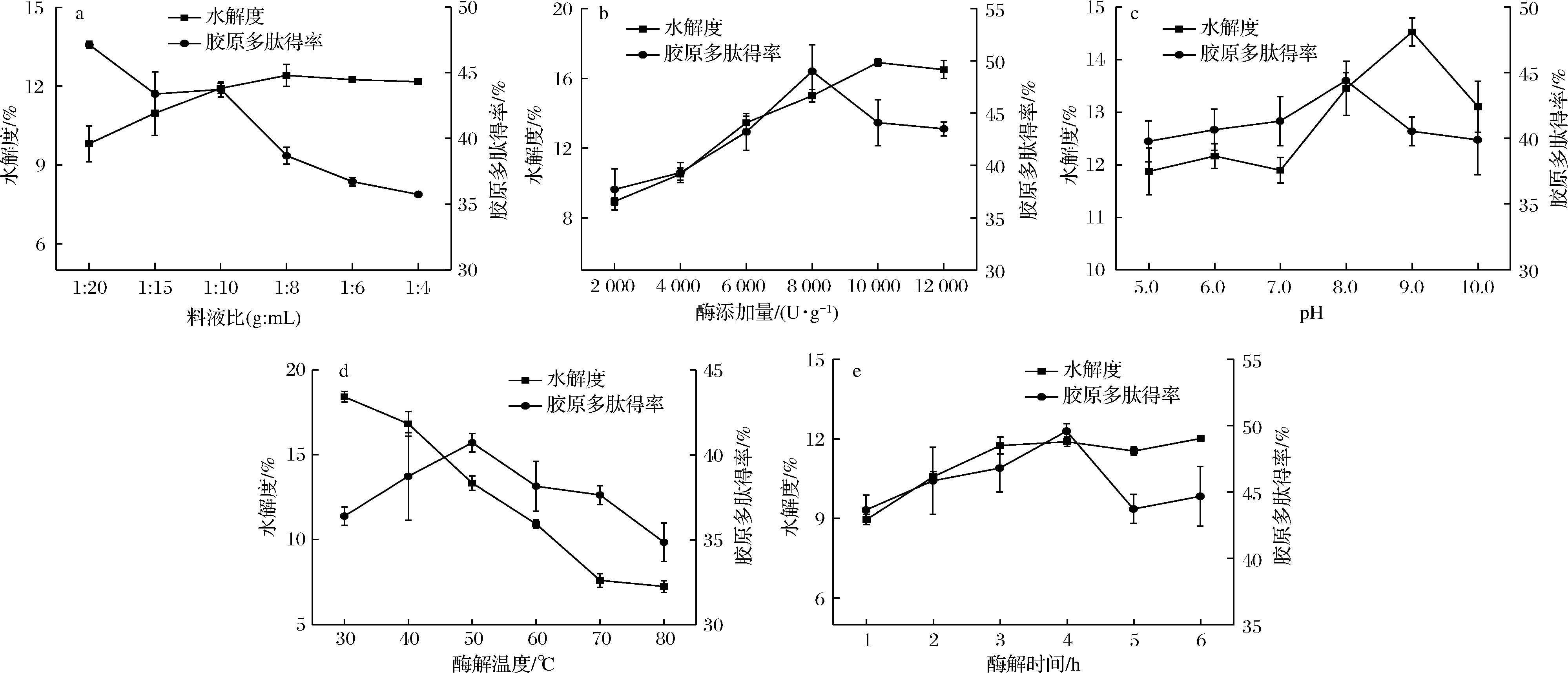
a-液料比;b-酶添加量;c-pH;d-酶解温度;e-酶解时间
图2 提取条件对胶原多肽得率和水解度的影响
Fig.2 Effect of extraction conditions on the collagen polypeptide yield and degree of hydrolysis
2.3 响应面优化试验结果
2.3.1 响应面试验设计及结果分析
根据单因素试验结果,选取酶添加量(A)、酶解温度(B)、酶解时间(C)3因素,利用Box-Behnken中心组合原理设计3因素3水平的响应面试验,试验结果见表2。
表2 Box-Behnken试验设计和胶原多肽得率结果
Table 2 Box-Behnken design and collagen polypeptide yield results
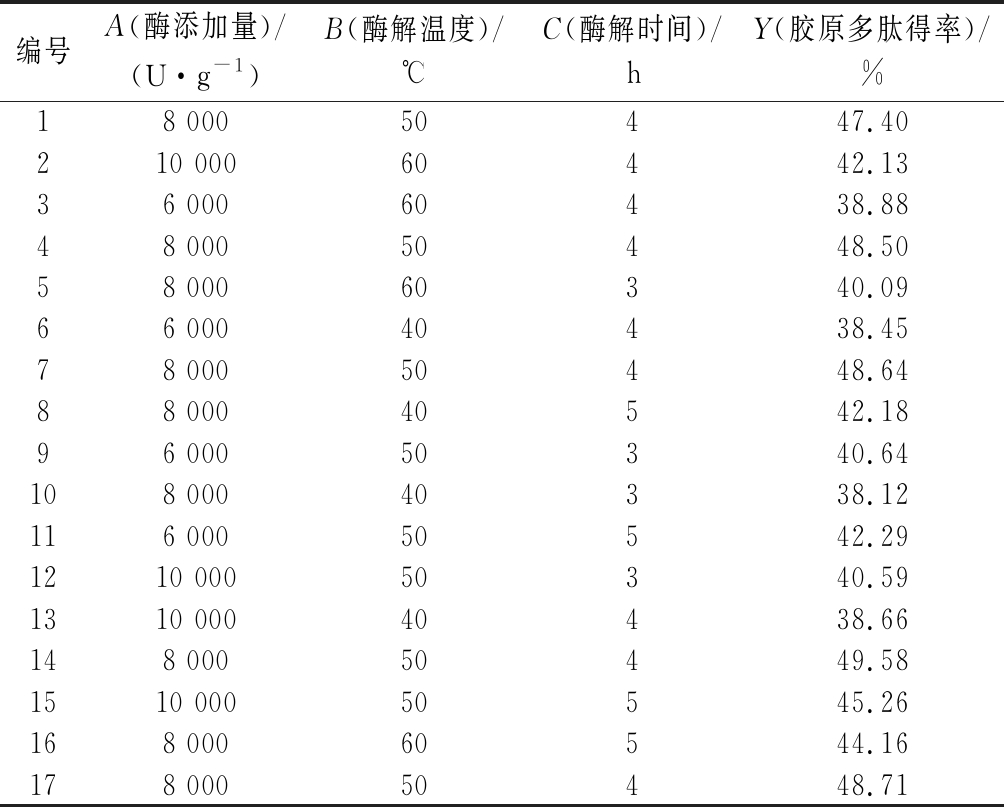
编号A(酶添加量)/(U·g-1)B(酶解温度)/℃C(酶解时间)/hY(胶原多肽得率)/%18 00050447.40210 00060442.1336 00060438.8848 00050448.5058 00060340.0966 00040438.4578 00050448.6488 00040542.1896 00050340.64108 00040338.12116 00050542.291210 00050340.591310 00040438.66148 00050449.581510 00050545.26168 00060544.16178 00050448.71
对表2中的试验结果进行回归分析,得到二次多项式方程:Y=48.57+0.80A+0.98B+1.81C+0.76AB+0.75AC+2.500E-003BC-3.99A2-5.05B2-2.38C2,回归模型方差分析和系数显著性结果如表3所示。
表3 回归模型方差分析和系数显著性检验
Table 3 Variance analysis and significance test of regression model
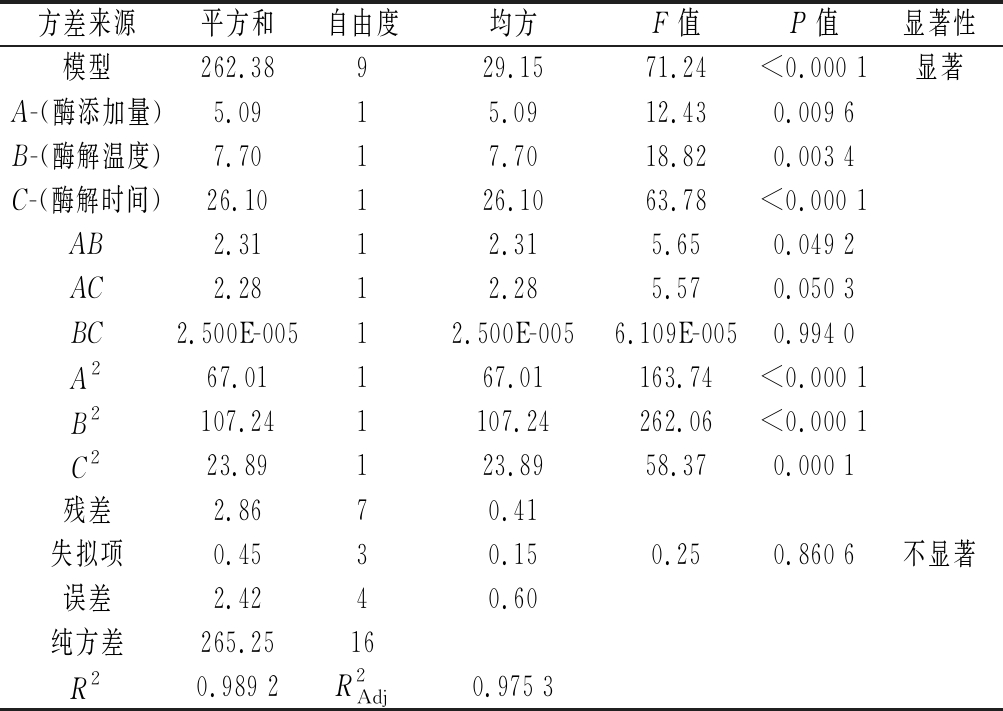
方差来源平方和自由度均方F值P值显著性模型262.38929.1571.24<0.000 1显著A-(酶添加量)5.0915.0912.430.009 6B-(酶解温度)7.7017.7018.820.003 4C-(酶解时间)26.10126.1063.78<0.000 1AB2.3112.315.650.049 2AC2.2812.285.570.050 3BC2.500E-00512.500E-0056.109E-0050.994 0A267.01167.01163.74<0.000 1B2107.241107.24262.06<0.000 1C223.89123.8958.370.000 1残差2.8670.41失拟项0.4530.150.250.860 6不显著误差2.4240.60纯方差265.2516R20.989 2R2Adj0.975 3
由表3可知,模型P<0.000 1,表明模型为极显著,且失拟项不显著(P>0.05),表示模型预测值与实际值之间的误差较小,具有较好的拟合程度。对回归方程进行显著性检验,结果为R2=0.989 2,反映各因子和响应值之间具有良好的相关性,可以通过此方程预测最佳提取条件;![]() 表明该模型能解释97.53 %的响应值变化,因此说明该模型可以描述复合蛋白酶制备胶原多肽的变化规律。
表明该模型能解释97.53 %的响应值变化,因此说明该模型可以描述复合蛋白酶制备胶原多肽的变化规律。
2.3.2 各因素相互作用分析
酶添加量(A)、酶解温度(B)、酶解时间(C)之间交互作用的响应面图和等高线图如图3所示,可直观分析2个因素之间交互作用对胶原多肽得率的影响程度。等高线的形状可反映出各因素相互作用的强弱,椭圆形则代表2个因素交互作用具有显著影响,而接近圆形则代表不显著。由表3和图3分析可知,因素A、B、C、A2、B2、C2项对胶原多肽得率的影响呈现极显著水平(P<0.01),因素A和B交互作用的等高线图呈椭圆形,对胶原多肽得率的影响具有显著差异(P<0.05),而因素A和C、因素B和C之间的交互作用呈圆形,对胶原多肽得率没有显著影响。由图3结合表3中的F值分析可知,各因素对胶原多肽得率的影响次序:酶解时间>酶解温度>酶添加量,剔除不显著项AC、BC,模型方程进行优化得到:Y=48.57+0.80A+0.98B+1.81C+0.76AB-3.99A2-5.05B2-2.38C2。

图3 酶添加量、酶解温度和酶解时间交互作用对胶原多肽得率的影响
Fig.3 Effects of enzyme addition, enzymatic hydrolysis temperature and enzymatic hydrolysis time on collagen polypeptide yield
2.3.3 最优条件的验证
采用软件对优化后的回归方程分析可知,当酶添加量为8 220.30 U/g、酶解温度为51.06 ℃、酶解时间为4.38 h时,此时的胶原多肽得率最高,其理论值为49.00 %。按照该条件进行验证试验,为了方便操作,选取酶添加量为8 220 U/g、酶解温度为51℃、酶解时间为4.5 h时,验证实验重复3次,测定胶原多肽得率为(49.00±0.80) %,非常接近理论值,无显著性差异(P>0.05),此条件是胶原多肽制备的最优条件,证明该模型方程可行。
2.4 胶原多肽分子质量分布情况
标准品及其混标的HPLC色谱图如图4-a所示,依据标准品与保留时间的关系,以相对分子质量的对数(lg MW)对保留时间(T)作线性回归得到相对分子质量校正曲线,如图4-b所示,其相对分子质量校正曲线方程:lg MW=6.821 42-0.246 15T(R2=0.997 05)。表明相对分子质量的对数(lg MW)与保留时间T(min)具有良好的线性关系,根据胶原多肽的出峰时间和相对分子质量校正曲线方程,可计算胶原多肽粉末各组分的分子质量。

a-液相色谱;b-校正曲线
图4 标准品的高效液相色谱图和相对分子质量校正曲线
Fig.4 The HPLC chromatogram and relative molecular mass correction curve of standard
鱼骨胶原多肽粉末的HPLC色谱图和分子质量分布如图5和表4所示,图中主要出现5个峰,表明鱼骨胶原多肽是由5种不同分子质量胶原多肽组分所组成,且胶原多肽分子质量分布广,大小不一。由图5和表4可知,利用复合蛋白酶对鱼骨粉酶解,其胶原多肽主要集中在组分Ⅱ、Ⅲ和Ⅳ,分子质量为400~3 000 Da,且组分Ⅲ含量最高,约为56.58 %。根据胶原多肽分子质量分布的HPLC色谱图,采用Sephadex G-25分子层析将其分离纯化。

图5 鱼骨胶原多肽的高效液相色谱图
Fig.5 The HPLC chromatogram of fish bone collagen polypeptide
2.5 Sephadex G-25分子筛层析
凝胶过滤是一种基于分子质量大小分离肽的有效方法,已经被广泛用于混合组分多肽的分离[28]。鱼骨胶原多肽经Sephadex G-25柱洗脱分离之后的图谱及各组分含量如图6和表5所示。鱼骨胶原多肽被分离成5个组分,冻干后组分Ⅰ~Ⅴ的质量分数分别为5.50%、28.49%、36.25%、7.55%和1.26%,组分Ⅲ的响应值和含量最高(P<0.05)。除去在分离过程中的损失量,其各组分的相对含量与HPLC的结果基本一致。其中,组分Ⅴ的含量低,分离1次仅有(2.53±0.04)mg的收集量,因考虑时间、经济成本等具体影响,故收集前4个组分作为后续的研究对象。
表4 鱼骨胶原多肽不同组分的分子量及相对含量
Table 4 The molecular weight and relative contentof different components of fish bone collagen polypeptide
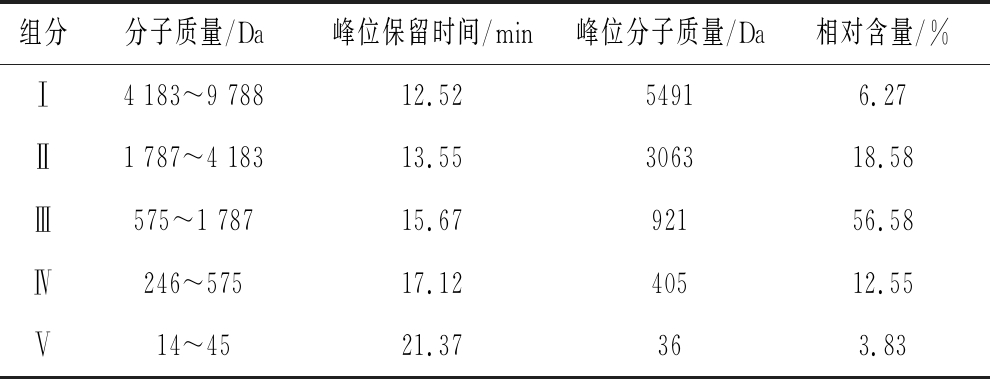
组分分子质量/Da峰位保留时间/min峰位分子质量/Da相对含量/%Ⅰ4 183~9 78812.5254916.27Ⅱ1 787~4 18313.55306318.58Ⅲ575~1 78715.6792156.58Ⅳ246~57517.1240512.55Ⅴ14~4521.37363.83
注:相对含量的数据来源于HPLC。

图6 鱼骨胶原多肽的Sephadex G-25注洗脱图谱
Fig.6 The elution chromatography of Sephadex G-25 column of fish bone collagen polypeptide
表5 不同胶原多肽组分的含量
Table 5 The content of different collagen polypeptide components

组分含量/mg质量分数/%Ⅰ11.00±1.50b5.50Ⅱ56.97±2.41d28.49Ⅲ72.50±2.30e36.25Ⅳ15.10±1.27c7.55Ⅴ2.53±0.04a1.26
注:酶解液浓度为100 mg/mL,一次上样体积2 mL。
2.6 氨基酸组成分析
对样品进行氨基酸组成分析,其含量如表6所示。
表6 胶原多肽及其组分的氨基酸含量比较
Table 6 The comparison of amino acid contents of collagen polypeptide and their components

氨基酸种类含量/(mmol·L-1)胶原多肽粉末组分Ⅰ组分Ⅱ组分Ⅲ组分Ⅳ天冬氨酸(Asp)5.757.428.401.110.53苏氨酸(Thr)#2.982.993.501.890.50丝氨酸(Ser)3.703.774.730.790.43谷氨酸(Glu)7.888.259.581.760.72甘氨酸(Gly)17.8823.7129.925.613.62半胱氨酸(Cys)0.170.150.07NDND酪氨酸(Tyr)0.94NDND0.944.36赖氨酸(Lys)#2.110.971.300.500.12组氨酸(His)0.680.310.390.781.22精氨酸(Arg)2.840.590.884.460.48丙氨酸(Ala)*6.365.87.963.070.94缬氨酸(Val)*#2.431.291.932.10.5甲硫氨酸(Met)*#0.770.170.110.580.29异亮氨酸(Ile)*#1.500.861.181.500.25亮氨酸(Leu)*#3.001.431.934.920.76苯丙氨酸(Phe)*#1.110.330.511.097.39脯氨酸(Pro)*7.389.3412.80NDND总氨基酸67.4867.3885.1931.122.11疏水氨基酸%33.4228.5231.0142.6445.82必须氨基酸%20.6011.9312.2840.4544.37
注:*表示该氨基酸为疏水氨基酸,#表示该氨基酸为必需氨基酸,ND表示末检测出该氨基酸。
胶原多肽粉末中甘氨酸(Gly)含量最高,谷氨酸(Glu)、脯氨酸(Pro)、丙氨酸(Ala)和天冬氨酸(Asp)的含量也相对较高,符合胶原蛋白氨基酸组成特征[29]。且样品分子质量较小,主要集中在400~3 000因此可以认为该粉末中主要成分是胶原多肽。当多肽的N-端或C-端存在疏水氨基酸时,有利于多肽在脂质中的溶解,从而提高其抗氧化活性[30-31],如SONG等[30] 使用内源性蛋白酶对鱿鱼内脏进行酶解,其水解物中疏水氨基酸的相对含量达到38.52%,有助于形成疏水结构,使得其具有显著的抗氧化性。如表6所示,胶原多肽粉末的疏水氨基酸含量仅有33.42 %,经Sephadex G-25柱洗脱之后,组分Ⅲ和组分Ⅳ的疏水氨基酸含量增加,分别为40.45 %和44.37%。除此之外,胶原多肽和各组分含有一定量的必需氨基酸。综上所述,鲢鱼骨胶原多肽中某些组分可以作为一种高营养的抗氧化剂膳食补充剂。
2.7 体外抗氧化实验结果
2.7.1 ABTS+·清除能力
胶原多肽及其各组分的ABTS+·清除能力如图7所示,其IC50值如表7所示。在样品的测试浓度(0.015~1.0 mg/mL),所有样品均具有较好的ABTS+·清除能力,且ABTS+·清除能力随着样品浓度的递增而增加。组分Ⅳ具有最强的ABTS+·清除能力(P < 0.05),其IC50值为0.02 mg/mL,明显低于胶原多肽粉末(IC50=0.15 mg/mL)、组分Ⅲ(IC50=0.47 mg/mL)、组分Ⅱ(IC50=0.69 mg/mL)和组分Ⅰ(IC50=0.74 mg/mL),略高于GSH(IC50=0.01 mg/mL)。由表6可知,组分Ⅳ的疏水氨基酸含量最高,使其抗氧化性增加;而胶原多肽粉末的ABTS+·清除能力却强于组分Ⅲ,这是因为一些非疏水氨基酸,如Gly、Asp和Lys,其含量的高低也与抗氧化活性有关[32-33],而胶原多肽中的Gly、Asp和Lys含量远高于组分Ⅲ,故导致胶原多肽粉末的ABTS+·清除能力强于组分Ⅲ。CHI等[34]从大黄鱼肉中分离出3种抗氧化肽,其中ABTS+·清除能力最高的5肽, IC50为0.31 mg/mL,其抗氧化活性低于组分Ⅳ。

图7 胶原多肽及其不同组分的ABTS+·清除能力
Fig.7 The ABTS+·scavenging capacity of collagen polypeptide and their components
表7 胶原多肽及其不同组分的ABTS+·清除能力 的IC50值和还原能力的OD1.0值
Table 7 The IC50 value for ABTS+·scavenging a capacity and OD1.0 value for reduction ability of collagen polypeptide and their components

样品ABTS+·清除能力(IC50)/(mg·mL-1)还原能力(OD1.0)/(mg·mL-1)胶原多肽粉末0.15±0.00b21.85±1.05c组分Ⅰ0.74±0.03dND组分Ⅱ0.69±0.01dND组分Ⅲ0.47±0.06c47.49±0.94d组分Ⅳ0.02±0.00a19.16±0.12bGSH0.01±0.00a0.86±0.02a
注:ND表示末检测。
2.7.2 还原能力
样品中的还原剂能将铁氰化钾(Fe+3)还原成亚铁氰化钾(Fe2+),进一步和FeCl3反应生成在700 nm处具有最大吸光度的普鲁士蓝,其吸光值越大,则表示还原能力及抗氧化性越强[35-36]。鲢鱼骨胶原多肽及其组分的还原能力如图8所示,其OD1.0值如表7所示。在样品的测试浓度(0~50 mg/mL),所有样品均有还原能力,且还原能力随着样品浓度的递增而增加。组分Ⅳ具有最强的还原能力(P < 0.05),其OD1.0值为19.16 mg/mL,明显低于胶原多肽粉末(OD1.0=21.85 mg/mL)、组分Ⅲ(OD1.0=47.49 mg/mL)、组分Ⅰ和组分Ⅱ,高于GSH(OD1.0=0.86 mg/mL),各样品的还原能力结果与ABTS+·清除能力基本一致。杨露等[5]制备的马面鱼骨多肽在50 mg/mL的A700 nm的值仅约为0.4,其还原能力远低于本论文的胶原多肽粉末和各组分。
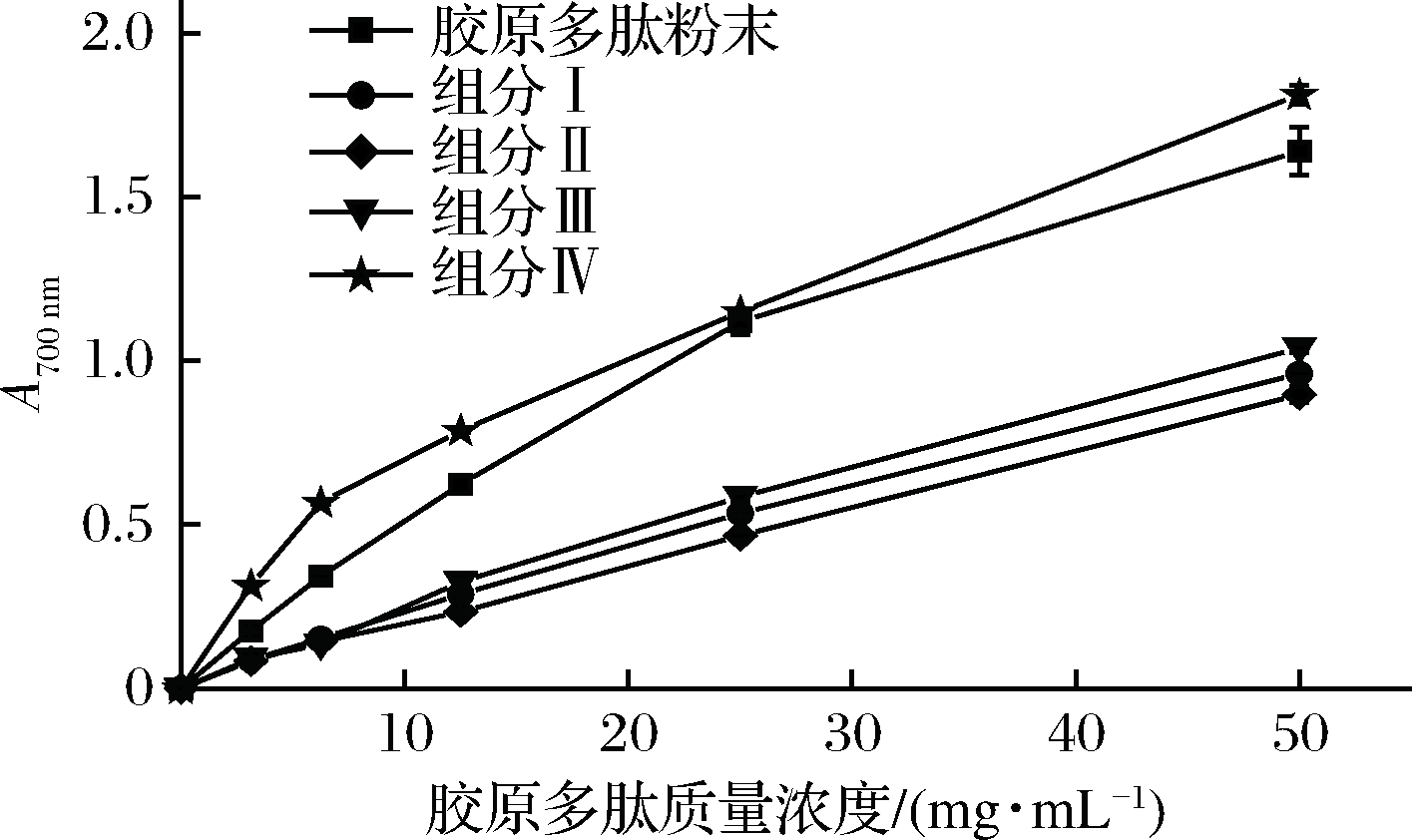
图8 胶原多肽及其不同组分的还原能力
Fig.8 The reducing power of collagen polypeptide and their components
3 结论
本论文以鲢鱼骨为原材料,以胶原多肽得率结合水解度为指标,筛选出复合蛋白酶为制备鱼骨中胶原多肽的最优酶。通过单因素实验、响应面优化确定鲢鱼骨制备胶原多肽的最佳工艺条件为:酶添加量为8 220 U/g、酶解温度为51℃、酶解时间为4.5 h,此时,胶原多肽得率为49.00 %。通过高效体积排阻色谱法分析得出其胶原多肽由5个组分组成,分子质量主要集中在400~3 000 Da。经Sephadex G-25过滤色谱法分离,各组分都具有一定的抗氧化能力,其中组分Ⅳ的ABTS+·清除能力和还原能力最高,其IC50和OD1.0值分别为0.02 mg/mL和19.16 mg/mL。本实验的研究可为制备高抗氧化鱼骨多肽提供数据支撑,也可为提高鱼骨资源利用率提供理论依据。
[1] 栾雅文, 戴高柱, 刘龙翔, 等. 鲢鱼(Hypophthalmichthys molitrix)消化系统组织学的初步研究[J]. 内蒙古大学学报(自然科学版), 1997(5):78-82.
[2] 徐新国. 鲢鱼的生活习性及养殖技术[J]. 现代畜牧科技, 2019,49(1):28-29.
[3] 农业部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2018.
[4] 沙小梅, 郝君晖, 涂宗财, 等. 基于亚临界水技术的鱼骨软化及其在鱼糜中的应用[J]. 食品与发酵工业, 2018,44(2):154-159.
[5] 杨露, 黄毅园, 丁利君, 等. 响应面法优化马面鱼骨多肽液酶解工艺分析及其性能研究[J]. 中国食品添加剂, 2012(Z1):118-124.
[6] KETNAWA S, WICKRAMATHILAKA M, LICEAGA A M. Changes on antioxidant activity of microwave-treated protein hydrolysates after simulated gastrointestinal digestion: Purification and identification[J]. Food Chemistry, 2018,254:36-46.
[7] 郑捷, 李素, 胡爱军, 等. 不同分子量真鲷鱼骨多肽抗氧化活性的研究[J]. 食品工业科技, 2014,35(2):108-111.
[8] PENG Z, HOU H, ZHANG K, et al. Effect of calcium-binding peptide from Pacific cod (Gadus macrocephalus) bone on calcium bioavailability in rats[J]. Food Chemistry, 2017,221:373-378.
[9] 张凯, 侯虎, 彭喆, 等. 鳕鱼骨明胶多肽螯合钙制备工艺及其在体外模拟消化液中的稳定性[J]. 食品科学, 2016,37(24):1-7.
[10] JUNG W K, LEE B J, KIM S K. Fish-bone peptide increases calcium solubility and bioavailability in ovariectomised rats[J]. British Journal of Nutrition, 2006,95(1):124-128.
[11] 王东, 蒲训, 陈明凯, 等. 鲑鳟鱼骨提取胶原肽工艺与产品生物活性研究[J]. 中兽医医药杂志, 2010,29(4):15-19.
[12] SANTOS N A, CORDEIRO A M T M, DAMASCENO S S, et al. Commercial antioxidants and thermal stability evaluations[J]. Fuel, 2012,97:638-643.
[13] 李娇娇. 鹅骨抗氧化肽的酶解工艺优化及其分离纯化的研究[D]. 雅安: 四川农业大学, 2013.
[14] 涂宗财, 唐平平, 郑婷婷, 等. 响应面优化鱼鳔胶原肽制备工艺及其抗氧化活性研究[J]. 食品与发酵工业, 2017,43(5):160-166.
[15] 国家国内贸易局, 上海市酿造科学研究所. SB/T 10317-1999 蛋白酶活力测定法[S]. 北京: 中国标准出版社, 1999.
[16] 贾瑞波, 韩春晖, 贺建华, 等. 市售不同来源福林试剂对多肽含量测定结果的影响[J]. 中国药师, 2016,19(12):2 378-2 380.
[17] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.5—2016 食品安全国家标准 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2016.
[18] 杨文博, 张英华. 蛋白质水解度的测定方法研究[J]. 中国调味品, 2014,39(3):88-90.
[19] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 31645—2018 食品安全国家标准 胶原蛋白肽[S]. 北京: 中国标准出版社, 2018.
[20] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.124—2016 食品安全国家标准 食品中氨基酸的测定[S]. 北京: 中国标准出版社, 2016.
[21] KETNAWA S, LICEAGA A M. Effect of microwave treatments on antioxidant activity and antigenicity of fish frame protein hydrolysates[J]. Food and Bioprocess Technology, 2017,10(3):582-591.
[22] 贾韶千, 李艳霞. 黄鳝鱼骨多肽制备及其抗氧化活性[J]. 食品科学, 2016,37(1):133-138.
[23] DONG S, ZENG M, WANG D, et al. Antioxidant and biochemical properties of protein hydrolysates prepared from Silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry, 2008,107(4):1 485-1 493.
[24] 白仁奥. 酶法制备文蛤活性多肽的研究[D]. 厦门: 集美大学, 2013.
[25] 吴书建, 张佳男, 高世珏, 等. 南美白对虾虾头制备鲜味水解物的研究[J]. 食品工业科技, 2019,40(4):34-42;50.
[26] 刘静. 牦牛骨胶原多肽螯合钙的制备研究[D]. 雅安: 四川农业大学, 2016.
[27] 任二芳, 艾静汶, 牛德宝, 等. 酶解罗非鱼骨提取胶原多肽的工艺优化[J]. 食品工业, 2017,38(5):1-5.
[28] FENG Y X, RUAN G R, JIN F, et al. Purification, identification, and synthesis of five novel antioxidant peptides from Chinese chestnut (Castanea mollissima Blume) protein hydrolysates[J]. Lwt-Food Science and Technology, 2018,92:40-46.
[29] 范鸿冰, 汪之颖, 刘鹏, 等. 鲢鱼骨胶原多肽螯合钙的制备研究[J]. 南方水产科学, 2014,10(2):72-79.
[30] SONG R, ZHANG K, WEI R. In vitro antioxidative activities of squid (Ommastrephes bartrami) viscera autolysates and identification of active peptides[J]. Process Biochemistry, 2016,51(10):1 674-1 682.
[31] ZHUANG Y, SUN L, ZHAO X, et al. Investigation of gelatin polypeptides of Jellyfish (Rhopilema esculentum) for their antioxidant activity in vitro[J]. Food Technology and Biotechnology, 2010,48(2):222-228.
[32] SILA A, BOUGATEF A. Antioxidant peptides from marine by-products: Isolation, identification and application in food systems. A review[J]. Journal of Functional Foods, 2016,21:10-26.
[33] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins: A review[J]. Peptides, 2010,31(10):1 949-1 956.
[34] CHI C F, HU F Y, WANG B, et al. Purification and characterization of three antioxidant peptides from protein hydrolyzate of croceine croaker (Pseudosciaena crocea) muscle[J]. Food Chemistry, 2015,168:662-667.
[35] SARBON N M, BADII F, HOWELL N K. Purification and characterization of antioxidative peptides derived from chicken skin gelatin hydrolysate[J]. Food Hydrocolloids, 2018,85:311-320.
[36] 时惠敏, 胡春霞. 基于Fe2+的显色反应测定还原性药物的研究进展[J]. 广州化工, 2015,43(7):39-41.