常春藤皂苷元,又名(3β,4α)-3,23-二羟基齐墩果-12-烯-28-酸,分子式C30H4804,属于齐墩果烷型五环三萜类化合物,是许多天然产物的活性成分[1],广泛存在于多种药用植物中[2]。对于常春藤皂苷元的研究,只有从各种植物中对所有有效成分的提取、分离及纯化得到常春藤皂苷元[3-4]、采用高效液色谱对其进行含量测定[5],没有研究者系统地对常春藤皂苷元工艺优化及含量测定进行研究。
八月瓜为木通科木通属攀援式常年生藤本植物三叶木通的果实,是野生水果珍品[6-12],SYUJIL等[13]在三叶木通的果皮中分离得到11个三萜皂苷,常春藤皂苷元是将皂苷成分水解后得到产物[14]。八月瓜果皮厚实,是提取皂苷元的优良来源。
本实验以通过超声辅助提取的皂苷粉末,进一步水浴水解为常春藤皂苷元的得率为指标,探寻水解常春藤皂苷元的最佳工艺条件,并在最优条件下用高效液相色谱法测定八月瓜果皮中常春藤皂苷元的含量。采用傅立叶红外光谱对常春藤皂苷元主要官能团进行分析,且与常春藤皂苷元标准品进行对照分析;采用核磁共振对常春藤皂苷元结构进行分析,与文献报道中的常春藤皂苷元核磁共振数据进行比较分析。本文将为陕西户县八月瓜基地的八月瓜果皮中常春藤皂苷元的提取、含量测定、以及结构分析提供参考价值。
1 材料与方法
1.1 试剂与仪器
八月瓜果皮,由陕西户县八月瓜基地提供(2019.11);HCl、H3PO4、乙醇、丙酮、正丁醇、氯仿、KBr(分析纯),乙腈、甲醇(色谱纯),国药集团化学试剂有限公司;氘代二甲基亚砜dimethylsulfoxide-d6(D,99.96%)(色谱纯),麦克林;常春藤皂苷元标品,上海源叶生物科技有限公司。
BSA224S电子天平,赛多利斯科学仪器(北京)有限公司;H-H数显恒温水浴锅,国华电器有限公司;R201L旋转蒸发仪,上海申生科技有限公司;DGH-9145A电热鼓风干燥箱,上海—恒科学仪器有限公司;KH-200KDB型高功率数控超声波清洗器,昆山禾创超声仪器有限公司;EClasscial 3100高效液相色谱仪,大连依利特分析仪器有限公司;傅立叶红外光谱仪,德国布鲁克Bruker公司;BrukeravanceⅢ-400MHz核磁共振波谱仪,德国布鲁克Bruker公司。
1.2 方法
1.2.1 皂苷的提取
准确称取5.00g八月瓜果皮粉末,按照料液比1∶15(g∶mL)加入75%乙醇溶液密封浸泡15 h,然后温度68℃,功率160W,超声萃取30 min,过滤收集上清液,将滤渣继续用相同料液比的乙醇溶液萃取,提取2次。合并萃取液减压蒸馏挥干,加入15 mL丙酮超声萃取绿原酸20 min,去掉丙酮萃取液。将未溶于丙酮中提取物加入15 mL蒸馏水剧烈摇动至全溶,用水饱和的正丁醇溶液纯化萃取3次,第1次和第2次用20 mL,第3次15 mL,合并水饱和的正丁醇萃取液浓缩挥干即为皂苷成品[15],收集粉末备待用。
1.2.2 常春藤皂苷元的水解
准确称取0.200 0 g 1.1.1项下提取的皂苷粉末,加入20 mL甲醇,一定体积分数的HCl 5 mL,在一定温度下水浴回流水解,待室温后向其加入10 mL蒸馏水,用氯仿纯化萃取2次,第1次用15 mL,第2次10 mL,然后合并氯仿层,减压蒸干得到常春藤皂苷元成品。
皂苷元得率![]()
(1)
2 结果与分析
2.1 单因素对皂苷元水解的影响
2.1.1 HCl体积对皂苷元水解的影响
按照1.1.2中方法,分别加入HCl体积为5%、10%、15%、20%、25%、30%、36%对皂苷水解,探索HCl体积分数对皂苷元水解的影响。由图1可知,HCl体积分数5%~25%,皂苷元得率呈现迅速递增趋势,而25%~36%呈现缓慢变化,因此皂苷元水解时HCl体积分数为25%为宜。当HCl体积分数过小时,水解不完全;当过大时,由于剧烈条件下苷元结构发生脱水、环合、双键位移等变化,从而使得皂苷元得率降低[16]。
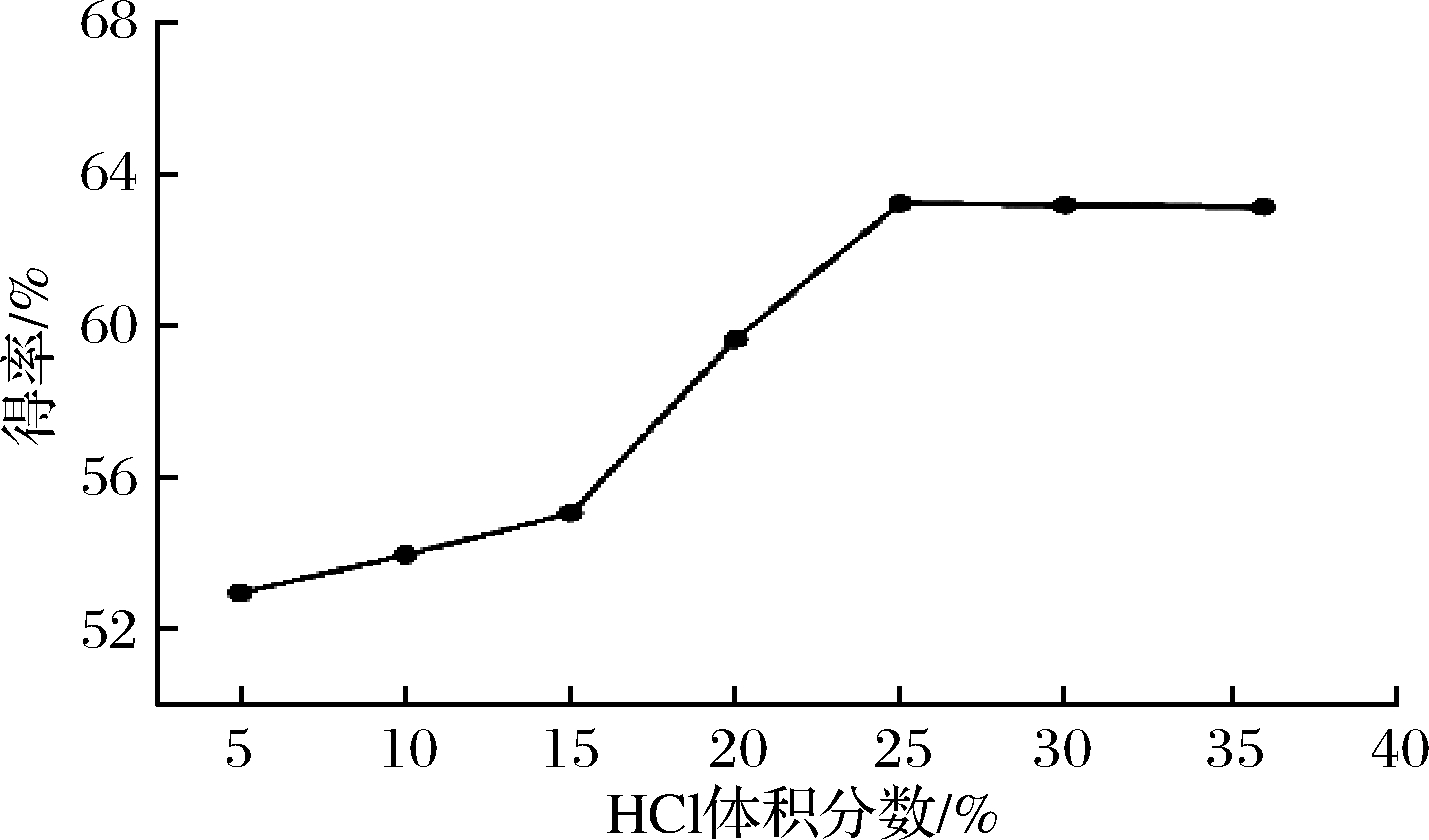
图1 HCl体积分数对常春藤皂苷元水解的影响
Fig.1 The effect of volume fraction of hydrochloric acid on hydrolysis of hederagenin
2.1.2 温度对皂苷元水解的影响
按照1.1.2中方法,加入25%HCl 5mL,分别在60、70、80、90、95 ℃条件下,探索温度对皂苷元水解的影响。由图2可知,温度60~80 ℃时,呈现递增趋势,而80 ℃之后呈现递减趋势,因此温度80 ℃为宜。皂苷元得率随着水解温度的升高而逐渐增大,可能是由于溶剂分子与皂苷分子运动剧烈,扩散增强所致;温度过高,得率降低的原因:(1)温度过高使得乙醇挥发,减少了萃取溶剂,(2)会导致部分苷元结构发生发转变,生成其他物质[17]。
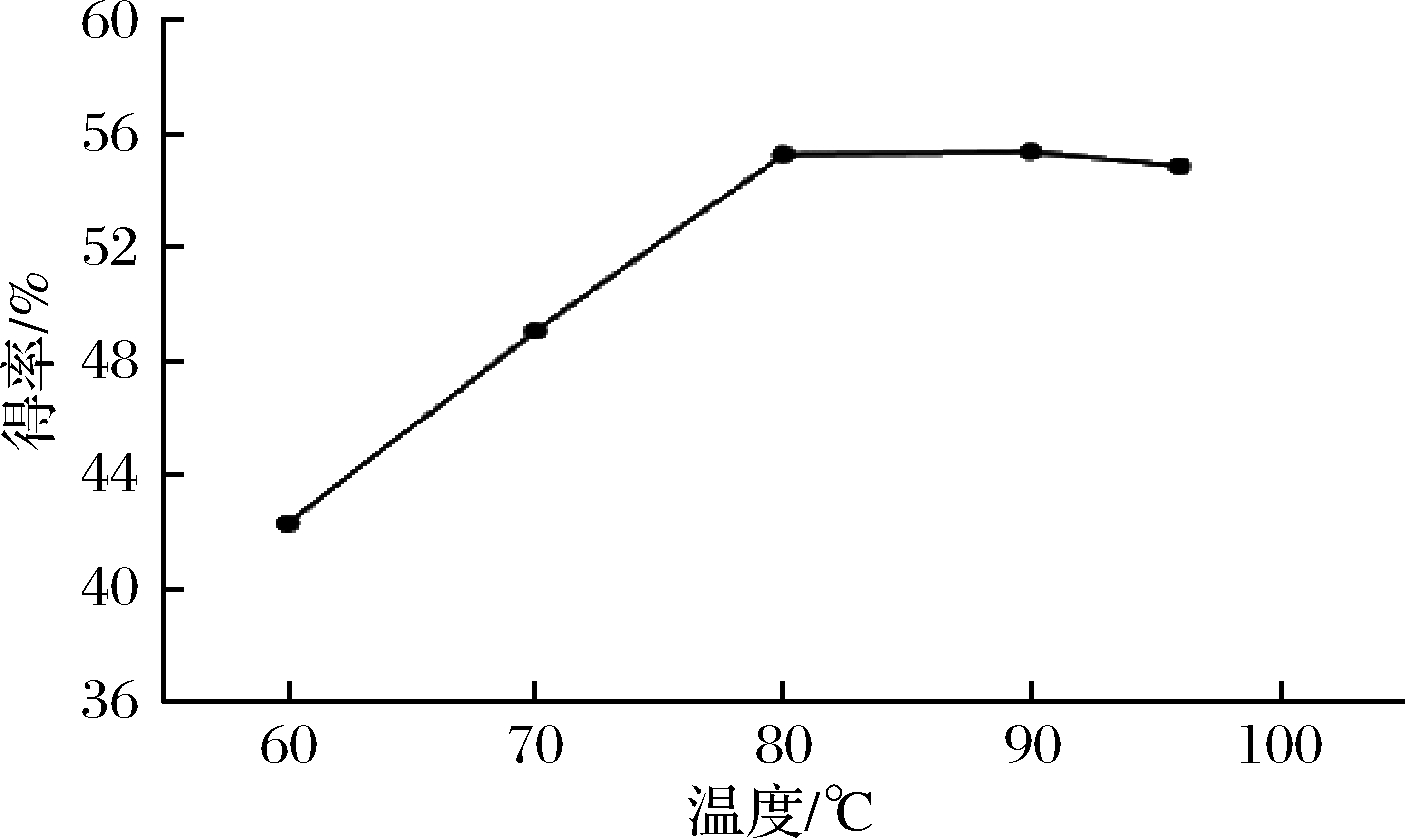
图2 温度对常春藤皂苷元水解的影响
Fig.2 The effect of temperature on hydrolysis of hederagenin
2.1.3 水解时间对皂苷元水解的影响
按照1.1.2中方法,加入25%HCl 5 mL,温度为80℃,分别水解0.5、1、1.5、2、2.5、3、3.5、4 h,探索时间对皂苷元水解的影响。由图3可知,水解时间0.5~3.0 h时,皂苷元水解得率呈现逐渐递增趋势,而3.0~3.5 h时缓慢变化,呈现出持平,3.5 h以后递减,考虑到时间、能量选择3 h为宜。随着水解时间加长,由于产生的热效应,使得率增加,但是水解时间过长,会使得皂苷元结构破坏,导致皂苷元得率降低,或者可能存在副反应的进行,导致皂苷元的生成逐渐减少[18]。
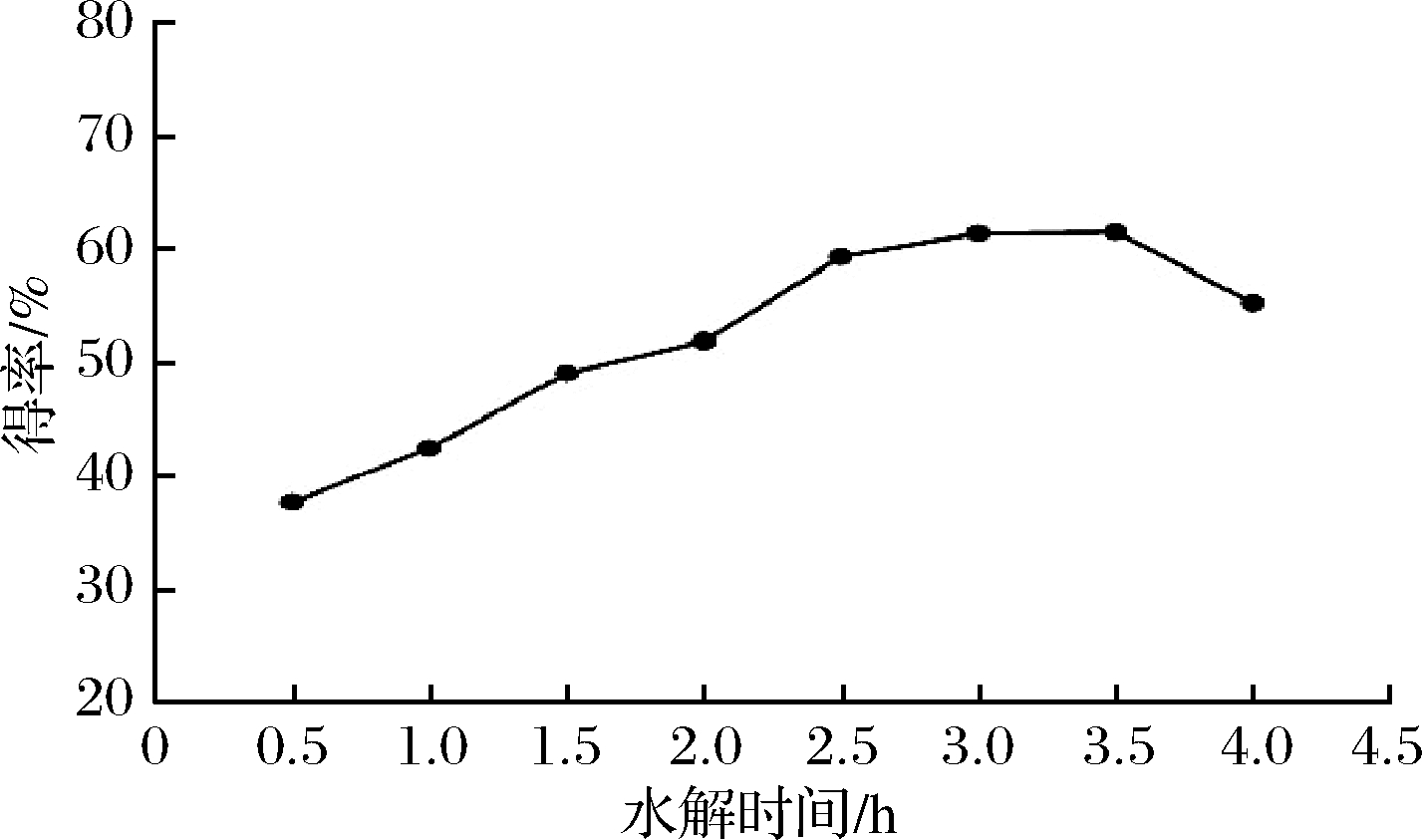
图3 时间对常春藤皂苷元水解的影响
Fig.3 The effect of time on hydrolysis of hederagenin
2.2 响应面优化设计
在单因素实验的基础上,以HCl体积分数,水解温度,水解时间3个因素为考察对象,每个因素选择3个水平,以常春藤皂苷元的得率作为响应值,利用Design-Expert 10.0进行响应面分析,实验因素与水平见表1。
表1 Box-Behnken实验因素与水平
Table 1 Experimental factors and levels of Box-Behnken
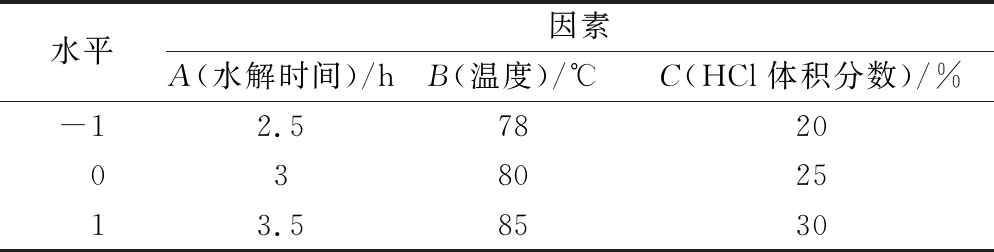
水平因素A(水解时间)/hB(温度)/℃C(HCl体积分数)/%-12.5782003802513.58530
2.3 响应面设计及结果分析
2.3.1 回归模型的建立及数据分析
根据实验过程进行优化实验。根据表1设计实验,结果见表2。
表2 Box-Behnken实验结果
Table 2 Box-Behnken experimental resultsof response surface analysis
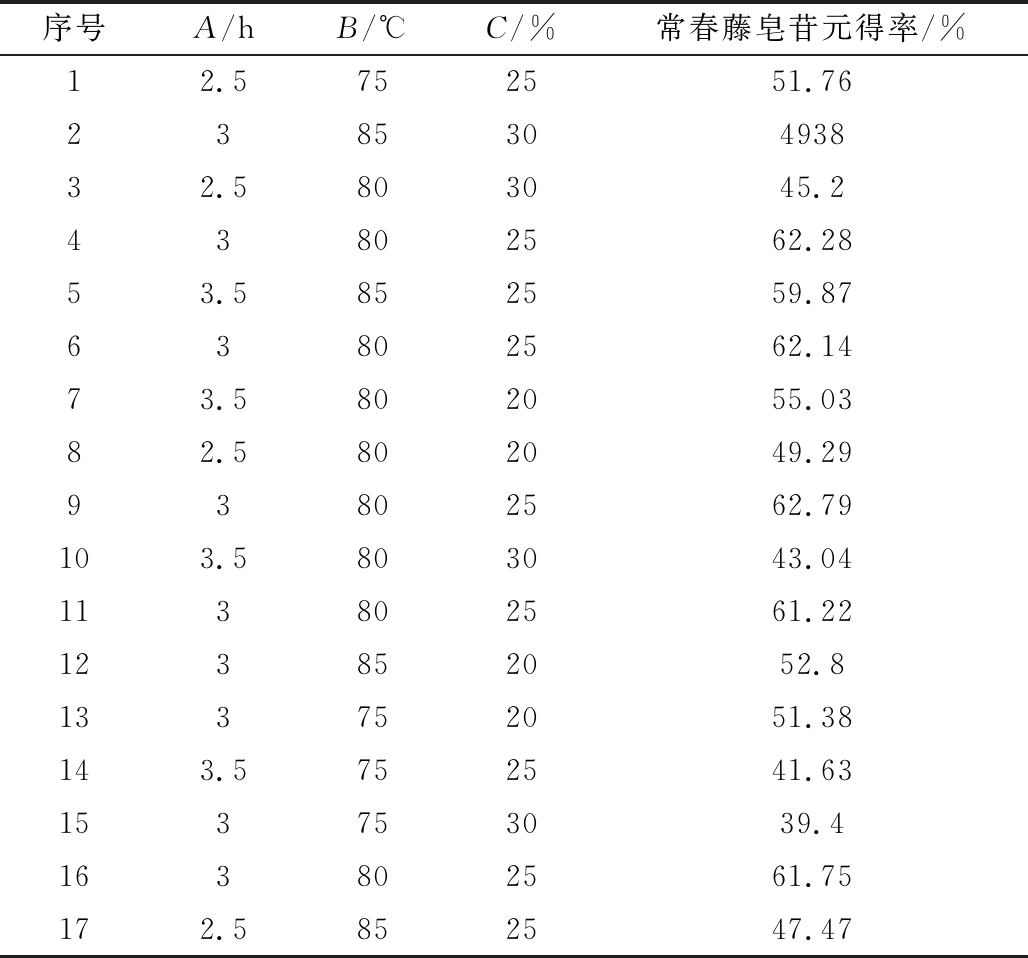
序号A/hB/℃C/%常春藤皂苷元得率/% 12.5752551.76238530493832.5803045.243802562.2853.5852559.8763802562.1473.5802055.0382.5802049.2993802562.79103.5803043.04113802561.22123852052.8133752051.38143.5752541.63153753039.4163802561.75172.5852547.47
各因素回归拟合后,得到常春藤皂苷元水解的回归方程为: Y=62.04+0.73A+3.17B-3.94C+5.63AB-1.98AC+2.14BC-5.98A2-5.88B2-7.92C2,二次回归拟合后的回归方程分析见表3。由表3实验结果进行分析,可知水解时间、水解温度和HCl体积分数3个因素对常春藤皂苷元的水解均为显著影响因子,其中水解温度和盐酸体积分数为极显著。该模型F=312.07,P=0.000 1(P<0.05),表明模型极显著,而失拟项的F=0.465 2,P>0.05失拟不显著,校正决定系数R2=0.994 3,说明模型拟合程度良好,且误差小。
表3 响应面实验结果
Table 3 The results of response surface methodology
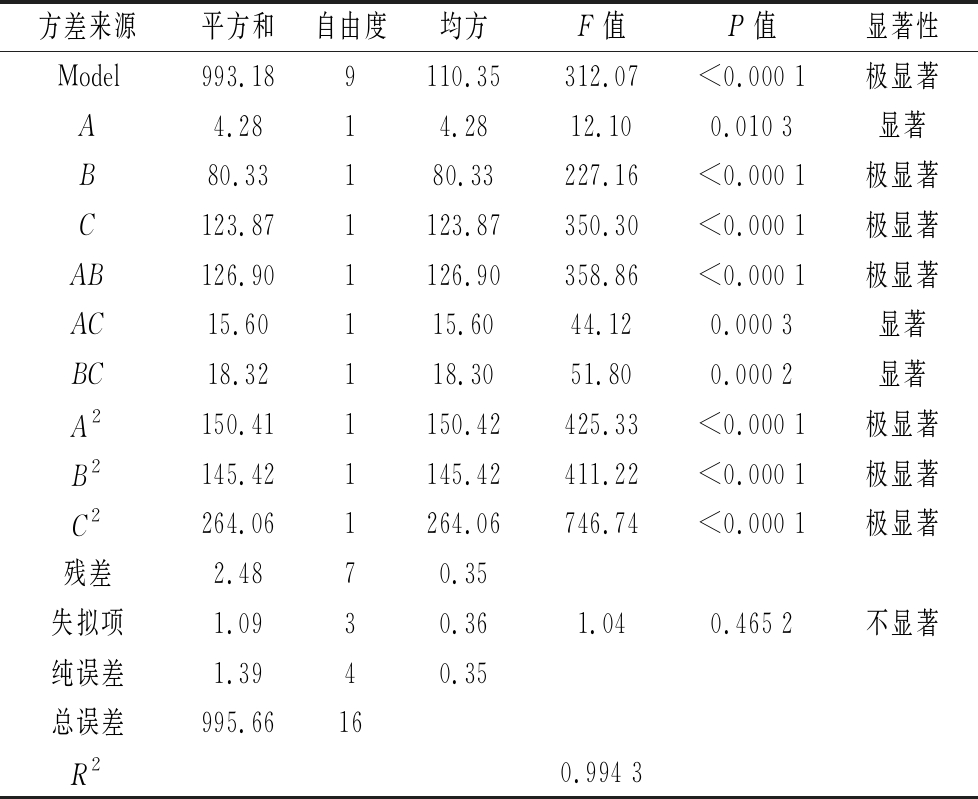
方差来源平方和自由度均方F值P值显著性Model993.189110.35312.07<0.000 1极显著A4.2814.2812.100.010 3显著B80.33180.33227.16<0.000 1极显著C123.871123.87350.30<0.000 1极显著AB126.901126.90358.86<0.000 1极显著AC15.60115.6044.120.000 3显著BC18.32118.3051.800.000 2显著A2150.411150.42425.33<0.000 1极显著B2145.421145.42411.22<0.000 1极显著C2264.061264.06746.74<0.000 1极显著残差2.4870.35失拟项1.0930.361.040.465 2不显著纯误差1.3940.35总误差995.6616R20.994 3
注:P<0.01差异极显著;P<0.05差异显著。
2.3.2 响应面分析
图4为根据回归结果绘制的各因素关于常春藤皂苷元水解响应曲面图和等高线图,考察拟合响应面的形状,分析各因素对皂苷水解得率的影响。图a中三维响应面的形状都与抛物线图形相似,说明皂苷元水解得率的最大值出现在中间点处,此模型存在最大值的稳定点。图b等高线中圆心都存在且位于其椭圆内部,交互作用显著,且A和B等高线图形状更趋近与椭圆,交互作用极显著。
2.3.3 响应面条件优化及验证试验
通过软件分析,常春藤皂苷元水解的最佳工艺条件为水解时间3.133 h、温度81.772℃、HCl体积分数23.828%。在此条件下,八月果果皮中提取到的皂苷元水解得率预测值可达63.156%。为了试验方便操作,将工艺条件进行修正为水解时间3.2 h、温度82℃、HCl体积分数24%。在此条件下验证皂苷元水解试验,得率均值为61.423%,与预测值 63.156%相近,说明响应面优化皂苷元水解的工艺条件可行。
2.4 常春藤皂苷元含量测定
2.4.1 色谱条件
色谱柱: Hypersil ODS C18色谱;检测器:DAD3100二极管阵列检测器;柱温:27℃;流动相:乙腈-0.1%磷酸水溶液(体积比20∶80);流速:1 mL/min,进样量:20 μL。在此条件下对常春藤皂苷元对照品溶液和样品溶液进行测定。在此色谱条件下分析常春藤皂苷元对照品和样品,由图5常春藤皂苷元标品的保留时间为22.71 min,图6八月瓜果皮中常春藤皂苷元样品保留时间为22.55 min,因此标品与样品得到保留时间基本一致。
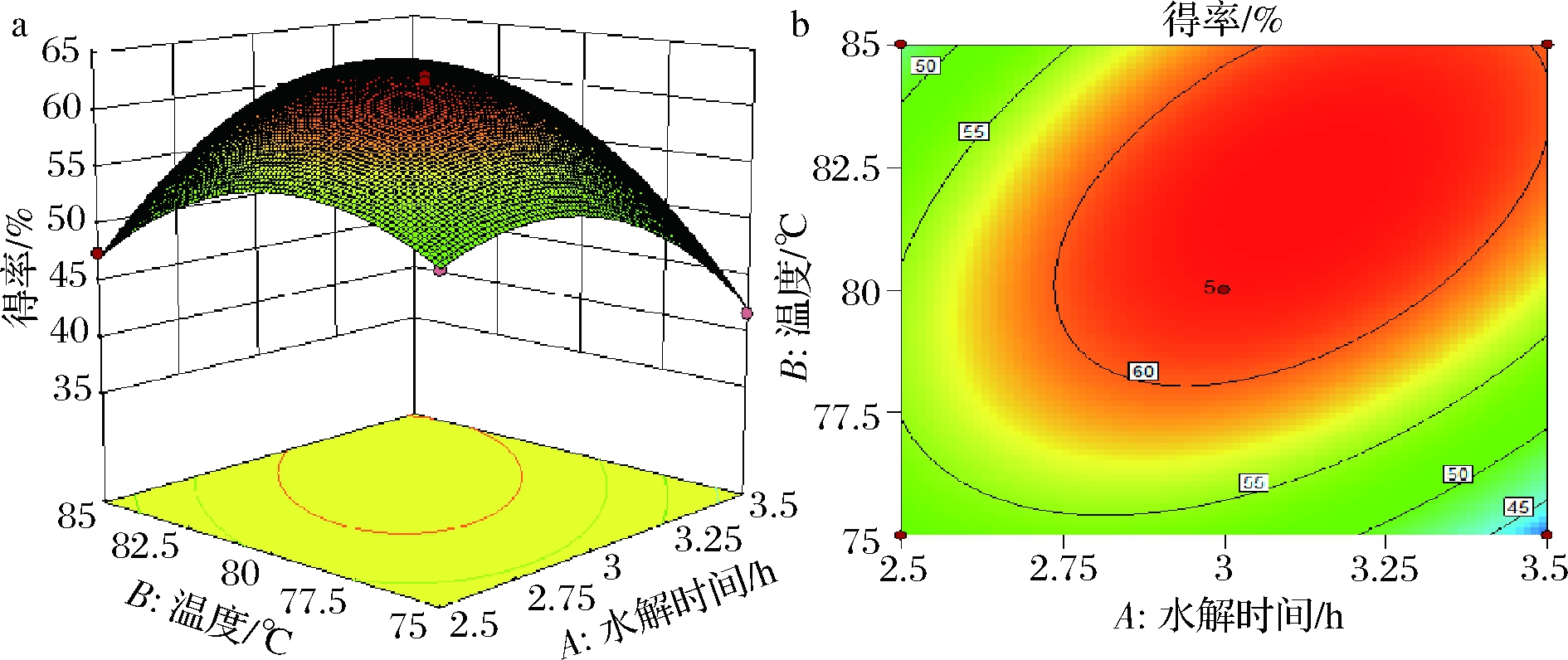

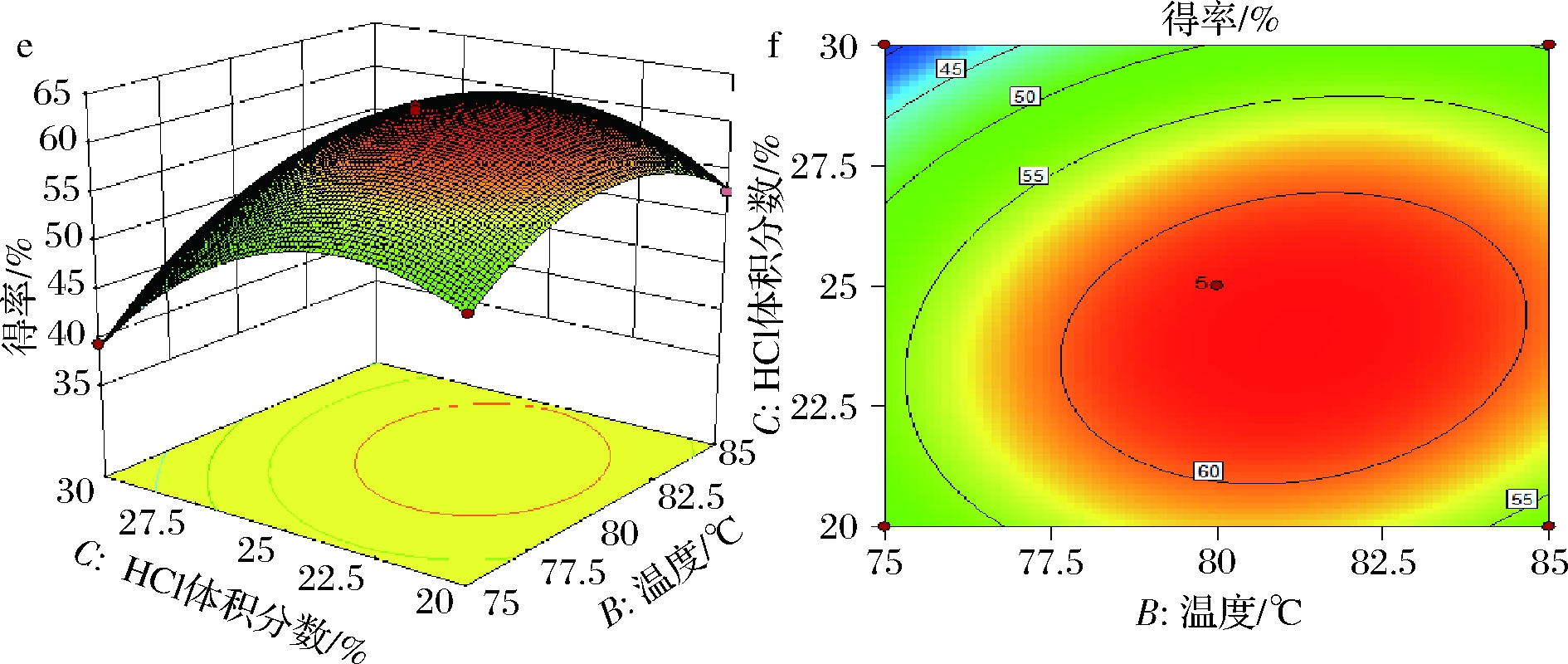
a、b-水解时间和温度交互作用;c、d-水解时间和盐酸体积交互作用;e、f-温度和HCl体积分数交互作用
图4 水解时间、温度、HCl体积分数对常春藤皂苷元得率的响应面与等高线图
Fig.4 Response surface and contour map of hydrolysis time, temperature and hydrochloric acid volume fraction to the yield of hederagenin
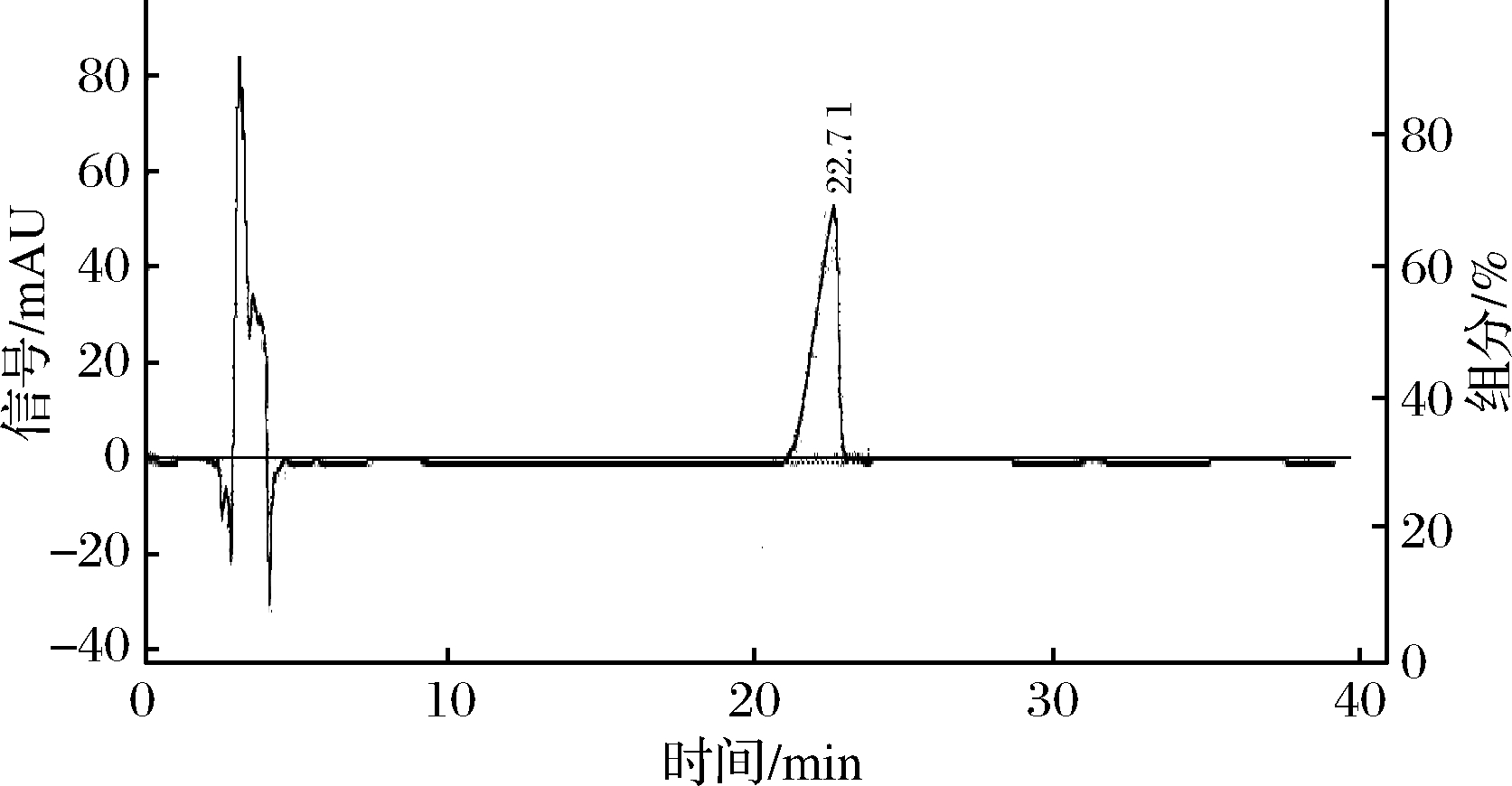
图5 常春藤皂苷元标品的HPLC谱图
Fig.5 HPLC chromatogram of hederagenin

图6 八月瓜果皮中常春藤皂苷元HPLC谱图
Fig.6 HPLC chromatogram of hederagenin from Akebia trifoliata pericarp
2.4.2 对照品溶液的配制
精确称取常春藤皂苷元标准品10.00 mg,用V(甲醇)∶V(二氧甲烷)=5∶1溶解,然后定容于10 mL容量瓶,配成质量浓度为1 mg/mL常春藤皂苷元对照品溶液。
2.4.3 供试品溶液的配制
将2.3.3项下最优条件下水解得到常春藤皂苷元,用色谱甲醇溶解并定容于10 mL容量瓶。
2.4.4 线性关系的考察
精密移取常春藤皂苷元标准品溶液1.6,1.2,0.4,0.2和2 mL的容量瓶中,用色谱甲醇稀释至刻度,得到成质量浓度分别为800、600、200、100 μg/mL的系列标准溶液,在上述色谱条件下测定,以对照品浓度(X)为横坐标,峰面积(Y)为纵坐标进行线性回归,计算得回归方程为:Y=2 866.81X-60.451 6,R2=0.999 7,常春藤皂苷元浓度在0.1~1 mg/mL线性关系良好。
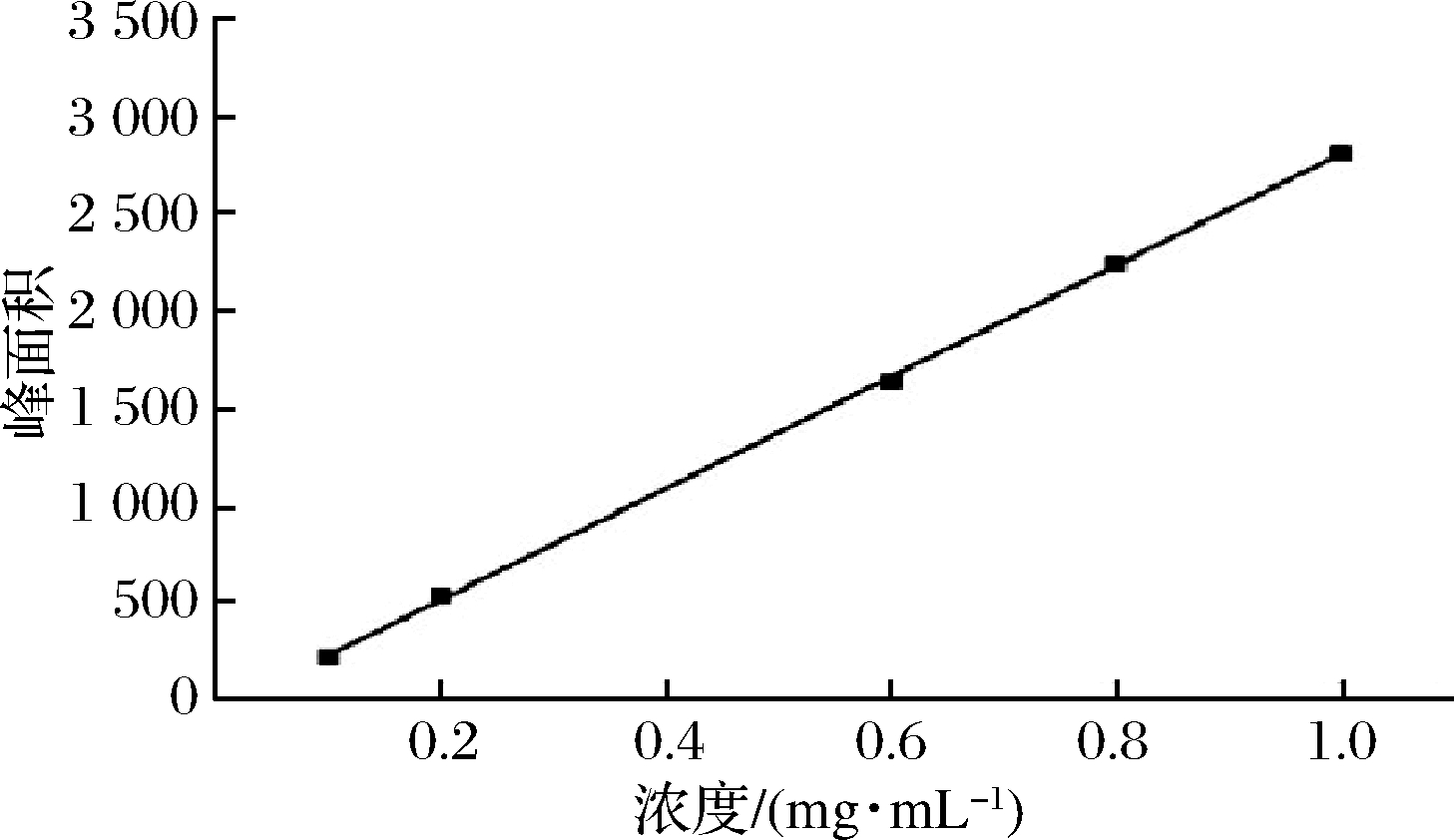
图7 常春藤皂苷元的标准曲线
Fig.7 The standard curve of hederagenin
2.4.5 精密度试验
精密吸取质量浓度为1 mg/mL的对照品溶液20 μL,按上述色谱条件连续进样6次,记录其峰面积,常春藤皂苷元峰面积的RSD=0.73%(n=6),表明仪器精密度良好。
表4 精密度试验
Table 4 The precision experiment
序号123456RSD/%峰面积2 832.6112 812.9842 796.7442 839.2992 791.2012 793.7980.73
2.4.6 重复性试验
取已提取的皂苷粉末6份进行水解,采用2.4.3项下方法制备供试品溶液,分别置在上述色谱条件测定,记录峰面积,计算含量。结果如表5所示,由表5可以看出,RSD=1.6%,表明此方法重现性良好。
表5 重复性试验
Table 5 The repetitive experiment
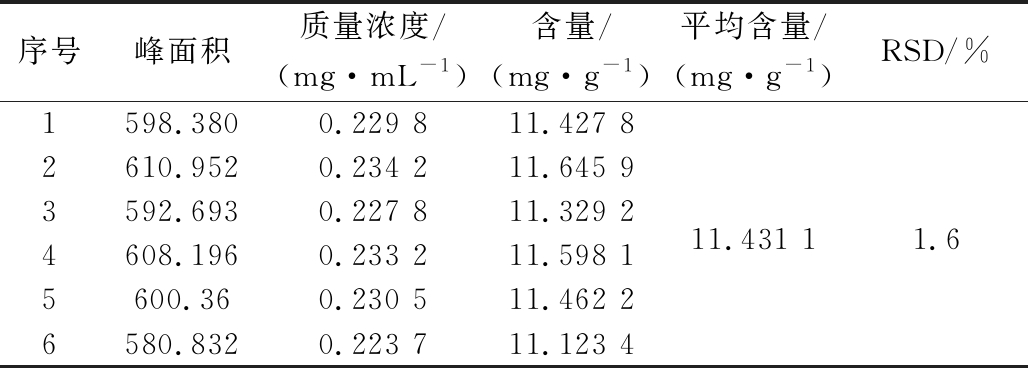
序号峰面积质量浓度/(mg·mL-1)含量/(mg·g-1)平均含量/(mg·g-1)RSD/%1598.3800.229 811.427 82610.9520.234 211.645 93592.6930.227 811.329 211.431 11.64608.1960.233 211.598 15600.360.230 511.462 26580.8320.223 711.123 4
2.4.7 稳定性试验
取同一样品溶液,每隔2 h 进样20 μL,在上述色谱条件下测定6次,记录其峰面积,计算得RSD=2.4%,所测得的RSD小于3%,说明供试品溶液在11 h内是稳定的,具体数据见表6。
表6 稳定性试验
Table 6 The stability experiment
时间/h1357911RSD/%峰面积582.966568.723609.996577.585590.236575.362.4
2.4.8 加样回收率试验
精密称取已知含量的八月瓜皂苷粉末0.2 g,共6份,分别精密加入常春藤皂苷元对照品0.6 mL(浓度为1.00 mg/mL),按照实验方法制备,按上述色谱条件进行测定,并计算常春藤皂苷元的回收率,结果见表7,从表7中可以看出,加标回收率为97.06%,相对标准偏差为1.73%,表明所建立的方法能够满足实际样品的分析要求。
表7 回收率实验
Table 7 The recovery rate experiment
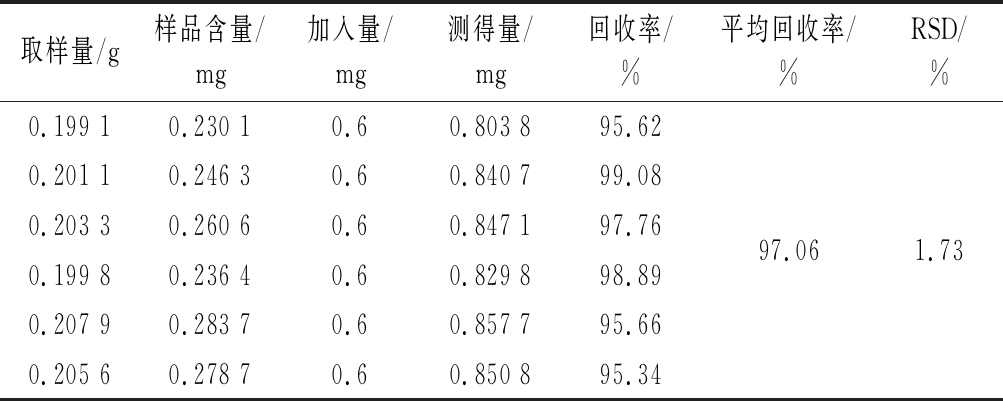
取样量/g样品含量/mg加入量/mg测得量/mg回收率/%平均回收率/%RSD/%0.199 10.230 10.60.803 895.620.201 10.246 30.60.840 799.080.203 30.260 60.60.847 197.7697.061.730.199 80.236 40.60.829 898.890.207 90.283 70.60.857 795.660.205 60.278 70.60.850 895.34
2.4.9 样品含量测定
取从八月瓜果皮中提取的皂苷粉末0.191 1g,按1.2.1的方法进行水解,按2.4.3方法配制供试品溶液进行测定,平行试验3次,结果表明,八月瓜果皮中常春藤皂苷元的含量为11.559 0、11.516 5、11.594 8 mg/g,所以八月瓜果皮中常春藤皂苷元含量为(11.556 75±0.039 221) mg/g。
2.5 核磁共振分析
由图8可知,在低场处δ12.07(1H,s,COOH)为羧基上的的氢信号,δ5.18(1H,brs,H-12)为12位上烯基上的氢信号,δ4.32(1H,s,-OH)为羟基上的氢信号,δ3.24(1H,m,H-3)是连接羟基碳上的氢信号,δ1.24(3H,s,H-27)为27位甲基上的氢信号,δ1.10(3H,s,H-30)为30位上甲基上的氢信号,δ0.88(3H,s,H-26)是26位甲基上的氢信号,δ0.71(3H,s,H-26)为26位甲基上的氢信号,δ0.54(3H,s,H-23)为23位甲基上的氢信号。
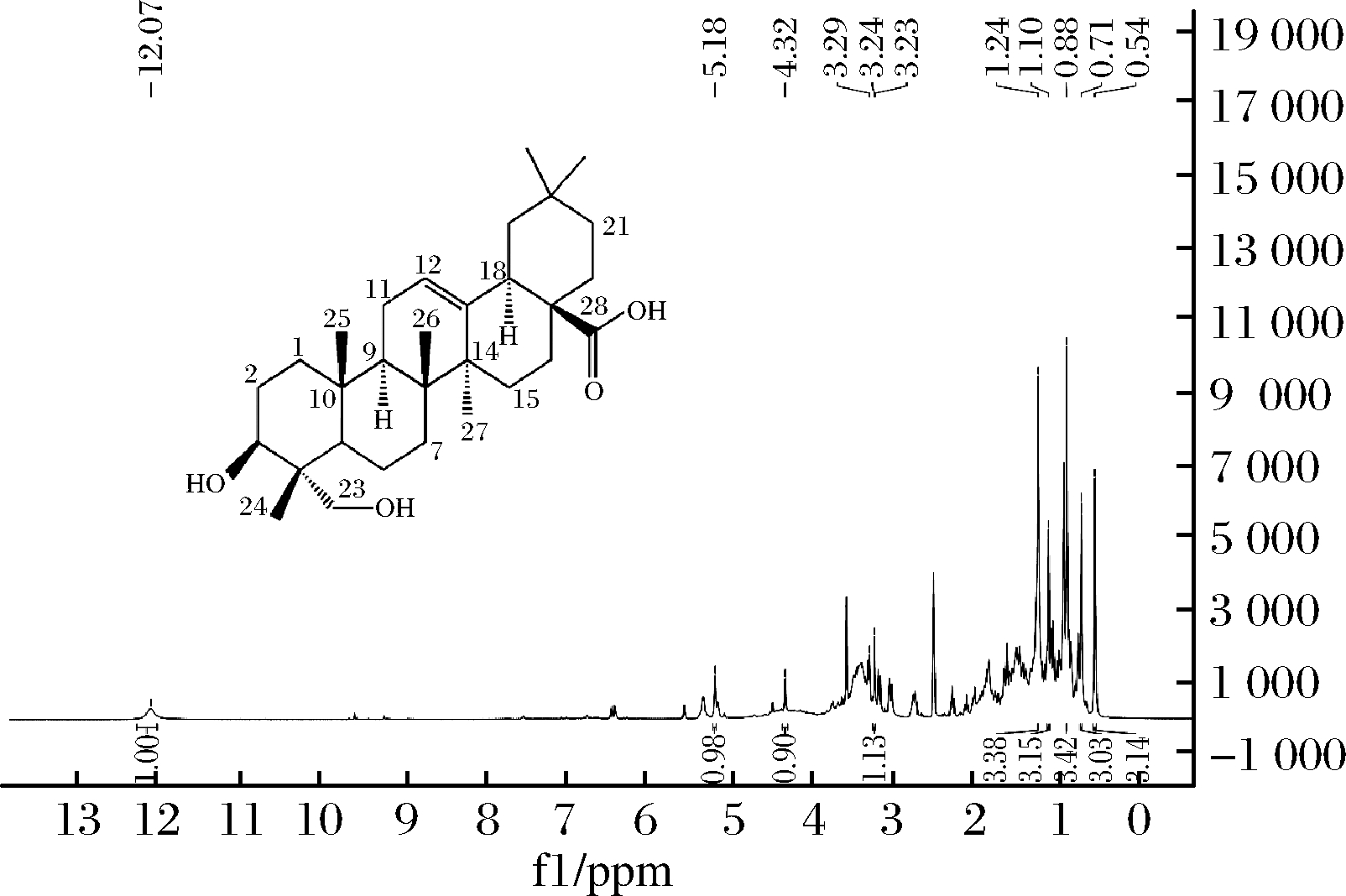
图8 常春藤皂苷元的核磁共振HNMR谱
Fig.8 Nuclear magnetic resonance HNMR spectrum of hederagenin
由图9可知,在碳谱的低场处δ179.07(C-28)是羧基上的碳信号,δ121.95(C-12)和δ144.38(C-13)分别是12位、13位双键上的碳信号,δ75.92(C-3)是连接—OH上的—CH的碳信号,δ64.30(C-23)是连接—OH上的—CH2的碳信号。在碳谱的高场区δ14.19(C-24)、δ15.02(C-25)、δ17.22(C-26)、δ26.50(C-27)、δ33.30(C-29)、δ23.03(C-30)是6个-CH3的碳信号。以及其他的饱和碳信号δ38.95(C-1)、δ27.07(C-2)、δ42.96(C-4)、δ46.42(C-5)、δ17.36(C-6)、δ31.78(C-7)、δ40.82(C-8)δ47.51(C-9)、δ37.83(C-10)、δ22.58(C-11)、δ41.83(C-14)、δ27.62(C-15)、δ26.9(C-16)、δ46.11(C-17)、δ41.24(C-18)、δ45.89(C-19)、δ30.09(C-20)、δ33.71(C-21)、δ32.13(C-22)。
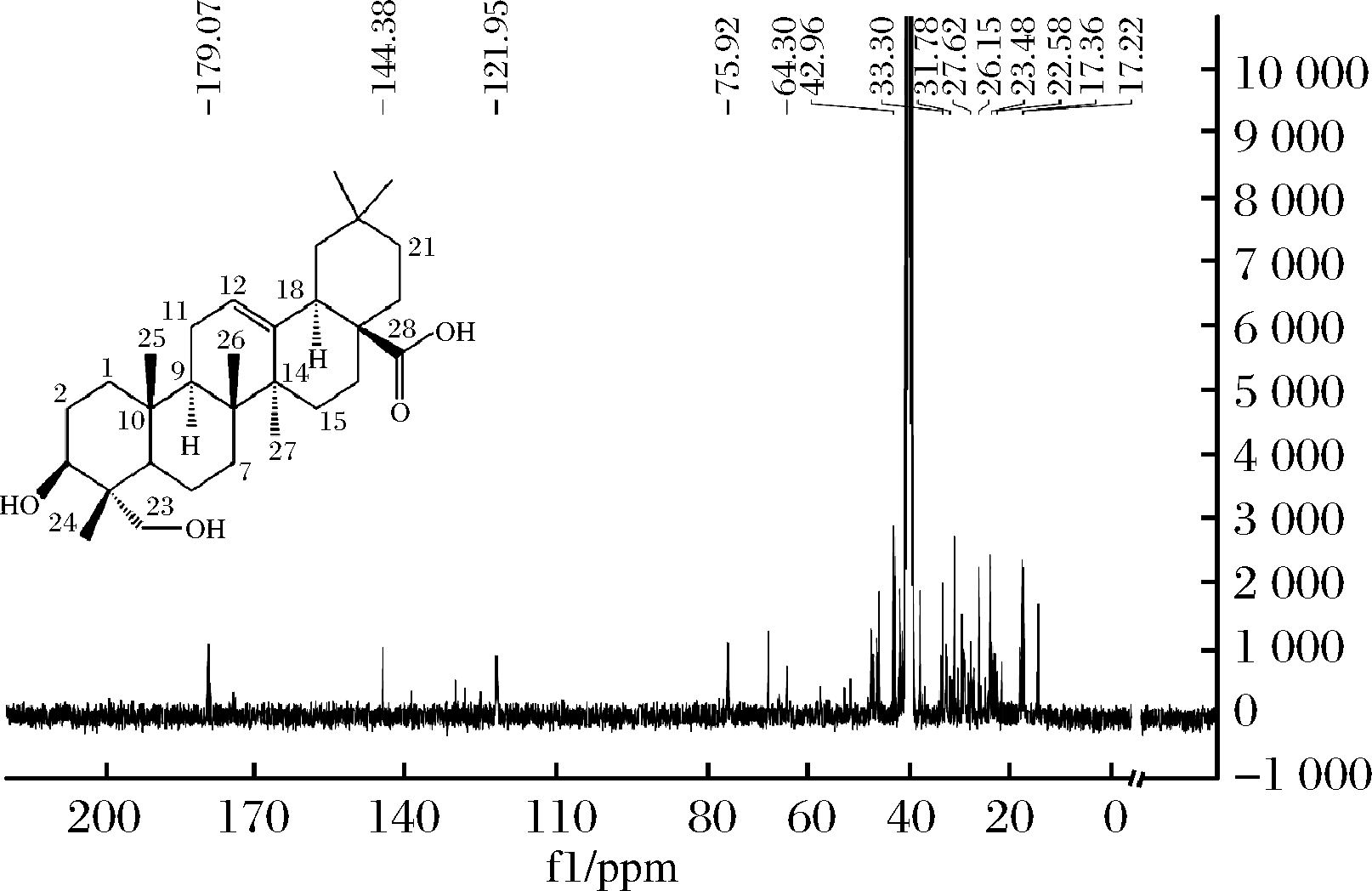
图9 常春藤皂苷元的核磁共振13CNMR谱
Fig.9 Nuclear magnetic resonance 13C NMR spectrum of hederagenin
综上所述,所提取的化合物与文献[4,19-20]所报道的常春藤皂苷元核磁数据基本一致,其核磁1HNMR13CNMR数据与文献报道比较见表8。
2.6 傅立叶红外光谱分析
由图10常春藤皂苷元标准品和样品的红外光谱可以看出,皂苷元所特有的5个主要特征吸收峰3 442、2 943、1 693、1 461、1 043 cm-1。3 442 cm-1左右为—OH的伸缩振动,可能是常春藤皂苷元标准品与样品提取及纯化的方法不同,使得样品的峰强度较弱[21]。2 943 cm-1左右为C—H伸缩振动,1 693 cm-1左右为环内双键C![]() C伸缩振动,1 461 cm-1左右为6个甲基的C—H弯曲振动,1 043 cm-1为C—O键的伸缩振动,943 cm-1吸收峰是OH…O的面外变形振动。与常春藤皂苷元标准品的红外光谱比较,常春藤皂苷元的官能团基本都吻合。
C伸缩振动,1 461 cm-1左右为6个甲基的C—H弯曲振动,1 043 cm-1为C—O键的伸缩振动,943 cm-1吸收峰是OH…O的面外变形振动。与常春藤皂苷元标准品的红外光谱比较,常春藤皂苷元的官能团基本都吻合。
表8 常春藤皂苷元的核磁共振数据
Table 8 The NMR spectral data of hederagenin
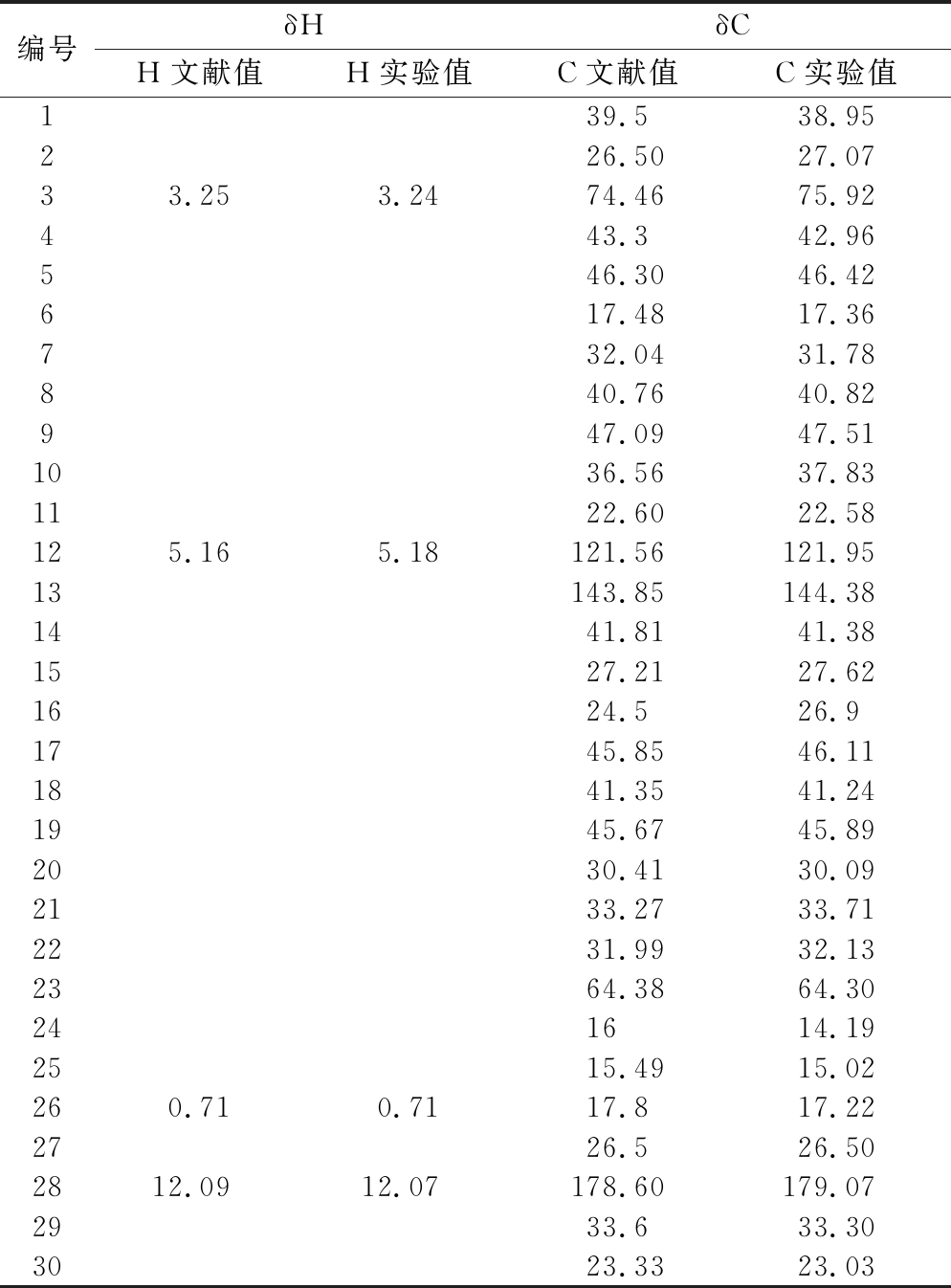
编号δHδCH文献值H实验值C文献值C实验值139.538.95226.5027.0733.253.2474.4675.92443.342.96546.3046.42617.4817.36732.0431.78840.7640.82947.0947.511036.5637.831122.6022.58125.165.18121.56121.9513143.85144.381441.8141.381527.2127.621624.526.91745.8546.111841.3541.241945.6745.892030.4130.092133.2733.712231.9932.132364.3864.30241614.192515.4915.02260.710.7117.817.222726.526.502812.0912.07178.60179.072933.633.303023.3323.03
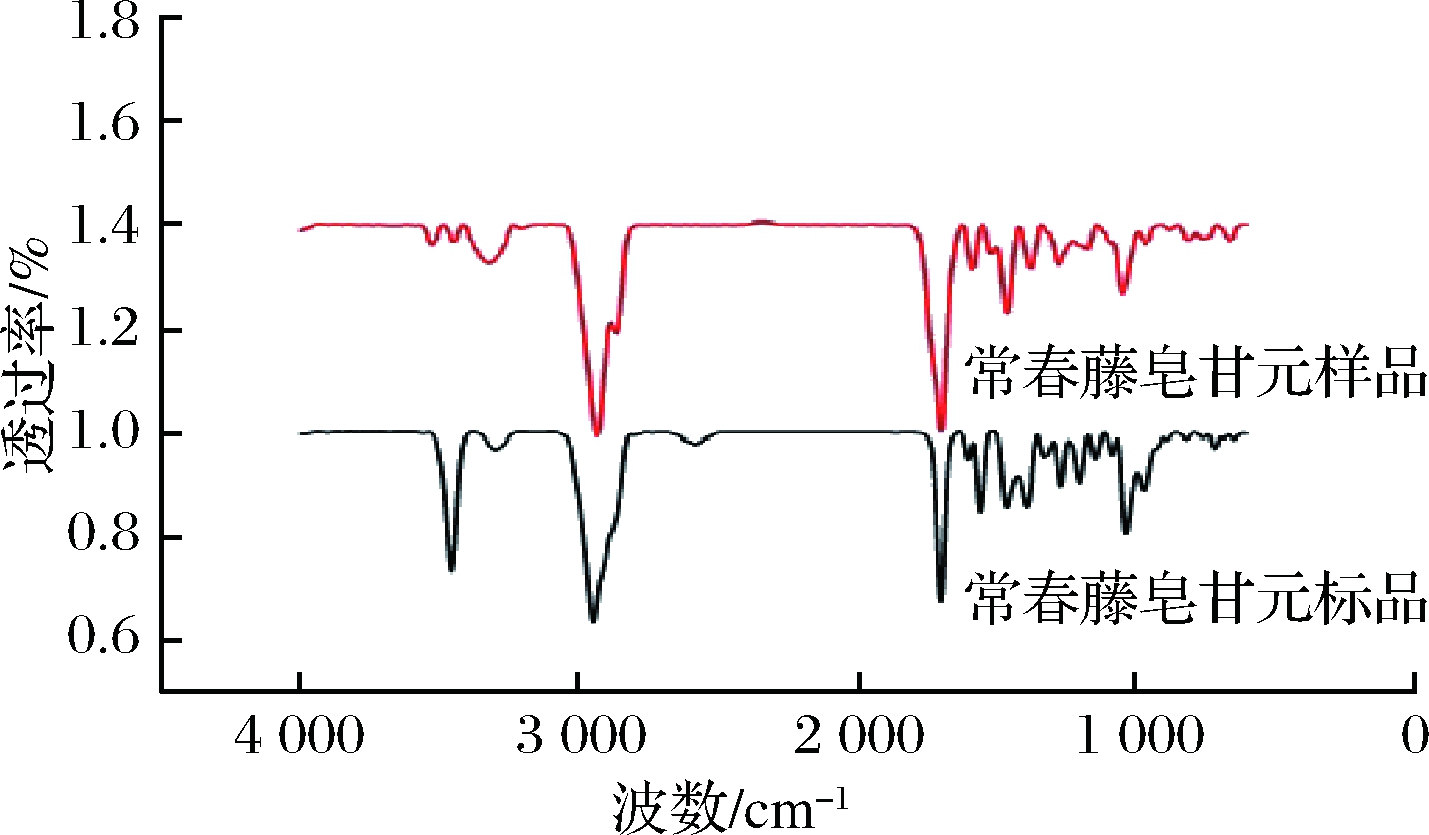
图10 常春藤皂苷元的红外光谱
Fig.10 Infrared spectra of hederagenin
3 结论
本实验以通过超声辅助提取的皂苷粉末,进一步水浴水解为常春藤皂苷元的得率为指标,探索了HCl体积、水解时间、温度各影响因素,并根据单因素试验结果设计了响应面实验,确定了水解常春藤皂苷元的最佳工艺条件,并在最优条件下建立八月瓜果皮中常春藤皂苷元的含量测定方法,高于文献汇报的陕西常春藤皂苷元含量5.26 mg/g。采用傅立叶红外光谱对常春藤皂苷元主要官能团进行分析;采用核磁共振对常春藤皂苷元结构进行分析,与文献报道中的常春藤皂苷元核磁共振数据基本一致[4,19-20]。其主要结论如下:
(1)通过单因素与响应面分析来优化水解条件。探讨了HCl体积分数、温度和水解时间对常春藤皂苷元得率的影响。得到最佳的水解条件:水解时间3.2 h、温度82℃、HCl体积分数24%,在该条件下常春藤皂苷元得率为61.423%,常春藤皂苷元水解得率高,接近预期结果。
(2)以乙腈-0.1%磷酸(体积比20∶80)溶液为流动相,检测波长为210 nm,建立了高效液相色谱法测定八月瓜果皮中常春藤皂苷元的方法。结果表明,常春藤皂苷元在0.1~1 mg/mL具有线性关系,回归方程:Y=2 866.81X-60.451 6,R2=0.999 7。精密度试验RSD 为0.73%,稳定性试验RSD为2.4%,重复性试验RSD 为1.6%,加标回收率为97.0%,其RSD为1.73%。样品中常春藤皂苷元含量为(11.556 75±0.039 221)mg/g,此方法操作准确、可靠,可以作为常春藤皂苷元含量测定的方法。
(3)采用傅立叶红外光谱对常春藤皂苷元主要官能团分析,皂苷元特有的5个主要特征吸收峰3 442、2 943、1 693、1 461、1 043 cm-1都存在,且与常春藤皂苷元标准品的官能团基本吻合。
(4)采用核磁共振对常春藤皂苷元结构进行分析,常春藤皂苷元的核磁共振数据与报道中的基本一致。
[1] 邢颖, 南敏伦, 王雪, 等. 常春藤皂苷元的研究进展[J]. 中国实验方剂学杂志, 2017(22):234-242.
[2] 马晓琳, 李畏娴, 王冬, 等. 常春藤皂苷元生物合成解析及酵母细胞工厂的构建[J]. 中国中药杂志, 2018,43(9):1 844-1 850.
[3] 蒋丹. 预知子化学成分及其生物活性研究[D]. 长春:东北师范大学, 2006.
[4] 郭林新. 三叶木通化学成分及生物活性研究[D]. 西安:陕西科技大学, 2017.
[5] 李敬芝, 张春凤, 杨中林, 等. HPLC法测定续断药材中常春藤皂苷元的含量[J]. 中医药学报, 2011(6):62-64.
[6] JIANG Y, DU Y, ZHU X, et al. Physicochemical and comparative properties of pectins extracted from Akebiat rifoliata, var. australis, peel[J]. Carbohydrate Polymers, 2012, 87(2):1 663-1 669.
[7] ZOU S, YAO X, ZHONG C, et al. Genetic analysis of fruit traits and selection of superior clonal lines in Akebia trifoliate, (Lardizabalaceae)[J]. Euphytica, 2018, 214(7):111.
[8] XU Q L, WANG J, DONG L M, et al. Two new pentacyclic triterpene saponins from the leaves of akebiatrifoliata[J]. Molecules, 2016, 21(7):962.
[9] 顾仁勇, 杨万根, 余佶. 响应面优化超临界CO2萃取八月瓜幼果多酚工艺[J]. 食品科学, 2015, 36(10):76-80.
[10] 李加兴, 吴萍, 吴越,等. 八月瓜果皮果胶提取工艺优化及其理化特性研究[J]. 食品工业科技, 2016, 37(1):275-277.
[11] WANG J, REN H, XU Q L, et al. Antibacterial oleanane-type triterpenoids from pericarps of Akebia trifoliata[J]. Food Chemistry, 2015, 168:623-629.
[12] 成晓霞, 孙蓉蓉, 欧阳浩楠, 等. 三叶木通中常春藤皂苷的提取工艺[J]. 安徽农业科学, 2008, 36(16):6 792-6 794.
[13] IWANAGA S,WARAASHINA T,MIYASE T. Triterpene saponinsfrom the pericarps of Akebia trifoliata[J].Chemical & Pharmaceutical Bulletin, 2012, 60(10): 1 264-1 274.
[14] 石慧慧, 吴凡, 华俊磊, 等. 预知子不同部位中常春藤皂苷元含量的比较[J]. 中国现代应用药学, 2014, 31(11):1 344-1 347.
[15] 成晓霞. 三叶木通有效成分含量测定及指纹图谱研究[D]. 西安:陕西师范大学, 2008.
[16] 郭秀洁, 朱靖博, 郑敏,等. 黄姜总皂苷的提取及其水解条件[J]. 大连工业大学学报, 2010, 29(3):161-164.
[17] 杨新河, 吕帮玉, 毛清黎. 盐酸水解法提取苦丁茶皂苷元的工艺[J]. 贵阳中医学院学报, 2013,31(1):264-268.
[18] 代良敏, 熊永爱, 范奎, 等. 酸水解地榆总皂苷制备地榆皂苷元的工艺优选[J]. 中草药, 2016, 47(14):2 454-2 459.
[19] 石钰. 美丽芍药化学成分及其生物活性研究[D]. 西安:陕西科技大学, 2015.
[20] 欧莹宝,魏明杰,李贺然. 黄背栎化学成分的研究[J]. 中草药, 2013, 44(14):1 872-1 876.
[21] 张黎明, 王亮亮, 高文远. 黄姜总皂苷不同提取物的FTIR谱图特征分析[J]. 中草药, 2009(9):1 413-1 416.