甘薯又称番薯、红薯、红苕等,在我国至今已有400多年的种植历史[1]。世界粮农组织显示,2017年我国甘薯种植面积约为3.37×104 km2,约占世界甘薯种植面积的36.5%;产量为7.2×107 t,约占世界总产量的63.6%。甘薯是重要的粮、菜、饲兼用作物,营养丰富,含有丰富的膳食纤维、糖类、维生素和矿物质,有提高免疫力、预防骨质疏松、防癌抗癌、防止动脉硬化等作用[2],是营养均衡的保健食品。随着居民生活水平的提高和营养健康意识的增加,甘薯用于营养食品、工业原料、饲料及医药的比例不断增加。
甘薯在鲜切或加工过程中受到机械伤害后,伤口处极易发生褐变,进而导致营养及加工价值降低。鲜切甘薯的褐变主要是由甘薯中的多酚氧化酶(polyphenol oxidase,PPO)催化绿原酸引起的[3]。PPO是广泛存在于植物体中的一种含铜金属酶类,在食品生产加工过程中极易催化多酚类物质氧化生成黑色素,是甘薯育种、贮藏、保鲜及深加工过程中重点关注与检测的对象。PPO活力检测常用的方法是消光值法[4],测定前需要在低温条件下(4 ℃)提取粗酶液、离心并绘制标准曲线,操作繁琐、费时费力,不能满足大样本容量检测需求。因此,建立一种快速便捷的甘薯PPO活力快速检测方法意义重大。
数字图像比色法(digital image colorimetry)是一种便捷的新型检测技术,主要是利用朗伯-比尔定律,即有色溶液的颜色深度(色度)与溶液浓度成正比,将数字图像与化学显色检验结合起来的定性定量分析方法[5]。目前,数字图像比色法已应用于生物医学[6-8]、化学[9-10]、农业及环境[11-15]等多个领域中。在食品工业中,数字图像比色可用于食品成分分析[16-17]、品质检测[18-19]、食品掺假[20]、酶活检测[21]及食品安全监控[22-24]。智能手机可以摄录一段时间内食品的颜色变化,利用数字图像比色法分析被测样品颜色的变化规律,从而对食品品质进行快速分析。有研究表明,甘薯块根颜色与甘薯图像的RGB值有相关性[25],但基于数字图像比色法的甘薯PPO活力快速检测方法研究尚未见报道。本实验以不同品系的甘薯为研究对象,通过提取甘薯切片在一定时间内的图像信息,建立甘薯PPO活力的快速检测模型,以期为甘薯品质分析、种质筛选及企业生产提供参考。
1 材料与方法
1.1 材料与试剂
甘薯由重庆市甘薯工程技术研究中心提供,选取大小一致、表面光滑、无病虫害的不同品系甘薯,共计90份样品。将甘薯表面泥土清洗干净,室温下晾干表面水分并编号,储存于(15±2)℃备用。
Na2HPO4、NaH2PO4、冰乙酸、无水乙酸钠(分析纯),成都市科龙化工试剂厂;交联聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidone, PVPP),北京拜尔迪生物技术有限公司;儿茶酚(化学纯),中国医药集团上海化学试剂公司。
1.2 仪器与设备
5810 R冷冻离心机,德国Eppendorf公司;AQ-180E粉碎机,慈溪市耐欧电器有限公司;iPhone 6s智能手机,美国苹果公司;UV-2450紫外可见分光光度计,日本岛津公司。
拍照装置:自制正方体木箱,箱内背景为黑色毛毡,顶部开5 mm圆孔用于手机拍照,采用25 W白色日光灯作为光源(图1)。
图1 拍照装置图
Fig.1 Photo device
1.3 实验方法
1.3.1 甘薯切片图像信息采集
甘薯样品从中心横向一切两半,一半用于甘薯PPO活力测定,另一半进行切片,切片厚度约2 mm,用于手机拍照及图像信息(RGB值)采集。将甘薯切片后立即放入拍照装置中,采用手机摄像功能记录甘薯切片的褐变过程,摄像时长为180 s,摄像参数设置为720p HD, 30 fps,文件存贮为MOV格式。
图像信息采用Matlab 2016a(美国MathWorks公司)软件自编程序获得,具体步骤为:读取采集到的视频文件,每间隔10 s截取一帧视频图像,对图像进行二值化(image binarization)处理及图像分割,获得甘薯切片轮廓区域内图像的红(R)、绿(G)、蓝(B)通道均值,即可得到该样品在180 s内RGB值的动态变化数据。每个样品重复3次并取平均值。
1.3.2 PPO活力测定
粗酶液提取参照王礼群等[26]的方法,随机称取2.0 g样品,加入5 mL 0.1 mol/L的磷酸缓冲液(pH 6.8,含有0.1 mol/L PVPP),研成匀浆后在4 ℃离心15 min(12 000 r/min),上清液即为PPO粗酶液。
PPO活力的测定参照PIZZOCARO等[4]的方法稍作修改,取2.5 mL醋酸缓冲液(pH 4.4,醋酸浓度0.1 mol/L),加入1 mL 0.2 g/L儿茶酚底物,再加入0.5 mL粗酶液后充分摇匀,测量3 min内吸光度在410 nm波长处的变化。在测定条件下,每分钟吸光度变化0.01即为1个酶活力单位(U)。实验重复3次。
1.3.3 模型的建立及验证
模型的建立及数据分析采用Matlab 2016a软件。所建模型的优劣采用拟合确定系数(coefficient of determination,R2)来判定,R2的意义是一个变量的变化有百分之多少可以由另一个变量来解释,其计算如公式(1)所示:
(1)
式中,![]() 表示校正集第i个样品的预测值yci表示其对应的实测值
表示校正集第i个样品的预测值yci表示其对应的实测值![]() 表示校正集所有样品实测值的平均值。
表示校正集所有样品实测值的平均值。
同时,为了评价模型的预测能力,需要采用外部验证集样品对模型进行验证。通常采用预测均方根误差(root mean square error of prediction,RMSEP)、预测相关系数(correlation coefficient of prediction,rp)、预测标准差(square error prediction SEP)、偏差(bias)以及标准偏差比(standard deviation ratio,SDR)来评价模型的预测能力。RMSEP即模型对样品预测的均方根误差,主要用于评价模型对外部样本的预测能力,其值越小表明模型对外部样品的预测能力越高,反之则预测能力越低。rp用于衡量样本的预测值和实测值之间的相关程度,其值越接近于1,则表明预测值与实测值之间的相关程度越好。SEP为预测标准偏差,对未知样本进行预测时,SEP值越小越好;bias为验证集各样品的预测偏差的平均值,bias用于衡量模型的预测系统误差,越小越好。SDR用来评价模型的稳定性和预测能力,一般认为,SDR<1表示无预测能力,SDR=1.5表明模型有一定的区分力,SDR=2表明有较好的预测能力,SDR>3则表示模型有很强的预测能力[27]。RMSEP、rp、SEP、bias和SDR的计算公式(2)、(3)、(4)、(5)和(6)如下:
(2)
(3)
(4)
(5)
(6)
式中:![]() 表示验证集第i个样品的预测值,ypi表示其对应的实测值,
表示验证集第i个样品的预测值,ypi表示其对应的实测值,![]() 表示验证集所有样品实测值的平均值,n表示验证集样品数量,σ表示表验证集样品实测值的标准偏差。
表示验证集所有样品实测值的平均值,n表示验证集样品数量,σ表示表验证集样品实测值的标准偏差。
2 结果与分析
2.1 PPO活力测定结果与样品集划分
实验样品共测定了90份甘薯样品的PPO活力,采用含量梯度法[27]从90份样品中挑选72份样品作为校正集,用以构建预测模型,其余18份作为外部验证集,以对模型的预测能力进行验证,结果如表1所示。
表1 甘薯样品PPO活力测定结果及样品集划分
Table 1 PPO activity of sweet potato samples and and partition of calibration and validation subsets
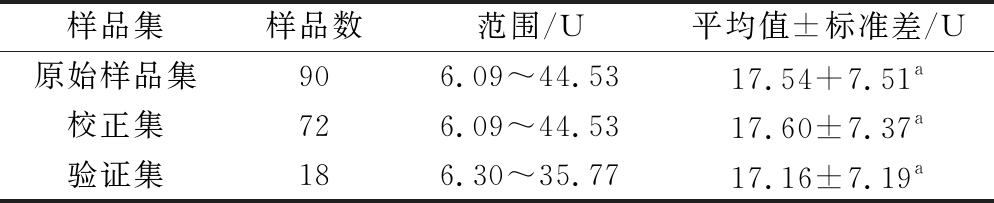
样品集样品数范围/U平均值±标准差/U原始样品集906.09~44.5317.54+7.51a校正集726.09~44.5317.60±7.37a验证集186.30~35.7717.16±7.19a
注:显著差异性分析采用最小显著差数法,表中相同小写英文字母表示无显著差异(P>0.05)。
由表1可知,甘薯样品中PPO活力最小值为6.09 U,与王礼群等[26]报道的结果近似,最大值为44.53 U,与郁志芳等[3]报道的结果接近;样品集PPO活力6.09~44.53 U,表明实验材料涵盖的范围较广,有利于后期模型的拟合。显著性分析结果显示,原始样品集与校正集和验证集之间没有显著差异,说明样品集划分合理;通过含量梯度法划分校正集与验证集后,校正集样品PPO活力范围大于验证样品集,有利于建立高精度的预测模型。
2.2 甘薯切片图像RGB值随放置时间的变化
由于PPO的存在,甘薯鲜切后持续暴露于空气中,块根中的多酚类物质会不断氧化变色,切面颜色持续褐变加深。由酶活力的定义可知,切口处颜色变深的快慢与PPO活力有关。为详细了解甘薯切片图像RGB值随时间变化的情况,选择样品中PPO活力较低和较高的2个样品,以时间为横轴,以切片的RGB颜色值为纵轴作图,结果如图2所示(图2-a为低PPO活力样品,PPO活力10.84 U;图2-b为高PPO活力样品,PPO活力32.13 U)。甘薯切片颜色的直观变化如图3所示。
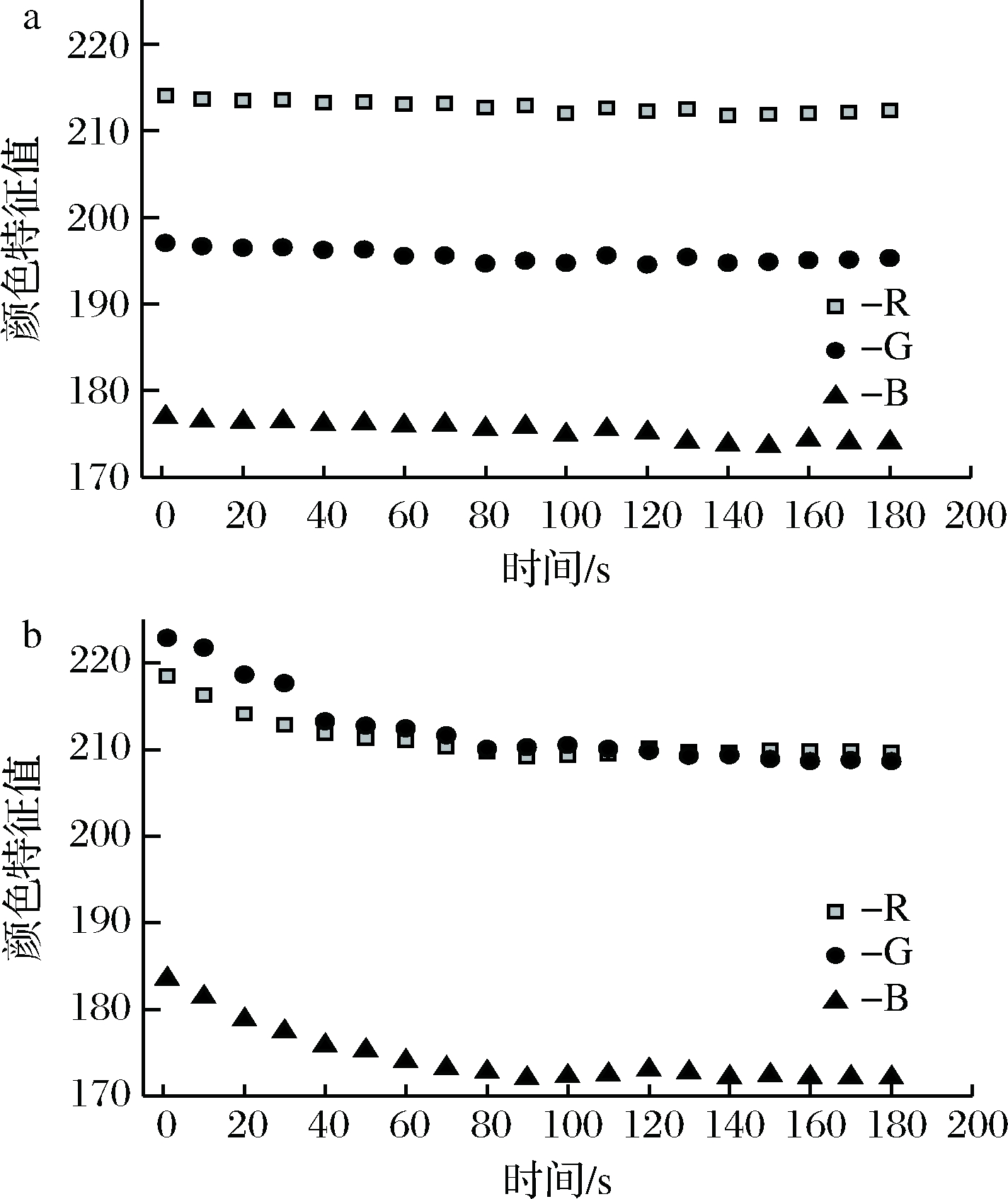
a-低PPO活力样品;b-高PPO活力样品
图2 甘薯切片RGB值随放置时间的变化
Fig.2 Changes of RGB values of sweet potato slice during storage time
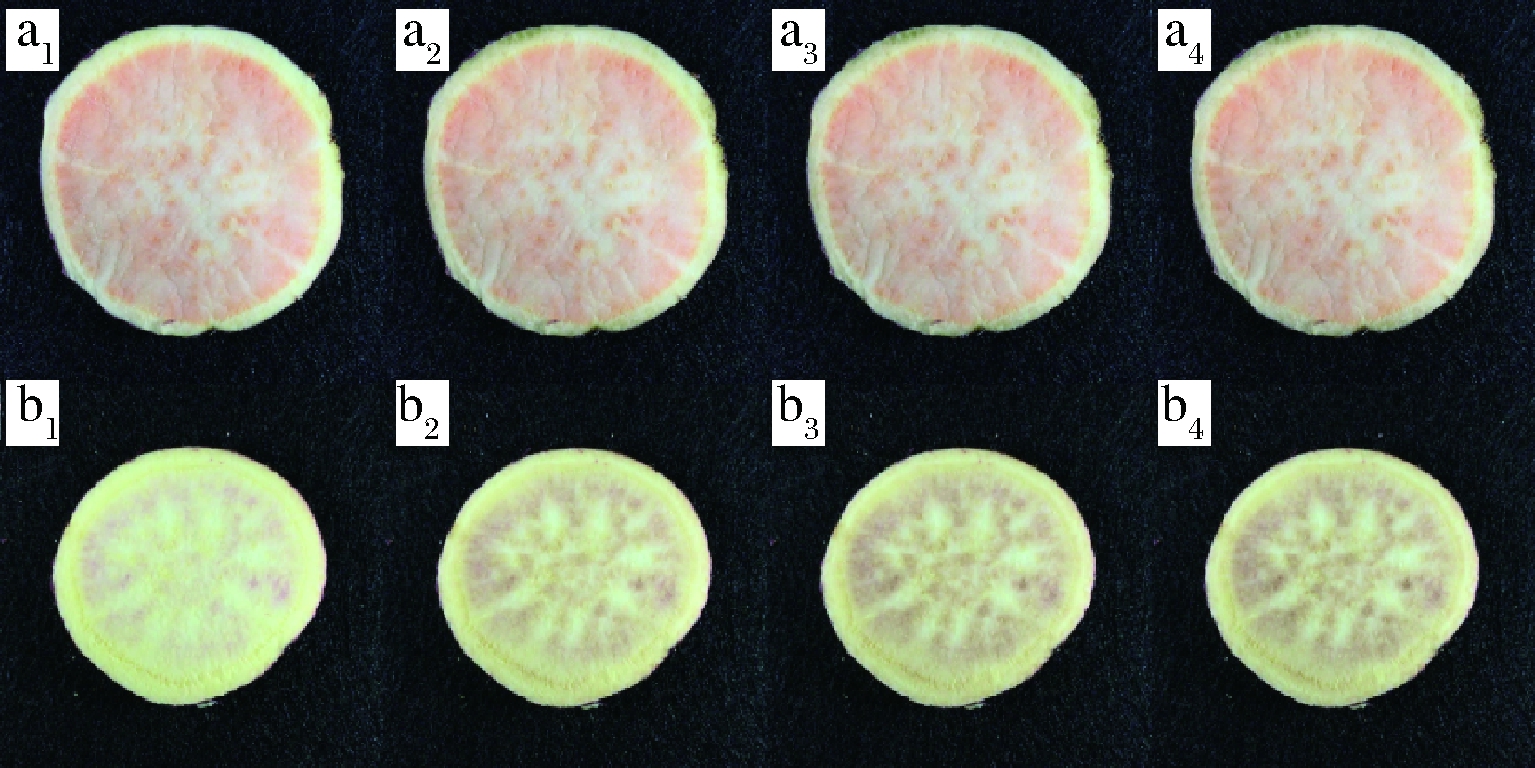
a-低PPO活力样品;b-高PPO活力样品;下标1 ~ 4分别代表0、60、120、180 s时的切片图像
图3 甘薯切片的褐变图
Fig.3 Browning of sweet potato slices
从图2可以看出,低PPO活力样品(图2-a)切片图像的R、G、B值在0~180 s略有下降,但变化不大,即褐变程度不大。高PPO活力样品(图2-b)切片图像的R、G、B值在前60 s内快速下降,在120 s后变化趋于平直。这可能是因为在甘薯切片与空气刚刚接触时,由于PPO活力较高,底物与氧气快速反应使得切片快速褐变;60 s以后,随着底物的不断消耗,褐变速度逐渐减缓;在120 s后,随着底物的进一步消耗,切面附近的酶促褐变趋于停止。
由图3可以直观地看出,由于品种的不同,低PPO活力样品的颜色偏红(图3-a),因此其图像RGB值的R值最高,G值次之,B值最低(图2-a);高PPO活力样品切片总体偏黄(图3-b),因此其图像的R值和G值总体相当(图2-b),即红光和绿光混合而呈现为黄色。由于甘薯中含有β-胡萝卜素等橘黄色天然色素,当白光照射至甘薯切片时,β-胡萝卜素等吸收光线中蓝绿色光的同时反射红黄色光,从而使甘薯块根切片呈现橘黄或橘红色,手机镜头拍摄到的实际是吸收光的补色,因此在图2中B值总处于最低。在空气中放置一段时间,低PPO活力样品边缘略微褐变,但总体变化不明显,表现为图2-a中RGB值总体下降平缓;高PPO活力样品褐变明显,特别是图3-b1到图3-b2,样品的褐变程度明显增加,与图2-b中0~60 s RGB值快速下降对应。
甘薯切片发生褐变,其图像的RGB值会不断变化(图2),同时甘薯中含有β-胡萝卜素等天然色素,切片本身的颜色(图3)也会对图像的RGB值产生叠加与影响。因此直接使用切片的RGB值评价甘薯PPO活力会存在很大误差。CHOODUM等[28]的研究发现,使用数字图像比色法建立预测模型时,采用反应前后体系RGB差值作为自变量,模型预测能力不会受到体系本身颜色的影响。甘薯酶促褐变程度受到PPO活力与底物浓度的双重影响,由图2可以看出,甘薯鲜切初期酶促褐变的底物充足,图像RGB值的变化可以充分反映PPO的活力,而超过60 s后,由于底物消耗褐变速度逐渐下降。综合考虑样品PPO活力高低情况,在后续的研究中,选择 30 s作为提取甘薯切片图像RGB变化特征的时间点,将切片图像0~30 s的R、G、B值的变化量记为ΔR、ΔG和ΔB。
2.3 ΔR、ΔG和ΔB与PPO活力的相关性
分别以ΔR、ΔG和ΔB为横轴,以样品PPO活力为纵轴作图,以考察0~30 s切片图像RGB的变化量与PPO活性的关系,结果见图4。同时,分析ΔR、ΔG和ΔB与PPO活力间的相关性,结果见表2。
表2 甘薯切片PPO活力与数字图像RBG值的相关性分析
Table 2 Correlation analysis between PPO activity and RGB values of sweet potato slices
相关性分析ΔRΔGΔBPPO活力0.946**0.799**0.620**
注:**表示在0.01水平上显著相关。
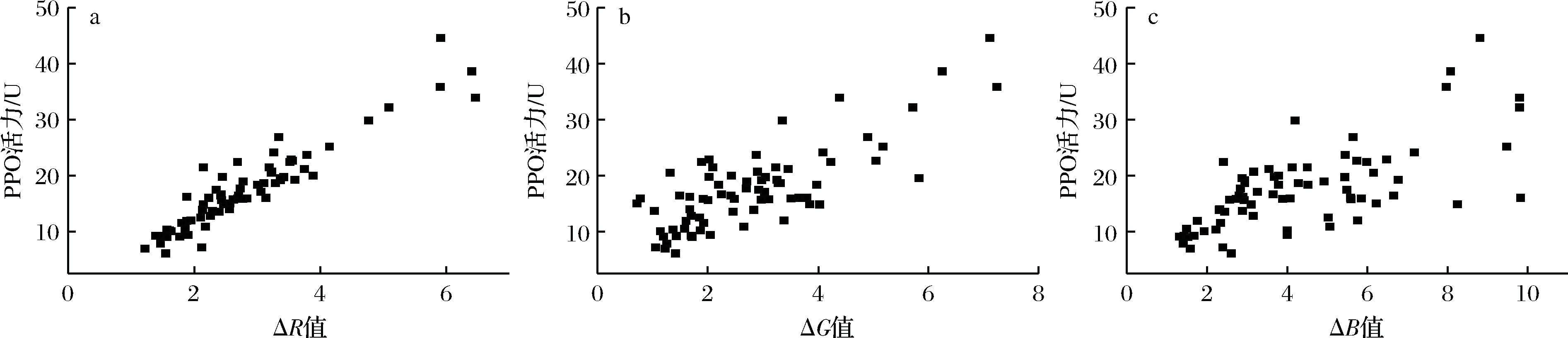
a-ΔR;b-ΔG;c-ΔB
图4 图像RGB的变化量与PPO活力的关系图
Fig.4 Relationship between the changes of RGB values and PPO activity
从图4可以直观地看出,ΔR、ΔG和ΔB均与PPO活力呈正相关。图4-a中,数据点的分布较为集中且有较强的规律性,表明ΔR与PPO活力有较高的相关性,相关性分析结果显示(表2),ΔR值与PPO活力间呈极强正相关,相关系数达到0.946。图4-b和图4-c中,数据点的分布较为分散,但整体上随着ΔG或ΔB的增加PPO活力也不断提高,相关性分析结果显示,ΔG、ΔB与PPO活力呈中等强度正相关,相关系数分别为0.799和0.620。
2.4 甘薯PPO活力预测模型的建立及验证
分别采用ΔR、ΔG、ΔB及其组合为自变量,建立线性回归模型(分别记为模型1~7),模型的优劣采用拟合决定系数R2评价,结果如表3所示。
表3 甘薯PPO活力预测模型
Table 3 Prediction models of PPO activity in sweet potato
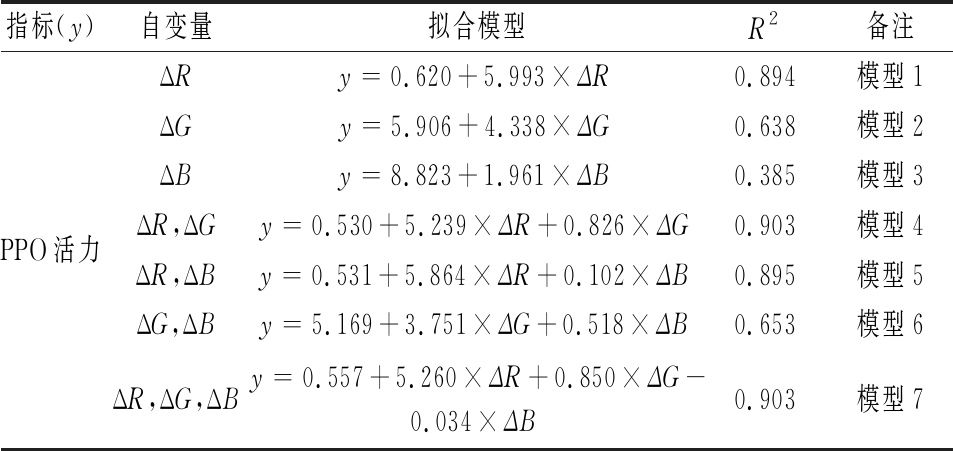
指标(y)自变量拟合模型R2备注PPO活力ΔRy=0.620+5.993×ΔR0.894模型1ΔGy=5.906+4.338×ΔG0.638模型2ΔBy=8.823+1.961×ΔB0.385模型3ΔR,ΔGy=0.530+5.239×ΔR+0.826×ΔG0.903模型4ΔR,ΔBy=0.531+5.864×ΔR+0.102×ΔB0.895模型5ΔG,ΔBy=5.169+3.751×ΔG+0.518×ΔB0.653模型6ΔR,ΔG,ΔBy=0.557+5.260×ΔR+0.850×ΔG-0.034×ΔB0.903模型7
由表3可知,模型1、4、5、7的R2较为接近,分别为0.894,0.903,0.895和0.903,并且所有模型中均包含变量ΔR,这是因为ΔR与PPO活力呈极强正相关,相关系数达到0.946。仅用ΔR对PPO活力进行拟合,模型1的R2即可达到0.894,同时,ΔG和ΔB均与PPO有中等强度正相关,在模型1的基础上引入ΔG和(或)ΔB,模型的R2均有所提高。
为了进一步比较模型1、4、5、7的预测能力,采用验证集样品对以上4个模型进行验证,结果如表4所示。
表4 模型的验证结果
Table 4 Verification results of the models
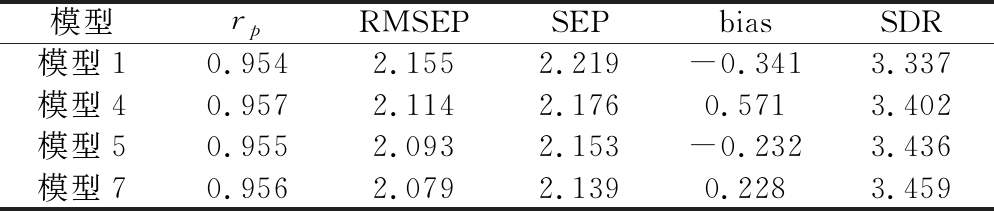
模型rpRMSEPSEPbiasSDR模型10.9542.1552.219-0.3413.337模型40.9572.1142.1760.5713.402模型50.9552.0932.153-0.2323.436模型70.9562.0792.1390.2283.459
可以看出,4种模型的rp均大于0.95,说明对于验证集样品,4种模型预测值和实测值之间的相关程度均较高;SDR均大于3,说明模型均有较强的预测能力。模型7的RMSEP=2.079,低于其他模型,SEP与bias最小,说明预测的标准偏差与系统误差最小,而SDR=3.459,高于其他模型,说明模型7对外部样本的预测能力最强,因此选择模型7为甘薯PPO活力最优预测模型,模型的表达式为:
甘薯PPO活力(U)=0.557+5.260×ΔR+0.850×ΔG-0.034×ΔB
图5为最优模型预测值与实测值的关系图。模型的预测值与实测值比较均匀的分布在趋势线周围,无明显的聚集或偏移趋势,说明模型的预测值和实测值之间的相关程度较高。
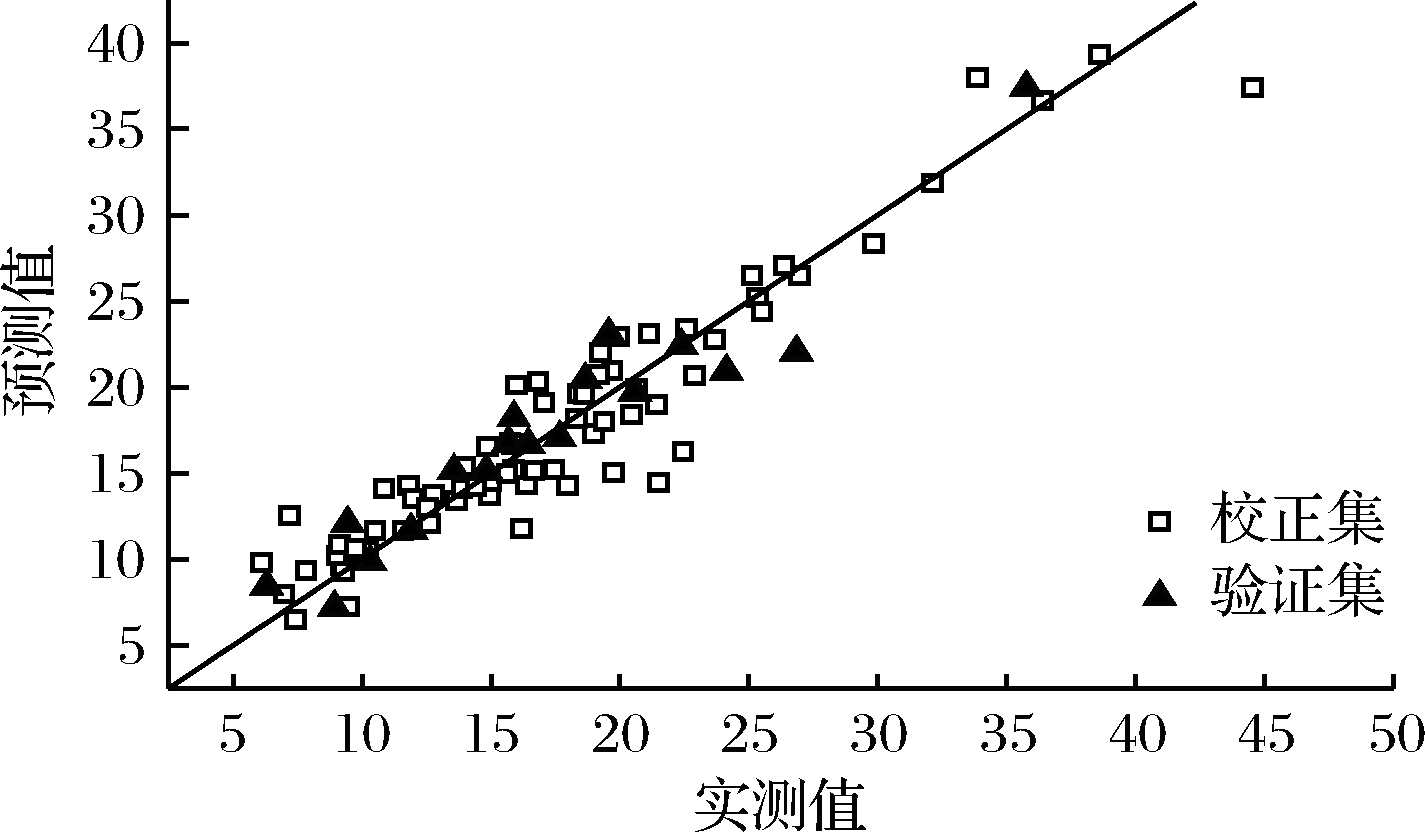
图5 预测值与实测值关系图
Fig.5 Relationship between predicted and true values of the model
3 结论
PPO是引起鲜切甘薯褐变的主要原因,PPO活力是甘薯贮藏保鲜及深加工中经常测定的指标。常用的PPO活力检测方法操作较为繁琐,建立一种快速、简便且不需要太多化学前处理的检测方法意义重大。实验采用手机拍摄甘薯切片的褐变视频,采用Matlab软件自编程序提取视频180 s内图像信息的动态变化数据,并建立了PPO活力预测模型。研究发现,0~30 s图像R值的变化量(ΔR)与PPO活力呈极强的正相关(相关系数0.946),G值与B值的变化量(ΔG和ΔB)与PPO活力呈中等强度正相关(相关系数分别为0.799和0.620)。采用多元线性回归模型对ΔR、ΔG、ΔB与PPO活力间的关系进行拟合,所得最优模型的R2达到0.903;对验证集样品进行预测,最优模型的rp、RMSEP和SDR分别为0.956,2.079和3.459。相比于常用的PPO活力检测方法,基于视频信息的甘薯PPO活力检测方法,在模型建立之后,样品无需前处理,操作简便快捷,为数字图像比色法在甘薯品质检测中的应用提供了一种新的思路与方法。需要说明的是,在实际应用中由于甘薯的品种、产地等不同,所得结果会产生一定误差,需不断增加校正集样品数量并更新模型,以获得更为可靠的预测结果。在后续的研究中,还可以考虑采用近红外光谱等方法建立无损检测模型,更为快速的检测甘薯PPO活力。
[1] 刘水英, 李新生, 江海, 等. 彩色甘薯不同品种中基本物质及功能成分分析[J]. 江苏农业科学, 2015,43(1):303-305.
[2] 周郑坤, 郑元林. 甘薯营养价值与保健功能的再认识[J]. 江苏师范大学学报(自然科学版), 2016,34(4):16-19;87.
[3] 郁志芳, 夏志华, 陆兆新. 鲜切甘薯酶促褐变机理的研究[J]. 食品科学, 2005,26(5):54-59.
[4] PIZZOCARO F, TORREGGIANI D, GILARDI G. Inhibition of apple polyphenol oxidase (PPO) by ascorbic, citric acid and sodium chloride[J]. Journal of Food Processing and Preservation, 1993,17(1):21-30.
[5] 刘锐, 杨瑞琴, 常冠群. 图像比色法测定有色溶液[J]. 理化检验-化学分册, 2014,50(11):1 348-1 350.
[6] JIA M, WU Q, LI H, et al. The calibration of cellphone camera-based colorimetric sensor array and its application in the determination of glucose in urine[J]. Biosensors & Bioelectronics, 2015,74:1 029-1 037.
[7] KOSTELNIK A, CEGAN A, POHANKA M. Color change of phenol red by integrated smart phone camera as a tool for the determination of neurotoxic compounds[J]. Sensors, 2016,16(9):1-10.
[8] ONCESCU V, MANCUSO M, ERICKSON D. Cholesterol testing on a smartphone[J]. Lab on A Chip, 2014,14(4):759-763.
[9] WONGNIRAMAIKUL W, LIMSAKUL W, CHOODUM A. A biodegradable colorimetric film for rapid low- cost field determination of formaldehyde contamination by digital image colorimetry[J]. Food Chemistry, 2018,249:154-161.
[10] CHOODUM A, SRIPROM W, WONGNIRAMAIKUL W. Portable and selective colorimetric film and digital image colorimetry for detection of iron[J]. Spectrochimica Acta Part A-Molecular and Biomolecular Spectroscopy, 2019,208:40-47.
[11] SUMRIDDETCHKAJORN S, CHAITAVON K, INTARAVANNE Y. Mobile device-based self-referencing colorimeter for monitoring chlorine concentration in water[J]. Sensors and Actuators B: Chemical, 2013,182:592-597.
[12] LOPEZ-RUIZ N, CURTO V F, ERENAS M M, et al. Smartphone-Based simultaneous pH and nitrite colorimetric determination for paper microfluidic devices[J]. Analytical Chemistry, 2014,86(19):9 554-9 562.
[13] SEKINE Y, KATORI R, TSUDA Y, et al. Colorimetric monitoring of formaldehyde in indoor environment using built-in camera on mobile phone[J]. Environmental Technology, 2016,37(13):1 647-1 655.
[14] WEI Q, NAGI R, SADEGHI K, et al. Detection and spatial mapping of mercury contamination in water samples using a smart-phone[J]. Acs Nano, 2014,8(2):1 121-1 129.
[15] GUO J, WONG J X H, CUI C, et al. A smartphone-readable barcode assay for the detection and quantitation of pesticide residues[J]. Analyst, 2015,140(16):5 518-5 525.
[16] SANTOS NETO J H, PORTO I S A, SCHNEIDER M P, et al. Speciation analysis based on digital image colorimetry: Iron (Ⅱ/Ⅲ) in white wine[J]. Talanta, 2019,194:86-89.
[17] MASAWAT P, HARFIELD A, NAMWONG A. An iPhone-based digital image colorimeter for detecting tetracycline in milk[J]. Food Chemistry, 2015,184:23-29.
[18] MAHATO K, CHANDRA P. Paper-based miniaturized immunosensor for naked eye ALP detection based on digital image colorimetry integrated with smartphone[J]. Biosensors and Bioelectronics, 2019,128:9-16.
[19] SINGKHONRAT J, SRIPRAI A, HIRUNWATTHANAKASEM S, et al. Digital image colorimetric analysis for evaluating lipid oxidation in oils and its emulsion[J]. Food Chemistry, 2019,286:703-709.
[20] DE SOUSA FERNANDES D D, ROMEO F, KREPPER G, et al. Quantification and identification of adulteration in the fat content of chicken hamburgers using digital images and chemometric tools[J]. LWT-Food Science and Technology, 2019,100:20-27.
[21] THONGPRAJUKAEW K, CHOODUM A, SA-E B, et al. Smart phone: A popular device supports amylase activity assay in fisheries research[J]. Food Chemistry, 2014,163:87-91.
[22] AZEEM S M A, MADBOULY M D, EL-SHAHAT M F. Determination of nitrite in processed meat using digital image method and powdered reagent[J]. Journal of Food Composition and Analysis, 2019,81:28-36.
[23] WONGNIRAMAIKUL W, LIMSAKUL W, CHOODUM A. A biodegradable colorimetric film for rapid low-cost field determination of formaldehyde contamination by digital image colorimetry[J]. Food Chemistry, 2018,249:154-161.
[24] LEE K, BAEK S, KIM D, et al. A freshness indicator for monitoring chicken-breast spoilage using a Tyvek® sheet and RGB color analysis[J]. Food Packaging and Shelf Life, 2019,19:40-46.
[25] 沈升法, 吴列洪, 李兵. 基于图像RGB特征值的甘薯色素与肉色关系初步探讨[J]. 植物遗传资源学报, 2015,16(4):888-894.
[26] 王礼群, 刘硕, 杨春贤, 等. 鲜切甘薯不同部位褐变机理差异[J]. 食品科学, 2018,39(1):285-290.
[27] CHEN J, ZHU S, ZHAO G. Rapid determination of total protein and wet gluten in commercial wheat flour using siSVR-NIR[J]. Food Chemistry, 2017,221:1 939-1 946.
[28] CHOODUM A, KANATHARANA P, WONGNIRAMAIKUL W, et al. A sol-gel colorimetric sensor for methamphetamine detection[J]. Sensors and Actuators B: Chemical, 2015,215:553-560.