便秘是一种症状,而非是一种疾病的名称[1]。当今社会生活节奏越来越快,改变了人们的饮食习惯。不仅如此,社会压力也日益增大,使得许多人受到了便秘的困扰。便秘的成因复杂,目前用于缓解便秘的泻剂都有一定的副作用,不能长期使用。目前大量的研究发现具有便秘症状的人和正常人的肠道菌群存在着差异[2-3],因此,我们可以尝试从肠道菌群入手,通过用益生菌干预肠道菌群,改善肠道微环境,从而缓解便秘相关症状。
近年来,人们对益生菌领域的兴趣大大增加,与此同时,利用随机、双盲法进行人体试验,益生菌的益生功能也逐渐被人们所接受。联合国粮食及农业组织定义益生菌为活的微生物,当给予足够数量的益生菌时,对宿主的健康有益[4]。人类肠道中最常见的2个属是乳杆菌属和双歧杆菌属。
副干酪乳杆菌LC2、LC3、LC38、FJSWX33-L2是分离自健康人肠道的4株不同遗传背景的菌株。本试验通过对由洛哌丁胺造成便秘小鼠模型,研究这4株副干酪乳杆菌的缓解便秘的能力,并比较这4株菌在缓解便秘途径可能存在的差异,以期为益生菌缓解便秘的研究评价提供参考依据,为益生菌生物活性的开发和利用奠定基础。
1 材料与方法
1.1 实验菌株
副干酪乳杆菌LC2、LC3、LC38、FJSWX33-L2,江南大学食品生物技术中心菌种保藏库。
1.2 实验材料
盐酸洛哌丁胺胶囊,西安杨森制药有限公司;活性炭粉,生工生物工程(上海)股份有限公司;小鼠胃动素(MTL)、小鼠5-羟色胺(5-HT)、小鼠酪酪肽(PYY)ELISA试剂盒,南京森贝伽生物科技有限公司;小鼠神经营养因子-3(NT-3)、上海酶联生物科技有限公司;阿拉伯树胶粉、乙酸、丙酸、异丁酸、戊酸,国药集团化学试剂公司。
墨汁配制方法:称取阿拉伯胶100 g,量取水800 mL,将两者混合均匀,加热煮沸至溶液透明,再加入活性炭50 g,煮沸3次。待溶液冷却后,用水稀释定容至1 000 mL,4℃保存。
1.3 仪器与设备
PB300-N电子天平,Mettler Toledo;真空冷冻干燥机,美国LABCONCO公司;GC-MS、Milli-Q水净化系统,密理博(中国)有限公司;Multiscan Go多功能酶标仪,美国Thermo公司。
1.4 实验方法
1.4.1 动物实验设计
6周龄雄性SPF级BALB/c小鼠,购自上海斯莱克公司。动物实验方案经江南大学伦理委员会批准(JN.No20180115b1920520),并按照欧盟指导方针(2010/63/EU)执行。饲养环境保持在(23±2)℃,相对湿度(50±10)%,12 h光照12 h黑夜交替。36只小鼠随机分成空白组、模型组、LC2组、LC3组、LC38组、FJSWX33-L2组,每组6只。小鼠适应7 d后开始灌胃,从第8天到第25天空白组灌胃0.2 mL 3%蔗糖溶液、模型组灌胃0.2 mL 3%蔗糖溶液、其余4组灌菌组灌胃相应的用0.2 mL 3%蔗糖溶液重悬的菌悬液(5×109CFU/mL)。从第26天到第30天,首先模型组、灌菌组灌胃0.2mL 3%蔗糖溶液重悬的盐酸洛哌丁胺悬液(10 mg/kg b.w),空白组灌胃0.2 mL 3%蔗糖溶液,1 h后,空白组、模型组灌胃0.2mL 3%蔗糖溶液,灌菌组灌胃相应的用0.2 mL 3%蔗糖溶液重悬的菌悬液(5×109CFU/mL)。
1.4.2 检测指标及方法
1.4.2.1 小鼠粪便含水量的测定
在第29天,灌胃结束后,将小鼠单只放入垫有吸水纸的笼盒中,收集粪便,称重即为湿重,冻干后,即为干重,按照公式(1)计算粪便含水量:
粪便含水量![]()
(1)
1.4.2.2 小鼠首粒黑便时间测定
第30天,空白组给予0.2 mL 3%蔗糖溶液、模型组和灌菌组均给予0.2 mL盐酸洛哌丁胺溶液(10 mg/kg b.w),1 h后,各组菌灌胃墨汁,从灌胃墨汁开始,记录每一只小鼠排首粒黑便的时间。
1.4.2.3 小鼠小肠推进率测定
第30天,各组小鼠禁食不禁水过夜。第31天上午8点空白组给予0.2 mL 3%蔗糖溶液、模型组和灌菌组均给予0.2 mL盐酸洛哌丁胺溶液(10 mg/kg b.w),30 min后,空白组和模型组灌胃墨汁,4组灌菌组灌胃含有各自灌胃内容物的墨汁,30 min后处死小鼠,打开腹腔,剪取上端自幽门,下端至盲肠,测量小肠全长为“小肠总长度”,从幽门到墨汁前沿为“墨汁推进长度”,按照公式(2)计算小肠推进率:
小肠推进率![]()
(2)
1.4.2.4 小鼠血清、结肠组织匀浆中胃肠调节肽、神经递质、神经营养因子检测
将收集到的小鼠血液静置2 h,3 000×g离心15 min后获得血清,参照相应试剂盒说明书进行实验,根据标准曲线计算中血清中胃动素(motilin,MTL)、酪酪肽(peptide tyrosine tyrosine,PYY)的浓度。
用预冷的PBS冲洗结肠组织,去除残留血液,剔除周围脂肪组织,称重后将其剪碎。将剪碎的组织与对应体积的PBS按照1∶9(g∶mL)在组织破碎仪上进行破碎,最后5 000×g离心10 min,取上清检测5-HT、NT-3的浓度。具体操作参照相应试剂盒说明书。
1.4.2.5 小鼠结肠组织Aqp4基因和c-kit基因表达量的测定
采用实时荧光定量聚合酶链反应(quantitative real-time polymerase china reaction,qRT-PCR)来测定相关蛋白的表达量。取超低温冰箱冻存新鲜结肠组织,按说明书用Trizol法提取总RNA,1 μg总RNA经逆转录合成30 μL cDNA,基因引物由生工生物工程(上海)股份有限公司合成。Aqp4基因、c-kit基因、m-Gapdh基因引物序列如表1所示。
表1 Aqp4基因、c-kit基因、m-Gapdh基因引物序列
Table 1 Aqp4 gene, c-kit gene, m-Gapdh gene primer sequence

目的基因引物序列(5'-3')c-kitF:5'- GCAGGTTGTCCAACTTATTGAGA-3'R:5'- GCAGTTTGCCAAGTTGGAGT-3'Aqp4F:5'- TGATTCCAAACGAACTGATGTT-3'F:5'- ATAACTGCGGGTCCAAAAGATT-3'm-GapdhF:5'- AGGTCGGTGTGAACGGATTTG-3'R:5'- TGTAGACCATGTAGTTGAGGTCA-3'
以逆转录得到的cDNA为模板,进行实时荧光定量聚合酶链式反应,反应体系共10 μL。反应条件为:95℃、2 min,95℃、30 s,59℃、30 s,72℃、20 s,共38个循环。以m-Gapdh基因为内参,CFX96Manager软件分析结果。
1.4.2.6 小鼠粪便中短链脂肪酸含量测定
根据毛丙永[5]的方法利用GC-MS测定小鼠冻干粪便中的短链脂肪酸含量。使用Rtx-Wax柱(30 m),参照文献设置载气、流速、分流比、进样量、进样温度和GC升温程序,质谱分析为全扫描模式。通过外标法制得标准曲线,小鼠粪便经过冻干、饱和NaCl浸泡、H2SO4(体积分数10%)酸化,无水乙醚萃取后,上机检测,根据标准曲线计算样品中各种短链脂肪酸的浓度。
2 结果与分析
2.1 四株副干酪乳杆菌对小鼠肠道运动能力和粪便含水量的影响
便秘主要表现为持续性排便困难, 排便次数减少或排便不尽感以及粪便坚硬干结、含水量减少[6]等。所以我们选用小鼠小肠推进率、小鼠排首粒黑便时间以及粪便含水量这3个指标来直接反应小鼠便秘造模情况、乳杆菌缓解便秘情况。
小肠推进率能直接反映小肠的运动能力[7]。盐酸洛哌丁胺可以作用于肠道平滑肌,抑制肠道平滑肌收缩,抑制肠道蠕动,从而延长食物在小肠的停留时间,这与实际临床便秘类型中慢传输型便秘症状十分吻合。由图1可知,模型组小肠推进率与空白组相比,存在显著差异(P<0.05),说明用该剂量(10 mg/kg b.w)洛哌丁胺造模成功。4株副干酪乳杆菌中,LC3、FJSWX33-L2具有良好地缓解由洛哌丁胺造成的小肠蠕动减慢的现象,LC2次之,LC38效果并不十分明显。
小鼠排首粒黑便时间可以反映食糜在整个肠道转运时间[7],由图2可知,空白组和模型组在排首粒黑便时间上具有显著差异(P<0.05),说明洛哌丁胺造模成功。4株副干酪乳杆菌中,LC3和FJSWX33-L2能较好缩短小鼠排首粒黑便的时间,LC2次之。有趣的是,LC38虽然在改善小肠推进率方面没有表现出明显的效果,但却显著缩短了小鼠排首粒黑便的时间,推测副干酪乳杆菌LC38可通过某种特殊机制,在对小肠转运速率无影响的情况下,仍能加快结肠的转运速率,其具体机制有待进一步研究。
除了以上2个指标,我们还考察了副干酪乳杆菌对小鼠粪便含水量的影响。有文献指出,用洛哌丁胺造成的小鼠便秘模型,会导致粪便含水量减少的现象[8],与人类慢传输型便秘的症状相似。由图3可知,经过洛哌丁胺造模后,小鼠粪便的含水量显著低于空白组(P<0.05),这与之前研究结果吻合[9]。从菌的影响可看出,副干酪乳杆菌LC2和LC38这2株菌均能较好地提高粪便中的含水量,达到润肠通便的效果。FJSWX33-L2的效果次之,LC3的小鼠粪便含水量与模型组之间没有差异,可知其虽然可以改善便秘小鼠的肠道运动能力,却不能通过提高粪便含水量来达到缓解便秘的效果。

图1 各组小鼠小肠推进率
Fig.1 Small intestine propulsion rate of each group of mice
注:柱形图上的字母不同表示组间差异显著(P<0.05)。下同。

图2 各组小鼠排首粒黑便时间
Fig.2 Time to the first black stool defecation

图3 各组小鼠粪便含水量
Fig.3 Moisture content of mice in each group
2.2 四株副干酪乳杆菌对小鼠血清中胃肠肽的影响
胃动素是调节人类胃肠运动功能的胃肠道肽类激素[10],具有刺激肠道蠕动的作用。胃动素可以促进小肠分节运动,从而缩短食糜在小肠中的传递时间。ZHAO等[11]利用活性炭对小鼠进行便秘造模,发现空白组的血清中的MTL含量显著低于模型组,灌胃干酪乳杆菌后,其血清中MTL水平较模型组有了显著的上升。由图4可知,用洛哌丁胺灌胃造模也可降低小鼠血清中MTL的浓度,可以看到副干酪乳杆菌LC3、LC38和FJSWX33-L2可以将血清中的MTL恢复至正常水平,推测其可通过改善胃肠肽的水平实现对便秘的缓解。综上所述,LC38在小肠推进率方面并没有显著差异,所以,对于乳杆菌缓解便秘的途径可能比较复杂,MTL的水平虽然可以作为乳杆菌缓解便秘的一个表现,但其缓解便秘具体机制也可能是多种途径综合的结果。
酪酪肽是一种胃肠激素,它由肠内分泌型L细胞分泌的一种36个氨基酸组成的肽类物质[12]。WANG等[13]在小鼠腹腔注射PYY发现,PYY对清醒小鼠的结肠推进运动具有抑制作用。有学者发现,对肥胖患者进行减肥手术后,同时观察到肠道菌群改变及血清中PYY含量的改变[14],所以肠道菌群可能与PYY的分泌有关,用益生菌干预去影响PYY的产生存在可能性。从现有对便秘的研究来看,较少有报道乳酸菌通过调节血清中PYY的浓度实现对结肠运动的调节。图5显示模型组和空白组血清中PYY浓度没有明显差异,但从模型组的数据能够看出上调趋势,可能原因是洛哌丁胺对血清中PYY的浓度影响并不明显,或者由于造模时间较短,导致模型组血清中PYY的浓度尚未显著升高。但灌胃副干酪乳杆菌LC2和FJSWX33-L2的小鼠血清中PYY的浓度较模型组而言,发生了显著的下调,LC2和FJSWX33-L2可能通过某种途径作用于L细胞,调节血清中的PYY含量,从而调节胃肠道运动,缓解由洛哌丁胺导致的胃肠道运动变缓的症状。
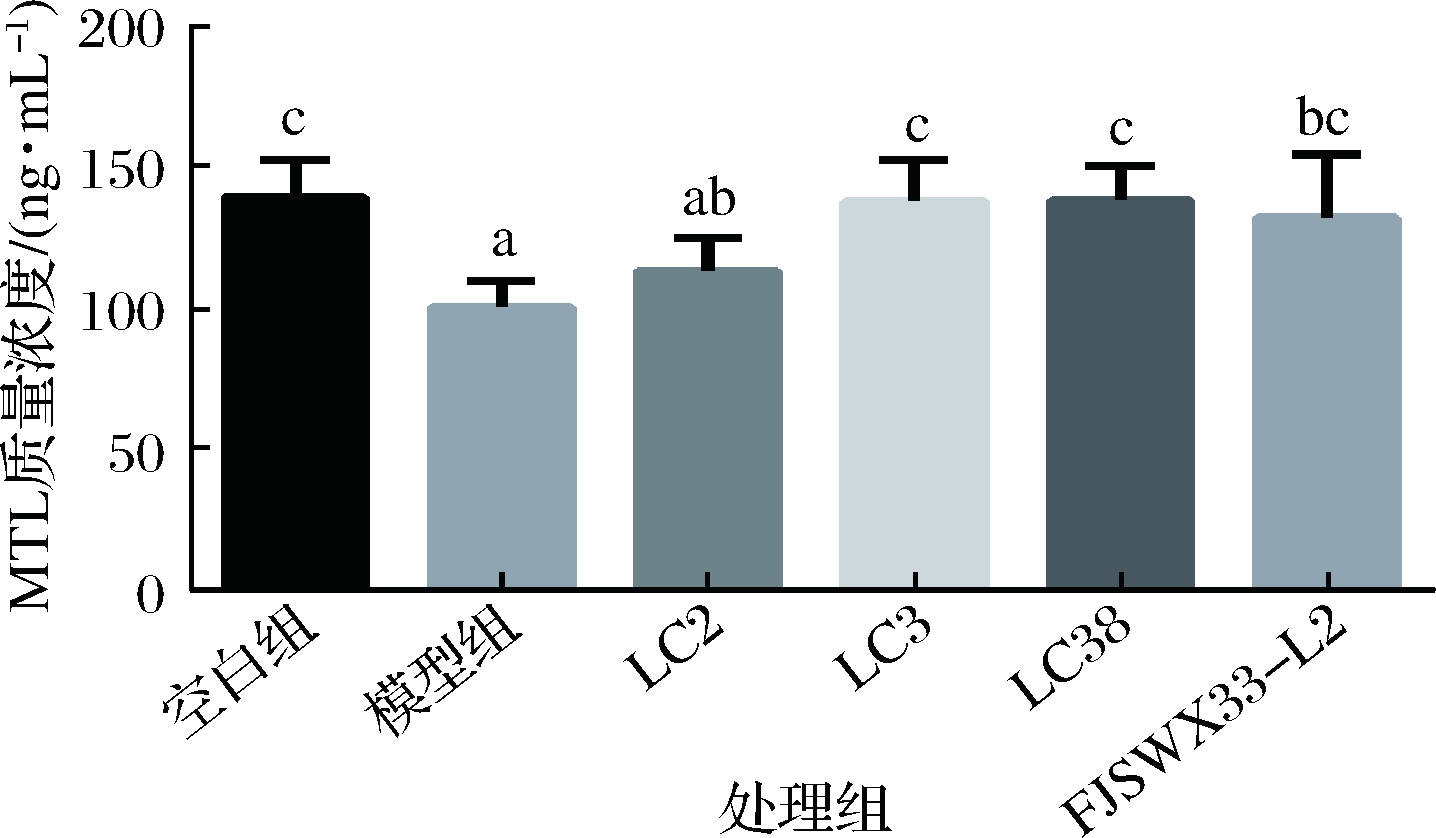
图4 各组小鼠血清中MTL浓度
Fig.4 MTL concentration in serum of each group of mice
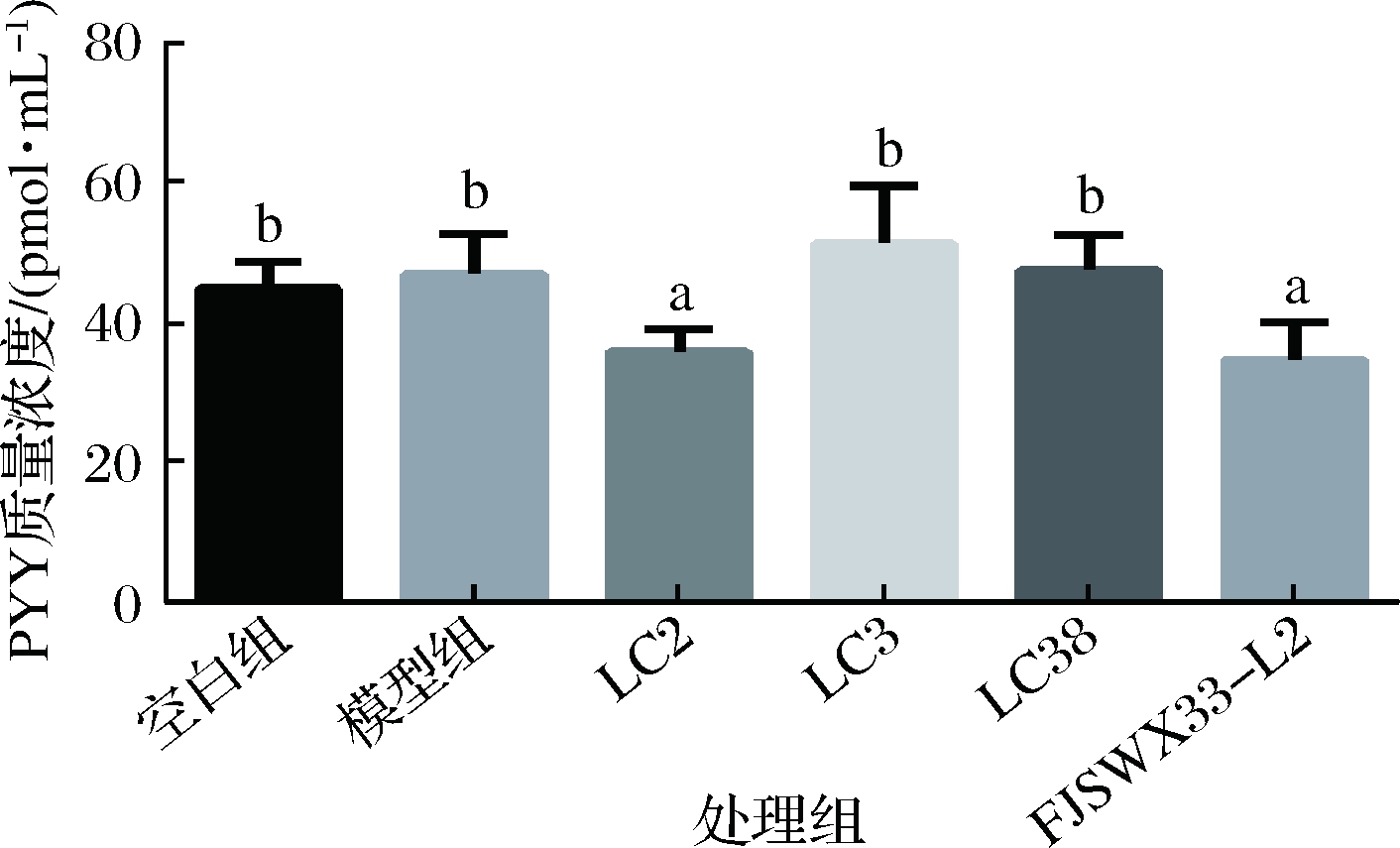
图5 各组小鼠血清中PYY浓度
Fig.5 PYY concentration in serum of each group of mice
2.3 四株副干酪乳杆菌对小鼠结肠神经递质及神经营养因子的影响
5-羟色胺(5-hydroxytryptamine,5-HT)是调节肠道蠕动的重要介质, 主要由肠道黏膜的肠嗜铬细胞产生[15]。5-HT 与胃肠道蠕动有着密切的关系,有文献报道5-HT能加速胃肠道蠕动[16]。另外已有证据表明,新 5-HT受体4激动剂SHR116958可加速胃肠蠕动[17],且5-HT对于肠道推进的作用可以被5-HT受体拮抗剂所阻断[18]。这也从侧面印证了5-HT对于肠道蠕动的重要作用。不仅如此,最新研究表明肠嗜铬细胞释放5-HT可能与微生物代谢物有关[19],这也给用益生菌调节体内5-HT的含量从而加速肠道蠕动提供了可能。由图6可知,本文的研究表明,通过对小鼠灌胃洛哌丁胺,模型组与空白组相比,小鼠结肠中的5-HT含量呈显著下降趋势,这表明洛哌丁胺会对肠道中5-HT的含量产生一定的影响。另外,副干酪乳杆菌LC2、LC38、FJSWX33-L2都能不同程度地上调肠道中5-HT的含量,从而加速肠道的收缩,缓解由洛哌丁胺造成的肠动力减慢现象。这3株菌中,LC2能较好地上调结肠中5-HT的浓度,LC38和FJSWX33-L2次之。有文献表明,短链脂肪酸可以影响到5-HT的释放[20]。而肠道中的短链脂肪酸可以由肠道微生物产生,推测副干酪乳杆菌LC2、LC38、FJSWX33-L2缓解便秘的途径可能是其提高了便秘小鼠肠道中部分脂肪酸的含量,从而刺激肠道释放5-HT,促进结肠收缩,加速结肠运动。
有研究发现神经营养因子3(neurotrophin-3,NT-3)可促进肠道的蠕动,可用于便秘的治疗。PARKMAN等[21]通过对107例便秘患者注射NT-3,发现NT-3可促进肠道运动,自发、完全排便和总排便次数明显增加。COULIE等[22]的研究也有相同结果。但是目前对于乳酸菌是否可以通过提高结肠中NT-3的含量来缓解便秘还鲜有报道。在本研究中,由图7可知,空白组小鼠和模型组小鼠在结肠NT-3浓度方面存在显著差异,说明由洛哌丁胺造成的便秘小鼠的结肠中,NT-3浓度呈下降趋势。4株副干酪乳杆菌中,能显著提高结肠中NT-3浓度的只有LC2。因此,乳酸菌可能存在具有能提高便秘小鼠结肠中NT-3含量的能力,但是具有明显的菌株差异性。
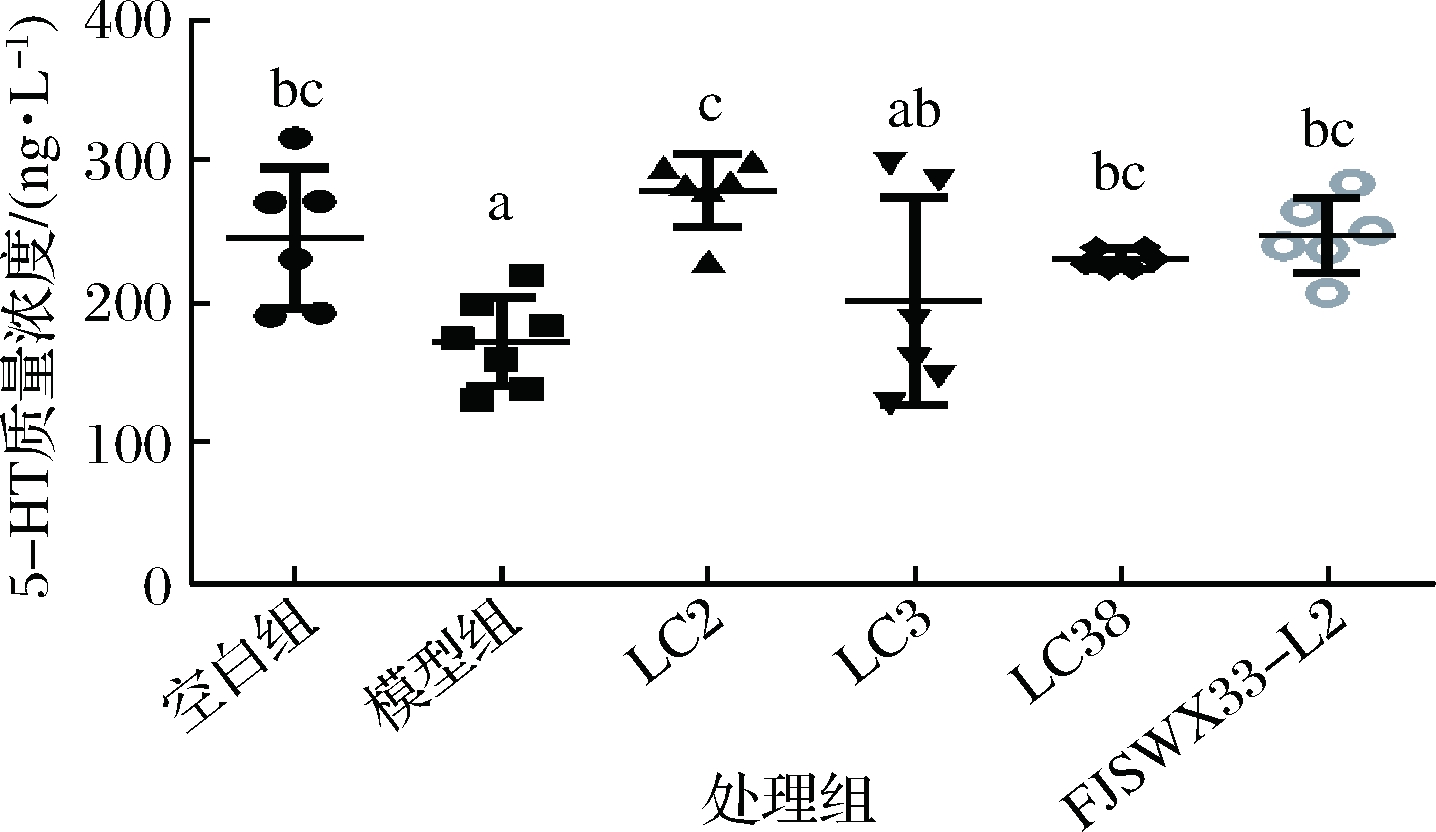
图6 各组小鼠结肠中5-HT浓度
Fig.6 5-HT concentration in the colon of each group of mice

图7 各组小鼠结肠中NT-3浓度
Fig.7 NT-3 concentration in the colon of each group of mice
2.4 四株副干酪乳杆菌对c-kit基因和Aqp4基因转录水平的影响
在人的消化系统中,存在着一种Cajal间质细胞(intestitial cells of Cajal,ICC),ICC相当于心脏的起搏细胞,它是胃肠道的电的起搏细胞[23],它能产生一种促进肠道蠕动的慢波。包云光等[24]给SD大鼠饲喂复方苯乙哌啶后,观察到大鼠产生便秘症状的同时伴随着远端结肠黏膜ICC数量减少。而c-kit受体在ICC发育过程中具有十分重要的作用[25],所以可以通过检测肠道中c-kit蛋白的表达量来反映肠道中Cajal细胞的数量。已经有研究发现植物乳杆菌NCU116可通过提高胃肠道ICC的c-kit基因表达,从而促进结肠的蠕动,缓解便秘症状[26]。由图8可知,便秘小鼠和空白小鼠相比,c-kit的转录水平显著下降,这说明有洛哌丁胺造成的便秘小鼠结肠中Cajal细胞数量下降,导致肠动力减小,产生便秘的症状。在这4株副干酪乳杆菌中,我们发现LC2、LC3能显著提高c-kit的转录水平至正常水平,但是LC38、FJSWX33-L2未能显著提高c-kit的转录水平,这提示我们,LC2和LC3通过提高便秘小鼠结肠中ICC的数量缓解便秘症状。而这种机制在乳酸菌上并不是普遍存在的,具有显著的菌株差异性。LC38、FJSWX33-L2并不能通过这一途径实现便秘的缓解。
水通道蛋白(aquaporin)是一种细胞膜上的蛋白质,可控制水在细胞的进出。水通道蛋白有许多的亚家族,其中Aqp4基因在小鼠结肠中高表达。研究表明腹泻和便秘患者中,水通道蛋白的水平都会存在异常[27]。李立胜等[28]发现洛派丁胺作用于大鼠后可上调腹泻大鼠结肠黏膜AQP4 蛋白表达。另有学者发现用洛哌丁胺造成小鼠便秘后,其结肠中AQP4水平显著高于正常组[29]。由图9可知,模型组结肠中的Aqp4转录水平显著高于正常组,这与前人的研究结果具有一致性。结合本研究粪便含水量的数据,灌胃LC2和LC38两株菌的小鼠粪便含水量显著高于模型组,并达到正常组的水平。相应地,在图9中,LC2使得便秘小鼠结肠中Aqp4转录水平提升到了正常水平,这说明灌胃LC2能够降低结肠细胞水通道蛋白AQP4的表达量实现粪便含水量的增加。灌胃LC38的小鼠结肠中Aqp4转录水平并未见明显提升,这提示粪便含水量的升高除了与AQP4蛋白表达有关外,可能还有其他分子的参与。

图8 各组小鼠结肠中c-kit基因相对转录水平
Fig.8 Relative transcription of c-kit gene in the colon of each group of mice
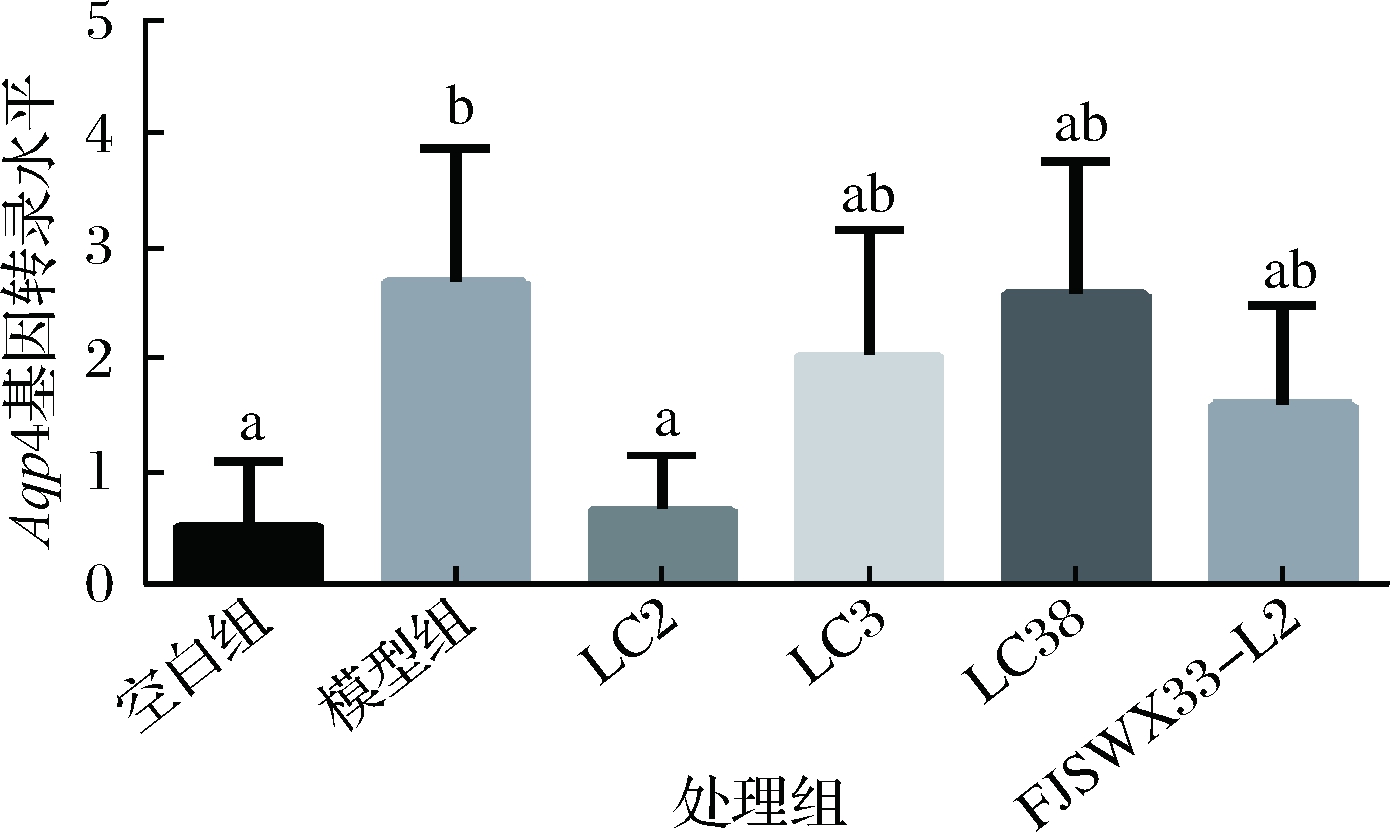
图9 各组小鼠结肠中Aqp4基因相对转录水平
Fig.9 Relative transcription of Aqp4 gene in the colon of each group of mice
2.5 四株副干酪乳杆菌对小鼠粪便短链脂肪酸水平的影响
短链脂肪酸(short-chain fatty acids,SCFAs)是肠道微生物通过在结肠发酵碳水化合物和氨基酸产生的[30],其种类主要有乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸。短链脂肪酸对宿主机体有着十分重要的作用,如为结肠上皮细胞提供能量、维持体液和电解质的平衡、调节肠道菌群等[31]。SCFAs能刺激肠壁蠕动,提高肠内渗透压,促进水分吸收,从而缓解便秘[7]。HURST等[32]通过在豚鼠的结肠管腔注入乙酸盐、丁酸盐、丙酸盐,发现乙酸盐、丁酸盐可以加速结肠中的推进速度、而丙酸盐却不能。DASS等[33]通过体外实验发现,短链脂肪酸可增加肠道蠕动收缩频率,不同的酸对蠕动收缩频率的影响也不同,乙酸≈丙酸≈丁酸>戊酸。由从表2可知,模型组和空白组相比,粪便中乙酸含量存在着显著差异,且灌菌组LC2、LC3、LC38将粪便中的乙酸含量提高至正常水平,且LC2组乙酸含量与LC38组乙酸含量相当,LC3组其次。FJSWX33-L2菌组由于组内差异较大,导致未与模型组在乙酸含量上产生显著差异,但其乙酸含量有上升趋势。综合肠道运动的实验结果分析,发现便秘的程度和粪便中的乙酸含量呈一定的相关性,这与WANG等的研究结果一致[9]。其中副干酪乳杆菌LC2还能上调丙酸、丁酸、异丁酸、戊酸、异戊酸的浓度,从而提高总酸的含量。
3 结论
4株副干酪乳杆菌中LC2菌株能通过改善便秘小鼠体内中MTL、PYY 5-HT、NT-3水平以及Aqp4和c-kit基因转录水平,缓解便秘。其他3株菌也能在一定程度上缓解便秘的症状,但其缓解便秘的途径各有侧重,尤其是在5-HT和NT-3水平上,出现了截然不同的结果。这说明,副干酪乳杆菌缓解便秘的效果以及途径可能存在显著的菌株差异,这种差异还有待于结合其各自的遗传背景进行深入研究。
表2 各组小鼠粪便中不同短链脂肪酸的含量 单位:pmol/mg
Table 2 Contents of different short-chain fatty acids in the feces of each group of mice
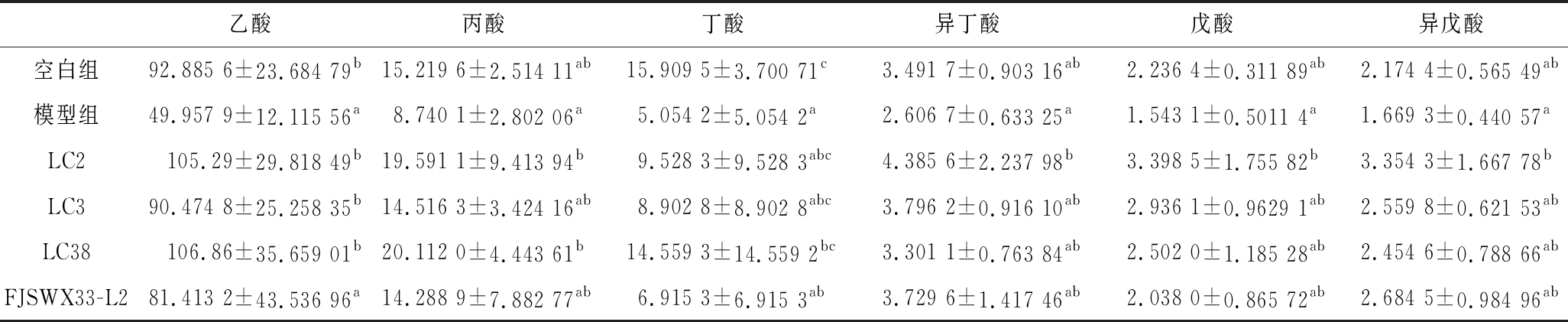
乙酸丙酸丁酸异丁酸戊酸异戊酸空白组92.885 6±23.684 79b15.219 6±2.514 11ab15.909 5±3.700 71c3.491 7±0.903 16ab2.236 4±0.311 89ab2.174 4±0.565 49ab模型组49.957 9±12.115 56a8.740 1±2.802 06a5.054 2±5.054 2a2.606 7±0.633 25a1.543 1±0.5011 4a1.669 3±0.440 57aLC2105.29±29.818 49b19.591 1±9.413 94b9.528 3±9.528 3abc4.385 6±2.237 98b3.398 5±1.755 82b3.354 3±1.667 78bLC390.474 8±25.258 35b14.516 3±3.424 16ab8.902 8±8.902 8abc3.796 2±0.916 10ab2.936 1±0.9629 1ab2.559 8±0.621 53abLC38106.86±35.659 01b20.112 0±4.443 61b14.559 3±14.559 2bc3.301 1±0.763 84ab2.502 0±1.185 28ab2.454 6±0.788 66abFJSWX33-L281.413 2±43.536 96a14.288 9±7.882 77ab6.915 3±6.915 3ab3.729 6±1.417 46ab2.038 0±0.865 72ab2.684 5±0.984 96ab
注:表中不同字母同表示组间差异显著(P<0.05)。
[1] LEPORT J. Constipation[M].S.1:Elsevier Inc,2019.
[2] CHOI C H, CHANG S K. Alteration of gut microbiota and efficacy of probiotics in functional constipation[J]. Journal of Neurogastroenterology and Motility, 2015, 21(1):4-7.
[3] MANCABELLI L, MILANI C, LUGLI G A, et al. Unveiling the gut microbiota composition and functionality associated with constipation through metagenomic analyses[J]. Scientific Reports, 2017, 7(1):9 879.
[4] SINGH T P, KAUR G, MALIK R K, et al. Characterization of intestinal Lactobacillus reuteri strains as potential probiotics[J]. Probiotics & Antimicrobial Proteins, 2012, 4(1):47-58.
[5] 毛丙永. 功能性低聚糖对肠道细菌的影响及机制[D]. 无锡:江南大学, 2015.
[6] 李延青, 于岩波. 功能性便秘的诊断与治疗[J]. 中国实用内科杂志, 2011, 31(2):158-160.
[7] 王琳琳. 双歧杆菌对便秘的影响及其作用机理研究 [D]. 无锡:江南大学, 2017.
[8] YANG Z H, YU H J, PAN A, et al. Cellular mechanisms underlying the laxative effect of flavonol naringenin on rat constipation model[J]. PLoS ONE, 2008, 3(10):e3 348.
[9] LINLIN W, LUJUN H, QI X, et al. Bifidobacterium adolescentis exerts strain-specific effects on constipation induced by loperamide in BALB/c mice[J]. International Journal of Molecular Sciences, 2017, 18(2):318-340.
[10] NUNOI H, MATSUURA B, UTSUNOMIYA S, et al. A relationship between motilin and growth hormone secretagogue receptors[J]. Regulatory Peptides, 2012, 176(1-3):28-35.
[11] ZHAO X, SUO H, QIAN Y, et al. Therapeutic effects of Lactobacillus casei Qian treatment in activated carbon induced constipated mice[J]. Molecular Medicine Reports, 2015, 12(2): 3 191-3 199.
[12] 闫媛, 董蕾. 消化道酪酪肽的作用和受体分布[J]. 国际消化病杂志, 2003,23(6):372-374.
[13] WANG L, GOURCAROL G, YUAN P Q, et al. Peripheral peptide YY inhibits propulsive colonic motor function through Y2 receptor in conscious mice[J]. American Journal of Physiology Gastrointestinal & Liver Physiology, 2010, 298(1):45-56.
[14] FEDERICO A, DALLIO M, TOLONE S, et al. Gastrointestinal hormones, intestinal microbiota and metabolic homeostasis in obese patients: Effect of bariatric surgery[J]. Vivo, 2016, 30(3):321-330.
[15] 朱敏佳,杨泽俊,王菲菲,等.肠嗜铬细胞与胃肠道疾病的研究进展[J].世界华人消化杂志, 2019, 27(2):117-124.
[16] 李小兰,江敏,阮征,等.色氨酸及其代谢产物5-HT对肠道功能的作用综述[J].食品安全质量检测学报, 2014,5(7):1 997-2 002.
[17] 赵香花.新5-羟色胺4受体激动剂SHR116958促进胃肠蠕动的药理作用[D].上海:中国人民解放军海军军医大学, 2009.
[18] SPENCER N J. Constitutively active 5-HT receptors: An explanation of how 5-HT antagonists inhibit gut motility in species where 5-HT is not an enteric neurotransmitter? [J]. Frontiers in Cellular Neuroscience, 2015,9:487-492.
[19] LUND M L, EGEROD K L, ENGELSTOFT M S, et al. Enterochromaffin 5-HT cells - A major target for GLP-1 and gut microbial metabolites [J]. Molecular metabolism, 2018,11:70-83.
[20] FUKUMOTO S, TATEWAKI M, YAMADA T, et al. Short-chain fatty acids stimulate colonic transit via intraluminal 5-HT release in rats[J]. American Journal of Physiology - Regulatory, Integrative and Comparative Physiology, 2003, 284(5):R1 269-R1 276.
[21] PARKMAN H P, RAO S S C, REYNOLDS J C, et al. Neurotrophin-3 improves functional constipation[J]. American Journal of Gastroenterology, 2003, 98(6):1 338-1 347.
[22] COULIE B, SZARRKA L A, CAMILLERI M, et al. Recombinant human neurotrophic factors accelerate colonic transit and relieve constipation in humans[J]. Gastroenterology, 2000, 119(1):41-50.
[23] 侯晓华,陈建德. Cajal间质细胞在胃肠运动中的作用[J].中华消化杂志, 2001,21(6):360-362.
[24] 包云光,舒小莉,李小兵,等.肠神经系统递质和Cajal间质细胞在大鼠慢传输型便秘中的作用[J]. 中国当代儿科杂志, 2009, 11(6):481-485.
[25] 贾后军,童卫东,刘宝华.胃肠道Cajal间质细胞与干细胞因子/c-kit信号途径关系[J].医学研究生学报, 2010, 23(2):192-195.
[26] LI C, NIE S P, ZHU K X, et al. Effect of Lactobacillus plantarum NCU116 on loperamide-induced constipation in mice[J]. International Journal of Food Sciences and Nutrition, 2015, 66(5): 533-538.
[27] IKARASHI N, KON R, SUGIYAMA K. Aquaporins in the colon as a new therapeutic target in diarrhea and constipation[J]. International Journal of Molecular Sciences, 2016, 17(7):1 172.
[28] 李立胜,王俊平.洛哌丁胺对腹泻模型大鼠结肠水通道蛋白4表达的影响[J].胃肠病学和肝病学杂志, 2009, 18(1):57-59.
[29] 方圆之,高杰.白芍的通便作用及其对便秘小鼠结肠AQP4、VIP表达的影响[J].山东中医杂志, 2017,36(1):62-65.
[30] EDWARDS C A. Short chain fatty acids. Production and effects on gut motility[J]. Oxygen Transport to Tissue XXXIII, 1997, 427(7):155-167.
[31] 陈燕,曹郁生,刘晓华.短链脂肪酸与肠道菌群[J].江西科学, 2006, 24(1):38-40;69.
[32] HURST N R, KENDIG D M, MURTHY K S, et al. The short chain fatty acids, butyrate and propionate, have differential effects on the motility of the guinea pig colon[J]. Neurogastroenterology & Motility, 2014, 26(11):1 586-1 596.
[33] DASS N B, JOHN A K, BASSIL A K, et al. The relationship between the effects of short-chain fatty acids on intestinal motility in vitro and GPR43 receptor activation[J]. Neurogastroenterology and Motility, 2007, 19(1):66-74.