众所周知,生物源单胺章鱼胺(octpamine,OA)在各种无脊椎动物中扮演着神经激素、神经调节剂和神经递质的角色,在多数无脊椎动物的神经和非神经组织中都发现了它,其功能相当于脊椎动物交感神经的肾上腺素能受体,OA调节了目前研究的无脊椎动物几乎所有的生理过程[1],包括周围器官、感觉器官和中枢神经系统内的过程。OA也是人体内源性的生物胺,在人体内有重要的生理作用[2]。研究发现,OA是一种天然的β3-肾上腺素能受体激动剂[3],它可作为食品和保健食品的原料或者临床药物的辅助制剂,也可以单独或与其它材料联合使用,用于减肥和治疗糖尿病[4-5]。在无脊椎动物的各种组织中都发现OA的存在[6],且含量较高。
鱼露中章鱼胺的含量相对丰富,约为0.06 %~0.1 %[7],是天然章鱼胺的主要来源。章鱼胺含量测定的方法有光纤LED诱导荧光毛细管电泳检测法、放射酶学测定法、柱前衍生-RP-HPLC方法、毛细管气相色谱-负化学电离质谱法[8-13]等。荣艳萍[7]等采用高效液相色谱法测得鳀鱼鱼露和七星鱼鱼露中章鱼胺含量分别为1055 μg/mL和566 μg/mL。曲映红[14]以智利外海茎柔鱼内脏为原料发酵鱼露,测得鱼露中的章鱼胺含量高达4.5 mg/mL。
牛磺酸(taurine),又称β-氨基乙磺酸,因为最早是从牛黄中分离出来的,所以取名牛磺酸。是一种存在于动物体内的非蛋白质结构的特殊游离氨基酸,是一种半必需氨基酸,在动物体内的各个组织和器官中含量最为丰富[15],对于维持体内组织细胞的稳定具有重要的意义。另外,还有少量的牛磺酸以小肽和乙酰化的形式存在,这些短肽在体内同样有重要的作用。合成牛磺酸的半胱氨酸亚硫酸羧酶(CSAD)在人体内活性较低,所以人体需要摄取食物中的牛磺酸来满足自身的需要。牛磺酸作为一种神经递质、渗透调节剂和抗氧化剂等作用已被研究。研究表明,牛磺酸有调节渗透压、抗氧化[16]、神经传导、免疫等作用,是良好的护肝剂,具有增强视力、促进大脑发育、解除疲劳的作用,还具有一定的抗肿瘤活性[17-21]。同时,牛磺酸还被作为强化营养的食品添加剂添加入婴幼儿奶粉中[22]。随着人们对牛磺酸功能的不断探索和认识,天然牛磺酸的市场潜力不断扩大。
水产品中牛磺酸的含量十分丰富,尤其是在软体动物中[23]。牛磺酸也是鱼露的重要成分。目前国内外测定牛磺酸的方法有中和滴定法、高压液相色谱法、氨基酸自动分析法、薄层层析法和分光光度计法等[24-25]。高效液相色谱法有样品处理简单、方法精确度、灵敏度高和测定速度快等特点,被广泛应用于测定牛磺酸。
牛磺酸和章鱼胺对人体来说都是必不可少的,而鱼露中同时含有章鱼胺和牛磺酸,因此本研究在于寻找一种方便、快捷的方法同时检测鱼露中的章鱼胺和牛磺酸的含量。
1 材料与方法
1.1 材料与试剂
草鱼内脏:从南昌市鄱阳湖农牧渔产业发展股份有限公司取回,置于-20℃冰柜冻存,使用前在10℃以下用流水解冻;鳗鱼内脏:江西东海食品有限公司,-20℃冻存,使用前在10℃以下用流水解冻;实验室利用鱼内脏自行发酵制备鱼露,所有鱼露样品4℃保存;酱油种曲:北京食品酿造研究所,4℃保存;NaH2PO4(分析纯),天津市大茂化学试剂厂;乙腈(色谱纯),2,4-二硝基氟苯(分析纯),章鱼胺盐酸盐(≥98%),牛磺酸(≥99%),美国Sigma公司。
1.2 仪器与设备
Agilent 1260高效液相色谱仪,美国安捷伦;KQ-250DE型数控超声波清洗器,昆山市超声仪器有限公司;HH-1数显恒温水浴锅,常州市万丰仪器制造有限公司;0.45 μm水系微孔滤膜,0.22 μm有机相微孔滤膜 上海兴亚净化材料厂;DELTA- 320型精密pH计 METTLER TOLEDO公司;UT-12型电热鼓风干燥箱,上海一恒科学仪器有限公司;HA-300MD型高压灭菌锅,Hirayama Manufacturing Corporation;TDL-5A型台式低速离心机,上海菲恰尔分析仪器有限公司;SPX-100B-Z型生化培养箱,上海博讯实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 鱼露的制备
参照周敏等[26]的方法,将草鱼和鳗鱼的内脏经分段加盐、低盐速酿的方法发酵制备鱼露。取发酵第0、5、10、15、20、25、30天的样品以及成品鱼露为样品,所有样品4 ℃冰箱保存,进行章鱼胺和牛磺酸含量的测定。
1.3.2 检测分析
1.3.2.1 色谱条件
色谱柱:SunFireTM C18(4.6 mm×150 mm,5 μm),柱温35 ℃,流动相:乙腈-0.02 mol/L的NaH2PO4溶液(40∶60),pH 7.5,流速为1.0 mol/min,紫外检测波长360 nm,进样量10 μL。
1.3.2.2 标准溶液的制备
(1)取25 mL棕色容量瓶,加入称取的0.025 0 g牛磺酸和章鱼胺标准品,用超纯水溶解并定容,制备浓度为1 mg/mL的牛磺酸、章鱼胺标准混合液。
(2)将1 mL上述标准混合液置于10 mL的容量瓶中,加入1.5 mL浓度为10 mol/L的氨水溶液,再加入0.65 %的2.4-二硝基氟苯乙腈溶液2 mL,混匀室温静置5 min。在57 ℃水浴加热10 min,加入pH 7.5的磷酸盐溶液定容,得到0.1 mg/mL的牛磺酸、章鱼胺衍生标准混合溶液。将0.1 mg/mL的混合标准溶液,用pH7.5的磷酸盐溶液稀释成0.01、0.02、0.03、0.04、0.05、0.08 mg/mL的混合标准溶液,用微孔滤膜过滤,进样10 μL,用HPLC进行检测。以混合物衍生标准溶液的浓度为横坐标,以峰面积为纵坐标,进行线性回归。本试验所有样品放4 ℃冰箱冷藏保存,有效期7 d。
1.3.2.3 样品的制备
称0.0100 g的样品,用超纯水溶于10 mL的容量瓶中混匀并定容。吸取此样品溶液0.1 mL于10的容量瓶中,同1.3.2.2(2)进行衍生处理。
1.3.3 数据分析与作图
试验结果采用平均值±标准差(mean±SD)表示,每个试验平行4次。采用SPSS对试验数据进行差异性分析(ANOVA)检查各个结果的显著性差异,同时采用Excel 2010进行数据处理。
2 结果与分析
2.1 混合物衍生标准溶液中牛磺酸及章鱼胺高效液相色谱保留时间
取1.3.2.2(2)中的混合物衍生标准溶液,按照上述色谱条件进行液相测定,得到章鱼胺及牛磺酸衍生物色谱图如图1所示,可以确定标准品衍生物的出峰时间。牛磺酸衍生物的出峰时间是在1.89 min,章鱼胺衍生物的出峰时间是在7.72 min。图2为样品溶液中章鱼胺和牛磺酸衍生物色谱图,对样品用同样的方法衍生处理、测定,色谱图中相同时间点的出峰物质即为样品中的章鱼胺和牛磺酸衍生物,由此计算样品中章鱼胺和牛磺酸的含量。

a-牛磺酸;b-章鱼胺
图1 标准品溶液中章鱼胺和牛磺酸衍生物色谱图
Fig.1 Chromatogram of octopamine and taurine derivatives in standard solution

图2 样品溶液中章鱼胺和牛磺酸衍生物色谱图
Fig.2 Chromatogram of octopamine and taurine derivatives in sample solution
2.2 牛磺酸和章鱼胺衍生的标准混合溶液线性关系
按照色谱条件对牛磺酸和章鱼胺衍生的标准混合溶液进行测定,将测得的峰面积与样品浓度绘制标准曲线。章鱼胺的质量浓度在0.01~0.1 mg/mL时与峰面积呈良好的关系,线性回归方程为y=219 812x-1 428.9,相关系数R2=0.992 6;牛磺酸的质量浓度在0.03~0.1 mg/mL时与峰面积呈良好的关系,线性回归方程为y=23 860x-202.42,相关系数R2=0.992 9。
2.3 稳定性试验
吸取样品,按上述色谱条件分别在衍生后放置0、2、4、6、8、12、24 h进样,测定其峰面积的值,结果如表1所示。样品在放置的时间段内,其测得的峰面积变化越小,说明样品越稳定,试验结果准确。章鱼胺峰面积RSD=0.053 %(n=6),牛磺酸峰面积RSD=0.027 %(n=6)。结果分析可知,样品衍生后在24 h内基本稳定。
表1 稳定性试验(n=6)
Table 1 Stability test
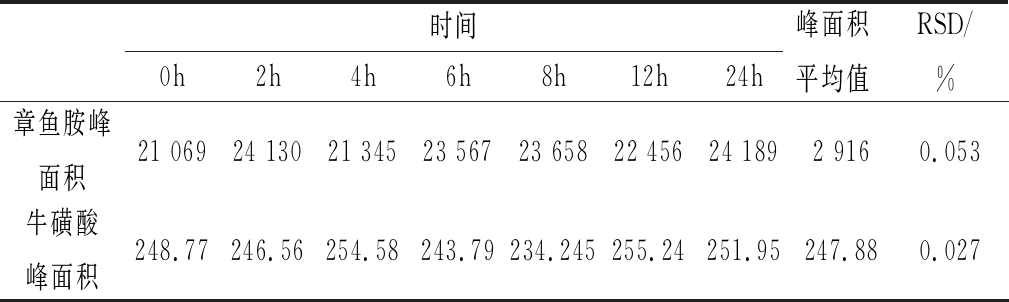
时间0h2h4h6h8h12h24h峰面积平均值RSD/%章鱼胺峰面积21 06924 13021 34523 56723 65822 45624 1892 9160.053牛磺酸峰面积248.77246.56254.58243.79234.245255.24251.95247.880.027
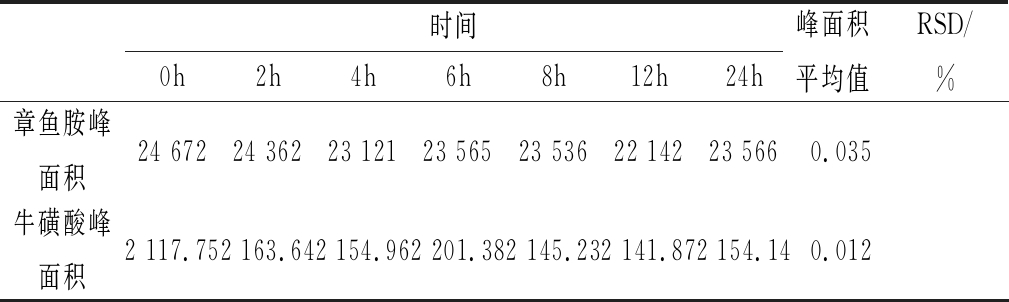
2.4 精密度试验
精密吸取衍生后的标准混合溶液,按照色谱条件,连续进样6次,记录峰面积的值,结果如表2所示。同种样品按照固定的条件进样检测,得到的结果越接近,说明仪器的精密度越好,测得的试验结果越精准。章鱼胺峰面积平均值为23 566,RSD=0.035%(n=6);牛磺酸峰面积平均值为2 154.14,RSD=0.012%(n=6),表明仪器精密度良好。
表2 精密度试验(n=6)
Table 2 Precision Test
时间0h2h4h6h8h12h24h峰面积平均值RSD/%章鱼胺峰面积24 67224 36223 12123 56523 53622 14223 5660.035牛磺酸峰面积2 117.752 163.642 154.962 201.382 145.232 141.872 154.140.012
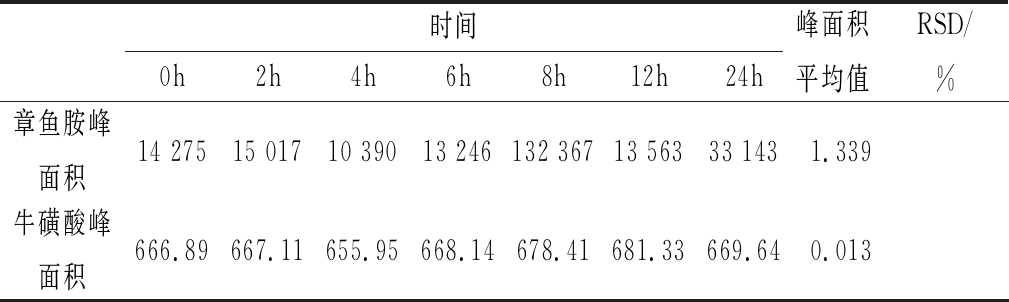
2.5 重复性试验
精密称取同样的样品六份,按照1.3进行样品制备、衍生,相同的色谱条件进行检测。试验结果如表3所示。同样的样品进行衍生处理后,如果测得出峰面积相差不大,说明本试验在操作过程中出现的误差比较小,试验结果更加准确。样品中章鱼胺的峰面积平均值为33 143,RSD=1.339 %(n=6);牛磺酸峰面积平均值669.64,RSD =0.013 %(n=6)。
表3 重复性试验(n=6)
Table 3 Repeatability test
时间0h2h4h6h8h12h24h峰面积平均值RSD/%章鱼胺峰面积14 27515 01710 39013 246132 36713 56333 1431.339牛磺酸峰面积666.89667.11655.95668.14678.41681.33669.640.013
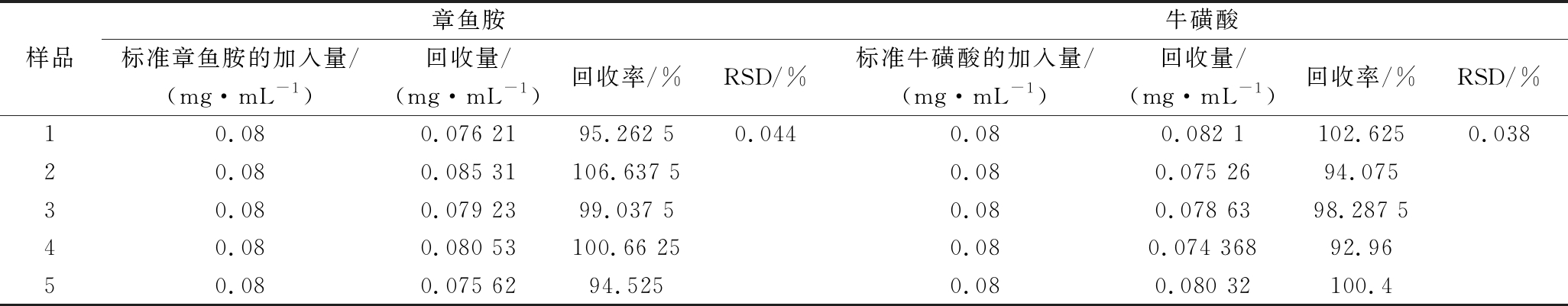
2.6 加标回收率试验
吸取已知含量的样品溶液0.2 mL,再向其中加入0.8 mL的标准混合溶液进行衍生化处理,在上述色谱条件下进行检测并计算回收率, 重复测定5次,加标回收率结果如表4所示,章鱼胺的平均回收率为99.23%,RSD =0.044%(n=5);牛磺酸的平均回收率为97.67%,RSD =0.038%(n=5)。使用高效液相色谱法测定鱼露中章鱼胺和牛磺酸的含量具有很好的适用性和可行性。
表4 加标回收率实验结果
Table 4 Test results of spiked recovery rate
样品章鱼胺牛磺酸标准章鱼胺的加入量/(mg·mL-1)回收量/(mg·mL-1)回收率/%RSD/%标准牛磺酸的加入量/(mg·mL-1)回收量/(mg·mL-1)回收率/%RSD/%10.080.076 2195.262 50.0440.080.082 1102.6250.03820.080.085 31106.637 50.080.075 2694.07530.080.079 2399.037 50.080.078 6398.287 540.080.080 53100.66 250.080.074 36892.9650.080.075 6294.5250.080.080 32100.4
2.7 鱼露样品中章鱼胺和牛磺酸含量的测定
取发酵过程中第0、5、10、15、20、25、30天以及第34 d制备的成品鱼露,测定章鱼胺和牛磺酸的含量。发酵过程中,章鱼胺含量的变化趋势如图3所示,从总体上看,鳗鱼发酵章鱼胺的含量稍高于草鱼鱼露。在发酵过程中,发酵前期章鱼胺的含量逐渐增加,发酵后期章鱼胺的含量有所下降,由于鱼露的发酵是由多种酶共同作用的结果,后期含量的下降可能是因为章鱼胺被降解为扁桃酸衍生物所引起的。发酵34 d制备的成品鱼露,草鱼鱼露中章鱼胺的含量为(6.53±0.12)mg/mL,鳗鱼鱼露中章鱼胺的含量为(7.49±0.08)mg/mL。
牛磺酸的含量变化如图4所示。在发酵的整个过程中,牛磺酸的含量基本保持不变,但草鱼鱼露中牛磺酸的含量显著高于鳗鱼鱼露。发酵成品草鱼鱼露牛磺酸的含量为(14.29±0.38)mg/mL,鳗鱼鱼露中牛磺酸的含量为(1.21±0.24)mg/mL。牛磺酸的含量不发生变化是因为在发酵的过程中牛磺酸不参与发酵反应,成品鱼露中牛磺酸的含量为原料中原本所含有的牛磺酸的含量。
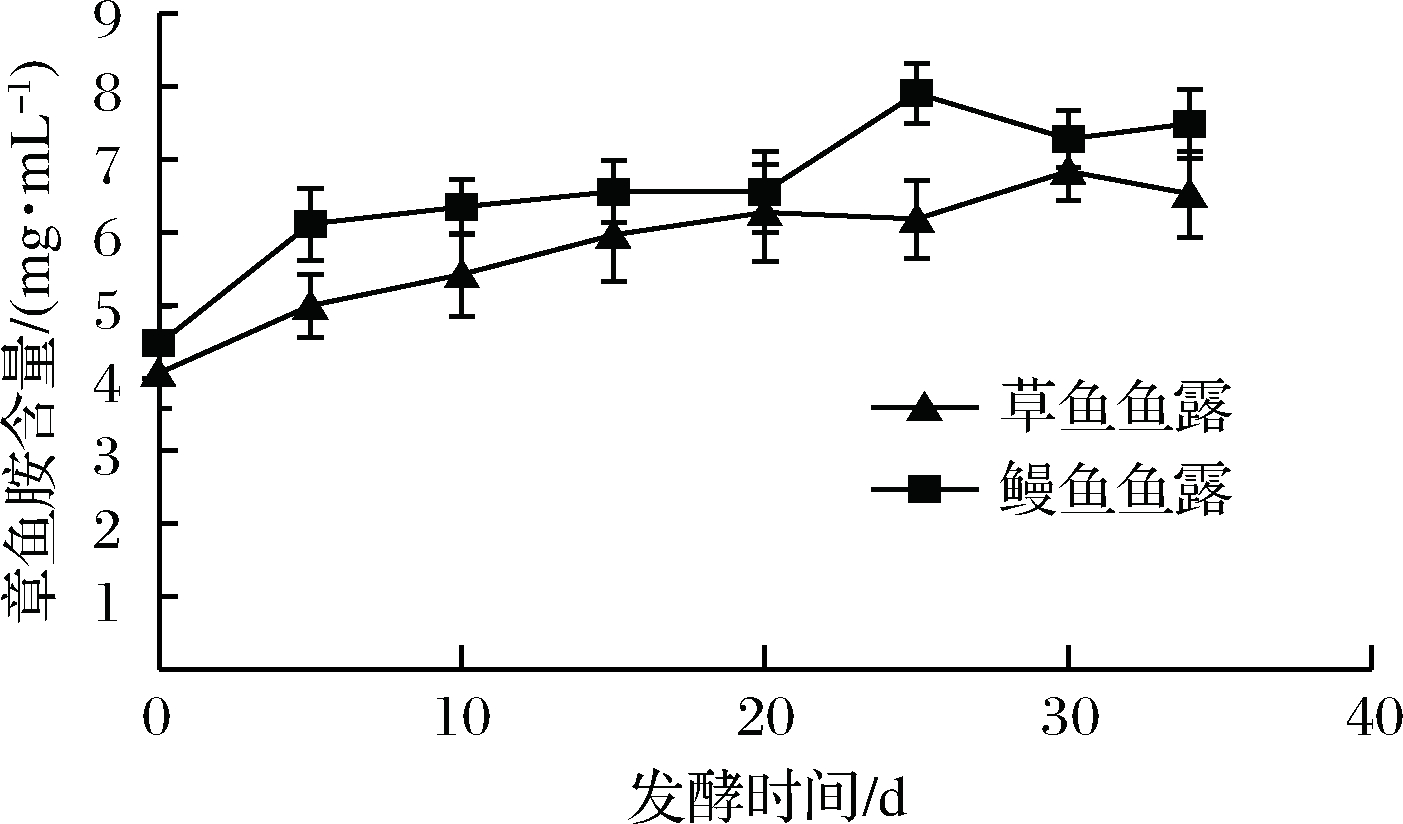
图3 发酵过程中章鱼胺含量的变化
Fig.3 Changes in octopamine content during fermentation
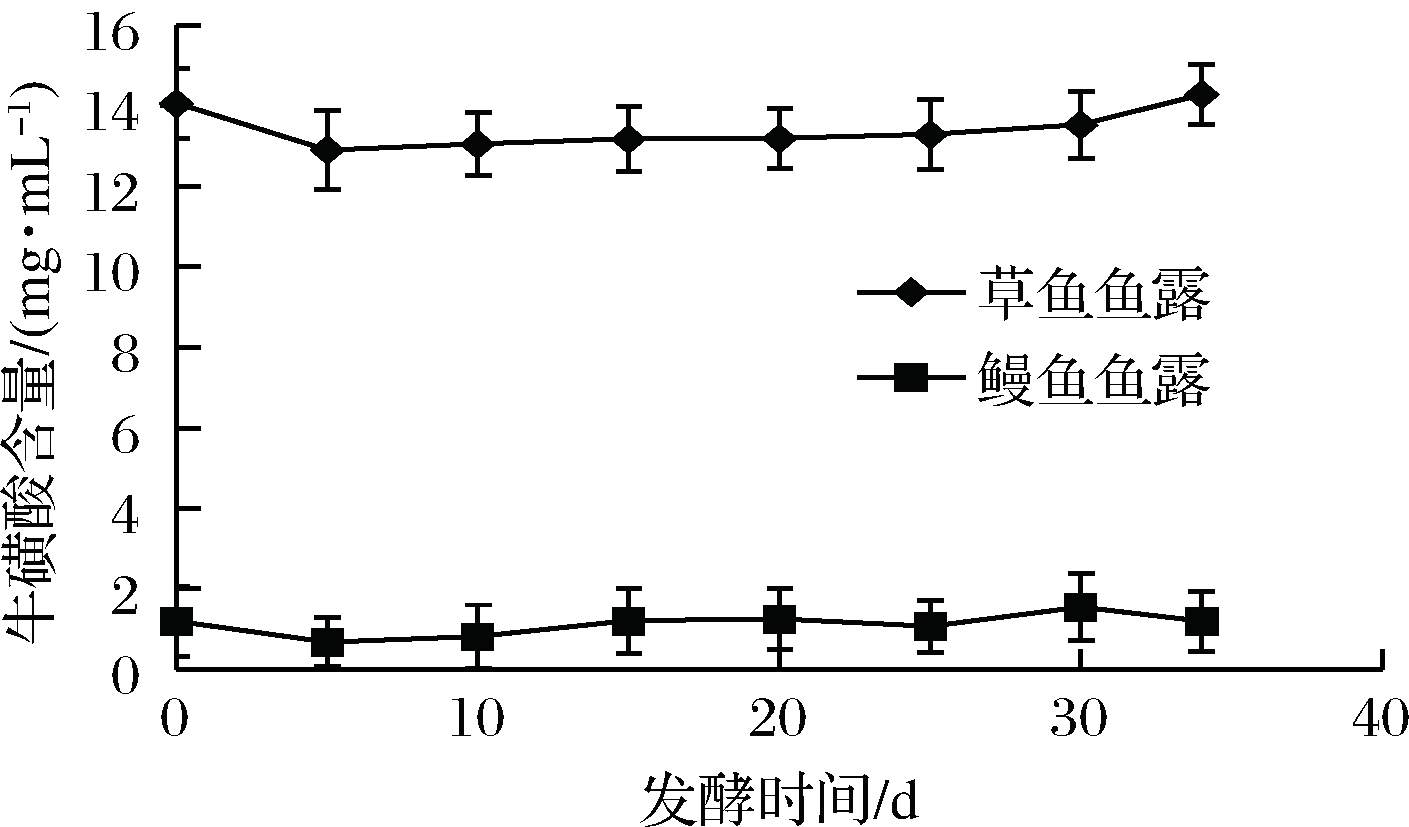
图4 发酵过程中牛磺酸含量的变化
Fig.4 Changes in taurine content during fermentation
3 结论
本试验建立了HPLC测定章鱼胺和牛磺酸含量的方法,并研究了鱼露发酵过程中章鱼胺和牛磺酸含的变化趋势。与之前的检测方法相比,该方法可以实现这两种物质同时检测,而且与以往单一的测定方法相比较,准确度有所提高。色谱条件为:色谱柱:SunFireTMC18(4.6 mm×150 mm,5 μm), 柱温35 ℃,以0.02 mol/L的NaH2PO4为流动相,pH调为7.5,流速为1.0 mol/min,紫外检测波长360 nm,进样量10 μL。鱼露发酵过程中章鱼胺含量呈现上升趋势,牛磺酸的含量基本不发生变化。发酵成品鱼露中,草鱼鱼露章鱼胺的含量为(6.53±0.12)mg/mL,鳗鱼鱼露中章鱼胺的含量为(7.49±0.08)mg/mL,草鱼鱼露牛磺酸的含量为(14.29±0.38)mg/mL,鳗鱼鱼露中牛磺酸的含量为(1.21±0.24)mg/mL。
[1] ROEDER T. Octopamine in invertebrates [J]. Progress in Neurobiology, 1999, 59(5): 533-561.
[2] 邱伟强, 陈舜胜, 王建中, 等. 人血清肾上腺素能受体激动剂章鱼胺测定方法的研究[J]. 时珍国医国药,2010,21(6):1 379-1 380.
[3] CARP N C, GALITZKY J, FONTANA E, et al. Selective activation of beta3-adrenoceptors by octopamine: comparative studies in mammalian fat cells [J]. Naunyn Schmiedebergs Arch Pharmacol, 1999, 359(4): 310-321.
[4] BOUR S, VISENTIN V, PR VOT D, et al. Moderate weight-lowering effect of octopamine treatment in obese Zucker rats [J]. Journal of Physiology & Biochemistry, 2003, 59(3): 175-182.
VOT D, et al. Moderate weight-lowering effect of octopamine treatment in obese Zucker rats [J]. Journal of Physiology & Biochemistry, 2003, 59(3): 175-182.
[5] ARCH J R S. β3 -Adrenoceptor agonists: potential, pitfalls and progress [J]. European Journal of Pharmacology, 2002, 440(2): 99-107.
[6] 潘灿平, 李维喜, 张卢军, 等. 昆虫体内章鱼胺的分布、功能及其研究进展[J]. 应用昆虫学报, 2005, 42(4): 369-374.
[7] 荣艳萍, 朱婷婷, 陈舜胜, 等. 鱼露中肾上腺素能受体激动剂章鱼胺分析方法的研究[J]. 中国海洋药物杂志, 2008, 27(1): 43-45.
[8] YU Q, ZHAO S, YE F, et al. Determination of octopamine in human plasma by capillary electrophoresis with optical fiber light-emitting diode-induced fluorescence detection [J]. Analytical Biochemistry, 2007, 369(2): 187-191.
[9] KINNIBURGH D W, BOYD N D. Determination of plasma octopamine and its level in renal disease [J]. Clinical Biochemistry, 1979, 12(1): 27-32.
[10] FEU T, LIANG T, LOU X, et al. Determination of octopamine, synephrine and tyramine in Citrus herbs by ionic liquid improved ‘green’ chromatography [J]. Journal of Chromatography A, 2006, 1125(2): 182-188.
[11] HARDIE S L, HIRSH J. An improved method for the separation and detection of biogenic amines in adult Drosophila brain extracts by high performance liquid chromatography [J]. Journal of Neuroscience Methods, 2006, 153(2): 243-249.
[12] MAO H M, CHEN B G, QIAN X M, et al. Simultaneous determination of twelve biogenic amines in serum by high performance liquid chromatography [J]. Microchemical Journal, 2009, 91(2): 176-180.
[13] IBRAHIM K E, COUCH M W, WILLIAMS C M, et al. Quantitative measurement of octopamines and synephrines in urine using capillary column gas chromatography negative ion chemical ionization mass spectrometry [J]. Analytical Chemistry, 1984, 56(9): 1 695-1 699.
[14] 曲映红. 章鱼胺的发酵制备及生物活性研究[D].上海:上海海洋大学, 2012.
[15] 郝中禹, 杨加明, 肖克权, 等. 牛磺酸的生理功能及其在猪生产中的应用[J]. 动物营养学报, 2018, 30(06):37-43.
[16] HUXTABLE R J. Physiological actions of taurine [J]. Physiological Reviews, 1992, 72(1): 101-142.
[17] SCHULLER-LEVIS G B, EUNKYUE P. Taurine: new implications for an old amino acid [J]. Fems Microbiology Letters, 2010, 226(2): 195-202.
[18] KOYAMA I, NAKAMORI K, NAGAHAMA T, et al. The Reactivity of Taurine with Hypochlorous Acid and Its Application for Eye Drops [J]. Advances in Experimental Medicine & Biology, 1996, 403(403): 9-18.
[19] LIU J, LIU L, CHEN H. Antenatal taurine supplementation for improving brain ultrastructure in fetal rats with intrauterine growth restriction [J]. Neuroscience, 2011, 181(13): 265-270.
[20] GWACHAM N, WAGNER D R. Acute effects of a caffeine-taurine energy drink on repeated sprint performance of American college football players [J]. Int J Sport Nutr Exerc Metab, 2012, 22(2): 109-116.
[21] AGOUZA I M E, EISSA S S, HOUSEINI M M E, et al. Taurine: a novel tumor marker for enhanced detection of breast cancer among female patients [J]. Angiogenesis, 2011, 14(3): 321-330.
[22] 陈秋虹, 莫建光, 黄艳. 天然牛磺酸的提取与应用[J]. 生物资源, 2011, 33(2): 43-50.
[23] 谭乐义, 薛长湖, 林洪, 等. 海洋生物中牛磺酸的生物活性及其含量测定[J]. 海洋科学, 2001, 25(1): 26-27.
[24] PETROSIAN A M, HAROUTOUNIAN J E. Taurine as a universal carrier of lipid soluble vitamins: a hypothesis [J]. Amino Acids, 2000, 19(2): 409-421.
[25] ZINELLU A, SOTGIA S, SCANU B, et al. Taurine determination by capillary electrophoresis with laser-induced fluorescence detection: from clinical field to quality food applications [J]. Amino Acids, 2009, 36(1): 159.
[26] 周敏, 吴朝朝, 杜雨芊, 等. 淡水鱼加工副产物低盐风味鱼露速酿工艺的优化[J]. 中国调味品,2017, 42(10): 11-14;19.