衰老是机体生命过程中不可避免的现象,是指生物在发育成熟后,机体组织器官随着时间推移功能逐渐衰退的过程[1-2]。机体的衰老与其生理机能以及各种病理过程存在密切的关系,如内环境稳态的失衡、自身免疫能力的下降,各组织器官发生不同程度的功能衰退等现象[3]。给小鼠连续颈脊皮下注射过量的D-半乳糖(D-galactose,D-gal)会造成动物体内代谢紊乱,产生大量自由基,打破氧化与抗氧化的动态平衡,从而导致氧化应激、认知障碍等衰老相关病理现象的发生[4]。
研究证明,肠道菌群作为胃肠道内环境稳定的重要组成部分,在维持机体健康等方面发挥着重要的作用[5]。在机体衰老的过程中,肠道屏障、营养吸收以及防御免疫功能都会发生一系列改变,综合其他外部因素如生活方式、营养摄取以及宿主免疫系统功能的影响,可导致肠道微生物生态系统发生实质性的变化[6-7],研究表明,伴随着衰老的进程,机体肠道菌群的多样性会发生改变,同时也会造成机体糖分解有关的菌群、产短链脂肪酸(short-chain fatty acids,SCFAS)菌群丰度减小以及与蛋白质分解有关的菌群增多等变化[8-10]。ZHAO等[11]研究发现,相比一般小鼠,衰老小鼠肠道菌群中的F/B(Firmicutes/Bacteroidetes)比例得到升高,衰老小鼠中各种有益菌的比例也相对于一般小鼠有所下降;此外,SALAZAR等对衰老人群的肠道菌群分析证实,与青少年相比,老年人肠道内Actinobacteria减少(特别是Bifidobacterium),而Proteobacteria增多[12]。
黄酒(Yellow rice wine,YRW)是中国特有的具有悠久历史的酿造酒,传统的黄酒主要是由谷物等原材料通过微生物半固态发酵而来,黄酒的曲法制酒和独特的双边发酵工艺,使黄酒保留了大量的功能营养成分如蛋白质、氨基酸、多肽、多糖、功能维生素等,另外在发酵过程中也会产生新的具有功能活性的物质,如多酚类物质、功能性低聚糖、活性肽等,活性物质的存在使得黄酒被认为具有保健作用,同时也被誉为“液体蛋糕”,罗铝铿等通过连续给予衰老小鼠摄入适量黄酒发现,黄酒具有延缓皮肤衰老的功效[13];ZHAO等发现持续给予适度剂量的黄酒能够增加衰老小鼠模型的免疫能力[14],除此之外,以往的研究表明黄酒还具有抗氧化、抗疲劳、抗衰老、降血压以及免疫调控的作用[15-17]。目前关于黄酒抗衰老与肠道微生物菌群之间的作用关系尚不明确,因此本研究以D-gal诱导衰老模型小鼠为对象,采用IonS5TMXL高通量测序平台对实验小鼠粪便样本中细菌16S rDNA V4区进行定性分析,比对衰老模型小鼠肠道微生物菌群的变化来探究黄酒延缓小鼠衰老与肠道微生物菌群之间的联系。
1 材料与方法
1.1 材料与试剂
黄酒样品:获取自酒类品质与安全国际联合研究中心(北京),酒精度约8%~15% vol,经过滤-4℃贮存待用。
实验动物采用SPF级昆明小鼠,雄性,12周龄,体重为(30±2)g,购自北京维通利华实验动物技术有限公司,动物许可证号:No. SCXK (京) 2016-002。饲养环境:12 h/12 h暗/光循环,(25±1)℃,相对湿度为60%,自由饮食。
超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、BCA蛋白浓度检测试剂盒,南京建成生物工程研究所;基因组DNA提取试剂盒,Omega Bio-Tek公司;D-半乳糖(分析纯),国药集团(上海)化学试剂有限公司;西班牙琼脂糖,北京索莱宝科技有限公司;Gold View(核酸染色剂),北京博奥拓达科技有限公司;其他实验相关试剂均采用国产分析纯。
1.2 仪器与设备
LDZX-50KBS高压灭菌锅,上海申安医疗器械厂;BG-sub MIDI多用途水平电泳仪、BG-Power600h电泳仪电源,上海珂淮仪器有限公司;NanoDrop 微量分光光度计,美国赛默飞世尔公司; BC-C57PCR仪、Tanon 1600凝胶成像系统,上海天能科技有限公司。
1.3 实验方法
1.3.1 动物分组及给药
将30只小鼠适应性饲养7 d后,随机分成3组,每组10只,分别为:空白对照组、模型对照组、黄酒组(YRW)。除了空白对照组其他各组采用颈脊皮下注射D-gal 300 mg/kg BW;空白对照组实验小鼠颈脊皮下注射等体积的生理盐水;黄酒组每天以8 mL/kg BW剂量灌胃饲养;空白对照组以及模型对照组则采用等体积的生理盐水灌胃,共持续42 d。实验期间观察小鼠状态,且每周据小鼠实际体重调整注射剂量。
1.3.2 动物行为学实验
Morris水迷宫实验(Morris water maze, MWM)常用来评价动物的空间定位与记忆认知的能力。MWM系统包括:一个圆形的水池(直径140 cm,高60 cm),水池内包括水深约35 cm的洁净自来水,水温控制在25℃左右;视频探头以及电脑显示屏。通常以水池为中点,均分为4个象限,在一个固定的象限内放置一个距水面1.5 cm的隐藏平台。实验设计根据SHIN等[18]的描述进行了改进,实验包括定位导航实验与探索空间测试。在定位导航实验过程中,第1天,小鼠先在无隐藏平台的水池中自由游泳60 s,从第2天开始设置平台,从一个固定象限开始,每只实验小鼠每次被训练60 s,每天接受4次训练,每次训练间隔30 min,持续5 d。在训练过程中,若小鼠在60 s内找到隐藏平台,允许其在平台上停留20 s。如果在60 s内未找到平台,则人为引导小鼠到隐藏平台停留20 s,实验过程中利用Any-maze软件记录实验动物在寻找平台过程中所需的时间(潜伏时间)。在第7天进行探索空间实验,即将平台撤去后,记录每只实验小鼠在空间中60 s内穿越原平台位置的数目、停留在目的区域(B区域)的时间以及运动轨迹。
1.3.3 样品收集
实验结束后,在无菌环境下,将每组小鼠的粪便统一采集入无菌管中,每组随机分出3个平行,置于-80℃保存。采用戊巴比妥钠对小鼠进行麻醉后,将其颈椎脱臼处死,在冰上,迅速解剖小鼠取出肝脏,利用冰生理盐水在冰浴下制成10%的组织匀浆液,离心10 min(4℃,5 000 r/min),取上清液,置于-80℃保存待测。
1.3.4 生化指标测定
分别采用相对应的试剂盒对组织匀浆中SOD、GSH-Px、CAT活性以及MDA含量进行检测,再根据BCA试剂盒所测定的匀浆蛋白浓度分别计算出相应测定值。
1.3.5 粪便DNA提取与测序
严格按照试剂盒中的方法对每组粪便中DNA进行提取,并利用nanodrop 微量分光光度计测定DNA含量后,将合格的DNA样品送至北京诺禾致源科技股份有限公司进行高通量测序。
1.3.6 数据统计与分析
利用Uparse软件 v7.0.1001对所有样品的全部 Clean Reads 进行聚类,以97%的一致性(identity)将序列聚类成为OTUs(operational taxonomic units)。使用Qiime 1.9.1软件计算Observed-otus,Chao1,Shannon,Simpson,Ace,Goods-coverage。利用SPSS 17.0进行数据分析,分析数据以平均值±标准差(Means±SEM)体现,3组以及以上数据的组间显著性差异采用单因素方差分析,并进行显著性分析,数据采用±s表示,P<0.05为差异显著。
2 结果与分析
2.1 黄酒对D-gal致衰老小鼠模型一般特征影响
当连续通过颈脊皮下注射给予D-gal后,如表1所示,与空白对照组相比,衰老模型组小鼠体重增量呈明显下降趋势(P<0.05),与模型组相比,给予黄酒的衰老小鼠体重增量得到提高(P>0.05)。给小鼠颈脊皮下注射D-gal致使小鼠在第4周开始出现脱毛现象,到第6周,衰老模型小鼠呈现出明显精神不佳,行为缓慢以及眼神涣散等现象,和ZHAO等实验结果一致[19-20]。说明了D-gal所造成的衰老对小鼠的体重正常增长存在一定的影响,适量摄入黄酒有利于改善由D-gal致衰老过程中的小鼠体重增长缓慢现象。
表1 黄酒对D-gal致衰老小鼠体重增量的影响
Table 1 Effect of YRW on weight gain of D-gal induced aging mice
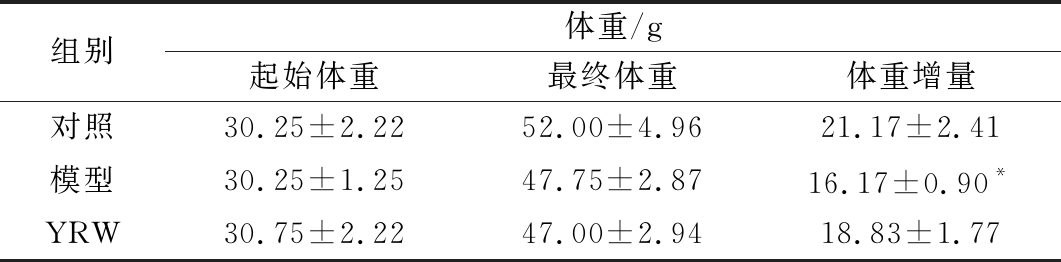
组别体重/g起始体重最终体重体重增量对照30.25±2.2252.00±4.9621.17±2.41模型30.25±1.2547.75±2.8716.17±0.90*YRW30.75±2.2247.00±2.9418.83±1.77
注:同列肩标符号“*”表示与对照相比差异显著(*P<0.05),“**”表示差异极显著(P<0.01);“#”表示与模型相比差异显著(#P<0.05)。下同。
2.2 黄酒对D-gal致衰老小鼠模型抗氧化指标的影响
研究表明,活性氧自由基(reactive oxygen species,ROS)在参与细胞信号传导与体内氧化平衡的过程中起着重要的双重作用,ROS累积生成与清除失衡会造成细胞组织器官发生氧化损伤进而导致与氧化相关疾病的发生。在抗氧化的调节中,体内的抗氧化防御系统起到了重要的作用,其中酶促抗氧化系统包括SOD、GSH-Px以及CAT等组成。如表2所示,相比空白对照组,衰老模型组小鼠的脑组织中的抗氧化酶活力显著下降(P<0.05,0.01),同时脂质氧化产物MDA的含量显著升高(P<0.05);与衰老模型组相比,摄入黄酒组衰老小鼠组脑组织SOD、GSH-Px以及CAT活力得到显著改善(P<0.05),肝组织中的SOD、GSH-Px以及CAT活力得到改善,同时MDA水平显著降低(P<0.05)。结果提示D-gal持续摄入会导致小鼠体内氧化应激,促进脂质过氧化,提示适量黄酒摄入可以提高衰老小鼠脑组织与肝脏组织的抗氧化能力,减少自由基累积,抑制脂质过氧化,使机体内MDA含量下降。
表2 黄酒对D-gal致衰老小鼠抗氧化指标的影响
Table 2 Effect of YRW on antioxidant indexes of D-gal induced aging mice
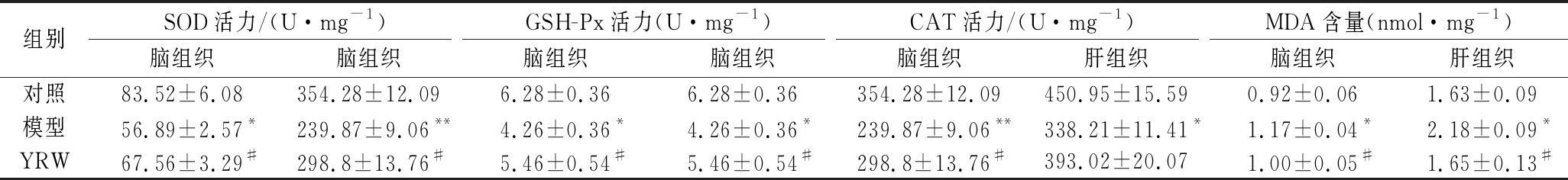
组别SOD活力/(U·mg-1)GSH-Px活力(U·mg-1)CAT活力/(U·mg-1)MDA含量(nmol·mg-1)脑组织脑组织脑组织脑组织脑组织肝组织脑组织肝组织对照83.52±6.08354.28±12.096.28±0.366.28±0.36354.28±12.09450.95±15.590.92±0.061.63±0.09模型56.89±2.57*239.87±9.06**4.26±0.36*4.26±0.36*239.87±9.06**338.21±11.41*1.17±0.04*2.18±0.09*YRW67.56±3.29#298.8±13.76#5.46±0.54#5.46±0.54#298.8±13.76#393.02±20.071.00±0.05#1.65±0.13#
2.3 黄酒对D-gal致衰老小鼠行为认知的影响
认知能力衰退是衰老过程中常见的病理现象,本研究通过Morris 水迷宫实验对实验小鼠的空间定位与学习、记忆能力进行评价。实验结果表明,在定位导航实验中,D-gal致衰老模型组小鼠的潜伏时间相比空白对照组显著(P<0.05)升高(图1),空间探索实验中,相较空白对照组衰老模型组穿越平台次数与B区域停留时间明显(P<0.05)降低(图2、图3),对比模型组,黄酒组小鼠在定位导航实验和空间探索实验中的潜伏时间、穿越平台次数以及B区域停留时间均得到明显改善(P<0.05),同时从最后一天各组小鼠游泳轨迹发现(图4),经过训练后,黄酒组小鼠到达平台的轨迹较衰老模型组更为直接。以上结果说明D-gal对实验小鼠的认知能力具有一定程度的影响,提示衰老模型造模成功,而适量的黄酒干预能够有效缓解由D-gal所致的衰老小鼠认知功能衰减。
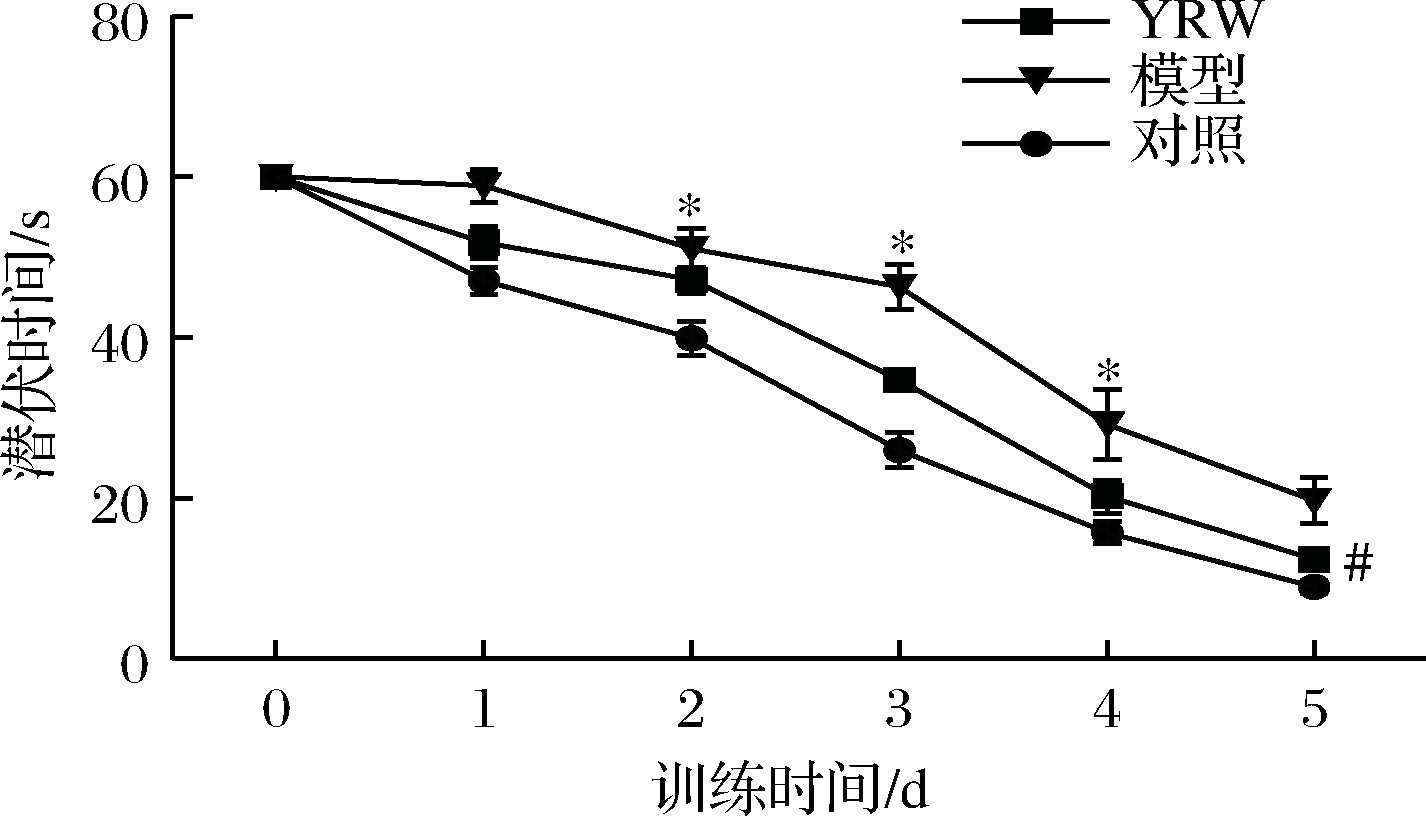
图1 小鼠在60 s内定位导航训练实验中的潜伏时间
Fig.1 Escape latency within 60 s during the 6 day learning trails
注:图中“*”表示与对照相比差异显著(P<0.05),“**”表示差异极显著(P<0.01);“#”表示与模型相比差异显著(P<0.05);“##”表示差异极显著(P<0.01)。下同。
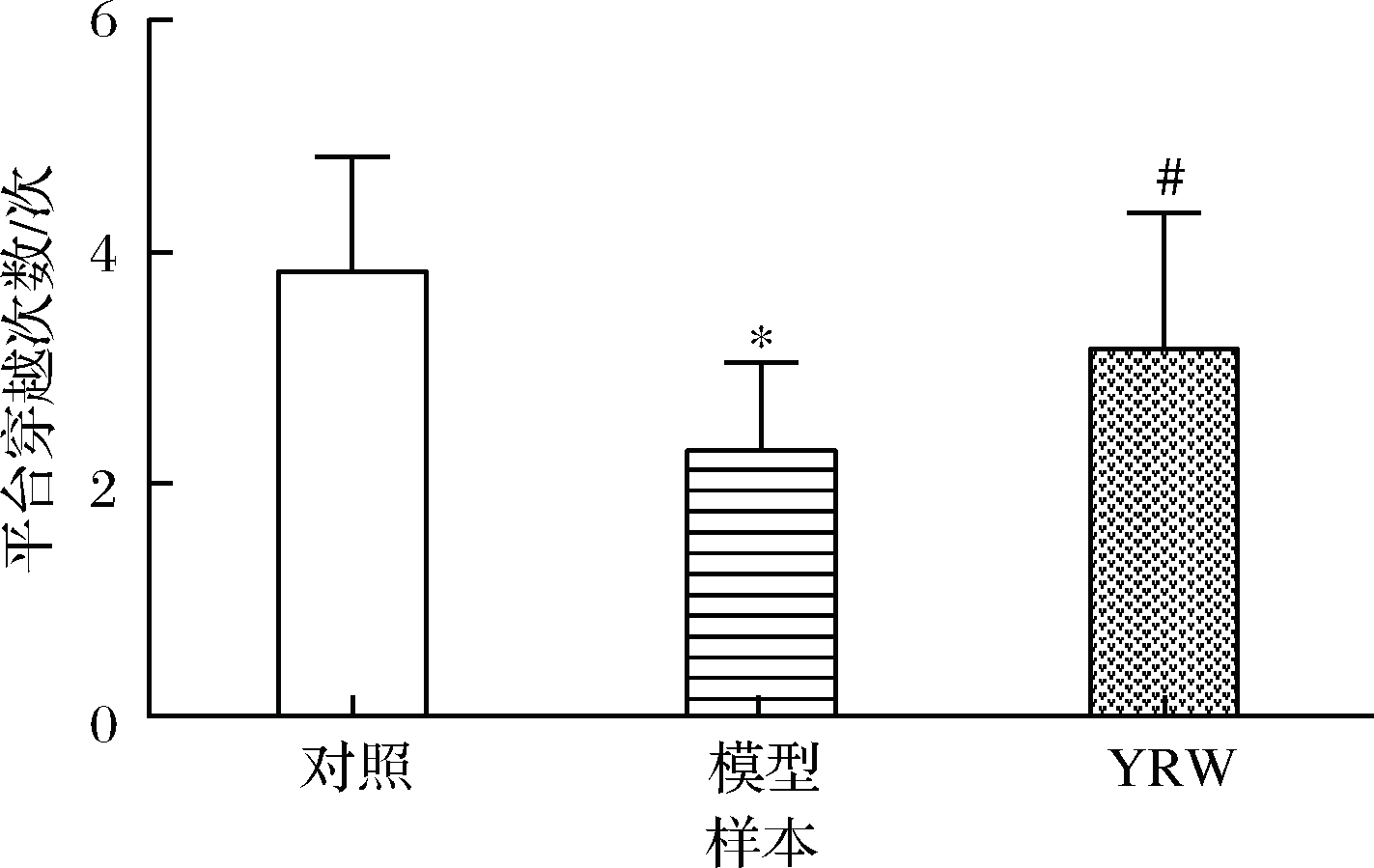
图2 小鼠在60 s内探索空间实验中的穿越平台的次数
Fig.2 The number of entries in the 60 s swim test
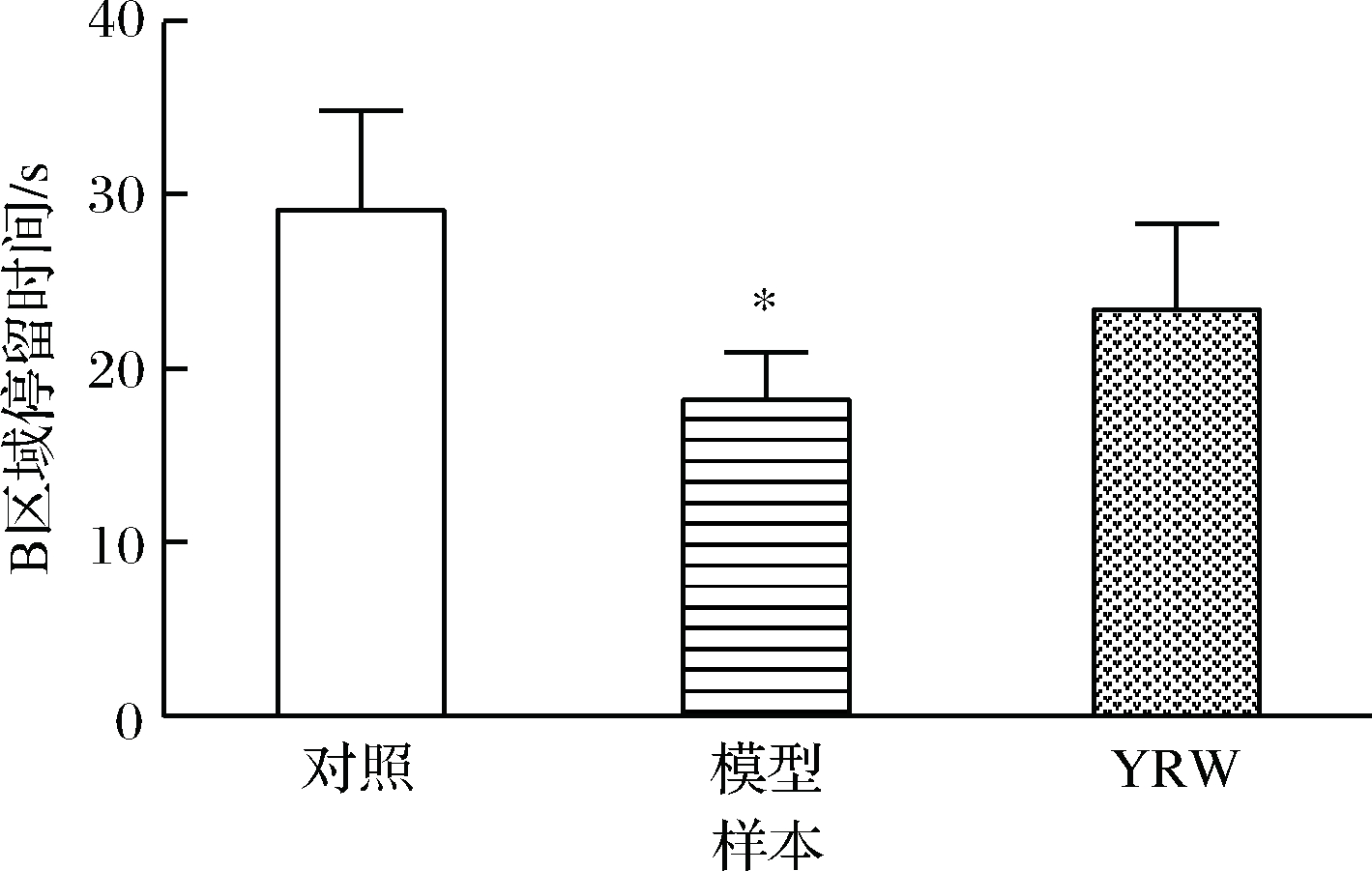
图3 小鼠在60 s内探索空间实验中的停留在目标区域的时间
Fig.3 The time spent in the target quadrant in 60 s test
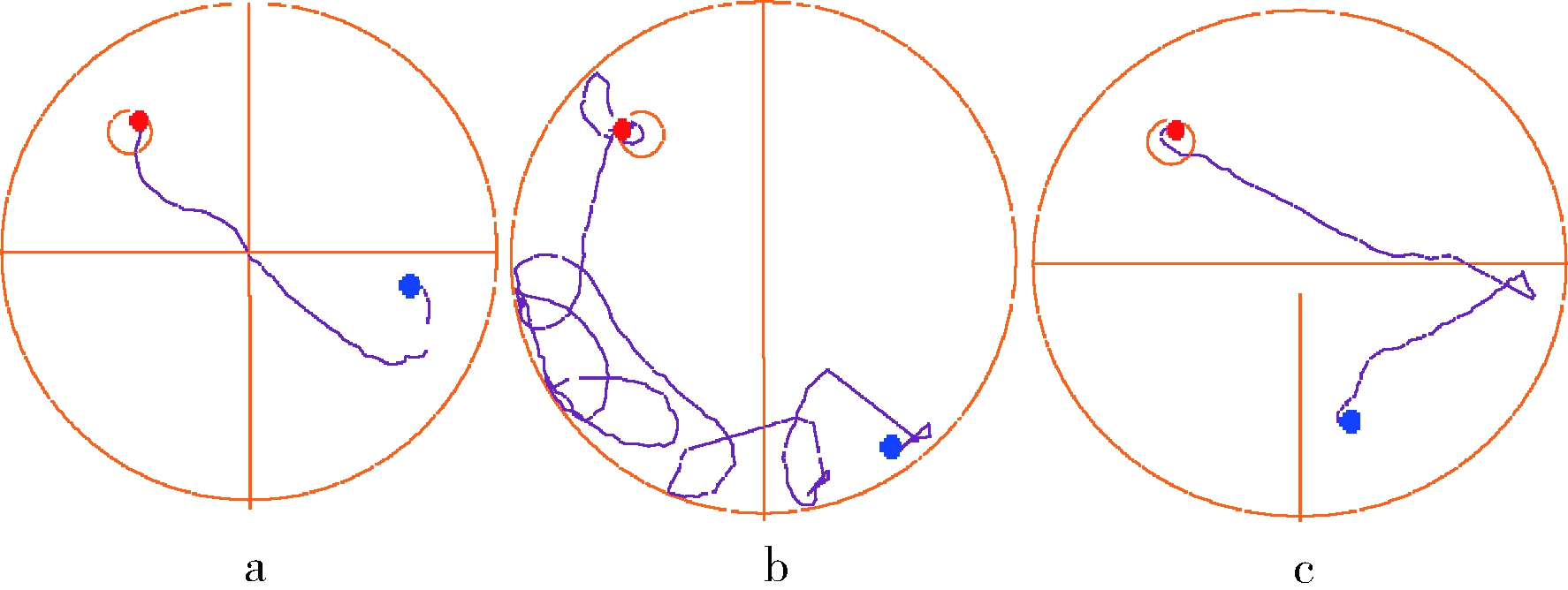
a-对照;b-模型;c-YRW
图4 小鼠在60 s内探索空间实验中的运动轨迹
Fig.4 The swim track of founding the hidden platform of the last training on the last day
2.4 黄酒对D-gal致衰老小鼠模型肠道微生物物种丰度及多样性影响
如表3所示,发现在所有样品中,OUT数目最多的是衰老模型组(686),其次是空白对照组(646),黄酒最少(630),表明本研究实验小鼠粪便中的菌群丰富度均可观。如图5所示,基于OUT水平发现在无度量多维标定法分析图上,衰老模型组和空白对照组样本显著分离,表示D-gal对小鼠肠道微生物菌群结构组成有较明显的影响,黄酒组与空白对照组相距相对而言较近,表明黄酒干预后衰老小鼠模型的肠道菌群结构有改善。
在Alpha多样性分析中,Chao1和Ace指数是反映菌群丰富度的重要指标,Shannon指数和Simpson指数反映菌群多样性,如表3所示,与空白组相比,模型组的Chao1(703)、Ace(699)和Shannon(7.37)指数最高,Simpson(0.967 3)指数最低(P<0.05),这说明D-gal致衰老小鼠的肠道微生物菌群结构发生了显著的变化。当衰老小鼠摄入黄酒后,肠道菌群OUT数得以调整,Chao1、Ace和Shannon指数得到显著下降,Simpson指数也得到相应的回升,提示黄酒干预有助于衰老小鼠肠道菌群结构一定程度的改善。Good-coverage指数代表样品的测序深度,本研究中测序覆盖深度均大于0.99,故样品序列未被检测到的几率较低,说明数据具有可靠性。同时,由图6可知,随着测序样本量的增加,各组的物种数量也随着增大,曲线逐渐趋向平坦,表明测序所用数据量具有合理性。
表3 各组样品肠道菌群多样性指数
Table 3 Diversity of intestinal microbiota in different groups

样品名菌群OUT数Chao1AceShannonSimpsonGoods-coverage对照6466676666.770.976 60.998模型686*703*699*7.37*0.967 3*0.997YWR630#649#652#6.57#0.973 30.997

图5 小鼠肠道菌群多样性NMDS分析
Fig.5 Non-metric multi-dimensional scaling of intestinal flora for different samples
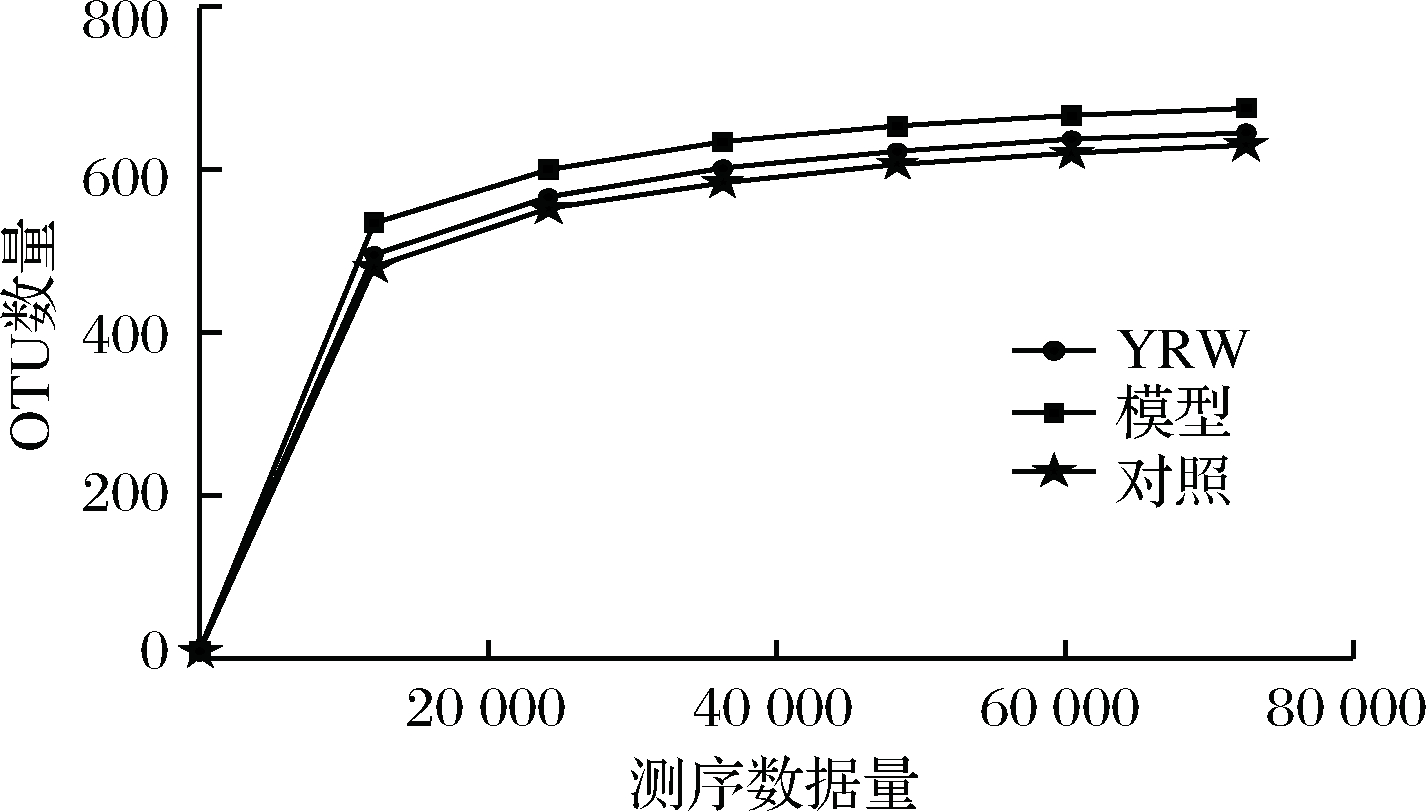
图6 样本测序数量
Fig.6 The number of sample sequence
2.5 黄酒对D-gal致衰老小鼠肠道菌群水平相对丰度的影响
对实验小鼠各组粪便样品细菌16S rRNA基因V4区序列进行测序,利用Mothur和SILVA132的SSUrRNA数据库对得到的有效OUT进行计算和分析,分别对样品肠道菌群门(phylum)与属(genus)水平组成进行统计分析。如图7所示,空白对照组、衰老模型组以及黄酒组的肠道菌群在门水平上都以Firmicutes和Bacteroidetes为主,各组相对丰度分别为23.59%和57.26%、35.81%和42.55%、21.78%和59.26%。
如图8所示,对3组粪便样品进行菌群属水平分析。空白对照小鼠组粪便中包含有Bacteroides、unidentified_Lachnospiraceae、Bifidobacterium等多个菌属。衰老模型小鼠组主要包含的菌属有Bacteroides、unidentified_Lachnospiraceae、Blautia、Butyricioccus等,黄酒样品组的粪便中主要有Bacteroides、unidentified_Lachnospiraceae、Butyricioccus、Lactobacillus等菌属。
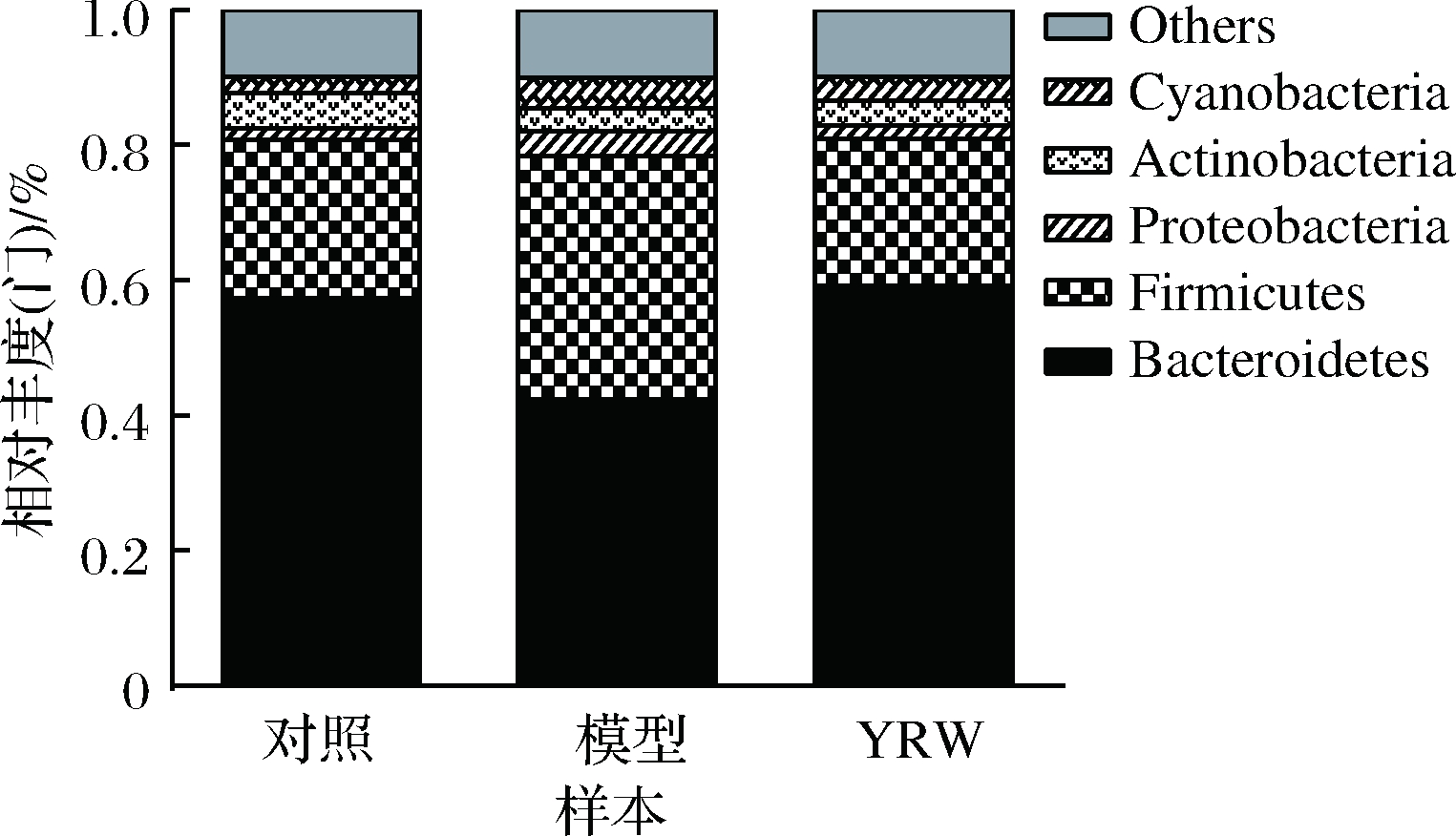
图7 各样本肠道菌群门水平相对丰度
Fig.7 Abundance of dominant intestinal bacterial at the phylum in mice
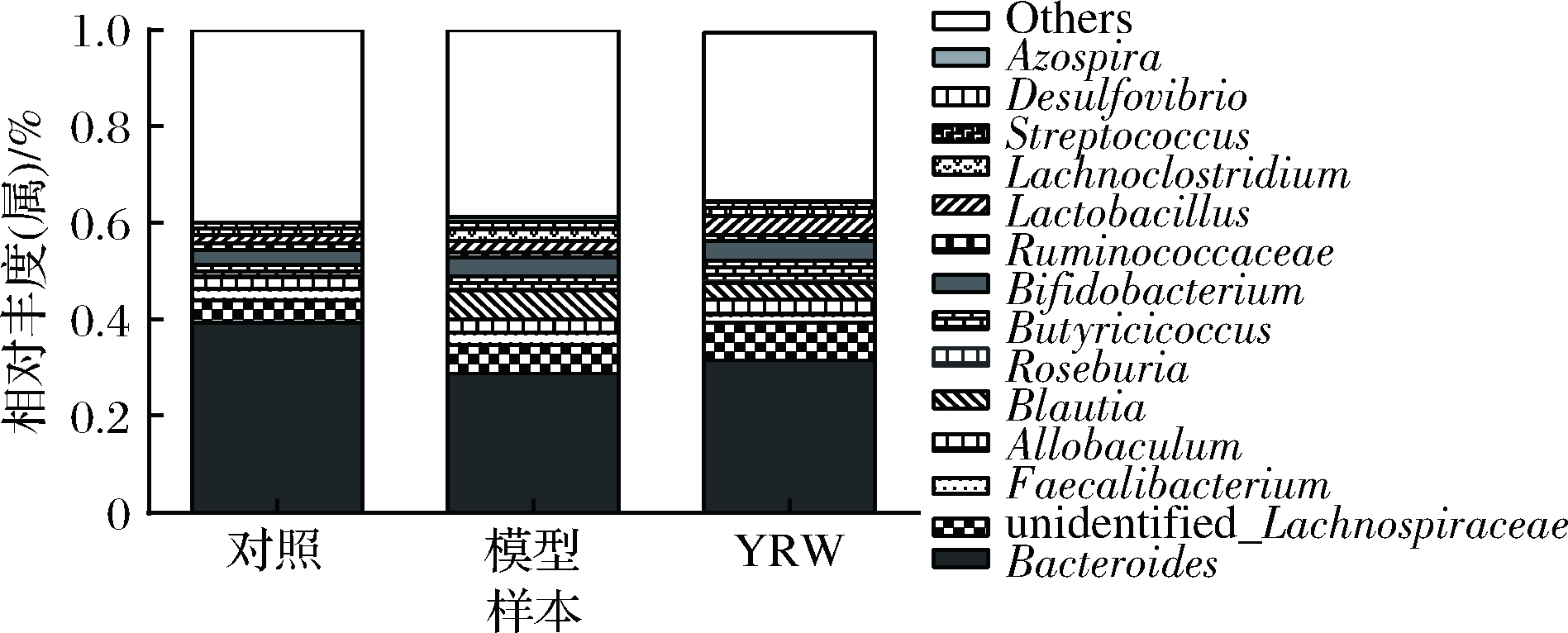
图8 各样本肠道菌群属水平相对丰度
Fig.8 Abundance of dominant intestinal bacterial at the genus in mice
2.6 黄酒对D-gal致衰老小鼠肠道差异菌群的影响
如图9所示,与空白对照组相比,衰老模型组中F/B显著上升(P<0.05),该结果与訾雨歌[10]、ZHAO[11]和ZHANG等[20]研究结果一致。通过黄酒干预后,衰老小鼠肠道菌群F/B值得到改善,逐渐接近空白对照组。如图10所示,通过进一步分析3组实验小鼠肠道菌群的差异性发现存在5种显著差异的菌属,与空白对照组相比,经过D-gal诱导后衰老模型组小鼠Bacteroides相对丰度显著下降,而unidentified_Lachnospiraceae、Blautia、Butyricioccus的相对丰度得到显著上升(P<0.05、0.01)。与衰老模型组小鼠的粪便菌群相比,经过黄酒干预,衰老模型小鼠肠道菌群内Bacteroides、unidentified_Lachnospiraceae、Butyricioccus、Lactobacillus、Bifidobacterium相对丰度显著升高(P<0.05),同时Blautia显著降低(P<0.05)。
3 讨论
衰老是生命过程中无法避免的现象,在衰老过程中通常伴随着不同程度的神经退行症状,会导致认知、学习记忆功能的损伤,衰老也与ROS的过量累积密切相关[21-22]。ROS作为胞内信号因子参与蛋白磷酸化到转运系统的各个途径和网络,但是过量的ROS会导致机体脂质过氧化、蛋白质氧化以及DNA突变等现象,从而造成氧化损伤,导致各种相关病理情况的出现[3, 23]。本研究发现在黄酒干预下,D-gal致衰老模型体重增长缓慢的情况有所缓解,且肝组织、脑组织中的SOD、GSH-Px、CAT等抗氧化酶活力得到显著改善,同时脂质过氧化物MDA的水平含量显著降低。黄酒是由粮食谷物通过微生物发酵而来,其含有丰富的抗氧化功能成分,适量的黄酒能够有效清除衰老过程中累积的自由基以及过氧化物等,达到抗氧化的目的,从而为延缓衰老的进程带来积极影响。
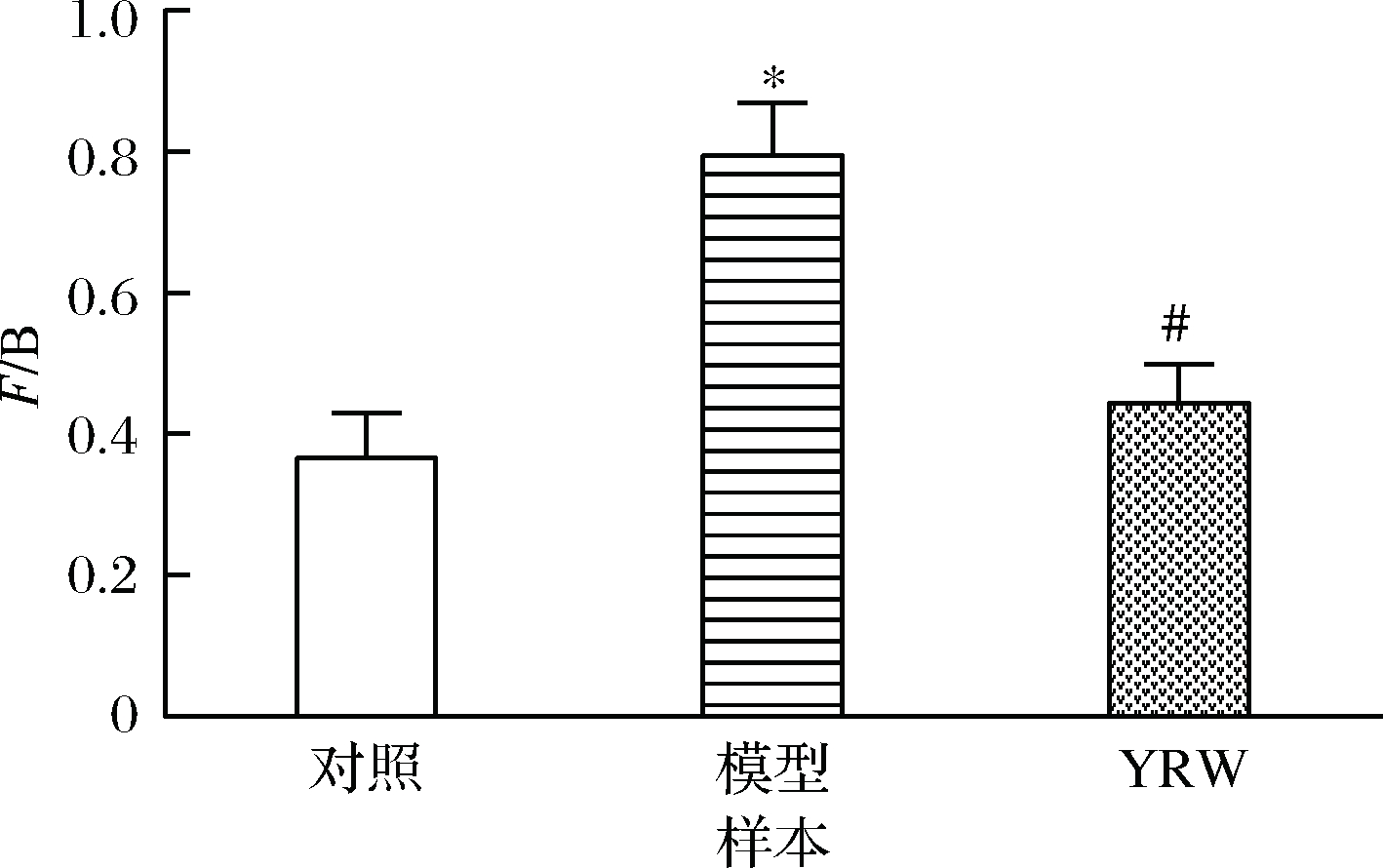
图9 黄酒对衰老小鼠肠道F/B值的影响
Fig.9 Effect of YRW on F/B ratio in mice
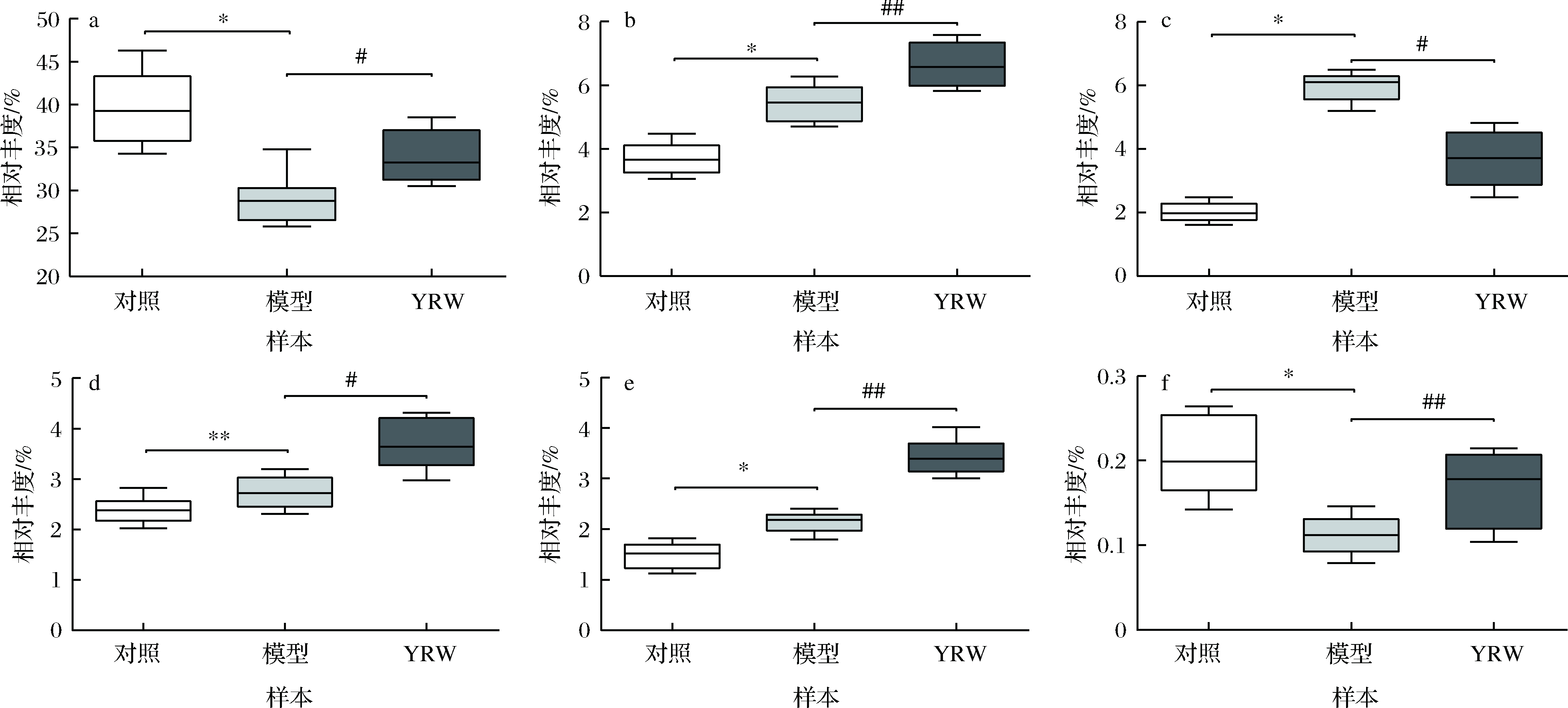
a-Bacteroides;b-unidentified_Lachnospiraceae;c-Blautia;d-Butyricicoccus;e-Lactobacillus;f-Bifidobacterium
图10 小鼠肠道差异性菌属
Fig.10 Differential genus of gut microbiota in mice
肠道微生物菌群是一个极其复杂的生态系统,被称为机体的“第二基因组”,与机体健康存在密切的联系[24]。随着研究的不断深入,肠道微生物菌群在生物体中发挥的作用得到广泛认可[7],更有研究证明了肠道微生物对大脑发育和脑部功能具有重要影响[25-26]。本研究结合行为学实验与高通量测序技术发现,与模型组相比,适量黄酒干预对衰老小鼠的学习与记忆能力有显著改善,以及发现黄酒组小鼠肠道菌群Firmicutes中的Lactobacillus和Bacteroidetes中的Bacteroides相对丰度相比衰老组明显增加,结果提示这种菌群结构的改变与衰老过程中的认知障碍改善存在一定的联系。研究表明,特异性菌种丰度改变与神经递质的含量变化存在一定相关性,![]() 等发现乳酸菌能够通过代谢谷氨酸产生γ-氨基丁酸(r-aminobutyric acid,GABA)[27];GABA在中枢神经系统中是一种重要的抑制型神经递质,具有保护认知的功能[28],当肠道微生物菌群中乳酸菌发生变化时与GABA水平变化具有一定相关性,可能对学习认知功能产生调节作用,从而抵抗衰老过程中的产生的认知障碍[29-30]。除此之外,Bacteroides在碳水化合物以及蛋白质代谢的途径中发挥着重要的作用,被认为与减少卡路里的摄入有关[31],有研究证明低卡路里摄取与延缓脑衰老存在一定的相关关系[32]。
等发现乳酸菌能够通过代谢谷氨酸产生γ-氨基丁酸(r-aminobutyric acid,GABA)[27];GABA在中枢神经系统中是一种重要的抑制型神经递质,具有保护认知的功能[28],当肠道微生物菌群中乳酸菌发生变化时与GABA水平变化具有一定相关性,可能对学习认知功能产生调节作用,从而抵抗衰老过程中的产生的认知障碍[29-30]。除此之外,Bacteroides在碳水化合物以及蛋白质代谢的途径中发挥着重要的作用,被认为与减少卡路里的摄入有关[31],有研究证明低卡路里摄取与延缓脑衰老存在一定的相关关系[32]。
本研究发现相比衰老模型组,在黄酒干预的D-gal致衰老模型小鼠肠道菌群中unidentified -Lachnospiracea和Butyricicoccus的相对丰度得到增加。unidentified -Lachnospiracea和Butyricicoccus都被证明是与短链脂肪酸(SCFAs)产生相关的菌属[33-34],SCFAs特别是丁酸能够刺激黏膜免疫反应[35],一定程度上能够缓解衰老所过程中肠道炎症[34,36],同时SCFAs能够通过调节肠道pH值,抑制有害菌生长,稳定肠道内环境,进一步改善衰老过程中肠道微生物菌群的失衡状态,从而起到延缓衰老的作用。黄酒中成分复杂多样,如多肽类、多糖类以及酚类物质等均很丰富,除了直接被人体吸收的部分以外,那些不能被直接吸收的成分及肠肝循环回收的化合物会到达大肠, 通过肠道微生物群进行广泛的代谢,与肠道微生物菌群相互作用,对机体产生影响。具体是黄酒中哪些成分有效调控肠道菌群,还需要进一步地深入研究分析。
4 结论
本研究结果表明,适量黄酒摄入能够增加衰老实验小鼠组织抗氧化酶活性,同时,通过高通量测序技术对D-gal致衰老小鼠粪便中肠道菌群进行宏基因组分析以及结合行为学实验结果发现,摄入适量黄酒能够改善衰老小鼠的肠道微生物菌群组成结构,以及改善衰老小鼠的学习认知障碍;同时增加了肠道微生物菌群中产丁酸类有益菌的相对丰度,一定程度上有利于SCFAs的产生,维持肠道内环境的平衡与稳定,助于延缓衰老。
[1] GOTO M,IWAKI-EGAWAS,WATANABEY.Ageing in werner syndrome[J].Bioscience Trends,2012,6(1):33-37.
[2] CEVENINI E,CARUSO C,CANDORE G,et al.Age-related inflammation:The contribution of different organs, tissues and systems. How to face it for therapeutic approaches [J].Curr Pharm Des,2010,16(6):609-618.
[3] SCHIFFRIN E J,MORLEY J E, DONNET-HUGHES A, et al.The inflammatory status of the elderly:The intestinal contribution[J].Mutation Research/Fundamental & Molecular Mechanisms of Mutagenesis,2010,690(1-2):50-56.
[4] XU L Q,XIE Y L,GUI S H,et al.Polydatin attenuates D-galactose-induced liver and brain damage through its anti-oxidative, anti-inflammatory and anti-apoptotic effects in mice[J].Food Funct,2016,7(11):4 545-4 555.
[5] VONMARTELS J Z H,SADABAD M S,BOURGONJE A R,et al.The role of gut microbiota in health and disease:In vitro modeling of host-microbe interactions at the aerobe-anaerobe interphase of the human gut[J].Anaerobe,2017,44(3):3-12.
[6] CHASSARD C,LACROIX C.Carbohydrates and the human gut microbiota[J].Curr Opin Clin Nutr Metab Care,2013,16(4): 453-460.
[7] VAISERMAN A M,KOLIADA A K,MAROTTA F.Gut microbiota:A player in aging and a target for anti-aging intervention[J].Ageing Research Reviews,2017,35:36-45.
[8] DENG,LI Y, ZHAO J.The gut microbiome of healthy long-living people[J].Aging(Albany NY)2019,11(2):289-290.
[9] BISCHOFF S C.Microbiota and aging[J].Current Opinion in Clinical Nutrition & Metabolic Care,2016,19(1):26-30.
[10] 訾雨歌,徐越,肖瀛,等.原花青素B2对D-半乳糖模型小鼠肠道菌群的影响[J].食品科学, 2019,40(9):146-151.
[11] ZHAO J,TIAN F,YAN S,et al.Lactobacillus plantarum CCFM10 alleviating oxidative stress and restoring the gut microbiota in D-galactose-induced aging mice[J].Food & Function,2018,9(2):917-924.
[12] SALAZAR N,VALD S-VARELA L,GONZ
S-VARELA L,GONZ LEZ S,et al.Nutrition and the gut microbiome in the elderly[J].Gut Microbes,2017,8(2):82-97.
LEZ S,et al.Nutrition and the gut microbiome in the elderly[J].Gut Microbes,2017,8(2):82-97.
[13] 罗铝铿,邹浩元,姚海荣,等.客家黄酒延缓皮肤衰老作用的研究[J].酿酒科技,2017(3):121-123.
[14] ZHAO P,WANG J,ZHAO W,et al.Antifatigue and antiaging effects of Chinese rice wine in mice[J].Food Science & Nutrition,2018,6(8):2 386-2 394.
[15] 张元,白卫东,刘功良.黄酒生物活性成分及其功能研究进展[J].中国酿造,2017,36(7):5-9.
[16] 王家林,张颖,于秦峰.黄酒中生物活性成分的探讨[J].酿酒科技,2011(7):47-50.
[17] 王璟,秦雪,仝令印,等.黄酒对小鼠抗疲劳能力和衰老小鼠免疫器官的影响[J].食品科学,2016,37(21):224-228.
[18] SHIN H Y,PARK S J,SEO S W,et al.Gamibojungikki-tang decreases immobility time on the forced swimming test and increases interferon-γ production from MOLT-4 cells[J].Journal of Ethnopharmacology,2005,102(1):113-119.
[19] ZHAO H,LI J,ZHAO J,et al.Antioxidant effects of compound walnut oil capsule in mice aging model induced by D-galactose[J].Food & Nutrition Research,2018:62.
[20] ZHANG H,LI Y,CUI C,et al.Modulation of gut microbiota by dietary supplementation with tuna oil and algae oil alleviates the effects of D-galactose-induced ageing[J].Applied Microbiology & Biotechnology,2018,102(6):2 791-2 801.
[21] VIGNERON A,VOUSDEN K H.p53,ROS and senescence in the control of aging[J].Aging (Hbany NY),2010,2(8):471-474.
[22] HARRAAN D.Aging:A theory based on free radical and radiation chemistry[J].J Gerontol,1956,11(3):298-300.
[23] FORMAN H J.Redox signaling: An evolution from free radicals to aging[J].Free Radic Biol Med,2016,97:387-407.
[24] CONG X,HENDERSON W A,GRAF J,et al.Early life experience and gut microbiome:The brain-gut-microbiota signaling system[J].Advances in Neonatal Care Official Journal of the National Association of Neonatal Nurses,2015,15(5):314.
[25] SUDO N,CHIDA Y,AIBA Y.Gut feelings:the emerging biology of gut-brain communication[J].Nature Reviews Neuroscience,2011,12(8):453-466.
[26] SUDO N,CHIDA Y,AIBA,et al.Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice[J].J Physiol,2010,558(1):263-75.
![]() T K L,HERMANN N,MAZZOTTAP M,et al.GABAergic function in Alzheimer's disease: Evidence for dysfunction and potential as a therapeutic target for the treatment of behavioural and psychological symptoms of dementia[J].Canadian Journal of Psychiatry Revue Canadienne De Psychiatrie,2004,49(7):439-453.
T K L,HERMANN N,MAZZOTTAP M,et al.GABAergic function in Alzheimer's disease: Evidence for dysfunction and potential as a therapeutic target for the treatment of behavioural and psychological symptoms of dementia[J].Canadian Journal of Psychiatry Revue Canadienne De Psychiatrie,2004,49(7):439-453.
[28] MCKERNAN R M,WHITING P J.Which GABA A -receptor subtypes really occur in the brain?[J].Trends in Neurosciences,1996,19(4):139-143.
[29] OHSAWA K,UCHIDA N,OHKI K,et al.Lactobacillus helveticus-fermented milk improves learning and memory in mice[J].Nutritional neuroscience,2015,18(5):232-240.
[30] MESSAOUDI M,LALONDE R,VIOLLE N,et al.Assessment of psychotropic-like properties of a probiotic formulation (Lactobacillus helveticus R0052 and Bifidobacterium longum R0175) in rats and human subjects[J].British Journal of Nutrition,2011,105(5):755-764.
[31] ARUMUGAM M,RAES J,PELLETIER E,et al.Addendum:Enterotypes of the human gut microbiome[J].Nature,2011,473(7 346):174.
[32] MARTIN B,MATTSON M P,MAUDSLEY S.Caloric restriction and intermittent fasting:Two potential diets for successful brain aging[J].Ageing Research Reviews,2006,5(3):332-353.
[33] ZHANG J,GOO Z,XUE Z,et al.A phylo-functional core of gut microbiota in healthy young Chinese cohorts across lifestyles,geography and ethnicities[J].Isme Journal Multidisciplinary Journal of Microbial Ecology,2015,9(9):1 979-1 990.
[34] WANG T,CAI G,QIU Y,et al.Structural segregation of gut microbiota between colorectal cancer patients and healthy volunteers[J].The ISME Journal,2012,6(2):320-329.
[35] DEN BESTEN G,VAN EUNEN N,et al.The role of short-chain fatty acids in the interplay between diet,gut microbiota,and host energy metabolism[J].Journal of Lipid Research,2013,54(9):2 325-2 340.
[36] SALONEN A,LAHTI L,SALOJ RVI J,et al.Impact of diet and individual variation on intestinal microbiota composition and fermentation products in obese men[J].The ISME Journal,2014,8(11):2 218-2 230.
RVI J,et al.Impact of diet and individual variation on intestinal microbiota composition and fermentation products in obese men[J].The ISME Journal,2014,8(11):2 218-2 230.