乳液是食品中常见的分散体系,其对食品品质形成、风味改善、营养素消化吸收控制,以及活性成分生物利用度提升等方面具有重要作用[1-2]。乳液是动力学不稳定体系,需要依赖乳化剂防止破乳或乳析。与磷脂、吐温等水溶性乳化剂制备的常规乳液不同,皮克林乳液是依靠固体粒子稳定的分散体系[3]。这些固体粒子的尺寸一般在微米级或纳米级,能在油-水界面上形成不可逆粒子吸附层,并借助粒子间强毛细管作用使皮克林乳液保持稳定[4-5]。构建食品级皮克林乳液的关键是开发新型颗粒乳化剂并探究对其乳液的稳定机理。2001年,ANTON等[6]率先报道了蛋黄颗粒稳定的皮克林乳液(油相分数φ=0.3),并采用透射电子显微镜观测到蛋黄颗粒在油滴上形成的吸附层。随后食品级皮克林乳液研究十分活跃,已报道的食品级皮克林颗粒可分为四类:多糖类颗粒(淀粉颗粒[5]、纳米纤维素[7]、几丁质纳米晶体[8]、壳聚糖纳米颗粒[9]等),蛋白质类颗粒(玉米醇溶蛋白[10]、小麦醇溶蛋白[11]、大豆蛋白[12]、铁蛋白等[13])、脂质颗粒[14]以及其他纳/微颗粒[15-16]。有些皮克林乳液已经应用于风味包埋[17]、活性成分递送[7, 18]、功能性食品设计[19-20]等领域。
当前,果蔬加工残渣资源化利用度低,向食品中直接添加会造成口感粗糙,降低食品品质[21]。常通过改性将其转化为水溶性组分,或采用超微粉碎技术得到超细化粉体来提升加工特性[22-23]。NUSHTAEVA研究发现肉桂粉(添加量5%)可制备稳定的皮克林乳液(平均粒径78 μm),且兼具抗氧化和抗菌特性[24]。JOSEPH等采用高能磨、高压微射流处理得到微米级可可粉颗粒,其添加量2.5%,油含量20%时,制备的皮克林乳液静置存放90 d液滴尺寸无显著变化[25]。LU等报道了研磨对市售纤维素水不溶性颗粒Sigmacell Cellulose Type 20的乳化能力的影响,超细化处理后,纤维素水不溶性颗粒的粒度从10~90 μm下降到38~671 nm,可制备得到粒径40~60 μm的皮克林乳液,存放30 d未发生显著失稳现象[26]。上述研究对加工残渣为起始材料的颗粒乳化剂开发起到了借鉴作用。本文采用高能磨处理豆渣得到超细化颗粒,研究其作为皮克林乳液稳定剂的特性,并探讨pH、离子强度等环境因素对乳液稳定性的影响。
1 材料与方法
1.1 原料及试剂
湿豆渣,实验室自制,反复水洗去除可溶性组分后,60 ℃热风干燥,粉碎过120目钢筛备用;玉米油(福临门非转基因压榨),中粮集团有限公司;NaCl,NaOH,浓HCl,均为分析纯,重庆川东化工(集团)有限公司。
1.2 仪器与设备
Labstar实验室砂磨机,德国Netzsch-Geratebau GmbH公司;JEM 1200EX透射电子显微镜,日本电子株式会社;PHS-3C型pH计,上海仪电科学仪器股份有限公司;T25数显型高速分散机,德国IKA集团;Sartorius电子天平,北京赛多利斯仪器系统有限公司;BX53生物显微镜,日本OLYMPUS株式会社;5810型台式高速离心机,德国艾本德股份公司;Mastersize2000激光粒度分析仪,英国马尔文公司;MCR302高级流变仪,奥地利安东帕公司。
1.3 方法
1.3.1 超细化豆渣制备
采用Labstar型实验室砂磨机对豆渣进行湿磨。条件为:研磨介质ZetaBeads(0.4 mm),研磨功率3 kW,研磨速度34 00 r/min,理论循环指数18/h,研磨溶剂为去离子水,料液比1∶10,研磨腔体温度通过水循环保持在25 ℃以下。分别在120、240、480、720 min时取出料液,备用。
1.3.2 超细化豆渣基本组成分析
超细化豆渣中蛋白质含量按照GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法测定;脂肪含量按照GB 5009.6—2016《食品中脂肪的测定》中的索氏抽提法测定;灰分含量按照GB 5009.4—2016《食品中灰分的测定》的方法测定;总膳食纤维、可溶性膳食纤维和不溶性膳食纤维含量参考GB 5009.88—2014《食品中膳食纤维的测定》测定。
1.3.3 超细化豆渣结构及悬浮性质表征
将超细化湿豆渣加去离子水稀释10倍,在超声波清洗器中分散10 min,得到质量分数为1%的浆液,倒入量筒中静置,考察其悬浮稳定性;另吸取少许滴加在铜网上,空气中自然干燥,用JEM 1200EX透射电子显微镜观测豆渣颗粒的显微结构;吸取1 mL稀释后的浆液放入样品池中,采用Mastersize2000型激光粒度分析仪测定粒度及ζ-电位[27]。
1.3.4 皮克林乳液制备
将超细化豆渣浆液加去离子水稀释、超声分散调整为不同质量分数(0.2%~1.2%),加入玉米油,采用T25数显型高速分散机12 000 r/min高速分散2 min,得到超细化豆渣稳定的皮克林乳液[24-25]。并考察水/油、pH及离子强度(NaCl)对皮克林乳液稳定性的影响。
1.3.5 皮克林乳液表征及分析
皮克林乳液液滴形貌采用生物显微镜观测:乳液制备完毕后,取中间层乳液1~2滴置于洁净的载玻片上,不盖盖玻片,观测模式BF,于4倍生物显微镜下观测,获取乳液的显微镜照片;通过Nano Measurer软件统计分析液滴粒径。
皮克林乳液的乳析指数计算[13]:将20 mL新鲜乳液移至直径为2 cm的平底试管中,加入0.02%(m/V)的NaN3防止微生物生长,试管口包上2层保鲜膜以防止乳液中的水分挥发。室温静置,定期测量乳液分层的样品底部清液层的高度(HS),根据公式(1)计算乳液的乳析指数(creaming index,CI),HT为乳液总高度。
(1)
皮克林乳液流变学分析[27]:采用MCR302型流变仪,测量温度恒定在25 ℃,平板间距1 mm,剪切速率0~500 s-1,记录乳液表观黏度(Pa·s)、剪切应力(Pa)随剪切速率变化情况。
1.3.6 数据计算及统计分析
所有数据至少重复测定3 次,结果以平均值±标准偏差表示,采用Origin 8.0作图,采用SPSS 18.0进行单因素方差分析,设置P<0.05为具有显著性差异。
2 结果与分析
2.1 超细化豆渣的结构及物性
2.1.1 超细化豆渣的显微结构
由图1可知,湿磨后豆渣呈不规则形状,其尺寸随着湿磨时间延长(120~480 min)而减小,但480 min和720 min两个研磨时间的样品的粒度无显著差异,说明Labstar型实验室砂磨机存在粉碎极限,超细化豆渣的粒度为0.5~3 μm。豆渣质地坚硬,对其粉碎程度与所采用的设备及能量输入有关[21-28]。ULLAH等[27]采用德国Netsch-Geratebau公司的MINI ZETA 03E型高速湿磨机结合热处理,可使豆渣不溶性膳食纤维颗粒的粒径减小到298.12 nm。

A-湿磨120 min;B-湿磨240min;C-湿磨480min;D-湿磨720min
图1 湿磨120~720 min的豆渣颗粒透射电镜照片(比例尺5 μm)
Fig.1 TEM images of okara particulates by wet grinding for 120-720 minutes
2.1.2 超细化豆渣的基本组成
由表1可知,湿磨对豆渣中蛋白质、脂肪、灰分、总膳食纤维的含量无显著影响;但是超细化豆渣中可溶性膳食纤维的比例显著增加(P <0.05),表明豆渣在湿磨过程中,一些亲水性组分从颗粒中解聚出来,或者由于湿磨剪切产生高压的机械化学作用使得不溶性组分发生降解,转化为可溶性组分[21, 27]。
表1 常规粉碎豆渣及超细化豆渣化学组成比较 单位:g/100g干重
Table 1 Chemical composition of conventional pulverized okara particulates and ultra-fine ones

成分蛋白质脂肪灰分总膳食纤维不溶性膳食纤维可溶性膳食纤维常规粉碎豆渣22.4±2.0a10.8±1.4a4.1±0.43a56.3±2.2a51.1±3.5a5.2±1.2a超细化豆渣(湿磨480 min)21.5±1.3a11.4±1.7a3.8±0.31a58.0±2.9a40.7±3.1b17.3±2.2b
注:表中数据为平均值±标准差,同一列不同小写字母表示不同样品之间差异显著(P<0.05)。
2.1.3 超细化豆渣的悬浮特性
由图2可见,超细化豆渣悬液均匀细腻,具有良好的分散稳定性;而常规粉碎的豆渣颗粒呈淡黄色,在水相中容易沉降。原因在于超细化处理大幅度降低了豆渣颗粒的粒度,且在豆渣颗粒周围包裹着亲水性物质(图1),这种结构增加了豆渣颗粒的水力学尺寸[29],赋予体系更高的黏度[21]。
超细化豆渣悬液采用1 mol/L HCl或1 mol/L NaOH调节pH值为3~8,采用Mastersize2000激光粒度分析仪测定粒度和ζ-电位(25 ℃)。由图3-A可知,pH值对超细化豆渣的分散性指数(PDI)的影响较小,但是超细化豆渣的平均粒径受pH值的影响较大。在pH=6时平均粒径达最小值(1.34 μm),之后随着水相酸度增加而增大,pH=3时平均粒径增加88%。中性及弱碱性条件(pH=7~8)下,平均粒径略有增加但不显著(P>0.05),这一现象与大豆蛋白质在等电点处溶解性最差这一特性类似。原因在于水相pH影响着颗粒表面的电荷频率,从而影响颗粒的水合状态,最终影响到豆渣在水相中悬浮的水力学尺寸[11]。由图3-B可知,豆渣颗粒的ζ-电位为负值,说明颗粒表面带有带负电荷的基团(如羧酸根)[27, 30];ζ-电位随着pH值增加而降低,绝对值增加,表明豆渣在中性及弱碱性条件下颗粒表面电荷去屏蔽化,分散性更好,更加稳定[27]。

A-超细化豆渣;B-普通粉碎豆渣
图2 配制质量分数1%的豆渣颗粒悬液,静置15min后外观
Fig.2 Digital images of 1% okara particulate suspensions observed after 15 minutes settlement
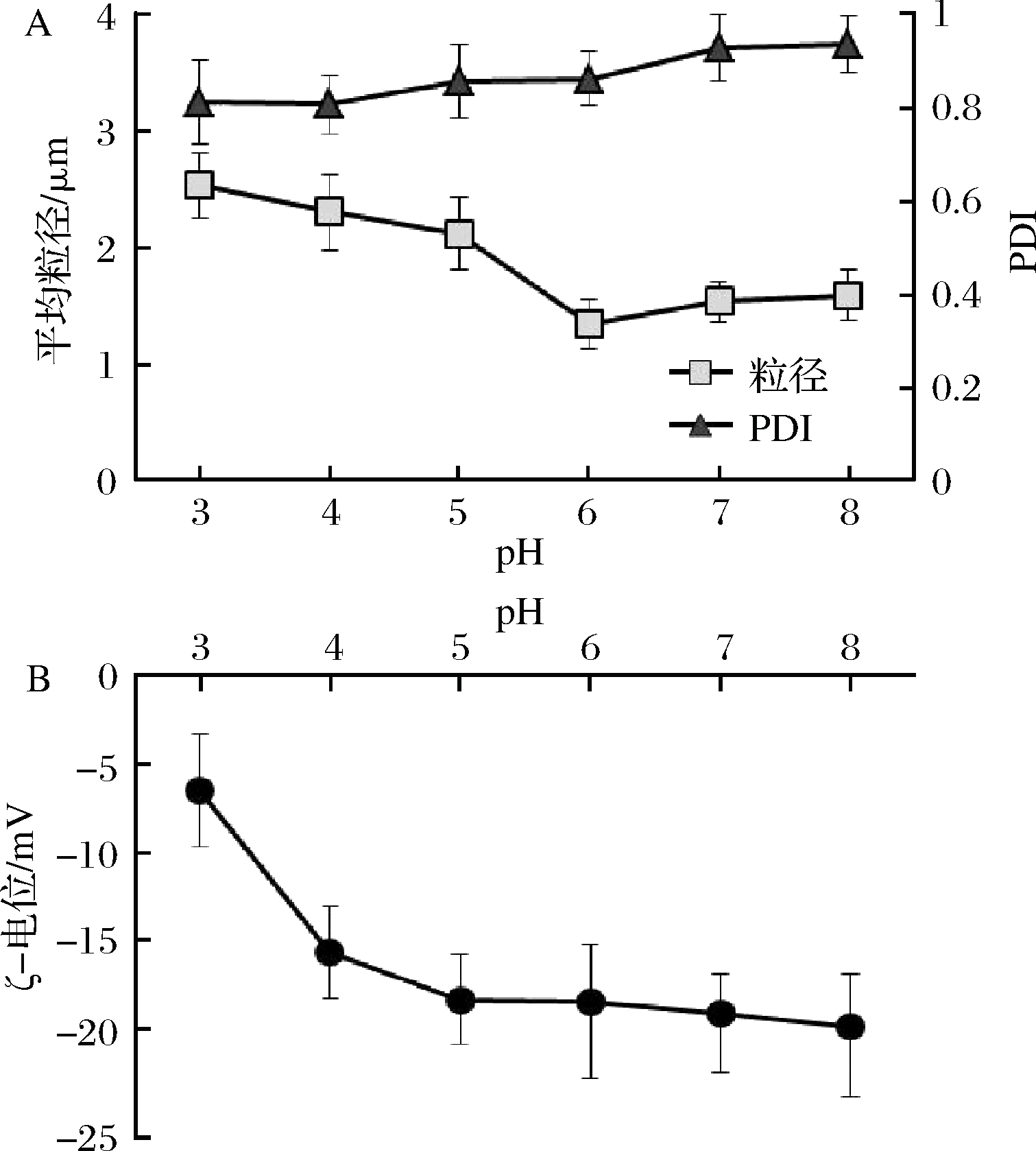
A-豆渣颗粒粒径及分散性指数(PDI);B-豆渣颗粒悬液ζ-电位
图3 水相pH对悬液中豆渣颗粒特性的影响
Fig.3 The effect of aqueous pH on the properties of okara particulate suspensions
2.2 超细化豆渣添加量对乳液形成及稳定性的影响
皮克林的制备与传统乳液的制备方法相似,都是借助于机械搅拌或高速剪切使分散相形成液滴,均匀分布在连续相中,乳化剂吸附或分布在界面形成稳定的乳液[3-5]。由图4-A可知,当油相分数φ=0.6保持不变,随着豆渣颗粒添加量增加,乳液层体积随之增加,且乳液层的稳定性增加。水相中豆渣颗粒质量分数为0.2%时,静置1 d乳析指数为36.11%;为0.8%时,乳析指数减小至15.00%。由图4-B可知,豆渣颗粒质量分数为0.2%时乳液液滴平均粒径较大,且在1~30 d存放期内平均粒径显著增加(P<0.05),随着豆渣颗粒添加量增加乳液液滴随之减小,且乳液变得稳定。豆渣颗粒质量分数0.4%~1.2%的样品,1~30 d未见油析出,乳析指数未发生显著变化,表明豆渣颗粒不可逆地吸附在液滴界面上,并形成了稳固的空间壁垒,使乳液保持稳定[24, 31]。图5为乳液液滴的显微镜照片,直观反映制备乳液液滴显微结构随豆渣颗粒添加量的变化。值得注意的是,除了豆渣颗粒质量分数为0.2%的乳液液滴尺寸在贮藏期内增加,其他添加量下制备的乳液均具有较好的稳定性。

A-乳液外观;B-乳液液滴平均粒径随时间(1 d、7 d、30 d)变化情况
图4 豆渣颗粒添加量对乳液稳定性的影响
Fig.4 The stability of emulsions with different mass percentage of okara particulates
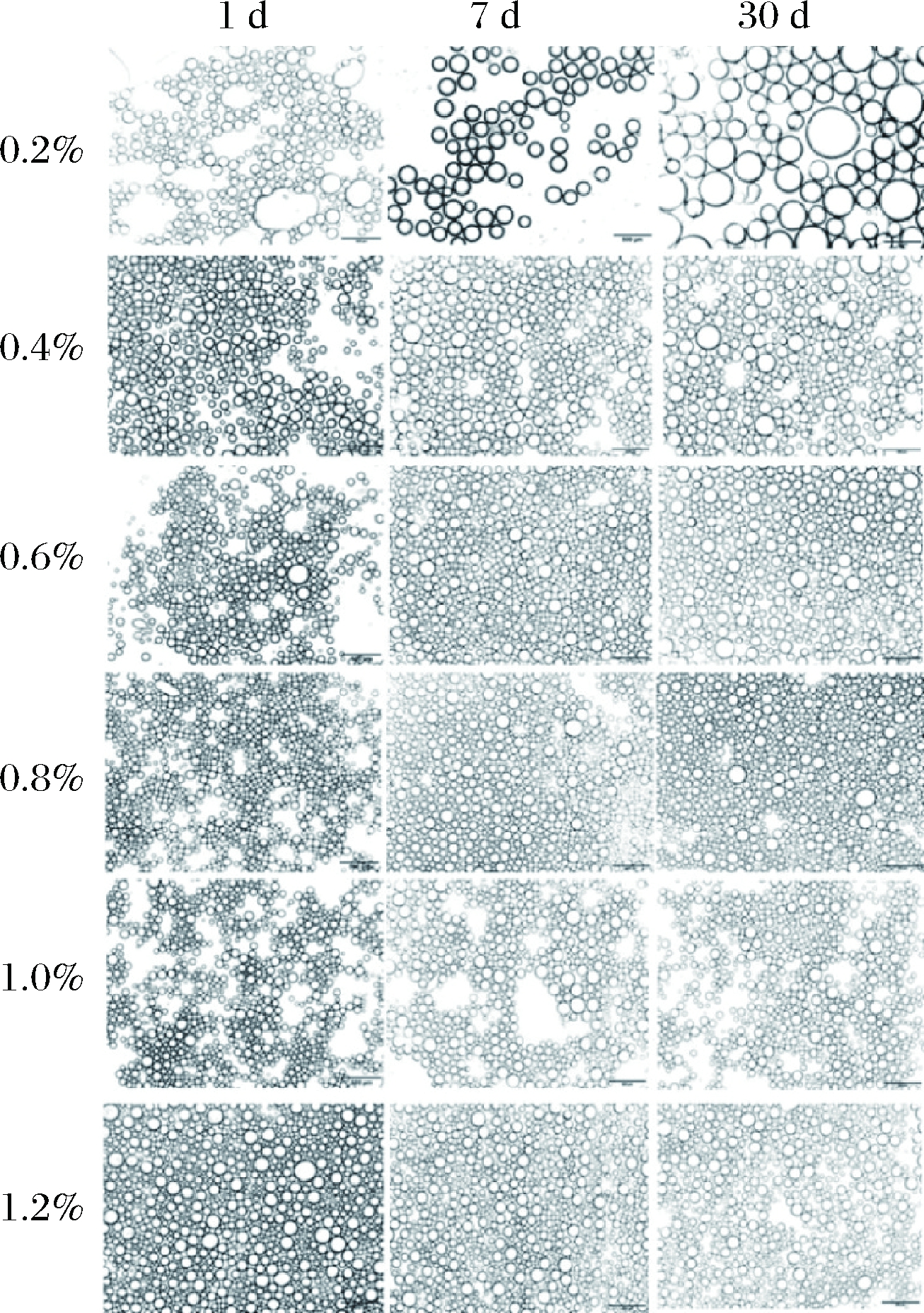
图5 三个贮藏时间(1 d、7 d、30 d)的乳液液滴粒径与豆渣颗粒质量分数的关系图(比例尺500 μm)
Fig.5 The relationship between the droplet size and the percentage of okara particulate at different storage time (1d, 7d and 30d)
2.3 油相分数对乳液形成及稳定性的影响
水相与玉米油的总体积(20 mL)及水相中豆渣颗粒质量分数(1%)均保持不变,当水油体积比依次为8∶2、7∶3、6∶4、5∶5、4∶6、3∶7,与之对应的玉米油与豆渣颗粒的比例依次为25.0∶1、42.8∶1、66.7∶1、100∶1、150∶1、233∶1(mL∶g)。由图6-A可知,乳液平均粒径随着玉米油占比的增加而增加,原因在于油相分数增加时,分散相界面总面积增加,而豆渣颗粒相对比例在减少,只得形成较大尺寸液滴以减小比表面积,以尽量覆盖油滴表面[13]。由图6-B可知,当水油体积比为8∶2时,体系含16 mL水相,4 mL油相,乳化后取出乳液静置,1 d内乳析指数为46%,即乳液层和下层清液约各占一半,约1/4体积的水参与了乳液形成;随着体系中水相比例减小,乳析指数随之下降,主要是下层清液体积减小以及乳液层体积占比增加所致。所有实验组在贮藏期内未观测到乳析指数的大幅变化,表明乳液一旦形成即具有良好的稳定性[4, 7]。
2.4 水相pH对皮克林乳液稳定性的影响
为考察pH对乳液稳定性的影响,油相分数(φ=0.6)及豆渣颗粒质量分数(1%)保持不变,调节水相pH=3~8,高速分散(12 000 r/min,2 min)得到样品,静置7 d后的外观照片如图7-A所示。乳析指数在pH=3时最小,且随着pH增加持续增加。由图7-B可知,乳液液滴在pH=3~4时具有最小的粒度,平均粒径为40~43 μm,乳液液滴随pH增加而增大,pH=7时平均粒径为145.2 μm,pH=8时平均粒径为95.4 μm。图8为不同pH下的乳液液滴的显微镜照片,直观反映制备乳液液滴显微结构随pH的变化。结果表明,1~30 d,制备乳液的油滴尺寸在酸性条件(pH=3~6)变化不显著,即油滴大小在乳液制备时就已确定,乳液在静置时能保持较好的稳定性。原因在于水相中豆渣颗粒ζ-电位随pH升高越来越负,通过静电斥力作用使吸附界面具有较高的电荷频率,从而有助于乳液稳定[32]。另一方面,豆渣颗粒悬液中存在的可溶性膳食纤维能增加体系黏度并与吸附层相互作用形成网络结构,该结构有助于固定液滴[26, 33]。值得指出,pH=7时乳液的油滴尺寸最大,这可能是该条件下豆渣颗粒表面的亲水亲油平衡值不利于乳液形成[24-25]。
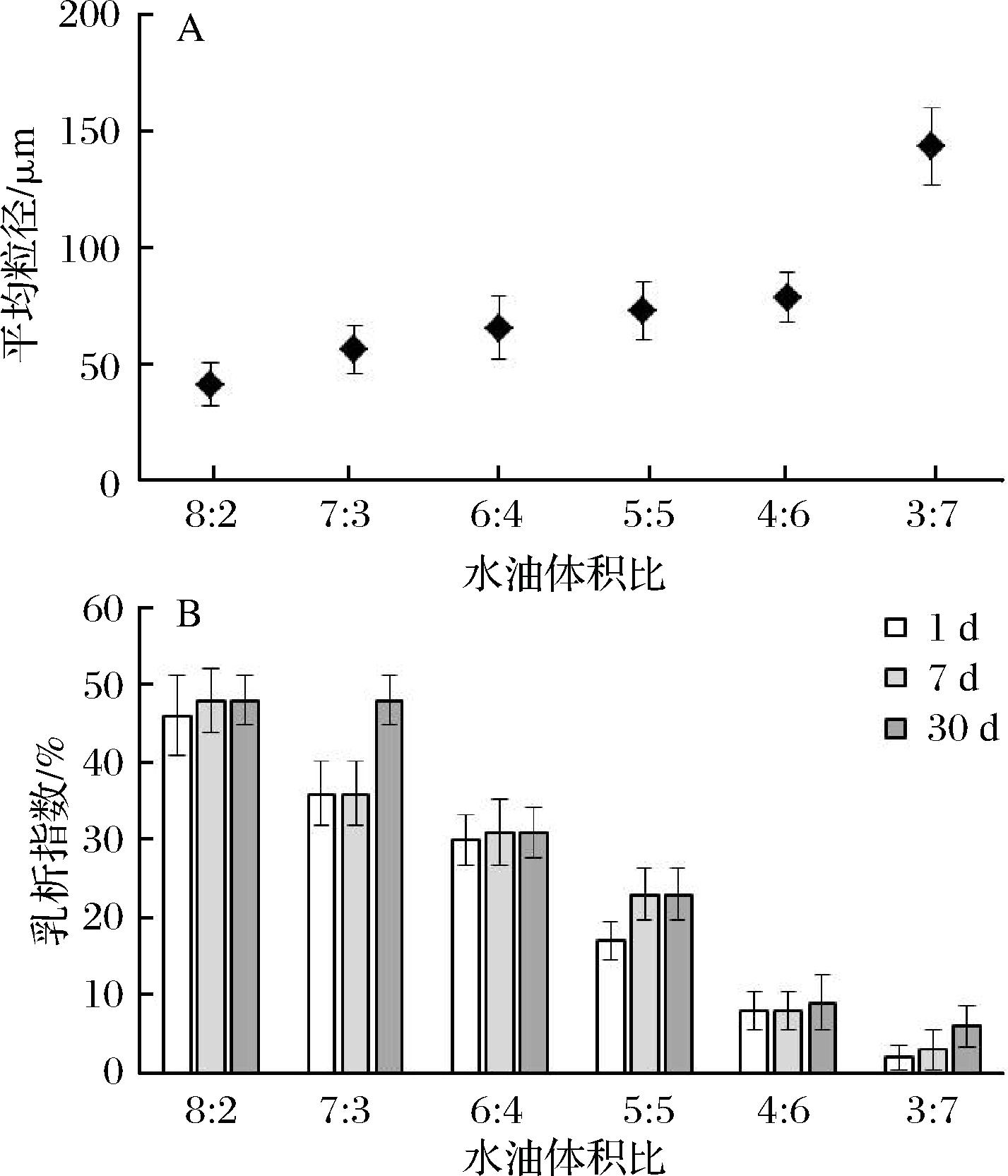
图6 不同水油体积比下制备乳液的液滴尺寸变化情况(静置7d)和乳析指数与水/油比关系图
Fig.6 The droplet size change of emulsion prepared under different water/oil ratio (for 7 d settlement) and relationship between creaming index and water/oil ratio of the emulsion samples
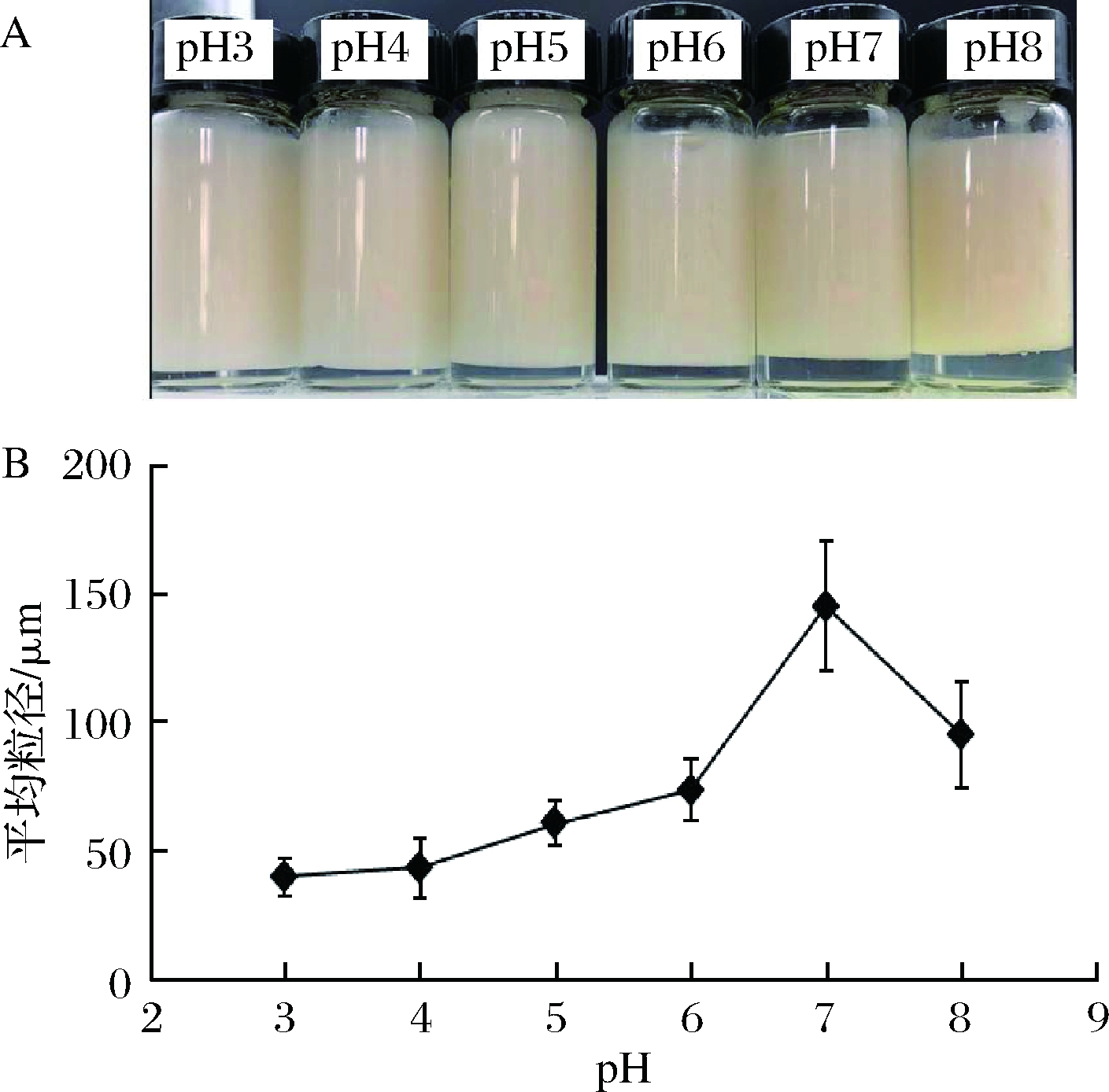
图7 不同pH下制备乳液外观照片(静置7 d)和不同pH下制备乳液平均粒径与pH关系图
Fig.7 Digital images of emulsions prepared under different aqueous pH values (sampled after 7 d settlement) and relationship between the average particle size of the emulsion and aqueous pH values
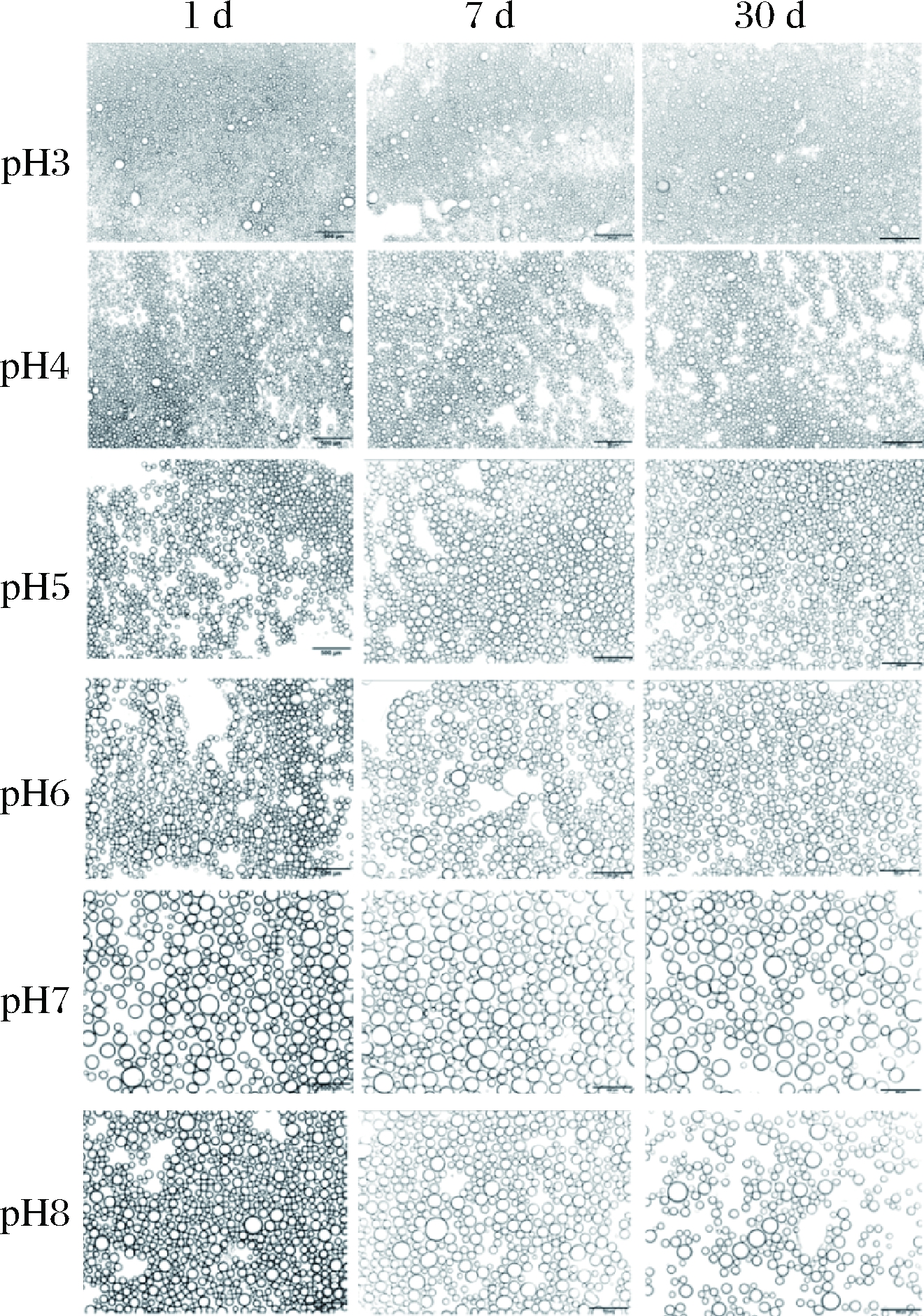
图8 不同pH下制备乳液的显微镜照片(比例尺500 μm)
Fig.8 Microscopic photographs of emulsions prepared at different aqueous pH values
2.5 离子强度对皮克林乳液稳定性的影响
为考察离子强度对乳液稳定性的影响,油相分数(φ=0.6)、豆渣颗粒质量分数(1%)及水相pH=5保持不变,水相中NaCl浓度为50~350 mmol/L。由图9-A可见,乳液在静置存放1~30 d乳析指数变化不显著,均在10%以内。由图9-B可知,NaCl浓度在100~350 mmol/L对乳液液滴粒度无显著影响(P>0.05),但在50 mmol/L时乳液液滴较大。原因可能在于稀浓度的中性盐(NaCl)解离的正负离子阻断了豆渣中蛋白质分子链上正负电荷间的相互作用,增加了颗粒表面的电荷频率,颗粒更容易水合,改变了豆渣颗粒的亲水亲油平衡值,降低了在油滴表面的吸附性能[34]。
2.6 超细化豆渣稳定的皮克林乳液流变学分析
为理解超细化豆渣稳定的皮克林乳液的受应力作用后的流动特性,不同豆渣颗粒质量百分数及不同水相pH条件下制备的乳液进行稳态剪切流变实验,结果分别如图10和图11所示。由图10-A可知,随着豆渣颗粒质量分数的增加,乳液的剪切应力-剪切速率曲线不断上移,表明乳液体系中的网络结构在逐渐增强。由图10-B可知,乳液为剪切变稀型流体,随剪切速率增加,表观黏度降低。此前有大量报道皮克林乳液的剪切变稀效应[15, 34-35]。ULLAH等[27]在湿磨法制备的纳米化豆渣不溶性膳食纤维的稳态剪切试验中也观测到了剪切变稀现象。豆渣颗粒稳定的皮克林乳液的剪切变稀效应与乳液液滴在力场中解聚集有关。静止状态下,乳液液滴借助颗粒吸附层形成弱的聚集态,使乳液呈现弱凝胶结构,而剪切力破坏了这种结构[15, 36]。从组间比较上看,豆渣颗粒质量分数(1.2%)的样品体系表观黏度最高,这是因为豆渣颗粒占比越高,液滴尺寸越小,液滴在分散相中填充越紧密,吸附层及弱凝胶结构越牢固。由图11可知,水相pH值为3和7的乳液体系具有较高的剪切应力和表观黏度。pH=3时,乳液液滴最小(图8),液滴填充紧密,乳液具有较强的凝胶结构[34, 36];pH=7时乳液液滴最大(图8),且豆渣颗粒处于较充分的水合状态,因此乳液体系的表观黏度较大。pH=8时乳液体系的表观黏度最低,原因在于此时豆渣颗粒粒径较小而ζ-电位的绝对值最大(图3),颗粒之间静电斥力较强,造成液滴之间相互作用力弱,在应力作用下容易流动。
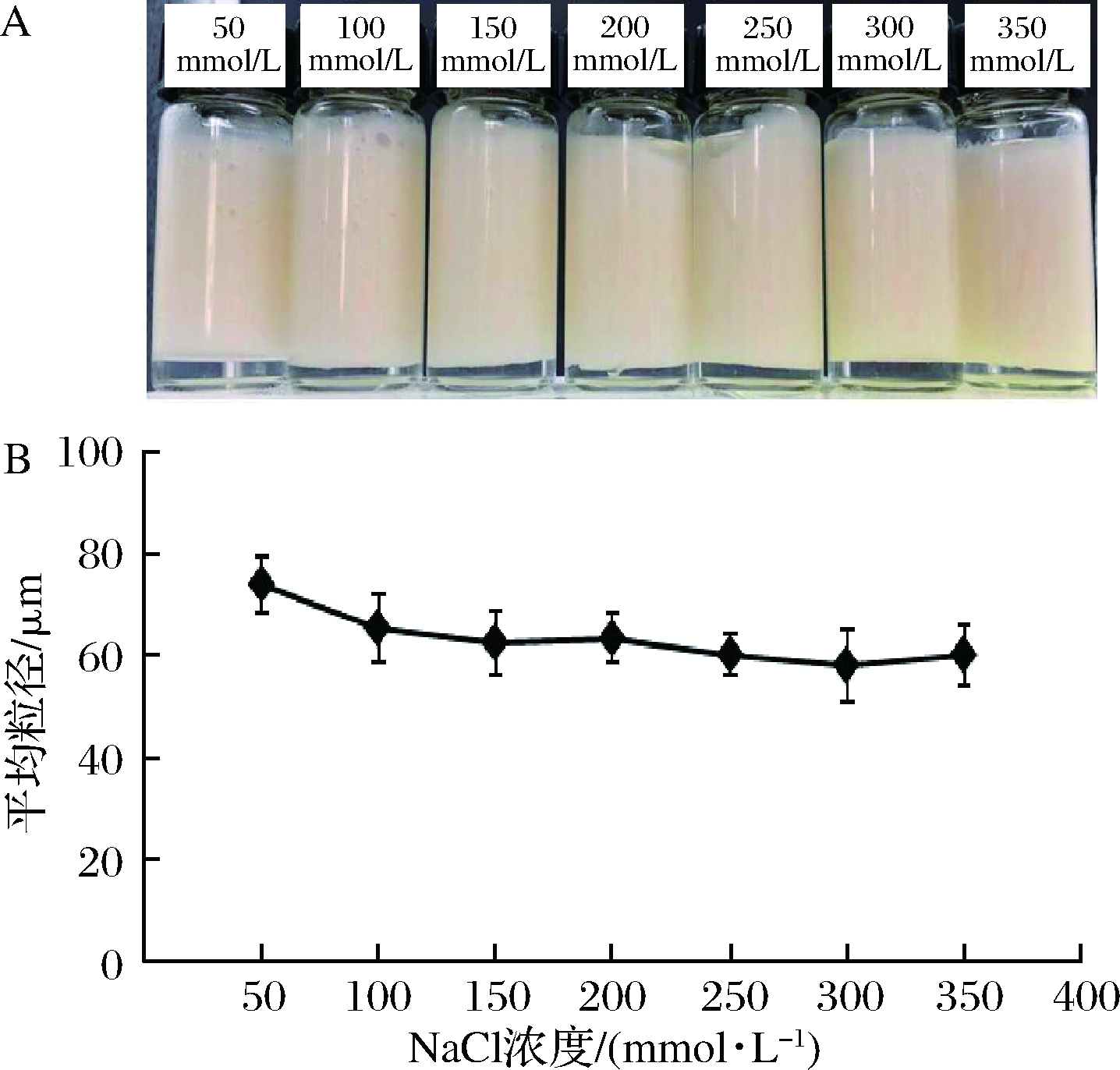
A-乳液;B-平均粒径变化
图9 水相不同NaCl浓度下制备乳液的照片和乳液液滴粒径随水相NaCl浓度变化情况
Fig.9 Digital photographs of emulsions prepared at different NaCl concentrations in aqueous phase and the emulsion droplet size changing with the concentration of NaCl in aqueous phase.
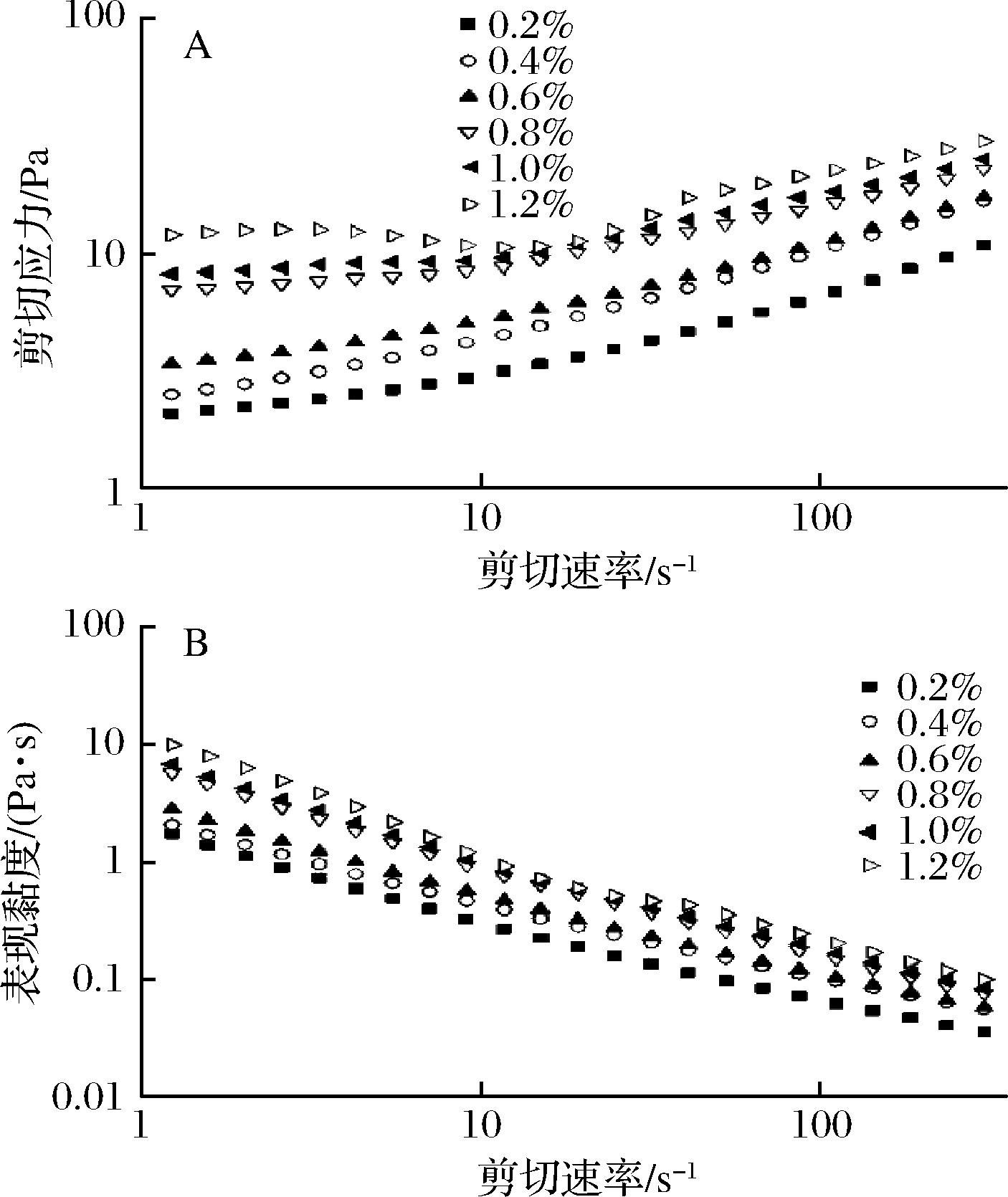
A-剪切应力随剪切速率变化曲线;B-表观黏度随剪切速率变化曲线
图10 豆渣颗粒质量分数对皮克林乳液流变学性质的影响
Fig.10 Effect of mass percentage of okara particulate on rheological properties of Pickering emulsion
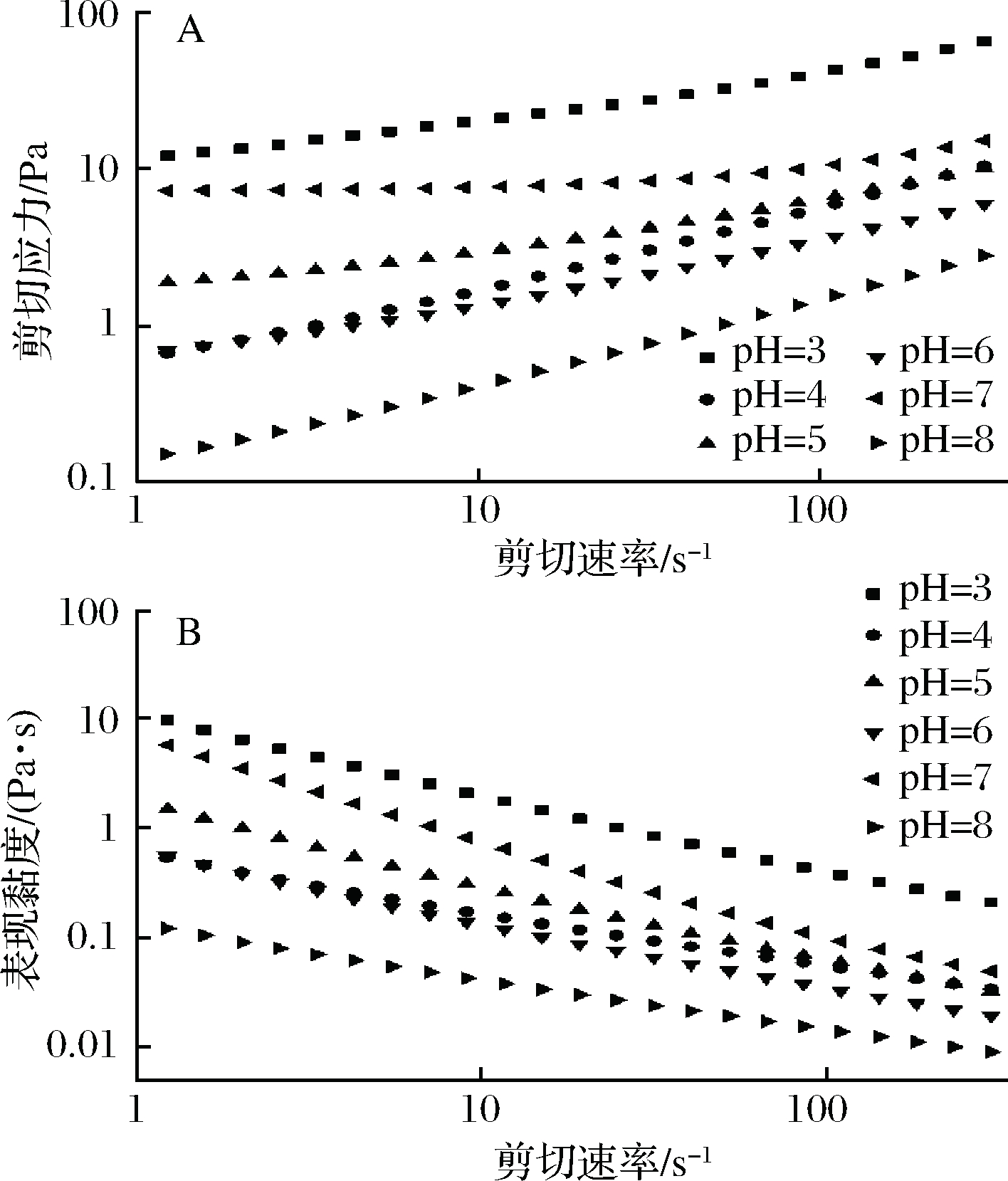
A-剪切应力随剪切速率变化曲线;B-表观黏度随剪切速率变化曲线
图11 水相pH对皮克林乳液流变学性质的影响
Fig.11 Effect of aqueous pH value on rheological properties of Pickering emulsions
3 结论
普通粉碎豆渣经湿法超细化处理,可将粒径降至0.5~3 μm,悬浮稳定性显著增强,豆渣颗粒中可溶性膳食纤维含量显著增加,豆渣颗粒悬液ζ-电位为负值。当油相分数φ=0.6,质量分数为0.4%~1.2%的超细化豆渣具有良好稳定皮克林乳液的能力,乳液平均粒径80~140 μm,静置30 d仍相当稳定。乳液液滴大小及稳定性与豆渣颗粒添加量、油相体积分数、水相pH和离子强度有关,尤其受体系中油与豆渣颗粒比例、水相pH的影响较大,受测试浓度的NaCl的影响较小。超细化豆渣稳定的皮克林乳液呈现剪切变稀效应,其流动特性受颗粒添加量及水相pH的影响,pH=3时乳液细腻且具有弱凝胶结构。结果表明,超细化豆渣具有作为食品级皮克林乳液稳定剂的应用潜力。
[1] CHUNG C, MCCLEMENTS D J. Structure-function relationships in food emulsions: Improving food quality and sensory perception[J].Food Structure, 2014, 1(2): 106-126.
[2] BERTON-CARABIN C, ![]() K. Towards new food emulsions: Designing the interface and beyond[J]. Current Opinion in Food Science, 2019, 27:74-81.
K. Towards new food emulsions: Designing the interface and beyond[J]. Current Opinion in Food Science, 2019, 27:74-81.
[3] MURRAY B S. Pickering emulsions for food and drinks[J]. Current Opinion in Food Science, 2019, 27: 57-63.
[4] TAVERNIER I, WIJAYA W, VAN DER MEEREN P, et al. Food-grade particles for emulsion stabilization[J]. Trends in Food Science & Technology, 2016, 50: 159-174.
[5] ZHU Fan. Starch based Pickering emulsions: Fabrication, properties, and applications[J]. Trends in Food Science & Technology, 2019, 85: 129-137.
[6] ANTON M, LE DENMAT M, BEAUMAL V, et al. Filler effects of oil droplets on the rheology of heat-set emulsion gels prepared with egg yolk and egg yolk fractions[J]. Colloids and Surfaces B: Biointerfaces, 2001, 21(1-3): 137-147.
[7] WINUPRASITH T, KHOMEIN P, MITBUMRUNG W, et al. Encapsulation of vitamin D3 in pickering emulsions stabilized by nanofibrillated mangosteen cellulose: Impact on in vitro digestion and bioaccessibility[J]. Food Hydrocolloids, 2018, 83: 153-164.
[8] BARKHORDARI M R, FATHI M. Production and characterization of chitin nanocrystals from prawn shell and their application for stabilization of Pickering emulsions[J]. Food Hydrocolloids, 2018, 82: 338-345.
[9] SHAH B R, LI Y, JIN W, et al. Preparation and optimization of Pickering emulsion stabilized by chitosan-tripolyphosphate nanoparticles for curcumin encapsulation[J]. Food Hydrocolloids, 2016, 52: 369-377.
[10] KASAAI M R. Zein and zein-based nano-materials for food and nutrition applications: A review[J]. Trends in Food Science & Technology, 2018, 79: 184-197.
[11] HU Y Q, YIN S W, ZHU J H, et al. Fabrication and characterization of novel Pickering emulsions and Pickering high internal emulsions stabilized by gliadin colloidal particles[J]. Food Hydrocolloids, 2016, 61: 300-310.
[12] 金蓓,官金敏,许佳音,等.光催化大豆蛋白纳米颗粒皮克林乳液的制备及稳定性研究[J].中国食品学报,2018,18(1):162-168.
[13] WEI Z, CHENG J, HUANG Q. Food-grade Pickering emulsions stabilized by ovotransferrin fibrils[J]. Food Hydrocolloids, 2019, 94: 592-602.
[14] ROUSSEAU D. Trends in structuring edible emulsions with Pickering fat crystals[J]. Current Opinion in Colloid & Interface Science, 2013, 18(4): 283-291.
[15] LIU F, TANG C H. Phytosterol colloidal particles as Pickering stabilizers for emulsions[J]. Journal of Agricultural and Food Chemistry, 2014, 62(22): 5 133-5 141.
[16] BERTON-CARABIN C C, ![]() K. Pickering emulsions for food applications: background, trends, and challenges[J]. Annual Review of Food Science and Technology, 2015, 6: 263-297.
K. Pickering emulsions for food applications: background, trends, and challenges[J]. Annual Review of Food Science and Technology, 2015, 6: 263-297.
[17] WEN C, YUAN Q, LIANG H, et al. Preparation and stabilization of D-limonene Pickering emulsions by cellulose nanocrystals[J]. Carbohydrate Polymers, 2014, 112: 695-700.
[18] MAREFATI A, BERTRAND M, SJ
 M, et al. Storage and digestion stability of encapsulated curcumin in emulsions based on starch granule Pickering stabilization[J]. Food Hydrocolloids, 2017, 63: 309-320.
M, et al. Storage and digestion stability of encapsulated curcumin in emulsions based on starch granule Pickering stabilization[J]. Food Hydrocolloids, 2017, 63: 309-320.
[19] KARGAR M, FAYAZMANESH K, ALAVI M, et al. Investigation into the potential ability of Pickering emulsions (food-grade particles) to enhance the oxidative stability of oil-in-water emulsions[J]. Journal of Colloid and Interface Science, 2012, 366(1): 209-215.
[20] MADADLOU A, RAKHSHI E, ABBASPOURRAD A. Engineered emulsions for obesity treatment[J]. Trends in Food Science & Technology, 2016, 52: 90-97.
[21] ULLAH I, YIN T, XIONG S, et al. Structural characteristics and physicochemical properties of okara (soybean residue) insoluble dietary fiber modified by high-energy wet media milling[J]. LWT-Food Science and Technology, 2017, 82: 15-22.
[22] 吴占威,胡志和,鲍洁. 超微粉碎及螺杆挤压对大豆豆渣粒度和加工性质的影响[J].食品科学, 2012, 33(22):133-138.
[23] 谢怡斐,田少君,马燕,等. 超微粉碎对豆渣功能性质的影响[J].食品与机械, 2014, 30(2): 7-11.
[24] NUSHTAEVA A V. Natural food-grade solid particles for emulsion stabilization[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016, 504: 449-457.
[25] JOSEPH C, SAVOIRE R, HARSCOAT-SCHIAVO C, et al. O/W Pickering emulsions stabilized by cocoa powder: Role of the emulsification process and of composition parameters[J]. Food Research International, 2019, 116: 755-766.
[26] LU X, ZHANG H, LI Y, et al. Fabrication of milled cellulose particles-stabilized Pickering emulsions[J]. Food Hydrocolloids, 2017, 77: 427-435.
[27] ULLAH I, YIN Tao, XIONG Shanbai, et al. Effects of thermal pre-treatment on physicochemical properties of nanosized okara (soybean residue) insoluble dietary fiber prepared by wet media milling[J]. Journal of Food Engineering, 2018, 237: 18-26.
[28] CHEN Y, YE R, YIN L, et al. Novel blasting extrusion processing improved the physicochemical properties of soluble dietary fiber from soybean residue and in vivo evaluation[J]. Journal of Food Engineering, 2014, 120: 1-8.
[29] WEI F, YE F, LI S, et al. Layer-by-layer coating of chitosan/pectin effectively improves the hydration capacity, water suspendability and tofu gel compatibility of okara powder[J]. Food Hydrocolloids, 2018, 77: 465-473.
[30] 赵强忠,周海媚. 大豆纤维稳定水包油型皮克林乳液的研究[J]. 现代食品科技, 2016,32(10):8;39-44.
[31] DICKINSON E. Use of nanoparticles and microparticles in the formation and stabilization of food emulsions[J]. Trends in Food Science & Technology, 2012, 24(1): 4-12.
[32] WANG H, SINGH V, BEHRENS S H. Image charge effects on the formation of Pickering emulsions[J]. The Journal of Physical Chemistry Letters, 2012, 3(20): 2 986-2 990.
[33] HUNTER T N, PUGH R J, FRANKS G V, et al. The role of particles in stabilising foams and emulsions[J]. Advances in Colloid and Interface Science, 2008, 137(2):57-81.
[34] XIAO J, WANG X, GONZALEZ A J P, et al. Kafirin nanoparticles-stabilized Pickering emulsions: Microstructure and rheological behavior[J]. Food Hydrocolloids, 2016, 54: 30-39.
[35] LI X, DING L, ZHANG Y, et al. Oil-in-water Pickering emulsions from three plant-derived regenerated celluloses[J]. Carbohydrate Polymers, 2019, 207: 755-763.
[36] XI Z, LIU W, MCCLEMENTS D J, et al. Rheological, structural, and microstructural properties of ethanol induced cold-set whey protein emulsion gels: Effect of oil content[J]. Food Chemistry, 2019, 291: 22-29.