酱香型白酒生产历史悠久,是我国的著名白酒,香气幽雅、细腻、酒体醇厚丰满、回味悠长[1]。高温制曲是酱香型白酒特殊工艺之一,制曲温度最高达65 ℃,高温环境下形成了特殊的微生物区系,产生多种热稳定性好的酶类,这些酶不仅有利于原料的利用,对酱香型白酒的风格和质量也起着决定性作用[2]。
淀粉酶是一类能够催化α-D-吡喃葡糖基之间 1-4 糖苷键水解的酶类,使淀粉绝大部分转化为可发酵性糖从而提高淀粉利用率,是衡量大曲质量的重要指标[3-5]。酱香型白酒产酒率低,其主要原因是高温大曲中微生物所产生的淀粉酶活力不高、糖化发酵不彻底所致[6]。因此,高温大曲中淀粉酶活力高的土著菌株的筛选及应用具有较大的研究价值。目前对于高温大曲中淀粉酶产生菌的研究主要集中于细菌、霉菌,对产淀粉酶酵母研究较少,然而大曲中酵母对于淀粉分解也有一定的贡献,有研究发现生产之前的高温大曲中存在大量的酵母,这些酵母不仅有产酒产香的能力,有的还具有较强的淀粉分解能力[7]。在白酒固态发酵中后期,随着氧气耗尽,霉菌迅速死亡,这类产淀粉酶的酵母对于中后期的双边发酵就凸显其优势。
本研究对酱香高温大曲中的1株产淀粉酶酵母进行了分离鉴定,并研究该菌株在不同温度、pH值、酒精条件下的生长情况,对比分析了该菌利用不同原料的发酵产物,以期对该菌在白酒酿造中的应用提供一定的数据支持。
1 材料与方法
1.1 材料
曲样,取自赤水河畔的名优酒厂。大米、小麦、麸皮,均为市售。
1.2 培养基
YPD培养基(g/L):酵母浸膏10、蛋白胨20、葡萄糖20、琼脂20,pH自然。
筛选培养基(g/L):酵母浸膏10、蛋白胨20、可溶性淀粉20、琼脂20,pH自然。
发酵培养基(g/L):酵母膏2、蛋白胨8、可溶性淀粉12、 MgSO4·H2O 0.5、K2HPO4 1、pH 7.0。
液态培养基:分别加入200 g小麦、大米、麸皮粉碎后加水800 mL,调节pH 5.5~6.0,加入2 000个单位的酶,煮沸10 min,过程中注意适当补水。待冷却后,加入碱性蛋白酶100 000个单位,55 ℃水浴保温30 min,结束后取上清液,使用前加葡萄糖至终质量浓度为10 g/L。
1.3 实验方法
1.3.1 菌种筛选
称取曲样10 g,加入生理盐水90 mL,摇床振荡30 min制备成菌悬液。逐次稀释到10-2、10-3、10-4、10-5、10-6、10-7倍,分别取0.2 mL分别均匀涂布于筛选分离培养基中, 28 ℃恒温培养2~3 d。观察菌落周围出现的透明圈大小,挑选透明圈直径与菌落直径比最大的菌落进行纯化,观察菌落形态和显微形态。
1.3.2 菌株的鉴定
通过显微镜进行形态鉴定[8-9]。采用酵母基因组DNA 提取试剂盒提取该酵母基因组DNA,根据参考文献[10-11],采用引物ITS1(5′-TCCGTAGGTGAAC-CTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATAT-GC-3′)参照WHITE[12]的方法扩增 ITS 区基因。将扩增产物送北京擎科新业生物技术有限公司测序,将最终测序结果在NCBI 中进行BLAST 比对,并对近似序列进行系统发育学分析。
1.3.3 菌株生长和产酶曲线的测定
将纯化好的酵母菌株制成菌悬液(菌液OD600=0.266),按接种量4%接种于发酵培养基中,于28 ℃、160 r/min条件下振荡培养。每隔2 h取样,离心收集上清液测定酶活力,同时收集菌体、测定菌体干重,绘制生长曲线和产淀粉酶曲线。
1.3.4 耐受特性分析
以OD600为指标,在原有细菌液体培养基的基础上,分别考察温度(31、34、37、40、43、46、49 ℃),pH值(1、1.5、2、2.5、3、3.5、4、4.5、5),酒精体积分数(10%、12%、14%、16%、18%、20%),NaCl质量分数(10%、12%、14%、16%、18%、20%)、葡萄糖质量分数(10%、15%、20%、25%、30%、35%、40%)5个因素对细菌生长情况的影响,恒温摇床培养24 h测定数据。
1.3.5 分析方法
淀粉酶的测定方法:比色法[13];总酸测定方法[14]:酸碱滴定法;总酯测定方法[15]:指示剂法;挥发性物质测定方法:准确称取样品2 g,装入5 mL顶空样品瓶中,加入质量浓度为200 mg/L 的乙酸丁酯内标50 μL。SPME 条件:温度设为70 ℃,平衡时间为15 min,萃取时间为50 min。GC-MS 进样口解吸4 min,GC-MS 分析条件参考吉彩婷[16]的方法。将检测结果与数据库中质谱信息进行比对,确定挥发性风味成分。
2 结果与分析
2.1 产淀粉酶酵母筛选
将样品稀释涂布于淀粉培养基,28 ℃恒温培养24 h,筛选出1株酵母有较大的透明圈,命名为酵母JM,其菌落直径与透明圈直径及其比值见表1,透明圈、菌落、显微形态图见图1。淀粉水解圈较大,菌落为乳白色,圆形,表面干燥,不易挑起。放大10倍的菌落图可以观察到菌落表面为绒毛状。
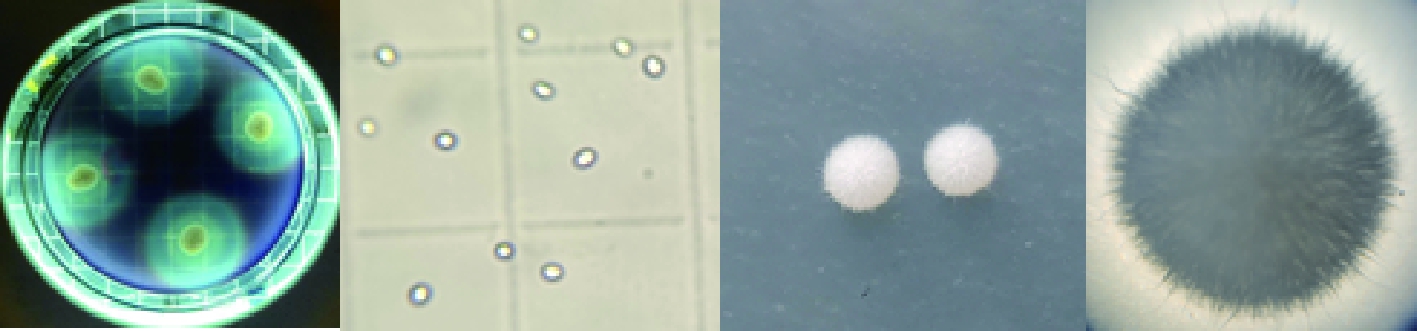
图1 透明圈、显微形态及菌落(右一为放大10倍菌落形态)
Fig.1 Transparent circle, microscopic morphology and colony morphology
表1 菌落直径与透明圈直径及其比值
Table 1 Colony diameter and transparent circle diameter and their ratios
编号菌落直径(d)/mm透明圈直径(D)/mmD/dJM18±0.525±0.63.125±0.1
2.2 菌种鉴定
采用MEGA软件进行系统发育树分析,结果如图2所示。菌株JM与2株扣囊复膜酵母聚在一起,且相似度为100%。结合显微形态,初步将该菌株归属于扣囊复膜酵母属。
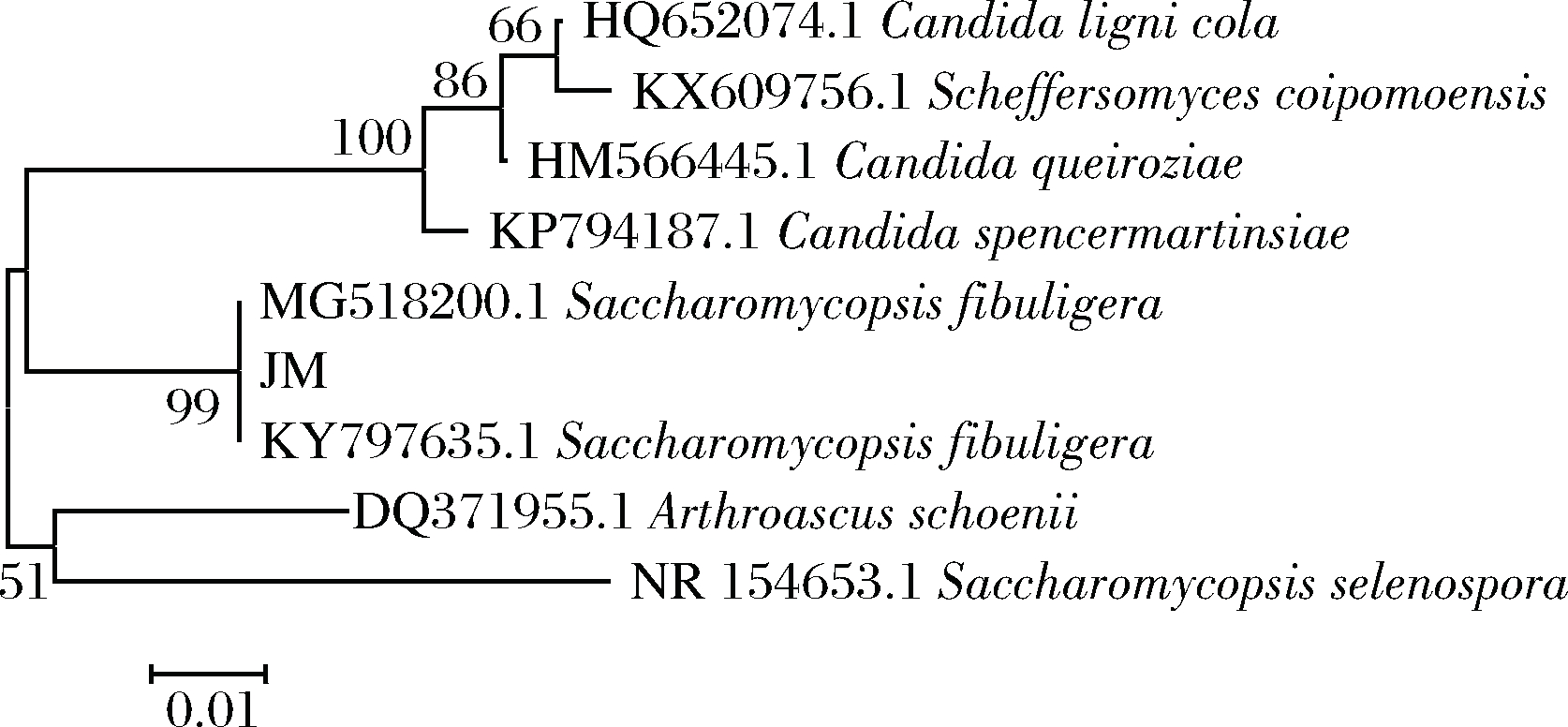
图2 产淀粉酶酵母JM的系统发育学分析
Fig.2 Phylogenetic analysis of amylase producing yeast JM
2.3 生长曲线及产淀粉酶曲线
酵母JM生长及产酶情况如图3所示,该菌株在12 h之前生长较快,12 h后菌体浓度趋于稳定。该菌株在4 h前,菌体处于迟滞期,酶活较低,10 h后进入快速产酶期,12 h左右酶活最高达1 452 U/mL。由图3可以看出产酶和菌体生长偶联。
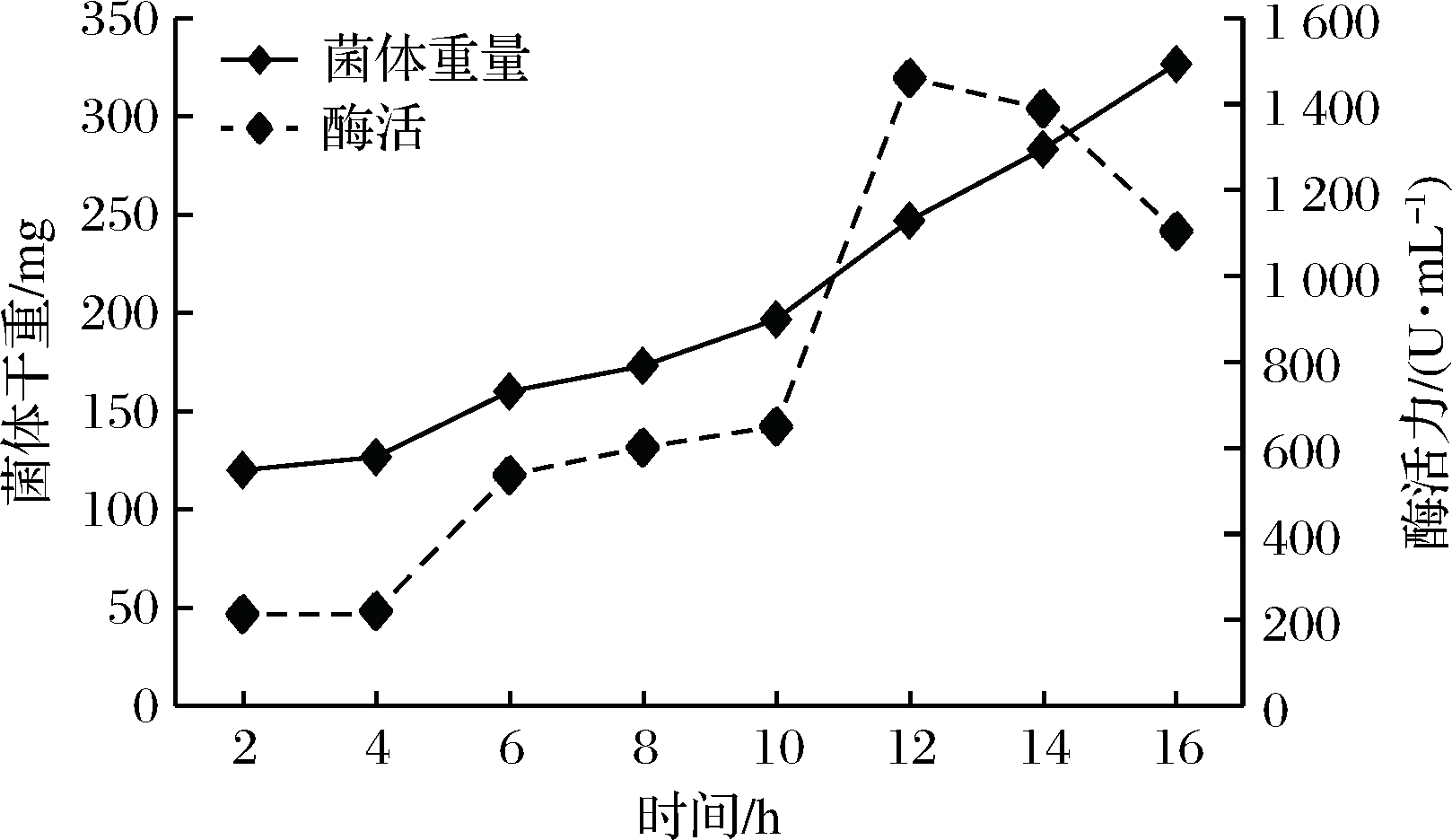
图3 酵母JM的生长及产酶曲线
Fig.3 Growth curve and enzyme production curve of yeast JM
2.4 耐受性研究
2.4.1 温度耐受性
发酵温度升高有利于酶促反应的进行,但是高温可导致细胞膜破坏、酶失活,代谢活动减弱[17]。因此确定菌株对温度的耐受能力很有必要。由图4可知,该菌在37 ℃时生长最好,比一般酵母最适生长温度高,当温度达到40 ℃后,菌株生长受到一定抑制,说明其耐温性良好。在糖化及发酵过程中升温幅度较大,耐温性好的微生物更有利于酒类酿造。

图4 不同温度对酵母JM生长的影响
Fig.4 effect of different temperature on the growth of yeast JM
注:图中不同小写字母代表差异显著(P<0.05)。下同。
2.4.2 pH值耐受性
pH能改变微生物细胞中的电解质,从而对微生物的生长代谢造成一定影响[18]。由于发酵环境为酸性环境,发酵产酸快,pH较低,因此对酿酒微生物耐酸性要求较高。由图5可知,pH 4.0是酵母JM最适生长pH值,随着pH值下降,菌体生长逐渐受到抑制, 在pH 2.0的强酸性环境中仍能生长,表现出较强的耐酸能力。

图5 不同pH值对酵母JM生长的影响
Fig.5 Effect of different pH values on the growth of yeast JM
2.4.3 高糖耐受性
糖不仅是发酵生产乙醇的主要基质,也是酵母赖以生存的能源物质。但是高浓度的糖对酵母生长有抑制作用,高渗透压会导致酵母细胞水分流失。由图6可知,葡萄糖质量分数在20%时菌体干重最大,当含糖质量分数达到40%时,菌株仍继续生长,表现出良好的耐高糖特性。
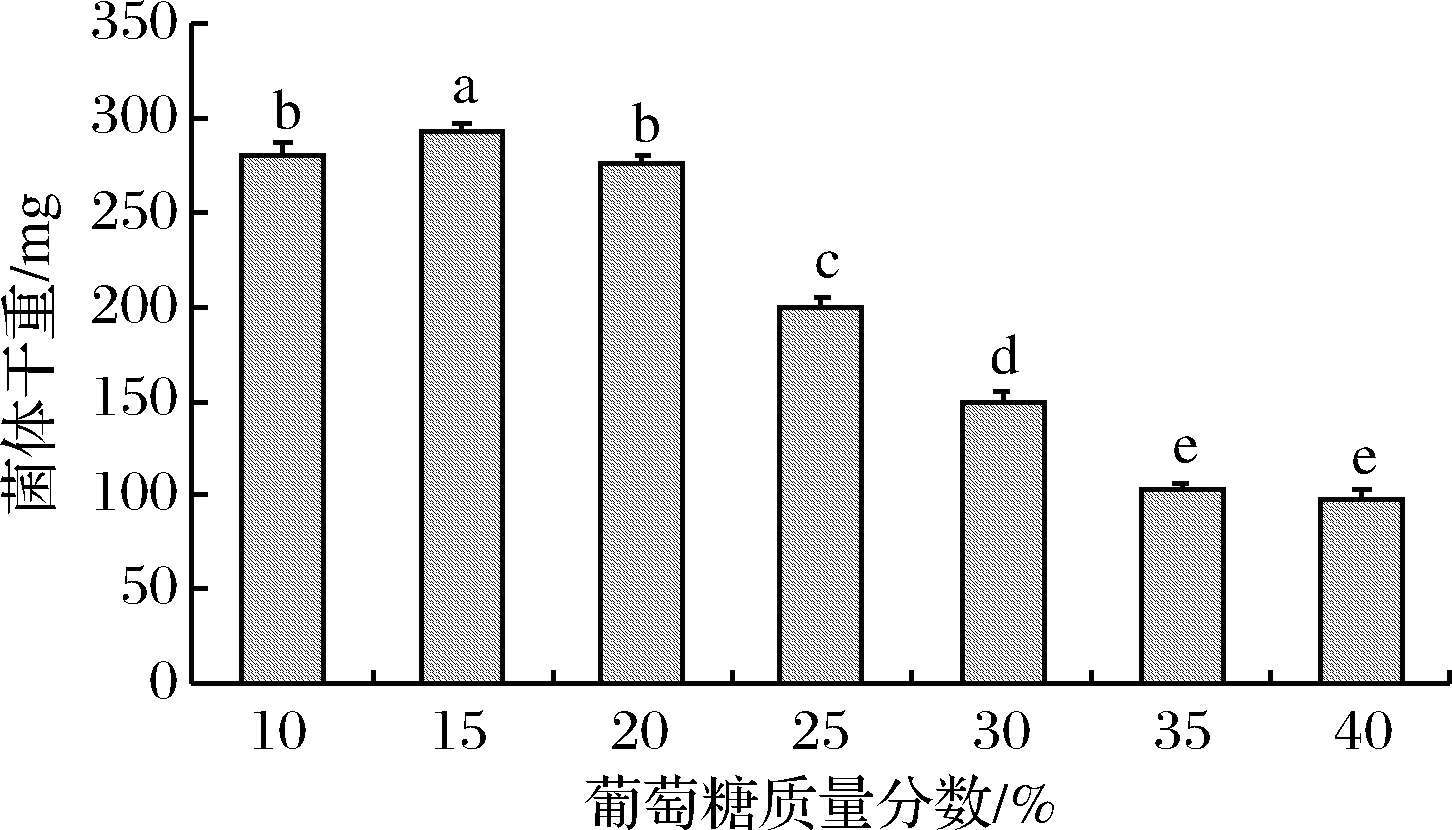
图6 不同糖度对酵母JM生长的影响
Fig.6 Effect of different brix on the growth of yeast JM
2.4.4 渗透压耐受性
由图7中可知,酵母JM对于渗透压表现出较高的耐受性,在NaCl质量分数为14%中生长菌丝干重最大,在NaCl质量分数为20%时依然正常生长。在NaCl质量分数为17%时酵母JM生长受到抑制,在NaCl质量分数为20%时酵母JM仍能继续生长。
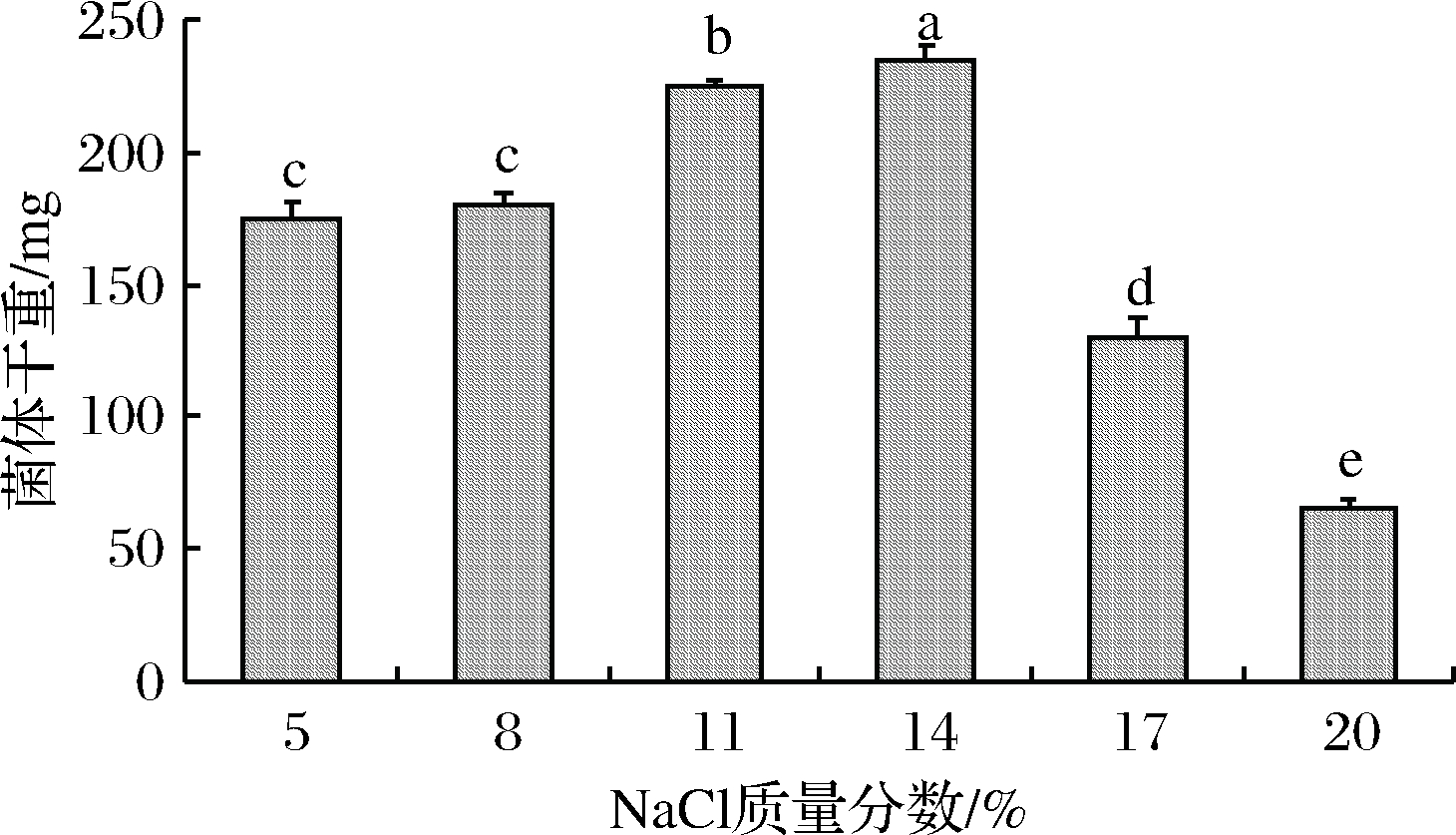
图7 不同盐浓度对酵母JM生长的影响
Fig.7 Effects of different salt concentrations on the growth of yeast JM
2.4.5 酒精耐受性
酒精是大曲中酵母菌厌氧发酵产物,霉菌和酵母在高浓度酒精环境中都受到一定的抑制,酒精对细胞的抑制作用很复杂,主要表现在抑制酵母的增殖速度、存活性和发酵力3个方面[19-22]。因此在白酒发酵过程中,酵母菌酒精的耐受能力对出酒率有较大影响。由图8可知,酵母JM的生长随着酒精含量(体积分数)的增加而减弱,在含量(体积分数)酒精为20%时仍然能够生长,表现出了良好的酒精耐受性。

图8 不同酒精浓度对酵母JM生长的影响
Fig.8 Effects of different alcohol concentrations on the growth of yeast JM
2.5 液态发酵试验
2.5.1 不同原料液态发酵产物理化指标分析
利用该酵母分别在大米、麸皮、小麦3种不同培养基进行液态发酵,如图9所示,小麦培养基发酵产生的酒精、总酸、总酯含量分别为9.3%(体积分数)、3.4 g/L、2.2 g/L,均高于麸皮培养基和大米培养基。
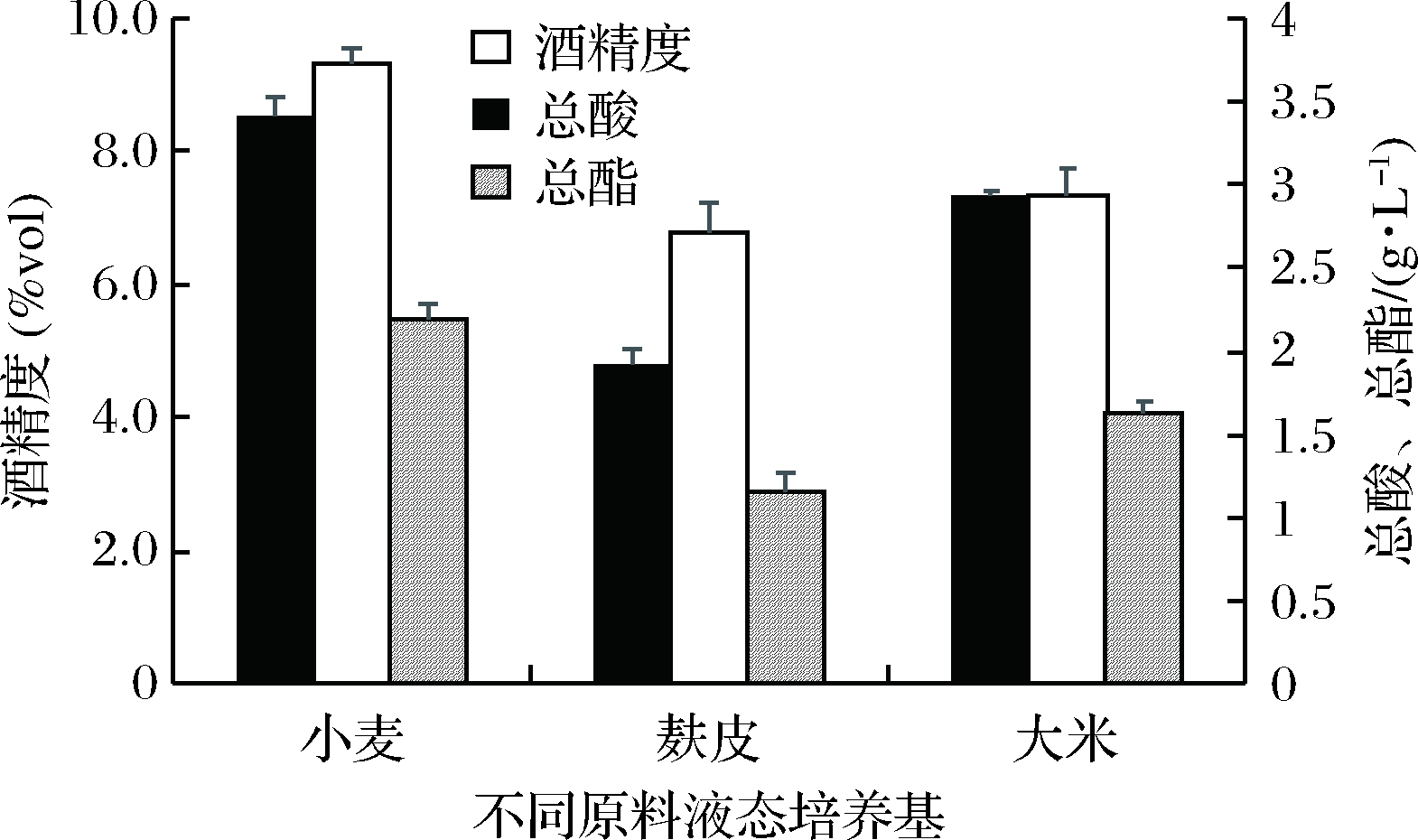
图9 不同原料液态发酵发酵理化分析
Fig.9 Physicochemical analysis of liquid fermentation by different raw materials
2.5.2 不同原料液态发酵产物挥发性成分分析
由表2所示,酵母JM在小麦、麸皮、大米发酵液中发酵产生的香味成分差别较大,分别鉴定出38、15、29种挥发性成分。检出种类最多的是酯类化合物,这类化合物是饮料酒中重要的呈香呈味物质。大米发酵液中相对含量最高的是带有愉快果香的乙酸丁酯;小麦发酵液中辛酸乙酯、乙酸丁酯相对含量都较高,这类物质呈舒适的水果果香;麸皮培养基中含量最高的是具有椰子样香气的十一酸乙酯,感官嗅闻也呈类似结果。酵母JM在3种培养基中均检出较高含量具有清甜的玫瑰样花香的苯乙醇,在大米培养基中相对含量最高。在小麦培养基中除乙醇和苯乙醇外其他醇类物质含量均为少量。大米培养基除乙醇外,还含6种醇类其中含量较高的是3-丁炔-1-醇、环丁醇、异戊醇、苯乙醇。除此之外,在麸皮培养基中检出较高含量具有玫瑰、柑橘等香气的壬醛,小麦培养基中也检测出含量较少的醛酮类物质,分别是壬醛、椰子醛、甲基壬基甲酮,浓度低时呈类似柑橘、杏仁的香味[23-25]。
表2 不同原料液态发酵的风味物质 单位:%(相对含量)
Table 2 Flavor substances from liquid fermentation by different raw materials

分类物质名称物挥发性风味成分小麦麸皮大米1-辛醇0.062,3-丁二醇0.040.833-丁炔-1-醇4.16丙醇0.070.95庚醇0.04醇类环丁醇3.56顺-3-壬烯-1-醇0.08乙醇76.8642.2725.05苯乙醇2.9617.6312.33异丁醇0.510.610.65异戊醇2.242.645.61丙酸丁酯0.03丙酸戊酯0.04丙酸异戊酯0.10丙烯酸辛酯0.15草氨酸乙酯0.20丁二酸二乙酯0.08反式-4-癸烯酸乙酯1.93高香兰酸乙酯0.03庚酸乙酯0.070.13癸酸乙酯0.32己二酸二乙酯0.03壬酸乙酯0.680.07肉桂酸乙酯0.19十一酸乙酯5.450.28酯类戊二酸二乙酯0.06戊酸乙酯0.76辛酸3-甲基丁酯0.31辛酸乙酯6.9511.16乙酸丁酯6.723.1425.89乙酸乙酯0.041.060.47乙酸异戊酯0.091.42异戊酸乙酯0.22丁酸苯乙酯1.12苯甲酸乙酯0.08苯乙酸乙酯0.27辛酸-2-苯乙酯0.81乙酸苯乙酯0.130.363-苯丙酸乙酯0.04正己酸乙酯1.001.86
续表2
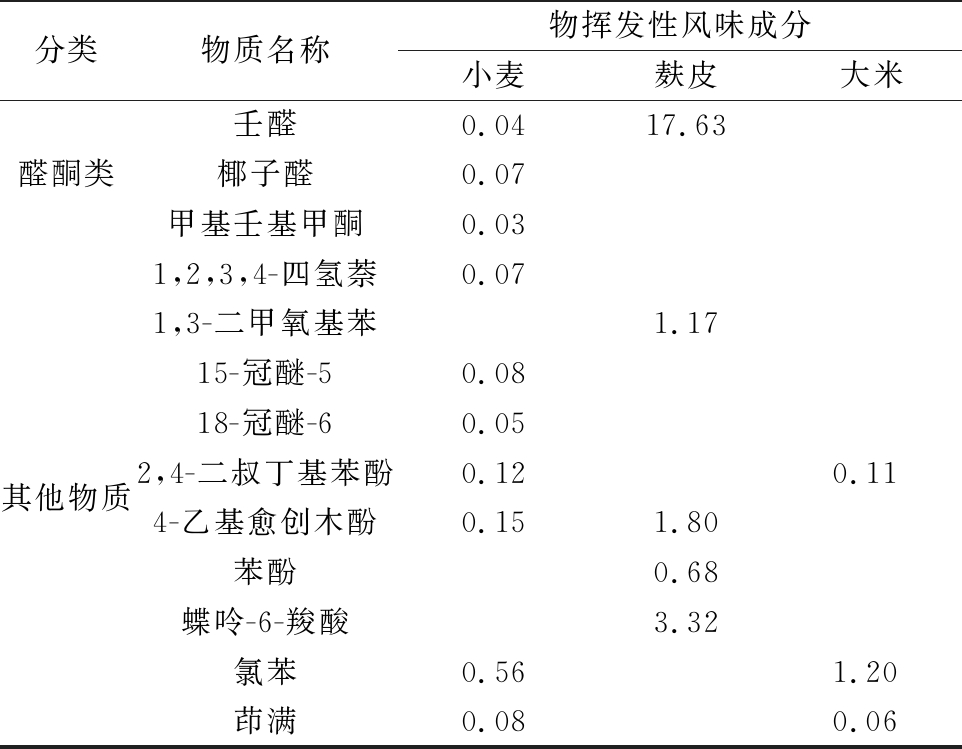
分类物质名称物挥发性风味成分小麦麸皮大米壬醛0.0417.63醛酮类椰子醛0.07甲基壬基甲酮0.031,2,3,4-四氢萘0.071,3-二甲氧基苯1.1715-冠醚-50.0818-冠醚-60.05其他物质2,4-二叔丁基苯酚0.120.114-乙基愈创木酚0.151.80苯酚0.68蝶呤-6-羧酸3.32氯苯0.561.20茚满0.080.06
3 结论
采用淀粉平板透明光圈法从高温大曲中筛选得到1株产淀粉酶菌株JM,结合显微形态及分子生物学鉴定为扣囊复膜酵母。通过产淀粉酶能力、耐受性、液体发酵试验,发现酵母JM具有较好的产淀粉酶能力及产香能力,且对于温度、pH、酒精度的耐受性好,初步说明该菌株在酒类酿造方面具有很好的应用潜质,后续研究可围绕该菌株的综合性能及与酿酒酵母协同发酵等方面展开。
[1] 沈怡方.白酒生产技术全书[M]. 北京:中国轻工业出版社,2007.
[2] 鲁珍,魏姜勉,谌馥佳,等.高温大曲中高产α-淀粉酶菌株分离鉴定及其产酶性能研究[J].农业研究与应用,2016,163(2):5-11.
[3] SENYAY-ONCEL D,YESIL-CELIKTAS O.Treatment of immobilized α-amylase under supercritical CO2 conditions: Can activity be enhanced after consecutive enzymatic reactions?[J].Journal of Molecular Catalysis B: Enzymatic,2013, 91:72-76.
[4] 贾瑞博,胡荣康,周文斌,等.米曲霉(Aspergillus oryzae FAFU)淀粉酶的分离纯化及其酶学性质研究[J].食品与发酵工业,2016,42(11):71-76.
[5] 苏小军,熊兴耀,谭兴和,等.产生淀粉酶菌株的诱变选育及酶学性质研究[J].食品与机械,2009,25(2):11-14;33.
[6] 张志刚,吴生文,陈飞.大曲酶系在白酒生产中的研究现状及发展方向[J].中国酿造,2011(1):13-16.
[7] 孙思佳,翟磊,许玲,等.扣囊复膜孢酵母CICC 33077在芝麻香型白酒高温大曲生产中的应用[J].酿酒科技,2018,289(7):67-73.
[8] 王晓丹,陈美竹,班世栋,等.茅台大曲中酵母的分离、鉴定及其功能初探[J].食品科学,2017,38(4):51-57.
[9] 王旭亮,王异静,张五九,等.白酒发酵高糖化性能霉菌的筛选及鉴定[J].酿酒科技,2012(9):22-28.
[10] 武俊瑞,王晓蕊,唐筱扬,等.辽宁传统发酵豆酱中乳酸菌及酵母菌分离鉴定[J].食品科学,2015,36(9):78-83.
[11] 唐玉明,姚万春,任道群,等.优良根霉菌株C-24和LZ-24的选育[J].中国酿造,2001,112(2):12-14.
[12] WHITE T J. A Guide to Methods and Applications[M].Masschusetts:Academic Press, 1990:315-322.
[13] 肖长清,戚天胜,赵海.生淀粉糖化酶产生菌Aspergillus niger(6#)的分离筛选及其产酶条件[J].应用与环境生物学报,2006, 12(1): 76-79.
[14] 赵金松,冯兴垚,刘茗铭,等.不同澄清剂对桂花鸭梨复合型果酒澄清效果的研究[J].四川理工学院学报(自然科学版), 2017, 30(5): 20-25.
[15] 林建城,张雄.复合载体固定化果胶酶澄清枇杷果汁的工艺优化[J].食品科技,2015,40(5):49-54.
[16] 吉彩婷.不同进样方法对白酒GC-MS分析的对比研究[J].中国化工贸易,2017,9(13):208-210.
[17] 周德庆.微生物学实验教程第2版[M].北京:高等教育出版社,2006.
[18] 付肖蒙,王鹏飞,郝爱丽,等.高耐性酿酒酵母的筛选及其耐受性研究[J].中国酿造,2017,36(10):23-26.
[19] 毛志群,张伟,檀建新,等.高产酒精酵母的筛选及鉴定[J].食品与发酵工业,2003,29(3):50-53.
[20] 李新,孙晓,李悦佳, 等.中度嗜盐菌LY9的分离鉴定及其淀粉酶特性研究[J].生物技术,2011,21(3):62-65.
[21] EGAS M C V, COSTA M S D, COWAN D A, et al. Extracellular α-amylase from Thermus Filiformis Ork A2: Purification and biochemical characterization[J]. Extremophiles, 1998, 2(1):23-32.
[22] 张琳,张也,王如福,等.大曲中高产糖化酶菌株的筛选及环境耐受性分析[J].山西农业大学学报(自然科学版), 2016,36(10):740-744.
[23] 邢钢,敖宗华,邓波.大曲中微生物研究和检测进展[J].酿酒科技,2012(12):86-89.
[24] 刘杰雄,陈号,陆雯,等.淀粉酶高产菌株的筛选及其酶活的测定[J].食品工程,2010(1):45-47.
[25] 吕佳慧.白酒酿酒和制曲原料中结合态风味物质的研究[D].无锡:江南大学,2017.