鱼类等水产品作为促进人类健康的饮食组成部分变得越来越重要[1]。海鲈鱼(Perca fluviatilis)是我国重要的经济鱼类之一,广泛分布于中国、日本、韩国等国家。《2019中国渔业统计年鉴》统计,2018年海水养殖鱼类中鲈鱼产量为16.58万t,位居第二。海鲈鱼味道鲜美,富含蛋白质、脂肪及微量元素等营养成分,并有一定的药用价值,与养殖鱼类相比具有巨大的经济价值。但海鲈鱼水分活性高,极易腐烂,目前主要依靠冷冻技术来保存。一般来说,短时间的冷冻可以保持鱼类的感官特性和营养特性,但解冻会导致肌原纤维蛋白的变性、聚集和结构破坏等[2-3]。
解冻是冰晶融化的过程,但解冻的食品很难恢复到原来的新鲜状态。因此,人们致力于研究新的解冻方法,更好地解决冷冻食品在解冻过程中的品质变化问题。但目前的解冻方法通常是缓慢和不均匀的,往往会引起鱼肉品质的下降,如颜色变化、质量下降(解冻损失、蒸煮损失)、蛋白质变性和脂肪氧化等。因此,降低解冻对食品品质的影响是值得关注的问题。XIA等[4]研究发现猪肉质量变差的主要原因是蛋白质的氧化。蛋白质氧化的原因之一是通过非共价和共价分子间键形成蛋白质聚集体。一些研究表明,活性氧可以导致肉类蛋白质聚集和降解,使蛋白质的溶解度和功能降低[5]。蛋白质氧化的常见变化包括氨基酸的破坏,蛋白质的解折叠,断裂和交联以及蛋白质羰基的形成[6]。蛋白质氧化可能会导致食品品质下降,如汁液流失,风味变差和颜色变深。因此,人们致力于研究新的解冻方法,更好地减缓冷冻食品在解冻过程中蛋白质理化性质的变化。
鉴于上述原因,本实验使用不同的解冻方式(超声微波解冻,超声远红外解冻,超声欧姆解冻、超声真空解冻,超声解冻),从蛋白质结构(拉曼光谱、紫外吸收光谱和内源荧光光谱)、蛋白质聚集程度(粒径、Zeta电位和SDS-PAGE)和蛋白质氧化程度(总巯基含量和蛋白质溶解度)3个方面研究肌原纤维蛋白理化性质的变化,以找到能更好维持海鲈鱼肌原纤维蛋白理化性质的解冻方式。
1 材料与方法
1.1 材料与试剂
本实验原料为新鲜海鲈鱼,质量为(1±0.1) kg,购于辽宁锦州当地的水产市场。自封袋(10 cm×7 cm),购于广州乔峰塑料制品有限公司。
Na2HPO4、Na2HPO4、CuSO4、酒石酸钠等试剂均为分析纯,国药集团化学试剂有限公司;十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶试剂盒,北京索莱宝科技有限公司;总巯基试剂盒,南京建成生物科技有限公司;18兆欧超纯水,睿希化工处理厂。
1.2 材料与试剂
PS-60A超声清洗机,东莞洁康超声波设备有限公司;CX-1250L层析柜,嘉鹏科技有限公司;远红外管,元祥电器有限公司;Kl3705-B变频电源,东莞市科联电子有限公司;SHB-III水循环多功能真空泵,郑州长城科工贸有限公司;RC-4温度记录仪,江苏省精创电气股份有限公司;PL602-L电子天平,梅特勒-托利多仪器有限公司;FJ300-SH标本数显恒速高速分散均质机,上海右一仪器有限公司;Bioguge Stratos台式高速冷冻离心机,美国Thermo公司;Lab RAM HR Evolution氩离子激光拉曼光谱仪,HOPIBA公司;UV-2550紫外可见分光光度计,尤尼柯(上海)仪器有限公司;970CRT荧光分光光度计,上海精密科学仪器有限公司;Zetasizer Nano-ZS90纳米粒径电位分析仪,马尔文仪器有限公司;Mini Protean 3凝胶电泳仪、GS-800拍照系统美国Bio-Rad公司;ZD-9556脱色摇床,常州市凯航仪器有限公司。
1.3 实验方法
购买鲜活海鲈鱼,0.5 h内运至实验室。将鱼敲死后剥皮取背部肉。鱼片均切成5 cm×4 cm×2 cm小片,约30 g。用去离子水清洗后用保鲜膜包裹并放入自封袋,于-20 ℃冰箱内冷冻24 h。
1.3.1 解冻方式
超声解冻:所有解冻方式的超声波清洗机参数均设置为360 W、40 kHz[7],每个处理组的鱼肉均为30 g。耐热容器中加入适量水淹没鱼肉,并放入超声波清洗机中。鱼块中心温度达到0 ℃时,解冻完成。解冻所需时间约为5 min。
超声微波解冻:耐热容器中加入适量水没过鱼肉,并放入超声波清洗机中。将微波发射器对准耐热容器。整个装置置于层析柜中[7]。解冻耗时3 min左右。
超声远红外解冻:耐热容器中加入适量水没过鱼肉,并放入超声波清洗机中,2两根红外管置于层析柜中夹层两侧的凹槽内[7]。解冻时长约为3 min。
超声欧姆解冻:鱼肉放入欧姆解冻的加热槽中,并加水淹没,然后放入超声波清洗机中。同时开启变频电源和超声清洗机进行解冻,耗时3 min左右。
超声真空解冻:鱼肉放入真空瓶中,加水淹没,然后置于超声波清洗机中[8]。同时打开真空泵和超声清洗机进行解冻,4 min左右能完成解冻。
1.3.2 肌原纤维蛋白的提取
通过改进年琳玉[9]的方法来提取海鲈鱼的肌原纤维蛋白。将切碎的鱼肉放入绞肉机内搅拌30 s,并称取10 g碎鱼肉。肌原纤维蛋白的整体提取工艺均维持在4 ℃。将碎鱼肉加入到4倍体积预冷的磷酸钠缓冲液(20 mmol/L,pH 7.5),使用均质机均质60 s。然后将溶液在4 ℃下以6 000 r/min离心10 min,取沉淀。再次使用磷酸钠缓冲液(20 mmol/L,pH 7.5)溶解沉淀,均质,离心,重复3次。最后,将沉淀加入到4倍体积的磷酸盐缓冲液(20 mmol/L,0.6 mol/L NaCl,pH 7.5),再次均质、离心。上清液为肌原纤维蛋白。将肌原纤维蛋白在4 ℃冰箱中保存24 h。通过双缩脲法测定蛋白浓度,并根据实验要求调整合适的浓度。
1.3.3 拉曼光谱的测定
参考李秀霞等[10]的方法并稍作修改。将鱼肉切成3 mm×3 mm×1 mm小片后,通过氩离子激光拉曼光谱仪进行测定。具体条件为:激发波长为532 nm,功率为120 mW,采集速率为120/(cm·min),分辨率为2 cm-1,曝光时间为60 s,扫描范围为400~3 600 cm-1。将样品调整到3个不同的位置进行测量,并使用50倍透镜显微镜观察。
1.3.4 紫外吸收光谱的测定
参考ZHANG等[11]的方法进行测试,并稍作改动。用磷酸盐缓冲液(20 mmol/L,0.6 mol/L NaCl,pH 7.5)将肌纤维蛋白质量浓度稀释至1 mg/mL,磷酸缓冲液作为空白。参数设定为扫描速度240 nm/min,间隔为1 nm,扫描波长范围为190~400 nm。紫外二阶导光谱可以形象地表征肌原纤维蛋白的结构变化。
1.3.5 内源荧光光谱的测定
参考李瑞平[12]的方法并稍作改动,对肌原纤维蛋白样品进行内源荧光高速扫描检测。将蛋白的最终质量浓度调整为0.1 mg/mL,并以磷酸盐缓冲液(20 mmol/L,0.6 mol/L NaCl,pH 7.5)为空白。具体条件为激发波长295 nm,激发狭缝和发射狭缝均为10 nm,灵敏度为4,扫描范围300~400 nm,每个处理组至少扫描3次。
1.3.6 粒径的测定
参考BELICIU等[13]的方法并稍作修改。用稀释至1 mg/mL的肌原纤维蛋白溶液进行粒径测定,可以看出蛋白的聚集程度。参数设定为溶剂为水,平衡时间为2 min,温度为25 ℃,散射角为90°。蛋白溶液置于特定的比色皿,并放入测量池中,使用纳米粒度分析仪进行测定,每组至少重复3次。
1.3.7 Zeta电位的测定
参考BELICIU等[13]的方法并稍作修改。样品的最终测定质量浓度与粒径相同,为1 mg/mL。将肌原纤维蛋白溶液倒入特定比色皿的1/3处,在25 ℃下使用纳米粒度分析仪测定Zeta电位。
1.3.8 SDS-PAGE
将肌原纤维蛋白溶液稀释至质量浓度为3 mg/mL,使用12%的分离凝胶和4%的浓缩凝胶。将6组肌原纤维蛋白溶液(10 μL)和上样缓冲液以体积比1∶1混匀并按顺序编号。Marker(6.5~200 kDa)作为参考,不添加上样缓冲液。然后,在沸水中煮沸5 min,使蛋白质变性。将玻璃板置于充满电极缓冲液的电泳装置中。在电极缓冲液中取出梳状体后加入混合物(20 μL)和Marker。施加80 V的电压,到样品形成一条直线后,将电压升高至120 V。停止后,将凝胶放入摇床中,在塑料盆中加入100 mL的考马斯亮蓝染色剂,染色50 min。然后将凝胶转移到另一个塑料盆中,使用混合液[V(无水乙醇)∶V(乙酸)∶V(超纯水)=400∶100∶500]脱色过夜。最后,对凝胶进行拍照,得到电泳图。
1.3.9 总巯基含量的测定
使用总巯基试剂盒测定总巯基的含量。每个样品都需要对照管和测量管,但共用空白。将肌原纤维蛋白溶液稀释至5 mg/mL,在412 nm波长处测量吸光度值,每个样品重复3次。巯基总量计算如公式(1)所示:
总巯基含量![]()
(1)
式中:A1,测量管的吸光度;A2,空白管的吸光度;A3,对照管的吸光度;V1,反应物的总体积,mL;ε,毫摩尔消光系数13.6/(mmol·cm);C,蛋白质的含量;L,光径(0.5 cm);V2,样品的体积,mL。
1.3.10 溶解度的测定
参考姜晴晴等[14]的方法,并稍作修改。将5 mL肌原纤维蛋白溶液(5 mg/mL)放入离心管中,4 ℃,10 000×g离心10 min。取上清液测蛋白质浓度。溶解度计算如公式(2)所示:
蛋白质溶解度![]()
(2)
1.3.11 数据处理
使用SPSS 19.0的单因素方差分析(ANOVA)分析数据,然后进行Duncan多重范围检验,数据表示为平均值±标准偏差(SD),且P<0.05为显著。使用OriginPro 9.0绘图。每个处理组至少重复测定3次。
2 结果与分析
2.1 拉曼光谱扫描
拉曼光谱是基于分子在基态电子态的离散振动跃迁,拉曼带的波数和强度变化可以反映蛋白质的二级结构和局部环境的改变[15]。图1-a为对400~3 600 cm-1的光谱进行了平滑处理、基线校正并将其归一化得到的拉曼光谱图。在1 600~1 700 cm-1,通过退卷曲、二阶导和迭代拟合并通过计算峰面积比例分布,得到图1-b。其中α-螺旋代表着组织良好的蛋白质结构(1 650~1 658 cm-1);无规则卷曲代表着紊乱的蛋白质结构(1 660~1 665 cm-1),以及β-折叠(1 665~1 680 cm-1)和β-转角(1 680 cm-1附近)[16]。解冻后样品的α-螺旋含量均下降,这可能是因为解冻过程中蛋白质展开,疏水基团暴露,氢键减弱,从而导致α-螺旋的断裂,β-折叠,β-转角和无规则卷曲的形成,β-折叠含量降低也可以归因于疏水相互作用引起了蛋白质聚集。还可能是解冻处理使水进入蛋白质内部,从而导致蛋白质构象由折叠到展开[17]。由图1-b可知,超声解冻的蛋白质α-螺旋的含量约为33.95%,低于新鲜样品和其他解冻方法;无规则卷曲的含量约为25.25%,高于所有处理组,这意味着超声解冻维持蛋白质二级结构的能力最差。超声微波解冻和超声真空解冻的α-螺旋的含量和新鲜样品最接近。CAI等[7]发现美国红鱼在超声微波解冻后,α-螺旋转化为无规卷曲的含量较少,显示出更稳定的蛋白质结构,和本文的结果一致。
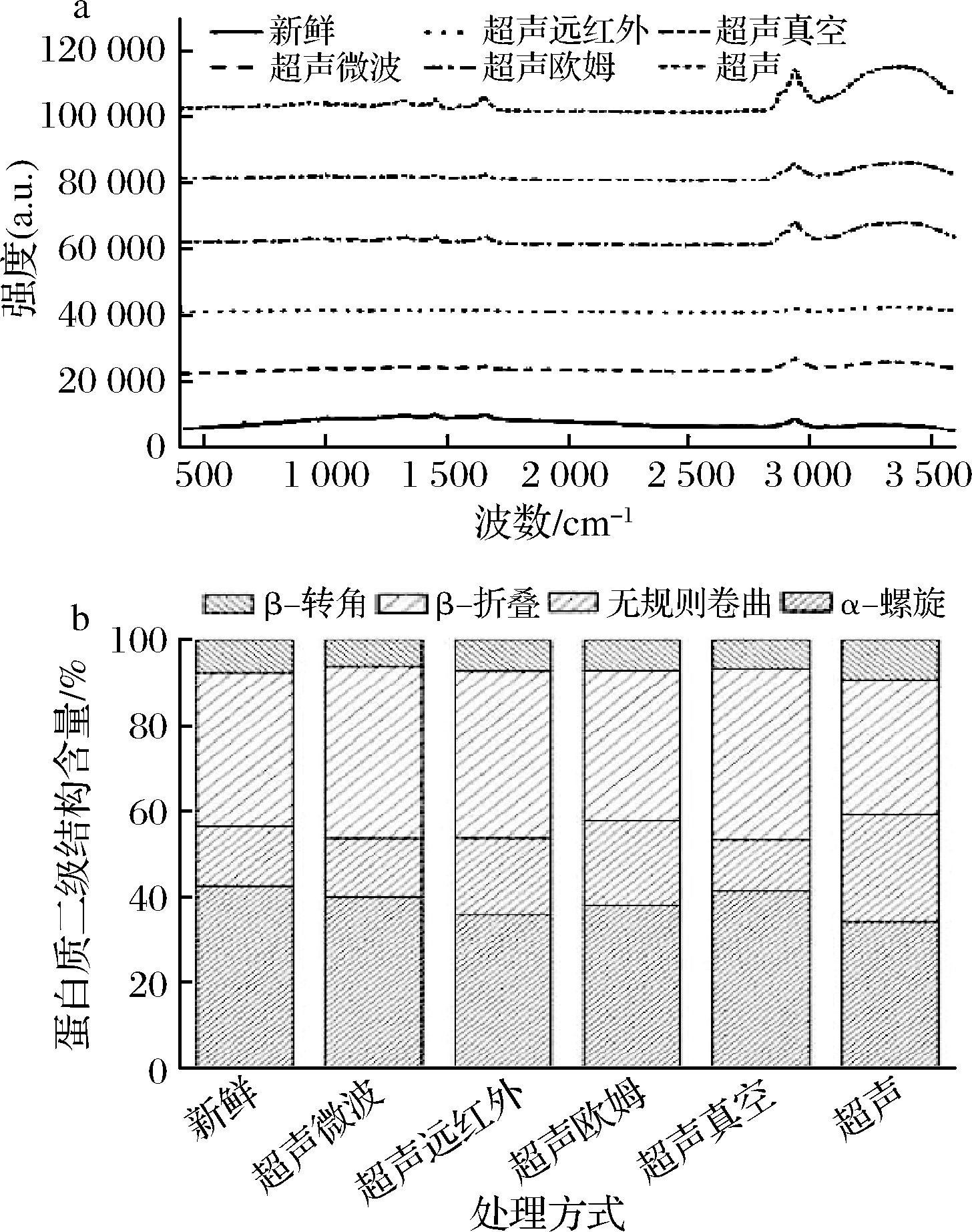
a-拉曼光谱;b-二级结构分布比例
图1 不同解冻方式对肌原纤维蛋白拉曼光谱
二级结构分布比例的影响
Fig.1 Effects of different thawing methods on Raman spectroscopy and
different distribution proportions of secondary structure
2.2 紫外吸收光谱
利用紫外吸收光谱分析蛋白质的光谱跃迁和芳香氨基酸的微环境变化[18]。紫外二阶导数光谱是一种从光谱中提取信息的方法,已用于描述近紫外区域中复杂的蛋白质光谱转变,以及芳香族氨基酸残基的作用。由图2可知,有2个正吸收峰(287 nm处为色氨酸和酪氨酸共同作用的吸收峰,296 nm处为色氨酸单独作用的吸收峰)和2个负吸收峰(279 nm和293 nm处)。相较于新鲜样品,所有解冻后样品在287 nm处的波峰出现不同程度的红移(向长波方向移动);在296 nm处的波峰出现不同程度的蓝移(向短波方向移动),这说明蛋白质变性,色氨酸极性环境增大,表面疏水性增加,蛋白质发生聚集。“a”为第一个吸收峰的波峰与波谷的距离,“b”为第二个吸收峰的波峰与波谷的距离。“r”值为“a”与“b”的比值,可以用来反映酪氨酸微环境的变化。酪氨酸的“r”值随着溶剂极性的减小而减小,而色氨酸的“r”值几乎与溶剂极性无关。较低的“r”值说明酪氨酸微环境的极性降低[19],较高的“r”值意味着蛋白质结构的解聚和展开过程中,埋在肌原纤维蛋白中的酪氨酸残基逐渐暴露于表面,并发生向疏水区域移动和三维位置变化的现象[20]。超声欧姆解冻和超声真空解冻的“r”值小于新鲜样品,超声微波解冻、超声远红外解冻和超声解冻的“r”值大于新鲜样品。与新鲜样品的“r”值相比,超声微波解冻、超声远红外解冻、超声欧姆解冻、超声解冻没有显著性差异(P>0.05)。其中,超声微波解冻的“r”值与新鲜样品的最接近,这说明超声微波解冻对蛋白质的结构影响较小,可以更好地维持肌原纤维蛋白原有的特性。
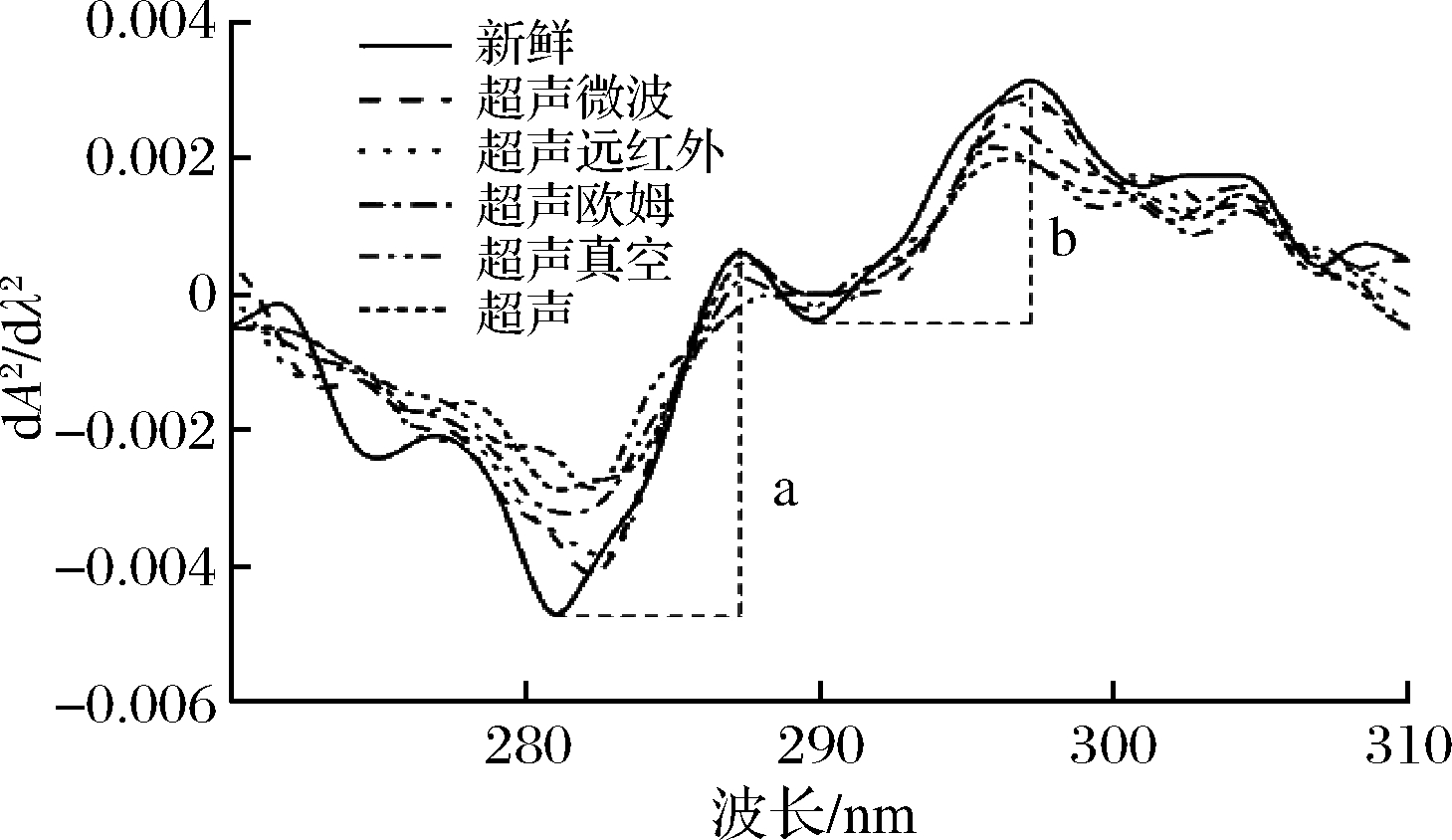
图2 不同解冻方式对肌原纤维蛋白紫外二阶
导光谱的影响
Fig.2 Effects of different thawing methods on
ultraviolet second derivative spectra of myofibrillar protein
2.3 内源荧光光谱
内源荧光光谱法是一种追踪蛋白质三级结构转变的技术[21]。色氨酸是一种必需氨基酸,通常包含在许多基于蛋白质的食品中。色氨酸埋藏在蛋白质的核心,对结构转变过程中微环境的极性特别敏感。当其他分子与蛋白质相互作用时,蛋白质构象也可能受到影响,色氨酸的荧光强度发生变化。最大荧光峰位的红移表明芳香氨基酸的极性环境增加,色氨酸处于亲水环境中,蛋白质结构展开[22];最大荧光峰位的蓝移表明蛋白聚集,色氨酸进入更疏水的环境[23]。如图3所示,新鲜样品的色氨酸的最大发射波长位于335 nm附近。与新鲜样品相比,超声微波解冻、超声远红外解冻、超声解冻的最大荧光峰位发生蓝移,超声欧姆解冻和超声真空解冻发生红移,但所有处理组间的最大荧光峰位没有显著性差异(P>0.05)。新鲜样品的荧光强度明显高于解冻后的样品,荧光强度的降低是由色氨酸的暴露和氧化造成的[24],也有可能是部分蛋白质的解聚导致从内部到表面的色氨酸残基增加,从而增强了色氨酸残基周围水分子的穿透,使色氨酸残基暴露在更极性的微环境中。超声微波解冻、超声远红外解冻的荧光强度和新鲜样品相比无显著性差异(P>0.05),这说明超声微波解冻和超声远红外解冻处理的样品有效地避免了蛋白质的结构破坏和变性,且超声微波解冻的荧光强度与新鲜样品最接近。超声欧姆解冻、超声真空解冻、超声解冻的荧光强度显著低于新鲜样品(P<0.05),说明蛋白质的结构被破坏。其中,超声解冻的蛋白质结构的受损程度比联合解冻方式更严重,这可能是因为解冻过程中氨基酸暴露在空气中的时间较长,氧化程度更高,从而导致荧光强度显著降低。CAI等[8]研究超声解冻、真空解冻、微波解冻、超声真空解冻和微波真空解冻对真鲷品质的影响,发现联合处理的样品具有更少的蛋白质损伤。
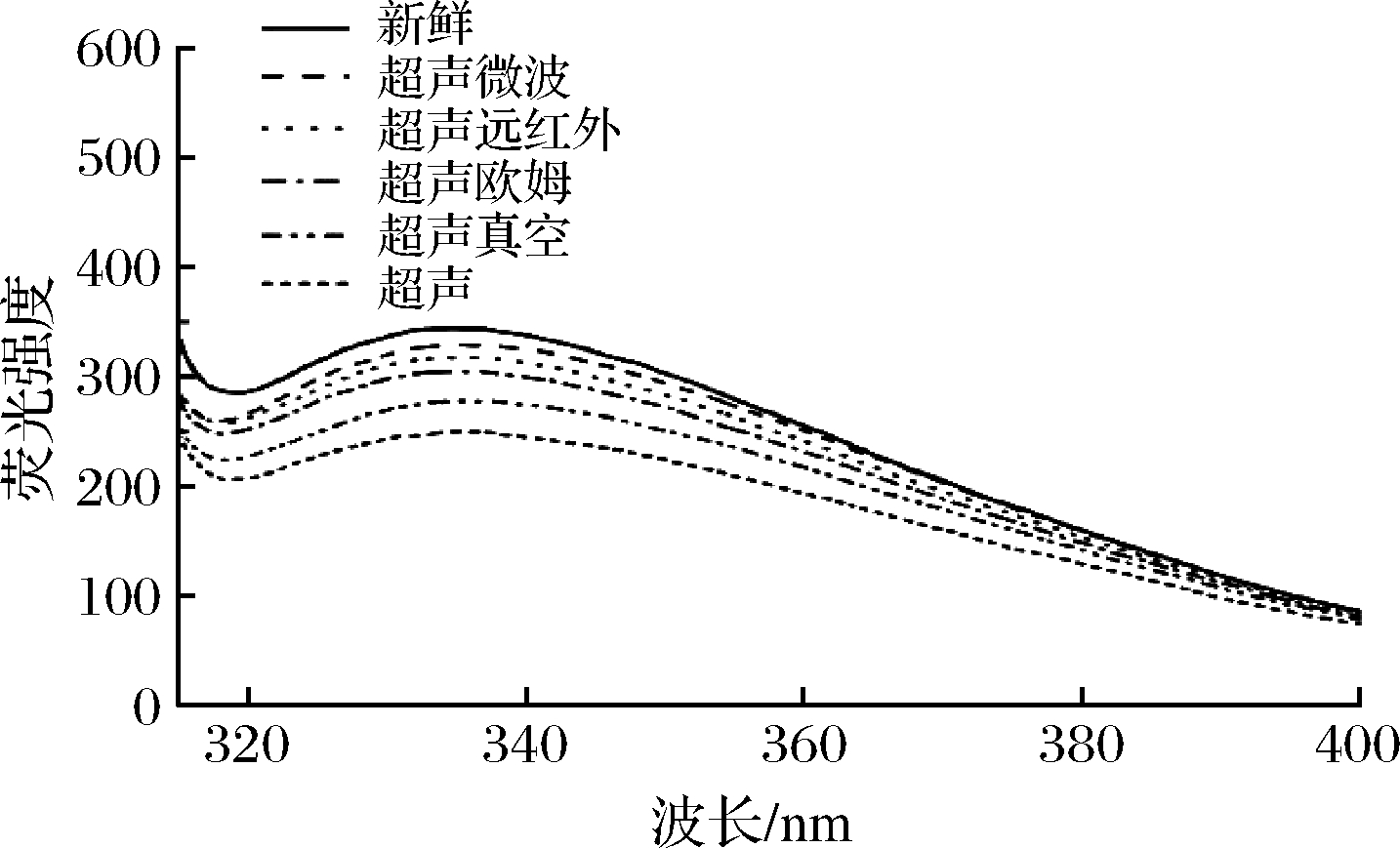
图3 不同解冻方式对肌原纤维蛋白内源荧光光谱的影响
Fig.3 Effects of different thawing methods on
intrinsic fluorescence scanning of myofibrillar protein
2.4 粒径
粒径可以用来表征肌原纤维蛋白的聚集程度。解冻过程中会产生热量,热诱导的肌原纤维蛋白聚集分为2个阶段:(1)单个蛋白分子的变性和展开,导致肌丝解离形成可溶性寡聚物;(2)在后续阶段中,连续加热后,未折叠的亚基可能会重新排列并彼此偶联,形成大的聚集体和化合物簇[25]。所有样品的粒径分布和平均直径如图4所示。在1 000 nm左右,只观察到新鲜样品、超声远红外解冻和超声欧姆解冻的一个峰,说明它们的粒径分布比较均匀。而超声真空解冻和超声解冻的新峰出现在约100 nm处,这个现象可以用肌原纤维蛋白聚集的第一阶段来解释;超声微波解冻的新峰出现在约10 000 nm处,这可能是因为肌原纤维蛋白发生了聚集的第二阶段。与新鲜样品相比,超声微波解冻和超声欧姆解冻的峰在1 000 nm处略微向左移动,颗粒尺寸分布更宽,这表明蛋白质的完整性被破坏,颗粒尺寸减小。同时,在1 000 nm处观察到超声远红外解冻、超声真空解冻和超声解冻的峰值向右偏移。这可能是由于蛋白质变性从而导致肌原纤维蛋白的三级和四级结构的聚集[26]。由图4可知,超声微波解冻的有效粒径最小,超声解冻的有效粒径最大。相较于新鲜样品,超声远红外解冻、超声欧姆解冻、超声真空解冻和超声解冻的蛋白质有效粒径增大。蛋白质的有效粒径的增大可能是由于蛋白质的氧化作用,从而使蛋白质分子形成二硫键并发生聚集。SUN等[27]发现,除了热相互作用和蛋白降解外,巯基和二硫键的转换可能导致肌纤维蛋白的有效粒径发生变化。FU等[28]研究出蛋白质的疏水基团氧化后暴露,通过疏水相互作用使蛋白质聚集,使肌纤维蛋白的有效粒径增大。新鲜样品和解冻后样品的有效粒径间没有显著性差异(P>0.05)。因此,解冻后的所有肌原纤维蛋白均能保持稳定的结构。其中,超声微波解冻、超声远红外解冻和超声欧姆解冻的有效粒径与新鲜样品最接近。结果表明,超声微波解冻、超声远红外解冻和超声欧姆解冻的肌原纤维蛋白能够在解冻过程中保持相对稳定的状态。

图4 不同解冻方式对肌原纤维蛋白粒径分布的影响
Fig.4 Effects of different thawing methods on the
particle size distribution of myofibrillar protein
2.5 Zeta电位
Zeta电位是影响分散体系稳定性的基本参数之一,是描述颗粒之间排斥或吸引的强度的参数。可以表示蛋白质表面的有效电荷,反映着蛋白质的分散和聚集[29]。由图5可知,所有的Zeta电位值都是负数。用|ξ|来表示Zeta电位的绝对值。静电排斥可以降低蛋白质分子之间聚集的可能性,从而维持系统的稳定性。较高的|ξ|意味着同性电荷的静电排斥增强,使蛋白质溶液更稳定,从而削弱了蛋白质之间的相互作用,形成的分子或分散的颗粒较小[30]。反之,较低的|ξ|,静电排斥低,蛋白质容易发生聚合。超声微波解冻,超声真空解冻和超声解冻的|ξ|低于新鲜样品,这表明经超声微波解冻、超声真空解冻、超声解冻后,蛋白质有一定的聚集,稳定性略有下降。超声远红外解冻的|ξ|最大,并且超声远红外解冻和超声真空解冻的|ξ|高于新鲜样品,这可能是因为在超声远红外解冻和超声真空解冻的复杂解冻过程中蛋白质发生了解聚。解冻后样品的Zeta电位值出现高于或低于新鲜样品的现象,这可以归因于热诱导的肌原纤维蛋白分别处于聚集的2个阶段。与新鲜样品相比,所有的解冻处理的Zeta电位无显著性差异(P>0.05),保留了肌原纤维蛋白原有的状态,与上述粒径的结果一致。这说明所有的解冻方法都能有效地防止蛋白氧化和聚集,得到相对稳定的蛋白溶液体系。
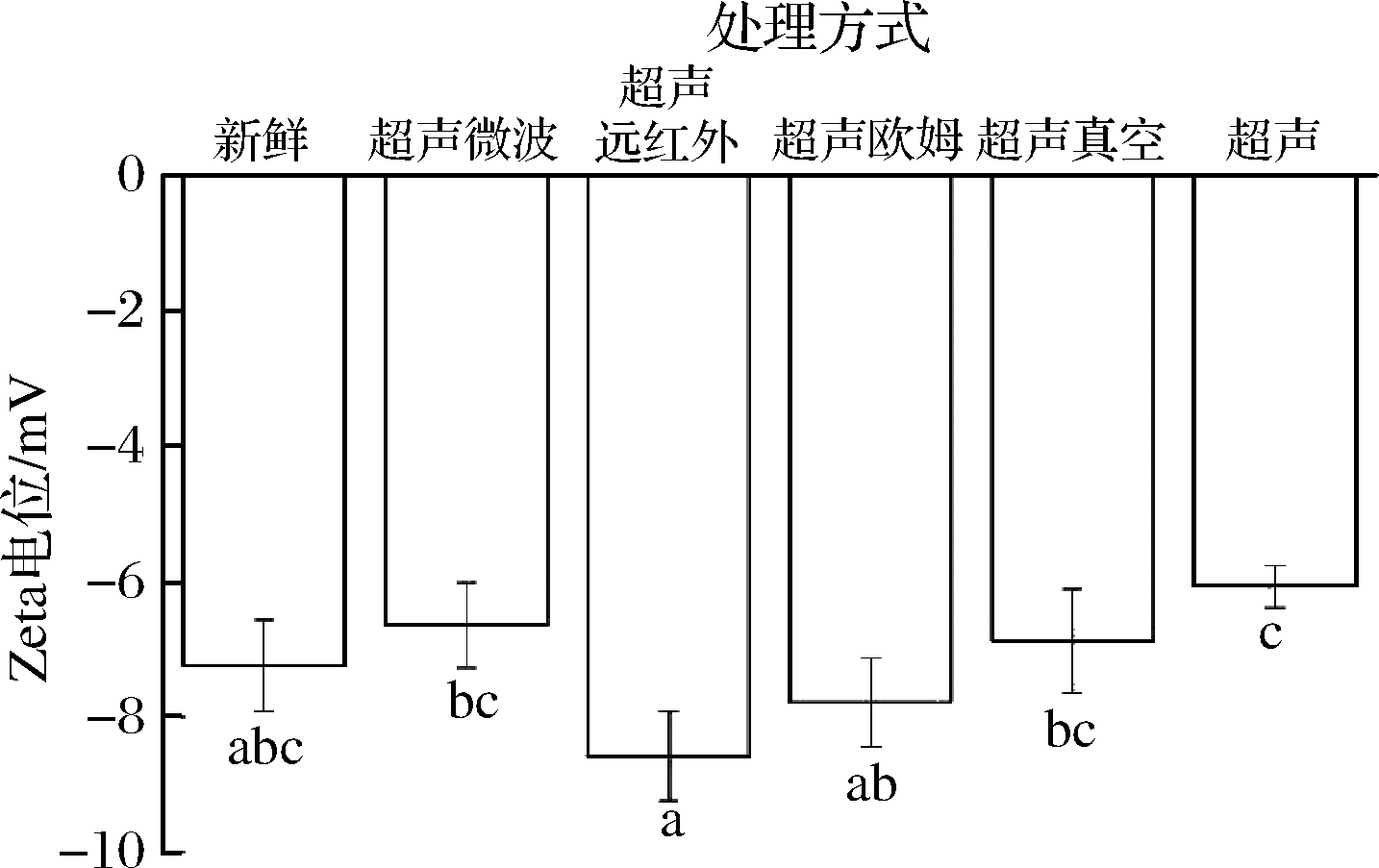
图5 不同解冻方式对肌原纤维蛋白电位的影响
Fig.5 Effects of different thawing methods on
Zeta potential of myofibrillar protein
注:不同小写字母表示差异显著(P<0.05)(下同)
2.6 SDS-PAGE
图6中为6种不同处理方式的电泳图谱。肌原纤维蛋白的主要条带有肌球蛋白重链(200 kDa)、肌动蛋白(48 kDa)、原肌球蛋白(35 kDa)和肌球蛋白轻链(10~30 kDa)。可以观察到,肌球蛋白重链和肌动蛋白的条带较宽,说明肌原纤维蛋白主要由肌球蛋白和肌动蛋白组成。其中,肌球蛋白重链是分析鱼肉的理化性质有关的最重要的蛋白质[31]。新鲜样品的肌球蛋白重链条带颜色最深且宽,解冻处理后的条带颜色较浅。这可能是由于在解冻过程中,蛋白质在极端条件下的交联受到限制,或者是肌球蛋白重链氧化,二硫键和羰基的形成导致蛋白质降解,溶解度降低[32]。超声解冻的肌球蛋白重链条带颜色最浅,蛋白聚合物降解程度最严重,这可能是因为单独超声波产生的空化对肌原纤维蛋白影响更大。超声微波解冻的电泳条带与新鲜样品最接近,可能是因为较快的解冻速度抑制肌球蛋白重链浓度的降低并减少蛋白质降解,较好地保持了肌原纤维蛋白原有的理化性质。

图6 不同解冻方式的肌原纤维蛋白SDS-PAGE电泳图谱
Fig.6 The SDS-PAGE diagram of myofibrillar
protein of different thawing methods
2.7 总巯基含量
总巯基含量会影响蛋白质的功能特性,可以用来表示蛋白质的氧化程度[33]。总巯基含量是指蛋白质分子的所有巯基,包括暴露在表面的(反应性巯基)和埋在蛋白质中的。肌原纤维蛋白主要由肌球蛋白和肌动蛋白组成,包含了许多易受氧自由基影响的巯基基团,并容易转化为分子内和分子间二硫键。巯基的减少和二硫键的形成是肌肉蛋白聚集结构形成的关键。但是,ZHANG等[34]指出在强氧化条件下,巯基的损失与二硫键的生成并不完全对应。解冻过程中会产生热量并发生挤压,这也可能导致蛋白质解折叠并影响二硫键和巯基的含量[20]。二硫键在蛋白质聚合中起着重要的作用,但过多的二硫键会阻碍反应官能团的有序相互作用,导致凝胶化能力下降[32]。由图7可知,新鲜样品的总巯基含量高于解冻后的样品。这是由于在解冻过程中,蛋白质展开,巯基暴露于表面,被氧化成二硫键[35]。超声解冻的总巯基含量最低,和新鲜样品有显著性差异(P<0.05)。超声微波解冻、超声远红外解冻、超声欧姆解冻和超声真空解冻的总巯基含量与新鲜样品无显著性差异(P>0.05),这说明这些解冻方法的蛋白氧化程度较低。其中,超声微波解冻和超声远红外解冻的总巯基含量和新鲜样品更接近。因此,超声微波解冻和超声远红外解冻能有效地阻止蛋白质的氧化。李慢[36]发现超声解冻的虾肉蛋白质巯基含量较高、氧化程度较低,但本文中所有超声辅助解冻处理的均高于单独的超声解冻,说明超声辅助解冻对海鲈鱼肌原纤维蛋白的功能特性影响较小。

图7 不同解冻方式对肌原纤维蛋白总巯基
含量的影响
Fig.7 Effects of different thawing methods on the
content of total sulfhydryl (SH) groups of myofibrillar protein
2.8 溶解度
蛋白质的溶解度是反映蛋白质变性程度的常见指标之一[37]。溶解度也是蛋白质功能性质的重要表现,蛋白质与水分子通过肽键(偶极-偶极或氢键相互作用)或氨基酸侧链(内化、极性甚至非极性基团相互作用)相互作用[11],影响了蛋白质的保水性、发泡性、乳化性等。由图8可知,新鲜样品的蛋白溶解度显著高于解冻样品(P<0.05)。蛋白质氧化过程中,形成了二硫键、二酪氨酸和羰基,二硫化物发生交联,疏水基团的结构疏松暴露出来,蛋白质变性,导致溶解度降低,这与上述巯基总含量的结果一致。肌原纤维蛋白在解冻过程中会经历构型变化,这受到疏水性增加的支持,对热稳定性的影响较小。超声解冻的蛋白溶解度最低,说明大量蛋白质通过疏水作用形成聚集体,导致蛋白质高度变性。超声微波解冻、超声远红外解冻、超声欧姆解冻和超声解冻的溶解度没有显著性差异(P>0.05)。超声真空解冻的溶解度明显高于其他解冻方法(P<0.05),这可能是由于超声真空解冻是2种非热解冻方式的结合,蛋白氧化程度较低。

图8 不同解冻方式对肌原纤维蛋白溶解度的影响
Fig.8 Effects of different thawing methods on the
solubility of myofibrillar protein
3 结论
不同超声辅助解冻方式对肌原纤维蛋白有着不同的影响。实验结果表明,超声辅助解冻方式比单独的超声解冻更有效的维持蛋白质原有的特性。超声微波解冻和超声真空解冻的α-螺旋的含量与新鲜样品接近,维持蛋白质二级结构的能力较强。超声微波解冻样品的“r”值和荧光强度与新鲜样品最接近,有效地避免了蛋白质结构的破坏。所有处理组的蛋白粒径、Zeta电位无显著性差异(P<0.05),蛋白质未发生明显聚集。但凝胶电泳的结果表明超声解冻的蛋白质严重降解。超声微波解冻和超声远红外解冻样品的总巯基含量与新鲜样品无显著性差异(P>0.05),氧化程度较低。综上所述,超声微波解冻是一种能较好地维持海鲈鱼蛋白结构、防止蛋白聚集、抑制蛋白氧化的解冻方法。
[1] 谭明堂, 谢晶, 王金锋. 解冻方式对鱿鱼品质的影响[J]. 食品科学, 2019, 40(13): 94-101.
[2] YUAN C H,YU K F,CHEN S S,et al. Effect of freezing rate on the denaturation of myofibrillar proteins[J]. International Journal of Food Science & Technology, 2007, 20(6): 735-744.
[3] SRIKET P, BENJAKUL S, VISESSANGUAN W, et al. Comparative studies on the effect of the freeze-thawing process on the physicochemical properties and microstructures of black tiger shrimp (Penaeus monodon) and white shrimp (Penaeus vannamei) muscle[J]. Food Chemistry, 2006, 104(1): 113-121.
[4] XIA X F, KONG B H, LIU Q, et al. Physicochemical change and protein oxidation in porcine longissimus dorsi as influenced by different freeze-thaw cycles[J]. Meat Science, 2009, 83(2): 239-245.
[5] HOWELL N K, HERMAN H, LI-CHAN E C. Elucidation of protein-lipid interactions in a lysozyme-corn oil system by Fourier transform raman spectroscopy[J]. Journal of Agricultural & Food Chemistry, 2001, 49(3): 1 529-1 533.
[6] LIU G, XIONG Y L, BUTTERFIELD D A, et al. Chemical, physical, and gel-forming properties of oxidized myofibrils and whey- and soy-protein isolates[J]. 2000, 65(5): 811-818.
[7] CAI L Y, ZHANG W D, CAO A L, et al. Effects of ultrasonics combined with far infrared or microwave thawing on protein denaturation and moisture migration of Sciaenops ocellatus (red drum)[J]. Ultrasonics Sonochemistry, 2019, 55: 96-104.
[8] CAI L Y, CAO M J, CAO A L, et al. Ultrasound or microwave vacuum thawing of red seabream (Pagrus major) fillets[J]. Ultrasonics Sonochemistry, 2018, 47: 122-132.
[9] 年琳玉. 鲱鱼抗冻蛋白对真鲷品质特性的影响及抗冻机制研究[D]. 锦州:渤海大学, 2019.
[10] 李秀霞, 马莹莹, 刘宏影, 等. 超声波处理对金枪鱼肌原纤维蛋白理化性质和结构的影响[C]. 中国食品科学技术学会第十六届年会暨第十届中美食品业高层论坛论文摘要集. 北京:中国食品科学技术学会, 2019: 557-558.
[11] ZHANG M C, LI F F, DIAO X P, et al. Moisture migration, microstructure damage and protein structure changes in porcine longissimus muscle as influenced by multiple freeze-thaw cycles[J]. Meat Science, 2017, 133: 10-18.
[12] 李瑞平. 微波场内草鱼鱼肉蛋白营养和结构性质的研究[D]. 南昌:南昌大学, 2015.
[13] COSMIN M,BELICIU, CARMEN I. The effect of protein concentration and heat treatment temperature on micellar casein-soy protein mixtures[J]. Food Hydrocolloids, 2011, 25(6): 1 448-1 460.
[14] 姜晴晴, 吴春华, 董开成, 等. 解冻方式对带鱼蛋白性质及肌肉品质的影响[J]. 中国食品学报, 2016, 16(11): 17-27.
[15] HERRERO A M. Raman spectroscopy for monitoring protein structure in muscle food systems[J]. Critical Reviews in Food Science & Nutrition, 2008, 48(6): 512-523.
[16] 孙攀. 超声波处理对金枪鱼肌原纤维蛋白理化特性、结构和凝胶特性的影响[D]. 锦州:渤海大学, 2019.
[17] GUO J J, ZHOU Y H, YANG K, et al. Effect of low-frequency magnetic field on the gel properties of pork myofibrillar proteins[J]. Food Chemistry, 2019, 274: 775-781.
[18] JIANG J, CHEN J, XIONG Y L. Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline ph-shifting processes[J]. Journal of Agricultural and Food Chemistry, 2009, 57(16): 7 576-7 583.
[19] RAGONE R, COLONNA G, BALESTRIERI C, et al. Determination of tyrosine exposure in proteins by second-derivative spectroscopy[J]. Biochemistry, 1984, 23(8): 1 871-1 875.
[20] ZHAO J Y, DONG F J, LI Y Y, et al. Effect of freeze-thaw cycles on the emulsion activity and structural characteristics of soy protein isolate[J]. Process Biochemistry, 2015, 50(10): 1 607-1 613.
[21] GUO X, QIU H H, DENG X R, et al. Effect of chlorogenic acid on the physicochemical and functional properties of coregonus peled myofibrillar protein through hydroxyl radical oxidation[J]. Molecules, 2019, 24(17): 3 205.
[22] ZOU Y, YANG H, ZHANG M H, et al. The influence of ultrasound and adenosine 5′-monophosphate marination on tenderness and the structures of myofibrillar proteins of beef[J]. Asian Australasian Journal of Animal Sciences, 2019, 32(10): 1 611-1 620.
[23] CAO M J, WANG J, CAO A L, et al. The impact of recrystallisation on the freeze - thaw cycles of red seabream (Pagrus major) fillets[J]. International Journal of Food Science and Technology. 2019, 54(5): 1 642-1 650.
[24] NIU J Z, ZHAO B F, GUO X J, et al. Effects of vacuum freeze-drying and vacuum spray-drying on biochemical properties and functionalities of myofibrillar proteins from silver carp[J]. Journal of Food Quality, 2019, 2019: 1-8.
[25] CHEN X, XIONG Y L, XU X L. High-pressure homogenization combined with sulfhydryl blockage by hydrogen peroxide enhance the thermal stability of chicken breast myofibrillar protein aqueous solution[J]. Food Chemistry, 2019, 285: 31-38.
[26] ZHENG J B, HAN Y R, GE G, et al. Partial substitution of NaCl with chloride salt mixtures: Impact on oxidative characteristics of meat myofibrillar protein and their rheological properties[J]. Food Hydrocolloids, 2019, 96: 36-42.
[27] SUN W Z, ZHAO M M, YANG B, et al. Oxidation of sarcoplasmic proteins during processing of cantonese sausage in relation to their aggregation behaviour and in vitro digestibility[J]. Meat Science, 2011, 88(3): 462-467.
[28] FU Q Q, LIU R, WANG H O, et al. Effects of oxidation in vitro on structures and functions of myofibrillar protein from beef muscles[J]. Journal of Agricultural & Food Chemistry, 2018, 67(20): 5 866-5 873.
[29] ZHOU L, FENG X, YANG Y L, et al. Effects of high-speed shear homogenization on the emulsifying and structural properties of myofibrillar protein under low-fat conditions[J]. Journal of the Science of Food and Agriculture, 2019, 99(14): 6 500-6 508.
[30] LI F F, WANG B, LIU Q, et al. Changes in myofibrillar protein gel quality of porcine longissimus muscle induced by its stuctural modification under different thawing methods[J]. Meat Science, 2019, 147: 108-115.
[31] GAO W H, HUANG Y P, ZENG X, et al. Effect of soluble soybean polysaccharides on freeze-denaturation and structure of myofibrillar protein of bighead carp surimi with liquid nitrogen freezing[J]. International Journal of Biological Macromolecules, 2019, 135: 839-844.
[32] LIN D Q, ZHANG L T, LI R J, et al. Effect of plant protein mixtures on the microstructure and rheological properties of myofibrillar protein gel derived from red sea bream (Pagrosomus major)[J]. Food Hydrocolloids, 2019, 96: 537-545.
[33] XIA M Q, CHEN Y X, GUO J J, et al. Effects of oxidative modification on textural properties and gel structure of pork myofibrillar proteins[J]. Food Research International, 2019, 121: 678-683.
[34] ZHANG L T, GUI P, ZHANG Y Q, et al. Assessment of structural, textural, and gelation properties of myofibrillar protein of silver carp (Hypophthalmichthys molitrix) modified by stunning and oxidative stress[J]. LWT - Food Science and Technology, 2018, 102: 142-149.
[35] CHENG J R, ZHU M J, LIU X M. Insight into the conformational and functional properties of myofibrillar protein modified by mulberry polyphenols[J]. Food Chemistry, 2020, 308: 125 592.
[36] 李慢. 超声辅助解冻对中国对虾品质影响的研究[D]. 杭州:浙江大学, 2018.
[37] DYMERSKI T, GEιBICKI J, WARDENCKI W, et al. Application of an electronic nose instrument to fast classification of polish honey types[J]. Sensors, 2014, 14(6): 10 709-10 724.