食用油是日常生活中重要的调味品,由多种脂肪酸混合而成,为人体提供能量和必需脂肪酸,是促进脂溶性维生素吸收的重要成分[1]。按照不饱和程度分类,脂肪酸可大致分为饱和脂肪酸(saturated fatty acid,SFA)、不饱和脂肪酸(unsaturated fatty acid,UFA)、以及反式脂肪酸(trans fatty acid,TFA)3大类,其中不饱和脂肪酸又可分为单不饱和脂肪酸(monounsaturated fatty acids,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)。SFA主要来源于动物类油脂,包括丁酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、花生酸等[2],具有调节免疫应答、抑制肿瘤生长、促进细胞分化和凋亡的作用。MUFA是含有一个双键的脂肪酸,广泛分布于动物脂肪和植物油中,具有保护心脏、降血糖、调节血脂、降低胆固醇等功能[3]。PUFA又叫多烯酸,是含有2个及2个以上双键的脂肪酸。与SFA相比,PUFA具有更多的功效,能降低血液黏稠度,改善血液微循环,增强人体防御系统[4]。PUFA系列繁多,最具生物学意义的是ω-3和ω-6系列,如花生四烯酸(arachidonic acid,AA)、二十二碳五烯酸(docosapentaenoic acid,DPA)等。TFA主要产生于高温油炸过程中,对人体健康有着巨大的危害[5]。大部分的脂肪酸无法通过人体自身合成,需要通过食物获取,因此合理、均衡的油脂摄入有益于机体健康。不同种类的脂肪酸各有优缺点,通过脂肪酸平衡配比能很好地综合各类油脂的优点,同时弥补各自的缺点[6]。1977年9月世界卫生组织与联合国粮农组织首次提出有关脂肪酸平衡的概念,部分专家提出MUFA∶PUFA∶SFA=1∶1∶1的脂肪酸平衡比例。“金龙鱼”食用植物调和油是在此比例的基础上研发而出,其SFA∶MUFA∶PUFA=0.27∶1∶1,PUFA(n-6)∶PUFA(n-3)=5∶1,帮助人体脂肪酸达到1∶1∶1的平衡比例,深受广大消费者的欢迎。《中国居民膳食指南(2007)》建议每人每天油脂的用量应不超过25 g或30 g[6],然而随着生活水平的不断提高,人均每天油脂摄入量已经远远超过建议用量,致使心血管疾病、肥胖、脂肪肝等多种慢性病的患病率增加。本研究从肠道微生态的角度来分析不同剂量“金龙鱼”食用植物调和油对正常小鼠肠道内可培养微生物以及肠道功能酶的影响,结合血常规等指标,为食用油的合理膳食提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 动物
6周龄无特定病原体(specific pathogen free,SPF)级昆明小鼠30只,18~22 g,雌雄各15只,购于湖南斯莱克景达实验动物有限公司。动物编号SCXK(湘)2013-0004。
1.1.2 饲料、垫料
普通维持饲料和普通杨木垫料,购于湖南斯莱克景达实验动物有限公司。
1.1.3 动物屏障环境
湖南中医药大学动物实验中心(室温23~25 ℃,相对湿度50%~70%)。设施使用许可证编号SYXK(湘)2019-0009。
1.1.4 培养基
乳酸菌(MRS培养基)、细菌总数(牛肉膏蛋白胨培养基)、双歧杆菌(BBL培养基)、大肠杆菌(伊红美蓝培养基)、配制参考文献的方法进行[7]。
1.1.5 试剂
植物油为金龙鱼1∶1∶1食用植物调和油:大豆油(49.0%)、菜籽油(23.5%)、葵花籽油(14.0%)、玉米油(9.0%)、稻米油(3.0%)、芝麻油(0.6%)、花生油(0.5%)、胡麻油(0.4%);羧甲基纤维素钠、三氯乙酸,国药集团化学试剂有限公司;干酪素,武汉佰兴生物科技有限公司;木聚糖,上海山蒲化工有限公司;淀粉、NaOH,西陇化工股份有限公司;Na2CO3,湖南汇虹试剂有限公司;福林酚,合肥博美生物科技有限责任公司;DNS,实验室配制。
1.1.6 仪器与设备
手提式压力蒸汽灭菌锅,浙江新丰医疗器械有限公司;分光光度计,上海创萌生物科技有限公司;SH2-82气浴恒温振荡器,太原仪城实验设备有限公司;HHBII.500-s电热恒温培养箱,上海博泰实验设备有限公司;恒温水浴锅,上海精密仪器仪表有限公司;CA-500 血液自动分析仪,山东兰桥医学科技有限公司。
1.2 实验方法
1.2.1 动物分组及处理
30只昆明小鼠适应性喂养2 d后,采用随机数字表发分为正常组、A组、B组、C组、D组。正常组灌胃蒸馏水0.2 mL/次,A、B、C、D组分别按6.67 mL/(kg·d)(0.1 mL/次)、13.33 mL/(kg·d)(0.2 mL/次)、20.00 mL/(kg·d)(0.3 mL/次)、26.67 mL/(kg·d)(0.4 mL/次)的剂量灌胃“金龙鱼”食用植物调和油,每天2次,间隔8 h,连续30 d。
1.2.2 小鼠肠道指标测定
小鼠肠道内容物的提取、微生物数量的测定、酶活性的分析参照文献[8-10]的方法进行。
1.2.3 血常规测定
实验前禁食12 h,禁水1 h,眼球采血1.0~1.5 mL,注入乙二胺四乙酸二钾(ethylenediamine tetraacetic acid disodium salt-K2,EDTA-K2)抗凝管中,混匀后,运用CA-500 血液自动分析仪采用阻抗法测定各组小鼠血常规指标。
1.2.4 统计学分析
用SPSS 21.00软件处理数据,所得数据采用平均值±标准差(x±s)表示,多组均数比较若符合条件则用单因素方差分析,否则采用多组秩和检验。
2 结果与分析
2.1 不同剂量植物油对小鼠肠道微生物的影响
植物油对小鼠肠道微生物的影响见表1。由表1可知,植物油可以显著降低小鼠肠道细菌总数和大肠杆菌数(P<0.05),而细菌总数在不同剂量植物油组间差异不显著(P>0.05),大肠杆菌数除A组和C组无显著差异外(P>0.05),其余剂量的植物油组间均存在显著性差异(P<0.05)。从乳酸菌数来看,低剂量组(A组)和高剂量组(D组)能显著降低正常小鼠肠道内乳酸菌数P<0.05),而中剂量组(B、C组)则能升高正常小鼠肠道乳酸菌数,但与正常组比,升高的幅度与正常组小鼠相比差异不显著(P>0.05)。双歧杆菌数也表现出类似的规律,低剂量组(A组)能降低小鼠双歧杆菌数,中剂量组则能升高正常小鼠双歧杆菌数,2组双歧杆菌数与正常组差异显著(P<0.05)。综合分析4种可培养肠道微生物,提示适当摄入植物油能增加有益菌的数量,减少大肠杆菌等条件致病菌的数量。
表1 不同剂量植物油对小鼠肠道微生物的影响
Table 1 Effects of different doses of vegetable oil on
intestinal microorganisms in mice
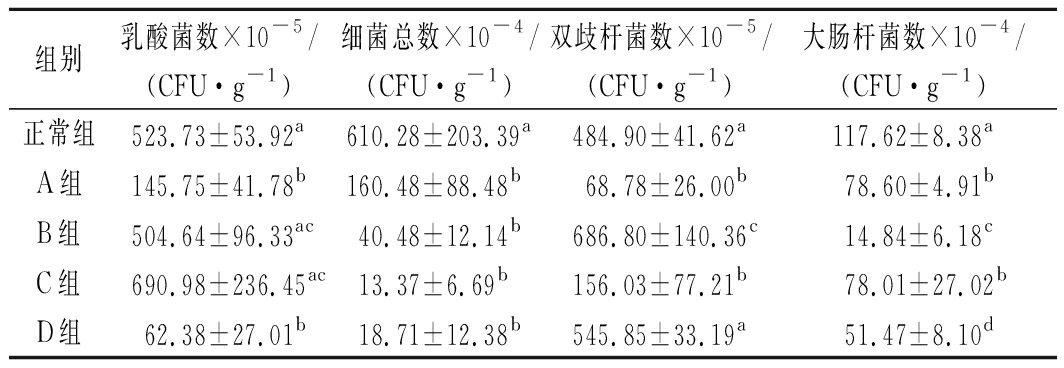
组别乳酸菌数×10-5/(CFU·g-1)细菌总数×10-4/(CFU·g-1)双歧杆菌数×10-5/(CFU·g-1)大肠杆菌数×10-4/(CFU·g-1)正常组523.73±53.92a610.28±203.39a484.90±41.62a117.62±8.38aA组145.75±41.78b160.48±88.48b68.78±26.00b78.60±4.91bB组504.64±96.33ac40.48±12.14b686.80±140.36c14.84±6.18cC组690.98±236.45ac13.37±6.69b156.03±77.21b78.01±27.02bD组62.38±27.01b18.71±12.38b545.85±33.19a51.47±8.10d
注:同列不同小写字母表示差异显著(P<0.05)(下同)
2.2 不同剂量植物油对小鼠肠道酶活性的影响
如图1所示,与正常组比,A组的4种肠道酶活性均升高,差异显著(P<0.05)。就蛋白酶而言,正常组的蛋白酶活显著低于植物油摄入组(P<0.05),其中C组的蛋白酶活最高,与其他各组差异显著(P<0.05)。C组的纤维素酶活与其他各组比差异不显著(P>0.05);A组的纤维素酶活最高,显著高于正常组、植物油B组及D组(P<0.05);与A组纤维素酶活变化相反,B组及D组的纤维素酶活显著低于正常组(P<0.05)。除B组的木聚糖酶与正常组比无差异外,其余各组与正常组比均差异显著(P<0.05)。与纤维素酶相似,木聚糖酶活在植物油A组最高,显著高于其他各组(P<0.05),而C组及D组木聚糖酶活显著低于正常组和B组(P<0.05)。植物油D组的木聚糖酶活性显著高于植物油C组(P<0.05)。与正常组比,A组、B组的淀粉酶活性显著升高(P<0.05),而C组显著降低(P<0.05);A组的淀粉酶活与其他各组均具有显著差异(P<0.05);植物油B组的淀粉酶活显著高于C组、D组(P<0.05)。
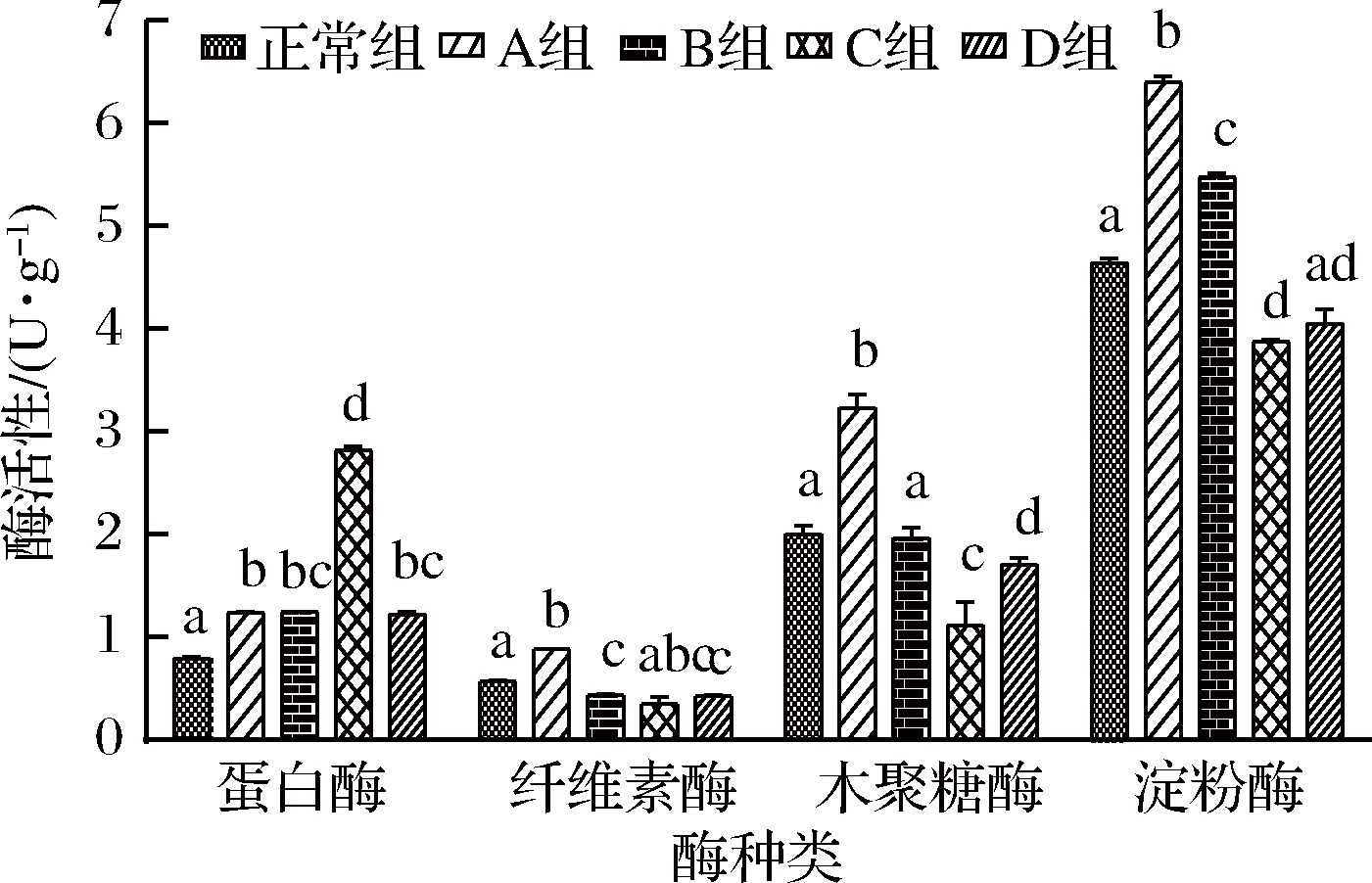
图1 不同剂量植物油对小鼠肠道酶活性的影响
Fig.1 Effect of different doses of vegetable oil on
intestinal enzyme activity in mice
注:同种酶中不同小写字母表示差异显著(P<0.05)
2.3 不同剂量植物油对小鼠红细胞的影响
红细胞(red blood cells,RBC)是机体运输氧气的主要媒介物质,同时还有一定的免疫功能。红细胞分布宽度(red blood cell distribution width,RDW)是反映红细胞体积变化大小的变异性指标系数,红细胞的平均体积(mean corpuscular volume,MCV)降低常见于小细胞低色素贫血和全身性溶血性贫血,因此RDW和MCV常用于贫血的辅助诊断[11]。红细胞比容(hematocrit value,HCT)是血液黏度的主要决定因素,与冠心病、高血压病、冠状动脉慢回流等多种心血管疾病有着密切的联系[12]。由图2可知,不同剂量的植物油对RBC、HCT、MCV及RDW的影响均无统计学意义(P<0.05)。但仔细分析HCT、MCV以及RDW的变化,不难发现植物油组的HCT和RDW略微高于正常组,HCT的提高提示油脂对心血管疾病有着潜在的风险,而RDW的升高则提示红细胞的形态出现异常。研究指出RDW水平较高的人群存在着更高的心血管不良预后风险[13]。综上可知,植物油对机体红细胞的影响可能是长期、慢性的,高油脂的摄入会使患心血管疾病的风险增加。

图2 不同剂量植物油对小鼠红细胞的影响
Fig.2 Effect of different doses of vegetable oil on
red blood cells of mice
2.4 不同剂量植物油对小鼠血小板的影响
血小板是机体正常凝血机制中的关键成分,其质量与数量反映骨髓造血功能和凝血功能状态[14]。血小板的参数由血小板计数(platelet count,PLT)、血小板比容(thrombocytocrit,PCT)、血小板平均体积(mean platelet volume,MPV)以及血小板体积分布宽度(platelet distribution width,PDW)组成,血小板参数的变化可以间接反映机体骨髓造血功能。李月等[15]研究发现,PDW值与血小板活化呈正相关,可作为新型血小板活化特异性标志物的评价。由图3可知,较大剂量的植物油能减少PLT和PCT,升高MPV和PDW值,但与正常组相比差异不显著(P>0.05),并且不同剂量植物油组间的差异也不显著。从这些变化中得知,PDW值与血小板活化呈正相关,而血小板活化是血栓形成的重要环节,因此摄入油脂过多容易引发血栓。
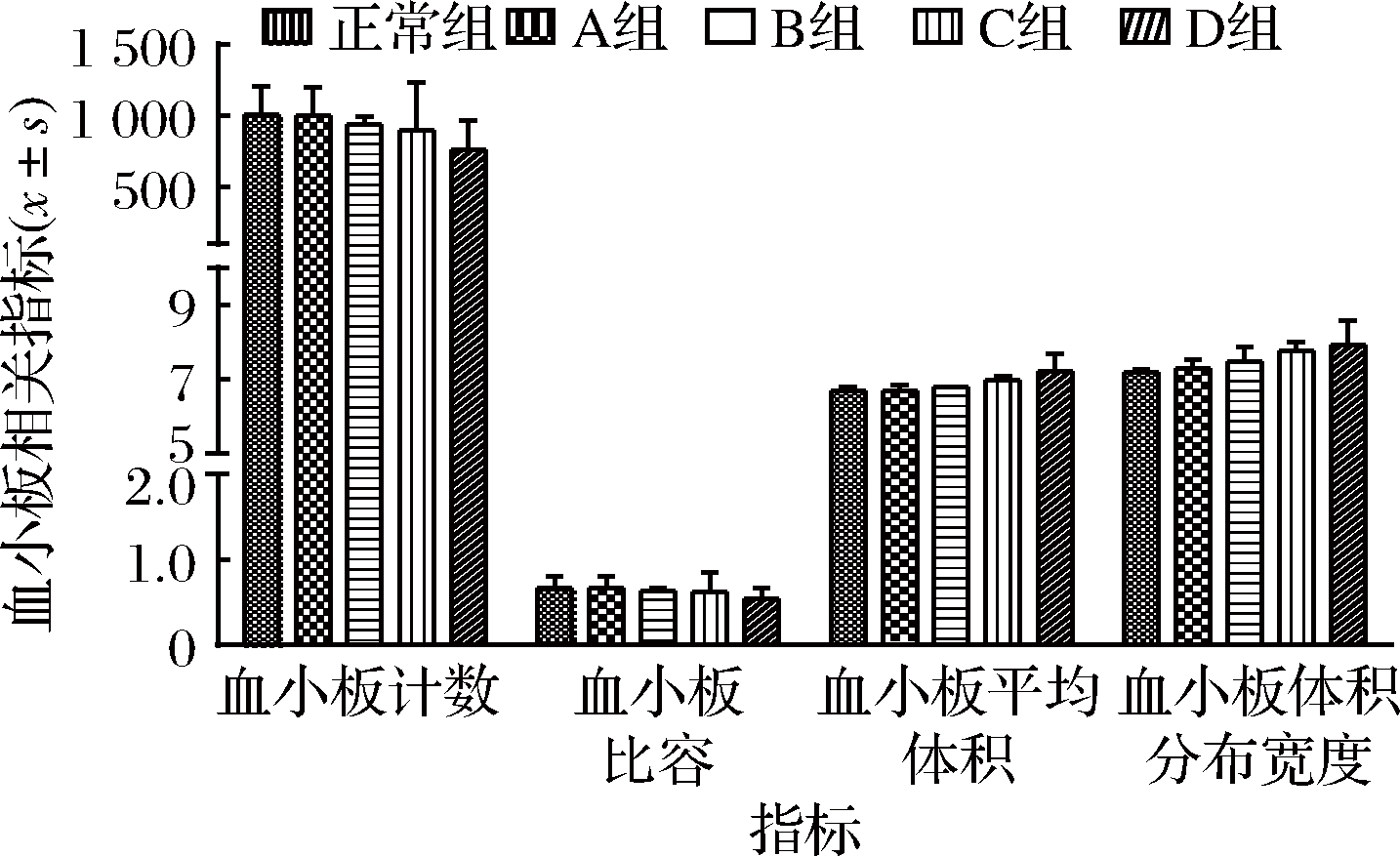
图3 不同剂量植物油对小鼠血小板的影响
Fig.3 Effects of different doses of vegetable oil on platelets in mice
2.5 不同剂量植物油对小鼠血红蛋白的影响
血红蛋白(hemoglobin,HGB)具有维持血液酸碱平衡以及运输氧和二氧化碳的功能。如图4所示,不同剂量植物油对正常小鼠的HGB、平均血红蛋白量(mean corpuscular hemoglobin,MCH)、平均血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)无显著性差异(P>0.05),提示植物油对机体的血红蛋白基本无影响。
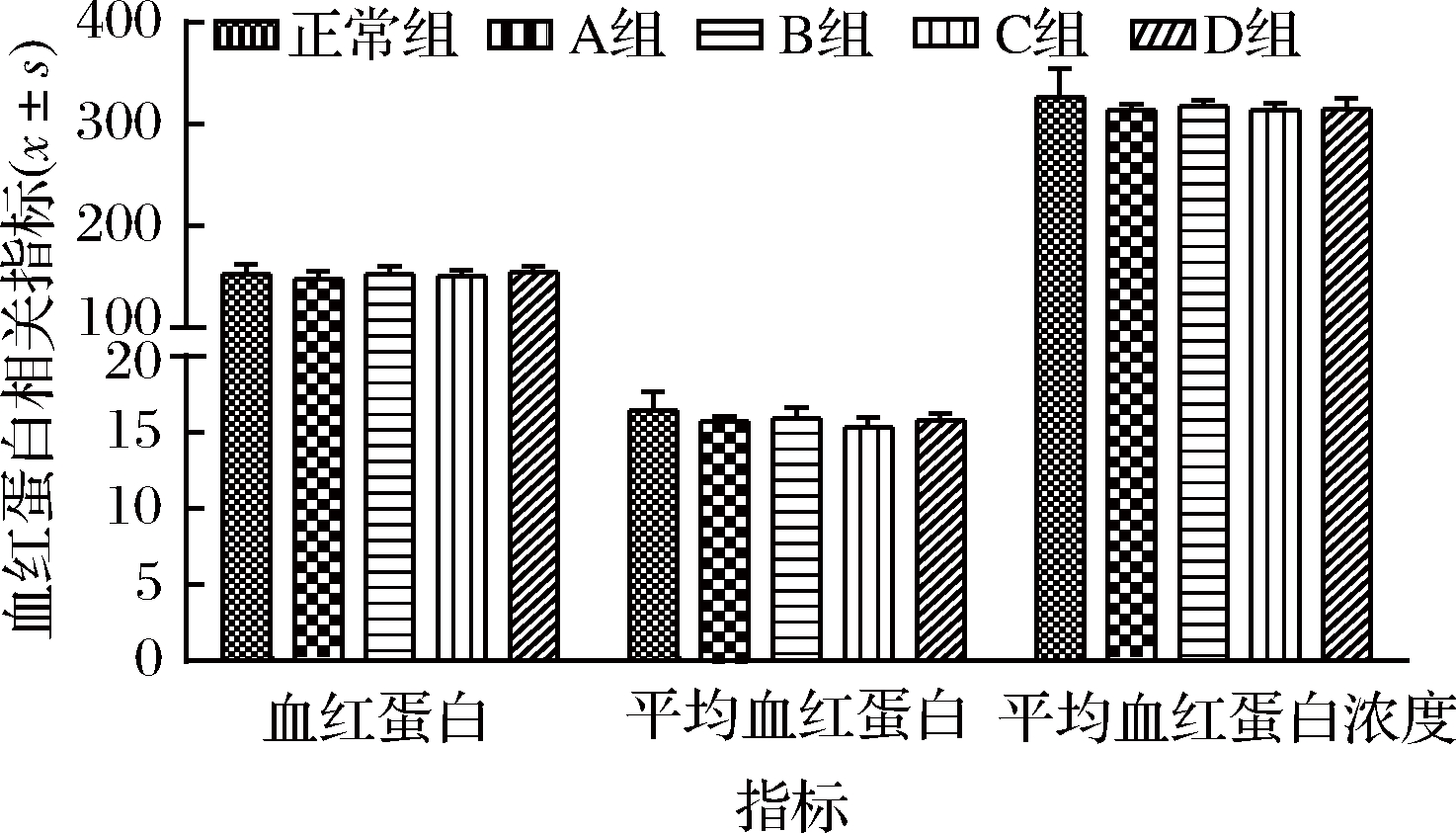
图4 不同剂量植物油对小鼠血红蛋白的影响
Fig.4 Effect of different doses of vegetable oil on
hemoglobin in mice
2.6 不同剂量植物油对小鼠白细胞的影响
白细胞对防止机体损伤和抵御病原体的侵入具有重要作用,主要包括粒细胞、单核细胞和淋巴细胞。如表2所示,低、中剂量植物油对正常小鼠的淋巴细胞(lymphocyte,LYM)以及中性粒细胞(granulocyte,GRA)并无显著影响,而高剂量植物油使小鼠的LYM数显著降低(P<0.05),GRA值显著升高(P<0.05),提示我们高剂量的植物油能破坏机体的免疫功能。单核细胞方面,不同剂量植物油对正常小鼠的单核细胞百分比无显著影响,且植物油组间的单核细胞百分比数值也无较大差异(P>0.05)。
表2 不同剂量植物油对小鼠白细胞的影响
Table 2 Effects of different doses of vegetable oil on
mouse leukocytes

组别淋巴细胞百分比/%单核细胞百分比/%中性粒细胞百分比/%正常组85.17±4.89a0.42±0.45a14.54±4.57aA组85.94±3.58a0.24±0.40a13.94±3.78aB组84.77±4.38a0.09±0.10a15.25±4.41aC组81.44±2.84ab0.19±0.10a18.44±2.84abD组75.47±8.53b0.37±0.34a24.14±8.30b
3 讨论
油脂摄入不当容易导致肥胖、胰岛素抵抗、非酒精性脂肪肝、动脉粥样硬化等代谢性疾病,肠道菌群在代谢性疾病的发生发展中发挥着重要的作用[16-17]。小肠是脂肪吸收的主要部位,当机体摄入过多的脂肪,容易导致肠道组织发生氧化应激[18]。正常情况下,机体内的活性氧与抗氧化系统处于一个平衡的状态,而过多的油脂摄入会导致线粒体电子传递链过载,造成活性氧生成增多,导致机体产生的活性氧超过机体抗氧化能力[19-20]。当肠道中超氧阴离子自由基、羟自由基、过氧化氢等氧化应激产物增加时,会改变肠道内的微环境,造成肠道菌群的紊乱[21]。本研究结果显示,植物油的摄入能显著降低小鼠肠道细菌总数和大肠杆菌数,B组或C组能使小鼠肠道内乳酸菌和双歧杆菌数得以保持或略微提高。这种变化可从肠道组织氧化应激这一角度加以解释,当肠道发生氧化应激时,导致肠道内细菌总数和大肠杆菌数显著降低,肠道微生态遭到破坏。而益生菌(乳酸菌和双歧杆菌)的增殖能够对氧化应激所产生的氧化应激物起到一定的抑制作用[22],减轻肠道炎症,并且由于肠道菌群相互制约的关系,益生菌的增多也会在一定程度上影响大肠杆菌等条件致病菌的数目。随氧化应激产物增加,会对益生菌起到破坏作用,这可能是D组乳酸菌数下降的原因。二者之间的具体关系有待进一步量化研究。肠道pH值也是影响肠道菌群的一个重要影响因素,食用油的主要成分为脂肪酸,在一定程度上能够降低肠道pH值,有益于乳酸菌、双歧杆菌等益生菌的生长。
肠道消化酶是机体肠道内重要组成部分,影响着机体营养物质吸收、免疫以及生长发育等[23]。肠道消化酶的来源主要有肠道菌群、机体分泌及外界摄入,其活性受肠道pH值、盐度、温度、食性等多种肠道理化因素的影响[24]。郑淘等[25]通过给小鼠灌胃不同浓度的咖啡,持续30 d,结果发现适量饮用咖啡能显著提高小鼠肠道淀粉酶、纤维素酶、蛋白酶、木聚糖酶等的活性。范观宇等[26]用10%、20%和30% (体积分数)的酒精水溶液作为小鼠的唯一饮用水,持续1个月,发现30%的酒精水溶液对小鼠肠道内淀粉酶、纤维素酶、蛋白酶、木聚糖酶等的活性具有显著提高作用。本研究结果显示,低剂量的植物油摄入量能显著提高蛋白酶、纤维素酶、木聚糖酶以及淀粉酶等的活性,而随着剂量的增加,部分肠道功能酶的活性受到抑制。课题组在前期的研究中发现高脂饮食小鼠肠道内木聚糖酶、淀粉酶以及蛋白酶显著提高[27],并且特制饲料(高蛋白、高热量饲料)诱导的食积小鼠内相应的肠道功能酶较正常组相比也显著提高[28]。王朝明等[29]利用不同脂肪水平试验饲料饲喂胭脂鱼,结果发现随着饲料脂肪水平增加,蛋白酶活性逐渐降低。本次实验的4种酶也表现出类似的规律,高剂量摄入植物油的小鼠体内多种酶活显著低于正常组。可能与当小鼠体内油脂含量较低时,小鼠通过增加对蛋白质和碳水化合物的消化吸收能力来维持其正常的生命活动有关。而当油脂含量升高时,会降低其对蛋白质和碳水化合物的依赖能力,致使蛋白酶和淀粉酶活下降。再者,高剂量植物油组的小鼠细菌总数显著下降,在一定程度上也能反映纤维素酶和木聚糖酶活的下降[26]。
不同剂量植物油对正常小鼠的红细胞、血小板、血红蛋白以及白细胞等指标基本无影响,仅有D组的淋巴细胞百分比、中性粒细胞百分比与正常组比差异显著。但这些结果并不支持食用油对机体的血常规无影响,食用油对机体的影响可能是长期的、慢性的,本实验时长仅1个月,食用油对小鼠血常规各项指标还不足以造成影响。仔细分析发现摄入高剂量食用油组小鼠HCT、RDW、MCV、MPV、PDW等指标值升高,而这些指标与冠心病、高血压病、冠状动脉慢回流等多种心血管疾病有着密切的联系。提示我们长期高脂饮食会使患各种心血管疾病的风险增加。此外从HGB、MCH、MCHC等值变化提示我们高脂饮食容易导致机体出现贫血、血液运输能力减弱。这一影响也可从氧化应激的角度得以解释,超氧阴离子能够与一氧化氮迅速形成过氧硝酸盐,减少血浆NO的水平,使血管功能出现障碍[30]。当摄入大量的食用油,容易造成血液中游离脂肪酸增多,脂肪酸能够刺激巨噬细胞的炎症过程,导致血栓的进一步形成[31]。
4 结论
通过分析不同剂量植物油对正常小鼠可培养微生物、肠道功能酶以及血常规的影响发现低剂量的植物油能显著提高肠道功能酶的活性,促进消化。中剂量的植物油虽然能增加有益菌的数量,但部分肠道功能酶的活性下降。而高剂量的摄入植物油容易导致肠道有益菌的数目下降,肠道功能酶的活性下降,并且血常规中多种与心血管疾病相关的指标出现异常。整体而言,适当的摄入植物油有助于提高机体的消化能力、减少炎症,预防心血管疾病的发生。
[1] 刘娅薇, 惠华英, 谭周进. 食用油对身体健康的影响及与肠道菌群的关系[J]. 世界华人消化杂志, 2019, 27(9): 583-588.
[2] 陈银基, 鞠兴荣, 周光宏. 饱和脂肪酸分类与生理功能[J]. 中国油脂, 2008, 33(3): 35-39.
[3] 张伟敏, 钟耕, 王炜. 单不饱和脂肪酸营养及其生理功能研究概况[J]. 粮食与油脂, 2005, 18(3): 13-15.
[4] 王萍, 张银波, 江木兰. 多不饱和脂肪酸的研究进展[J]. 中国油脂, 2008, 33(12): 42-46.
[5] 朱航榉, 王锋, 杨贤, 等. 不同油脂对小鼠肠道菌群的影响[J]. 环境与职业医学, 2017, 34(11): 995-998.
[6] 黄海滨. 平衡油脂对小鼠脂代谢的影响及其机理研究[D]. 长沙: 湖南农业大学, 2015.
[7] 赵斌, 何绍江. 微生物学实验[M]. 北京: 科学出版社, 2002.
[8] 曾奥, 张华玲, 谭周进, 等. 小鼠菌群失调腹泻模型的建立及超微七味白术散的疗效[J]. 微生物学通报, 2012, 39(9): 1 341-1 348.
[9] 谭周进, 张华玲, 周赛男, 等. 菌群失调小鼠腹泻造模及超微中药干预过程中肠道微生物的变化[J]. 应用与环境生物学报, 2013, 19(3): 449-453.
[10] 龙承星, 贺璐, 郭艳芳, 等. 铁皮石斛多糖对脾虚便秘小鼠免疫、肠道微生物及酶活性的影响[J]. 天然产物研究与开发, 2017, 29(6): 1 020-1 024;1 034.
[11] 柯淑兰, 陈礼平, 王彤, 等. 不同中医证型高血压患者红细胞分布宽度水平变化的研究[J]. 浙江中医杂志, 2018, 53(6): 399-400.
[12] 周梦琦, 顾宁. 红细胞比容与心血管系统疾病相关性研究进展[J]. 辽宁中医药大学学报, 2019, 21(6): 94-97.
[13] ZALAWDAIVA S K, VEERANNA V, NIRAJ A, et al. Red cell distribution width and risk of coronary heart disease events[J]. American Journal of Cardiology, 2010, 106(7): 988-993.
[14] 曹文延, 杨东亮. 血小板参数在NSCLC患者化疗效果评估和预后评估中的应用价值[J]. 检验医学与临床, 2019, 16(16): 2 406-2 408;2 418.
[15] 李月, 代震宇, 张德纯. 血小板分布宽度作为新型血小板活化特异性标志物的评价[J]. 重庆医科大学学报, 2011, 36(2): 200-202.
[16] LARSEN N, VOGENSEN F K, VAN DEN BERG F W, et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J]. PLoS One, 2010, 5(2): e9 085.
[17] TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7 122): 1 027-1 031.
[18] 乔艺. 高脂诱导的氧化应激对小鼠肠道菌群改变与炎症反应的影响[D]. 无锡: 江南大学, 2014.
[19] WALLACE J P, JOHNSON B, ADILLA J, et al. Postprandial lipaemia, oxidative stress and endothelial function: A review[J]. International Journal of Clinical Practice, 2010, 64(3): 389-403.
[20] LACROIX S, ROSIERS C D, TARDIF J C, et al. The role of oxidative stress in postprandial endothelial dysfunction[J]. Nutrition Research Reviews, 2012, 25(2): 288-301.
[21] 刁永佳. 煎炸油摄入引起大鼠肠道菌群代谢紊乱的研究[D]. 天津: 天津科技大学, 2017.
[22] CHOE E, MIN D B. Chemistry of deep-fat frying oils[J]. Journal of Food Science, 2007, 72(5): 77-86.
[23] 贺璐, 龙承星, 刘又嘉, 等. 中药对肠道消化酶活性的调节作用[J]. 中药材, 2017, 40(8): 1 983-1 986.
[24] 陈晓瑛, 曹俊明, 王国霞, 等. 芽孢杆菌和低聚木糖对凡纳滨对虾生长和消化酶活力的影响[J]. 饲料工业, 2011, 32(20): 18-22.
[25] 郑淘, 彭买姣, 肖嫩群. 咖啡摄入量对小鼠肠道微生物及酶活性的影响[J]. 中国微生态学杂志,2018, 30(8): 900-903;910.
[26] 范观宇, 贺璐, 郑淘, 等. 酒精摄入量对小鼠肠道微生物、酶活性和血常规的影响[J]. 微生物学通报, 2018, 45(7): 1 462-1 469.
[27] 何云山, 喻嵘, 彭买姣. 芦笋对高脂饮食小鼠肠道微生物及酶活性的影响[J]. 中国微生态学杂志, 2018, 30(12): 1 386-1 390.
[28] 何云山, 谭周进, 李丹丹,等. 保和丸对食积小鼠的肠道微生物及酶活性的影响[J]. 中国微生态学杂志, 2019, 31(7): 763-767.
[29] 王朝明, 罗莉, 张桂众, 等. 饲料脂肪水平对胭脂鱼生长性能、肠道消化酶活性和脂肪代谢的影响[J]. 动物营养学报, 2010, 22(4): 969-976.
[30] JACKSON K G, POPPITT S D, MINIHANE A M. Postprandial lipemia and cardiovascular disease risk: Interrelationships between dietary, physiological and genetic determinants[J].Atherosclerosis,2012,220(1): 22-33.
[31] ANSAR S, KOSKA J, REAVEN P D. Postprandial hyperlipidemia, endothelial dysfunction and cardiovascular risk: Focus on incretins[J]. Cardiovascular Diabetology, 2011, 10(1):61.