胶原蛋白是脊椎动物体内重要的蛋白质,约占总蛋白质量的25%,通常用于支撑、保护器官和身体[1]。目前胶原蛋白可作为营养补充剂、食用保鲜膜、皮肤替代物和生物膜等的原料[2-5],被广泛应用于食品、医药、化妆品等多种领域。近年来,由于宗教问题及疯牛病、口蹄疫等传染病的流行率增加,使陆生动物胶原蛋白的应用受限。研究表明,鱼胶原蛋白在组织应用工程中可以代替牛胶原蛋白[6]。另外,由于氨基酸组成和交联度等方面的差异使得水生动物胶原蛋白具有更低的抗原性和致敏性[7]。
罗非鱼是中国重要的养殖鱼类,然而在其加工中产生的鱼鳞、鱼皮等副产物通常被丢弃或制成廉价饲料,因此,如何对这部分资源实现高值化利用,已成为罗非鱼产业面临的关键问题。罗非鱼皮中的胶原蛋白含量较高[8],这为工业化大规模生产提供了可能。
目前,胶原蛋白的提取多采用酸法、热水法、碱法等传统方法。然而,考虑到产品品质、生产成本和环境污染等问题,这些提取方法存在诸多局限性。发酵法可将去除鱼皮中杂蛋白和脂肪与提取胶原蛋白通过加菌发酵一个程序完成,极大地简化了生产工艺。由于微生物产生的胞外蛋白酶和脂肪酶的作用,在提取过程中无需使用化学试剂和昂贵的酶制剂,不仅能够减少环境污染,而且使胶原蛋白的生产成本得以降低[9]。另外,通过微生物发酵还可以去除鱼皮中的腥臭味从而提高样品的感官质量[10]。实验证明,液态发酵法制备鱼皮胶原蛋白的得率远高于酸法、热水法和碱法[11]。固态发酵(soild-state fermentation,SSF)与液态发酵相比,其成本低、产物浓度高、能耗低,且有利于菌体次生代谢,已被用于生产一系列高附加值产品,如乳酸、木质素酶、抗氧化肽[12-14]等。
本研究以罗非鱼皮为原料,通过响应面法优化发酵条件以获得最佳发酵工艺,并将SSF胶原蛋白与酸溶性胶原蛋白(acid-soluble collagen,ASC)的结构特性进行分析比较,旨在为胶原蛋白的新型生产途径和罗非鱼皮的深入开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
罗非鱼鱼皮,雷州市龙之润水产品有限公司;菌种Bacillus subtilis CCTCC AB 90008,中国典型培养物保藏中心;营养肉汤培养基,青岛海博生物有限公司;L-羟脯氨酸(纯度99%),Sigma公司;其他试剂均为分析纯,国药化学试剂有限公司。
1.2 仪器与设备
Heraeus Pico 17高速离心机、Nicolet iS50傅立叶变换红外光谱仪,美国赛默飞世尔科技有限公司;UV-1800 PC型紫外可见分光光度计,上海美谱达仪器有限公司;DYCZ-25D型双垂直电泳仪、DYY-6D型电脑三恒多用电泳仪电源,北京六一生物科技有限公司;L-8800氨基酸自动分析仪,日本Hitachi公司。
1.3 试验方法
1.3.1 鱼皮的预处理
将鱼皮去鳞、除杂,用蒸馏水洗净后充分沥干,切分成约1 cm×1 cm的碎块并经打粉机粉碎,冷冻至-20 ℃,备用。
1.3.2 固态发酵法提取胶原蛋白
将Bacillus subtilis CCTCC AB 90008从甘油保藏管接入营养肉汤培养基中,于37 ℃培养24 h,将活化好的菌种接至种子培养基(牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH 7.2~7.4)中,于37 ℃、120 r/min培养一定时间,制得种子液。将10 g处理好的鱼皮装入250 mL锥形瓶中,121 ℃高温灭菌20 min,在无菌条件下加入一定量的灭菌去离子水(pH自然),作为固态发酵培养基。按比例接入培养好的发酵种子液,恒温静置培养,并每隔5 h摇瓶翻动1次,相应的发酵条件按照单因素试验设计实施。
发酵结束后,将残留物用去离子水定容至100 mL,于4 ℃浸提2 h,过滤,于10 000 r/min离心15 min。收集上清液,盐析至最终浓度为0.9 mol/L,在10 000 r/min的条件下离心20 min,收集沉淀并将其完全溶于0.5 mol/L的乙酸溶液,于0.1 mol/L的乙酸溶液(体积比1∶20)中透析20 h,随后在相同体积的去离子水中透析24 h。将透析后的样品液进行真空冷冻干燥,得到SSF胶原蛋白。
1.3.3 酸法提取胶原蛋白
将处理好的鱼皮与0.5 mol/L乙酸溶液(体积比1∶20)混合提取24 h。提取液于10 000 r/min离心15 min,收集上清液,后续制备ASC样品的步骤同SSF胶原蛋白。
1.3.4 胶原蛋白提取率的测定
采用WOESSNE比色法[15]测定样品中羟脯氨酸的含量。胶原蛋白提取率的计算如公式(1)所示:
(1)
式中:Y,胶原蛋白提取率,%;m,样品中羟脯氨酸质量,g;11.1,水生动物中羟脯氨酸与胶原蛋白的换算系数;M,发酵鱼皮质量,g。
1.3.5 单因素试验
以胶原蛋白提取率为指标,先后考察菌龄、加水量、接种量、发酵温度、发酵时间5个因素对枯草芽孢杆菌固态发酵制备鱼皮胶原蛋白工艺的影响。
1.3.6 响应面优化试验
根据单因素试验结果,选取加水量、接种量、发酵温度作为3个参考因素,以胶原蛋白提取率为响应因子,采用Box-Behnken设计原理进行3因素3水平的响应面试验,实验设计因素与水平如表1所示。
表1 Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken experiments
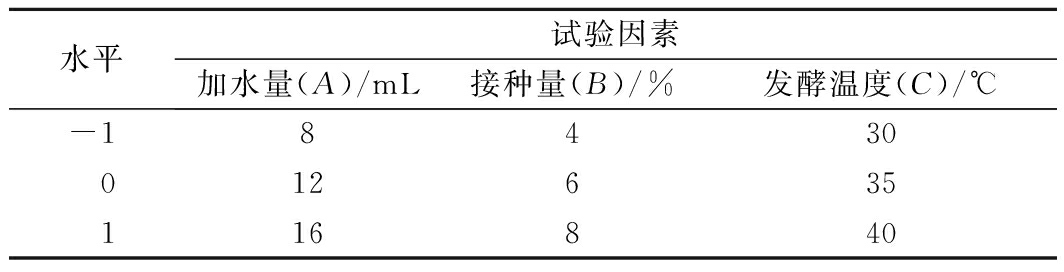
水平试验因素加水量(A)/mL接种量(B)/%发酵温度(C)/℃-18430012635116840
1.3.7 傅里叶变换红外光谱扫描
参考ISWARIYA等[16]的方法略作改动:分别取适量胶原蛋白冻干样品与干燥的KBr于玛瑙研钵中研磨均匀、装样、手动压片,在4 000~500 cm-1进行检测,分辨率为1 cm-1。
1.3.8 紫外光谱扫描
参考WANG[17]的方法略作改动:将冻干的样品溶于0.5 mol/L的乙酸溶液,配制成1 g/L的胶原蛋白溶液,0.5 mol/L的乙酸溶液作为空白对照。在200~400 nm近紫外光区对胶原蛋白溶液进行扫描。
1.3.9 聚丙烯酰胺凝胶电泳
参考LAEMMLI[18]的方法略作改动:将纯化的胶原蛋白样品用0.1 mol/L的乙酸溶液配制成10 g/L的胶原蛋白溶液,与上样缓冲液混合煮沸3 min后冷却,4 000 r/min离心5 min后取10 μL溶液上样。电泳使用8%分离胶和5%浓缩胶,采用直流稳定电源,浓缩胶电压为80 V,进入分离胶后电压加至120 V。电泳结束后用考马斯亮蓝R-250溶液对凝胶染色90 min,随后脱色。
1.3.10 氨基酸分析
采用GB 5009.124—2016[19]的方法,测定分析样品中氨基酸含量。
1.4 数据处理
所有实验均重复3次,采用SPSS 18、Origin 8.5和 Design-Expert 10等软件进行数据统计分析及绘图。
2 结果与分析
2.1 单因素试验结果
2.1.1 菌龄对胶原蛋白提取率的影响
在加水量8 mL、接种量4%、发酵温度35 ℃、发酵时间44 h的发酵条件下,考察接入不同菌龄(14、16、18、20、22、24 h)的种子液对胶原蛋白提取率的影响。如图1所示,随着接入不同菌龄的种子液,胶原蛋白的提取率也相应改变。菌种培养14~20 h时提取率呈上升趋势,当菌龄为20 h时的提取率达到最高,此后继续培养则菌种开始衰退,导致胶原蛋白提取率呈下降趋势。故本试验选择20 h为菌种最佳培养时间。
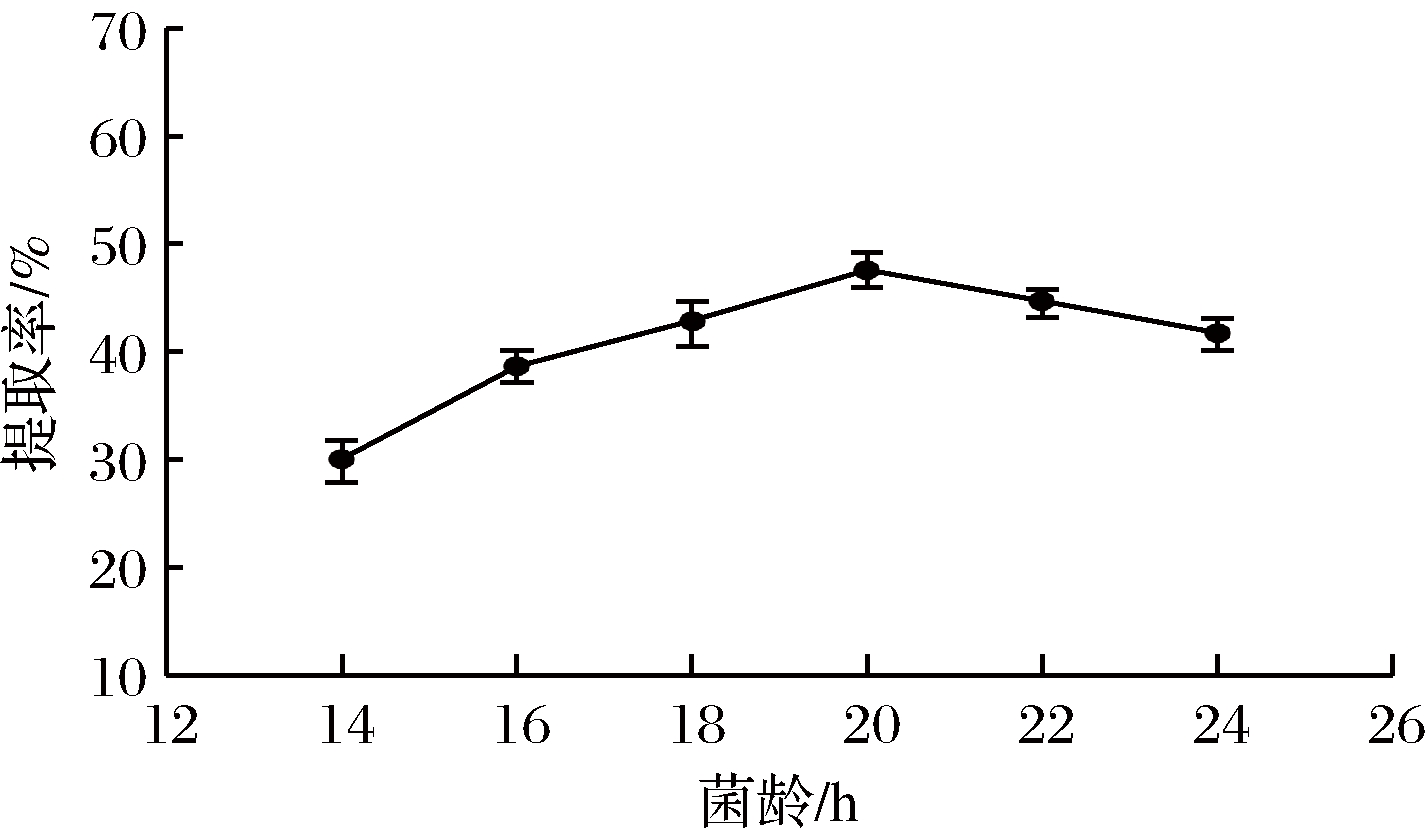
图1 菌龄对胶原蛋白提取率的影响
Fig.1 Effect of cell age on the extraction rate of collagen
2.1.2 加水量对胶原蛋白提取率的影响
以2.1.1确定的最佳菌龄20 h为基础,在接种量4%、发酵温度35 ℃、发酵时间44 h的条件下,考察不同加水量(4、8、12、16、20 mL)对胶原蛋白提取率的影响。固态发酵过程中,培养基中的含水量不但会影响菌体对水分的吸收,而且还会影响菌体对氧的吸收,因此适合的含水量是发酵的重要条件。如图2所示,随着含水量增加,胶原蛋白提取率先升高后降低,当加水量为12 mL时提取率达到最高。故本试验选取最佳加水量为12 mL。
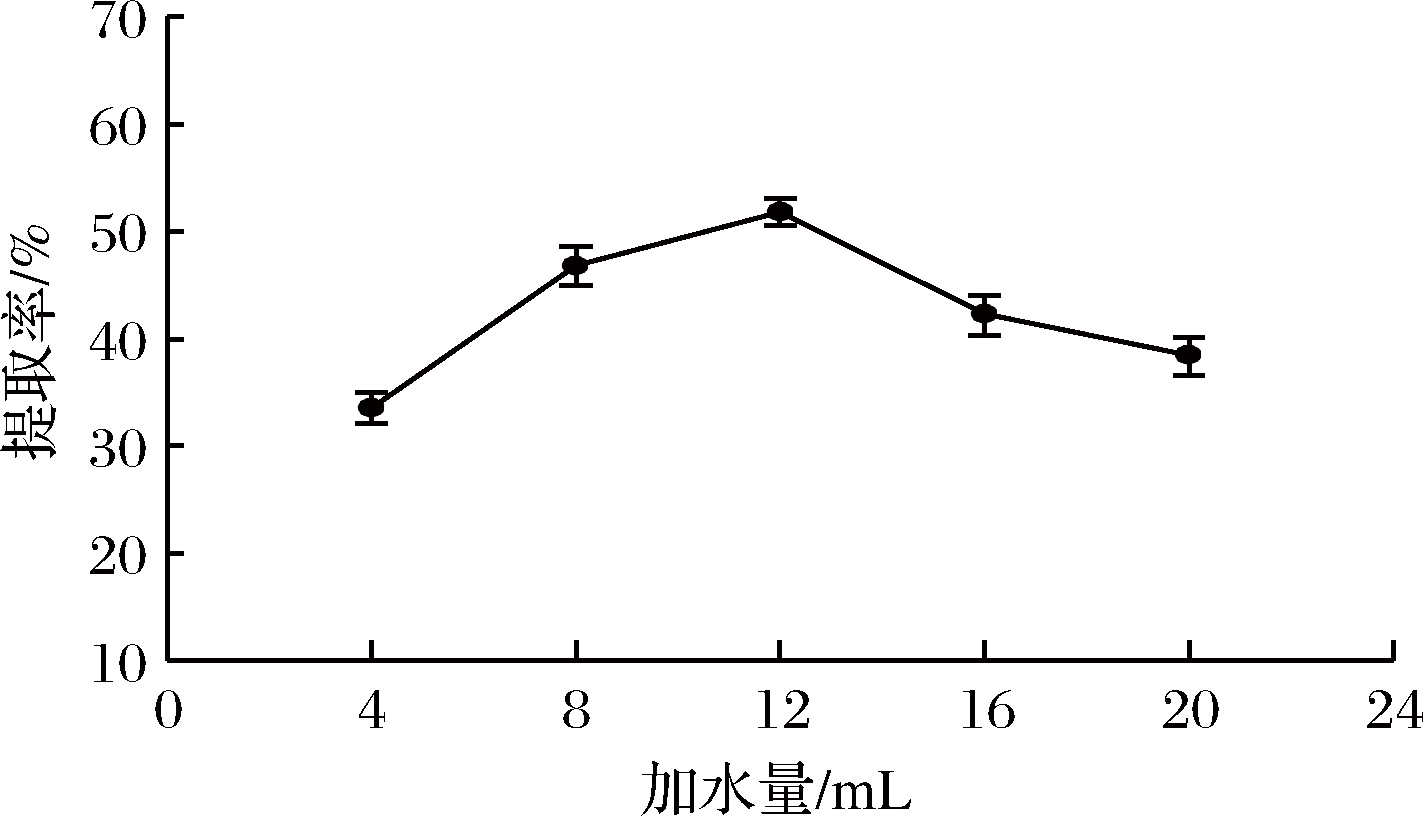
图2 加水量对胶原蛋白提取率的影响
Fig.2 Effect of water addition on the extraction rate of collagen
2.1.3 接种量对胶原蛋白提取率的影响
以上述实验中确定的最佳菌龄20 h、加水量12 mL为基础,在发酵温度35 ℃、发酵时间44 h的条件下,考察不同接种量(2%、4%、6%、8%、10%、12%)对胶原蛋白提取率的影响。如图3所示,当接种量<6%时,培养基内的营养足够支持菌体旺盛的代谢,此时发酵水平较高,接种量>6%时,菌体生长消耗大量营养成分且代谢废物增多,导致发酵水平降低,胶原蛋白提取率逐渐降低。故本试验选择6%为最佳接种量。
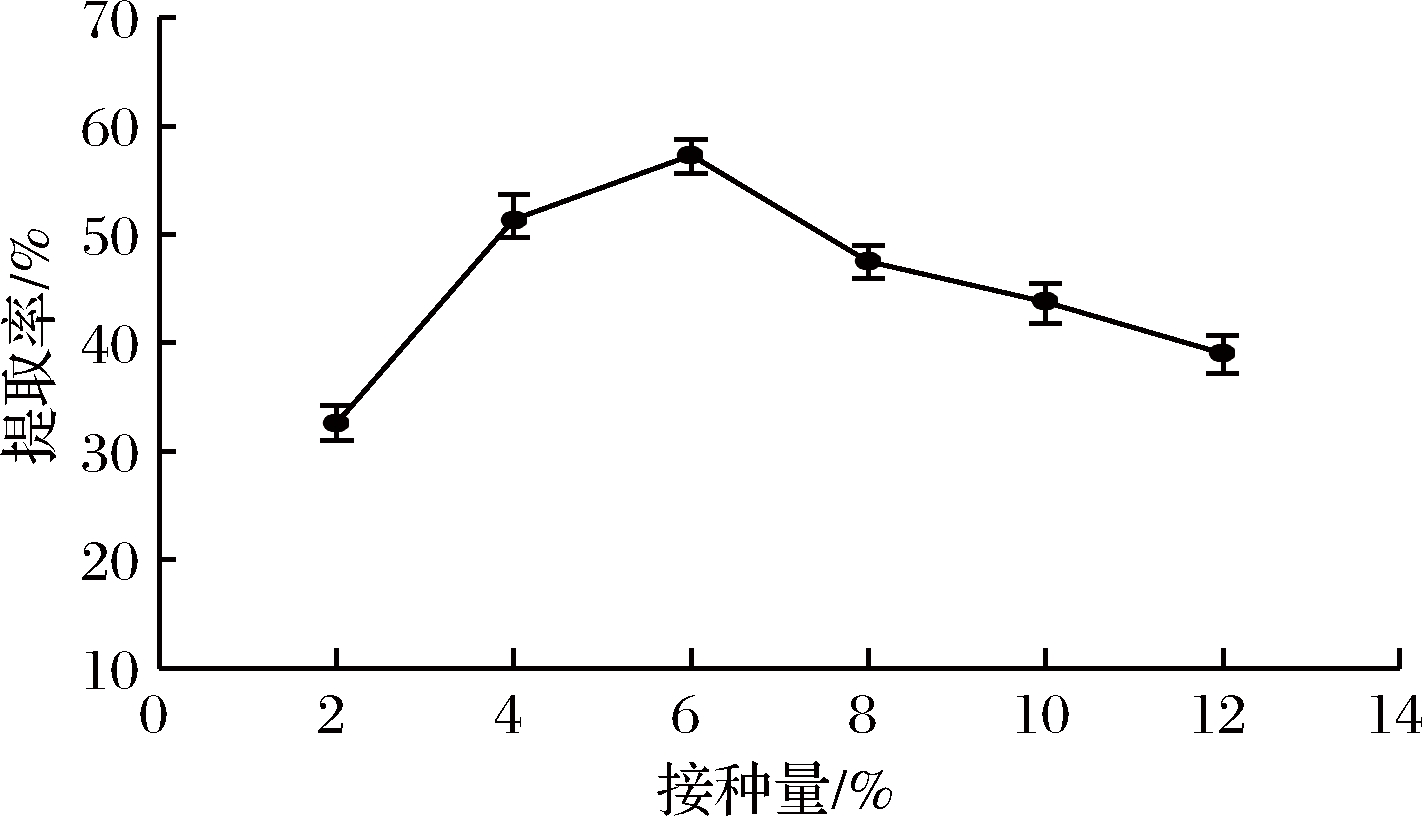
图3 接种量对胶原蛋白提取率的影响
Fig.3 Effect of inoculum size on the extraction
rate of collagen
2.1.4 发酵温度对胶原蛋白提取率的影响
以上述实验中确定的最佳菌龄20 h、加水量12 mL、接种量6%为基础,在发酵时间44 h的条件下,考察不同发酵温度(20、25、30、35、40 ℃)对胶原蛋白提取率的影响。温度是影响菌体发酵的关键因素之一,温度过低会减慢菌体的繁殖和代谢,过高又会抑制其生长,都会导致胶原蛋白提取率产生变化。如图4所示,发酵温度为20~35 ℃时胶原蛋白的提取率呈上升趋势,当发酵温度为35 ℃时提取率达到最高,继续升温则提取率逐渐降低。故本试验选择35 ℃为最佳发酵温度。
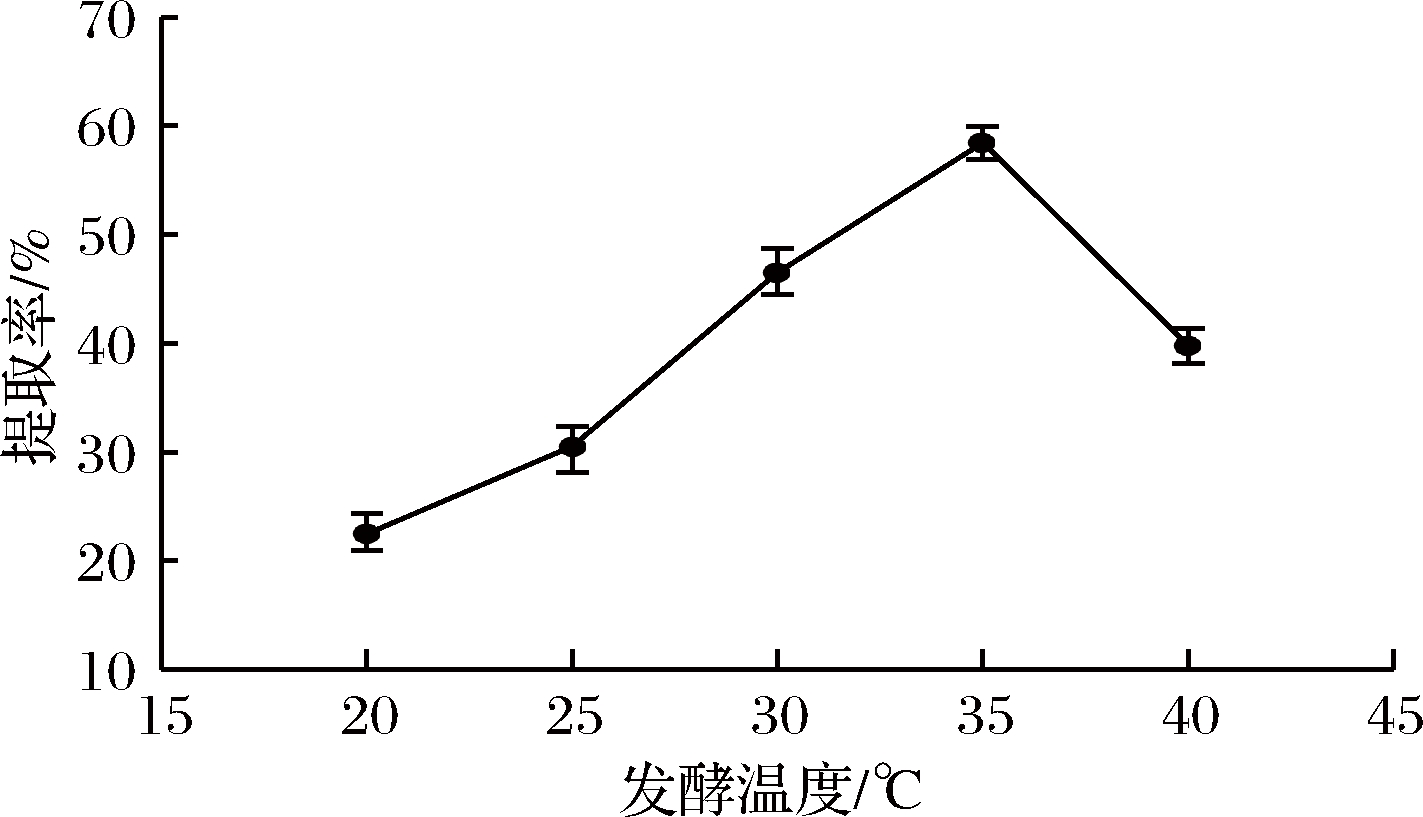
图4 发酵温度对胶原蛋白提取率的影响
Fig.4 Effect of fermentation temperature on the
extraction rate of collagen
2.1.5 发酵时间对胶原蛋白提取率的影响
以上述实验中确定的最佳菌龄20 h、加水量12 mL、接种量6%、发酵温度35 ℃为基础,考察不同发酵时间(36、40、44、48、52、56 h)对胶原蛋白提取率的影响。如图5所示,随着发酵时间的延长,胶原蛋白提取率逐渐增加,在48 h之后提取率增加趋势近于平缓,综合考虑成本和生产效率,本试验选取48 h为最佳发酵时间。
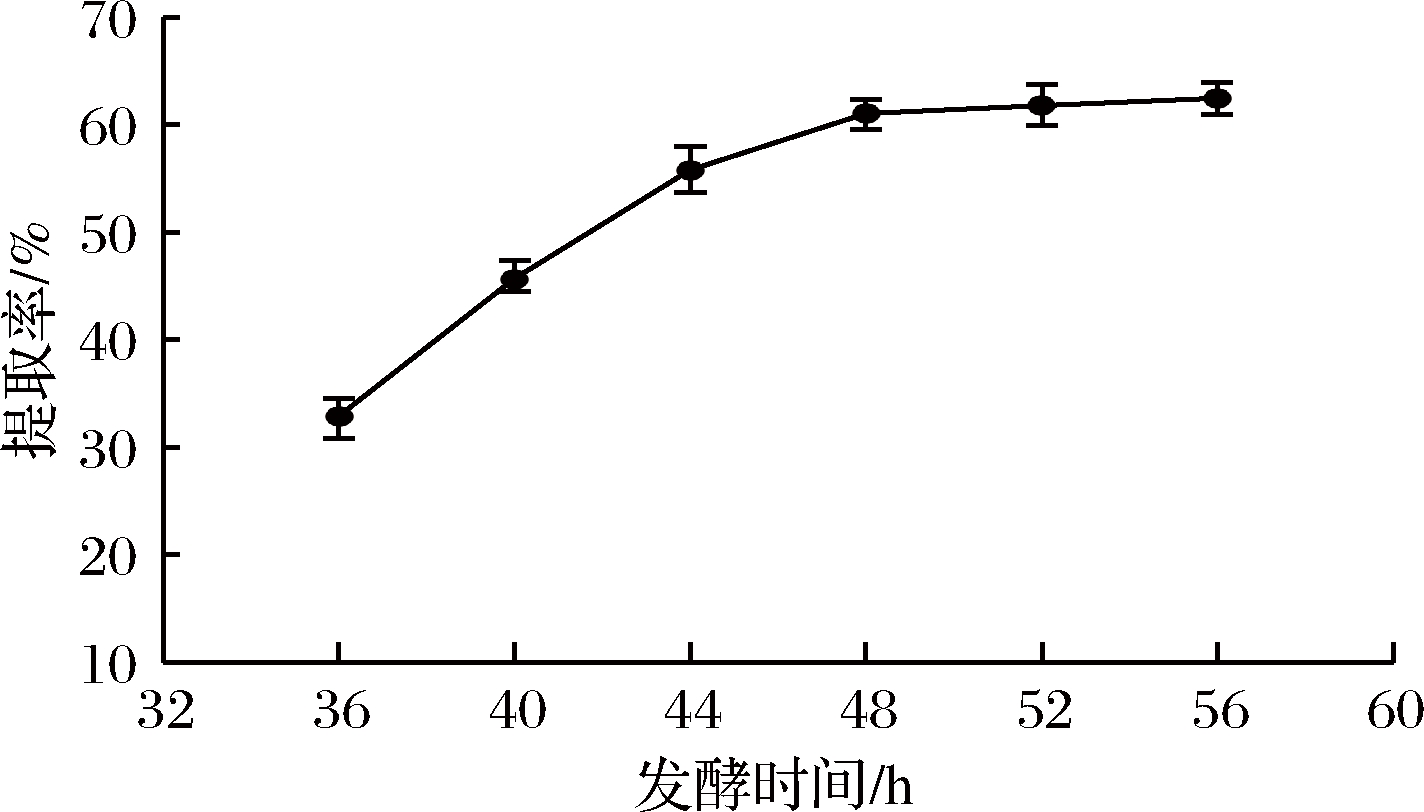
图5 发酵时间对胶原蛋白提取率的影响
Fig.5 Effect of fermentation time on the extraction
rate of collagen
2.2 响应面优化试验结果
2.2.1 响应面试验设计与结果
参考单因素试验结果,采用Box-Behnken中心组合试验原理设计方案,选取加水量(A)、接种量(B)、发酵温度(C)3个影响较显著的因素,以胶原蛋白提取率(Y)为响应因子,实验设计及结果如表2所示。
表2 Box-Behnken试验设计及结果
Table 2 Design and values of Box-Behnken experiments
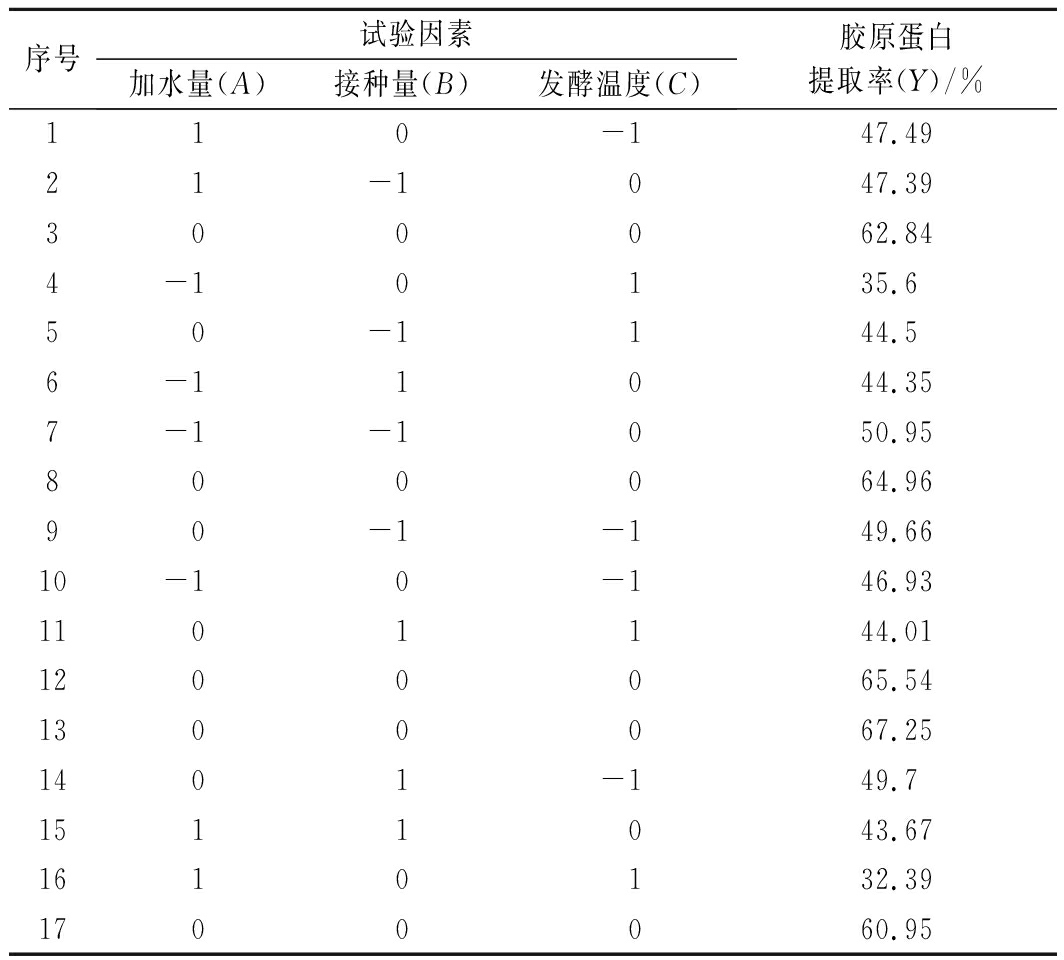
序号试验因素加水量(A)接种量(B)发酵温度(C)胶原蛋白提取率(Y)/%110-147.4921-1047.39300062.844-10135.650-1144.56-11044.357-1-1050.95800064.9690-1-149.6610-10-146.931101144.011200065.541300067.251401-149.71511043.671610132.391700060.95
2.2.2 响应面试验结果分析
对表2中17组试验数据进行多元拟合回归分析,得到加水量(A)、接种量(B)、发酵温度(C)对胶原蛋白提取率(Y)影响的多元二次回归方程为: Y=64.31-1.97A-1.45B-3.44C+0.72AB-3.17AC-0.34BC-11.03A2-6.68B2-10.45C2。
回归模型的方差分析结果如表3所示,此模型P<0.01,差异较为显著,失拟项P>0.05不显著,表示模型对实验的拟合度较高。决定系数R2=0.968 5,说明响应值的变化有96.85%来源于所选的3个变量。逐项显著性结果检验表明,3个因素对胶原蛋白提取率影响程度分别为C>A>B,且C的P<0.01,表明发酵温度对胶原蛋白的提取率影响较为显著。交互项AC的P<0.05,表明加水量和发酵温度的交互作用对胶原蛋白提取率具有显著影响。二次项A2、C2的P<0.000 1,说明加水量和发酵温度的二次项对提取率的影响极显著。
对回归方程进行分析计算得出固态发酵提取胶原蛋白的最优工艺为菌龄20 h,加水量11.71 mL,接种量5.78%,发酵温度34.24 ℃,发酵时间48 h,此时胶原蛋白的提取率预测值为64.72%。
表3 回归模型方差分析
Table 3 Analysis of variance for the regression model
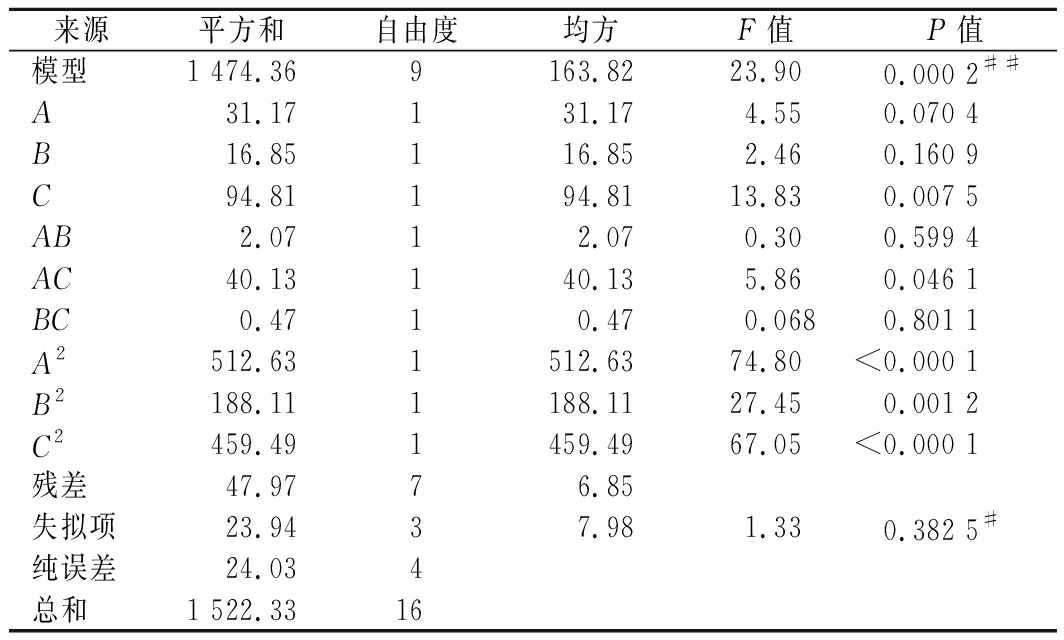
来源平方和自由度均方F值P值模型1 474.369163.8223.900.000 2##A31.17131.174.550.070 4B16.85116.852.460.160 9C94.81194.8113.830.007 5AB2.0712.070.300.599 4AC40.13140.135.860.046 1BC0.4710.470.0680.801 1A2512.631512.6374.80<0.000 1B2188.111188.1127.450.001 2C2459.491459.4967.05<0.000 1残差47.9776.85失拟项23.9437.981.330.382 5#纯误差24.034总和1 522.3316
注:##表示差异显著,P<0.05;#表示差异不显著,P>0.05
2.2.3 验证实验
为验证模型预测的可靠性,同时考虑实际操作,将最优工艺条件修改为菌龄20 h,加水量11.7 mL,接种量5.8%,发酵温度34 ℃,发酵时间48 h。按照该条件进行3次平行实验验证,测得胶原蛋白提取率为65.03%,与预测值接近,证明该模型具有可行性与准确性。
2.3 胶原蛋白提取率的比较
羟脯氨酸是胶原蛋白的特征氨基酸,一般通过测量羟脯氨酸含量来计算胶原蛋白的提取率。根据公式(1)得到ASC的提取率为57.26%。在最佳条件下,SSF胶原蛋白的提取率为65.03%,表明固态发酵法的提取效率更高。
2.4 傅里叶变换红外光谱分析
如图6所示,罗非鱼皮SSF胶原蛋白和ASC均具有典型的胶原蛋白红外光谱特征吸收峰,即酰胺A、B以及Ⅰ、Ⅱ、Ⅲ吸收峰,且与其他鱼类胶原蛋白的主要吸收峰类似[20-21]。酰胺A带与N—H基团的伸缩振动相关,其吸收峰在3 400~3 440 cm-1,当含有N—H基团的分子肽段参与氢键形成时,其吸收峰将发生蓝移[22]。罗非鱼皮SSF胶原蛋白和ASC的酰胺A带吸收峰分别出现在3 282、3 301 cm-1处,说明其分子中均有氢键存在。由于蛋白质分子的—CH2会发生非对称伸缩振动,使得SSF胶原蛋白和ASC的酰胺B带吸收峰分别出现在2 924和2 933 cm-1。酰胺Ⅰ带属于C![]() O伸缩振动峰,一般在1 600~1 700 cm-1,可用来分析蛋白质的二级结构[23];酰胺Ⅱ带属于α-螺旋、β-折叠、β-转角和无规卷曲叠加的扭转振动峰,通常位于1 500~1 600 cm-1[24];酰胺Ⅲ带属于甘氨酸和脯氨酸残基上的—CH2特征振动峰,一般出现在1 200~1 300 cm-1,可用于证明三螺旋结构是否完整[25]。罗非鱼皮SSF胶原蛋白含有的酰胺Ⅰ、Ⅱ和Ⅲ带的特征吸收峰分别出现在1 629、1 536和1 240 cm-1处,ASC的3个特征吸收峰分别位于1 635、1 547和1 249 cm-1。分析结果表明,固态发酵法和酸法提取的罗非鱼皮胶原蛋白均能够保持较完整的三维结构且二级结构没有明显差异。
O伸缩振动峰,一般在1 600~1 700 cm-1,可用来分析蛋白质的二级结构[23];酰胺Ⅱ带属于α-螺旋、β-折叠、β-转角和无规卷曲叠加的扭转振动峰,通常位于1 500~1 600 cm-1[24];酰胺Ⅲ带属于甘氨酸和脯氨酸残基上的—CH2特征振动峰,一般出现在1 200~1 300 cm-1,可用于证明三螺旋结构是否完整[25]。罗非鱼皮SSF胶原蛋白含有的酰胺Ⅰ、Ⅱ和Ⅲ带的特征吸收峰分别出现在1 629、1 536和1 240 cm-1处,ASC的3个特征吸收峰分别位于1 635、1 547和1 249 cm-1。分析结果表明,固态发酵法和酸法提取的罗非鱼皮胶原蛋白均能够保持较完整的三维结构且二级结构没有明显差异。

图6 SSF胶原蛋白和ASC的傅里叶变换
红外光谱图
Fig.6 Fourier transform infrared spectra of
SSF collagen and ASC
2.5 紫外光谱分析
由于—C![]() O、—COOH、—CONH2等发色基团的存在,使得蛋白分子能够在某一波长处发生紫外吸收。色氨酸、酪氨酸和苯丙氨酸等芳香族氨基酸在280 nm处有较强的紫外吸收,但是胶原蛋白由于几乎不含这些氨基酸,因此在280 nm处应无明显吸收峰,这可作为鉴定胶原蛋白及其纯度的方法。如图7所示,罗非鱼皮SSF胶原蛋白和ASC的最大吸收波长分别位于232和233 nm,符合胶原蛋白紫外吸收特征,并且与河豚[16]和黄鳍金枪鱼[21]的胶原蛋白的紫外光谱扫描结果一致。由以上结果可初步表明,由2种方法提取的胶原蛋白为典型的胶原蛋白且所含杂蛋白少,纯度较高。
O、—COOH、—CONH2等发色基团的存在,使得蛋白分子能够在某一波长处发生紫外吸收。色氨酸、酪氨酸和苯丙氨酸等芳香族氨基酸在280 nm处有较强的紫外吸收,但是胶原蛋白由于几乎不含这些氨基酸,因此在280 nm处应无明显吸收峰,这可作为鉴定胶原蛋白及其纯度的方法。如图7所示,罗非鱼皮SSF胶原蛋白和ASC的最大吸收波长分别位于232和233 nm,符合胶原蛋白紫外吸收特征,并且与河豚[16]和黄鳍金枪鱼[21]的胶原蛋白的紫外光谱扫描结果一致。由以上结果可初步表明,由2种方法提取的胶原蛋白为典型的胶原蛋白且所含杂蛋白少,纯度较高。
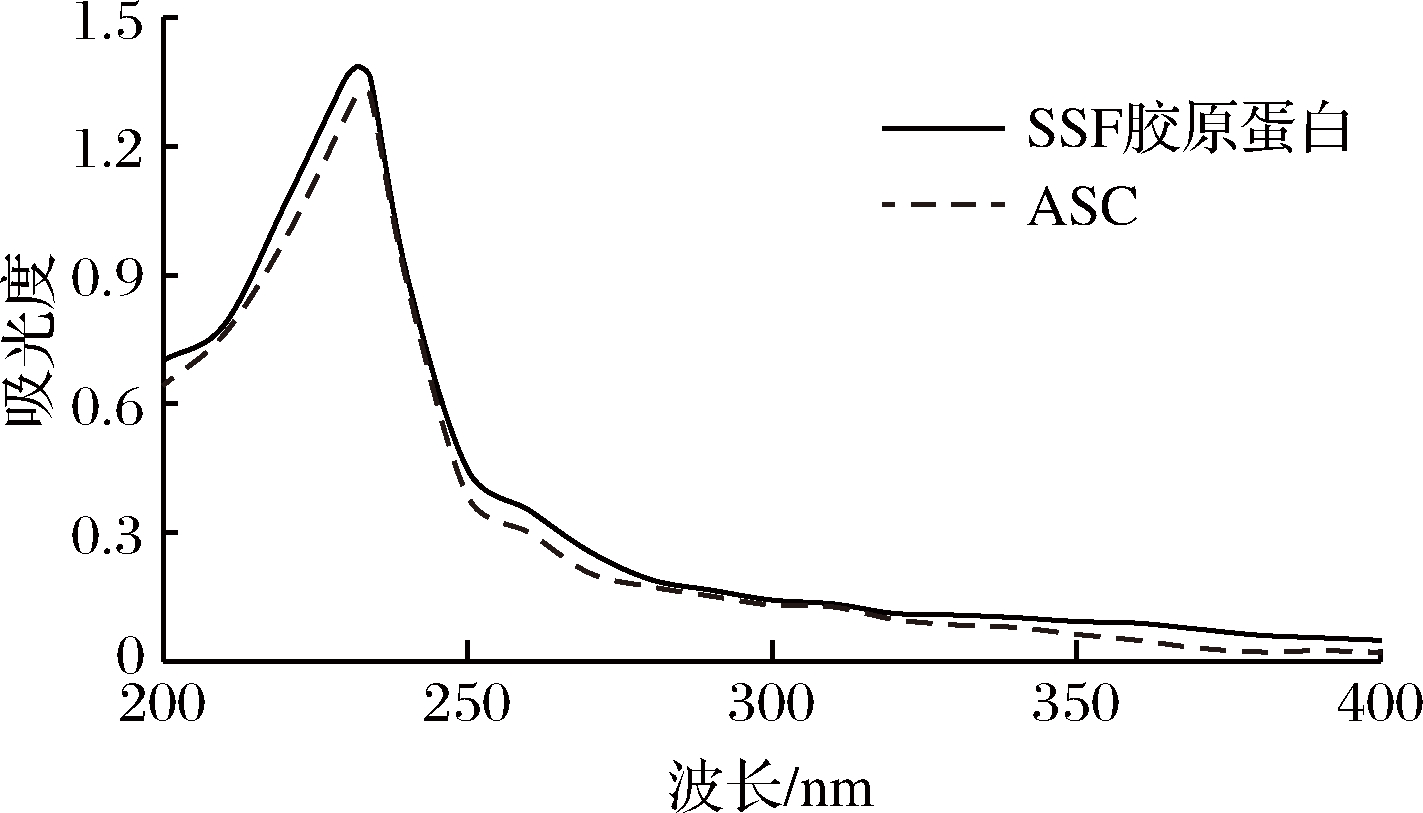
图7 SSF胶原蛋白和ASC的紫外吸收光谱
Fig.7 Ultraviolet spectra of SSF collagen and ASC
2.6 聚丙烯酰胺凝胶电泳分析
由图8可知,2种方法所提取的罗非鱼皮胶原蛋白均含2条α链(α1与α2)和1条β链,符合Ⅰ型胶原蛋白的特征[26]。在相对分子质量为130和110 kDa附近分别出现α1链和α2链,在200 kDa附近出现α链,说明胶原蛋白分子中存在分子内和分子间的交联作用[27]。与ASC相比,SSF胶原蛋白中的α链含量有所降低,α链以下出现较多低分子电泳条带,可能是因为在固态发酵提取过程中,胶原酶的作用使部分胶原蛋白降解为小分子组分所造成。
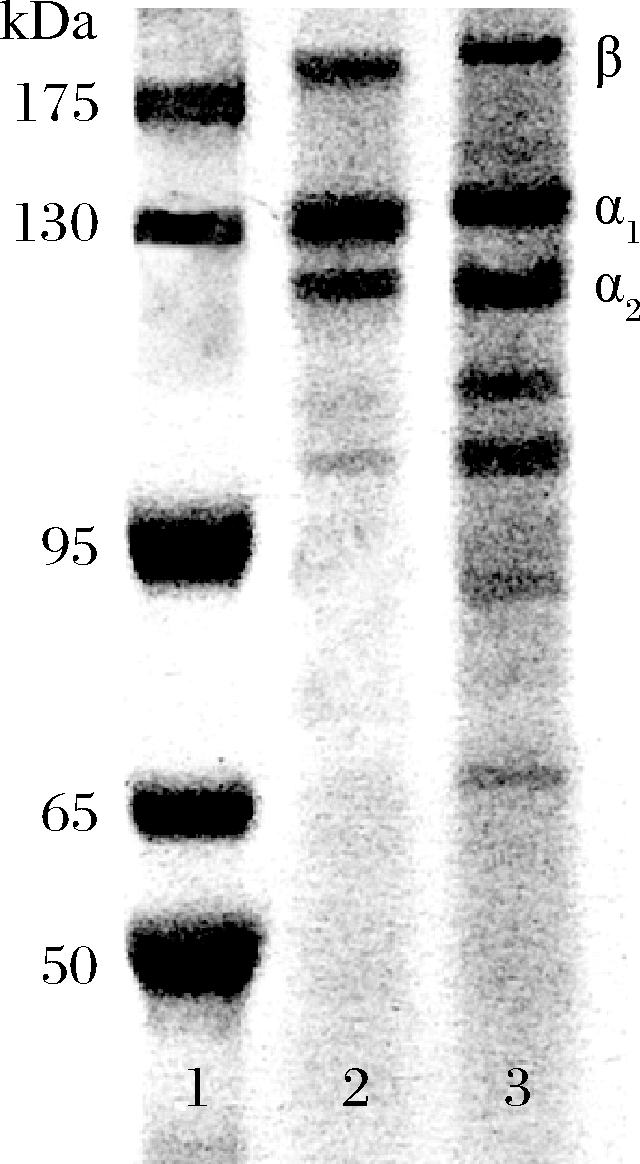
1-Marker;2-ASC;3-SSF胶原蛋白
图8 SSF胶原蛋白和ASC的电泳图谱
Fig.8 Sodium dodecyl sulfate polyacrylamide gel
electrophoresis patterns of SSF collagen and ASC
2.7 氨基酸组成分析
由表4可知,2种罗非鱼皮胶原蛋白的氨基酸组成符合天然胶原蛋白的基本特征,即富含甘氨酸(约占总氨基酸质量1/3)、丙氨酸和脯氨酸,而蛋氨酸、异亮氨酸、酪氨酸和组氨酸的浓度均较低,色氨酸和半胱氨酸未检测出。罗非鱼皮ASC的亚氨基酸含量为183.5/1 000个残基。罗非鱼皮SSF胶原蛋白的亚氨基酸含量(221.7/1 000个残基)高于报道的鲈鱼皮(195/1 000个残基)[28]和军曹鱼皮(203/1 000个残基)[29]。脯氨酸和羟脯氨酸的吡咯烷环可加强多肽链的构象限制,能够稳固胶原蛋白的三螺旋结构,与其热稳定性相关,故罗非鱼皮SSF胶原蛋白由于亚氨基酸含量较高,可能表现出较好的热稳定性[30-31]。
表4 SSF胶原蛋白和ASC的氨基酸组成
Table 4 Amino acid composition of SSF collagen and ASC
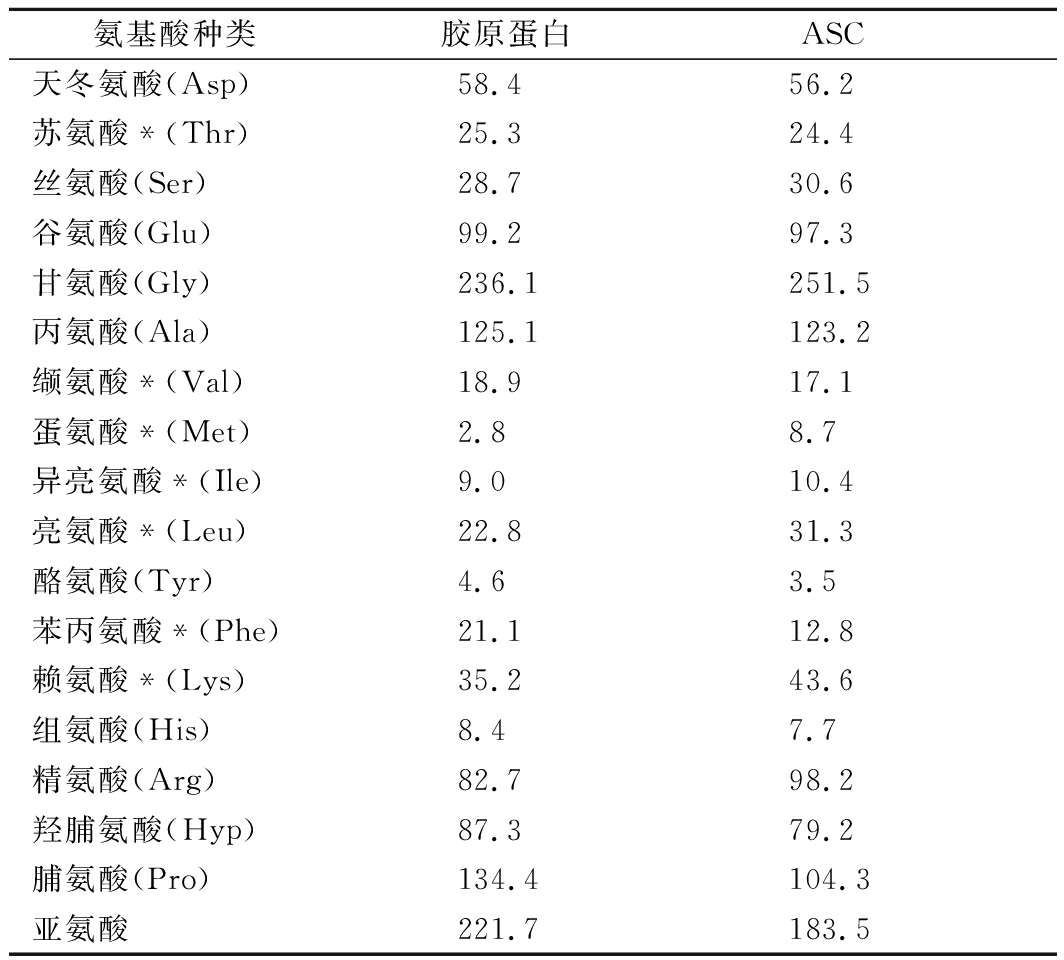
氨基酸种类胶原蛋白ASC 天冬氨酸(Asp)58.456.2苏氨酸*(Thr)25.324.4丝氨酸(Ser)28.730.6谷氨酸(Glu)99.297.3甘氨酸(Gly)236.1251.5丙氨酸(Ala)125.1123.2缬氨酸*(Val)18.917.1蛋氨酸*(Met)2.88.7异亮氨酸*(Ile)9.010.4亮氨酸*(Leu)22.831.3酪氨酸(Tyr)4.63.5苯丙氨酸*(Phe)21.112.8赖氨酸*(Lys)35.243.6组氨酸(His)8.47.7精氨酸(Arg)82.798.2羟脯氨酸(Hyp)87.379.2脯氨酸(Pro)134.4104.3亚氨酸221.7183.5
注:*表示必需氨基酸;亚氨酸=脯氨酸+羟脯氨酸;表中数据表示氨基酸残基数占1 000个氨基酸残基的比例
3 结论
本研究以罗非鱼鱼皮为原料,通过单因素试验和响应面法优化枯草芽孢杆菌固态发酵提取胶原蛋白的工艺。综合考虑实际操作,将最佳发酵工艺条件定为菌龄20 h,加水量11.7 mL,接种量5.8%,发酵温度34 ℃,发酵时间48 h,在此条件下胶原蛋白提取率可达65.03%,且与模型预测值基本吻合,说明使用该模型优化制备工艺较为准确有效。傅里叶变换红外光谱结果显示,罗非鱼皮经固态发酵制备的胶原蛋白仍能保持其完整的三股螺旋结构。紫外光谱扫描结果显示,SSF胶原蛋白在232 nm处有最大紫外吸收特征峰。聚丙烯酰胺凝胶电泳结果显示ASC与SSF胶原蛋白均具有β链,α1链和α2链3种条带,表明2种方法所提取的蛋白均为典型的Ⅰ型胶原蛋白。氨基酸组成表明,SSF胶原蛋白存在特征氨基酸,并具有潜在的抗氧化和降血压活性。以上分析结果表明,固态发酵法制备的罗非鱼皮胶原蛋白具有典型的胶原蛋白特性,且与常规酸法提取的ASC性质相似,表明其有代替ASC进行研究和应用的可能。该工艺建立了一种新型、环保、高效的从罗非鱼副产物中分离胶原蛋白的生物技术,所提出的发酵工艺简单、经济、稳定,为生产水生生物胶原蛋白提供了新的思路和工业化的理论支持。
[1] GHAZANFARI S,KHADEMHOSSEINI A,SMIT T H.Mechanisms of lamellar collagen formation in connective tissues[J].Biomaterials,2016,97:74-84.
[2] HASHIM P,RIDZWAN M,BAKAR J,et al.Collagen in food and beverage industries[J].International Food Research Journal,2015,22(1):1-8.
[3] 阮一凡,朱静静,潘道东,等.鹅皮胶原蛋白/壳聚糖复合膜理化性质和保鲜效果[J].食品科学,2019,40(1):271-277.
[4] SADEGHI-AVALSHAHR A R,KHORSAND-GHAYENI M,NOKHASTEH S,et al.Synthesis and characterization of PLGA/collagen composite scaffolds as skin substitute produced by electrospinning through two different approaches[J].Journal of Materials Science: Materials in Medicine,2017,28(1):14.
[5] ZHAO X,SONG W J,LI W C,et al.Collagen membranes crosslinked by β-cyclodextrin polyrotaxane monoaldehyde with good biocompatibilities and repair capabilities for cornea repair[J].RSC ADVANCES,2017,7(39):28 865-28 875.
[6] SRIPRIYA R,KUMAR R.A novel enzymatic method for preparation and characterization of collagen film from swim bladder of fish rohu (Labeo rohita)[J].Food and Nutrition Sciences,2015,6(15):1 468-1 478.
[7] 张锐,许永安.水产胶原蛋白的特性及应用研究进展[J].渔业研究,2011,33(2):79-83.
[8] 杨树奇,曾少葵,周春霞,等.3种鱼皮的基本成分及氨基酸组成分析[J].广东海洋大学学报,2010,30(1):97-100.
[9] 刘唤明,曾少葵.发酵法制备罗非鱼皮胶原蛋白肽的工艺的研究[J].食品科技,2012,37(4):232-235.
[10] 曾少葵,杨萍,陈秀红.微生物发酵对罗非鱼下脚料蛋白酶解液脱腥去苦效果比较[J].南方水产,2009,5(4):58-63.
[11] 韩玮.微生物发酵法制备胶原蛋白及其性质和应用研究[D].上海:上海海洋大学,2019.
[12] ZHANG J S,GUO Z Y,LIU B C,et al.Optimization of L-lactic acid production by fermentation of Huaimi dregs[J].Biotechnology & Biotechnological Equipment,2017,32(3):357-365.
[13] ERGUN S O,UREK R O.Production of ligninolytic enzymes by solid state fermentation using Pleurotus ostreatus[J].Annals of Agrarian Science,2017,15(2):273-277.
[14] 姬中伟,陈翔,孔小勇,等.枯草芽孢杆菌发酵芝麻香白酒酒醅制备抗氧化活性肽[J].食品与发酵工业, 2018, 44(10): 45-50.
[15] WOESSNER J F.The determination of hydroxyproline in tissue and protein samples containing small proportions of this imino acid [J].Archives of Biochemistry and Biophysics,1961,93(2):440-447.
[16] ISWARIYA S,VELSWAMY P,SIVAGNANAM U T.Isolation and characterization of biocompatible collagen from the skin of puffer fish (Lagocephalus inermis)[J].Journal of Polymers and the Environment,2017,26(5):2 086-2 095.
[17] WANG J,PEI X L,LIU H Y,et al.Extraction and characterization of acid-soluble and pepsin-soluble collagen from skin of loach (Misgurnus anguillicaudatus)[J].International Journal of Biological Macromolecules,2017,106(1):544-550.
[18] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[19] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.124—2016 食品安全国家标准 食品中氨基酸的测定[S].北京:中国标准出版社,2016.
[20] CHEN J D,LI L,YI R Z,et al.Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromis niloticus)[J].LWT-Food Science and Technology,2016,66(11):453-459.
[21] NURILMALA M,PERTIWI R M,NURHAYATI T,et al.Characterization of collagen and its hydrolysate from yellowfin tuna Thunnus albacares skin and their potencies as antioxidant and antiglycation agents[J].Fish Science,2019,85(3):591-599.
[22] DOYLE B B,BENDIT E G,BLOUT E R.Infrared spectroscopy of collagen and collagen like peptides[J].Biopolymers,1975,14(5):937-957.
[23] HEU M S,LEE J H,KIM H J,et al.Characterization of acid-and pepsin-soluble collagens from flatfish skin[J].Food Science and Biotechnology,2010,19(1):27-33.
[24] BARTH A,ZSCHERP C.What vibrations tell about proteins[J].Quarterly Reviews of Biophysics,2002,35(4):369-430.
[25] LIU D S,LIANG L,REGENSTEIN J,et al.Extraction and characterization of pepsin-solubilized collagen from fins, scales, skins, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis)[J].Food Chemistry,2012,133(4):1 441-1 448.
[26] 张强,黄鑫,符安卫,等.中华鳖裙边胶原蛋白的提取、鉴定及其理化性质[J].食品与发酵工业,2019,45(12):176-182.
[27] 蔡路昀,马帅,李秀霞,等.不同提取方法对鲽鱼皮胶原蛋白结构特征和功能性质的影响[J].食品与发酵工业,2017,43(5):240-246.
[28] LIAO W,XIA G H,LI C,et al.Extraction and characterization of collagen from scales and skin of Asian seabass[J].Food Science,2018,39(1):36-41.
[29] ZENG S K,YIN J J,YANG S Q,et al.Structure and characteristics of acid and pepsin-solubilized collagens from the skin of cobia (Rachycentron canadum)[J].Food Chemistry,2012,135(3):1 975-1 984.
[30] RIGBY B J.Amino-acid composition and thermal stability of the skin collagen of the Antarctic ice-fish[J].Nature,1968,219(5 150):166-167.
[31] LI J,WANG M C,QIAO Y Y,et al.Extraction and characterization of type I collagen from skin of tilapia (Oreochromis niloticus) and its potential application in biomedical scaffold material for tissue engineering[J].Process Biochemistry,2018,74:156-163.