蓝莓,又名笃斯、黑豆树(大兴安岭)为杜鹃花科越橘属植物,其浆果呈深蓝色,近圆形,表皮一层白霜,含有丰富的VC、多酚、多糖,花色苷等营养成分。蓝莓中的化学成分既具有药物学性质,又具有生物活性功能,如抗氧化、抗衰老、改善眼部血液循环等,因此近年来受到消费者的认可[1]。蓝莓果汁继紫葡萄汁、黑莓汁和桑葚汁后作为天然红色果汁饮料的新兴饮料也受到了消费者的追捧。相较于苹果汁、梨汁、桃汁等,天然红色果汁饮料的特征性成分为花色苷,如蓝莓果汁中主要为飞燕草素、矢车菊素、芍药素、矮牵牛素、天竺葵素等花青素与糖通过糖苷键结合而成的苷类物质[2], 黑莓果汁中主要为矢车菊素、天竺葵素、锦葵素等与糖结合成的苷类物质[3-4]。
果汁的生产以尽可能的保持新鲜水果的独特性以及其营养价值为目的,天然花色苷成分赋予果汁鲜艳色泽的同时又具有较好的生理活性,但其稳定性较差,易受到温度、pH、光照等因素的影响。膜过滤工艺较于传统的酶法澄清、热浓缩等工艺具有温度低、压力小、不损害物质生物活性、能耗低、设备简单、可连续生产、无污染等优点[5]。因此,膜技术也被越来越多地应用到果汁加工领域,如VIVEKANAND等[6]使用5 000 Da 截留分子质量的螺旋膜处理梨汁,得到澄清梨汁的同时也提高了梨汁的稳定性。AREND等[7]使用纳滤膜浓缩草莓中的多酚,得到的浓缩草莓汁抗氧化活性提高了60%。CONIDI等[8]研究了超滤和纳滤膜从石榴汁中分离纯化酚类化合物并考察了所选膜的产率和分离能力,发现聚酰胺类膜的产率高,污垢指数低,分离效率好,且截留液显示出较高的抗氧化活性。GHOSH等[9]使用超滤膜(50 kDa)对果汁澄清后采用纳滤膜(300 Da)浓缩,证实了集成膜处理果汁的可行性。就蓝莓汁领域,有单独利用超滤或纳滤对蓝莓汁进行澄清和浓缩处理的研究[10-11],但是利用不同膜工艺加工蓝莓汁产品的对比研究并未见报道。
本实验比较了直接与顺序膜法处理蓝莓汁的工艺,考察了直接超滤、直接纳滤和顺序超滤+纳滤对蓝莓果汁渗透通量和果汁理化性质的影响,分析了过滤前后膜表面特性的变化。
1 材料与方法
1.1 材料与仪器
蓝莓(兔眼蓝莓),杭州市鲜丰水果店;聚醚砜超滤膜(5 kDa)、聚酰胺纳滤膜(300 Da),中科瑞阳膜技术(北京)有限公司;葡萄糖(标准品)、浓H2SO4、苯酚(分析纯),国药集团化学试剂有限公司;无水Na2CO3(分析纯),太仓美达试剂有限公司;NaOH、KCl、无水醋酸钠(分析纯),天津博迪化工股份有限公司;纤维素酶、果胶酶,阿拉丁试剂公司;福林-酚试剂,美国Sigma公司;矢车菊素-3-葡萄糖苷(>97%),上海源叶生物科技有限公司。
数显恒温水浴锅,江苏省金坛市医疗仪器厂;S-4700(II)场发射扫描电子显微镜、离心机,日本日立公司;UV-2450紫外-可见分光光度计,日本岛津公司;三联高压平板膜设备,厦门福美科技有限公司;漩涡振荡混合器,上海琪特仪器有限公司; pH计,奥豪斯仪器有限公司;电子天平,梅特勒-托利多仪器有限公司;榨汁机,飞利浦有限公司;接触角测量仪,德国Dataphysics公司; zeta电位仪,奥地利Anton Paar公司; ColorQuest XE色差仪,美国HunterLab公司。
1.2 实验方法
1.2.1 蓝莓汁制备及预处理
称取新鲜蓝莓经清洗,热烫(100 ℃蒸汽热烫3 min),打浆,添加0.22%果胶酶和0.73%纤维素酶,在温度为50 ℃水浴锅中酶解100 min,榨汁,纱布粗滤后布氏漏斗抽滤,4 500 r/min离心15 min后得到蓝莓汁,置于-20 ℃冰箱内储藏作为后续实验的原料[12]。过滤实验前将原果汁稀释20倍,作为进料液。
1.2.2 实验装置
本实验使用错流膜分离实验装置,如图1所示。高压泵2提供实验所需要的操作压力,将料液泵入膜组件5(可拆卸更换膜)中进行膜分离,通过调节阀门8控制系统的操作压力,流量计3测定溶液流速,压力表4、7分别测定系统的进口压力和出口压力,计算跨膜压差,量筒6 测定渗透液的体积,被膜截留的液体返回储液罐1。
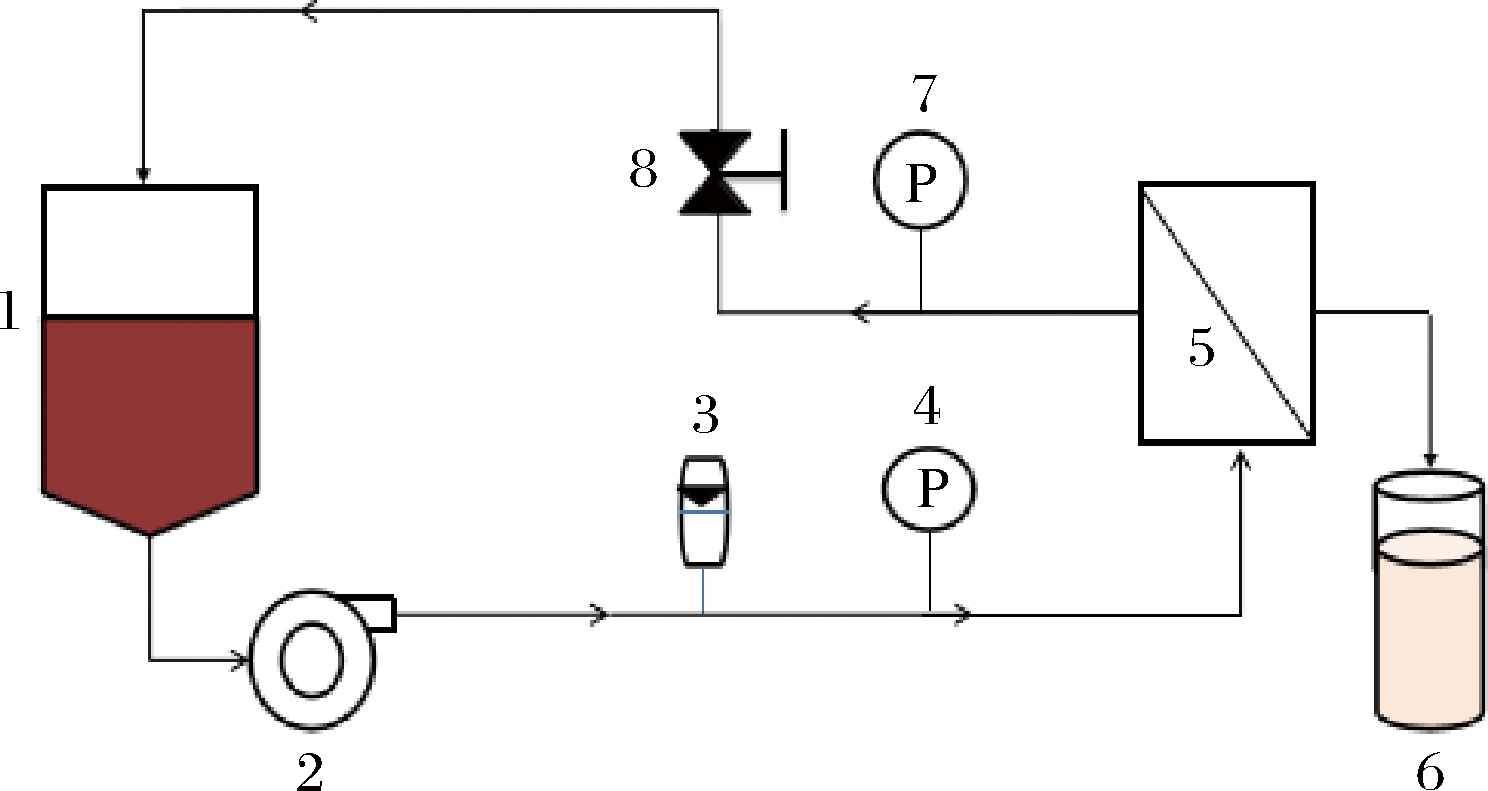
1-进料罐;2-泵;3-流量计;4、7-压力表;5-膜组件;6-量筒;
8-进料阀
图1 膜分离装置实验图
Fig.1 Schematic diagram of the membrane separation device
1.2.3 不同膜过滤工艺
选择了2种不同的平板膜,用于顺序过滤及直接过滤蓝莓汁,最终得到体积减少系数为4.0的蓝莓汁,工艺流程如图2所示:
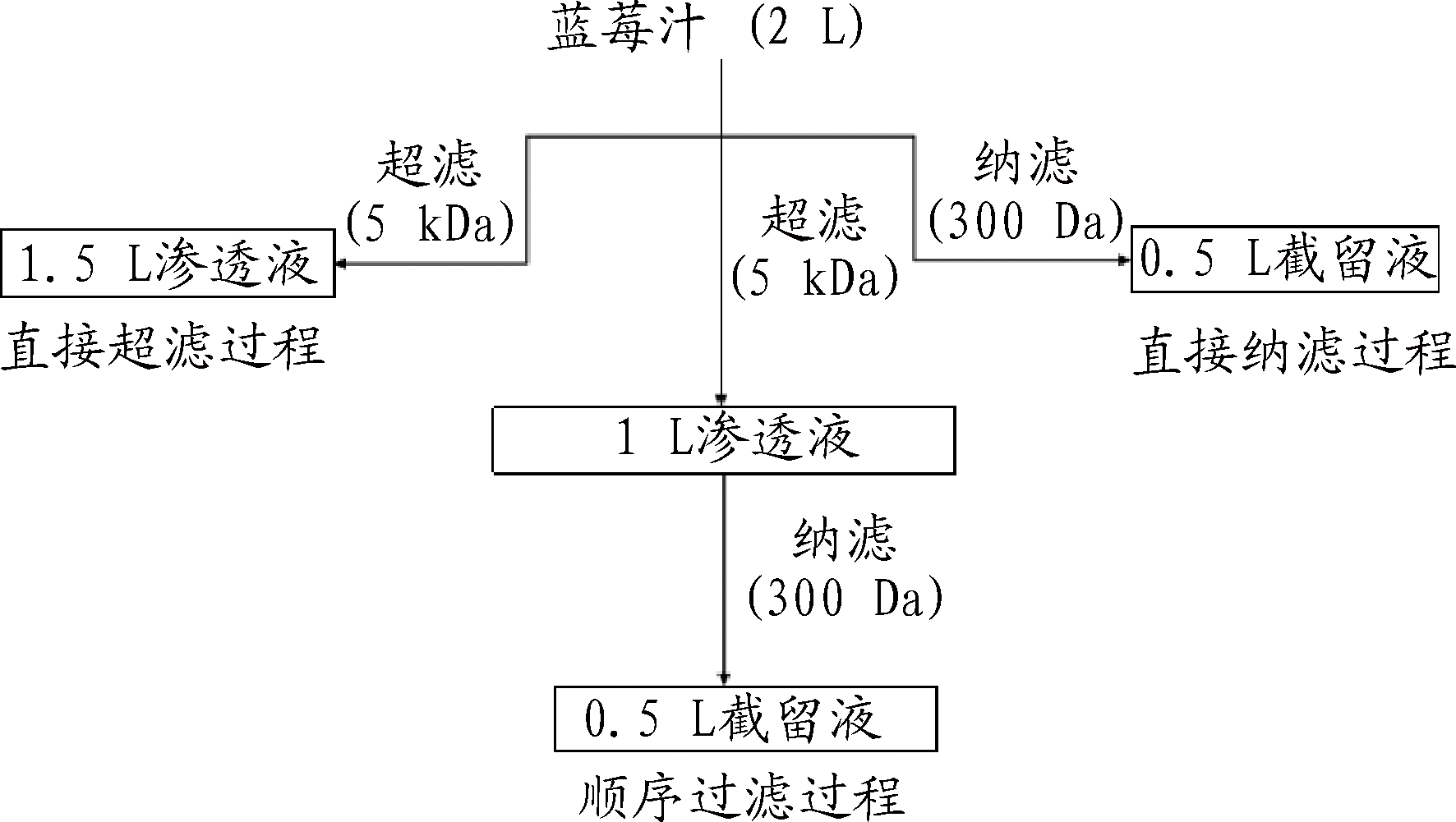
图2 不同膜过滤工艺流程
Fig.2 Flow chart of different membrane filtration
直接超滤:取蓝莓汁约2 L,用截留分子质量为5 kDa 的超滤膜在1.0 MPa、600 r/min下进行超滤澄清,得到1.5 L渗透液。
直接纳滤:取蓝莓汁约2 L,用截留分子质量为300 Da的纳滤膜在1.2 MPa、600 r/min下进行纳滤浓缩,得到0.5 L截留液。
顺序膜法:取蓝莓汁约2 L,用截留分子质量为5 kDa 的超滤膜在1.0 MPa、600 r/min下进行超滤澄清,得到1 L超滤渗透液,再经截留分子质量为300 Da 的纳滤膜进行纳滤浓缩,得到0.5 L截留液。
蓝莓汁的体积减少系数计算如公式(1)所示[13]:
体积减少系数![]()
(1)
式中:V0为进料液体积,L;Vf为截留液体积,L。
渗透液体积的计算如公式(2)所示:
Vp=V0-Vf
(2)
式中:Vp为渗透液体积,L。
1.2.4 蓝莓汁理化性质分析
测定不同膜法得到的渗透液及截留液的理化指标。
1.2.4.1 果汁澄清度的测定
根据MONDAL等[14]的方法,以蒸馏水作为空白,测定样品在660 nm下的吸光度,用T表示样品的澄清度,计算如公式(3)所示:
T=100×10-A
(3)
式中:T为澄清度;A为样品在660 nm下的吸收值。
1.2.4.2 总花色苷(total anthocyanins content, TAC)的测定
采用pH示差法[15]。根据溶液介质中花青素会随pH的改变而发生结构的转变,其结构的转变是pH 的函数,而干扰物的特征光谱不随pH的改变而发生变化。所以通过2个pH、同一波长(花青素最大吸收波长)下的吸光值差,结合Fuleki T公式测得总花色苷的含量。在25 ℃条件下,取10 mL蓝莓汁,4 500 r/min离心15 min,收集上清液,取2个10 mL容量瓶各加入1 mL上清液,分别用pH值为1.0 KCl缓冲液和pH值为4.5醋酸钠缓冲液定容,在冰箱内避光静置2 h,以蒸馏水为空白,分别在520 nm和700 nm下测吸光值A520和A700,TAC含量按公式(4)计算(结果以矢车菊素-3-葡萄糖苷计):
TAC含量/(mg·L-1)=
(4)
式中:MW为矢车菊素葡萄糖苷的分子质量(449.2 g/mol);DF为稀释倍数;ε 为矢车菊素花葡萄糖苷的摩尔消化系数,26 900 L/(mol·cm);L为比色皿的宽度,取1 cm。
1.2.4.3 总酚含量的测定
参考牛雪等[16]的方法。取1 mL膜法过滤得到的蓝莓汁加入5 mL质量分数10%福林-酚试剂,摇匀反应3~8 min,然后加入4.0 mL质量分数7.5% Na2CO3 溶液,摇匀。室温下放置60 min后在765 nm波长处测吸光度。以蒸馏水为空白对照,用没食子酸标准品建立标准曲线,得到标准方程y=21.54x+0.007 2, R2= 0.999 4,定量范围为0.01~0.05 mg/mL。测定出样品的吸光度,用回归方程计算出样品溶液中总酚的含量。
1.2.4.4 总糖含量的测定
采用苯酚-硫酸测定法[17]。精确吸取不同膜法过滤得到的蓝莓汁样品2.0 mL,加入质量分数6%苯酚1 mL、浓H2SO45 mL,振荡摇匀后沸水浴15 min,取出后迅速冷却至室温,测定490 nm波长处的吸光度,以蒸馏水为空白对照,采用葡萄糖标准品建立标准曲线,方程为y=18.143x+0.001 4, R2= 0.999 8,定量范围为0.01~0.04 mg/mL。测定样品的吸光度,根据标准曲线方程计算出样品总糖含量。
1.2.4.5 果汁pH的测定
使用手持式pH计测定。
1.2.4.6 果汁色差的测定
用色差计进行分析[18],其中:L*值表示亮度,L*越大亮度越大;a*值表示红色强度;b*表示黄色强度。ΔE*表示总颜色变化,计算如公式(5)所示:
(5)
式中:L0,a0,b0是样品在标准样品的颜色值。
1.2.4.7 总酚、花色苷、总糖等组分的保留率
按照公式(6)计算组分保留率[19]:
保留率![]()
(6)
式中:CP为渗透液中组分浓度;CF为进料液组分浓度。
1.2.5 膜通量测定
通过一定时间内测定的透过液体积(ΔV),计算出过滤过程的膜通量(Jv),其计算如公式(7)所示[20]:
(7)
式中:Jv为过滤过程中的膜通量,L/(m2·h);ΔV 是在相同时间间隔内收集的透过液体积,L;Am为膜有效面积,m2(Am=7.34×10-3 m2);t为间隔时间,h。
1.2.6 zeta电位测量
zeta电位反应了膜的电荷性。将超滤膜样品裁剪成合适矩形大小,插入塑料试管中,浸入含有质量分数为0.5%聚丙烯酸的10 mmol/L KCl 溶液,通过zeta电位仪检测膜表面电荷随pH的变化情况。原始超滤膜记为M1,直接超滤后膜记为M2,顺序超滤后膜记为M3,原始纳滤膜记为M4,直接纳滤后膜记为M5,顺序纳滤后膜记为M6。
1.2.7 接触角测量
参考文献[21],将超滤膜样品置于载玻片上并用双面胶粘贴确保膜表面平整。微量进样器取2 μL 去离子水,每张膜样品测3个不同的点取平均值。
1.2.8 扫描电镜分析
采用场发射扫描电子显微镜(field emission scanning electron microscopy,FE-SEM)对膜表面微结构进行表征[22]。
1.3 数据处理与分析
本实验所有数据均重复测定3次,使用SPSS 18.0软件进行数据处理,采用Origin 9.1软件作图。
2 结果与分析
2.1 不同膜法工艺对蓝莓汁理化指标的影响
如表1所示,直接超滤对花色苷与总酚的保留率分别为92.7%和81.5%,这一结果与MADY等[23]探究不同超滤膜和跨膜压力对总花色苷的保留率结论一致。经过直接超滤后果汁澄清度提高,由28.84%增至为91.71%,与金振宇等[10]使用中空纤维超滤膜澄清蓝莓汁,得到果汁的透光率为97.8% 结果相似。花色苷和总酚在直接超滤过程中没有质量平衡,可能涉及到溶质分子与膜材料的相互作用、溶质与残留大分子的缔合等。值得关注的是,直接超滤截留液中总糖比进料液低但其营养成分与原果汁较接近,且总花色苷及总酚分别为133.89 mg/L和0.80 g/L。直接纳滤显著提高了蓝莓汁活性成分的含量,其截留液中总花色苷为430.94 mg/L是进料液花色苷含量的2.6倍,总酚为3.81 g/L是进料液总酚含量的2.9倍,可以得出直接纳滤用于回收蓝莓汁活性成分是可行的,同样也有很多研究证明了膜浓缩花色苷的高效率[23-24]。要得到澄清的果汁,需要降低色值、花色苷含量,但降低花色苷含量会影响果汁的营养质量。与直接膜法相比,顺序膜法可得到的澄清度较高的蓝莓汁且在一定程度上保留了蓝莓汁的活性成分,如总花色苷含量为65.87 mg/L, 总酚含量为0.76 g/L,因此可以将其作为食品添加剂或者软饮料的基质。3种不同的膜工艺就回收花色苷及多酚方面以直接膜法为最佳,其次是顺序膜法,可以以产品为导向选择合适的膜工艺。
从色差结果可以看出,经过直接超滤蓝莓汁的L*增加,这是因为超滤除去了悬浮物固体,直接纳滤渗透液具有最高L*,因为其较低的截留分子质量,致使大分子不能透过膜只能滞留在截留液中。花色苷的损失最明显的特征是a*减少,通过直接超滤及超滤后纳滤,蓝莓果汁的a*相较于进料液降低,而直接纳滤截留液a*约为进料液1.4倍,相应的直接纳滤蓝莓汁截留液与进料液色差最大。蓝莓果汁过滤前后的样品如图3所示。

图3 蓝莓汁不同膜处理后的样品示图
Fig.3 Blueberry juice samples of different membrane treatments
表1 过滤前后蓝莓汁理化性质变化
Table 1 Physicochemical properties of blueberry juice after filtration
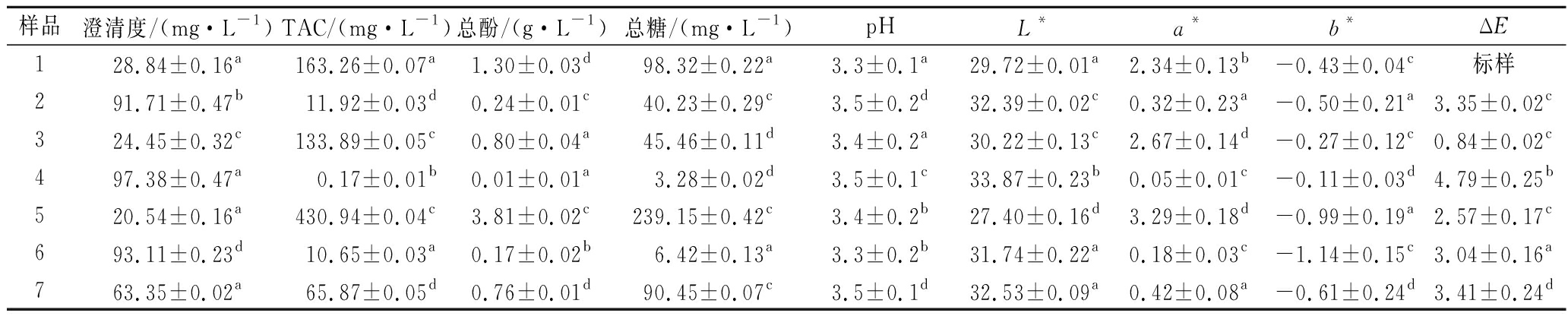
样品澄清度/(mg·L-1)TAC/(mg·L-1)总酚/(g·L-1)总糖/(mg·L-1)pHL*a*b*ΔE128.84±0.16a163.26±0.07a1.30±0.03d98.32±0.22a3.3±0.1a29.72±0.01a2.34±0.13b-0.43±0.04c标样291.71±0.47b11.92±0.03d0.24±0.01c40.23±0.29c3.5±0.2d32.39±0.02c0.32±0.23a-0.50±0.21a3.35±0.02c324.45±0.32c133.89±0.05c0.80±0.04a45.46±0.11d3.4±0.2a30.22±0.13c2.67±0.14d-0.27±0.12c0.84±0.02c497.38±0.47a0.17±0.01b0.01±0.01a3.28±0.02d3.5±0.1c33.87±0.23b0.05±0.01c-0.11±0.03d4.79±0.25b520.54±0.16a430.94±0.04c3.81±0.02c239.15±0.42c3.4±0.2b27.40±0.16d3.29±0.18d-0.99±0.19a2.57±0.17c693.11±0.23d10.65±0.03a0.17±0.02b6.42±0.13a3.3±0.2b31.74±0.22a0.18±0.03c-1.14±0.15c3.04±0.16a763.35±0.02a65.87±0.05d0.76±0.01d90.45±0.07c3.5±0.1d32.53±0.09a0.42±0.08a-0.61±0.24d3.41±0.24d
注:1-进料液;2-直接超滤渗透液;3-直接超滤截留液;4-直接纳滤渗透液;5-直接纳滤截留液;6-顺序纳滤渗透液;7-顺序纳滤截留液。同一列不同小写字母表示具有显著性差异(P<0.05)
2.2 不同膜法工艺过程中膜通量的变化
如图4所示,在所有过滤过程的前20 min,通量显著下降,这是由于膜过滤过程中,果汁中大分子如蛋白质、果胶等物质不断地堆积在膜表面,致使渗透通量逐渐下降[25],另外果汁成分复杂其溶质分子在膜表面的吸附堵塞膜孔。直接纳滤的膜通量从26.3下降至3.2 L/(m2·h),顺序纳滤通量从34.5下降至8.4 L/(m2·h),因此得出顺序膜法在增大纳滤膜通量方面有显著效果。得到相同浓缩系数的浓缩液或澄清液,直接纳滤需要约180 min,直接超滤则需要120 min,顺序超滤纳滤需要约133 min。因此,尽管直接纳滤在浓缩生物活性成分方面效率较高,但其渗透通量低,耗时较长。
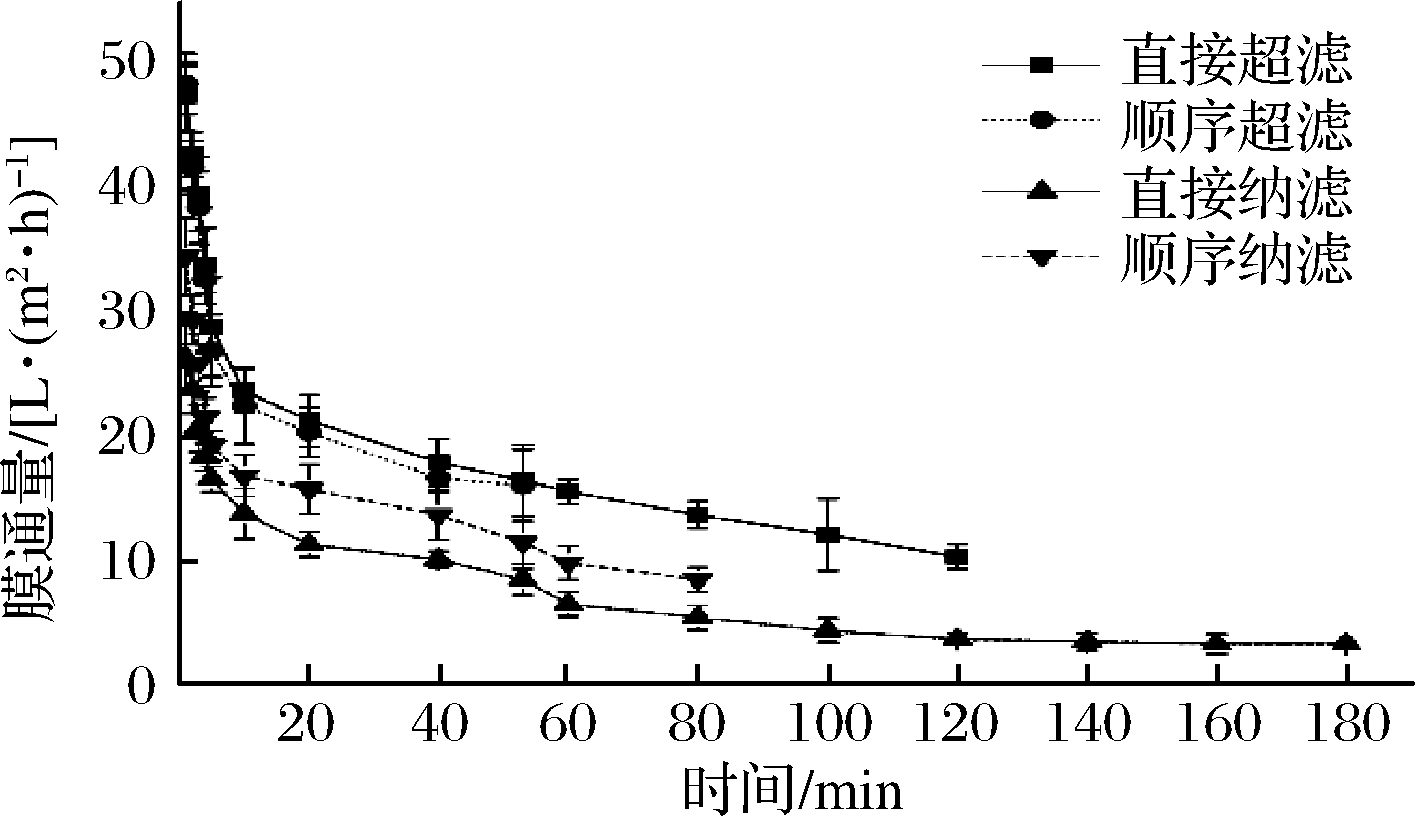
图4 膜过滤过程中膜通量的变化
Fig.4 Changes of permeate flux with time during membrane filtration
2.3 膜法过滤前后膜特性的变化
2.3.1 zeta电位的差异
超滤纳滤前后膜zeta电位的测定结果如图5所示。
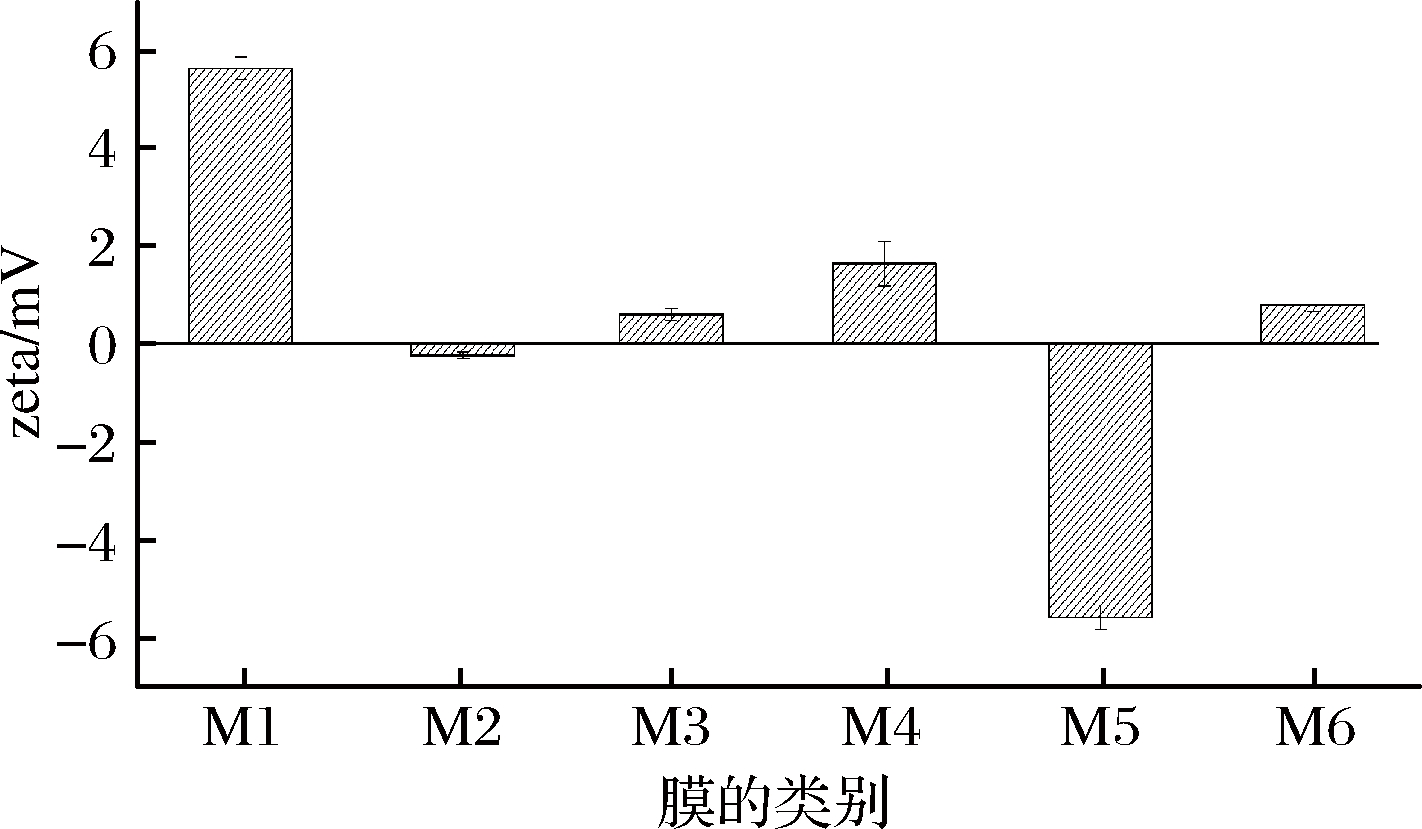
图5 过滤前后膜zeta电位的变化
Fig.5 Zeta potential changes of membrane with filtration
注:M1-原始超滤膜;M2-直接超滤后膜;M3-顺序超滤后膜;
M4-原始纳滤膜;M5-直接纳滤后膜;M6-顺序的纳滤后膜(下同)
由图5可知,M1及M4都带有正电荷分别为5.63、1.64 mV,M2与M5的zeta电位均出现负电位分别为-0.24、-5.59 mV,且M5负电位的绝对值最大。zeta电位数值降低通常意味着膜表面污染层的形成,zeta电位的下降可以解释为溶液中带有负电荷的溶质与膜在过滤过程中发生静电相互作用,从而沉积或吸附于膜表面及孔内,形成污染层,导致zeta电位的下降。M3与M6的zeta电位仍为正值分别为0.60、0.79 mV,可以看出M5受静电相互作用的影响最大,膜污染是最严重的,可知顺序膜法可以有效地减轻膜污染。这是因为直接超滤,直接纳滤分别比顺序超滤及顺序纳滤操作时间长,致使溶质中物质与膜接触时间增长,又因离子化花色苷及酚酸在弱酸性pH值带有负电荷[26],因此直接膜法中,更多带有负电荷的物质滞留在膜表面,膜污染较为严重。
2.3.2 接触角的差异
过滤前后膜接触角的变化如图6所示。
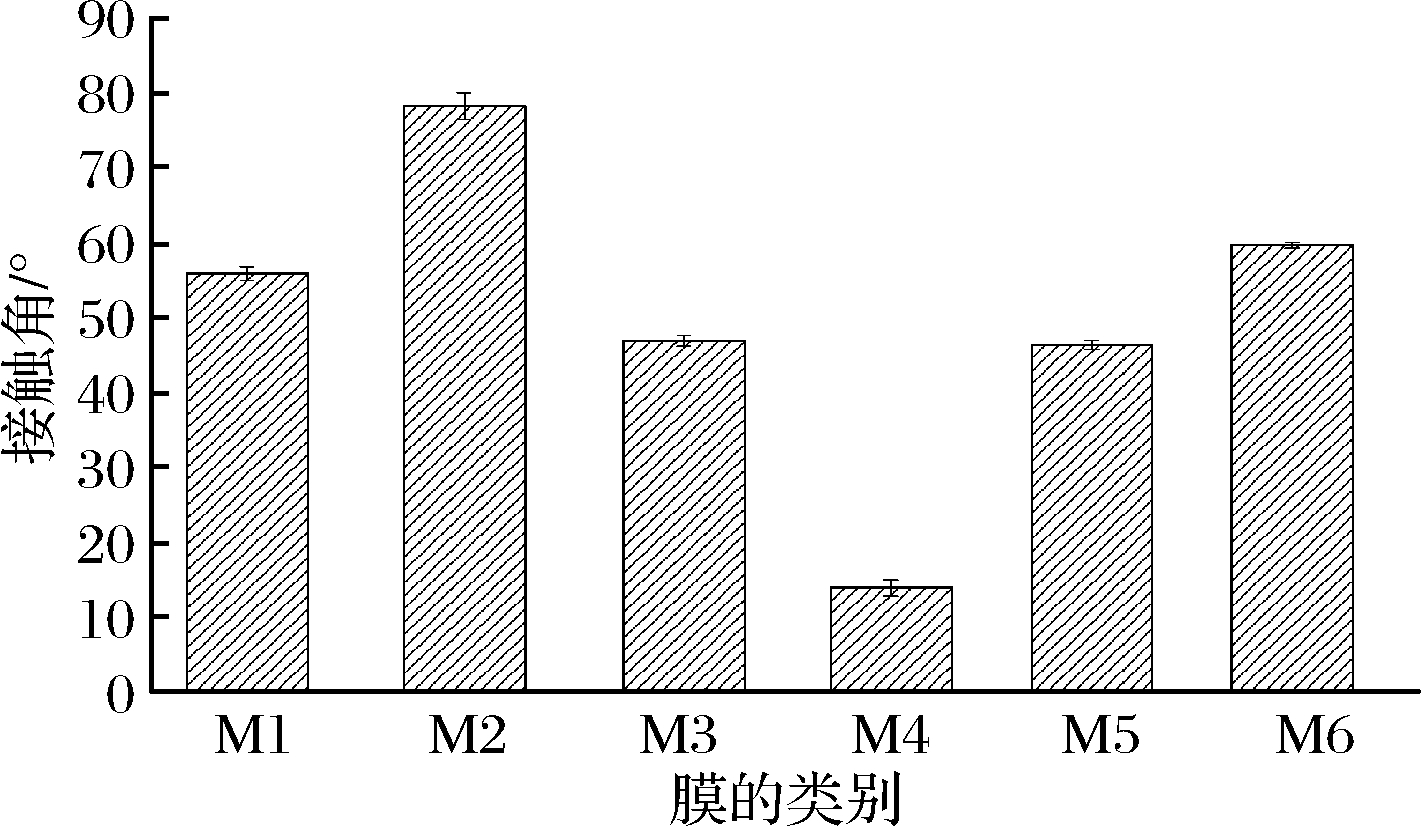
图6 过滤前后膜接触角的变化
Fig.6 Changes of water contact angle on membrane with filtration
实验中所用膜接触角小于90°均为亲水性膜,且原始纳滤膜的亲水性比原始超滤膜强。M1接触角为55.9°,M2的接触角上升为78.3°,与此相反M3接触角降低为46.9°,M4接触角为13.9°,M5与M6的接触角分别上升为46.4°和59.7°。可以看出,经过过滤后,膜的亲疏水性均发生了变化,说明在过滤澄清及浓缩过程中,膜与蓝莓汁某些溶质成分相互作用使的表面性质发生了改变[21]。顺序超滤膜与直接超滤膜相比接触角变化较小,是因为其超滤时间短,因而受到亲水/疏水影响较小。顺序纳滤膜接触角增大其疏水性增强,是因为顺序纳滤以超滤渗透液为原料,因此含有更多大分子亲水性物质如果胶、蛋白质等,它们的亲水基团由于亲水相互作用而更易于黏附在亲水膜表面,其疏水性基团暴露在溶液中,这样增加了亲水膜的疏水性[27]。
2.4 膜表面微观结构的差异
图7为原始膜与实验后膜表面微结构扫描电镜图。由图7中可以看出,原始的超滤膜M1表面没有杂质,且较不平整。经过超滤后,可以看到膜表面发生了一些变化,其中M2表面出现凸起的污染层,出现有轻微裂痕。M3中可以看到较平整的污染层均匀分布在膜表面,同时有裂痕出现。M5直接纳滤后膜与M4原始的纳滤膜相比,表面覆盖了一层污染物,并有星点的白色污染物。M6顺序纳滤膜表面污染较小,没有明显的污垢层,可以解释为超滤过程除掉大分子物质,从而在后续纳滤中减少污染,这与前面膜通量及Zeta电位的变化是相对应的。即顺序膜法在减轻膜污染方面有较好的表现。

a-M1;b-M2;c-M3;d-M4;e-M5;f-M6
图7 扫描电镜观察膜表面
Fig.7 SEM images of membrane surface
3 结论
本文就直接膜法及顺序膜法对处理得到的蓝莓汁进行比较,分析了不同膜法在处理果汁的优缺点,有利于开发以产品为导向的膜工艺。其中直接纳滤得到的截留液中花色苷与总酚含量分别为430.94 mg/L和3.81 g/L,证实了纳滤可以浓缩回收蓝莓汁中的活性成分,可用于生产天然着色剂或添加到营养保健品中。但其耗时较长,且膜污染最为严重。直接超滤可以除去蓝莓汁中大分子悬浮固体,可用于前处理澄清果汁,适合于产生透明的渗透液和富含酚类化合物的截留液。顺序膜法适合用于生产较澄清且营养价值较高的蓝莓汁,可将其作为食品添加剂或做软饮料的基质同时可以增加膜通量,减少膜污染,缩短减少过滤时间。
[1] 陶伯旭. 蓝莓清汁饮料的加工工艺研究[D].呼和浩特:内蒙古农业大学, 2013.
[2] 李斌, 雷月, 孟宪军, 等.蓝莓营养保健功能及其活性成分提取技术研究进展[J]. 食品与机械, 2015, 31(6): 251-254.
[3] WU X L, PRIOR R L. Systematic identification and characterization of anthocyanins by HPLC-ESI-MS/MS in common foods in the United States: Fruits and berries[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2 589-2 599.
[4] DUGO P, MONDELLO L, ERRANTE G, et al. Identification of anthocyanins in berries by narrow-bore high-performance liquid chromatography with electrospray ionization detection [J]. Journal of Agricultural and Food Chemistry, 2001, 49(8): 3 987-3 992.
[5] DRIOLI E, ROMANO M. Progress and new perspectives on integrated membrane operations for sustainable industrial growth[J]. Industrial and Engineering Chemistry Research, 2001, 40(5): 1 277-1 300.
[6] VIVEKANAND V, IYER M,AJIOUWI S. Clarification and stability enhancement of pear juice using loose nanofiltration[J]. Food Processing and Technology, 2012, 3(6): 1-6.
[7] AREND G D, ADORNO W T, REZZADORI K, et al. Concentration of phenolic compounds from strawberry (Fragaria X ananassa Duch) juice by nanofiltration membrane[J]. Journal of Food Engineering, 2017, 201:36-41.
[8] CONIDI C, CASSANO A, CAIAZZO F, et al. Separation and purification of phenolic compounds from pomegranate juice by ultrafiltration and nanofiltration membranes[J]. Journal of Food Engineering, 2017, 195:1-13.
[9] GHOSH P, PRADHAN R C, MISHRA S, et al. Quantification and concentration of anthocyanidin from indian blackberry(Jamun) by combination of ultra- and nano-filtrations[J]. Food and Bioprocess Technology, 2018, 11(12): 2 194-2 203.
[10] 金振宇, 杨宏志. 中空纤维超滤膜澄清蓝莓果汁工艺研究[J]. 食品与机械, 2014, 30(5): 260-264.
[11] AVRAM M A, MORIN P, BROWNMILLER C, et al. Concentrations of polyphenols from blueberry pomace extract using nanofiltration[J]. Food and Bioproducts Processing, 2017, 106: 91-101.
[12] 戴晓晴. 蓝莓浓缩汁的制备及蓝莓覆盆子复合饮料研究[D]. 合肥: 合肥工业大学, 2017.
[13] GARCIA-CASTELLO M E, MAYOR L, CHORQUES S, et al. Reverse osmosis concentration of press liquor from orange juice solid wastes: Flux decline mechanisms[J]. Journal of Food Engineering, 2011, 106(3):199-248.
[14] MONDAL M, BISWAS P P, DE S. Clarification and storage study of bottle gourd (Lagenaria siceraria) juice by hollow fiber ultrafiltration [J]. Food and Bioproducts Processing, 2016, 100:1-15.
[15] WALLACE T C, GIUSTI M M. Determination of color, pigment, and phenolic stability in yogurt systems colored with nonacylated anthocyanins from Berberis boliviana L. as compared to other natural/synthetic colorants[J]. Journal of Food Science, 2008, 73(4): C241-C248.
[16] 牛雪, 张军翔, 徐国前. 葡萄与葡萄酒中总酚测定方法的研究进展[J]. 食品与机械, 2016, 32(3): 239-242.
[17] 周春丽, 钟贤武, 范鸿冰, 等. 果蔬及其制品中可溶性总糖和还原糖的测定方法评价[J]. 食品工业, 2012,33(5): 89-92.
[18] LI N, TAYLOR L S, FERRUZZI M G, et al. Color and chemical stability of tea polyphenol (-)-epigallocatechin-3-gallate in solution and solid states[J]. Food Research International, 2013, 53(2): 909-921.
[19] CASTRO-MU OZ R, BARRAG
OZ R, BARRAG N-HUERTA B E, Y
N-HUERTA B E, Y
 EZ-FERN
EZ-FERN NDEZ J. The use of nixtamalization waste waters clarified by ultrafiltration for production of a fraction rich in phenolic compounds[J]. Waste and Biomass Valorization, 2016, 7(5): 1 167-1 176.
NDEZ J. The use of nixtamalization waste waters clarified by ultrafiltration for production of a fraction rich in phenolic compounds[J]. Waste and Biomass Valorization, 2016, 7(5): 1 167-1 176.
[20] LEU M, MARCINIAK A, CHAMBERLAND J, et al. Effect of high-hydrostatic-pressure-treated skim milk on permeate flux and fouling during ultrafiltration[J]. Journal of Dairy Science, 2017, 100(9):7 071-7 082.
[21] PALACIO L, CALVO J I, PR DANOS P, et al. Contact angles and external protein adsorption onto UF membranes [J]. Journal of Membrane Science, 1999, 152(2): 189-201.
DANOS P, et al. Contact angles and external protein adsorption onto UF membranes [J]. Journal of Membrane Science, 1999, 152(2): 189-201.
[22] ABDULLAH S Z, BÉRUBÉ P R, HORNE D J. SEM imaging of membranes: Importance of sample preparation and imaging parameters[J]. Journal of Membrane Science, 2014, 463: 113-125.
[23] MADY CISSÉ, VAILLANT F, PALLET D, et al. Selecting ultrafiltration and nanofiltration membranes to concentrate anthocyanins from roselle extract (Hibiscus sabdariffa L.)[J]. Food Research International, 2011, 44(9): 2 607-2 614.
[24] CHANDRASEKHAR J, RAGHAVARAO K S M S. Separation and concentration of anthocyanins from jamun: An integrated process[J]. Chemical Engineering Communications, 2015, 202(10): 1 368-1 379.
[25] 吴燕华, 李楠, 刘文力.超滤膜在果汁加工中的应用研究[J]. 广东化工, 2006, 33(3): 57-59.
[26] RIBÉREAU-GAYON P, GLORIES Y, MAUJEAN A, et al. HandBook of Enology[M].NewYork:JohnWiley&Sons,2006: 141-203.
[27] CHEN X R, LUO J Q, QI B K, et al. NOM fouling behavior during ultrafiltration: Effect of membrane hydrophilicity[J]. Journal of Water Process Engineering, 2015, 7:1-10.