海洋源抗菌活性乳酸菌的筛选及对冷鲜鸡肉货架期评价
陈全毅1,唐慧芳1,刘颖1,3*,徐慧珊1,孙力军1,2,蚁硕钊1
1(广东海洋大学 食品科技学院, 广东 湛江, 524088)2(广东海洋大学,广东省水产品加工与安全重点实验室, 广东 湛江, 524088)3(水产品深加工广东普通高等学校重点实验室, 广东 湛江, 524088)
摘 要 从华贵栉孔扇贝中筛选出能抑制冷鲜鸡中单增李斯特菌生长,并能有效延长冷鲜鸡肉货架期的乳酸菌。采用划线分离纯化乳酸菌,牛津杯法检测抗菌活性。通过在鸡肉上涂抹具有抗菌活性乳酸菌发酵上清液的方式,对冷鲜贮藏的鸡肉进行感官、pH值、挥发性盐基氮、单增李斯特菌数与菌落总数的测定。结果表明,筛选到5株具有抗菌活性的乳酸菌,其中菌株Pe-B1具有很强的抑菌效果。16S rRNA鉴定结果与菌株Pediococcus pentosaceus DSM 20336相似度为99.51%,构建系统发育树在同一支系上,鉴定为戊糖片球菌。涂抹发酵上清液试验组在贮藏9 d时,菌落总数5.0 lg CFU/g,挥发性盐基氮17.82 mg/100g,pH值为5.8,色泽暗黄、肌肉发白、异味加重、弹性较差,与未涂抹发酵上清液的对照组冷藏6 d各指标基本一致,涂抹发酵上清液至少能延长3 d的保质期,并对鸡肉中耐低温的单增李斯特菌有很好的抑制效果,该研究为从该菌发酵液中获得食品生物防腐剂提供依据。
关键词 乳酸菌;抑菌活性;冷鲜鸡肉;货架期
DOI:10.13995/j.cnki.11-1802/ts.023212
引用格式:陈全毅,唐慧芳,刘颖,等.海洋源抗菌活性乳酸菌的筛选及对冷鲜鸡肉货架期评价[J].食品与发酵工业,2020,46(20):164-170.CHEN Quanyi,TANG Huifang,LIU Ying, et al. Screening of marine-sourced antibacterial active lactic acid bacteria for increasing the shelf life of chilled fresh chicken[J].Food and Fermentation Industries,2020,46(20):164-170.
第一作者:硕士研究生(刘颖教授为通讯作者,E-mail: 406662864@qq.com)
基金项目:广东省科技计划项目(2017A030303079;2016A020222014)
收稿日期:2019-12-27,改回日期:2020-06-01
Screening of marine-sourced antibacterial active lactic acid bacteria for increasing the shelf life of chilled fresh chicken
CHEN Quanyi1,TANG Huifang1,LIU Ying1,3*,XU Huishan1,SUN Lijun1,2,YI Shuozhao1
1(College of Food Science and Technology, Guangdong Ocean University, Zhanjiang 524088,China)2(Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety, Guangdong Ocean University, Zhanjiang 524088, China)3(Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution, Zhanjiang 524088,China)
ABSTRACT This study screened lactic acid bacteria (LAB) from the scallop Chlamys nobilis, which can effectively inhibit the growth of Listeria monocytogenes in chilled fresh chicken and thereby prolong its shelf life. LABs were purified by streaking and the antimicrobial activity was detected by the Oxford cup method. Sensory performance, pH value, volatile basic nitrogen, the number of Listeria monocytogenes and the total number of bacterial colonies on the chilled fresh chicken were tested after applying the supernatant from LAB fermentation broth onto the chicken. Results showed that five LABs strains with antibacterial activity were screened and the strain Pe-B1 had a very strong antibacterial effect. Sequencing of 16S rRNA showed a 99.51% similarity with Pediococcus pentosaceus DSM 20336. And the strain was identified as Pediococcus pentosaceus. On the 9th day of storage, the total number of bacterial colonies, volatile basic nitrogen and the pH value of the test group treated with the P. pentosaceus fermentation broth were 5.0 lg CFU/g, 17.82 mg/100g and 5.8, respectively. The chicken developed a dull yellow appearance, whitened muscles, intensified smell and poor elasticity. These characteristics were largely consistent with the control group that did not have a fermentation broth applied, after 6 days. Therefore, the fermentation broth can prolong shelf life for at least 3 days and can inhibit low-temperature-resistant Listeria monocytogenes in chicken. This study provides a reference for developing food biological preservatives from the fermentation broths of LAB.
Key words lactic acid bacteria; antimicrobial activity; chilled fresh chicken; shelf life
如今食品污染和食源性疾病在世界范围内普遍存在,食品安全形势不容乐观。有统计显示,在影响食品安全的诸多因素中,微生物污染仍高居首位,成为影响食品安全的罪魁祸首[1]。目前,解决这一问题主要依靠化学食品防腐剂,但化学食品防腐剂的不当使用引起的不安全性,促使生物防腐剂发展成为一种有吸引力的替代方法[2],乳酸菌及其代谢产物如乳酸、乳酸菌素等作为重要的生物防腐剂一直是研究人员关注的热点[3]。作为已在食品应用中使用了数千年的乳酸菌(lactic acid bacteria,LAB),被普遍认为是对人类安全的微生物[4]。随着人类不断地对陆地资源进行筛选与开发,从中获取新的乳酸菌或化学结构独特、活性强的代谢产物的概率变的愈来愈低。海洋环境的特殊性孕育着丰富的海洋动物,而乳酸菌作为海洋动物肠道重要的微生物类群,它们不仅对维持动物肠道的生态方面起着重要作用,而且其产生的细菌素等代谢产物对抗病原菌感染也起到了不容忽视的作用。因此,从海洋动物肠道中获得具有抗菌活性的乳酸菌是一个重要来源[5-7]。ZHANG等[8]从南海海域动物高贵海扇蛤肠道中筛选到1株戊糖片球菌,其抑菌谱广且对单增李斯特菌有很好的抑制作用。BUNTIN等[9]从鱼类、虾类和贝类的胃肠道中分离出160株对病原性大肠杆菌具有抑制活性的乳酸菌。根据其胆汁和酸耐受性选择了3种菌株,菌株显示出对人类病原体的抑制活性,包括金黄色葡萄球菌、单核细胞增生李斯特菌、沙门氏菌和大肠杆菌,16S rRNA鉴定为罗伊氏乳杆菌和发酵乳杆菌。
由于禽流感等疾病的爆发和消费者对方便、快捷食品的需求,以冷鲜鸡肉为代表的冷藏食品逐渐成为消费的主流[10-11]。但由于单增李斯特菌(Listeria monocytogenes)的耐低温特性,成为冷鲜鸡肉贮藏和运输过程中的安全隐患因子[12]。AMEZQUITA等[13]从市售肉制品中分离出乳酸片球菌、干酪乳杆菌和副干酪乳杆菌,其发酵液能降低香肠和火腿中单增李斯特菌数量。DICKS等[14]将植物乳杆菌菌株和弯曲乳杆菌菌株的复配培养物加入鸵鸟肉萨拉米香肠中,单增李斯特菌数量延迟了9 h到达7.0 lg CFU/g。所以筛选具有抑菌活性的乳酸菌这种生物防腐方法受到越来越多人的青睐。
本文立足从海洋扇贝中筛选具有抑菌活性的乳酸菌,并应用到营养丰富的冷鲜鸡肉中进行货架期效应评价。
1 材料与方法
1.1 材料
1.1.1 原料和菌株
华贵栉孔扇贝(Mimachlamys nobilis ),湛江湖光水产品批发市场;指示菌株:金黄色葡萄球菌(Staphylococcus aureus ATCC6538)、副溶血性弧菌(Vibrio parahemolyticus ATCC 17802)、单核细胞增生李斯特氏菌(Listeria monocytogenes ATCC 19111)、枯草芽孢杆菌(Bacillus subtilis CMCC 63501)、大肠埃希氏菌(Escherichia coli ATCC 25922),广东海洋大学食品安全微生物保藏室。
1.1.2 培养基与试剂
MRS琼脂培养基、营养琼脂、LB营养琼脂、LB肉汤、MRS肉汤、TSA培养基,青岛海博生物技术公司;纳氏试剂,天津特化研科技有限公司。
形态及生化鉴定用试剂:生化鉴定管、革兰氏染色试剂盒,北京陆桥技术股份有限责任公司;过氧化氢,上海生工生物有限公司。
分子鉴定试剂MightyAmpDNAPolymeraseVer.2、2×MightyAmpBuffe,宝生物工程有限公司;16S rRNA 细菌通用引物 1492R:-GGTTACCTTGTTACGACTT-,27F:-AGAGTTTGATCCTGGCTCAG,由上海生工生物技术有限公司合成。
1.1.3 仪器与设备
LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;SPX-250B-Z生化培养箱,上海博迅实业有限公司医疗设备厂;XSP-2CA生化显微镜,上海光学仪器一厂;EPS-202电子天平,长沙湘平科技发展有限公司;Delta 320-SpH酸度计,杭州齐威仪器有限公司;TGL-20MW台式高速冷冻离心机,湖南赫西仪器装备有限公司;Hema 9600聚合酶链式反应(polymerase chain reaction,PCR)仪,珠海黑马医药仪器有限公司;SW-CJ-1F单人双面净化工作台,苏州净化设备有限公司;DHG-914OA电热烘箱广州市深华生物技术有限公司;BCD-603 WDA冷藏冷冻冰箱,惠而浦(中国)股份有限公司;XW-80A涡旋混合器,上海驰唐电子有限公司,EPS-200电泳仪,上海天能科技有限公司。
1.2 实验方法
1.2.1 乳酸菌的分离
样品采集后装入无菌袋中,密封并用冰袋迅速运回实验室。取扇贝胃肠道共25 g到三角锥形瓶内,捣碎均质后稀释,分别取0.1 mL稀释溶液涂布于含有0.3%(质量分数)CaCO3的MRS培养基上,30 ℃培养24~48 h,对有溶钙圈的菌落进行反复分离纯化。
对反复纯化获得的菌落通过革兰氏染色、过氧化氢酶试验、形态观察,并结合《乳酸菌科学与技术》与《乳酸细菌分类鉴定及实验方法》,对有溶钙圈、革兰氏阳性、过氧化氢酶阴性的分离菌株确认为乳酸菌[15-16],并进行斜面保藏。
1.2.2 具有抑菌活性乳酸菌的筛选
指示菌菌悬液的制备:大肠埃希菌、枯草芽孢杆菌、单核细胞增生李斯特氏菌、副溶血性弧菌在相应培养基中37 ℃条件下培养24 h,用接种环刮入菌苔到装有10 mL生理盐水的试管并混匀,制备成OD600≈0.3的菌悬液[17]。
发酵上清液的制备:将保存于斜面的乳酸菌活化2代后再接种于MRS液体培养基中,30 ℃培养48 h,发酵液8 000 r/min离心20 min,收集上清液置于4 ℃冰箱中,备用。
乳酸菌抑菌活性的测定:无菌操作下在洁净平板注入约10 mL素琼脂,待凝固后用镊子均匀在素琼脂表面放置4个牛津杯,接着倒入OD600=0.3的指示菌培养基。待琼脂完全凝固后,用镊子轻轻拔出牛津杯,接着在3个杯孔中注入0.2 mL的乳酸菌发酵上清液,另一孔注入0.2 mL无菌生理盐水作对照,放置在4 ℃静置4 h,再移到指示菌相应的生长温度培养,观察每个平板是否有产生抑菌圈,并记录产生抑菌圈直径的大小[18-19]。
1.2.3 16S rRNA分子生物学鉴定
采用16S rRNA寡核苷酸的碱基序列分析的方法对筛选的具有抑菌活性菌株展开分析鉴定。在PCR小管内配制30 μL反应体系,灭菌牙签挑取培养基上少量菌苔作为模板DNA,2×MightyAmp buffer 15 μL,MightyAmpDNA 聚合酶 0.75 μL,27F(10 μmol/μL)0.75 μL,1492R(10 μmol/μL)0.75 μL,ddH2O 12.75 μL。PCR反应条件为98 ℃预变性2 min,98 ℃变性10 s,55 ℃退火15 s,68 ℃延伸90 s,共做40个循环。设置1×TAE缓冲液作为电泳缓冲液,取5 μL PCR扩增产物进行1.0%(质量分数)琼脂糖凝胶电泳检测,电泳40 min后取出凝胶,观察凝胶成像系统中的条带,将符合要求的目的条带PCR产物寄往上海生工生物技术有限公司进行序列测序。
下载NCBI-BLAST搜索程序从GenBank对16S rRNA测序结果进行同源性检索,对相似性极高的已知菌株的16S rRNA基因序列进行下载并用MEGA5.1建立系统发育树。
1.2.4 具有抗菌活性乳酸菌上清液对冷鲜鸡肉的防腐评价
1.2.4.1 冷鲜鸡肉的处理
取当天屠宰冷鲜鸡肉,无菌操作切分成面积5 cm2,厚约5 mm的肉块若干份[20]。
A-CK:使用生理盐水浸泡15 s,置于网格上晾2 min,封膜4 ℃保存。
A-1:使用乳酸菌上清液浸泡15 s,置于网格上晾2 min,封膜4 ℃保存,15 d内每隔2 d进行1次感官评定、理化指标和菌落总数的测定。
1.2.4.2 感官评定
感官评定小组选取10位食品相关专业同学,在室内自然光线下,结合表1对冷鲜鸡肉的肌肉色泽、气味、弹性、黏性和煮沸后肉汤进行感官评价打分并记录[21]。然后取10人评分结果的平均值为最终结果。
表1 感官评定标准
Table 1 Criteria of sensory evaluation

指标10分7~9分4~6分1~3分色泽表皮和肌肉切面有鲜肉光泽皮肤光泽稍变暗,肉质略浅色皮肤质干暗黄,肌肉发白皮肤无光泽,发白程度严重气味具有鸡肉的气味且无异味有轻度不愉快异味不快异味加重臭味弹性弹性较好,压下去后马上恢复弹性略差,指压后短时间内恢复弹性较差,指压后难以恢复弹性差,指压后无法恢复黏性肌肉湿润不黏手稍有黏手比较黏手十分黏手煮沸后肉汤透明澄清,具有固有香味透明澄清,略带腥味浑浊且具有腥味十分浑浊,出现腥臭味
1.2.4.3 菌落总数测定
按照GB/T 4789.2—2016[22]关于菌落总数的测定方法,根据GB 2707—2016[23]关于冻禽产品菌落总数的规定,冻禽产品菌落总数应符合≤5×105 CFU/g。
1.2.4.4 肉样pH值测定
按照GB 5009.237—2016[24]中关于食品pH的测定方法,各取A-CK,A-1两组5 g已经搅碎的样品,与50 g生理盐水混合,过滤用pH计测定滤液pH值[25]。
1.2.4.5 挥发性盐基氮的测定
依照GB 2707—2016《食品安全国家标准鲜(冻)畜、禽产品》[23]规定的关于冷却肉挥发性盐基氮(total volatile base nitrogen,TVB-N)含量TVB-N值≤15 mg/100 g。本次实验采用分光光度计法[26]测定挥发性盐基氮,计算如公式(1)所示:
(1)
式中:X为所测样品的TVB-N值,mg/100g;ρ为样品测定液中TVB-N值,μg/mL,ρ0为空白测定液中TVB-N值,μg/mL;m,测定样品质量,g;V,测定用样品液体体积,mL。
1.2.5 具有抗菌活性乳酸菌发酵液对鸡肉中单增李斯特菌的抑制效果
用接种环刮取适量已活化2代的单增李斯特氏菌菌苔到10 mL无菌生理盐水中制成菌悬液,采用血球计数板法将其稀释成7.0 lg CFU/mL菌悬液[19]。
B-CK: 使用95%(体积分数)乙醇浸泡2 s,接着点燃肉块进行表面灭菌,将肉块浸泡在7.0 lg CFU/mL的单核增生李斯特氏菌悬液中2 s,置于网格上晾2 min,封膜4 ℃保存。
B-1: 使用95%乙醇浸泡2 s,接着点燃肉块进行表面灭菌,将肉块浸泡在7.0 lg CFU/mL的单核增生李斯特氏菌悬液中2 s,接着喷洒乳酸菌上清液,置于网格上晾2 min,封膜4 ℃保存。按照GB/T 4789.30—2016测定单增李斯特氏菌的菌数[27]。
1.3 数据处理
所有数据都做3组平行实验。数据采用 Excel 进行分析,计算平均值与标准差MEGA5.1构建系统发育树。
2 结果与分析
2.1 抗菌活性乳酸菌的筛选
从海洋动物扇贝中共分离出17株具有溶钙圈的分离株,其中12株为革兰氏阳性菌,过氧化氢酶实验呈阴性有5株,按照陈卫与凌代文筛选乳酸菌的标准,确定菌株Pe-B1、Lp-B5、Es-B7、E1-B16与E1-B22为乳酸菌。
双层牛津杯抑菌试验发现(表2),5株乳酸菌只有E1-B16没有抗菌活性,菌株Lp-B5、Es-B7、El-B22 抗菌谱窄,抑菌活性较弱,而菌株Pe-B1对5种指示菌均有抗菌活性,且对5种指示菌的抑菌圈直径为14~20 mm。菌株Pe-B1不仅能抑制以金黄色葡萄球菌、单增李斯特菌和枯草芽孢杆菌为代表的革兰氏阳性菌的生长繁殖,还能抑制以大肠埃希氏菌和副溶血性弧菌为代表的革兰氏阴性菌的生长繁殖,具有相对较广的抑菌谱。
表2 菌株Pe-B1对不同指示菌的抑菌效果
Table 2 Bacteriostatic effect of strain Pe-B1 on
different indicator bacteria
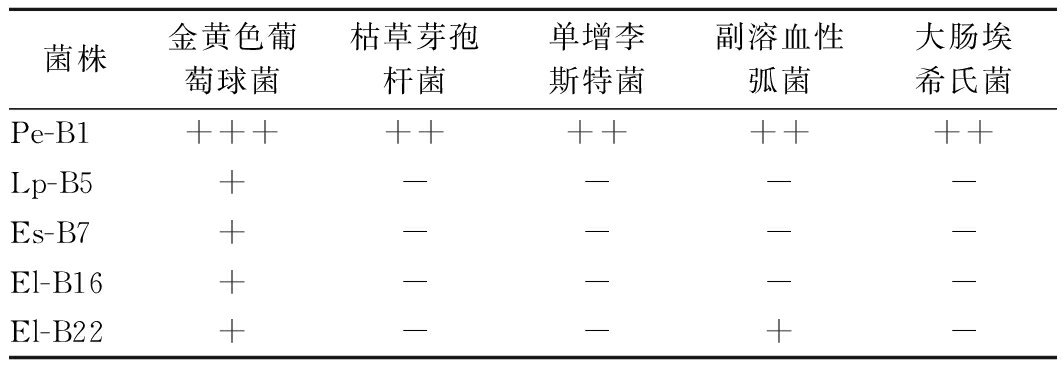
菌株金黄色葡萄球菌枯草芽孢杆菌单增李斯特菌副溶血性弧菌大肠埃希氏菌Pe-B1+++++++++++Lp-B5+----Es-B7+----El-B16+----El-B22+--+-
注:牛津杯内径7.8 mm,外径 8.0 mm;+++:抑菌圈直径﹥20 mm;++:抑菌圈直径14~20 mm; +:抑菌圈直径﹤14 mm;-:无抑菌活性
2.2 乳酸菌菌株的16S rRNA鉴定
菌株Pe-B1 PCR扩增产物电泳所产生的亮条带经检测DNA分子量在1 500 bp左右,经过送检实验室完成测序之后,登录搜索程序进行搜索,根据GenBank对16S rRNA测序结果进行同源性检索,菌株Pe-B1与Pediococcus pentosaceus DSM 20336T的相似度为99.51%,并与构建的系统发育树在同一支系上(图1),鉴定菌株Pe-B1为戊糖片球菌。
2.3 戊糖片球菌Pe-B1发酵上清液对冷鲜鸡肉感官的影响
由于鸡肉中水分和蛋白质含量高,很容易腐败变质,保质期变短。众所周知,肉品表面微生物菌群的发育及其活性是引起鸡肉产品感官特性变化的主要原因,这些变化缩短了鸡肉产品的商业使用寿命,造成了工业经济损失,感官指标已成为评定食品新鲜程度的重要指标,本文参考KARAM等[28]对腌制鸡肉货架期的感官评定方法,结果如表3所示,对照组A-CK在第6天出现皮肤干燥暗黄、肌肉发白、腥味严重、肉质弹性差、指压后难以恢复、有黏液、煮熟后肉汤浑浊且具有腥味,综合评价已经低于冷却肉货架不能销售期限的终点6.0[21],说明对照组A-CK的保质期不超过6 d。而实验组A-1在第9天时才出现上述腐败变质现象,说明喷洒了戊糖片球菌Pe-B1发酵上清液的冷鲜鸡肉保鲜时间比未使用上清液延长了3 d。
表3 感官指标变化
Table 3 Sensory index change
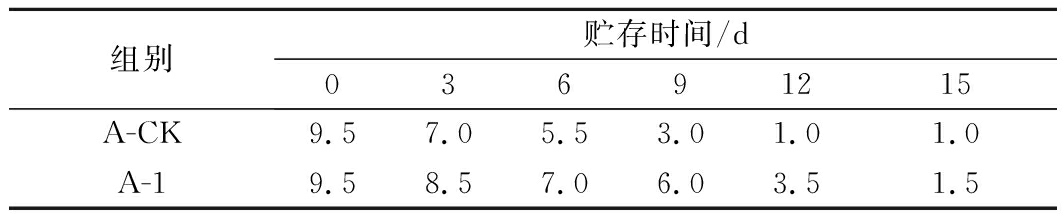
组别贮存时间/d03691215A-CK9.57.05.53.01.01.0A-19.58.57.06.03.51.5
注:6.0分为冷却肉货架销售期限终点[21]
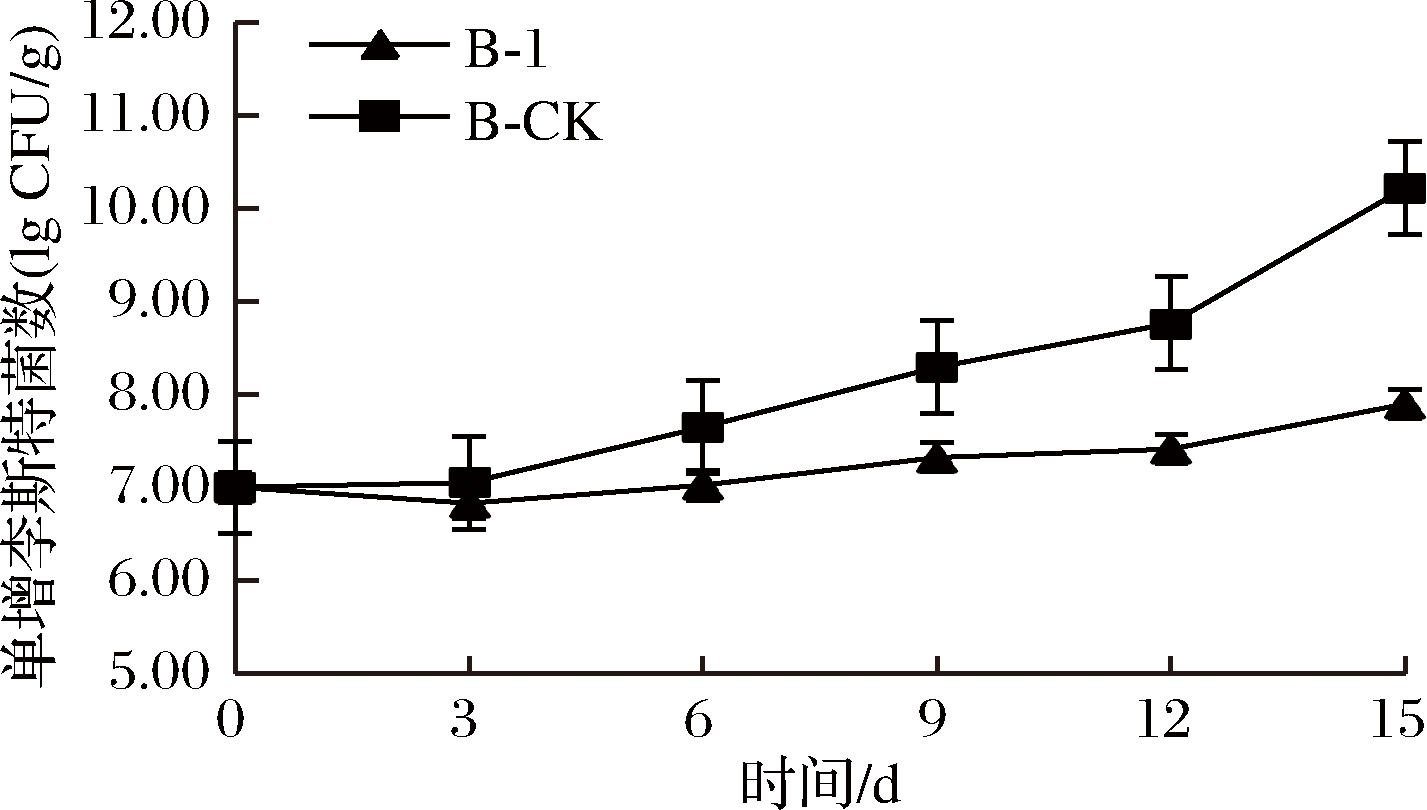
2.4 戊糖片球菌Pe-B1发酵上清液对冰鲜鸡肉细菌总数的控制
相同培养条件下,2组的菌落总数随着储藏时间的延长均呈现上升趋势(图2),但对照组A-CK比实验组A-1上升速度快,根据国家卫生标准规定,冷鲜肉的菌落总数应控制在≤5.0 lgCFU/g才可以安全食用[22]。实验发现对照组A-CK在第6天时细菌数已达到5.7 lg CFU/g,说明对照组的货架期不超过6 d。而实验A-1到第9天时细菌总数5.0 lg CFU/g,刚好在国家卫生标准规定指标范围内,说明实验组的货架期可达到9 d,由此可见, 具抗菌活性乳酸菌的上清液可以抑制杂菌的生长,冷鲜鸡肉的货架期延长了3 d。
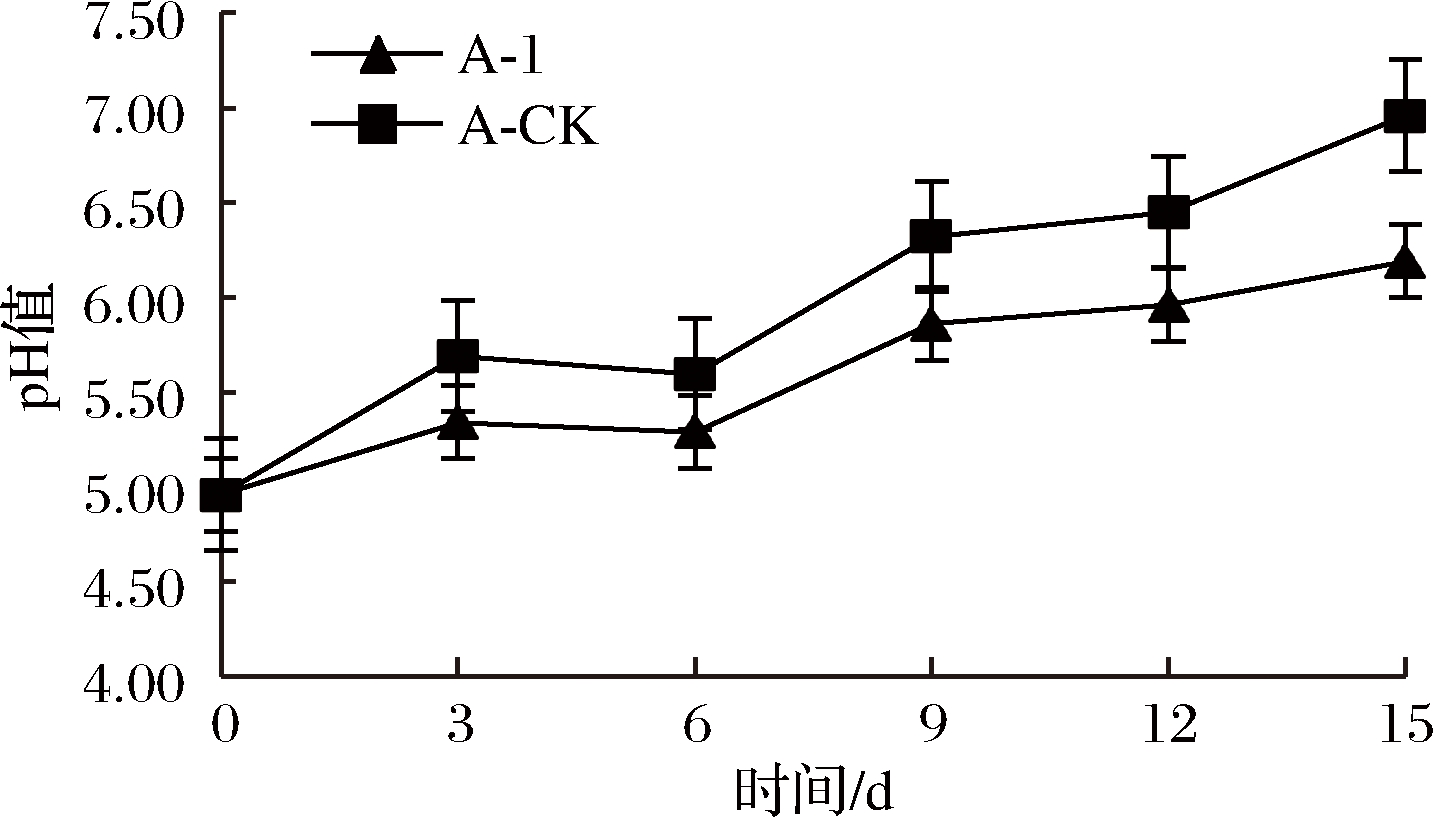
2.5 戊糖片球菌Pe-B发酵上清液对冰鲜鸡肉pH值的影响
由于微生物的生长繁殖会使鸡肉中的蛋白质分解,导致pH上升,引起食品腐败变质。参照GB 2707—2016,冰鲜鸡肉产品的pH值应该≤6.7 (其中,一级鲜度pH 5.8~6.3, 二级鲜度pH 6.3~6.7, 腐败变质肉pH>6.7)[25]。由图3可知,实验组A-1和对照组A-CK在贮存的第0~3天pH值先上升,3~6 d pH值又下降,这是因为屠宰后,动物体内的糖类物质会分解为乳酸等物质,实验组A-1与对照组A-CK相比,在此时期pH值变化幅度低,冷鲜鸡肉的蛋白质分解比较少,鸡肉还比较新鲜。6 d后,鸡肉中的腐败微生物大量增殖,通过代谢产生的分子胺类物质、硫化物等成分以及乳酸被消化分解导致肉样pH值升高,但A-CK组较A-1组上升速度较快。A-CK组在第9天超出一级鲜肉pH值的范围,此时A-CK组较快出现肉的蛋白质大量分解,有异味,鸡肉开始腐败变质的现象,在第13天肉样pH值超过6.7,为变质肉;而A-1组在第15天的pH 6.2,仍在一级鲜肉pH 5.8~6.3,说明菌株上清液能延缓蛋白质的分解,延长冷鲜鸡肉的保藏期。
2.6 戊糖片球菌Pe-B发酵上清液对冷鲜鸡肉挥发性盐基氮形成的控制
酶和微生物的作用使蛋白质分解而产生氨及胺类等具有挥发性的含氮物质,该类物质可以与腐败过程中分解产生的有机酸结合形成TVB-N,并且其含量随着腐败的进程而增加。因此,测定TVB-N含量成为动物性食品腐败变质重要的指标之一[29]。本文参考DENG等[30]对水煮鸡肉货架期的评价方法,并依据《中华人民共和国卫生部食品检查方法理化部分》规定的肉及肉制品中TVB-N的标准:一级鲜肉≤15 mg/100g;二级鲜肉≤20 mg/100g;变质肉>20 mg/100g进行货架期的评判。由图4可知,对照组A-CK的曲线上升速度较快,在第8天开始变质,在第9天时,对照组A-CK的TVB-N值为17.82 mg/100g,超出一级的鲜度范围,而实验组 A-1的TVB-N为10.74 mg/100g,仍在国标一级鲜度范围内;对照组约在第11天超出国标二级鲜度,此时肉质为腐败变质肉,而实验组A-CK在第14天才超出国标二级鲜度范围,说明乳酸菌上清液可降低挥发性盐基氮的生成速率,对延长冷鲜鸡肉货架期具有一定的效果。
2.7 戊糖片球菌Pe-B发酵上清液对冷鲜鸡肉中单增李斯特菌的抑制效果
单增李斯特菌的耐低温特性是导致冷鲜食品安全的一个潜在危害因子,由图5可知,对照组B-CK冷鲜鸡肉的单增李斯特氏菌菌落总数变化,先呈缓慢上升趋势,后迅速上升,而实验组B-1先下降后缓慢上升,从上升趋势来看,实验组的上升速度明显比对照组缓慢,在0~3 d时是下降的,抑菌效果明显,3~9 d呈上升趋势,但与对照组相比增长缓慢,9~12 d的增长速度比之前小,超过12 d后单增李斯特菌会快速增加,不适宜再继续储藏。说明乳酸菌上清液能有效抑制嗜冷菌单核细胞增生李斯特氏菌的生长繁殖,对冷鲜鸡肉耐低温病原菌的危害具有一定的控制效果。
3 结论
本研究从海洋华贵栉孔扇贝中分离筛选到17株具有溶钙圈的分离株,经过革兰氏染色、过氧化氢实验确定5株为乳酸菌,分别是Pe-B1、Lp-B5、Es-B7、El-B16、El-B22。双层牛津杯抑菌试验结果表明,菌株Pe-B1的抑菌谱广、抑菌强度最大,不仅能抑制金黄色葡萄球菌、单增李斯特菌和枯草杆菌等革兰氏阳性菌的生长繁殖,还能抑制大肠埃希氏菌和副溶血性弧菌等革兰氏阴性菌的生长繁殖。由16S rRNA鉴定结果可知,菌株Pe-B1与Pediococcus pentosaceus DSM的相似度为99.51%,构建系统发育树发现处于同一分支,确定为戊糖片球菌。防腐实验中,冷鲜鸡肉中涂抹发酵上清液能显著降低菌落总数、延缓pH上升、延长感官品质时间、降低氨氮浓度。综合各指标能延长冷鲜鸡肉的货架期3 d,具有很好的应用前景。由于单增李斯特菌是嗜冷致病菌,在4 ℃条件下能生长繁殖,所以在冷鲜鸡肉中存在安全隐患,在人工复染单增李斯特菌组中,但涂抹Pe-B1发酵上清液能显著抑制单增李斯特菌的生长,表明Pe-B1上清液对冷鲜鸡肉中单增李斯特菌有很好的抑制作用,为今后开发冷鲜鸡肉贮藏运输的生物防腐剂提供支持,但Pe-B1上清液中的抑菌成分及分子质量大小和作用方式还有待进一步研究。
参考文献
[1] 陈锡文. 中国食品安全战略研究[M]. 北京:化学工业出版社, 2004.
[2] AN J Y,ZHU W J,LIU Y et al. Purification and characterization of a novel bacteriocin CAMT2 produced by Bacillus amyloliquefaciens isolated from marine fish Epinephelus areolatus[J]. Food Control, 2015, 51:278-282.
[3] GHANBARI M, JAMI M, KNEIFEL W, et al. Antimicrobial activity and partial characterization of bacteriocins produced by lactobacilli isolated from Sturgeon fish[J]. Food Control, 2013, 32(2):379-385.
[4] WIDYASTUTI Y,TUSSOLIHAT R,FEBRISANTOSA A. The role of lactic acid bacteria in milk fermentation[J]. Food and Nutrition Sciences, 2014, 5(4): 435-442.
[5] LEE H I, KIM M H, KIM K Y, et al. Screening and selection of stress resistant Lactobacillus spp. isolated from the marine oyster (Crassostrea gigas)[J]. Anaerobe, 2010, 16(5):522-526.
[6] 焦冬冬, 任文彬, 赵鸭美, 等. 南海海域动物肠道中抗菌活性乳酸菌的分离及多样性分析[J]. 食品科学, 2017, 38(8):74-79.
[7] FLORIE D,DIANE D, NATHALIE B, et al. Bacteriocin as weapons in the marine animal-associated bacteria warfare: Inventory and potential applications as an aquaculture probiotic[J]. Marine Drugs, 2010, 8(4):1 153-1 177.
[8] ZHANG Y, YANG J M, LIU Y, et al. A novel bacteriocin PE-ZYB1 produced by Pediococcus pentosaceus zy-B isolated from intestine of Mimachlamys nobilis: Purification, identification and its anti-listerial action[J]. LWT-Food Science and Technology, 2020,118:108 760.
[9] BUNTIN N,CHANTHACCHUM S,HONGPATTARAKERE T. Screening of lactic acid bacteria from gastrointestinal tracts of marine fish for their potential use as probiotics[J]. Songklanakarin Journal of Science & Technology, 2008, 30(Suppl 1):141-148.
[10] 叶藻, 谢晶, 高磊. 工厂实测冷鲜鸡冷却贮藏过程品质的变化[J]. 食品工业科技, 2015, 36(19):332-335.
[11] 陈 鹏, 程镜蓉, 陈之瑶, 等. 黄羽肉鸡冷鲜储存过程中品质变化研究[J]. 现代食品科技, 2016,32(3):140-146.
[12] GREIKA F M,CLEISE D O S, EDUARDO E D S F, et al. Listeria monocytogenes in chicken meat[J]. Journal of Food and Nutrition Research, 2016,4(7): 436-441.
[13] AMEZQUITA A,BRASHEARS M M. Competitive inhibition of Listeria monocytogenes in ready-to-eat meat products by lactic acid bacteria[J]. Journal of Food Protection,2002,65(2): 316-325.
[14] DICKS L M T, MELLETT F D,HOFFMAN L C. Use of bacteriocin-producing starter cultures of Lactobacillus plantarum and Lactobacillus curvatus in production of ostrich meat salami[J]. Meat Science, 2004, 66(3):703-708.
[15] 陈 卫. 乳酸菌科学与技术[M]. 北京:科学出版社, 2018.
[16] 凌代文. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 1-129.
[17] 周小蓓. 食品微生物检验中菌种管理和保藏[J]. 商品与质量, 2017(36):176.
[18] 董韩博, 谢晶, 钱韻芳, 等. 带鱼肠道中抑菌性乳酸菌的筛选和抑菌效应分析[J]. 食品与发酵工业, 2016, 42(12):32-37.
[19] 杜琨. 乳酸菌肽对冷却猪肉感官质量的影响[J]. 贵州农业科学, 2017, 45(12):133-135.
[20] 张国强. 产类细菌素乳酸菌的分离、筛选与鉴定及发酵条件研究[D]. 杨凌:西北农林科技大学, 2008.
[21] 鲁 伟. 冰鲜黄鸡肉品质评定与鲜度分级研究[D]. 扬州:扬州大学, 2017.
[22] GB 4789.2—2016食品安全国家标准食品微生物学检验菌落总数测定[S].北京:中国标准出版社,2016.
[23] GB 2707——2016 食品安全国家标准鲜(冻)畜、禽产品[S].北京:中国标准出版社,2016.
[24] GB 5009.237—2016 食品安全国家标准食品pH值的测定[S].北京:中国标准出版社,2016.
[25] 许益民. 肉和肉制品pH测定的国际标准方法[J]. 中国动物保健, 2000(5):27.
[26] 张坤, 彭科怀, 杜洪凤. 分光光度法测定肉与肉制品中挥发性盐基氮[J]. 预防医学情报志, 2009, 25(1): 78-80.
[27] GB 4789.30—2016 食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验[S].北京:中国标准出版社,2016.
[28] KARAM L, ROUSTOM R, ABIAD M G. et al. Combined effects of thymol, carvacrol and packaging on the shelf-life of marinated chicken[J]. International Journal of Food Microbiology, 2018, 291:42-47.
[29] 谢主兰, 陈龙, 雷晓凌, 等. 采用挥发性盐基氮动力学模型预测低盐虾酱的货架寿命[J].现代食品科技, 2013,29(1):29-33; 95.
[30] DENG S, LI M,WANG H. et al. Enhancement of the edible quality and shelf life of soft-boiled chicken using MAP[J]. Food Science & Nutrition,2020,8(3):1 596-1 602.