三七为中国特有的名贵中药材,又称“田七”、“金不换”,主要产于云南省文山州。三七除含有三七皂甙外,还有挥发油、氨基酸等多种活性成分,三七对于心血管和脑血管系统具有生理活性作用,还可抑制肿瘤细胞的生长,增强免疫系统和神经系统,并具有抗炎和抗衰老的特性[1-5]。三七全株中皂苷含量最高,但皂苷种类与根茎部位有所差异,研究发现三七花降血压,降血脂的功效优于三七主根[6]。如今,我国有500多家制药、保健和化妆品公司使用三七作为原料,三七产业发展具有巨大的市场前景,但目前国内三七系列产品多以三七根为原料加工而成,三七花通常作为花茶进行泡饮或作为菜肴烹饪食用,其利用率和经济附加值都很低,对三七花的深入开发是三七产业发展的必然趋势。
对于中草药产品的开发,安全高效是成分提取的重要前提。常见的提取方法中回流、煮沸、渗滤等方式通常需要大量的溶剂和时间,成本较高,存在提取效率低、环境污染等问题[7]。另外,以上传统提取方法会导致皂苷水解,导致提取物的生物活性降低[8]。近年来,各种新的提取方法应用于中药功效成分的提取,如双水相萃取,离子液提取,超高压提取等[9-18],但这些方法设备成本高,容易造成环境污染,技术难以推广。目前,提取的最新趋势技术主要集中在寻找尽量减少污染,降低提取溶剂消耗和能量要求。近来,应用表面活性剂取代传统的有机溶剂进行天然产物提取分离成为研究新方向[19],由于它本身具有两亲性,使得它可以同时提取极性范围跨度很大的目标化合物[20]。VIEIRA等[21]利用非表面活性剂从微藻中提取了类胡萝卜素,马祥等[22]采用超声-表面活性剂协同的方法提取竹叶中的总黄酮,提取效果更好。采用表面活性剂提取与其他方法相比具有提取条件温和、更环保、安全性高、成本低等优点,可产业化生产[23]。
采用传统方法对三七花皂苷的提取已有大量研究,然而,兼顾绿色环保、高效的提取方法研究较少,表面活性剂作为溶剂已经被证明具有良好的萃取效率,但要进一步提高提取效率,还需要开发一种联合萃取方法。纤维素酶和果胶酶等在破坏细胞壁、提高生物活性成分的提取和进一步缩短提取时间方面表现出一定优越性;超声辅助萃取通过提供超声波,产生空化气泡,对细胞结构进行机械损伤,在实验室和放大实验中均证明了其较高的萃取效率[17-18]。结合这些提取技术的优点,本研究建立了一种新的酶法-超声辅助表面活性剂提取方法,考察其对三七总皂苷的提取效率,并与热回流提取法和超声辅助提取法传统进行比较。
1 材料与方法
1.1 材料与试剂
三七花,产于云南文山;标准品人参皂苷Re、Rg1、Rc、Rb1、Rb2、Rb3、Rd、F2,三七皂苷R1、Fc、Fe,北京中科益友化工研究院;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度>98%)、Triton X-100、Fe-三吡啶三吖嗪(TPTZ)、纤维素酶、果胶酶等,上海Aladdin公司,均为分析纯;puc19 DNA质粒,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
KQ-600E超声波清洗器,昆山市超声仪器有限公司;Gemini SEM300热场发射扫描电子显微镜,德国Carl Zeiss公司;DYCZ-24DN电泳仪,浙江纳德科学仪器有限公司;凝胶成像分析系统,北京布拉德科技发展有限公司;酶标仪,瑞士TECAN公司。
1.3 三七花皂苷的提取
将三年生的新鲜三七花通过冷冻干燥机干燥后,用粉碎机碾碎,通过40目筛。三七花粉末被收集在一个棕色的瓶子里,储存在-20 ℃的冰箱里以供进一步分析。对干燥三七花粉进行了不同提取条件的研究。
1.3.1 加热回流提取(heat reflux extraction,HRE)
称取1.00 g三七花粉,加入含有30 mL体积分数为70%的乙醇的圆底烧瓶中,将三七花粉与乙醇均匀混合,然后置于水浴锅中,与冷水连接,在70 ℃下回流加热1.5 h。
1.3.2 超声辅助提取(ultrasound-assisted extraction,UAE)
将1.00 g三七花粉放入锥形瓶中,加入30 mL 70%(体积分数)的乙醇,旋涡搅拌后,在60 ℃温度,超声功率465 W的超声波清洗器中提取40 min。
1.3.3 酶解超声辅助表面活性剂提取(enzymolysis-ultrasound-assisted surfactant extraction,EUASE)
将三七花粉(1.00 g)与30 mL Triton X-100溶液(0.24 mmol/L)和0.2%复合酶[m(纤维素酶)∶m(果胶酶)=4∶6]在50 mL PFTE容器中混合均匀,将容器盖上,在60 ℃下恒温水浴酶解孵育1.5 h,然后将反应化合物置于超声波清洗器中以465 W超声处理40 min。
1.4 三七总皂苷含量测定方法
采用香草醛-高氯酸比色法测定三七总皂苷(Panax notoginseng saponins,PNS)含量[15],以三七皂苷R1为对照,线性回归方程为:y=2.428 3x-0.002 4,R2=0.999 7,其中y为吸光值,x为皂苷含量(mg),根据回归方程可计算得到PNS含量,按公式(1)计算PNS得率:
PNS得率![]()
(1)
1.5 实验设计
1.5.1 单因素实验
在单因素实验之前,进行了预实验以选择最佳溶剂和提取方法,在预实验中测试不同溶剂(水、乙醇、十二烷基苯磺酸钠、十二烷基硫酸钠、曲拉通X-100、吐温 20)和提取方法(水浴、超声波、酶解超声波)中,溶剂曲拉通X-100和酶解超声法提取三七花皂苷得率最高[24]。通过单因素试验确定各因素的最佳条件。分别设定复合酶添加量(0.04%~0.24%,质量分数)、酶解pH(2~7)、酶解温度(20~70 ℃)、酶孵育时间(0.5~3 h)、液固比(10∶1~60∶1)、超声功率(300~600 W)、超声时间(10~60 min)和超声温度(30~80 ℃)在不同条件下提取。对每个因素进行了6个层次的测试,每次改变1个因素水平,其他因素保持不变。
1.5.2 响应面优化三七花总皂苷提取条件
通过对单因素实验结果进行多重比较分析,选择有显著影响的3个因素(超声时间、酶解温度、超声功率)进行Box-Behnken (BBD)设计,自变量分别为X1(超声时间), X2(酶解温度), X3(超声功率),以PNS提取率为实验的响应值Y,通过试验进行分析。对实验数据进行回归分析并拟合到二阶多项式模型,如公式(2)所示。为了推导出二次方程,使用BBD设计了17个阶乘点和5个中心点的重复,统计分析BBD中的数据,建立数学模型,估计独立变量的响应,验证响应实验的有效性。
(2)
式中:Y为响应因变量(PNS提取率),A0是回归常数;Ai是第i次线性系数;Aii是第i次二次项系数;Aij是第i次交互项系数(i≠j);n是实验中研究和优化的因子数量,Xi和Xj是编码的独立变量[13,25]。
1.6 抗氧化测定
1.6.1 PNS对DPPH自由基清除能力测定
将EUASE优化条件下提取得到的PNS提取液稀释成不同浓度,参考HUANG等[26]方法,并做少量修改,测定PNS对DPPH自由基的活性清除能力。准确吸取各浓度提取液100 μL转移至96孔板,然后将190 μL DPPH溶液(0.1 mmol/L)添加到各样品中,在黑暗中反应0.5 h,测定515 nm处吸光值,甲醇作为空白对照,结果表达为毫克 Trolox 当量每克干物质(mg TE/g DW)。
1.6.2 铁离子还原/抗氧化能力(Ferric ion reducting/antioxidant power,FRAP)实验测定PNS抗氧化能力
参考HUANG等[26]方法进行适当修改。按照体积比例10份醋酸缓冲液(0.1 mol/L),1份TPTZ(10 mmol/L),1份FeCl3(20 mmol/L)混合配制FRAP试剂。取样品提取液100 μL,加入FRAP 190 μL,混合均匀,置于37 ℃水浴锅中10 min,然后于593 nm下进行吸光度测定,以甲醇为空白对照。结果表达为毫克 Trolox 当量(TE)每克干物质(mg TE/g DW)。
1.6.3 PNS对质粒DNA氧化损伤的保护作用
通过加入不同浓度样品溶液,研究其对DNA氧化损伤变化影响。分别移取 pUC18质粒DNA 1 μL,PNS提取液4 μL,Fenton氧化剂(100 μmol/L的FeSO4、1 mmol/L的H2O2和104 μmol/L的EDTA)8 μL,用PBS补体积均为20 μL于2.0 mL离心管中。离心振荡后置于37 ℃水浴锅中60 min,加入 2.0 μL 10×Loading buffer染色,混匀,经琼脂凝胶电泳分离25 min,使用凝胶成像分析系统照相观察[27]。
1.7 HPLC测定皂苷组分
用高效液相色谱(Waters e2695)配合2998 PDA检测器测定三七花中皂苷组分,检测波长为203 nm。将EUASE皂苷提取液用0.22 μm滤膜进行过滤,用Agilent C18柱(4.6 mm×250 mm, 5 mm)分离,流动相溶剂A(乙腈)和溶剂B(0.5%磷酸)梯度洗脱:0~5 min,25%A;5~20 min,30%A;20~30 min,35%A;30~70 min,45%A;70~80 min,35%A;80~90 min,25%A。注入10 μL样品体积,在柱温40 ℃,流速 0.3 mL/min条件下洗脱分离。
1.8 扫描电子显微镜观察
采用扫描电子显微镜(scanning electron microscope,SEM)对提取处理前后的三七花样品进行观察。分别称取1 g干燥三七花粉末,进行HRE、UAE、EUASE提取,然后过滤提取液,收集滤渣置于玻璃培养皿内,在60 ℃热风干燥箱中干燥1 h。用导电胶将各处理后的样品粘在样品台上并喷金,在电压为5.00 kV,高真空条件下,使用SEM进行观察。
1.9 数据分析与图形绘制
所有实验均进行了3次平行,结果以均值±标准差表示;BBD设计采用Design Expert (Version 10.0)软件;统计学处理采用SPSS 17.0软件,组间差异采用ANOVA进行Duncan差异分析,差异的显著性被定义在5%的水平(P<0.05);实验结果图用Origin 8.0绘制。
2 结果与分析
2.1 单因素实验多重比较分析
为优化提取工艺条件,对各单因素的最佳提取率水平进行多重比较分析,找到显著影响PNS提取率的因素,为BBD设计提供判断依据,多重比较结果如表1所示。
表1 不同因素对PNS提取率影响的多重比较
Table 1 Multiple comparisons of the effects of
different factors on the yield of PNS
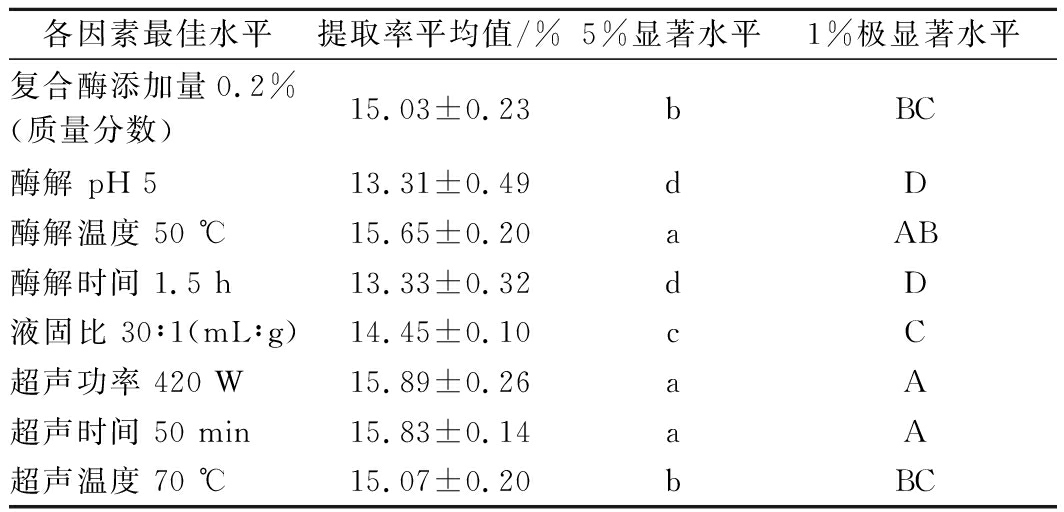
各因素最佳水平提取率平均值/%5%显著水平1%极显著水平复合酶添加量0.2%(质量分数)15.03±0.23bBC酶解 pH 513.31±0.49dD酶解温度 50 ℃15.65±0.20aAB酶解时间 1.5 h13.33±0.32dD液固比 30∶1(mL∶g)14.45±0.10cC超声功率 420 W15.89±0.26aA超声时间 50 min15.83±0.14aA超声温度 70 ℃15.07±0.20bBC
注:不同字母表示具有显著性差异(P<0.05)
通过对各单因素的多重比较分析,不同因素中超声时间、酶解温度和超声功率提取PNS的得率较其他因素较高,与其他因素提取结果相比,具有显著性差异(P<0.05),其余因素对PNS提取率影响不显著,故实验选择超声时间、酶解温度、超声功率为主要影响因素,进行响应面优化实验。
2.2 单因素实验分析
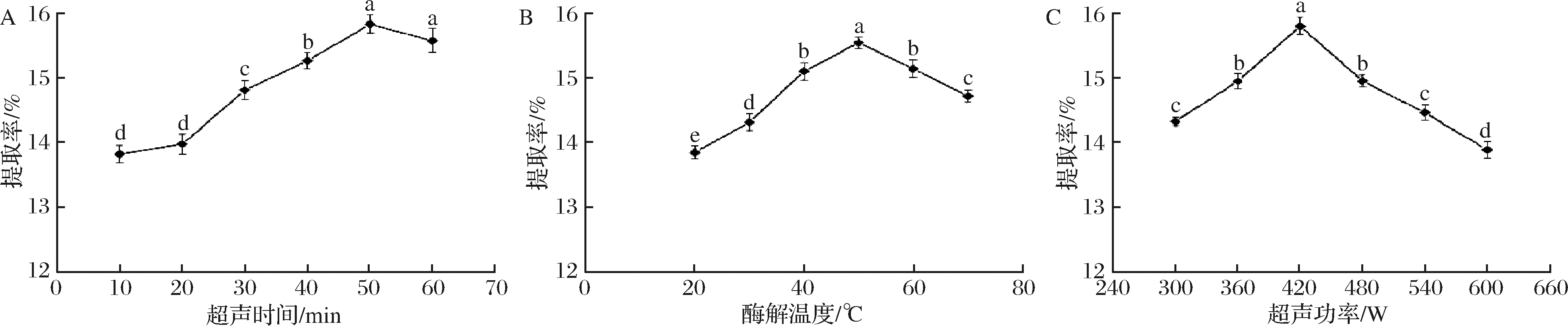
2.2.1 超声时间对PNS提取率的影响
超声时间在10~60 min与PNS提取率的关系如图1-A所示。当超声开始时,PNS提取率相对较低,但是20 min后,PNS的提取率显著提高,并在50 min时提取率最高,这是由于在超声过程中,在声波振动影响下,介质细胞受到不同程度破坏,此外机械能转变为热能,使得介质温度提高,加速分子运动,从而促进有效成分的溶解[11]。可见,需要达到一定超声时间对物料才可产生明显的空化效应和机械效应,从而提高PNS的提取率。当超声时间大于50 min,PNS的提取率减少,这可能是强烈的机械效应会破坏皂苷化合物的苷元结构,使得溶出的PNS产物部分被分解,从而提取率导致下降,这种现象在其他成分提取也有类似影响[25]。
2.2.2 酶解温度对PNS提取率的影响
由于酶属于生物活性物质,酶溶液反应温度严重影响酶的活性和构象。酶解温度在20~50 ℃范围内与PNS提取率的关系如图1-B所示。在50 ℃以下时,随温度增加PNS的提取率升高明显,提取率最高达15.65%,这一现象的原因是酶需要在最适的温度下激发其活性,植物组织才能得到有效分解,有效成分也因此能更好溶出。当温度超过50 ℃,PNS的提取率出现下降,这是由于超过一定温度总是会导致酶活性降低。
2.2.3 超声功率对PNS提取率的影响
由于空化效应,超声功率在萃取过程中发挥了重要作用。超声功率在300~600 W范围内与提取率的关系如图1-C所示。当超声功率为420 W时,PNS提取率最高,达到15.89%,功率继续增加反而降低了PNS的提取率。通过超声波的功率可控制频率与强度,改变空穴强度,达到提高提取率的目的。需引起注意的是,超声频率过高相反引起提取率下降,这主要是超声波产生的辐射压细胞组织变形,植物蛋白质变性,对有效成分结构破坏或分解[25]。
2.3 Box-Behnken设计优化变量
2.3.1 模型建立与统计分析
利用软件Design Expert (Version 10.0)进行实验设计和数据分析。研究了3个随机因子(超声时间、酶解温度、超声功率)对响应值(PNS提取率)的影响,BBD实验设计及PNS提取率见表2,通过多元回归分析,得到PNS提取率的多元二次回归响应面模型如下:
A-超声时间;B-酶解温度;C-超声功率
图1 单因素对PNS提取率的影响
Fig.1 Effect of single factor on the yield from PNS
注:不同字母表示具有显著性差异(P<0.05)
表2 Box-Behnken实验设计及响应值结果
Table 2 Results of Box-Behnken design tests
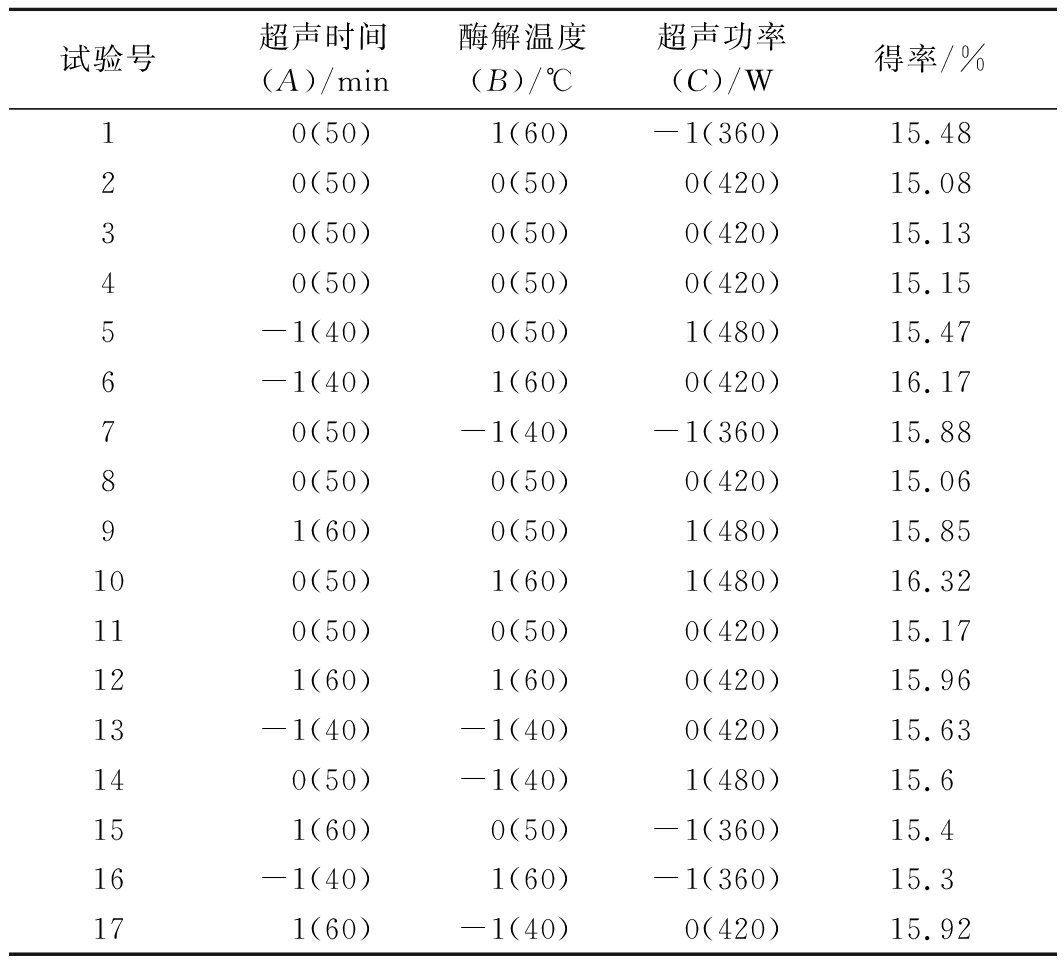
试验号 超声时间 (A)/min 酶解温度 (B)/℃ 超声功率 (C)/W得率/%10(50)1(60)-1(360)15.4820(50)0(50)0(420)15.0830(50)0(50)0(420)15.1340(50)0(50)0(420)15.155-1(40)0(50)1(480)15.476-1(40)1(60)0(420)16.1770(50)-1(40)-1(360)15.8880(50)0(50)0(420)15.0691(60)0(50)1(480)15.85100(50)1(60)1(480)16.32110(50)0(50)0(420)15.17121(60)1(60)0(420)15.9613-1(40)-1(40)0(420)15.63140(50)-1(40)1(480)15.6151(60)0(50)-1(360)15.416-1(40)1(60)-1(360)15.3171(60)-1(40)0(420)15.92
通过F统计量、响应面的二次多项式模型的方差分析(ANOVA)检验了回归模型的显著性,表3给出了各模型项的回归系数值。BBD模型表现为极显著(P<0.000 1),F统计量为51.49,表明该模型极显著,具有统计学意义;失拟项0.092不显著,说明该模型拟合程度理想,可用于PNS皂苷优化提取。模型中得到的确定系数R2为0.985 1,表明98.51%的变化可以用拟合模型解释,调整后的确定系数![]() 为0.966 0,说明模型拟合度高,实验值与预测值非常接近,较低的变异系数(C.V.=0.47%)表明实验值的准确性和可靠性较高。
为0.966 0,说明模型拟合度高,实验值与预测值非常接近,较低的变异系数(C.V.=0.47%)表明实验值的准确性和可靠性较高。
由表3可看出,回归方程的一次项中,超声功率(X3,P<0.01)对PNS提取率差异极显著,酶解温度(X2)和超声时间(X1)对PNS提取率影响为显著,各因素的对PNS提取率影响排序为:超声功率>酶解温度>超声时间。可见,超声波作用的强弱对PNS提取率影响最大。超声波作用下化合物的降解机理包括异构化、水解反应和热效应,也可以认为超声波功率的增加会产生较多较大的气泡,会影响超声波在介质中的传播[27]。在二次项中,![]() 和
和![]() 对PNS提取率表现出极显著的影响
对PNS提取率表现出极显著的影响![]() 对PNS提取率有显著的线性影响(P<0.05)。
对PNS提取率有显著的线性影响(P<0.05)。
表3 回归方差分析表
Table 3 Analysis of variance of the regression model
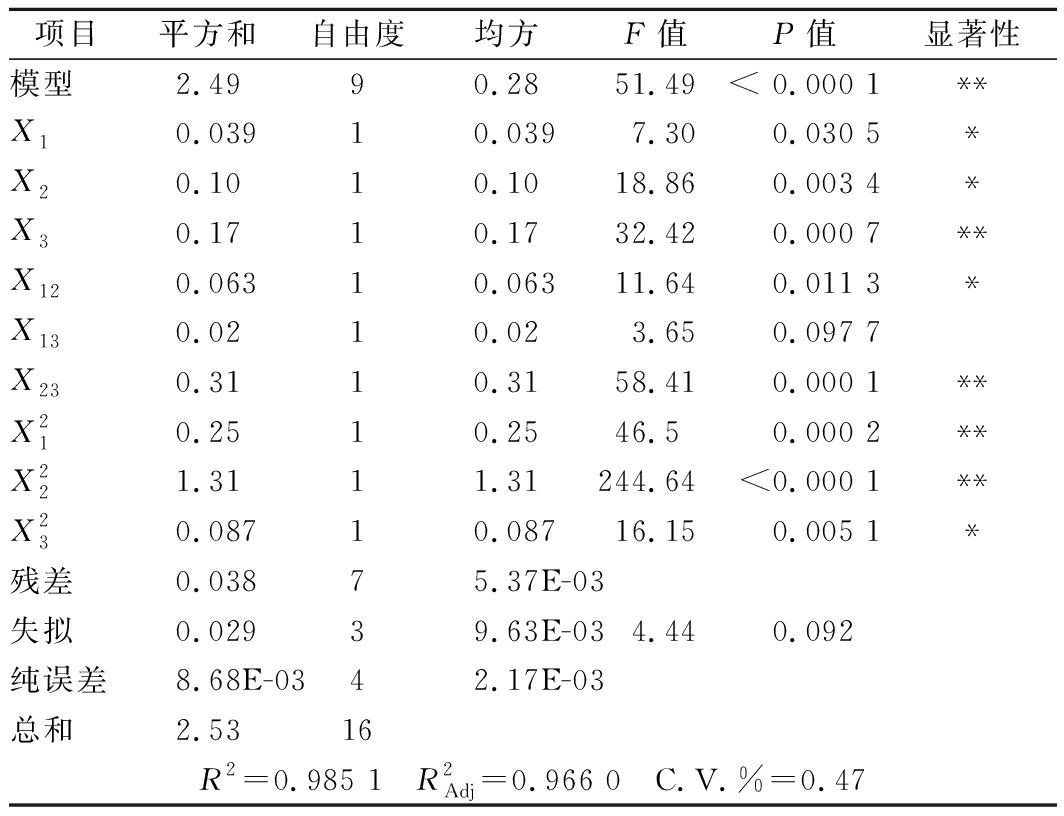
项目平方和自由度均方F值P值显著性模型2.4990.2851.49< 0.000 1**X10.03910.0397.300.030 5*X20.1010.1018.860.003 4*X30.1710.1732.420.000 7**X120.06310.06311.640.011 3*X130.0210.023.650.097 7X230.3110.3158.410.000 1**X210.2510.2546.50.000 2**X221.3111.31244.64<0.000 1**X230.08710.08716.150.005 1*残差0.03875.37E-03失拟0.02939.63E-034.440.092纯误差8.68E-0342.17E-03总和2.5316R2=0.985 1 R2Adj=0.966 0 C.V.%=0.47
注: “*”表示显著(P<0.05),“**” 表示极显著(P<0.01)
2.3.2 响应面交互影响
通过绘制三维响应面图及等高图,可以直观的反映各因素与PNS提取率的相互影响关系。由图2-A可看出,与酶解温度方向比较,超声功率曲线更陡峭。当酶解温度大于55 ℃时,等高线密度非常密集(图2-B),表明酶解温度和超声功率(X23)存在显著交互作用。在图2-C和图2-D中,酶解温度和超声时间的响应曲面较陡,等高线趋向椭圆形,说明此时超声时间和酶解温度之间的交互作用对PNS提取率的有较大影响。适宜的酶解温度对于溶剂能更深入进入组织内部,一定的超声时间为原料产生疏松结构形成重要影响,二者之间对提取率有显著的影响关系。这种相互影响关系在苹果皮多酚、苦瓜多糖等活性物质提取的超声波酶法提取中也有相同结论[11-13]。由图2-E和图2-F可看出,响应曲面较平缓,等高线密度均匀,无密集情况出现,表明超声功率与超声时间的交互作用不显著。
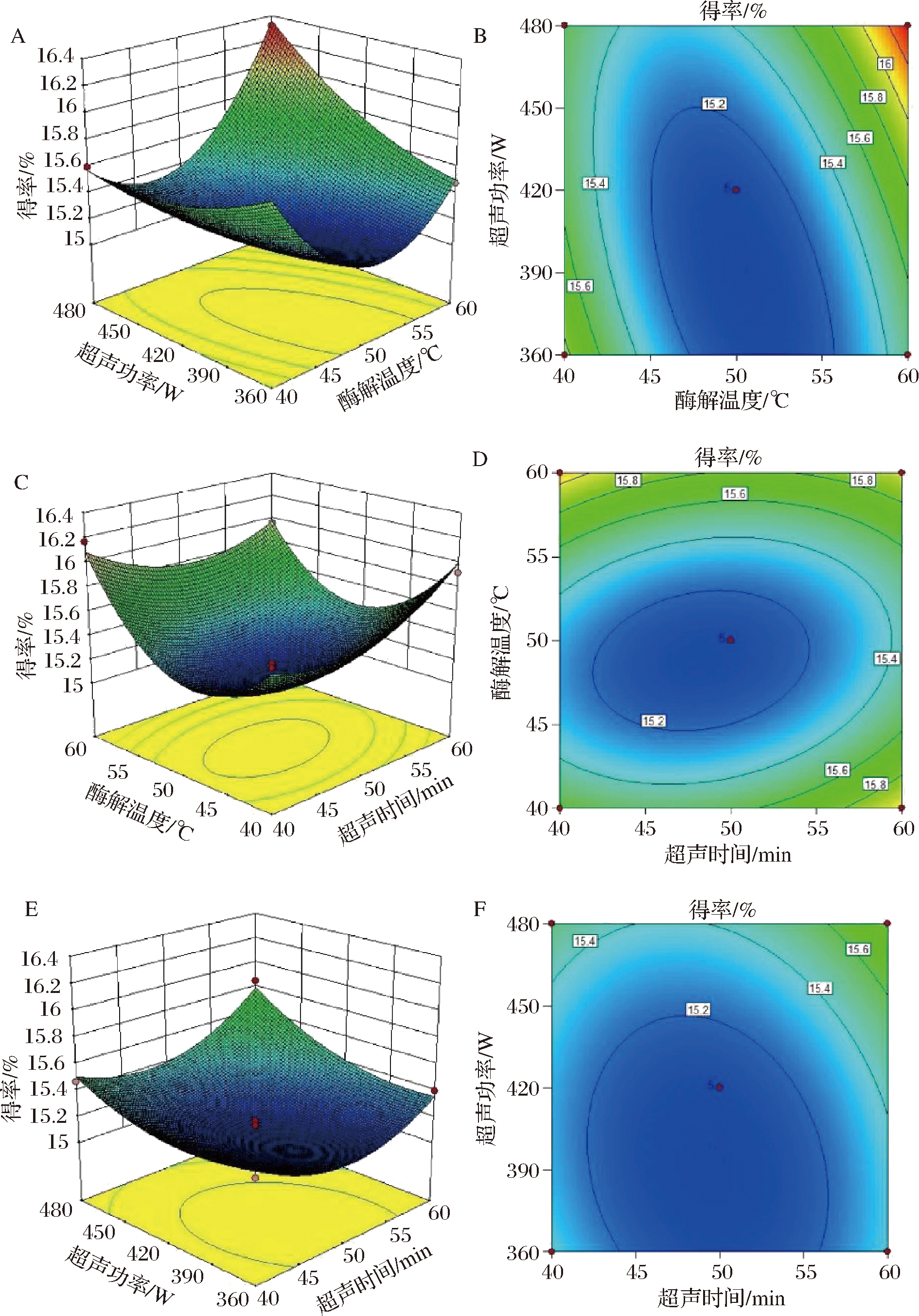
图2 各因素交互作用的响应面和等高线图
Fig.2 Response surface and contour diagram
of the interaction of various factors
2.3.3 模型结果验证
以Box-Behnken Design(BBD)模型为基础,结合各因素的线性、二次项和交互作用的显著性,确定了EUASE最佳提取条件为:酶解温度59.91 ℃,超声时间40.21 min,超声功率464.69 W,通过模型方程预测PNS的最大响应值为16.41%。根据实际实验条件,将最佳条件修改为酶解温度60 ℃,超声时间40 min,超声功率465 W,在此条件下进行3次验证实验,PNS提取率平均可达(16.38±0.02)%,与预测值的符合度较高,证实了响应模型预测的适用性,该条件可用进一步用于从三七花中提取PNS。
2.4 EUASE和其他传统方法的比较
分别采用HRE、UAE和EUASE三种方法对三七花进行PNS提取,由图3可知,HRE提取效率最低,为(13.47±0.12)%,UAE提取效果优于HRE提取,达到(15.63±0.08)%,2种方法相同之处在于提取溶剂均为乙醇,但UAE得到更高的提取效率归因于超声产生的空穴效应,对原料细胞壁结构破坏,导致固液相的接触面积变大,有效成分更易溶出。以上结果中EUASE法得到最高的提取率,为(16.38±0.02)%,比HRE高约2.91%,比UAE提高了0.75%,原因是主要由于处于临界浓度的表面活性剂胶束更容易渗透进入细胞,具有更好溶解提取物的能力,可见,表面活性剂取代乙醇有机溶剂后,通过超声酶解辅助作用,提取物溶出量更多,提取率更高。
有研究报道采用发酵法辅助提取三七皂苷,利用微生物产生的酶破坏三七细胞壁结构,可使三七皂苷提取含量达到(12.25±0.21)%,比醇提含量(9.05±0.43)%提高了35.36%[28],提取率虽然有较大提高,但发酵时间需4 d,效率低。LIN等采用离子液体进行超声提取从人参根中提取人参皂苷[29]。在优化条件下总皂苷提取率达(17.81±0.47)mg/g;WANG等[15]采用微波辅助酶解法对人参茎叶总皂苷进行提取,最佳条件下提取含量为(60.62±0.85)mg/g。与现有的三七皂苷提取技术的提取率相比,EUASE法具有提取效率高,提取溶剂安全环保,成本低,可工业化推广等优势,结果表明,该方法简便、高效、低成本、环保,对其他植物有效成分的提取也有参考价值。
2.5 抗氧化活性
2.5.1 三七总皂苷对DPPH自由基清除效果的测定
酚羟基是三七皂苷类物质中主要活性基团,自由基能被酚羟基捕获生成稳定的半酮式结构,使得自由基链式反应终止[30]。采用DPPH法测定UAE、EUASE、HRE三种处理方式下及不同浓度PNS的体外抗氧化能力,如图3-A所示,各提取物浓度增加时PNS的抗氧化能力也随之增加,但不同方法提取得到的三七花提取液抗氧化活性显著不同,EUASE法得到的PNS表现出明显高于HRE和UAE的抗氧化能力,当PNS质量浓度增加到20 mg/mL时,EUASE法的样品DPPH自由基清除能力达高150.46 mg TE/g DW,而HRE法的样品抗氧化能力最低,其DPPH自由基清除能力为63.39 mg TE/g DW。这是由于酚羟基数目的多少影响三七皂苷抗氧化能力的差异,当三七花提取浓度增加,皂苷含量高,故具有较多的酚羟基基团提供氢离子,表现良好的清除自由基的作用。由以上结果可知,EUASE法的PNS提取率最高,抗氧化能力最强,HRE法中提取时间较长,也会带来对三七皂苷苷元结构的分解,导致酚羟基数目减少,表现出弱的抗氧化性[26,28]。
2.5.2 FRAP测定
FRAP抗氧化能力测定,即通过待测物质对铁还原能力,反映样品总抗氧化能力,抗氧化能力越强则吸光值越高。图3-B中不同方法提取的PNS样品抗氧化能力随浓度增加出现明显增加趋势,与传统提取方法(UAE、HRE)相比,以EUASE法提取物的抗氧化能力增加趋势更明显,最高达264.72 mg TE/g DW(20 mg/mL),在相同浓度条件下,3种提取方法PNS提取物的抗氧化能力依次为EUASE>UAE>HRE,故EUASE提取的PNS总抗氧化能力高于相同条件下USE和HRE法提取的PNS。
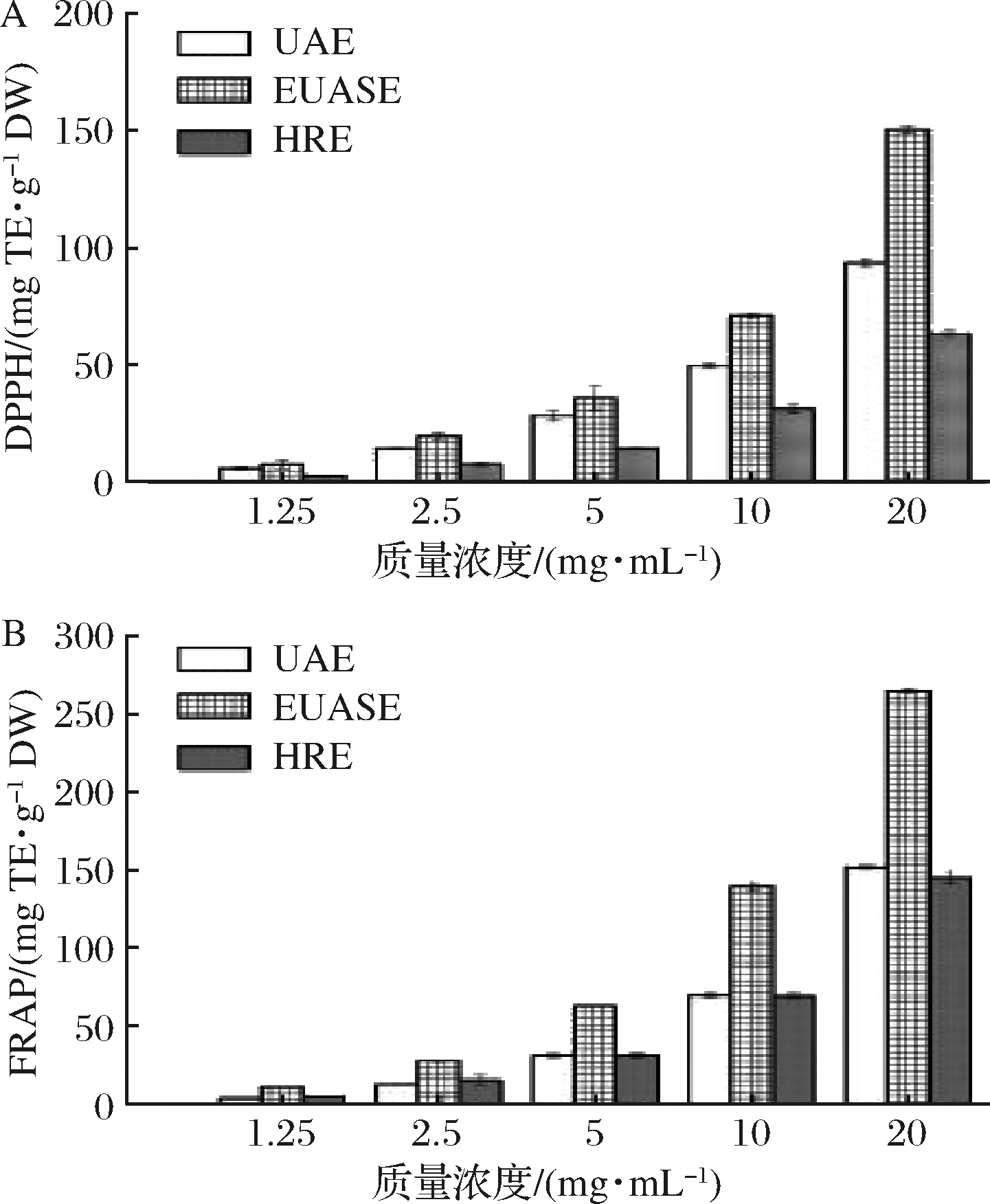
A-DPPH自由基清除力;B-FRAP测定
图3 不同质量浓度PNS的抗氧化活性
Fig.3 Antioxidant activity of the extracts of PNS at
different concentrations
2.5.3 三七总皂苷对质粒 DNA 氧化损伤的防护作用
生物体衰老和许多疾病的产生据研究表明均与活性氧的参与有密切关系[31],研究表明PNS能够有效清除·OH及![]() 通过清除捕捉自由基,·OH的氧化作用被螯合体系中Fe2+、Cu2+等元素阻断,DNA被·OH氧化损伤的作用能得到有效保护[31-32]。
通过清除捕捉自由基,·OH的氧化作用被螯合体系中Fe2+、Cu2+等元素阻断,DNA被·OH氧化损伤的作用能得到有效保护[31-32]。
实验将质粒DNA经Fenton试剂处理后,通过凝胶电泳检测质粒DNA超螺旋结构的转变,并观察其氧化损伤保护程度。电泳图4中lane2为DNA损伤未保护对照组,该组DNA发生完全氧化损伤,超螺旋结构被破坏,超螺旋结构数量比泳道1空白组大大减少。在泳道3~11加入不同浓度PNS对DNA进行孵育,在0.019 5~0.156 mg/mL时,超螺旋结构的质粒DNA明显增多,与浓度呈依赖关系;而在0.156~5.00 mg/mL时,质粒DNA开环结构增多,表明PNS对其氧化损伤保护作用开始减弱。对比PNS体外抗氧化能力,体外抗氧化实验中PNS的清除自由基能力与浓度呈正相关量效关系,而对DNA的氧化损伤保护实验结果中,PNS在低浓度时表现出保护DNA免被氧化损伤的作用,在高浓度时却有促氧化的作用,原因是皂苷结构中的酚羟基对·OH进行直接清除,从分子结构来看,·OH可与皂苷分子形成多种消旋结构,避免DNA生物分子的损伤,另外PNS可能还有络合、嵌入等其他方式与DNA结合起到保护作用[27]。

泳道1-未损伤DNA;泳道2~11-DNA+Fenton试剂+PNS提取液
(0、0.0195、0.039、0.078、0.156、0.312、0.625、1.25、2.50、5.00 mg/mL)
图4 不同浓度PNS提取液对质粒DNA损伤影响的电泳图
Fig.4 Protection against oxidative damage to puc19
DNA with the different concentrations of PNS extract
2.6 HPLC组分分析
依次将11种人参皂苷、三七皂苷标准品的混标样品和EUASE法最优条件下提取的皂苷样品按1.7方法进行HPLC分离,HPLC色谱图如图5所示。对比图5-A中11种标准品的分离保留时间,可看出图5-B中三七花通过EUASE法提取后分离得到三七皂苷R1、Fc、Fe,人参皂苷Rg1、Rb1、Rb2、Rb3、Rc、F29种皂苷组分。
2.7 扫描电镜观察结果
为进一步了解不同提取方法对三七花皂苷提取率产生较大差异的原因,使用扫描电镜观察经以下方法处理后的三七花样品,结果见图6。未处理三七花样品细胞壁结构完整致密,均匀(图6-A);样品进行HRE处理后,样品表面出现疏松结构,有少数部位穿孔,但细胞壁结构大部分完整,没有被破坏,原因可能是采用溶剂加热法提取对物料结构影响不大,导致能溶出的提取物有限(图6-B);当样品进行UAE处理,样品表面结构出现较大空穴结构,破坏程度强于HRE法处理,说明超声波的破坏作用比HRE有效得多,空穴效应明显,能使物料结构疏松,有利更多有效成分与溶剂接触并溶出,从形成的空穴看,内部仍有致密结构存在(图6-C);通过EUASE处理后,样品结构产生的空穴更大更多,相比较UAE法结构更疏松,对细部内部结构破坏更深入,这主要是由于在复合酶的分解作用下,表面的组织细胞壁分解,再加上超声波产生较多空化气泡,相互碰撞过程中,产生更高温度和压力的微射流,植物细胞内部带来更大破坏,将细胞分解成更多小碎片,促使物质的溶解及在溶剂中的转移(图6-D)。由上可知,不同的处理方式与样品结构的破坏程度有直接关系,原料内部结构破坏程度越大提取率也越高。EUASE法处理的原料破坏性最强,表现出最高提取率的结果是必然的。

A-混标色谱图;B-样品色谱图
图5 三七花总皂苷色谱图
Fig.5 Chromatogram of total saponins of Panax notoginseng flowers
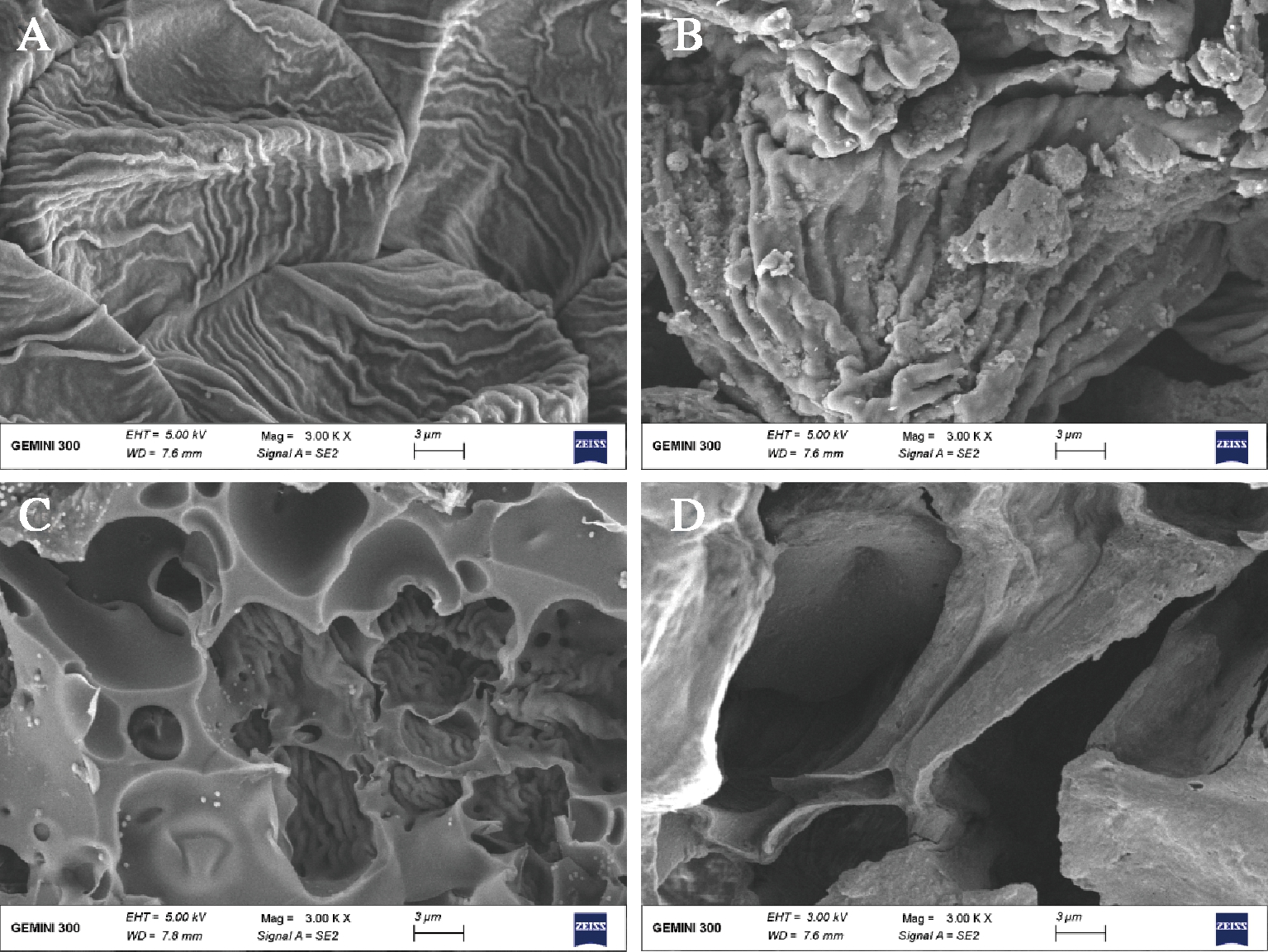
A-未处理干燥三七花;B-HRE法处理三七花;
C-UAE法处理三七花;D-EUASE法处理三七花
图6 扫描电镜图像
Fig.6 Scanning electron microscope images
3 结论
(1)通过响应面分析法得到表面活性剂协同超声波酶法提取三七花总皂苷的最佳工艺为添加0.2%(质量分数)复合酶,液固比为30∶1 (mL∶g)的Triton X-100,在酶解pH为5,酶解温度60 ℃,超声功率465 W条件下超声提取40 min,PNS提取率可达16.38%。EUASE对PNS提取起到重要作用,与传统提取方法相比,EUASE法能提高PNS的提取率。对于提取得到的三七总皂苷表现出较强抗氧化能力和保护DNA氧化损伤作用。
(2)EUASE法是一种绿色的提取技术,提取溶剂采用表面活性剂,具有提取效率高、用量少、成本低、无毒可降解、绿色环保等优点。本研究可推广用于在其他植物化学成分提取;并在优化条件下,用三七花提取有重要价值的皂苷,应用于各种功能食品、医药产品、化妆品中。
[1] MA L, LIU F, FENG Z, et al. Comparative study on chemical components and anti-inflammatory effects of Panax notoginseng flower extracted by water and methanol[J]. Journal of Separation Science, 2017,40(24):4 730-4 739.
[2] LIAO Peiran, LIU Ying, ZHAO Mingzhuo, et al. The development of a Panax notoginseng medicinal liquor processing technology using the response surface method and a study of its antioxidant activity and its effects on mouse melanoma B16 cells[J]. Food & Function, 2017, 8 (11):4 251-4 264.
[3] FENG S, CHENG H, XU Z, et al. Antioxidant and anti-aging activities and structural elucidation of polysaccharides from Panax notoginseng root[J]. Process Biochemistry, 2019, 78: 189-199.
[4] 李娟,王如锋,杨莉,等.三七皂苷类成分及对心血管作用的研究进展[J].中国中药杂志, 2015,40(17):3 480-3 487.
[5] WANG T, GUO R, ZHOU G, et al. Traditional uses, botany, phytochemistry, pharmacology and toxicology of Panax notoginseng (Burk.) F.H. Chen: A review[J]. Journal of Ethnopharmacology, 2016, 188:234-258.
[6] ZHANG S Q, CHEN C, LU W X, et al. Phytochemistry, pharmacology, and clinical use of Panax notoginseng flowers buds[J]. Phytotherapy Research, 2018, 32 (11): 2 155-2 163.
[7] HU Y P, CUI X M, ZHANG Z J, et al. Optimisation of ethanol-reflux extraction of saponins from steamed panax notoginseng by response surface methodology and evaluation of hematopoiesis effect.[J]. Molecules, 2018,23(5):1 206.
[8] ENGELBERTH A S, CLAUSEN E C, CARRIER D J. Comparing extraction methods to recover ginseng saponins from American ginseng (Panax quinquefolium), followed by purification using fast centrifugal partition chromatography with HPLC verification[J]. Separation & Purification Technology, 2010, 72 (1): 1-6.
[9] HE A, DONG B, FENG X, et al. Extraction of bioactive ginseng saponins using aqueous two-phase systems of ionic liquids and salts[J]. Separation & Purification Technology,2018, 196: 270-280.
[10] SUNWOO H H, GUJRAL N, HUEBL A C Z, et al. Application of high hydrostatic pressure and enzymatic hydrolysis for the extraction of ginsenosides from fresh ginseng root[J]. Food and Bioprocess Technology, 2013, 7 (5):1 246-1 254.
[11] FAN T, HU J, FU L, et al. Optimization of enzymolysis-ultrasonic assisted extraction of polysaccharides from Momordica charabtia L. by response surface methodology[J]. Carbohydrate Polymers, 2015, 115:701-706.
[12] CHEN S, CHEN H, TIAN J, et al. Enzymolysis-ultrasonic assisted extraction, chemical characteristics and bioactivities of polysaccharides from corn silk[J]. Carbohydrate Polymers, 2014, 101: 332-341.
[13] RAN J J, FAN M T, LI Y H, et al. Optimisation of ultrasonic-assisted extraction of polyphenols from apple peel employing cellulase enzymolysis[J]. International Journal of Food Science & Technology, 2013, 48 (5): 910-917.
[14] 滕浩,颜小捷,林增学,等.百香果皮多糖的组成及其体外抗氧化活性分析[J].食品与发酵工业,2019,45(15):176-181.
[15] WANG X Y, HUI R. Optimization of dynamic-microwave assisted enzymatic hydrolysis extraction of total ginsenosides from stems and leaves of panax ginseng by response surface methodology[J]. Preparative Biochemistry & Biotechnologyl, 2019, 49 (5):419-426.
[16] ZHANG G, HU M, HE L, et al. Optimization of microwave-assisted enzymatic extraction of polyphenols from waste peanut shells and evaluation of its antioxidant and antibacterial activities in vitro[J]. Food and Bioproducts Processing, 2013, 91(2):158-168.
[17] BELWAL T, EZZAT S M, RASTRELLI L, et al. A critical analysis of extraction techniques used for botanicals: Trends, priorities, industrial uses and optimization strategies[J]. Trends in Analytical Chemistry, 2018, 100: 82-102.
[18] FU X, BELWAL T, CRAVOTTO G, et al. Sono-physical and sono-chemical effects of ultrasound: Primary applications in extraction and freezing operations and influence on food components[J]. Ultrasonics Sonochemistry, 2020, 60: 104 726.
[19] SOSA FERRERA Z, PADR N SANZ C, MAHUGO SANTANA C, et al. The use of micellar systems in the extraction and pre-concentration of organic pollutants in environmental samples[J]. Trends in Analytical Chemistry. 2004, 23 (7): 469-479.
N SANZ C, MAHUGO SANTANA C, et al. The use of micellar systems in the extraction and pre-concentration of organic pollutants in environmental samples[J]. Trends in Analytical Chemistry. 2004, 23 (7): 469-479.
[20] CHOI M P K, CHAN K K C, LEUNG H W, et al. Pressurized liquid extraction of active ingredients (ginsenosides) from medicinal plants using non-ionic surfactant solutions[J]. Journal of Chromatography A, 2003, 983: 153-162.
[21] VIEIRA F A, GUILHERME R J R, NEVES M C, et al. Single-step extraction of carotenoids from brown macroalgae using non-ionic surfactants[J]. Separation & Purification Technology, 2017,172(1): 268-276.
[22] 马祥,晏日安.超声波-表面活性剂协同提取竹叶总黄酮的工艺[J].食品科学,2012,33(22):76-80.
[23] LEI Xiong, HU W B, YANG Z W, et al. Enzymolysis-ultrasonic assisted extraction of flavanoid from Cyclocarya paliurus (Batal) Iljinskaja:HPLC profile, antimicrobial and antioxidant activity[J]. Industrial Crops and Products. 2019, 130: 615-626.
[24] CUI Q, LIU J, XU W, et al. Enhanced extraction and preconcentration of main target saponins from Panax notoginseng root using green and efficient formulated surfactant aqueous systems[J]. Journal of Cleaner Production, 2019, 210:1 507-1 516.
[25] BELWAL T, HUANG H, LI L, et al. Optimization model for ultrasonic-assisted and scale-up extraction of anthocyanins from Pyrus communis 'Starkrimson′ fruit peel[J]. Food Chemistry, 2019, 297:124 993.
[26] HUANG Haizhi, SUN Yujing, LOU Shuting, et al. In vitro digestion combined with cellular assay to determine the antioxidant activity in Chinese bayberry (Myrica rubra Sieb. et Zucc.) fruits: a comparison with traditional methods[J]. Food Chemistry, 2014, 146:363-370.
[27] 张溢,孙培冬,陈桂冰,等.芡实多糖的提取、抗氧化活性及对质粒DNA氧化损伤防护作用的研究[J].食品工业科技,2015,36(11):122-126.
[28] 杨婧娟,于海宁,林秋生,等.发酵辅助提取对三七总皂苷提取物生物活性的影响[J].天然产物研究与开发,2012,24(12):1 816-1 820;1 852.
[29] LIN Hongmei, ZHANG Yonggang, HAN Mei, et al. Aqueous ionic liquid based ultrasonic assisted extraction of eight ginsenosides from ginseng root[J]. Ultrasonics Sonochemistry, 2013, 20 (2): 680-684.
[30] NG T B , LIU F, WANG H X. The antioxidant effects of aqueous and organic extracts of Panax quinquefolium, Panax notoginseng, Codonopsis pilosula, Pseudostellaria heterophylla and Glehnia littoralis[J]. J Ethnopharmacol, 2004, 93 (3):285-288.
[31] 哈木拉提·吾甫尔,阿不都热依木·玉素甫,阿布都艾尼·阿布力米提.羟自由基引发的DNA氧化损伤机理的研究进展[J].新疆医科大学学报,2000(3):273-275.
[32] 肖海芳,付晶晶,王友玲,等.菊苣酸对活性氧诱导脂质和DNA氧化损伤的影响[J].食品科学,2018,39(13):235-240.