采后真菌病害是引起果蔬品质劣变的主要原因之一。黄瓜作为一种组织柔嫩,含水量高的蔬菜,具有易腐性,极易引起真菌病害,在贮藏过程中易出现失水萎蔫,表皮变黄,硬度降低等品质变化[1]。其中,黄瓜炭疽病是由半知菌亚门真菌,葫芦科刺盘孢菌侵染所致,是瓜类作物生产中的主要病害之一,在全国各地均有发生[2]。一般发病率为20%~40%时,产量损失10%~15%,棚室病株率严重时达100%,产量损失40%以上[3]。目前,化学农药依然是生产上防治黄瓜炭疽病的主要方式,但化学农药使用成本高,存在农药残留、污染环境、病原菌抗药性增强等问题[4]。田菲菲等[2]曾报道了34种植物提取物对黄瓜炭疽病菌的抑制作用,报道表明大部分植物提取物对测试病菌具有一定程度的抑制作用。关丽杰等[4]也报道了补骨脂提取物对黄瓜炭疽病菌的抑制活性,报道表明0.2%异补骨脂查尔酮可溶液是一种很有市场前景的防治黄瓜炭疽病的植物源杀菌剂。
壳聚糖是天然生物甲壳素脱乙酰基的产物,是一种无毒无害可食用的天然物质,具有抗菌保鲜作用,可用于果蔬保鲜[5-6]。壳聚糖具有成膜性,将壳聚糖覆盖于果蔬表面,可以对果蔬起到很好的保护作用[7-9]。目前,壳聚糖主要用于西葫芦、冬枣、樱桃番茄、草莓、甜樱桃、黄瓜等果蔬的贮藏保鲜,并有一定成效。
植物精油是一类植物源次生代谢物质,分子质量较小且具有一定挥发性的油状液体物质[10]。植物精油中大多都具有还原性,具有抗氧化活性,可作为天然抗氧化剂[11]。在果蔬保鲜中,植物精油表现出一定的抑菌作用,可以有效减缓果蔬的腐烂速度[12-13]。植物精油具有无毒、无害、纯天然等特点,植物精油对果蔬品质的保持具有显著功效,对延长果蔬的货架期具有显著效果,采用熏蒸法、浸泡法、精油-气调联用、精油-羧甲基纤维素钠/壳聚糖复配法等处理果蔬,对果蔬的贮藏保鲜有良好的效果,应用前景十分广阔。
目前,黄瓜涂膜贮藏的研究很多,但关于植物精油联合壳聚糖对黄瓜的贮藏保鲜的研究还未见报道,本研究以黄瓜为材料,研究预选的13种植物精油对黄瓜炭疽病菌的抑菌效果,筛选出具有较高抑菌活性的植物精油,并联合壳聚糖,利用壳聚糖的成膜性和植物精油的抗氧化、抑菌性研究其对黄瓜贮藏效果的影响,为延长黄瓜的贮藏期及提高食用品质提供理论依据。
1 材料与方法
1.1 材料与试剂
市售新鲜青黄瓜。选取大小均匀、无机械损伤、无病虫害、成熟度一致黄瓜的进行试验。丁香、牛至、桂皮、百里香、迷迭香、甘草、八角、柠檬桉、雪松、鼠尾草、广藿香、肉豆蔻、生姜精油均购于美国诺奥(Now Foods)公司。2,6-二氯靛酚溶液:称50 mg的2,6-二氯靛酚钠盐(分析纯,上海源叶生物科技有限公司),溶于50 mL热水中,冷却后用蒸馏水定容至250 mL容量瓶中,过滤后置于棕色药瓶中保存;0.2 mg/mL标准抗坏血酸溶液:精确称取10 mg抗坏血酸(分析纯,西陇科学股份有限公司),用2%草酸定容到50 mL容量瓶中;2%草酸溶液:称取20 g草酸(分析纯,天津市大茂化学试剂厂)溶于1 000 mL蒸馏水中,试剂瓶保存备用;丙酮(分析纯),西陇科学股份有限公司;石英砂(分析纯),国药集团化学试剂有限公司;CaCO3(分析纯),天津市大茂化学试剂厂。黄瓜炭疽病菌(Colletotrichum lagenarium CGMCC 3.2198,中国普通微生物菌种保藏管理中心)。
1.2 仪器与设备
YP电子天平,上海津平科学仪器有限公司;LRH-250型生化培养箱,上海一恒科学仪器有限公司;HHS-21-6型电热恒温水浴锅,上海博讯实业有限公司;YXQ-LS-100SⅡ立式压力蒸汽灭菌器,上海博讯实业有限公司;GR-240热空气消毒箱,上海博讯实业有限公司;MJP-150D霉菌培养箱,上海森信实验仪器有限公司;GY-3型指针式果实硬度计,乐清市艾德堡仪器有限公司;手持折光仪,上海力辰邦西仪器科技有限公司;UV-1800紫外分光光度计,岛津仪器(苏州)有限公司。
1.3 试验方法
1.3.1 黄瓜炭疽病菌孢子悬浮液的制备
将黄瓜炭疽病菌(Colletotrichum lagenarium CGMCC 3.2198)接种到PDA平板培养基上,于25 ℃霉菌培养箱中黑暗培养5~7 d,待其表面长出大量孢子后,将其配制成浓度约为5×105 CFU/mL的孢子悬浮液,待用[1]。
1.3.2 滤纸片扩散法测定抑菌圈大小
将培养基倒入无菌培养皿中,冷却后加入0.10 mL上述悬浮液,用涂抹棒将表面涂匀,制成含菌平板。用镊子将灭菌的直径为6.0 mm的圆形滤纸片蘸取植物精油原液,贴于培养基表面,每个培养基放置3个滤纸片,摆放方式呈三角形。将制备好的培养基置于25 ℃培养箱中培养72 h,采用十字交叉法测量抑菌圈直径,结果取平均值,每种植物精油做3组平行[14-17]。
1.3.3 划线法测定最低抑菌浓度(minimal inhibitory concentration,MIC)
在无菌条件下,将马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)培养基配制成0.012 5%~0.2%(体积分数)二倍梯度浓度的含植物精油培养基,同时设置对照(不含植物精油),用马克笔将培养基平均分为2份,用无菌接种环蘸取上述悬浮液在培养基上划线,每个浓度重复3次,置于25 ℃培养箱中培养72 h,待对照组培养皿中菌丝体充分生长后,与对照相比,观察各植物精油各浓度对菌的抑制效果,无菌生长的最低浓度即为最低抑菌浓度。
1.3.4 生长速率法测定植物精油对菌丝生长的抑制作用
在无菌条件下,将PDA培养基配制成0.012 5%~0.05%二倍梯度浓度的含植物精油培养基,同时设置对照(不含植物精油)。从培养5~7 d的黄瓜炭疽病菌菌落边缘,用6 mm打孔器打下菌饼,在每个处理平板中央各放1块菌饼,每种处理重复3次,置于25 ℃培养箱中培养4 d,十字交叉法测量菌落直径(mm),计算菌落直径和抑菌率[1,18]如公式(1)、公式(2)所示:
菌落直径=3次测量直径的平均值-6
(1)
抑制率![]()
(2)
式中:A,对照菌落直径;B,处理菌落直径。
1.3.5 植物精油联合壳聚糖对黄瓜贮藏品质的研究
将黄瓜分为4组,其中不处理组为对照(CK)。试验重复3次。将壳聚糖配置成浓度为10 g/L的壳聚糖溶液,丁香精油、牛至精油、桂皮精油分别稀释成浓度为0.05%(体积分数),将配置好的10 g/L壳聚糖+0.05%丁香精油、10 g/L壳聚糖+0.05%牛至精油、1%壳聚糖+0.05%桂皮精油分别搅拌均匀,将黄瓜在溶液中浸泡2 min中后捞出,迅速风干并用保鲜膜包装好,做好标记,置于25 ℃温度下贮藏,每隔3 d天取样,测定各品质指标。试验重复3次。
1.3.6 失重率的测定
采用称重法(每组20根)测定,失重率计算如公式(3)所示:
失重率![]()
(3)
1.3.7 硬度的测定
采用GY-3果实硬度计测量,在黄瓜头、中、尾3个部位各削去一小块薄薄的果皮(厚约1 mm,面积约1 cm×1 cm),用硬度计测定各部位的硬度(kg/cm2),求平均值。
1.3.8 可溶性固形物的测定
采用手持折光仪[19]测定,先滴几滴蒸馏水于折光镜镜面,合上盖板,将仪器对向光线通过目镜观察。并用专用螺丝刀旋动补偿器旋钮,使视野为黑白两色,同时使明暗分界线与标尺上的“0”位重合。然后吸取样品液进行测定并读取刻度尺读数,注意盖板时要防止产生气泡。重复测定3次,求平均值。
1.3.9 VC含量的测定
采用2,6-二氯酚靛酚法[20]测定,称取黄瓜果肉5.0 g,加入10 mL,2%草酸溶液,迅速捣成匀浆,充分提取VC,然后将提取液转移至50 mL棕色容量瓶,用2%草酸溶液定容,提取 10 min。取10 mL滤液用已标定的2,6-二氯靛酚钠盐溶液滴定至淡红色,且15 s内不褪色。实验重复3次。
1.3.10 叶绿素含量的测定
采用紫外分光光度计法[19]测定。称取1.0 g黄瓜样品,加入少量石英砂和碳酸钙粉及2~3 mL,80%丙酮溶液,研成匀浆,再加10 mL,80%丙酮溶液继续研磨至组织变白。静置3~5 min提取。将提取液过滤到50 mL棕色容量瓶中,冲洗研钵、研棒和残渣数次,最后用80%丙酮溶液定容至50 mL,摇匀,用紫外分光光度计进行测定。
1.3.11 数据处理与分析
采用 Excel 2010 进行数据处理和作图,采用SPSS 19.0中 Duncan 新复极差法进行差异显著性分析,显著性水平设置P<0.05。
2 结果与分析
2.1 植物精油对黄瓜炭疽病菌的抑制效果
13种植物精油对黄瓜炭疽病菌的抑制程度不同,如表1所示,生姜、甘草和雪松对黄瓜炭疽病菌无明显抑菌作用,桂皮、牛至、丁香、八角以及百里香对黄瓜炭疽病菌有显著地抑制效果(P<0.05),抑菌圈最大达到了81.59 mm。肉豆蔻、柠檬桉、鼠尾草、广藿香以及迷迭香的抑菌效果稍弱,但也显示出了明显的抑菌效果(P<0.05)。
2.2 植物精油对黄瓜炭疽病菌的最低抑菌浓度
将对黄瓜炭疽病菌抑菌圈直径大于30 mm的5种植物精油按二倍稀释法稀释成0.012 5%~0.2%的浓度(体积分数)梯度,按1.3.2的操作步骤进行试验,测定5种精油的最低抑菌浓度,结果如表2所示,桂皮精油对黄瓜炭疽病菌的最低抑菌浓度为0.012 5%,牛至精油对黄瓜炭疽病菌的最低抑菌浓度为0.025%,丁香精油对黄瓜炭疽病菌的最低抑菌浓度为0.05%,八角及百里香精油对黄瓜炭疽病菌的抑菌浓度均大于0.2%。
表1 植物精油对黄瓜炭疽病菌的抑菌作用
Table 1 Antibacterial effect of plant essential
oils on Colletotrichum lagenarium
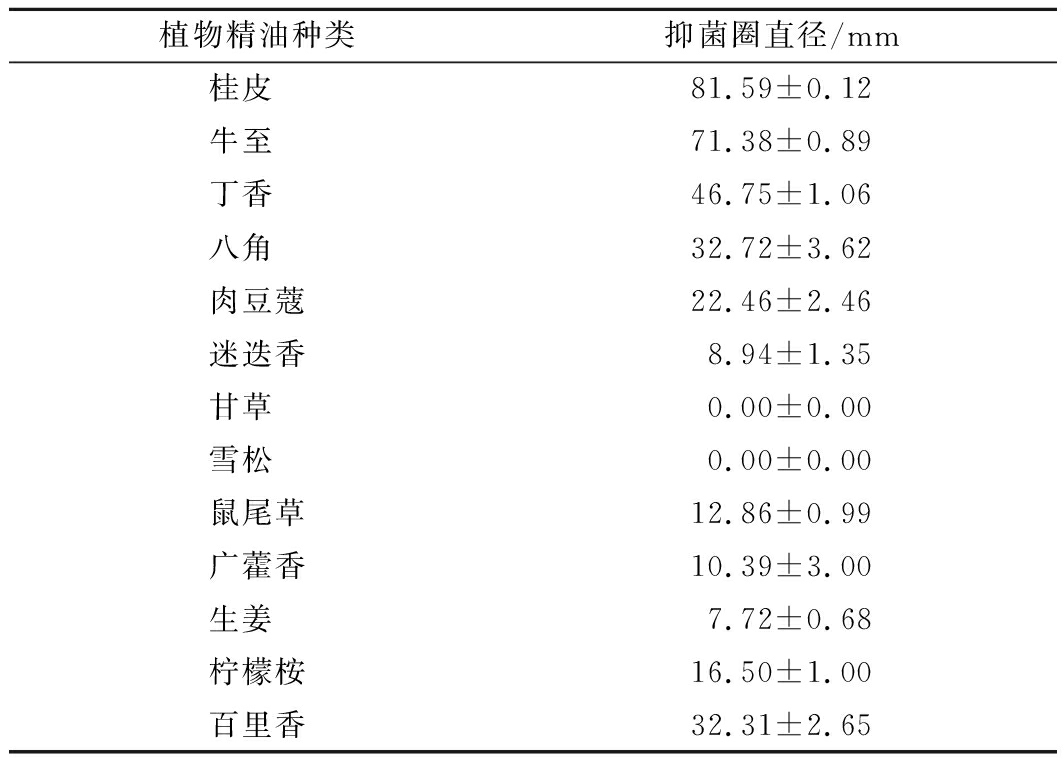
植物精油种类抑菌圈直径/mm桂皮 81.59±0.12牛至 71.38±0.89丁香 46.75±1.06八角 32.72±3.62肉豆蔻22.46±2.46迷迭香8.94±1.35甘草 0.00±0.00雪松 0.00±0.00鼠尾草12.86±0.99广藿香10.39±3.00生姜 7.72±0.68柠檬桉16.50±1.00百里香32.31±2.65
表2 植物精油对黄瓜炭疽病菌的最低抑菌浓度
Table 2 The minimum inhibitory concentration of
plant essential oils on Colletotrichum lagenarium
植物精油种类桂皮牛至丁香八角百里香最低抑菌浓度0.012 5%0.012 5%0.05%>0.2%>0.2%
2.3 植物精油对黄瓜炭疽病菌的最低抑菌浓度
将对黄瓜炭疽病菌最低抑菌浓度小于等于0.05%的3种精油按1.3.3的操作步骤进行试验,测定3种精油对黄瓜炭疽病菌的抑菌率。结果如表3所示,对照组菌落直径达到25.17 mm,不同浓度的桂皮、牛至以及丁香精油的菌落直径显著低于对照组(P<0.05)。3种精油体积分数为0.05%时均能完全抑制病菌生长。体积分数为0.025%桂皮及牛至精油仍能完全抑制菌丝生长,丁香精油的抑菌率为91.86%。当体积分数降至0.012 5%时,桂皮、牛至以及丁香精油的抑菌率分别为84.98%、100%、55.76%,抑菌效果显著(P<0.05)。
2.4 植物精油联合壳聚糖对黄瓜贮藏效果的影响
2.4.1 黄瓜贮藏期间失重率变化
黄瓜果实在采收后,仍有较高的呼吸作用和蒸腾作用,导致水分的流失。如图1所示,在贮藏期间,黄瓜的失重率随着贮藏时间的延长逐渐增加。与对照相比,采用植物精油联合壳聚糖复合处理能够降低黄瓜水分的散失,抑制黄瓜贮藏期间失重率的增加。在贮藏第12天,对照的黄瓜失重率为13.76%,显著高于0.05%牛至精油+10 g/L壳聚糖处理组(9.52%)、0.05%桂皮精油+10 g/L壳聚糖处理组(8.28%),0.05%丁香精油+10 g/L壳聚糖处理组(7.78%)(P<0.05)。植物精油涂膜处理抑制了贮藏期黄瓜的呼吸与蒸腾作用,有效减缓了黄瓜贮藏期水分的散失[21]。3个处理组比较发现,在贮藏第12天,各处理间有显著差异,其中丁香处理组明显低于桂皮和牛至处理组(P<0.05)。
表3 植物精油对黄瓜炭疽病菌的抑制作用
Table 3 Antibacterial effect plant essential
oils on Colletotrichum lagenarium
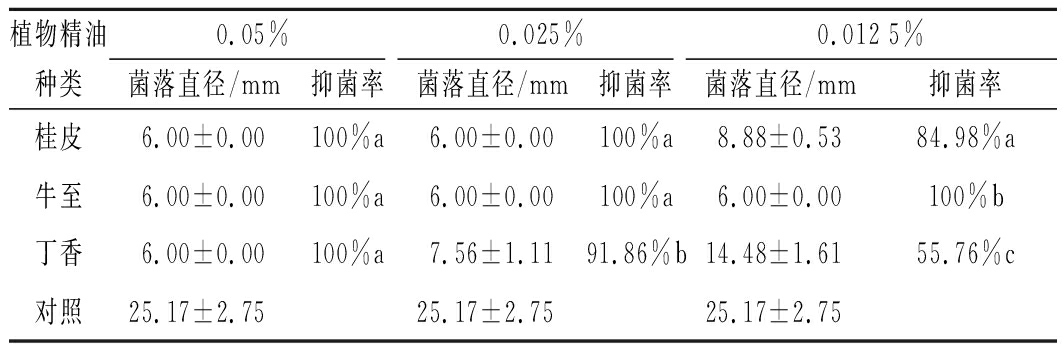
植物精油0.05%0.025%0.012 5%种类菌落直径/mm抑菌率菌落直径/mm抑菌率菌落直径/mm抑菌率桂皮6.00±0.00100%a6.00±0.00100%a8.88±0.5384.98%a牛至6.00±0.00100%a6.00±0.00100%a6.00±0.00100%b丁香6.00±0.00100%a7.56±1.1191.86%b14.48±1.6155.76%c对照25.17±2.7525.17±2.7525.17±2.75
注:同列数据后不同小写字母表示处理间差异显著(P<0.05)
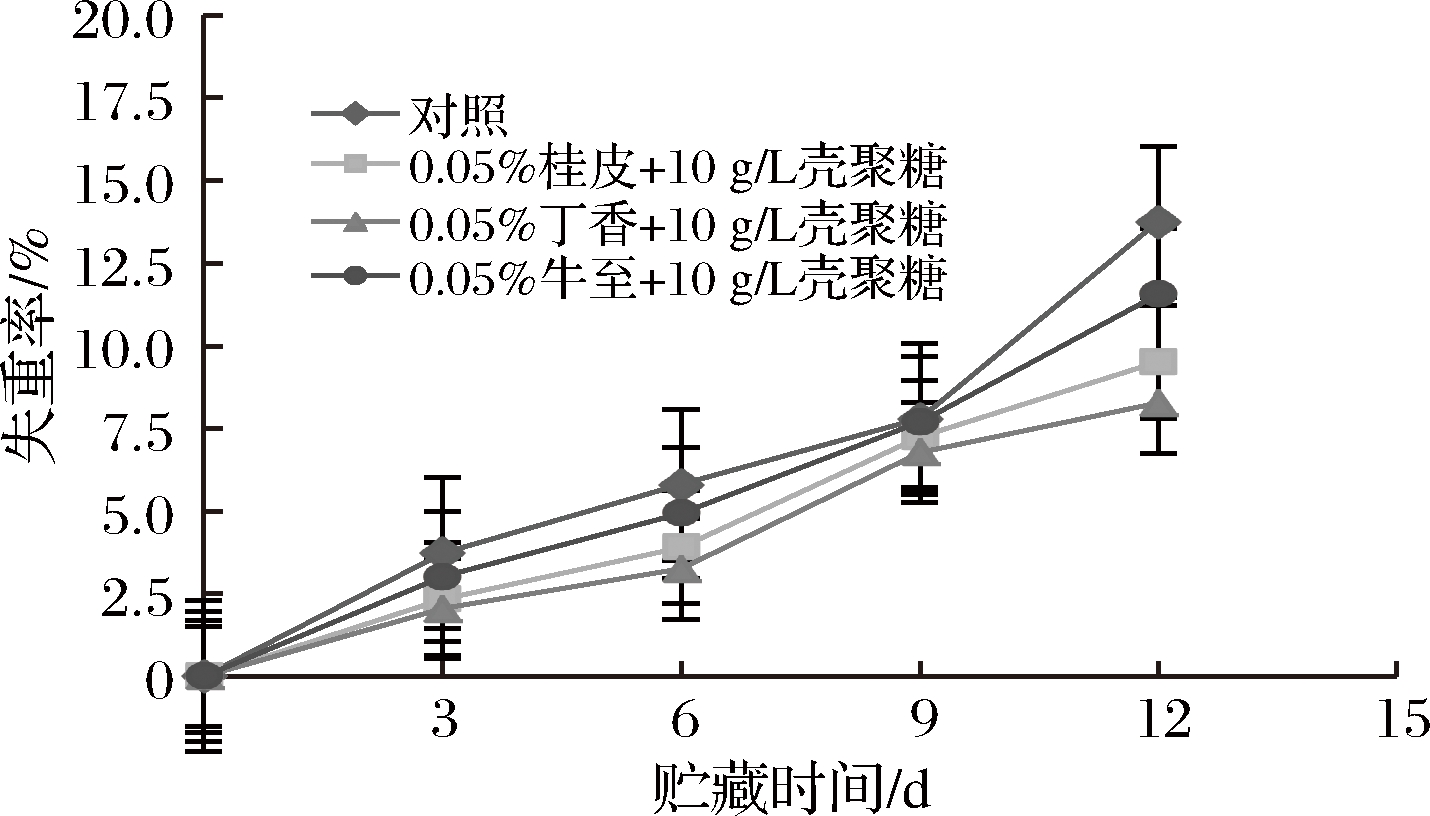
图1 黄瓜贮藏期间失重率变化
Fig.1 Changes in weight loss rate of
cucumber during storage
2.4.2 黄瓜贮藏期间硬度变化
果实硬度是衡量果实成熟度和贮藏品质的重要标志之一[22]。通过测定果实的硬度,可以掌握果实在贮藏过程中的品质变化。如图2所示,在贮藏期间,黄瓜的硬度随着贮藏时间的延长逐渐减少。在贮藏第6天时,不同处理果实硬度下降明显(P<0.05),对照组硬度为12.10 kg/cm2,处理组中丁香处理效果最好,硬度为14.55 kg/cm2,显著高于对照组(P<0.05)。在贮藏第12天时,对照组硬度降为8.56 kg/cm2,显著低于各处理组(P<0.05),其中丁香精油处理组硬度为13.21 kg/cm2,桂皮精油处理组硬度为12.51 kg/cm2,牛至精油处理组硬度为9.29 kg/cm2。
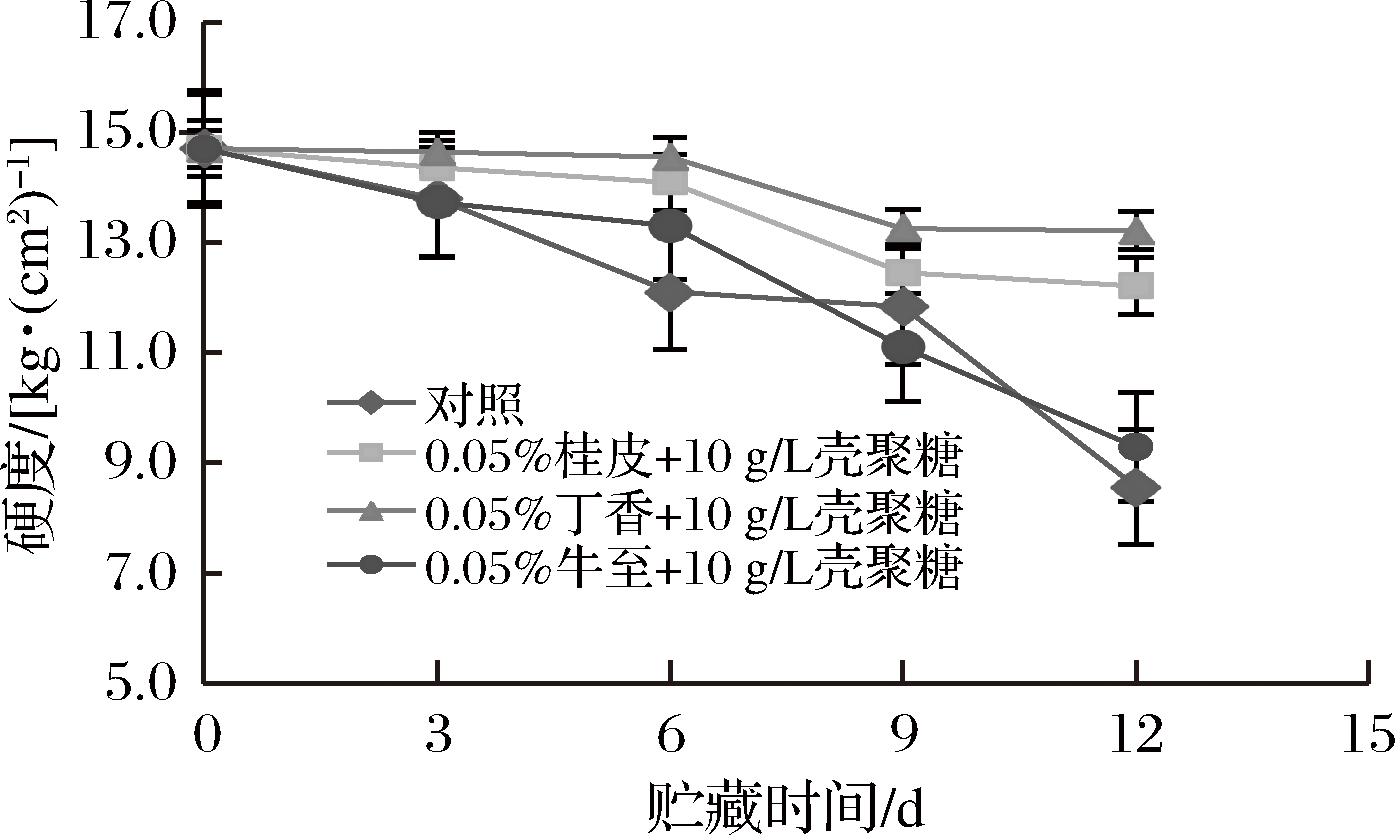
图2 黄瓜贮藏期间硬度变化
Fig.2 Changes in hardness of cucumber during storage
2.4.3 黄瓜贮藏期间可溶性固形物变化
可溶性固形物是溶解于果蔬中的一些旋光物质,主要是糖类,是果蔬主要营养物质指标,黄瓜果实中的可溶性固形物含量能够直接反映黄瓜的成熟程度和品质状况[23]。图3结果显示,在贮藏过程中,黄瓜中的可溶性固形物含量随着贮藏时间的延长逐渐减少。在贮藏第3天,对照组和处理组的可溶性固形物含量下降明显(P<0.05),对照组可溶性固形物含量降至3.25%。另外,对照组的可溶性固形物含量有所上升,原因可能是在贮藏过程中,多糖水解使还原糖含量上升,同时也在不断进行呼吸作用消耗糖分,两者的综合作用使糖类物质在贮藏初期有所升高,随后又趋于下降。在贮藏第12天时,对照组黄瓜中的可溶性固形物含量降至2.68%,丁香精油处理组的可溶性固形物含量为3.21%,显著高于其他各处理组的含量(P<0.05),这说明0.05%丁香精油+10 g/L壳聚糖对延缓黄瓜中可溶性固形物下降的效果最佳。
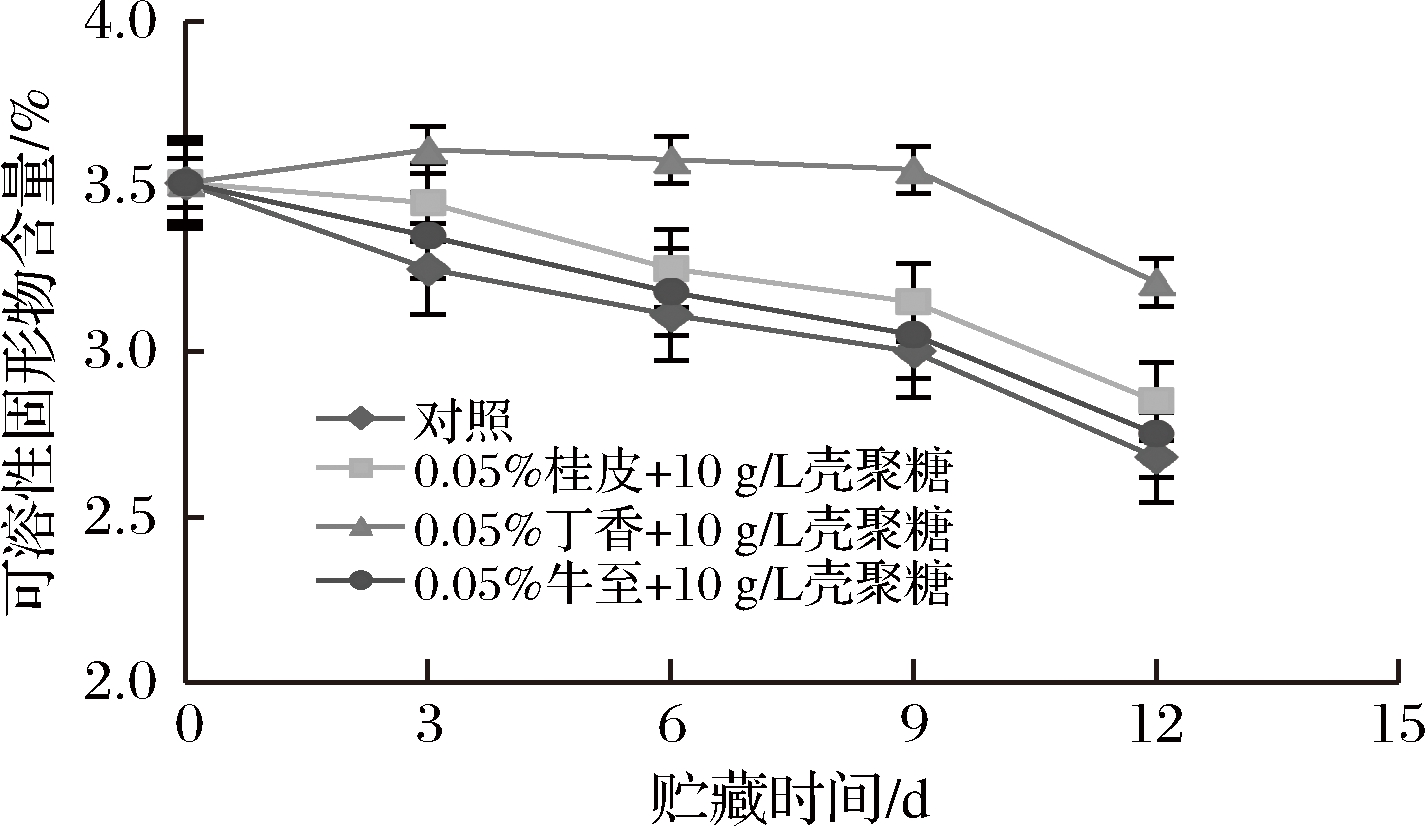
图3 黄瓜贮藏期间可溶性固形物变化
Fig.3 Changes in soluble solids content of cucumber during storage
2.4.4 黄瓜贮藏期间VC含量变化
VC含量是果蔬中最重要的营养物质之一,是黄瓜的营养品质和贮藏效果的一项重要评价指标[24]。VC不稳定,极易被氧化,易受pH、水分活度、酶等因素的影响发生降解[25]。图4结果显示,在贮藏过程中,黄瓜VC含量随着贮藏时间的延长逐渐降低,原因是VC是一种热敏性成分,极易被氧化,成熟过程中含量会有所上升,进入完熟阶段后果实中VC又会受环境条件的影响而分解损失[8]。在贮藏第12天时,对照组VC含量为1.05 mg/100g,显著低于牛至处理组的2.01 mg/100g,桂皮精油处理组的2.21 mg/100g,丁香精油处理组的2.78 mg/100g(P<0.05)。3个处理组比较发现,在贮藏第12天,桂皮处理组和牛至处理组间无显著差异,但丁香处理组的VC含量显著高于桂皮处理组和牛至处理组(P<0.05),这说明0.05%丁香精油+10 g/L壳聚糖在延缓黄瓜VC含量降低的效果最佳。
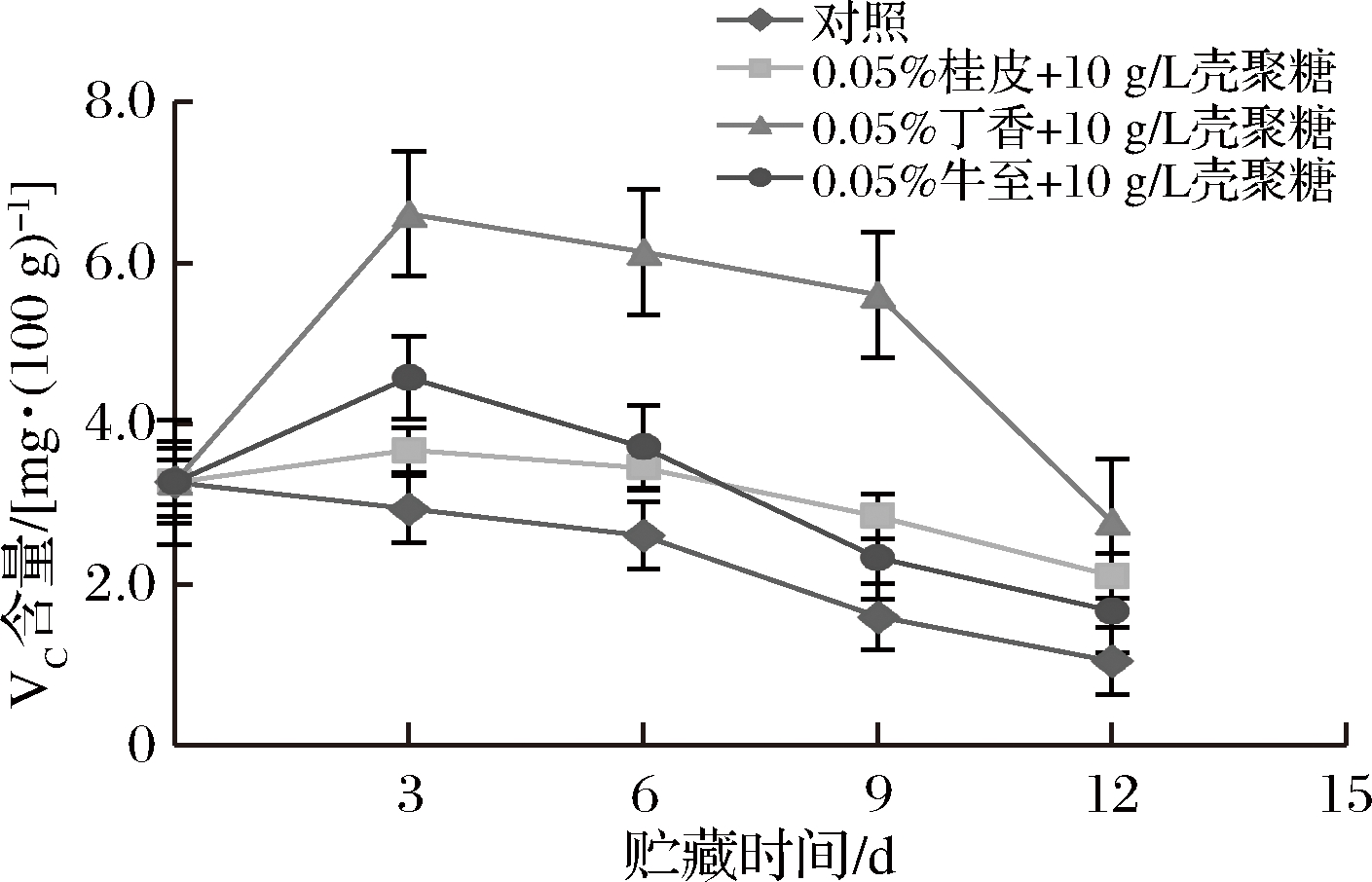
图4 黄瓜贮藏期间VC含量变化
Fig.4 Changes in VC content of cucumber during storage
2.4.5 黄瓜贮藏期间叶绿素含量变化
黄瓜贮藏过程中会出现果实退绿黄化,其表皮内叶绿素含量可以反映其在贮藏期间的品质变化,是测定黄瓜品质的一项重要指标[26]。如图5结果显示,在贮藏过程中,黄瓜的叶绿素含量随贮藏时间呈下降趋势,主要是由于发生了脱镁反应[27]。在贮藏第3天时,对照组黄瓜叶绿素含量为24.93 mg/100g,显著低于丁香精油处理组的29.67 mg/100g,桂皮精油处理组的27.58 mg/100g,牛至精油处理组的27.43 mg/100g(P<0.05)。在贮藏第3至第9天,丁香处理组的叶绿素含量显著高于其他各组(P<0.05)。在贮藏第12天时,对照组黄瓜叶绿素含量仅为11.53 mg/100g,与各处理组间无明显差异。
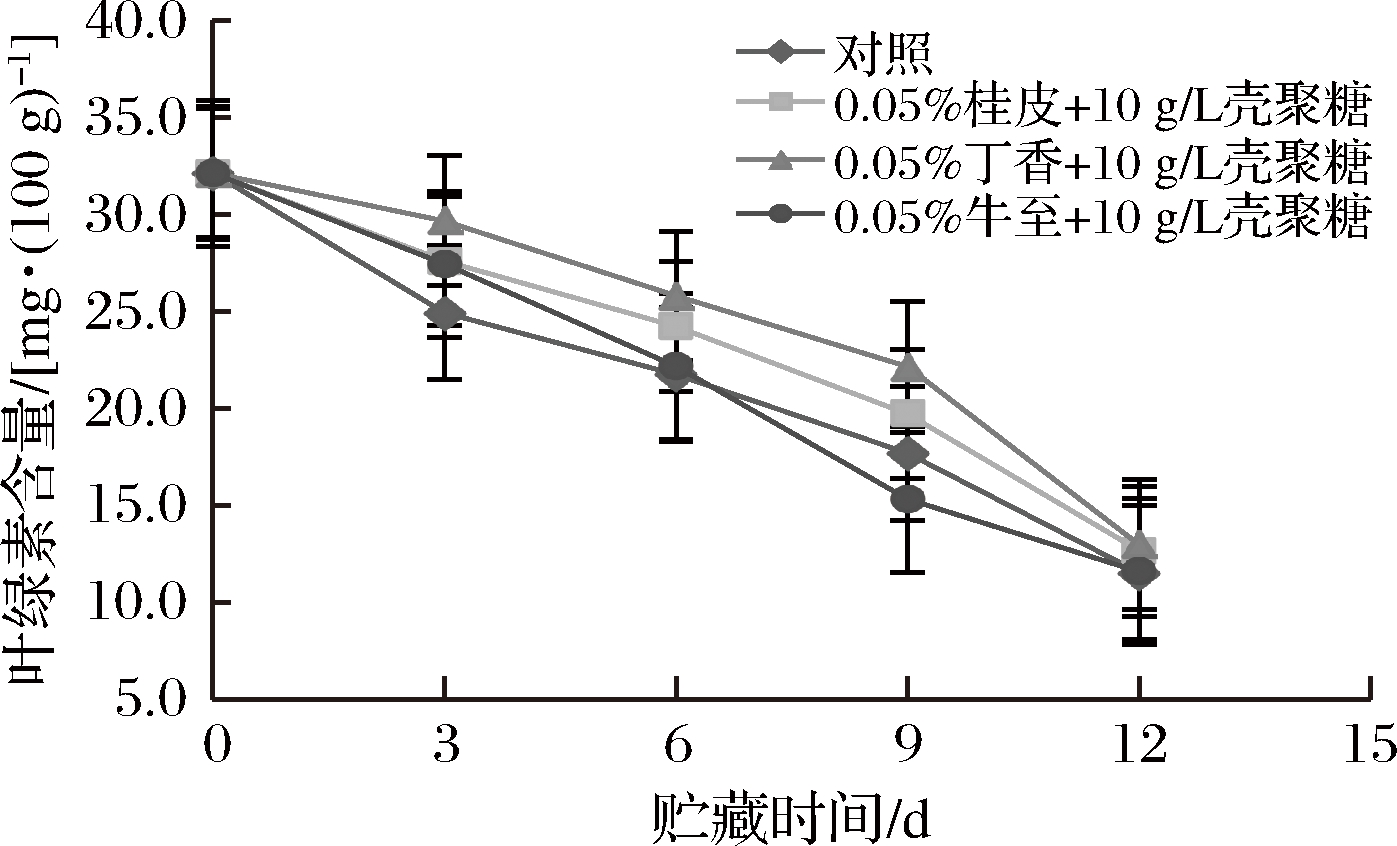
图5 黄瓜贮藏期间叶绿素含量变化
Fig.5 Changes in chlorophyll content of cucumber during storage
3 结论
植物精油对黄瓜炭疽病菌的抑制试验表明,在13种植物精油中,桂皮、牛至、丁香精油对黄瓜炭疽病菌的抑菌效果最佳,体积分数为0.05%的3种精油均能较好地抑制黄瓜炭疽病菌的生长,在此基础上,利用体积分数为0.05%的3种植物精油联合体积分数10 g/L的壳聚糖处理黄瓜,能不同程度地影响黄瓜的贮藏品质。不同植物精油处理对黄瓜贮藏品质的影响不同,与对照组相比,用0.05%丁香精油+10 g/L壳聚糖处理的黄瓜贮藏效果最好,能有效降低黄瓜的失重率,延缓呼吸作用,减少水分的散失,对黄瓜的硬度、可溶性固形物、VC、叶绿素含量的保持也有显著效果,具有良好的抗氧化作用和抑菌作用,能够使黄瓜维持良好的品质。桂皮精油和牛至精油对黄瓜炭疽病菌的抑制效果均强于丁香精油,但与丁香精油处理组相比,桂皮精油与牛至精油处理对黄瓜贮藏效果较差,且有加速黄瓜腐烂的表现,可能是贮藏过程中所用的精油浓度偏高,对黄瓜本身产生一定的毒害作用,使处理对黄瓜的贮藏效果不如丁香精油。植物精油对黄瓜贮藏效果的影响有待进一步研究。
[1] 张秀玲,唐国宪,凌海波. TY型保鲜袋对黄瓜贮藏品质影响[J]. 北方园艺, 2001(6): 45-47.
[2] 田菲菲,孙明清,蒋继志,等. 植物提取物对黄瓜炭疽病菌的抑制作用[J]. 中国农学通报, 2006, 22 (12): 327-330.
[3] 田菲菲,蒋继志,沈凤英,等. 126种中草药提取物对两种植物病原菌的抑菌活性[J]. 华北农学报, 2006,(51): 131-134.
[4] 关丽杰,董瑞芳. 补骨脂提取物对黄瓜炭疽病菌的抑制活性[J]. 江苏农业科学, 2016, 44(1): 160-162.
[5] 杜维维. 浅谈壳聚糖及壳聚糖膜[J]. 塑料包装, 2013, 23(2): 25-28.
[6] 封晴霞,赵雄伟,陈志周,等. 壳聚糖及其应用研究进展[J].食品工业科技, 2018,39(21): 333-335.
[7] 袁蒙蒙,庞杰,王清. 壳聚糖涂膜对西葫芦和黄瓜保鲜效果的影响及减轻冷害的研究[D]. 福州:福建农林大学, 2012.
[8] 许牡丹,刘红梅,曾令军. 马铃薯淀粉-壳聚糖复合膜对冬枣的保鲜研究[J]. 食品研究与开发, 2010, 31(3): 170-172.
[9] 张洪,王明力,毛玉涛. 壳聚糖复合涂膜在果蔬保鲜中的应用研究进展[J]. 贵州农业科学, 2011, 39(10): 149-152.
[10] 王巨媛,翟胜. 植物精油应用进展及开发前景展望[J]. 江苏农业科学, 2010(4): 1-3.
[11] DJOUAHRI A, SEBIANE S, KELLOU F, et al. Inhibitory effect oncorrosion of carbon steel in acidic media, antioxidant, antimicrobial,anti-5-lipooxygenase and anti-xanthine oxidase activities of essen-tial oil from Tetraclinis articulata (Vahl) Masters leaves[J]. Journalof Essential Oil Research, 2017, 29(2): 169-178.
[12] 杨巍巍. 植物精油在果蔬保鲜中的应用[J]. 农产品加工(学刊), 2012(10): 71-72.
[13] WANG F, WEI F Y, SONG C X, et al. Dodartia orientalis L. essential oil exerts antibacterial activity by mechanisms of disrupting cellstructure and resisting biofilm [J]. Industrial Crops and Products,2017, 109: 358-366.
[14] 陈林林,米强,辛嘉英. 柑橘皮精油成分分析及抑菌活性研究[J]. 食品科学, 2010, 31(17): 25-28.
[15] 谢宗波,姜国芳,黄德娟. 大蒜油的提取及抗菌活性研究[J]. 食品科技, 2007(8): 130-132.
[16] SOKOVIC M D, BRKIC D D, DAMIC A M, et al. Chemical composition and antifungal activity of Salvia desoleana Atzei & Picci essentialoil and its major components[J]. Flavour Fragr J, 2009, 24: 83-87.
[17] 何余堂,杜金艳,马春颖. 玉米花粉多糖的抗菌作用研究[J]. 食品科技, 2008(2): 156-158.
[18] WANG Shutong,WANG Xiaoyan,LIU Janling,et a1.Screening of Chinese herbs for the fungitoxieity against Phy-tophthora infestan[J].Journal of Agricultural University of Hebei,2001,24(2):101-107.
[19] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:24-25;32-34.
[20] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2001:246-248.
[21] 孟令伟,王启利,胡亚光.壳聚糖/琼脂涂膜处理对圣女果贮藏品质的影响[J].黑龙江八一农垦大学学报,2014,26(4):61-65.
[22] 孔祥佳,郑俊峰,林河通,等.热处理对果蔬贮藏品质和采后生理的影响及应用[J].包装与食品机械,2011,29(3):34-39.
[23] 盛海彦,翟丙年,杨岩荣,等. 蔬菜专用叶面肥对番茄产量及品质的影响[J]. 中国农学通报, 2004,20(4):182-184.
[24] 李昺胐,郑秋丽,徐冬颖,等. 外源精胺处理对采后黄瓜品质的影响[J]. 食品工业科技, 2018,39(14):248-251.
[25] ZHANGL P,XIE J,WANG T,et al.Study of physicochem-ical properties of Chinese small cabbage(Brassica Chinese L.)stored at four temperatures[J].Advanced Materials Research,2013,2 384:1 275-1 281.
[26] 张黎,王峥鉴,张秀玲,等. 川陈皮素-羧甲基纤维素钠复合涂膜对黄瓜保鲜效果的影响[J]. 北方园艺,2019(15):113-119.
[27] MARTINS R C,LOPES I C,SILVA C L M.Accelerated life testing of frozen green beans(Phaseolus vulgaris L.) quality loss kinetics:Colour and starch[J].Journal of Food Engineering,2004,67(3):339-346.