通过铝塑复合手段可提高包装材料的阻隔性,因此铝塑复合膜常用于货架期较长或对气体敏感性较高的食品包装[1-3]。由于静电作用造成的吸附以及层与层之间过大的内摩擦,塑料薄膜在生产和使用过程中存在开口性差等问题,而爽滑剂的加入可以减少该现象的发生[4]。芥酸酰胺(erucamide, EAD)和油酸酰胺(oleamide, OAD)是最常用的2种爽滑剂,一般复配使用[5]。EAD和OAD与聚烯烃熔体相容性良好,且冷却后会从聚烯烃薄膜内部迁移至膜的表面,并在薄膜表面形成一层膜以降低薄膜间的摩擦系数,提高薄膜的爽滑性[6-8]。
爽滑剂在产品中的添加量一般为高分子材料质量分数的0.08%~0.4%[9]。目前爽滑剂尚未进行完善的毒理学评估,但现有的研究表明爽滑剂存在一定毒性。其中EAD能够使小鼠行动变缓,认知能力下降。此外,EAD水解生成的芥酸容易引起皮肤损伤[10-12];而OAD与人体的各项生理活动及代谢过程密切相关,属于内源性并具有生物活性的一类物质[13]。食品接触材料中的OAD可迁移至食品,再通过膳食进入人体[14],而通过外源途径进入人体的OAD有可能对人体的各项生理过程和代谢产生干扰[15]。
目前,针对EAD和OAD的检测方法主要包括气相色谱法[16-18]、气相色谱-质谱法[11,19-20]、高效液相色谱法[21-22]、液相色谱-质谱法[15,23]等。如朱丽娴等[24]利用HPLC检测经二甲苯溶解聚乙烯提取的EAD;LYU等[11]采用气相色谱-质谱法检测聚乙烯包装材料中EAD和OAD,但这些方法存在检出限高和检测时间长等不足。本文在前人的研究基础上,在检测条件和样品前处理上进一步优化,以液相色谱串联质谱法测定铝塑复合膜中EAD和OAD的含量,该方法快速高效、操作简单,为铝塑复合膜中EAD和OAD的检测提供参考依据。
1 材料与方法
1.1 材料与试剂
食品级均聚聚丙烯母粒(型号:PPH-T03;熔点156 ℃),中国石油化工股份公司茂名分公司;市场销售的11种铝塑复合和镀铝复合食品包装膜或包装袋,由广州海关技术中心国家食品接触材料检测重点实验室提供。
芥酸酰胺标准品(纯度98%),北京百灵威科技有限公司;油酸酰胺标准品(纯度99%),美国Sigma公司;芥酸酰胺(纯度85%,用于制备阳性铝塑复合膜)、油酸酰胺(纯度70%,用于制备阳性铝塑复合膜),上海麦克林生化科技有限公司。
甲醇(色谱级)、乙醇(色谱级)、二氯甲烷(色谱级)、正己烷(色谱级),美国Fisher chemical公司;丙酮(分析纯),广东广试试剂科技有限公司;环己烷(分析纯),二甲苯(分析纯),天津科密欧化学试剂有限公司。
1.2 仪器与设备
液相色谱-三重四极杆串联质谱仪(Agilent 1200-6460),美国Agilent公司;电热鼓风干燥箱(GZX-9240MBE),上海博迅实业有限公司医疗设备厂;样品自动浓缩工作站(Turbo VAPII),美国Caliper公司;EL104电子分析天平(0~120 g,精度0.000 1 g),梅特勒-托利多仪器(上海)有限公司;超声波清洗器(SK250LH),上海科导超声仪器有限公司; 超纯水器(EPED-10TS),南京易普达科技发展有限公司;恒温加热器(COD),青岛路博伟业环保科技有限公司;水浴锅(HH-S4型),国立试验设备研究所(常州市);型双螺杆挤出造粒机(MEDU-22/40),广州市普同实验分析仪器有限公司;小型流延机(JYL-30),佛山市金中河机械有限公司;涂布机(K202),英国RK公司;马弗炉(LT 40/11),德国纳博热工业炉有限公司。
1.3 阳性铝塑复合膜的制备
考虑到市场上样品中目标物较难同时检出,因此制备阳性膜以便实验的开展。分别称取EAD和OAD 1.0 g(精确到0.000 1 g),与食品级PPH母粒998.0 g混合均匀后[25],倒入造粒机重复造粒3次[26],造粒时模头温度为170 ℃,料筒1~9区温度分别为160、160、160、165、165、165、170、170和165 ℃,得到含EAD和OAD/PPH复合母粒。造粒完成后将复合母粒用小型流延膜实验机进行流延成膜,流延机1~3区的温度为180、185、190 ℃,合流区和模具区均是190 ℃,流延得到EAD和OAD /PPH复合膜。不添加2种化合物的空白PPH膜按照同样的方法和条件制备。制成的薄膜厚度为(0.043±0.004) mm,密度为(0.956±0.057) g/cm3。
阳性铝塑复合膜由EAD和OAD/PPH复合膜与铝箔利用胶黏剂复合而得,其制备方法如下:首先利用涂布机将胶黏剂均匀地涂在铝箔层上,再利用一定的压力将薄膜与铝层复合,在复合的过程中将气泡挤出,随后放置在45 ℃的恒温箱中干燥36 h,挥发掉溶剂,使其充分交联。
1.4 试验方法
1.4.1 色谱与质谱条件
1.4.1.1 液相色谱条件
色谱柱InfinityLab Poroshell 120EC-C8(100 mm×3.0 mm,2.7 μm,美国Agilent公司);流速0.3 mL/min;流动相用甲醇等梯度洗脱;柱温30 ℃;进样量2 μL;进样时间,4 min。
1.4.1.2 质谱条件
离子源:电喷雾离子源(electron spray ionization, ESI);扫描方式:正离子模式;检测方式:多反应监测 (multiple reaction monitoring, MRM);毛细管电压4 000 V;干燥气流速6 L/min;干燥气温度300 ℃;雾化器压力45 psi;鞘气温度380 ℃;鞘气流速11 L/min;其他主要质谱条件见表1。
表1 EAD和OAD的质谱参数
Table 1 Mass spectrometric parameters of EAD and OAD
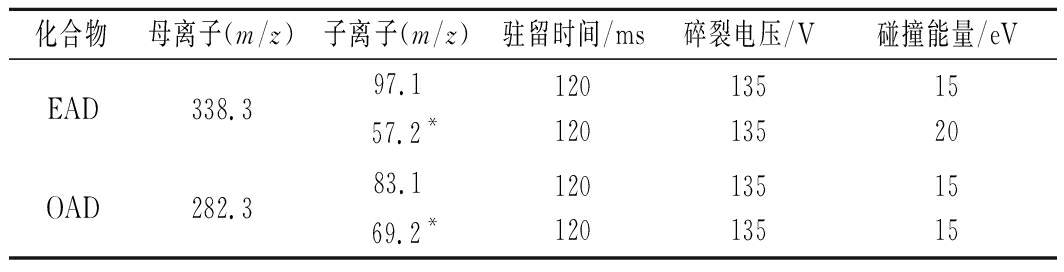
化合物母离子(m/z)子离子(m/z)驻留时间/ms碎裂电压/V碰撞能量/eVEAD338.397.1 57.2*1201201351351520OAD282.383.1 69.2*1201201351351515
注:*为定量离子
1.4.2 样品处理
为了避免实验工具带来的EAD和OAD污染,实验过程避免使用塑料滴管、针式过滤器和注射器等塑料制品。实验过程中所使用玻璃器皿(量器除外),洗净后,置于马弗炉400 ℃下烧制1 h,冷却至室温备用。
称取0.1 g(精确到0.000 1 g,约0.2 cm×0.2 cm)阳性铝塑复合膜置于具塞玻璃试管中,加入10 mL乙醇室温(30 ℃)下超声提取1 h,重复提取2次,合并混匀,静置后定容至25 mL,再用移液管取出5 mL提取液转移至玻璃离心管,进行高速离心,离心时间为5 min,离心机转速为6 000 r/min,待离心净化后用玻璃滴管取上清液至进样小瓶,上机分析。
1.4.3 标准曲线及检出限
准确称取EAD和OAD 0.010 0 g,用乙醇配制和稀释成100 mg/L的标准储备液,保藏于4 ℃的冰箱中,经过稀释后配制成0.10、0.50、1.00、1.50、2.00、2.50和3.00 mg/L的一系列标准工作液。
1.4.4 回收率及精确度
为了验证EAD和OAD提取方法的准确性,选取空白铝塑复合膜进行加标回收实验,低、中、高3个加标水平分别为0.5、1.5、2.5 mg/L,每组实验6个平行样,并做样品空白。按照1.3.2对样品进行处理和上机分析,计算其回收率和精密度。
1.4.5 EAD和OAD含量的计算
EAD和OAD含量计算如公式(1)所示:
(1)
式中:X为样品中EAD和OAD的含量, mg/kg;ρ为标准曲线定量的样品EAD和OAD质量浓度, mg/L;ρ0为标准曲线定量的空白样品EAD和OAD质量浓度, mg/L;V为定容体积, mL;m为样品质量,g。
1.4.6 数据统计与图像处理方法
Agilent LC-MS/MS Mass hunter工作站进行数据分析,用Office软件Excel和Origin 9.0对数据结果进行统计分析并作图,Minitab 17 对结果进行显著性分析(P<0.05)。
2 结果与分析
2.1 质谱条件优化
EAD和OAD的分子中含有氨基,易结合H+,所以采用ESI正离子模式进行检测。首先在未接入色谱柱下,优化质谱参数,即以0.1 mL/min的流速注入1 mg/L的EAD和OAD混合标准溶液,在ESI正离子扫描模式下,进行一级质谱扫描确定母离子;随后,进行二级质谱扫描,确定子离子;最后,在MRM模式下对碎裂电压、碰撞能量等参数进行优化,最终获得如表1所示的质谱条件。
2.2 色谱条件的优化
2.2.1 流动相的选择
实验分别比较了甲醇、乙腈、0.1%甲酸甲醇、0.1%甲酸乙腈、甲醇-0.1%甲酸水(体积比为90∶10)、乙腈-0.1%甲酸水(体积比为90∶10)作为流动相时色谱对EAD和OAD的分离效果及灵敏度的影响。结果表明,水相的加入对物质分离存在负面影响,且灵敏度相对较低;甲醇作为流动相时其灵敏度高于乙腈作为流动相时的灵敏度,且噪声较低。一般在正离子模式下,加入甲酸可使目标物预形成[M+H]+,有助于促进质子离子化,从而提高响应灵敏度[27],但使用0.1%甲酸甲醇作为流动相时,目标物的峰型和响应值与甲醇作为流动相时相比无明显变化,因此本实验选择纯甲醇作为流动相。
2.2.2 色谱柱的选择
色谱柱的填料种类和颗粒大小是影响样品组分分离度的主要因素。为获得更高的分离度和灵敏度,本实验选取柱效较高,分离度较好的3种色谱柱进行尝试,A柱:Poroshell 120EC-C8(100 mm×3.0 mm, 2.7 μm);B柱:Poroshell 120EC-C18(150 mm×3.0 mm, 2.7 μm);C柱:ZORBAX SB-C18(150 mm×4.6 mm, 5 μm)。结果表明,EAD和OAD在A柱上形成的色谱峰最佳,具有良好的分离度和响应度。故最终选择Poroshell 120EC-C8色谱柱,其混标总离子流图见图1。
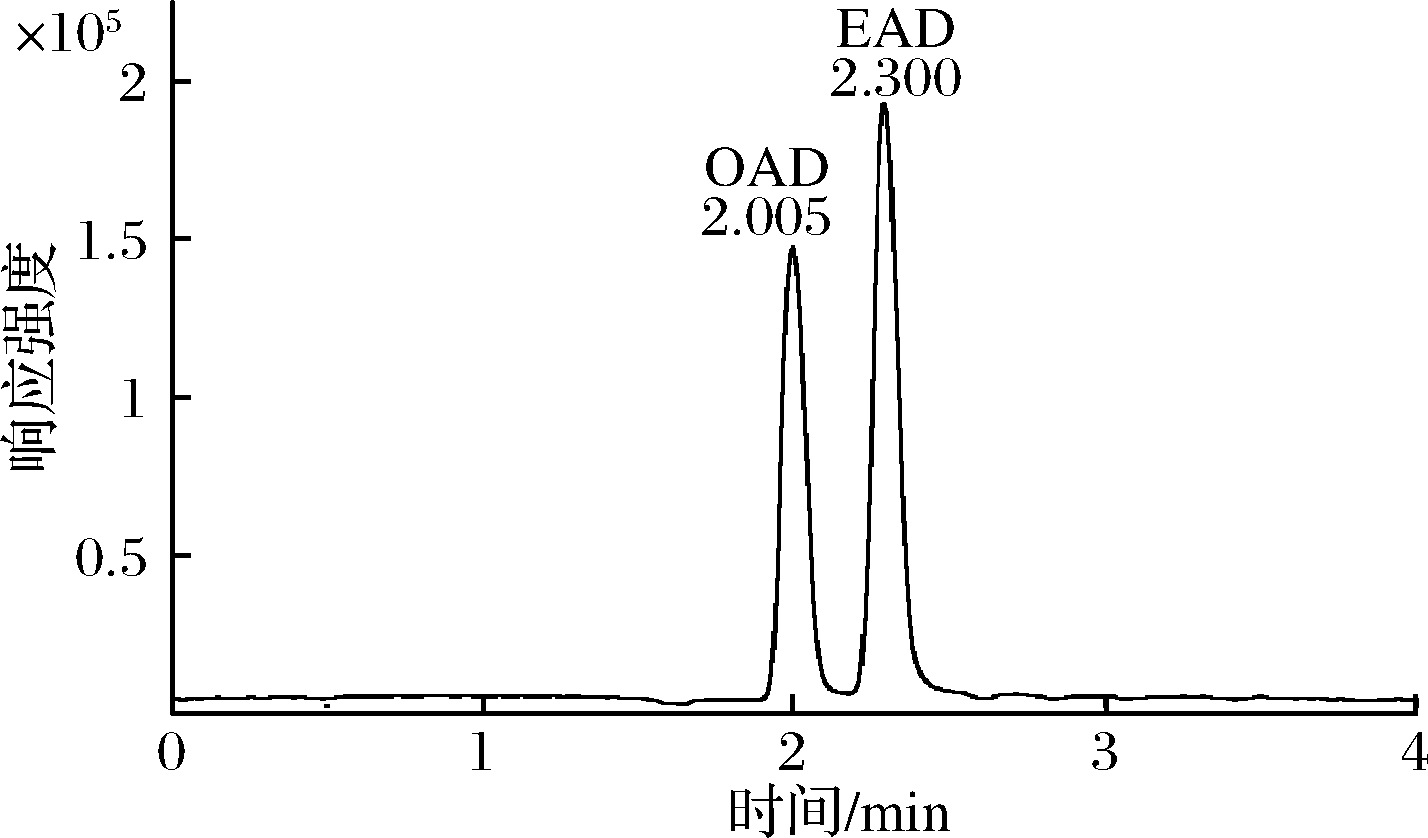
图1 EAD和OAD混标的总离子流图(1 mg/L)
Fig.1 Total ion chromatograms of EAD and OAD (1 mg/L)
2.3 样品前处理方法优化
目前对塑料薄膜的前处理方法有超声提取法、回流萃取法和溶解法,本实验比较了文献和标准中对EAD或OAD的不同前处理方法[11, 22, 24, 28-29],以选择较优的前处理方法实现物质的快速灵敏检测。
超声提取法可加快样品中目标物向溶剂中的溶出,从而实现提取效率的提高。超声提取法依照1.4.2的步骤进行超声提取实验[11]。
溶解法通过溶剂将试样溶解制成溶液,进而使目标物与原试样分离。由于复合包装材料中的PPH(熔点156 ℃)和铝箔层(熔点660 ℃)熔点较高,采用二甲苯等有机溶剂加热溶解提取目标物很难进行。称取样品0.1 g(精确到0.000 1 g,约0.2 cm×0.2 cm)于平底烧瓶中,加入25 mL二甲苯,在电热板上加热[24],随后将其定容至25 mL,取1 mL上清液氮吹干,再用1 mL乙醇复溶、振荡、离心、上机分析。
回流萃取法通过萃取装置进行回流萃取,进而分离出目标物。称取样品0.1 g(精确到0.000 1 g,约0.2 cm×0.2 cm)于平底烧瓶中,加入搅拌子和25 mL二氯甲烷/环己烷混合试剂(体积比75∶25),用回流萃取装置搅拌回流90 min。完成回流萃取后将平底烧瓶连带冷凝管从加热板移开,待溶液冷却至室温后容至25 mL,取1 mL上清液氮吹干,再用1 mL乙醇复溶、振荡、离心、上机分析[22]。
如图2所示,超声提取法对铝塑膜中的EAD和OAD提取能力最好(P<0.05)。通常认为将薄膜溶解可以促进目标物的溶出,但复合膜的熔点较高不易溶解,且目标物难溶于二甲苯,因此溶解法在此较难进行。故本实验选用超声提取法。
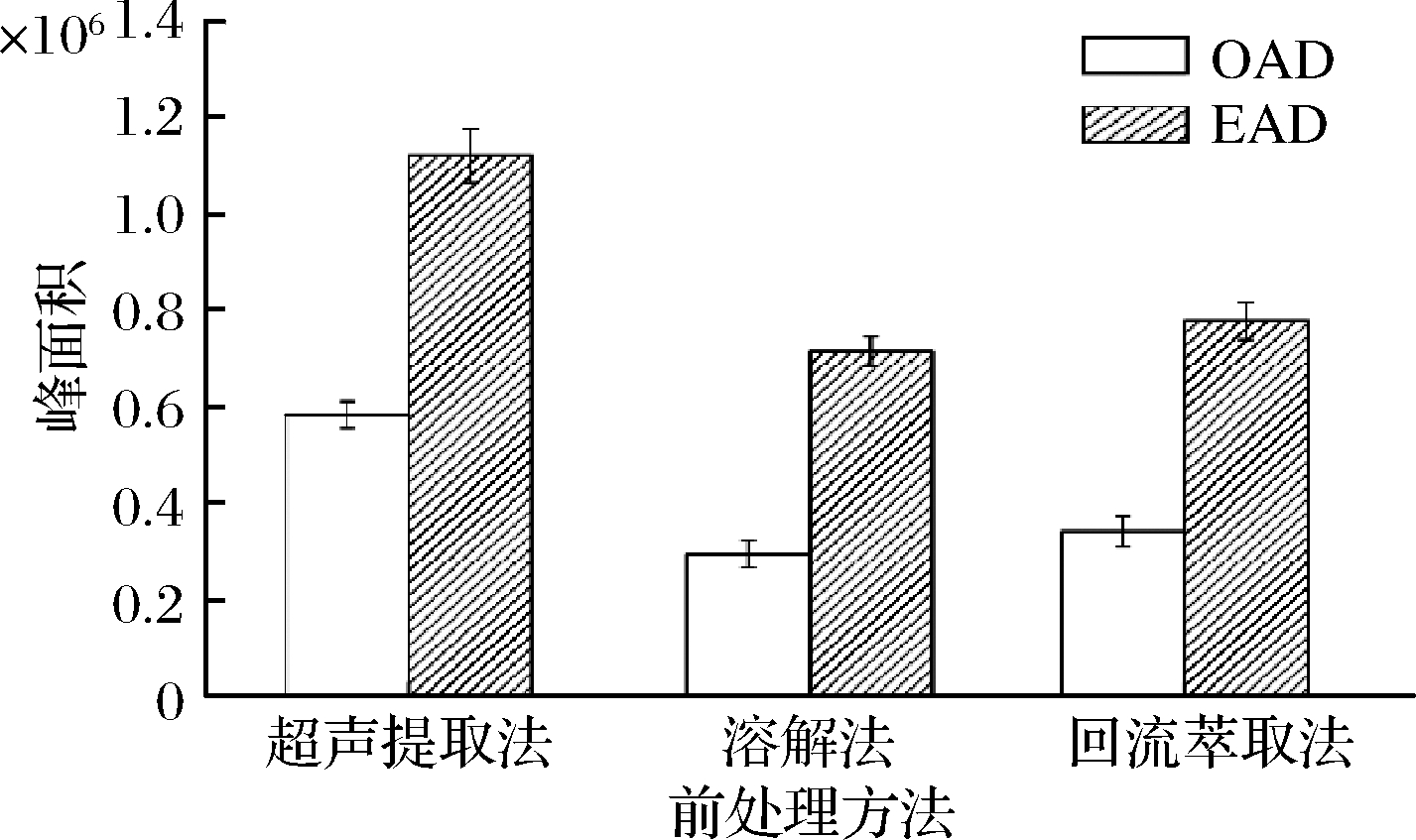
图2 前处理方法对复合膜中EAD和OAD
提取能力的影响
Fig.2 Effects of pretreatment methods on extraction
capability of EAD and OAD from composite film
2.4 提取溶剂的优化
基于上述实验结果,选用超声提取法作为前处理方法,比较了甲醇、乙醇、丙酮、二氯甲烷、正己烷对阳性铝塑复合膜中EAD和OAD的提取效果,目的在于选取一种对阳性铝塑复合膜中的EAD和OAD均具有良好提取效果的溶剂。依照1.4.2的步骤选择不同溶剂进行超声提取实验,结果如图3所示,乙醇对样品中OAD的提取效果同其他4种溶剂存在显著性差异(P<0.05),故选择乙醇作为提取溶剂。

图3 提取溶剂对复合膜中EAD和OAD提取能力的影响
Fig.3 Effects of extraction solvent on extraction
capability of EAD and OAD from composite film
2.5 提取时间的优化
选取乙醇为提取溶剂,对超声时间进行优化。称取0.1 g(精确到0.000 1 g,约0.2 cm×0.2 cm)于试管,加入10 mL乙醇,分别超声提取20、30、40、50、60、70、80 min,将提取液定容至10 mL,离心后上机分析。如图4所示,在超声时间为20~60 min时,乙醇对样品中EAD和OAD的提取效果随时间的延长而增加;超声时间为60 min时,EAD的提取效果达到最大值存在显著性差异(P<0.05);超声时间超过60 min后,超声时间对目标物的提取能力无显著增加。故选择60 min作为最优提取时间。随着超声时间的延长,OAD的提取效果较EAD的变化缓慢,这可能是因为OAD分子质量较小且分子链较短,大部分OAD在薄膜制备过程中已经迁移到薄膜表面[5-7, 9],因此薄膜表面的OAD可在短时间内被超声提取出来,而EAD则需要更长的提取时间。
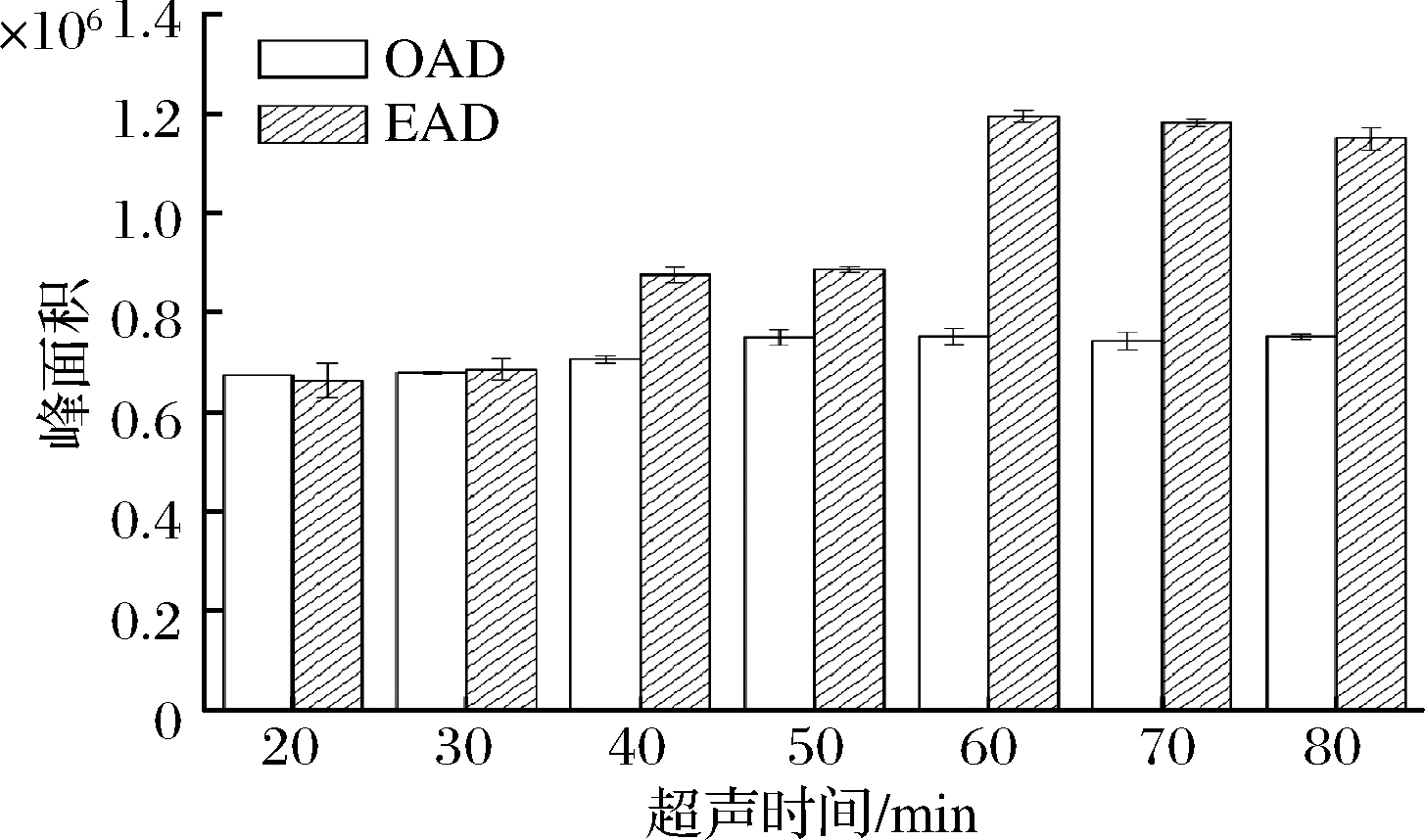
图4 超声时间对复合膜中EAD和OAD提取能力的影响
Fig.4 Effects of ultrasonic time on extraction capability of EAD and
OAD from composite film
2.6 提取次数的优化
以乙醇为提取溶剂,提取时间60 min为条件,对超声提取次数进行优化,分别重复提取1、2、3和4次,合并后定容至40 mL,离心后上机分析。由图5可知,2次重复提取效果比1次提取效果好,但继续增加提取次数时,乙醇对EAD和OAD的提取效果无显著性差异(P >0.05),因此本文选择重复提取2次为最优提取次数。
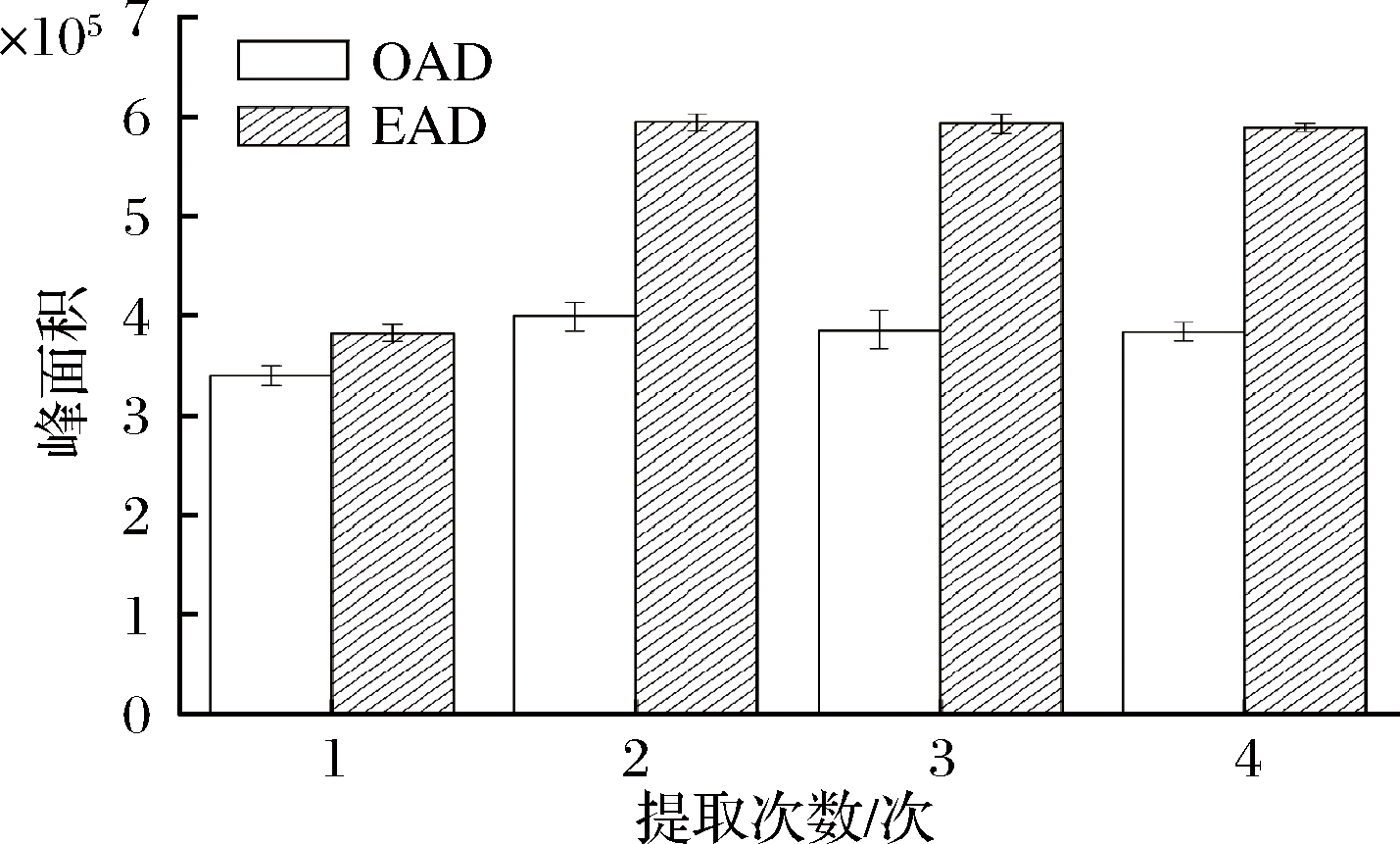
图5 超声提取次数对复合膜中EAD和OAD提取
效果的影响
Fig.5 Effects of ultrasonic extraction times on extraction
capability of EAD and OAD from composite film
2.7 方法验证
以EAD和OAD的质量浓度为横坐标,定量离子峰面积为纵坐标,建立工作曲线,结果表明,在0.1~3.0 mg/L的线性范围内两者的质量浓度与峰面积线性关系良好,相关系数均大于0.995。以信噪比S/N≥3为检出限(limit of detection,LOD),以S/N≥10为定量限(limit of quantitation,LOQ),具体数值如表2所示。
表2 EAD和OAD的线性方程、相关系数、线性范围、方法检出限和方法定量限
Table 2 Linear equations, correlation coefficients, linearity range, LOD and LOQ of EAD and OAD

化合物线性方程线性范围/(mg·L-1)相关系数R2检出限/(mg·L-1)定量限/(mg·L-1)芥酸酰胺y=368 571.258 898x+46 872.597 5100.1~3.00.9950.010.03油酸酰胺y=332 150.181 256x+52 305.231 5200.1~3.00.9960.020.05
在加标回收试验中,EAD和OAD的平均回收率为82%~116%,相对标准偏差(RSD)为4.1%~9.3%。结果表明该方法具有良好的准确度和精密度,符合分析要求。
2.8 文献中检测方法比较
由表3列出的检测方法与本文方法比较可知,这些检测方法存在检出限高、上机检测时间长和分离效果不佳等不足。因而本文在前人的研究基础上,进一步优化检测方法,通过液相色谱-质谱法建立了铝塑复合膜中EAD和OAD含量的检测方法,上机检测时间为4 min,并且检出限均≤0.02 mg/L。
表3 EAD和OAD的检测方法
Table 3 Detection methods of EAD and OAD
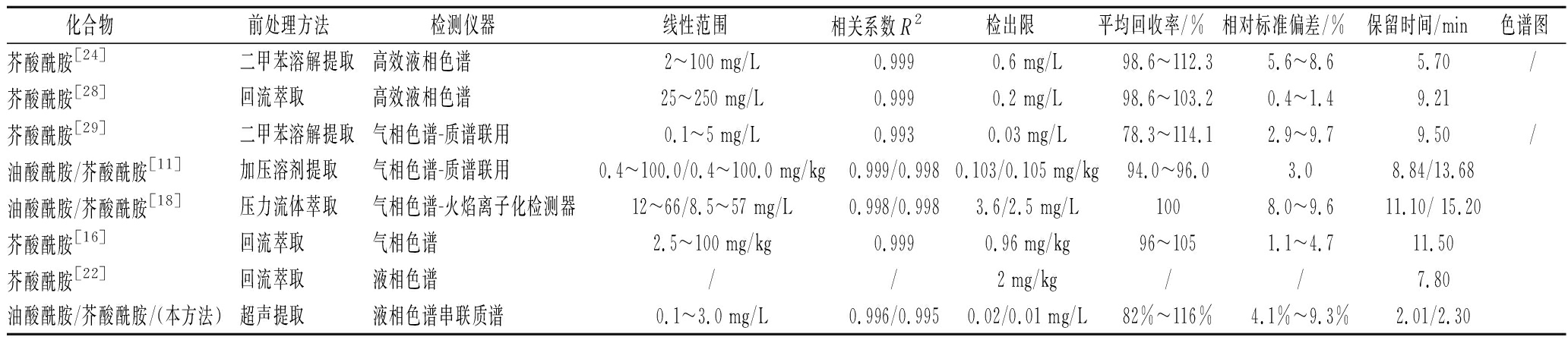
化合物 前处理方法检测仪器线性范围相关系数R2检出限平均回收率/%相对标准偏差/%保留时间/min色谱图芥酸酰胺[24]二甲苯溶解提取高效液相色谱2~100 mg/L0.9990.6 mg/L98.6~112.35.6~8.65.70/芥酸酰胺[28]回流萃取高效液相色谱25~250 mg/L0.9990.2 mg/L98.6~103.20.4~1.49.21芥酸酰胺[29]二甲苯溶解提取气相色谱-质谱联用0.1~5 mg/L0.9930.03 mg/L78.3~114.12.9~9.79.50/油酸酰胺/芥酸酰胺[11]加压溶剂提取气相色谱-质谱联用0.4~100.0/0.4~100.0 mg/kg0.999/0.9980.103/0.105 mg/kg94.0~96.03.08.84/13.68油酸酰胺/芥酸酰胺[18]压力流体萃取气相色谱-火焰离子化检测器12~66/8.5~57 mg/L0.998/0.9983.6/2.5 mg/L1008.0~9.611.10/ 15.20芥酸酰胺[16]回流萃取气相色谱2.5~100 mg/kg0.9990.96 mg/kg96~1051.1~4.711.50芥酸酰胺[22]回流萃取液相色谱//2 mg/kg//7.80油酸酰胺/芥酸酰胺/(本方法)超声提取液相色谱串联质谱0.1~3.0 mg/L0.996/0.9950.02/0.01 mg/L82%~116%4.1%~9.3%2.01/2.30
注:“/”表示文献或标准中未指出
2.9 市场样品的测定
在优化的试验条件下对市场上的11种镀铝复合膜和铝塑复合膜中EAD和OAD的含量进行测定。结果如表4所示,11种样品中均被检测出EAD,5种样品被检测出OAD。80%被检出OAD的样品具有印刷层,因此被检出的OAD可能来自于油墨。
表4 11种样品信息和检测结果(n=3)
Table 4 11 kinds of sample information and test results(n=3)
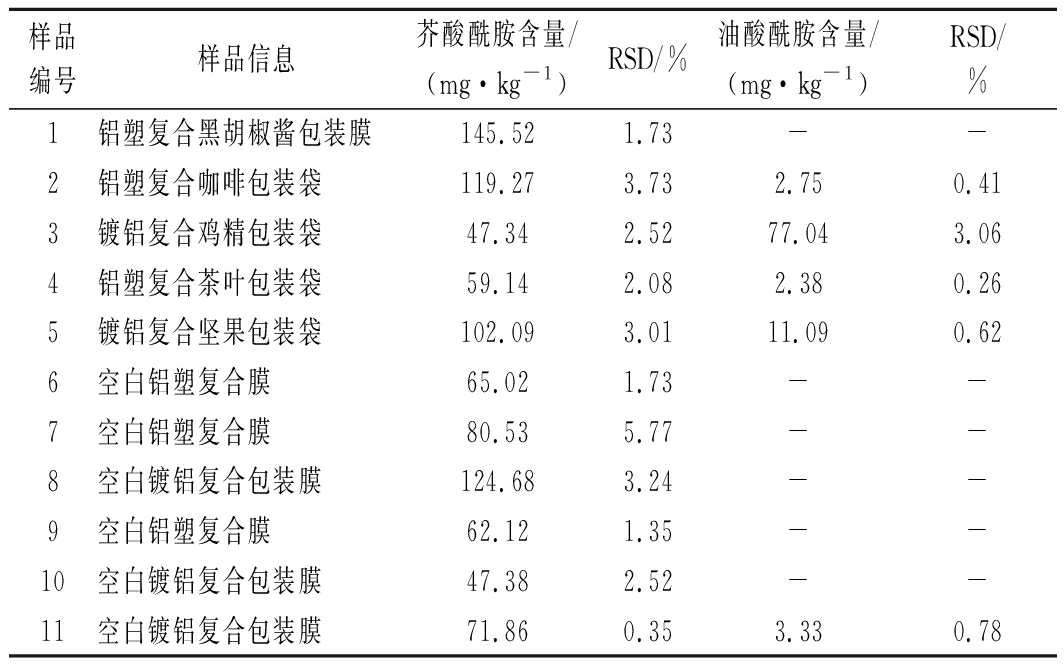
样品编号样品信息芥酸酰胺含量/(mg·kg-1)RSD/%油酸酰胺含量/(mg·kg-1)RSD/%1铝塑复合黑胡椒酱包装膜145.521.73--2铝塑复合咖啡包装袋119.273.732.750.413镀铝复合鸡精包装袋47.342.5277.043.064铝塑复合茶叶包装袋59.142.082.380.265镀铝复合坚果包装袋102.093.0111.090.626空白铝塑复合膜65.021.73--7空白铝塑复合膜80.535.77--8空白镀铝复合包装膜124.683.24--9空白铝塑复合膜62.121.35--10空白镀铝复合包装膜47.382.52--11空白镀铝复合包装膜71.860.353.330.78
注:“空白”表示未经印刷;“-”表示未检出
3 结论
铝塑复合材料具有良好的阻隔性。由于材料开口的困难,EAD和OAD常作为爽滑剂加入铝塑复合膜中,但其可能向食品迁移。本研究建立了超声提取-液质联用法快速检测铝塑复合膜中EAD和OAD的含量。该方法前处理简单,分离度较好,可在4 min内上机快速检测出EAD和OAD,2种物质的检出限均≤0.02 mg/L,定量限均≤0.05 mg/L,线性范围为0.1~3.0 mg/L,优于现有方法。加标回收实验中,EAD和OAD的平均回收率为82%~116%,相对标准偏差为4.1%~9.3%。并检测了市场销售的11种铝塑复合膜,其中EAD的检出率为100%,OAD的检出率为45.5%。通过比较分析7个检测方法与本文检测方法,本文检测方法检出限更低、上机检测时间短、同时检测EAD和OAD且分离效果好,可对市场中的铝塑复合膜中EAD和OAD进行定量分析。
[1] 曾忠斌,于佳佳,陈欣.铝塑与镀铝复合膜包材耐揉搓性研究[J].中国包装, 2013,33(10):56-58.
[2] 徐冰,陈志雄,吴育荣.铝塑复合软包装材料干式复合的工艺控制[J].塑料制造, 2011(6):69-73.
[3] WAKABAYASHI M,KOHNO T,TANA Y,et al.Study on the bleeding mechanism of slip agents in a polypropylene film using molecular dynamics[J].International Polymer Processing,2009,24(2):133-139.
[4] 郭锐,王群涛,王日辉,等.开口剂对LLDPE薄膜性能的影响[J].合成树脂及塑料,2013,30(6):56-58.
[5] 张娟,赵允,钟锦标,等.爽滑剂在塑料螺纹盖中的应用现状[J].塑料制造,2016(5):64-67.
[6] SHI Ting,DING Wei,KESSLER D W,et al.Investigation of air-liquid interface rings in buffer preparation vessels: The role of slip agents[J].PDA Journal of Pharmaceutical Science and Technology,2016,70(3):272-281.
[7] FARAJZADEH M A,EBRAHIMI M, RANJI A,et al.HPLC and GC methods for determination of lubricants and their evaluation in analysis of real samples of polyethylene[J].Microchimica Acta,2006,153(1-2):73-78.
[8] DULAL N,SHANKS R,CHALMERS D,et al.Migration and performance of erucamide slip additive in high-density polyethylene bottle caps[J].Journal of Applied Polymer Science,2018,135(43):46 822.
[9] 任晓兵.开口爽滑剂在低密度聚乙烯薄膜中的应用[J].当代化工,2017,46(1):173-176.
[10] 何金凤,吕新广,林勤保,等.聚乳酸发泡餐盒中两种爽滑剂向食品模拟物的迁移[J].食品与发酵工业,2019,45(7):123-129.
[11] LYU G,WANG L,LIU J,et al.Method for determination of fatty acid amides in polyethylene packaging materials-gas chromatography/mass spectrometry[J].Journal of Chromatography A,2009,1 216(48):8 545-8 548.
[12] FEKETE Z,ROFUSZ T,ANGYAL V,et al.Gas chromatographic-mass spectrometric analysis and subsequent quality improvement of plastic infusion packaging materials[J].J Pharm Biomed Anal,2014,97:111-115.
[13] 郭长彬,宋宏锐.内源性睡眠诱导物质油酰胺的研究进展[J].中国药物化学杂志,2000(4):68-72.
[14] HILEY C R,HOI P M.Oleamide:A fatty acid amide signaling molecule in the cardiovascular system?[J].Cardiovascular Drug Reviews, 2007,25(1):46-60.
[15] 晏嫣,张阳,姜德玮,等.超高效液相色谱-串联质谱法测定食品接触材料中油酸酰胺的迁移量[J].食品安全质量检测学报, 2019,10(6):1 710-1 714.
[16] 郝萍,王海,韩晓昱,等.用气相色谱法测定高密度聚乙烯中爽滑剂芥酸酰胺的含量[J].石化技术与应用,2013,31(1):71-73.
[17] GARRIDO-LOPEZ A,ESQUIU V,TENA M T.Comparison of three gas chromatography methods for the determination of slip agents in polyethylene films[J].Journal of Chromatography A,2007,1 150(1-2):178-182.
[18] GARRIDO-LOPEZ A,ESQUIU V,TENA M T.Determination of oleamide and erucamide in polyethylene films by pres-surised fluid extraction and gas chromatography[J].Journal of Chromatography A,2006,1 124(1-2):51-56.
[19] 于文涛,金明杰,李艳,等.GC-MS直接测定芥酸酰胺[J].分析试验室,2009,28(2):120-122.
[20] 房宁,王子剑,赵劲松,等.气相色谱-质谱法测定食品接触材料润滑剂在脂类食品模拟物中迁移量[J].中国食品卫生杂志, 2016,28(3):319-322.
[21] SN/T 1504.2—2017 食品容器、包装用塑料原料 第2部分:聚乙烯中抗氧化剂和芥酸酰胺爽滑剂的测定 液相色谱法[S].天津:国家质量监督检验检疫局总局,2018.
[22] GB/T 25277—2010塑料 均聚聚丙烯(PP-H)中酚类抗氧剂和芥酸酰胺爽滑剂的测定 液相色谱法[S].北京:国家质量监督检验检疫局总局和中国国家标准化管理委员会,2011.
[23] MORETA C,TENA M. Determination of plastic additives in packaging by liquid chromatography coupled to high resolution mass spectrometry[J].Journal of Chromatography A,2015,1 414:77-87.
[24] 朱丽娴,林勤保,钟怀宁,等.聚乙烯薄膜中芥酸酰胺的测定及其稳定性研究[J].包装工程, 2018,39(7):86-90.
[25] 麻玉龙,黄晓枭,王聚恒,等.芥酸酰胺对三元PP薄膜材料性能的影响[J].塑料工业,2018,46(1):91-94.
[26] LI B,WANG Z W,LI Q B,et al.Simultaneous determination of antioxidants and ultraviolet stabilizers in polypropylene food packaging and food simulants by high-performance liquid chromatography[J].Acta Chromatographica,2016,29(2):173-192.
[27] 陈岑,黄柳倩,程巧鸳,等.基于QuEChERS提取的高效液相色谱-串联质谱法同时测定4种不同基质类型化妆品中15种硝基咪唑类禁用药物[J].分析测试学报,2019,38(11):1 285-1 293.
[28] 杨璐,周国桁,焦毅,等.高效液相色谱内标法检测塑料中芥酸酰胺[J].分析仪器,2019(2):66-69.
[29] 王旖旎,林勤保,钟怀宁,等.低密度聚乙烯薄膜中芥酸酰胺的检测及其向食品模拟物的迁移[J].中国塑料, 2018,32(4):118-124.