灵武长枣以鲜食为主,皮薄、多汁,鲜销期短,采后储运不当,腐败现象严重。已有研究发现,交链格孢(Alternaria alternata)、灰葡萄孢(Botrytis cinerea)、黑根霉(Rhizopus stolonifer)、皮落青霉(Penicillium crustosum)和微孢毛霉(Mucor microsporus)等[1]病原真菌侵染是导致灵武长枣采后腐烂的重要因素。目前,灵武长枣采后保鲜多以低温冷藏和化学杀菌剂为主。但低温冷藏成本较高,能耗高,温度调控不当易引发果实冷害,果品质量不稳定[2];化学杀菌剂保鲜因存在果品污染、农药残留超标、健康威胁及增加病原菌的抗药性等问题也备受消费者抵制[3]。因此,寻求安全、有效的灵武长枣采后防腐保鲜新技术迫在眉睫。
芽孢杆菌(Bacillus)是一类好氧性革兰氏阳性细菌,其分布广泛、生长快、抗逆性强、存活率高、是重要的生防资源[4-5]。此外,还能分泌多种抗生物质抑制病原菌,提高植株的抗病性,促进植物的生长[6-7]。近年来,利用芽孢杆菌作为一种绿色果蔬保鲜剂逐渐成为一种趋势[8],大量研究表明,芽孢杆菌可以有效抑制桃褐腐病菌(Monilinia fructicola)[9]、梨黑斑病菌(Alternaria kikuchiana)[10]、白菜黑斑病菌(Alternaria brassicae) [11]及番茄灰霉病菌(Botrytis cinerea)[12]等多种果蔬采后病原真菌,但有关利用芽孢杆菌来防治灵武长枣采后致腐真菌的研究尚未见报道。
本研究以实验室前期从宁夏温棚土壤中分离的2株拮抗芽孢杆菌菌株YBGJ1和YBGJ2为材料,采用形态学、生理生化和分子生物学相结合的方法,确定2株拮抗芽孢杆菌的分类地位,并通过皿内对峙培养和离体保鲜试验探究2株拮抗芽孢杆菌对灵武长枣采后致腐真菌的抑菌作用和对灵武长枣的保鲜效果,以此评估拮抗芽孢杆菌菌株YBGJ1和YBGJ2在灵武长枣生产保鲜中的应用价值,以期为灵武长枣采后致腐病害的生物防治提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试材料
供试拮抗芽孢杆菌和化学杀菌剂:拮抗芽孢杆菌菌株YBGJ1和YBGJ2,分离自宁夏温棚土壤中,经纯化后,保存于宁夏大学植物病理实验室;50%多菌灵,购于江苏三山农药有限公司。
供试致腐真菌:交链格孢A. alternata和灰葡萄孢B. cinerea纯化菌种,从采后腐烂的灵武长枣上分离,经纯化后,保存于宁夏大学植物病理实验室。
供试果品:2019年9月~11月,在宁夏灵武市大泉林场采摘大小一致、无病虫害及机械损伤的8成熟灵武长枣(红色面积占枣果总面积的1/2~2/3)用于保鲜试验。
1.1.2 仪器与设备
Olympus BX53正置荧光显微镜,日本Olympus公司;Bio-Rad T100梯度聚合酶链式反应(polymerase chain reaction,PCR)仪,美国Bio-Rad公司;Centrifuge 5804R冷冻高速离心机,德国Eppendorf公司;Sciencetool R300真空抽滤泵,美国Sciencetool公司。
细菌基因组DNA提取试剂盒、LB液/固体培养基,北京天根生化科技有限公司;革兰氏染色液,北京索莱宝科技有限公司;10×EasyTaq buffe、dNTPs、EasyTaq DNA Polymerase,北京全式金生物技术有限公司。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,北京陆桥技术股份有限公司;营养琼脂(nutrient agar,NA)培养基,青岛海博生物技术有限公司。
1.1.3 引物
采用细菌16S rDNA基因组序列设计引物,引物序列为27F/1492R(5′-AGAGTTTGATCATGGCTCAG-3′)/(5′-TACGGTTACCTTGTTACGACTT-3′),上海生工生物有限公司合成。
1.2 试验方法
1.2.1 芽孢杆菌菌株鉴定
1.2.1.1 拮抗芽孢杆菌形态学和生理生化指标
形态特征观察及生理生化试验参照《常见细菌系统鉴定手册》(东秀珠2001版)。具体方法为取纯化好的拮抗芽孢杆菌菌株YBGJ1和YBGJ2在NA培养基平板上划线,30 ℃培养12 h,观察菌落形状、颜色和透明度等。继续培养12 h后,挑取菌株单菌落进行革兰氏染色,在油镜1 000倍下观察菌体形态。
采用东秀珠等[13]的方法,测定拮抗芽孢杆菌菌株YBGJ1和YBGJ2的最适生长温度、最适PH值、糖(醇)类发酵试验、氧化酶反应、接触酶反应、耐盐性试验、硝酸盐还原、淀粉水解、明胶液化、M·R试验、V-P测定、柠檬酸盐利用和吲哚试验等生理生化指标。
1.2.1.2 拮抗芽孢杆菌分子生物学鉴定
(1)拮抗芽孢杆菌DNA提取
将纯化好的拮抗芽孢杆菌菌株YBGJ1和YBGJ2在NA平板上活化培养16 h,用灭菌牙签挑取单菌落置于装有3 mL LB液体培养基的灭菌试管中,30 ℃,200 r/min培养24 h,获得细菌培养液。参照TIANGEN细菌基因组DNA提取试剂盒说明提取菌株YBGJ1和YBGJ2的总DNA。
(2)PCR反应体系及扩增条件
PCR反应体系(25 μL):EasyTaq buffer (10×) 2.5 μL、dNTPs (2.5 mmol/L) 2 μL、 27F/1492R引物(10 μmol/L)各1 μL、DNA模板1 μL、EasyTaq DNA Polymerase 0.25 μL,补充ddH2O至25 μL。PCR反应程序:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35个循环,72 ℃保温10 min,4 ℃保藏。扩增产物于1.0%(质量分数)琼脂糖凝胶电泳中检测。PCR扩增产物回收后送至上海生工生物有限公司进行测序。
(3)系统发育树分析
将拮抗芽孢杆菌菌株YBGJ1和YBGJ2的测序所得序列与GenBank数据库中近缘种的16S rDNA基因序列进行同源性比对,利用DNAMAN 6.0.3.48软件中邻接法(Neighbor-Joining methods,NJ)构建系统发育树。
1.2.2 拮抗芽孢杆菌培养滤液的抑菌活性
1.2.2.1 培养滤液的制备
挑取预先培养18 h的拮抗芽孢杆菌菌株YBGJ1和YBGJ2的单菌落,置于装有150 mL灭菌LB液体培养基的三角瓶中,30 ℃,200 r/min培养3 d,将培养好的发酵液(3.2×107 CFU/mL)于6 000 r/min离心20 min,上清液经0.45 μm的微孔滤膜过滤,获得培养滤液,4 ℃保存备用。
1.2.2.2 培养滤液对致腐真菌菌丝生长的抑制作用
采用菌丝生长速率法进行抑菌测定[14]。将拮抗芽孢杆菌菌株YBGJ1和YBGJ2的培养滤液与冷却至50 ℃左右的灭菌LB固体培养基混匀,分别配制成培养滤液体积分数为5%、10%、15%、20%、25%和30%的LB平板,无菌水处理为对照,凝固后,在平板中央放置1个直径6 mm的致腐真菌菌饼。每组处理重复3次,置于28 ℃霉菌培养箱中培养,待对照致腐真菌菌丝满皿后,测量对照和各处理的致腐真菌半径,计算菌丝抑制率。
菌丝抑制率![]()
(1)
式中:Rc,对照致腐真菌半径;Rp,各处理致腐真菌半径。
1.2.2.3 培养滤液对致腐真菌孢子萌发的抑制作用
致腐真菌孢子悬浮液的制备:将致腐真菌菌株接种至PDA培养基上,25 ℃黑暗培养5 d,进行菌种活化。加入5 mL无菌水冲洗PDA培养平板,收集菌丝和孢子混液,用双层无菌纱布过滤,除去菌丝,得到致腐真菌孢子悬浮液。用血球板计数法,将致腐真菌孢子悬浮液稀释至1×105 CFU/mL,接种备用。
致腐真菌孢子抑制率测定:将拮抗芽孢杆菌菌株YBGJ1和YBGJ2的培养滤液分别配制成体积分数为20%、40%、60%、80%和100%备用。将配制好的不同体积分数的拮抗芽孢杆菌培养滤液与致腐真菌孢子悬浮液按体积比1∶1混合,使拮抗芽孢杆菌菌株培养滤液的最终体积分数分别为10%、20%、30%、40%和50%,设无菌水和致腐真菌孢子悬浮液混合为对照,每组处理重复3次,30 ℃黑暗培养8 h,每个重复在光学显微镜(400倍)下随机观察5个视野,每个视野下随机观察20个孢子,统计孢子的萌发率和孢子萌发抑制率,计算如公式(2)所示:
孢子萌发抑制率/%=
(2)
1.2.3 离体保鲜试验
将健康的灵武长枣用无菌水轻微冲洗2次,祛除表面灰尘后置于吸水纸上晾干。分别用无菌水、50%(体积分数)多菌灵500倍液、拮抗芽孢杆菌菌株YBGJ1和YBGJ2培养滤液(体积分数10%、20%、30%、40%、50%)浸果1 min,自然晾干,装入20 μm厚保鲜袋中,预先在保鲜袋两侧均匀扎10个针孔(失去气调作用),每袋12颗果,共处理48袋,置于15 ℃冷藏柜中贮藏,每组处理重复4次。每隔5 d观察腐烂情况并统计腐烂率。参照张淑萍等[15]的方法统计灵武长枣贮藏期间腐烂率,果面出现直径>0.3 cm的病斑视为烂果,此类果占统计果实总数的百分比计为腐烂率,以20%腐烂率为临界点,判定灵武长枣失去商品价值。
2 结果与分析
2.1 拮抗芽孢杆菌菌株鉴定
2.1.1 形态学和生理生化指标
拮抗芽孢杆菌菌株YBGJ1和YBGJ2在NA平板上的菌落形态如图1所示。结合菌株形态学(表1)和生理生化特征(表2),参考《常见细菌系统鉴定手册》,初步将菌株YBGJ1和YBGJ2鉴定为枯草芽孢杆菌(Bacillus subtilis)和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
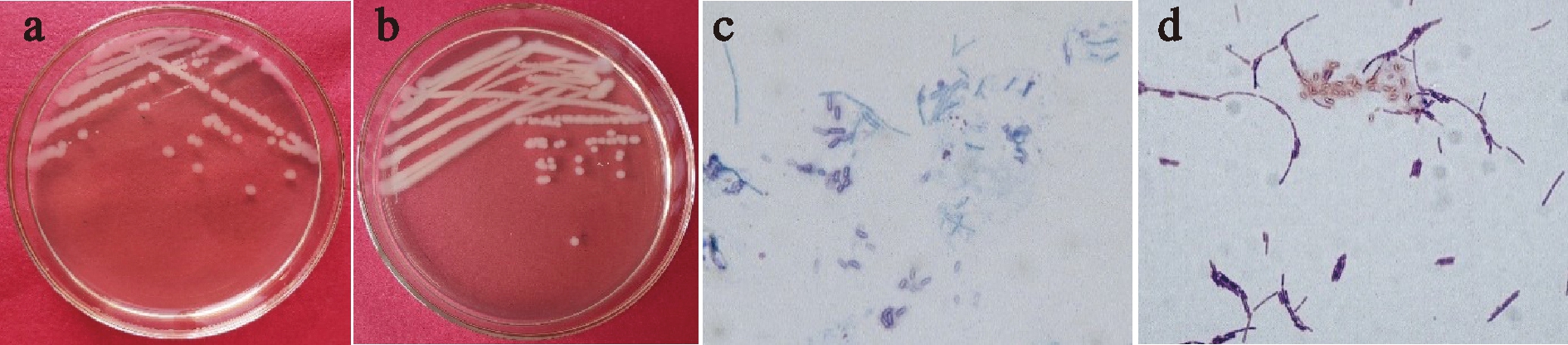
a-菌株YBGJ1菌落形态;b-菌株YBGJ2菌落形态;
c-菌落YBGJ1菌体形态;d-菌株YBGJ2菌体形态
图1 菌株YBGJ1和YBGJ2菌落及菌体形态(1 000×)
Fig.1 Observation of colonies and morphology of strains
YBGJ1 and YBGJ2
表1 菌株YBGJ1和YBGJ2在NA培养基上的菌落特征
Table 1 Colony characteristics of strains YBGJ1 and YBGJ2 on NA medium

菌株形状颜色菌体芽孢质地边缘黏性透明度YBGJ1近圆形污白色短杆状 椭圆或圆柱状表面粗糙 不整齐黏稠不透明YBGJ2圆形 污黄色短杆状,呈短链状排列卵圆形 中凸,表面皱褶整齐 黏稠不透明
表2 菌株YBGJ1和YBGJ2的生理生化特征
Table 2 Characteristics of strain YBGJ1 and YBGJ2

生理生化指标菌株YBGJ1菌株YBGJ2革兰氏染色++耐盐性最适1%~3%最适0~1%最适生长温度37 ℃28~30 ℃最适PH值6.07.0甘露醇++葡萄糖++蔗糖++木糖++氧化酶--接触酶++淀粉水解++硝酸盐还原++V-P测定++柠檬酸盐利用++明胶液化++
注:“+”表示阳性反应;“-”表示阴性反应
2.1.2 分子生物学鉴定
以拮抗芽孢杆菌菌株YBGJ1和YBGJ2的总DNA为模板,采用细菌16S rDNA序列通用引物(27F/1492R)进行PCR扩增,经1.0%琼脂糖凝胶电泳检测后获得2条1 400 bp左右的亮带。将2菌株的测序结果与NCBI中近缘种的16S rDNA基因序列进行同源性比对,构建系统发育树(图2)。按16S rDNA基因序列相似性>97%的菌株归于同一个种的规则,菌株YBGJ1(登录号:MN727140)与枯草芽孢杆菌(B. subtilis) MML5328(登录号:MF688046)的亲缘关系最近,同源率为100%,鉴定为枯草芽孢杆菌(B. subtilis);菌株YBGJ2(登录号:MN727139)与解淀粉芽孢杆菌(B. amyloliquefaciens) TL4(登录号:KY129662)的亲缘关系最近,同源率为100%,鉴定为解淀粉芽孢杆菌(B. amyloliquefaciens)。

图2 菌株YBGJ1和YBGJ2 基于16S rRNA基因序列
建立的系统发育树
Fig.2 Phylogenetic tree of strains YBGJ1 and YBGJ2
based on 16S rRNA gene sequence
2.2 拮抗芽孢杆菌培养滤液对致腐真菌的抑制作用
2.2.1 对致腐真菌菌丝生长的抑制作用
由表3可知,拮抗芽孢杆菌菌株YBGJ1和YBGJ2的培养滤液对交链格孢和灰葡萄孢菌丝生长都具有较好的抑制作用。其中菌株YBGJ1培养滤液体积分数为25%和30%时,对灰葡萄孢的菌丝抑制率均高达95.83%;菌株YBGJ2培养滤液体积分数为20%时,对灰葡萄孢菌丝的抑制率高达95.79%;菌株YBGJ1和YBGJ2培养滤液对交链格孢菌丝的抑制效果明显低于灰葡萄孢,菌株YBGJ1培养滤液体积分数为10%时,菌丝抑制率最高达79.46%;菌株YBGJ2培养滤液体积分数为15%时,对交链格孢菌丝抑制率最高达78.56%。观察平板上致腐真菌菌丝生长情况,发现与对照相比菌丝体长势明显减弱(图3-a和图3-b),菌落稀疏变薄,甚至停止生长(图3-c和图3-d)。
表3 菌株YBGJ1和YBGJ2培养滤液对致腐
真菌菌丝生长的抑制作用
Table 3 Inhibitory effect of culture filtrate of strains
YBGJ1 and YBGJ2 on mycelial growth of rotogenic fungi
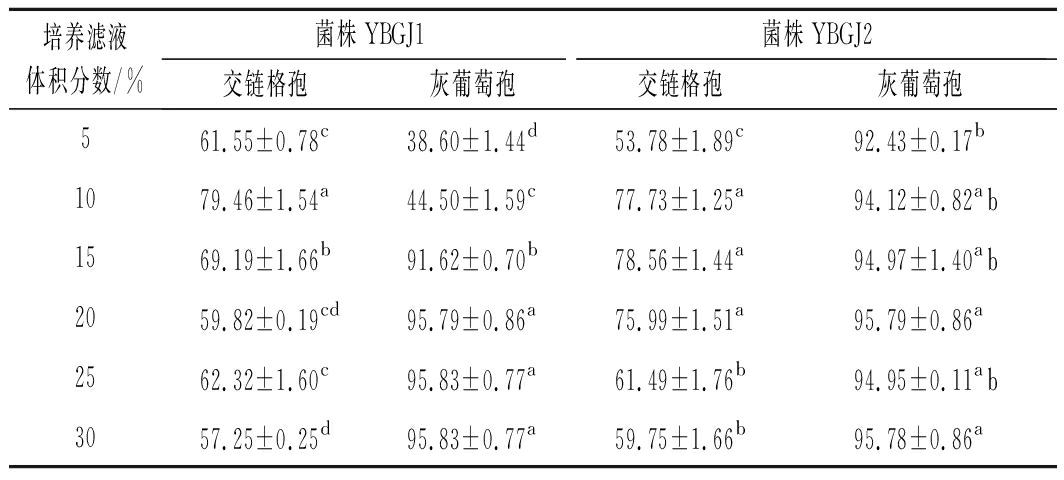
培养滤液体积分数/%菌株YBGJ1菌株YBGJ2交链格孢灰葡萄孢交链格孢灰葡萄孢561.55±0.78c38.60±1.44d53.78±1.89c92.43±0.17b1079.46±1.54a44.50±1.59c77.73±1.25a94.12±0.82ab1569.19±1.66b91.62±0.70b78.56±1.44a94.97±1.40ab2059.82±0.19cd95.79±0.86a75.99±1.51a95.79±0.86a2562.32±1.60c95.83±0.77a61.49±1.76b94.95±0.11ab3057.25±0.25d95.83±0.77a59.75±1.66b95.78±0.86a
注:表中数据为平均菌丝抑菌率±标准误差;同列数据后不同字母表示差异显著 (P<0.05)
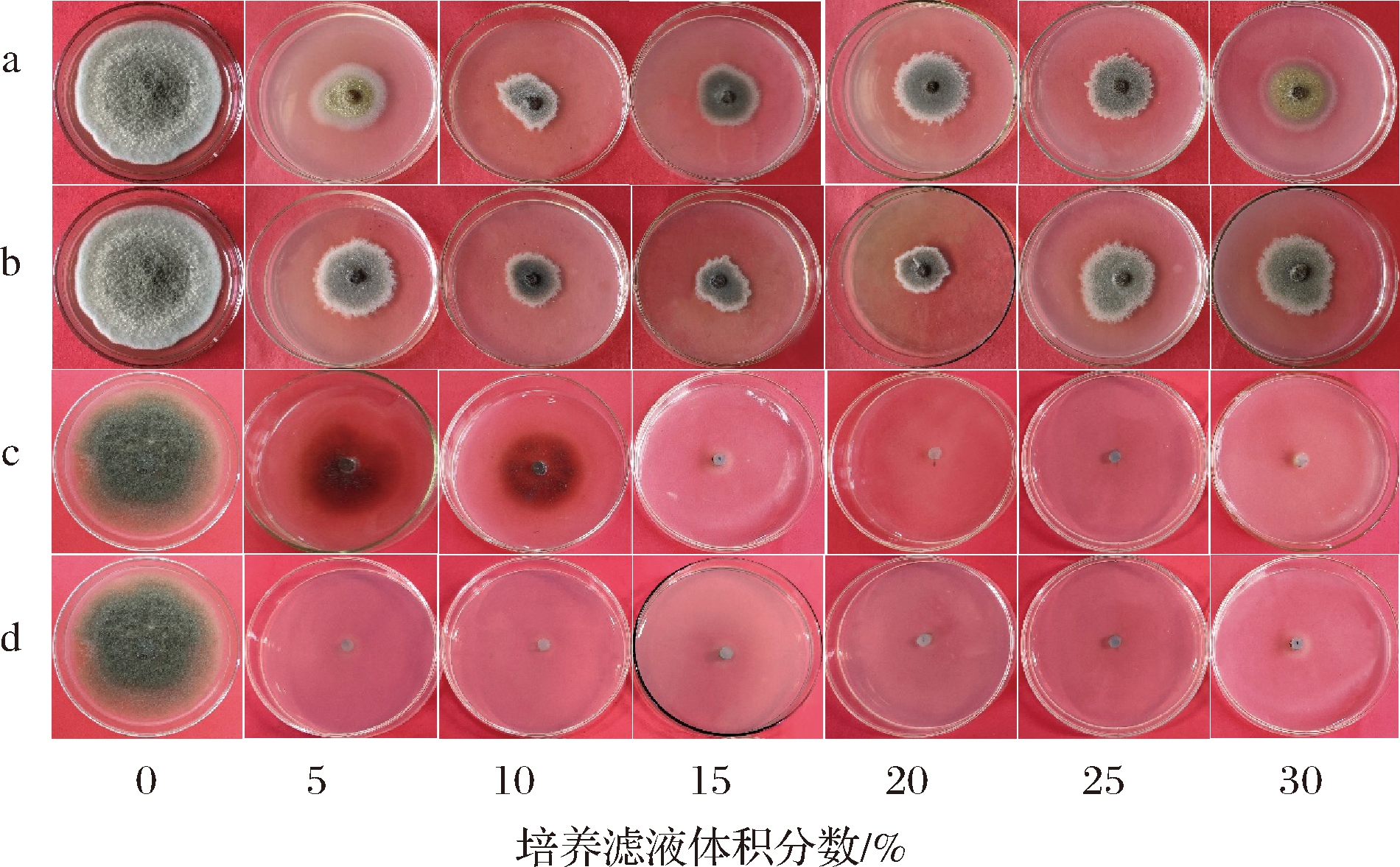
a-菌株YBGJ1培养滤液对峙交链格孢;b-菌株YBGJ2培养滤液
对峙交链格孢;c-菌株YBGJ1培养滤液对峙灰葡萄孢;
d-菌株YBGJ2培养滤液对峙灰葡萄孢
图3 菌株YBGJ1和YBGJ2培养滤液对致腐
真菌菌丝生长的抑制作用
Fig.3 Inhibitory effect of culture filtrate of strains YBGJ1 and
YBGJ2 on mycelial growth of rotogenic fungi
2.2.2 对致腐真菌孢子萌发的影响
由表4可知,拮抗芽孢杆菌菌株YBGJ1和YBGJ2培养滤液对交链格孢和灰葡萄孢的分生孢子萌发均有抑制作用。随着培养滤液体积分数的增加,对致腐真菌的孢子萌发抑制率增强。菌株YBGJ1 和YBGJ2培养滤液体积分数为50%时,对灰葡萄孢的孢子萌发抑制率分别高达85.00%和91.09%,对交链格孢的孢子萌发抑制率分别为80.98%和84.38%;其次,2株芽孢杆菌培养滤液体积分数为40%时,对致腐真菌的孢子萌发抑制率也均达到70.00%以上,由此可以推断,拮抗芽孢杆菌菌株YBGJ1和YBGJ2培养滤液中含有某种抑菌活性物质能显著抑制致腐真菌的生长。
表4 菌株YBGJ1和YBGJ2培养滤液对致腐
真菌孢子萌发的抑制作用 单位:%
Table 4 Inhibitory effect of culture filtrate of strains
YBGJ1 and YBGJ2 on spore germination of rotogenic fungi
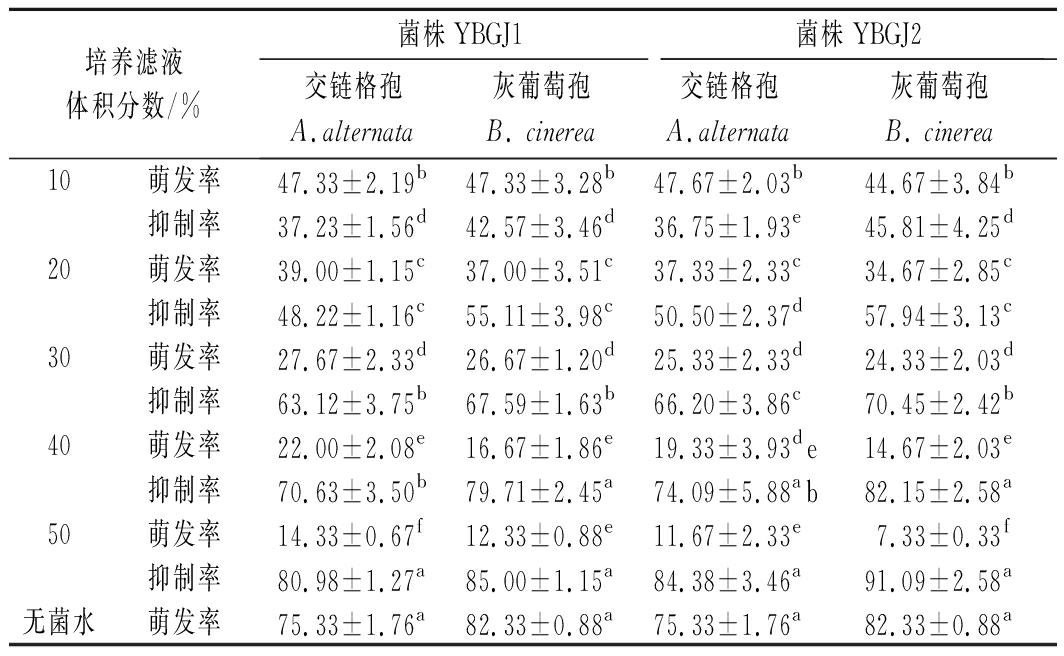
培养滤液体积分数/%菌株YBGJ1菌株YBGJ2交链格孢A.alternata灰葡萄孢B. cinerea交链格孢A.alternata灰葡萄孢B. cinerea10萌发率47.33±2.19b47.33±3.28b47.67±2.03b44.67±3.84b抑制率37.23±1.56d42.57±3.46d36.75±1.93e45.81±4.25d20萌发率39.00±1.15c37.00±3.51c37.33±2.33c34.67±2.85c抑制率48.22±1.16c55.11±3.98c50.50±2.37d57.94±3.13c30萌发率27.67±2.33d26.67±1.20d25.33±2.33d24.33±2.03d抑制率63.12±3.75b67.59±1.63b66.20±3.86c70.45±2.42b40萌发率22.00±2.08e16.67±1.86e19.33±3.93de14.67±2.03e抑制率70.63±3.50b79.71±2.45a74.09±5.88ab82.15±2.58a50萌发率14.33±0.67f12.33±0.88e11.67±2.33e7.33±0.33f抑制率80.98±1.27a85.00±1.15a84.38±3.46a91.09±2.58a无菌水萌发率75.33±1.76a82.33±0.88a75.33±1.76a82.33±0.88a
2.3 离体保鲜试验
由表5和图4离体保鲜试验结果可知,灵武长枣贮藏10 d时,无菌水对照腐烂率达20.84%,已失去商品价值,化学药剂多菌灵、体积分数为30%的YBGJ1培养滤液、体积分数为10%和20%的YBGJ2培养滤液处理的长枣腐烂率均为0。当贮藏30 d时,无菌水对照已全部腐烂,长枣果肉变褐,腐烂现象严重,经体积分数为30%的YBGJ1培养滤液和体积分数为10%的YBGJ2培养滤液处理的长枣达到了贮藏临界点,果面出现腐败斑,果肉由绿变褐,腐烂率分别为29.17%和22.92%,与无菌水对照相比腐烂率分别降低了70.83%和77.08%,延长货架期15~20 d,保鲜效果与化学药剂多菌灵相当。说明在15 ℃贮藏条件下,体积分数为30%的菌株YBGJ1培养滤液和体积分数为10%的菌株YBGJ2培养滤液对灵武长枣具有显著的保鲜效果。
表5 菌株YBGJ1和YBGJ2培养滤液对
灵武长枣采后保鲜效果 单位:%
Table 5 Effect of culture filtrate of strains YBGJ1 and
YBGJ2 on postharvest preservation of
Ziziphus jujube cv. Lingwu changzao

处理贮藏时间/d51015202530无菌水6.25±2.0820.84±2.4043.75±2.0860.42±3.9981.25±2.08100.00±0.0010%YBGJ12.08±2.086.25±2.0816.67±0.0027.08±2.0843.75±2.0858.33±3.40 20%YBGJ10.00±0.004.17±2.4010.42±2.0818.75±2.0833.33±3.4050.00±3.99 30%YBGJ10.00±0.000.00±0.002.08±2.088.33±3.4018.75±2.0829.17±2.4140%YBGJ10.00±0.004.17±2.4010.42±2.0816.67±0.0033.33±3.4047.92±2.0850%YBGJ14.17±2.4110.42±2.0820.83±2.4033.33±3.4050.00±3.4066.67±3.4010%YBGJ20.00±0.000.00±0.000.00±0.004.17±2.4012.50±2.4122.92±2.08 20%YBGJ20.00±0.000.00±0.006.25±2.0816.67±3.4027.08±2.0845.84±2.40 30%YBGJ20.00±0.004.17±2.4012.50±2.4122.92±3.9939.59±2.08 54.25±2.40 40%YBGJ24.17±2.418.33±3.4016.75±2.0829.17±2.4150.00±3.4066.67±3.4050%YBGJ24.17±2.4114.58±2.0833.33±3.4050.00±3.4068.75±2.0885.41±2.08多菌灵0.00±0.000.00±0.000.00±0.006.25±2.0812.50±2.4122.92±2.08
注:表中数据为平均腐烂率±标准误差

a-无菌水的保鲜效果;b-30% YBGJ1的保鲜效果;
c-10% YBGJ1的保鲜效果;d-多菌灵的保鲜效果
图4 菌株YBGJ1和YBGJ2培养滤液对灵武
长枣采后保鲜效果
Fig.4 Effect of culture filtrate of strains YBGJ1 and
YBGJ2 on postharvest preservation of Ziziphus jujube cv.
Lingwu changzao
3 结论与讨论
芽孢杆菌可通过竞争作用、拮抗作用、溶菌作用等方式发挥防病功效,具有防治果蔬采后病害的优势[6]。拮抗菌株YBGJ1和YBGJ2经形态学、生理生化和分子生物学鉴定,证明是枯草芽孢杆菌(B. subtilis)和解淀粉芽孢杆菌(B. amyloliquefaciens)。通过皿内对峙培养发现,拮抗芽孢杆菌菌株YBGJ1和YBGJ2培养滤液对交链格孢(A. alternata)和灰葡萄孢(B. cinerea)的菌丝生长和孢子萌发都具有明显的抑制作用,说明2种菌株培养滤液中含有某种抑菌活性物质能显著抑制致腐真菌的生长。LI等[16]从枯草芽孢杆菌(B. subtilis) B29培养液中分离到抗真菌蛋白B29I,其对尖孢镰刀菌(Fusarium oxysporum)和串珠镰刀菌(Fusarium moniliforme)的菌丝生长和孢子萌发具有较强的抑制作用;向亚萍等[17]从解淀粉芽孢杆菌(B. amyloliquefaciens) B1619的发酵液上清中分离出3 种脂肽类抗生素,并证实bacillomycin L、fengycins和surfactins都对尖孢镰刀菌(F. oxysporum)具有一定的抑制作用。但拮抗芽孢杆菌菌株YBGJ1和YBGJ2培养滤液中是何种活性成分对灵武长枣致腐病原真菌发挥抑菌功效,其是否具有安全性等还尚未明确,仍需进一步研究。
微生物保鲜剂的使用剂量与其保鲜效果有直接关系[18]。陈成等[19]发现采用中浓度(3.5×105 CFU/mL)枯草芽孢杆菌(B. subtilis) ME2菌悬液处理桑椹鲜果的保鲜效果高于低浓度(3.5×103 CFU/mL)和高浓度(3.5×107 CFU/mL)。胡丽杰等[20]将轮状镰刀菌(Fusarium nematophilum) NQ8GII4培养滤液体积分数设置在10%~40%可显著降低枸杞果炭疽病的发病率。本研究在前期离体保鲜预试验中发现,选用菌株YBGJ1和YBGJ2的培养滤液在体积分数10%~40%时对灵武长枣保鲜效果较好,其中体积分数为30%的菌株YBGJ1培养滤液和体积分数为10%的菌株YBGJ2培养滤液保鲜效果最好。培养滤液的体积分数过低或过高时,保鲜效果均不理想,可能是由于体积分数过低时,培养滤液中抑菌成分含量较少,不利于抑制病原菌,而培养滤液体积分数过高时,芽孢杆菌会吸收长枣表面的养分,与宿主处于敌对状态[20],故不利于灵武长枣的保鲜。
本研究发现枯草芽孢杆菌(B. subtilis)和解淀粉芽孢杆菌(B. amyloliquefaciens)可以作为极具前景的果蔬微生物源保鲜剂研发的出发菌种,有望开发成天然、无害、环保的生物制剂。但目前有关枯草芽孢杆菌(B. subtilis) YBGJ1和解淀粉芽孢杆菌(B. amyloliquefaciens) YBGJ2在灵武长枣上的防腐保鲜机理尚未明确,防腐保鲜过程中又受长枣本身生理特性及储藏环境等诸多因素影响,故作为新型果蔬保鲜制剂开发应用还有待深入研究。
[1] 任玉锋, 马爱瑛, 刘雅琴, 等. 灵武长枣采后主要病原真菌的鉴定[J]. 食品研究与开发, 2012, 33(9): 128-130.
[2] 沈雅珉, 何三宁. 鲜枣采后贮藏保鲜技术研究进展[J]. 保鲜与加工, 2016, 16(5): 134-138.
[3] 庞荣丽, 成昕, 谢汉忠, 等. 我国水果质量安全标准现状分析[J]. 果树学报, 2016, 33(5): 612-623.
[4] 赵新林, 赵思峰. 枯草芽孢杆菌对植物病害生物防治的作用机理[J]. 湖北农业科学, 2011, 50(15): 3 025-3 028.
[5] 魏倩, 张娜, 张平, 等. 四种芽孢杆菌对蒜薹灰葡萄孢霉抑制作用的时效性研究[J]. 生物技术通报, 2017, 33(6): 112-120.
[6] 陈志谊. 芽孢杆菌类生物杀菌剂的研发与应用[J]. 中国生物防治学报, 2015, 31(5): 723-732.
[7] 范三红, 李静, 施俊凤. 拮抗菌Burkholderia contaminans对玫瑰香葡萄采后灰霉病的抗性诱导[J]. 食品科学, 2016, 37(2): 266-270.
[8] 张丽霞, 黄开红, 周剑忠, 等. 枯草芽孢杆菌FR4对采后草莓的保鲜效果[J]. 江西农业学报, 2009, 21(9): 124-127.
[9] ZHOU T, SCHNEIDER K E, LI X. Development of biocontrol agents from food microbial isolates for controlling post-harvest peach brown rot caused by Monilinia fructicola[J]. International Journal of Food Microbiology, 2008, 126(1-2): 180-185.
[10] 曹丽亚, 陈大欢, 郭荣艳, 等. 多黏类芽孢杆菌HT16对梨采后黑斑病的抑制效果[J]. 江苏农业科学, 2017, 45(1): 107-110.
[11] 张敏, 庞立, 陈超, 等. 猕猴桃广谱拮抗内生菌分离鉴定及其对樱桃圣女果采后的保鲜作用[J]. 食品工业科技, 2019, 40(4): 112-118.
[12] 段军娜, 黄海, 罗晶, 等. 皮尔瑞俄类芽胞杆菌BC-39对番茄灰霉病的防治效果及防腐保鲜作用[J]. 植物保护学报, 2014, 41(1): 61-66.
[13] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[14] 马志远, 李金岭, 冯志珍, 等. 1株烟草赤星病拮抗芽孢杆菌的鉴定与活性研究[J]. 西北农林科技大学学报(自然科学版), 2012, 40(3): 117-125.
[15] 张淑萍, 张小康, 袁雪, 等. 1-甲基环丙烯对早中熟鲜食枣的保鲜及采后生理效应[J]. 食品科学, 2018, 39(13): 272-279.
[16] LI J, YANG Q, ZHAO L. Purification and characterization of a novel antifungal protein from Bacillus subtilis strain B29[J]. Journal of Zhejiang University (Science B:An International Biomedicine & Biotechnology Journal), 2009, 10(4): 264-272.
[17] 向亚萍, 周华飞, 刘永锋, 等. 解淀粉芽孢杆菌B1619脂肽类抗生素的分离鉴定及其对番茄枯萎病菌的抑制作用[J]. 中国农业科学, 2016, 49(15): 2 935-2 944.
[18] PUSEY P L, WILSON C L. Postharvest biological control of stone fruit brown rot by Bacillus subtilis[J]. Plant Disease, 1984, 68(9): 753-756.
[19] 陈成, 方银, 金超, 等. 枯草芽孢杆菌对桑椹采后致腐微生物的抑菌作用[J]. 蚕业科学, 2016, 42(1): 118-123.
[20] 胡丽杰, 闫思远, 李嘉泓, 等. 枸杞内生真菌对胶孢炭疽菌Colletotrichum gloeosporioides的拮抗作用及生防潜力[J]. 植物保护, 2020, 46(1): 125-133.