涪城麦冬,是原产于四川省绵阳三台县的道地药材。研究表明,麦冬中生物活性成分含量丰富,主要有皂苷、黄酮、氨基酸、核苷、多糖类等物质[1-2]。氨基酸有明显的耐缺氧作用,氨基酸和核苷类成分具有调节免疫力,调节中枢神经、改善细胞代谢等生理活性功能[3-4]。2019年1月,四川省卫生健康委员会发布了“麦冬须根”的食品安全地方标准DBS 51/ 007—2019《食品安全地方标准 麦冬须根》[5],意味着麦冬须根成为四川新的特色食品原料,有望进入“药食同源”目录。
目前,食品中氨基酸的测定国家标准方法为GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》,采用的是茚三酮柱后衍生离子交换色谱仪法[6],需要专有设备,氨基酸自动分析仪,该方法的缺点是前处理过程繁杂,分析时间冗长。文献报道主要的检测方法为氨基酸自动分析仪法[7-8]、茚三酮染色紫外比色法[9-10]、高效液相色谱法[11-12]、近红外光谱法[13-14]、液相色谱-串联质谱法[15-16]。茚三酮比色法用于测定氨基酸总量,对某一组分的氨基酸无法进行检测。高效液相色谱法一般采用柱前衍生法,但前处理较为复杂,需要时间较长。液相色谱-质谱法使用的C18色谱柱,氨基酸保留差,导致分离效果不理想,干扰物质不容易分开。本试验采用亲水作用色谱-串联质谱(hydrophilic interaction chromatography-mass spectrometry,HILIC-MS/MS)对涪城麦冬中的多种氨基酸进行直接测定,优化了前处理方法,能够快速、准确的对氨基酸含量进行分析测定。
1 材料与方法
1.1 材料与仪器
标准物质苯丙氨酸、色氨酸、异亮氨酸、甲硫氨酸、缬氨酸、脯氨酸、酪氨酸、丙氨酸、苏氨酸、甘氨酸、谷氨酰胺、丝氨酸、谷氨酸、天冬氨酸、精氨酸、组氨酸、赖氨酸,中国检验检定科学研究院;标准物质亮氨酸,Dr.Ehrenstorfer GmbH;乙腈、甲酸(色谱纯),Fisher公司;乙酸铵(分析纯),成都科隆。
样品:涪城麦冬共10批。
4000 Q TRAP高效液相色谱-串联质谱仪,美国AB SCIEX公司; ME204T/02电子天平,瑞士梅特勒-托利多有限公司; XSE205电子天平,瑞士梅特勒-托利多有限公司; Direct-Q超纯水机,美国Millipore公司;Poroshell 120 HILIC-Z色谱柱,美国安捷伦科技有限公司。
1.2 试验方法
1.2.1 标准溶液的配制
称取苯丙氨酸、亮氨酸、色氨酸、异亮氨酸、甲硫氨酸、缬氨酸、脯氨酸、酪氨酸、丙氨酸、苏氨酸、甘氨酸、谷氨酰胺、丝氨酸、谷氨酸、天冬氨酸、精氨酸、组氨酸、赖氨酸标准物质各20 mg,置50 mL容量瓶中,加水稀释至刻度,摇匀,制成各氨基酸质量浓度分别为 0.4 mg/mL的混合标准储备液。临用时,吸取适量用水稀释成不同浓度系列的标准溶液。
1.2.2 样品前处理
样品经粉碎后,称取试样0.1 g,于200 mL碘量瓶中,精密加入100 mL超纯水,超声提取(250 W,50 kHz)30 min,冷却,经0.22 μm水系滤膜过滤后,待测定。
1.2.3 液相色谱条件
色谱柱: Agilent InfinityLab Poroshell 120 HILIC-Z(2.1 mm×100 mm,2.7 μm);流速0.4 mL/min;进样量2 μL;柱温30 ℃;流动相A:乙腈、流动相B10 mmol/L乙酸铵溶液(含0.05%甲酸);梯度洗脱见表1。
表1 液相色谱梯度洗脱条件
Table 1 Gradient elution conditions of liquid chromatography
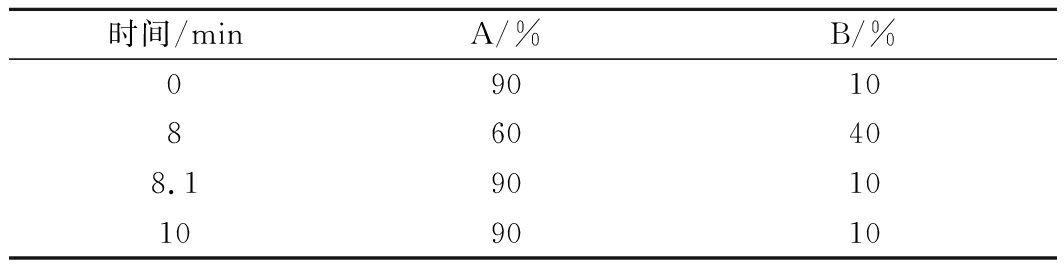
时间/minA/%B/%09010860408.19010109010
1.2.4 质谱条件
离子源:电喷雾电离源;检测方式:多反应监测;扫描方式:正离子扫描; 离子化电压:5 500 V;离子源温度:550 ℃;气帘气压力:25 psi;喷雾器压力:55 psi;辅助加热器压力:50 psi;碰撞器:Medium;碰撞室入口电压:10 V;碰撞室出口电压:12 V;具体参数见表2。
表2 质谱分析参数
Table 2 Mass spectrometric analysis parameters
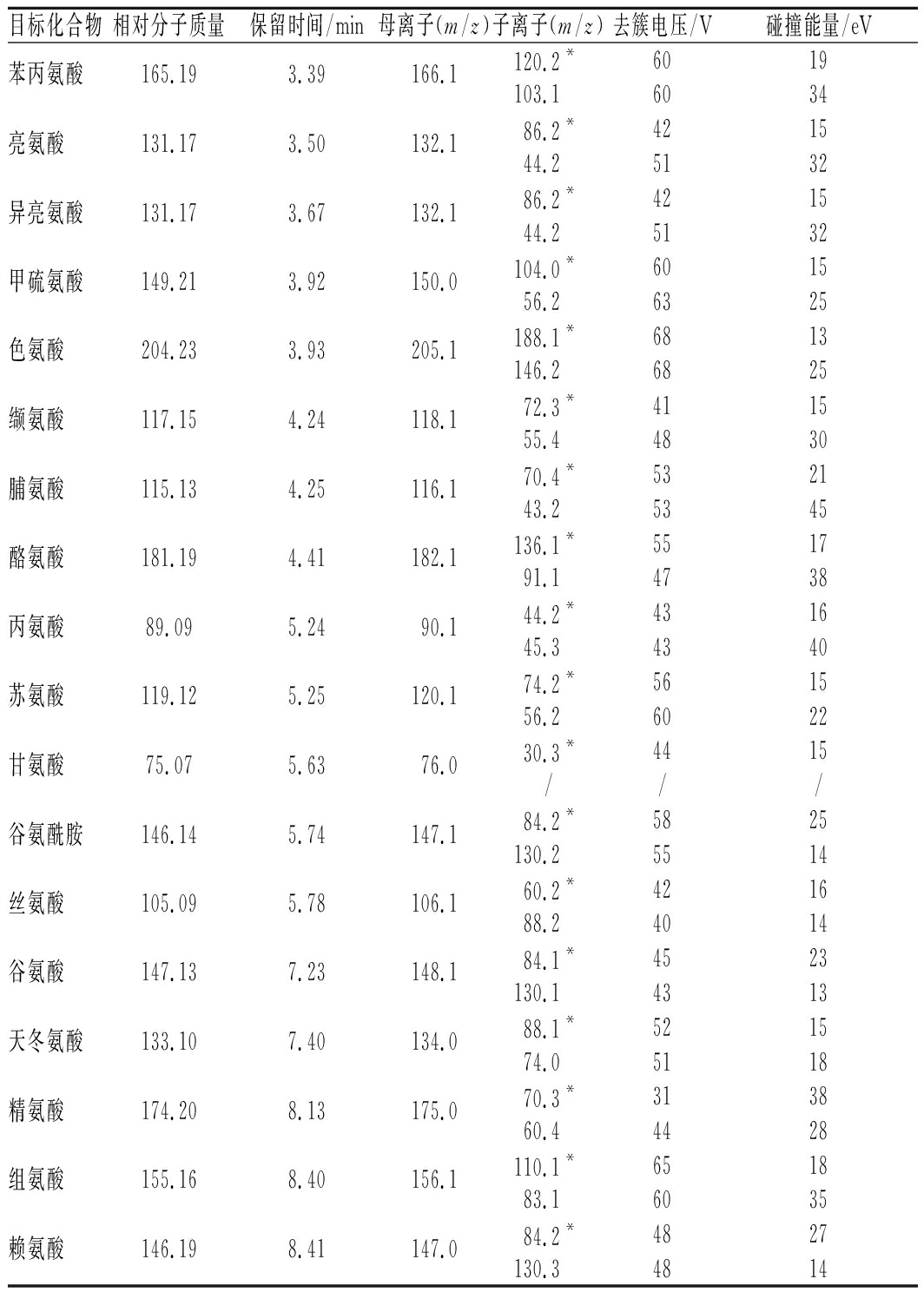
目标化合物相对分子质量保留时间/min母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/eV苯丙氨酸165.193.39166.1120.2*6019103.16034亮氨酸131.173.50132.186.2*421544.25132异亮氨酸131.173.67132.186.2*421544.25132甲硫氨酸149.213.92150.0104.0*601556.26325色氨酸204.233.93205.1188.1*6813146.26825缬氨酸117.154.24118.172.3*411555.44830脯氨酸115.134.25116.170.4*532143.25345酪氨酸181.194.41182.1136.1*551791.14738丙氨酸89.095.2490.144.2*431645.34340苏氨酸119.125.25120.174.2*561556.26022甘氨酸75.075.6376.030.3*4415///谷氨酰胺146.145.74147.184.2*5825130.25514丝氨酸105.095.78106.160.2*421688.24014谷氨酸147.137.23148.184.1*4523130.14313天冬氨酸133.107.40134.088.1*521574.05118精氨酸174.208.13175.070.3*313860.44428组氨酸155.168.40156.1110.1*651883.16035赖氨酸146.198.41147.084.2*4827130.34814
注:*为定量离子
2 结果与分析
2.1 质谱条件的优化
去簇电压和碰撞能量对氨基酸的裂解及灵敏度有重大影响。因此我们优化了每一种氨基酸的质谱条件,以确保其能获得高灵敏度的分析参数。在电喷雾离子源下,采用正离子模式,通过针泵进样,将混合标准溶液泵入质谱仪。第1步选择Q1 MS扫描模式,根据不同氨基酸的相对分子质量及结构,找到对应的母离子,并分别确定母离子的质荷比m/z。第2步调整为Product lon(MS2) 扫描模式,以5 eV为步长,由低到高逐步增加,优化碰撞能量CE,每种氨基酸分别选择2个响应值最强的碎片离子作为子离子。第3步调整扫描模式为多反应监测,选择丰度最大和丰度其次的子离子分别作为每种氨基酸的定量定性离子,确定2组检测离子对,再进一步优化碰撞能量CE和去簇电压DP,确定最佳分析条件,见表2。在该质谱条件下,大部分氨基酸在二级质谱碎片中产生了一个丢失甲酸的碎片离子[M+H-46]+。
2.2 色谱条件的优化
2.2.1 色谱柱的选择
本试验对比了常规的C18色谱柱和HILIC色谱柱的保留行为。首先采用了普通C18色谱柱(3.0 mm×100 mm,3 μm),流动相采用V(乙腈)∶V[10 mmol/L乙酸铵溶液(含甲酸体积分数为0.05%)]=5∶95,但氨基酸具有较强极性,即使在乙腈只占5%的流动相体系中,各氨基酸在普通的C18色谱柱上保留效果及峰形也较差,绝大多数在2 min内出峰,见图1。由于较早的出峰会增加共流出,导致很多强极性物质进入质谱,造成一定的基质效应。
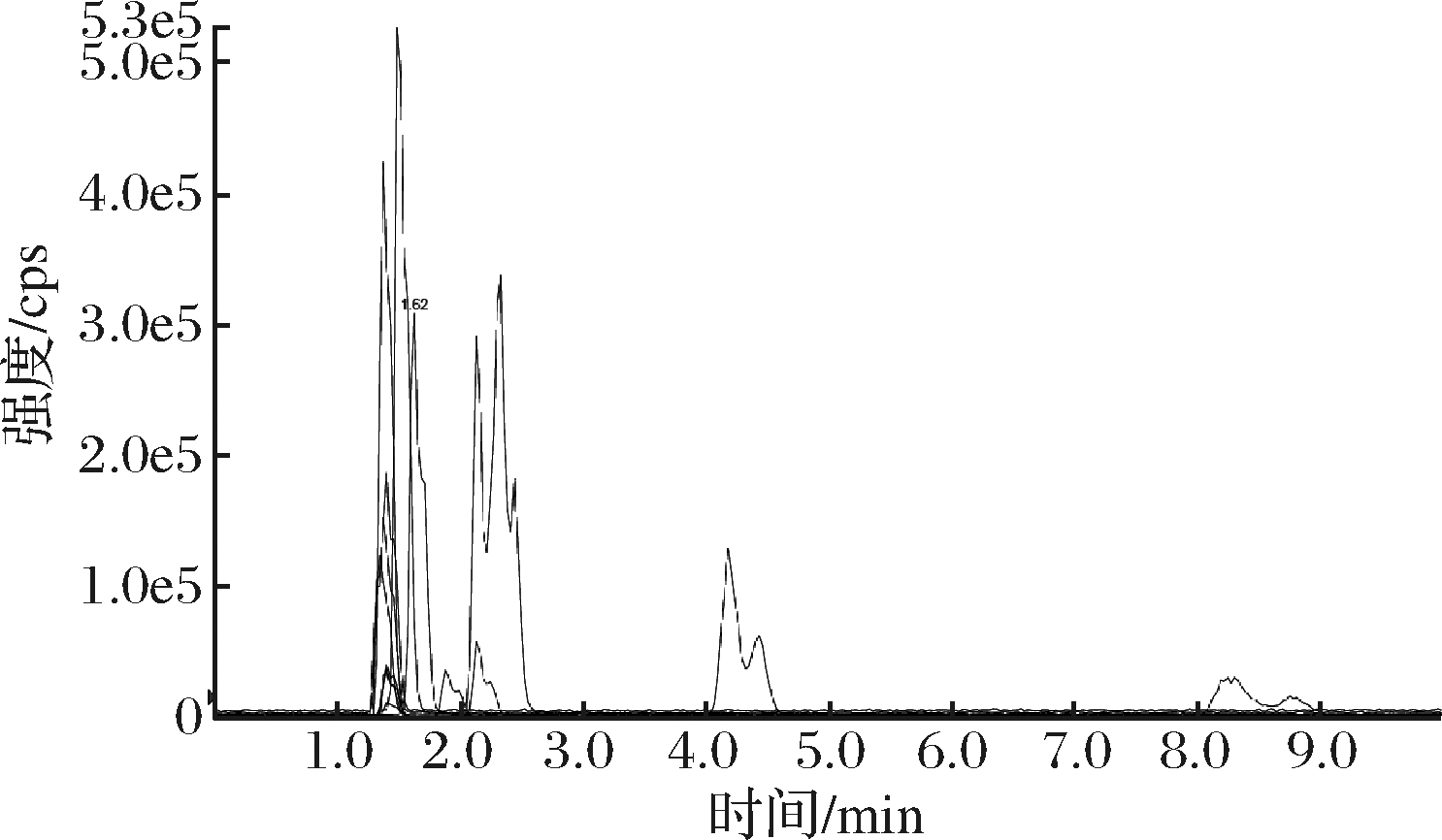
图1 C18色谱柱色谱行为
Fig.1 Chromatographic behavior of the C18 column
低水相及高有机相的流动相模式是HILIC色谱常用的流动相组成,乙腈作为常用的有机相,一般在流动相中的使用比例大于50%,水作为强的洗脱溶剂,这样的组成比例可以提高质谱检测的灵敏度,同时也避免污染较大的离子对试剂的使用,这些决定了HILIC很适合与质谱检测器联用。Poroshell 120 HILIC-Z柱,是一款具有亲水作用的色谱柱,如图2所示,对1 μg/mL的氨基酸混合标准溶液进样,进样量2 μL,用乙腈及10 mmol/L乙酸铵溶液(含甲酸体积分数为0.05%)梯度洗脱,在较短的保留时间内得到了良好的峰形且分离度较好。对于样品中同分异构体亮氨酸和异亮氨酸,也能使色谱峰得到有效分离,见图3。因此选择Poroshell 120 HILIC-Z色谱柱作为本次试验的分离柱。
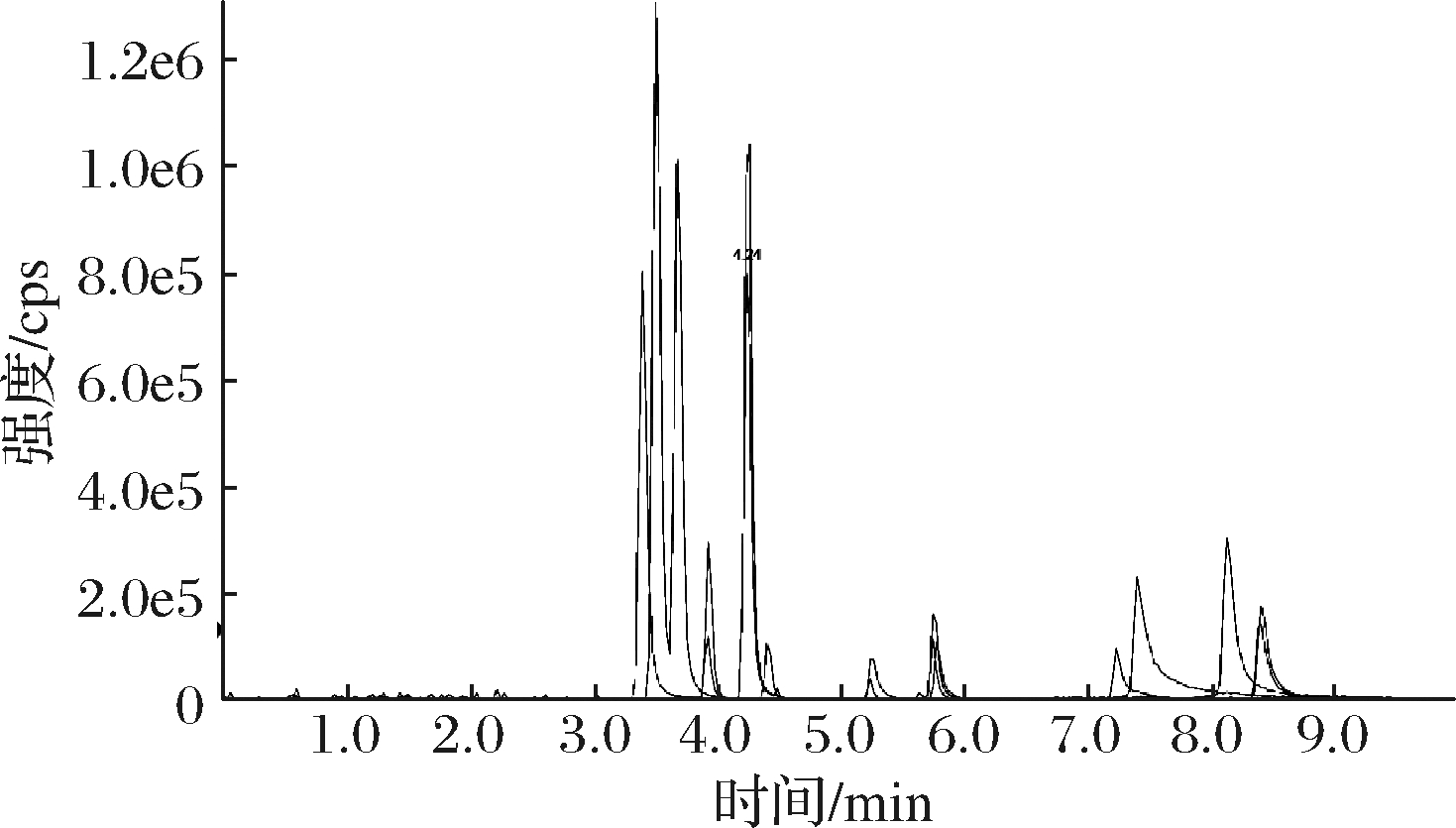
图2 氨基酸混合标准品总离子流图
Fig.2 Total ion chromatgrams of amino acid mixture standards
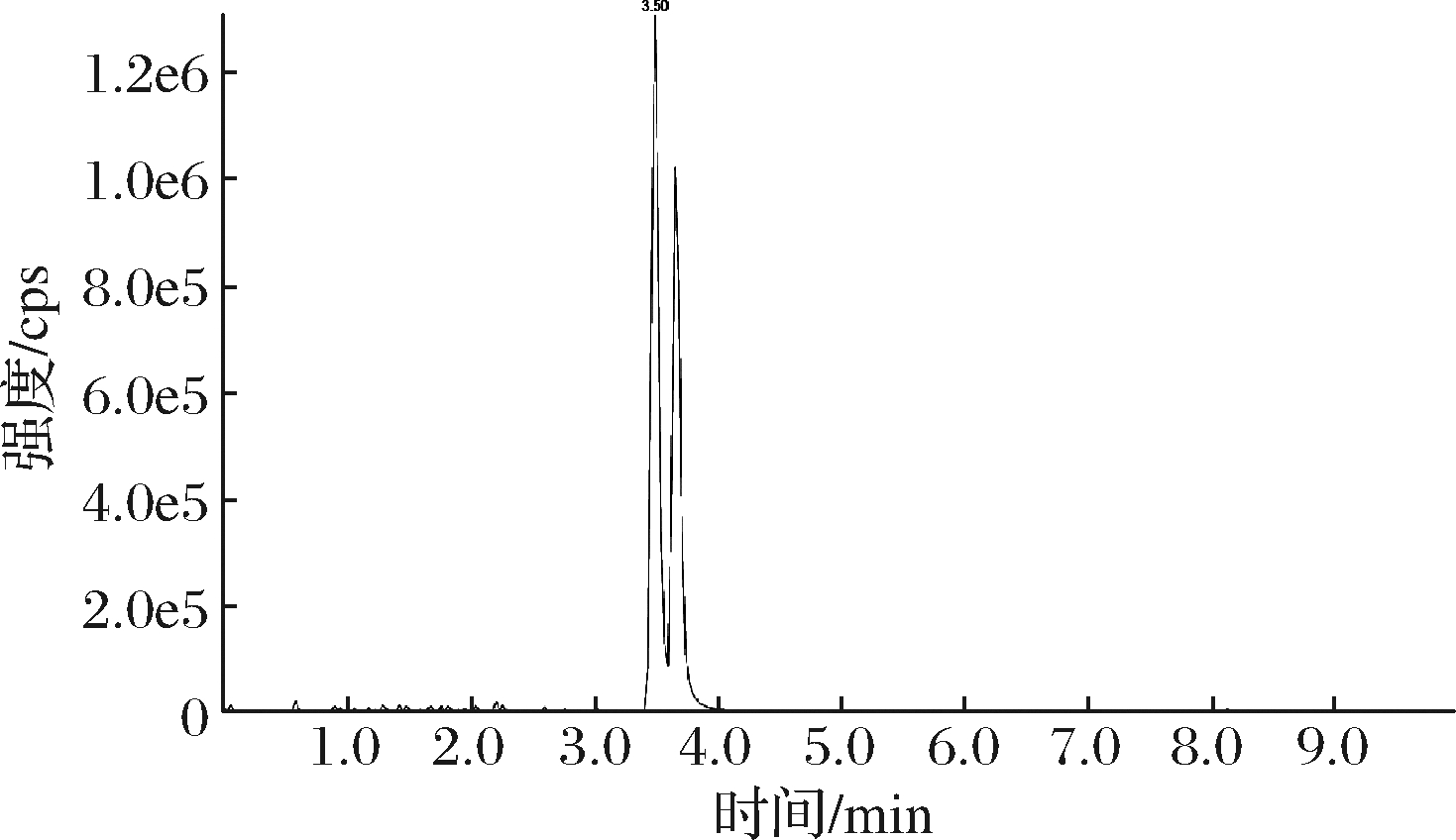
图3 亮氨酸和异亮氨酸的色谱分离
Fig.3 Chromatographic separation of leucine and isoleucine
2.2.2 流动相的优化
本试验采用乙腈-10 mmol/L乙酸铵溶液(含0.05%甲酸)作流动相。考虑到涪城麦冬生物成分比较复杂,可采取梯度洗脱对各成分进行分离,同时能够使待测氨基酸拥有合适的保留时间,且在梯度洗脱程序后阶段使用较大比例水相的冲洗步骤,使其他干扰组分尽可能被冲出来,从而达到较好的检测效果,同时可以保护色谱柱。流动相中适量添加甲酸具有改善峰形的作用,因此在10 mmol/L乙酸铵溶液中加入了体积分数0.05%的甲酸。经过多次试验优化,最后确定流动相的比例及洗脱的程序(表1)。
2.2.3 进样体积的确认
由于氨基酸易溶于水,为了提高样品中氨基酸的提取效率,本试验采用纯水作为目标成分的提取溶剂。而试验所用的Poroshell 120 HILIC-Z柱,是亲水作用的色谱柱,在液相分离模式中,水的洗脱能力大于乙腈。因此,由于水作为待测样品溶液的溶剂,会造成比较强的溶剂效应。在梯度洗脱的初始阶段中,乙腈的比例为90%,完成进样后当待测溶液与流动相发生混合时,由于待测溶液溶剂洗脱能力强于流动相溶剂,部分样品得不到保留,会先被洗脱出来,使峰变形,往往表现出峰的前伸、展宽、分叉等现象。在不改变提取溶剂及流动相的情况下,用减少进样体积的方式可以获得良好的峰形,同时能够降低溶剂效应的影响。本试验通过对混合标准溶液进样,比较了进样体积为2、5、10 μL的谱图,结果表明,进样体积为2 μL时峰形良好,加之进样体积减少也可以降低基质的流出,减少因基质效应造成的干扰。故本试验选择进样体积为2 μL。
2.3 提取溶剂的选择
试验对比了提取时长为30 min时,提取溶剂分别为水、50%(体积分数)的甲醇及80%(体积分数)的甲醇的提取效果。结果表明,以上各溶剂对目标物的提取效果并无显著差别。最终选择经济且易得的水作为提取溶剂。
2.4 提取时间的选择
用水作为提取溶剂,试验分别考察了提取时间为15、30、45 min对提取效率的影响。结果表明,提取时间达到30 min时较提取时间为15 min时,各目标化合物含量均有5%~20%的增加。但提取时间进一步延长,达到 45 min时,与30 min时相比已无显著性差异。最终选择样品的提取时间为30 min。
2.5 线性关系及检出限
按照选定方法,对混合氨基酸标液进行测定,做出工作曲线,以信噪比S/N=3时对应的目标化合物量为此方法该化合物的检出限,信噪比S/N=10时对应的目标化合物量为此方法该化合物的定量限,各氨基酸的线性范围、回归方程、相关系数、检出限、定量限见表3。结果表明,所测18种氨基酸具有良好的线性关系,相关系数r值都大于0.995。
2.6 回收率及精密度
按选定方法对样品(涪城麦冬)进行了3个水平的(n=6)加标回收,添加水平及结果见表4。结果表明,18种氨基酸回收率在81.7%~114.2%,相对标准偏差均小于4.0%,证实该方法具有良好的准确度和重复性。
表3 氨基酸标准品的线性范围、回归方程、相关系数、
检出限及定量限
Table 3 Linear ranges,regression equations, correlation
coefficients, LODs and LOQs of amino acid mixture standards

组分线性范围/(ng·mL-1)回归方程相关系数(r)LOD/(mg·kg-1)LOQ/(mg·kg-1)苯丙氨酸20.21~202.1y=7.08e+003x+1.72e+0050.998 60.782.6亮氨酸20.10~502.5y=5.91e+003x+8.87e+0050.996 40.411.4异亮氨酸19.96~199.6y=7.9e+003x+2.69e+0050.996 90.431.4甲硫氨酸20.06~200.6y=1.03e+003x+8.88e+0030.999 71.55.0色氨酸19.95~199.5y=2.58e+003x+1.39e+0040.999 81.03.3缬氨酸20.42~204.2y=4.21e+003x+3.13e+0050.998 20.752.5脯氨酸49.83~996.5y=6.56e+003x+4.43e+0050.996 60.792.6酪氨酸20.24~202.4y=697x+2.29e+0040.998 31.24.0丙氨酸51.65~2 066y=103x+2.15e+0030.999 24.916苏氨酸50.66~1 013y=385x+1.29e+0030.999 31.86.0甘氨酸20.00~200.0y=815x+1.69e+0040.996 94.515谷氨酰胺51.34~1 026y=342x+1.31e+0030.998 81.55.0丝氨酸51.20~2 048y=343x-4.84e+0030.999 82.37.7谷氨酸50.95~1 019y=388x-2.6e+0040.995 47.726天冬氨酸51.25~1 025y=132x-3.55e+0030.999 11.34.3精氨酸50.05~5 005y=1.32e+003x+3.19e+0040.999 61.13.7组氨酸20.04~200.4y=318x+2.6e+0030.998 24.013赖氨酸50.75~507.5y=850x+1.25e+0040.999 53.110
表4 回收试验结果(n=6)
Table 4 Results of recovery test(n=6)
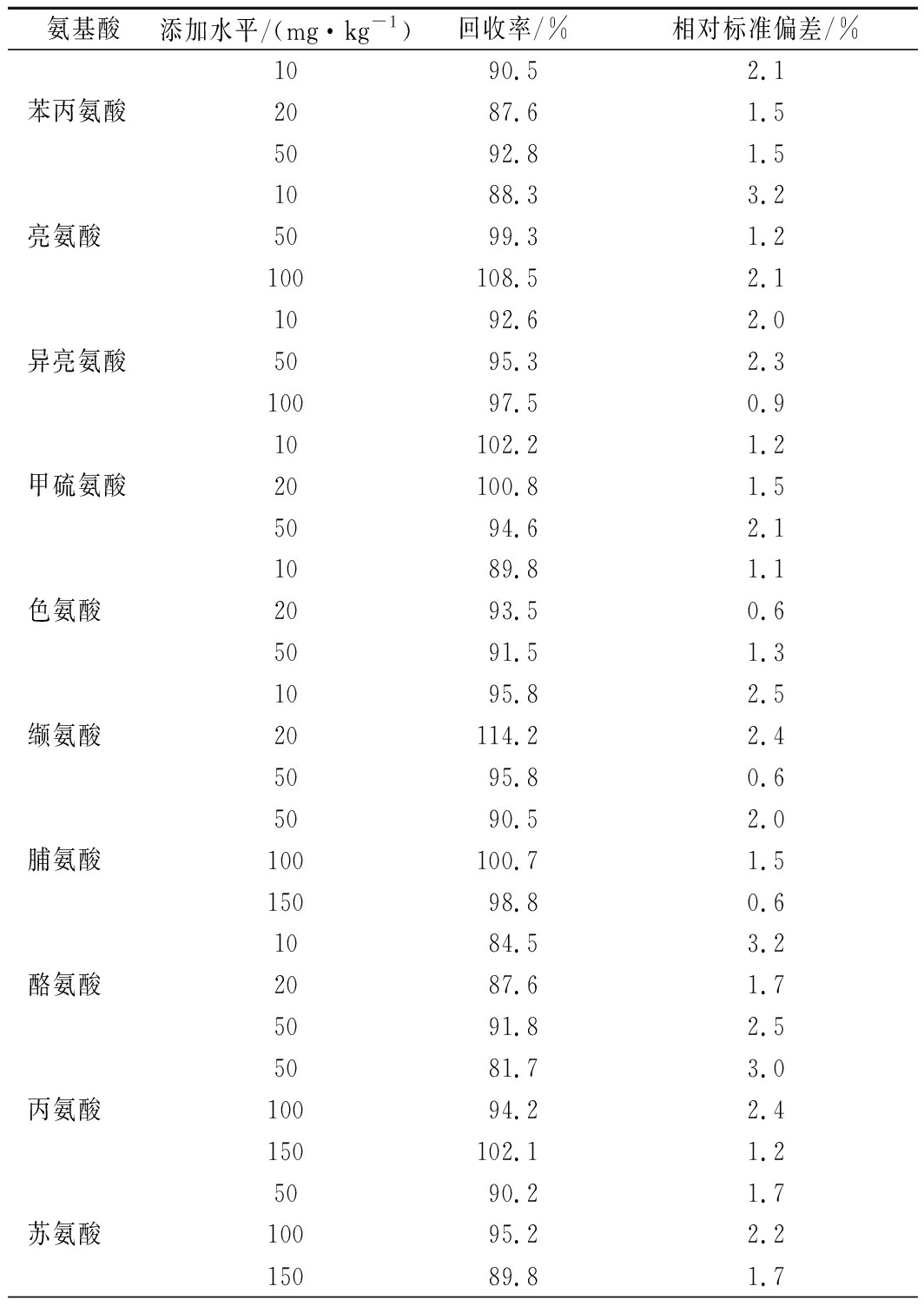
氨基酸添加水平/(mg·kg-1)回收率/%相对标准偏差/%1090.52.1苯丙氨酸2087.61.55092.81.51088.33.2亮氨酸5099.31.2100108.52.11092.62.0异亮氨酸5095.32.310097.50.910102.21.2甲硫氨酸20100.81.55094.62.11089.81.1色氨酸2093.50.65091.51.31095.82.5缬氨酸20114.22.45095.80.65090.52.0脯氨酸100100.71.515098.80.61084.53.2酪氨酸2087.61.75091.82.55081.73.0丙氨酸10094.22.4150102.11.25090.21.7苏氨酸10095.22.215089.81.7
续表4
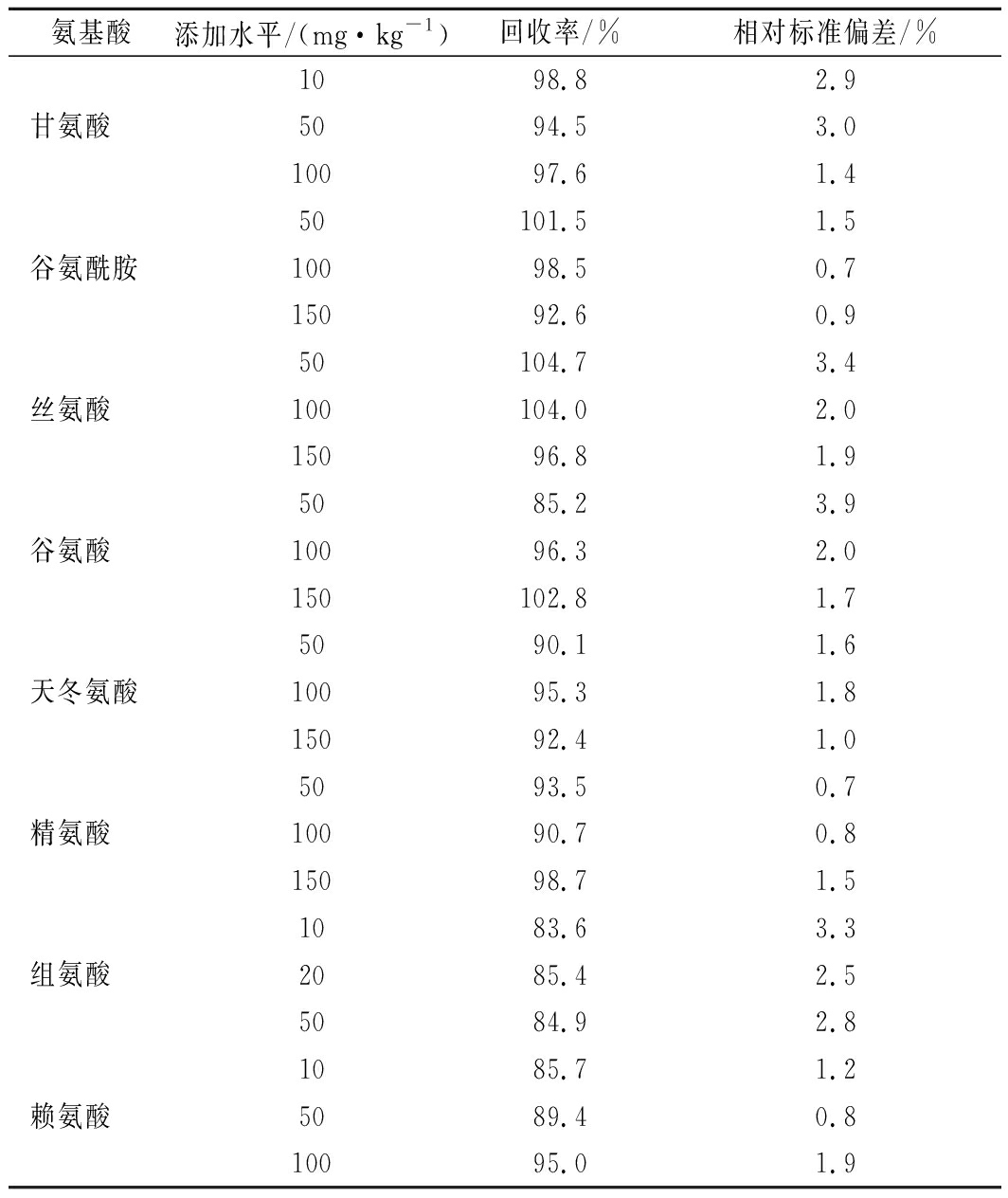
氨基酸添加水平/(mg·kg-1)回收率/%相对标准偏差/%1098.82.9甘氨酸5094.53.010097.61.450101.51.5谷氨酰胺10098.50.715092.60.950104.73.4丝氨酸100104.02.015096.81.95085.23.9谷氨酸10096.32.0150102.81.75090.11.6天冬氨酸10095.31.815092.41.05093.50.7精氨酸10090.70.815098.71.51083.63.3组氨酸2085.42.55084.92.81085.71.2赖氨酸5089.40.810095.01.9
2.7 样品的测定
取10批样品,以水为溶剂,提取30 min,作为供试品溶液。用选定方法进行含量测定,外标法定量,测定结果见表5。结果表明,不同批次样品的不同氨基酸含量有显著差异,但总体表现为所测氨基酸含量呈现整体偏低或整体偏高的现象,为提高麦冬的种植技术及改进种植条件的研究提供了一定的支持。
表5 样品中氨基酸的含量 单位:mg/kg
Table 5 Contents of amino acids in samples
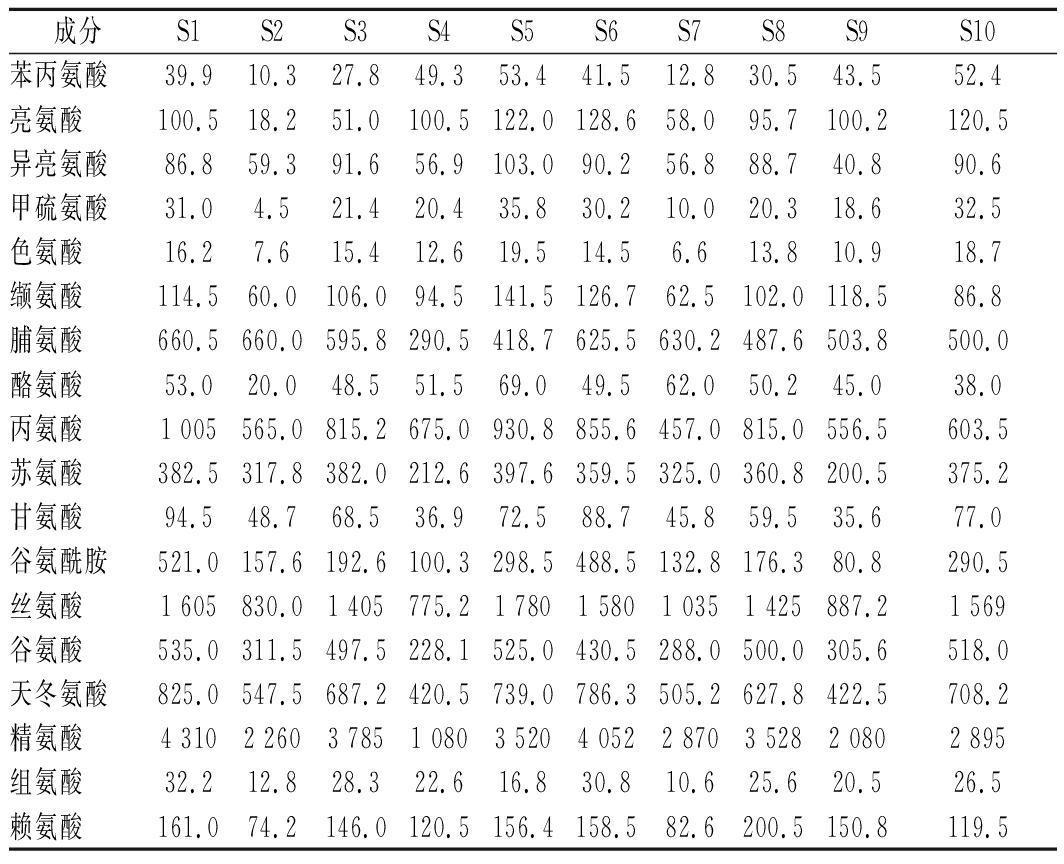
成分S1S2S3S4S5S6S7S8S9S10苯丙氨酸39.910.327.849.353.441.512.830.543.552.4亮氨酸100.518.251.0100.5122.0128.658.095.7100.2120.5异亮氨酸86.859.391.656.9103.090.256.888.740.890.6甲硫氨酸31.04.521.420.435.830.210.020.318.632.5色氨酸16.27.615.412.619.514.56.613.810.918.7缬氨酸114.560.0106.094.5141.5126.762.5102.0118.586.8脯氨酸660.5660.0595.8290.5418.7625.5630.2487.6503.8500.0酪氨酸53.020.048.551.569.049.562.050.245.038.0丙氨酸1 005565.0815.2675.0930.8855.6457.0815.0556.5603.5苏氨酸382.5317.8382.0212.6397.6359.5325.0360.8200.5375.2甘氨酸94.548.768.536.972.588.745.859.535.677.0谷氨酰胺521.0157.6192.6100.3298.5488.5132.8176.380.8290.5丝氨酸1 605830.01 405775.21 7801 5801 0351 425887.21 569谷氨酸535.0311.5497.5228.1525.0430.5288.0500.0305.6518.0天冬氨酸825.0547.5687.2420.5739.0786.3505.2627.8422.5708.2精氨酸4 3102 2603 7851 0803 5204 0522 8703 5282 0802 895组氨酸32.212.828.322.616.830.810.625.620.526.5赖氨酸161.074.2146.0120.5156.4158.582.6200.5150.8119.5
3 结论
本试验建立了涪城麦冬中氨基酸的HILIC-MS/MS检测方法,样品经水超声提取,选用Poroshell 120 HILIC-Z亲水作用色谱柱,用乙腈-10 mmol/L乙酸铵溶液(含甲酸0.05%)作流动相,采用梯度洗脱,用正离子模式多反应监测扫描,测定样品中氨基酸含量。该含量测定方法提取简单,测试灵敏度高、重复性好,能有效地满足涪城麦冬中多种氨基酸的同时测定。
[1] LUN W,JIANG X L,ZHANG W M,et al.Homo-aro-cholestane,furostane and spirostane saponins from the tubers of Ophiopogon japonicas[J].Phytochemistry,2017,136:125.
[2] CHEN M H,CHEN X J,WANG M,et al.Ophiopogon japonicus-aphytochemical,ethnomedicinal and pharmacological review[J].J Ethnopharmacol,2016,181:193.
[3] 张敏红,李美琴,曾宪武.麦冬类药材氨基酸分析[J].基层中药杂志,2000,14(2):7-8.
[4] 张黄琴,刘培,朱邵晴,等.双边栝楼成熟果实不同部位游离氨基酸及核苷类资源性化学成分分析与评价[J].中国现代中药,2017,19(12):1 683.
[5] 四川省卫生健康委员会. DBS 51/ 007—2019食品安全地方标准 麦冬须根[S].
[6] 中华人民共和国国家卫生和计划生育委员会.GB5009.124—2016食品安全国家标准 食品中氨基酸的测定[S].北京:中国标准出版社,2016.
[7] 张航,宋卿,林佶,等.氨基酸自动分析仪法测定云南新鲜羊肚菌中16 种氨基酸的含量[J].食品安全质量检测学报,2019,10(22):7 564-7 569.
[8] 辛丽娜,刘常凯,何林飞,等.6种农业特种养殖动物肉中18种氨基酸含量分析[J].肉类研究,2019,33(2):58-63.
[9] 涂云飞.茚三酮法测定茶叶游离氨基酸总量研究[J].现代农业科技,2018(14):235-238.
[10] 刘长姣,杨越越, 王妮,等.茚三酮比色法测定秋葵中氨基酸含量条件的优化[J].中国食品添加剂, 2018(1):187-193.
[11] 陈德权,何来斌,陈仕学, 等.HPLC法测定梵净山不同品种茶叶氨基酸含量比较分析[J].食品工业,2020,41(1):294-298.
[12] 贾载凯,毛新刚,苏晓岚,等.柱前衍生高效液相色谱法测定中韩泡菜中的氨基酸含量[J].农产品加工,2019(10):47-50.
[13] 阮治纲.近红外分析技术在食品氨基酸检测中的应用研究[J].现代食品,2017(20):66-68.
[14] 於筱岚,徐宁,何勇.近红外分析技术在食品氨基酸检测中应用的研究进展[J].光谱学与光谱分析,2014,34(9):2 377-2 381.
[15] 孔祥虹,付兴隆,张磊,等.浓缩果汁中20种氨基酸的超高效液相色谱—串联质谱法同时测定[J].分析测试学报,2010,29(4):347-352.
[19] 李东芹,张新婉.液相色谱—串联质谱直接测定茶叶中多种游离氨基酸[J].安徽农业大学学报,2019,46(1):8-12.