非淀粉多糖(non-starch polysaccharides NSP)被定义为除淀粉以外的复合多糖,是一种细胞壁多糖。NSP主要存在于植物细胞壁中,是由若干单糖通过糖苷键连接成的多聚体,主要包含纤维素、半纤维素、果胶等,而果聚糖、甘露聚糖和半乳甘露聚糖含量相对较少[1]。根据NSP在水中的溶解度不同,将其分为水溶性NSP和水不溶性NSP。纤维素、木质素、木聚糖和半乳甘露聚糖等被称为水不溶性NSP,而果胶、阿拉伯木聚糖、阿拉伯半乳聚糖和β-葡聚糖被称为水溶性NSP。谷物中含有多种NSP,主要由戊聚糖(阿拉伯木聚糖)、葡聚糖和纤维素组成。谷物的主要组分是淀粉(70%~80%)和蛋白质(10%~15%),细胞壁中NSP约占3%~8%。戊聚糖(阿拉伯木聚糖)和β-葡聚糖是许多谷物(如小麦、燕麦、大麦和黑麦)细胞壁的主要结构成分,它们的含量因物种和生长环境的不同而不同,小麦籽粒NSP含量(11.4%)低于黑麦(13.2%)和大麦(16.7%)。戊聚糖是小麦(6%~8%)和黑麦(8.9%)中主要的NSP,而β-葡聚糖是大麦(7.6%)和燕麦(9.4%)中主要的NSP。在谷物非淀粉多糖中,戊聚糖和β-葡聚糖是最重要的多糖,由于其功能性和营养性日益增强而备受人们的关注。
NSP是谷物细胞壁主要的生物活性成分,其功能和营养价值备受全球关注。NSP包括一系列具有不同理化性质的化合物,它们对动物和人类的营养作用取决于这些性质。这些特性包括黏度特性、持水性和发酵性等。从有益健康的方面来说,NSP作为益生元,具有重要作用,例如免疫调节剂、抗氧化剂、预防糖尿病和心脏保护剂。在食品工业中,NSP被用作功能性成分,尤其是在烘焙产品中,其可以改善流变特性和面团吸水特性,增大面包体积。本文主要介绍了戊聚糖和β-葡聚糖的特性、制备及分析鉴定方法,综述了各提取方法的提取效果及优缺点,并对其含量、分子质量及结构测定等分析鉴定方法进行了简要概述,以期为谷物非淀粉多糖在食品工业中的应用及进一步的深入研究提供参考。
1 谷物非淀粉多糖特性
1.1 NSP理化特性
1.1.1 戊聚糖
戊聚糖(pentosan)也称为阿拉伯木聚糖 (arabinoxylan),主要由阿拉伯糖(arabinose)和木糖(xylose)组成,还含有一定量的己糖、杂多糖和酚类物质等,是谷物中NSP的主要成分。根据溶解性不同,分为水溶性和水不溶性戊聚糖,二者的结构基本相似,不同的是后者的分支程度(阿拉伯糖与木糖的比例较高)。研究表明,戊聚糖具有高黏度、高持水力、氧化交联和酶解等显著的功能特性,虽然其在谷物中的含量很少, 但却是影响谷物加工过程及其产品质量的重要功能性成分。
(1)结构特征和相对分子质量
戊聚糖主要由阿拉伯糖和木糖组成,其分子结构包括线性β-(1-4)-木聚糖主链、阿魏酸以及沿着主链的阿拉伯糖取代物,取代基通过木糖基残基的O2和O3原子连接到该主链上。尽管不同谷类的戊聚糖具有相同的基本化学结构,但它们在阿拉伯糖(Ara)残基替代木糖(Xyl)骨架的方式上(2种糖比例、键的相对比例和顺序、其他取代基的存在)有所不同,这种差异性将影响戊聚糖的相互作用及其与细胞壁其他组分相互作用的能力,从而改变这些大分子的理化和功能性质。大多数阿拉伯糖残基作为单一取代基附着,然而,有报道表明在小麦和黑麦的戊聚糖中存在少量低聚物侧链,这些侧链含有通过1-2、1-3和1-5键连接的2个或多个阿拉伯糖残基。虽然阿拉伯糖是最常见的取代基,但在木聚糖骨架上也发现了其他单糖残基。其中包括D-葡萄糖醛酸及其4-O-甲基醚、木糖和半乳糖残基等。
戊聚糖的相对分子质量与谷类品种、基因型和生长环境以及处理和测定方法等有关。沉降法测得的水溶性戊聚糖的相对分子质量为65×103~66×103,而用凝胶过滤色谱测得的相对分子质量为8×105~5×106。水不溶性戊聚糖的平均相对分子质量为8.5×105,而凝胶过滤色谱的测定结果为2.18×105~2.55×105。
(2)黏度特性
戊聚糖是一种具有高黏度特性的非淀粉多糖,其构型、聚合度、阿拉伯糖排序以及阿魏酸含量和分布等均会影响其黏度特性。研究表明,戊聚糖是引起面粉水提物的固有黏度的主要原因,其固有黏度是水溶性蛋白质的15~20倍,而且具有较高Ara/Xyl比值和阿魏酸含量的戊聚糖,其固有黏度越高。BENDER等[2]研究表明水溶性阿拉伯木聚糖对面包的烘焙性能有显著影响,尤其是在面团的发展过程中,因为它们具有较高的水结合能力,能够提高面团的黏度。
(3)氧化交联特性
谷类戊聚糖具有在聚合物链之间形成共价键的独特能力。在自由基生成剂(例如,H2O2/过氧化物酶、氯化铁、过硫酸铵或漆酶)的存在下,阿魏酸残基的氧化偶联发生,引起多糖分子的交联。由于这种反应,戊聚糖能够形成非常黏稠的溶液,甚至凝胶,这取决于聚合物的浓度。戊聚糖的结构和分子质量对其凝胶化能力有显著影响,随着阿魏酸残基含量的增加、分子质量的增加和天然多糖分支度的降低,交联戊聚糖凝胶的硬度增加。BUKSA等[3]研究发现,戊聚糖是黑麦粉水提液中交联反应的主要对象。
(4)吸水性和持气性
戊聚糖在面粉中的含量虽然很少,但其在吸水量和面团水分分布上起着重要的调节作用。ARIF等[4]研究发现,戊聚糖可增加面粉的吸水能力(3%~10%),水溶性戊聚糖可大大提高面粉的吸水率(59.5%~68.8%)。面团发酵过程中气体保持能力对面团流变学特性及最终产品质有重要影响。BENDER等[5]研究表明,添加水提戊聚糖制作的面包有更大体积,水提戊聚糖较碱提取戊聚糖对无面筋面包品质具有更大的改善功能。
(5)酶解特性
在酶的作用下,戊聚糖可发生水解和降解,从而导致其结构和性质发生变化。夏洁人等[6]利用木聚糖酶酶解小麦麸皮,将酶解液浓缩后加入面粉,发现酶解戊聚糖能较好地改善面团的流变特性和面包烘焙品质。李文多[7]研究了黑小麦戊聚糖酶对水提和碱提戊聚糖的降解程度,后者的降解程度大于前者。BUKSA等[8]对可溶性戊聚糖通过酶水解、交联处理以及两者的结合进行改性以制备适用于不同品质的面包制作的改良剂。另外,在小麦淀粉和谷朊粉生产中,加入戊聚糖酶系可以有效地使淀粉和蛋白质分离,从而提高淀粉和谷朊粉的得率。
1.1.2 β-葡聚糖
大部分谷物都含有β-葡聚糖,其中大麦(2.5%~11.3%)和燕麦(2.2%~7.8%)中含量相对较高,主要存在于亚糊粉层与胚乳层。β-葡聚糖分为水溶性和水不溶性,其溶解度差异主要在于分子中β-(1→3)和β-(1→4)2种糖苷键的比例不同。据报道,大麦β-葡聚糖中β-(1→3)键β-(1→4)键的比例约1∶2.3,燕麦中的β-葡聚糖β-(1→3)和β-(1→4)2种糖苷键的比例约1∶2.1。β-葡聚糖的相对分子质量会影响其溶解性、黏度和流变学特性及其在水溶液中的存在状态,进而影响到β-葡聚糖生理功能(降血脂、降血糖、抗癌、通便及免疫调节功能)的发挥。
(1)结构特征和相对分子质量
谷物β-葡聚糖是由D-吡喃葡萄糖残基通过β-(1→3)和β-(1→4)糖苷键连接而成的葡萄糖聚合物,其结构主要由58%~72%的β-(1→3)键连接的纤维三糖基和20%~34%的纤维四糖单位组成,还含有少量的葡糖基和纤维素糊精。β-葡聚糖的相对分子质量与谷物的来源和品种不同有关,也受不同提取和分离方法方法的影响。相对分子质量分布是β-葡聚糖的一个重要特性,β-葡聚糖的相对分子质量为103~107。研究表明,燕麦、大麦和小麦的β-葡聚糖相对分子质量分布范围分别为 65×103~31×105、80×103~27×105、21×103~11×105。
(2)溶液流变特性
β-葡聚糖流变特性与β-葡聚糖的结构和分子质量密切相关,另外,外界因素如溶液浓度、温度、pH、盐类浓度等因素也会对其产生影响。β-葡聚糖在食品中的应用主要基于它的黏度特性。β-葡聚糖溶液的表观黏度是聚合物浓度、分子质量、链构象和分子间相互作用的函数。β-葡聚糖溶液在低剪切速率下表现出高的表观黏度,在高剪切速率下表现出剪切稀化流,这是黏弹性流体的典型行为。对燕麦β-葡聚糖溶液流动特性的研究已经证明了它们具有剪切稀化行为和对抗酸碱和热处理的相对稳定性。另外,黏度特性还与纤维三糖和四糖比值、纤维素样碎片、分子质量分布和谷物β-葡聚糖分子大小有关。
β-葡聚糖具有凝胶特性。谷物β-葡聚糖的剪切稀化行为在低浓度下也表现出来,但在高浓度下,它们往往形成凝胶,其凝胶特性受分子质量和分子结构的影响。高分子质量(2.39×105)β-葡聚糖凝胶即使在200 h贮藏后也没有表现出凝胶化的趋势,而低分子质量的短链分子表现出较高的流动性,这些具有低分子质量β-葡聚糖结构的短链更容易扩散,因此更易于聚集而形成凝胶化。
(3)乳化稳定性
研究发现,β-葡聚糖具有提高泡沫质量和增强乳化稳定性的能力。低分子质量β-葡聚糖分子链向水相中伸展,形成网络结构,产生空间位阻和静电排斥等作用,抑制了微粒的聚集,而高分子质量β-葡聚糖通过提高水相黏度表现出较好的乳化稳定性。研究结果表明,燕麦β-葡聚糖在高浓度、低温和中性pH值条件下,其乳化性较好,乳化稳定性也越高。
戊聚糖和β-葡聚糖的理化特性对食品加工性能的影响研究见表1。
表1 谷物非淀粉多糖理化特性对食品加工性能的影响
Table 1 The effect of the physicochemical properties of non-starch polysaccharides on food processing performance

理化特性NSP对加工性能的影响文献流变学特性、持水性、乳化性、发酵性戊聚糖β-葡聚糖通过影响面筋淀粉薄膜来保持面团中的气体保留[9]总戊聚糖和水溶性戊聚糖含量与饼干评分值呈显著负相关[10]戊聚糖含量与蛋糕体积呈显著正相关,而水溶性戊聚糖含量与蛋糕体积相关不显著[11]水溶性戊聚糖降低意大利面的黏度,从而改善意大利面的品质[12]面团吸水率增加,延伸性降低;充气压力的峰值增加,面团增大,气泡高度减小;面团断裂点应变降低[13]显著增加面包的硬度和保持较高的水分含量[14]作为增稠剂,调节功能性食品的结构和口感特性,开发低热量食品[15]用于不渗透的食品表面涂层,以及在冷冻乳产品中作为结晶和重结晶调节剂[16]用于发酵饮料,改善食品风味, 且口味清爽[17]
1.2 NSP营养特性
NSP对动物和人类的营养作用取决于一系列具有不同理化性质的化合物,这些特性包括黏度、保水性和发酵性等。人体的消化酶只能分解α-(1,4)糖苷键,因此,NSP不能在小肠内消化。NSP对单胃动物具有一定的抗营养作用,但其对人体健康有很大益处,是一种很好的功能性保健食品。戊聚糖是谷物中的一类膳食纤维成分,其特殊的健康益处与其分子精细结构有关。β-葡聚糖也是一种非常有价值的功能成分,其营养潜力在很大程度上取决于其结构、大小,黏度、提取技术、质量、流变特性、分子质量等。戊聚糖和β-葡聚糖的营养特性主要包括抗营养特性、免疫调节特性、抗氧化特性、抗糖尿病作用以及预防心血管疾病等[18]。
(1)抗营养特性
已经证明在猪和家禽等单胃动物的饮食中添加谷物NSP具有抗营养作用,其会影响动物对营养物质的消化和吸收。NSP对单胃动物的不良影响归因于肠道内容物的粘度增加。一般来说,肠道高黏度会减缓基质和消化酶的扩散速度,并阻碍它们在黏膜表面的有效相互作用。此外,NSP与肠壁边界相互作用,增厚了黏膜的限速未固定水层,从而降低了通过肠壁的营养吸收效率。此外,高消化黏度延迟胃排空和饲料转运时间,从而降低血糖和刺激肠道微生物生长。这反过来又导致生长速度减慢,并最终降低家禽和猪的性能。因此,NSP引起的消化液黏度是动物饲料行业最为关注的问题。相反,由于肠道高黏度而导致的胃排空延迟通常被认为是有益于人类健康的。较慢的转运时间增加了可用于吸水的时间,并允许更多时间由内源性肠道微生物群落降解,分解产物主要是短链脂肪酸。
戊聚糖通过选择性刺激有益的肠道微生物群在人类和动物的结肠中发挥益生元作用。长链可提取戊聚糖的特定浓缩物通过选择性刺激对宿主有益的一面(例如丙酸盐的生产)来刺激人类和动物中特定肠道微生物(如长双歧杆菌)并启动特定的发酵模式。β-葡聚糖通过产生短链脂肪酸有利于有益肠道细菌的生长。β-葡聚糖在大肠中分解。随着微生物细胞数量的增加,结肠干重增加。微生物细胞材料的保水能力大于不溶性纤维,增加了不溶性纤维的膨胀效应。
(2)免疫调节特性
戊聚糖的免疫调节特性取决于其结构特征,已经证明其可以影响不同的免疫细胞,从而增强动物和人类体内和体外的广泛免疫反应。β-葡聚糖被称为生物反应调节剂,其通过激活补体系统、增强巨噬细胞和自然杀伤细胞功能来增强宿主免疫防御。此外,β-葡聚糖可以通过激活单核细胞/巨噬细胞和增加免疫球蛋白、NK细胞、杀伤性T细胞等的数量来刺激免疫功能,从而提高对癌症、传染病和寄生虫病的抵抗力,并增加生物疗法及其预防能力。
(3)抗氧化性能
戊聚糖由于其分子结构中存在酚类基团而具有一定的抗氧化性能。戊聚糖能够在氧化还原反应过程中同时提供电子和氢原子。阿魏酸含量、木糖替代程度、膳食来源和代谢方式对其抗氧化潜力有很大影响。酯化阿魏酸含量较高、取代度较高的阿拉伯木聚糖寡糖是较好的抗氧化剂。由于这种抗氧化潜力,阿拉伯木聚糖降低了结直肠癌和糖尿病的风险。其发挥这些保健作用可能需要2个步骤:(1)可水提取的戊聚糖在通过胃肠道时提供电子或氢原子,以中和饮食中的自由基(与慢性疾病的发生和/或发展有关);(2)戊聚糖非竞争性地抑制肠道α-葡萄糖苷酶和葡萄糖转运蛋白,从而降低餐后血糖水平。阿魏酸和阿魏酰化阿拉伯木聚糖单/寡糖有可能用于糖尿病的治疗。添加到小麦面包中的戊聚糖可以对II型糖尿病的血糖控制产生有益的影响。β-葡聚糖的抗氧化能力表现在其参与了葡萄糖调节,从而降低了人类的血清胆固醇水平。
(4)抗糖尿病作用
戊聚糖对人体FDA中胆固醇水平和血糖指数有显著影响,但其作用方式尚不清楚。这可能是由于其良好的流变特性,即高黏度和可溶性。此外,黏性物质会减慢胃排空速度,降低小肠运动,从而导致葡萄糖吸收延迟。谷类β-葡聚糖通过降低血糖和胰岛素水平,在预防、治疗和控制糖尿病方面有效,其降低血糖、胰岛素水平的能力与谷类β-葡聚糖产生的黏度呈线性关系。
(5)预防心血管疾病
研究表明,戊聚糖具有心脏保护作用,它降低了心血管疾病、癌症、糖尿病、呼吸系统疾病和感染的发生率和死亡率。β-葡聚糖通过降低血液胆固醇达到降低冠心病、结直肠癌和肥胖的风险。总胆固醇和低密度脂蛋白胆固醇水平升高被认为是心血管疾病的主要危险因素。β-葡聚糖具有降低总胆固醇、低密度脂蛋白胆固醇、改善高密度脂蛋白胆固醇和血脂水平以及保持体重的能力。这反过来又降低了心血管疾病的风险。
2 谷物非淀粉多糖的提取和分离纯化
2.1 NSP提取方法
目前,谷物中非淀粉多糖的提取方法主要有水提法、碱提法、酶法提取等,微波和超声等辅助提取法及超临界流体萃取法等是近些年新兴起来的一些提取方法。各种提取方法及提取效果的研究见表2。
水提法是提取NSP普遍使用的一种方法,用水来提取NSP时,可以用热水也可用冷水浸提,然后将提取液浓缩后,再在浓缩液中加乙醇,利用其不溶于乙醇的性质,使其沉淀出来。热水提取NSP的原理是其在热水中的溶解度更大。NSP在热水中是稳定的,通常的做法是用热水提取2~6 h。此法应用广泛、易操作,但比较耗时,而且一些多糖不溶于热水。
碱提法一般与水提法结合使用。一些酸性或高分子质量NSP不易溶于热水而易溶于稀碱溶液。因此,常用一定浓度的NaON溶液或Na2CO3液代替热水进行NSP提取。谷物中的大多数NSP一般是首先用热水提取,然后用稀碱溶液提取残渣中的剩余NSP。该法优点是可以提取一些酸性多糖,但提取温度应保持在10 ℃以下。
酶法提取是在比较温和的条件下分解植物组织,加速NSP的释放。常用的酶有蛋白酶,果胶酶和纤维素酶等。谷物原料粉碎后悬浮在水中,根据复合酶的最佳反应条件,设定最佳温度和酸碱度,反应一段时间。一般常用酶-水相结合的方法,这样可以大幅度提高NSP的产量。此法优点是反应条件温和,但很少单独使用,通常与其他提取方法结合。
微波提取的原理是微射线辐射于溶剂并透过细胞壁到达细胞内部,溶剂和细胞液吸收微波能,使细胞内部温度升高,压力增大,当压力超过细胞壁承受能力时,细胞壁会破裂,位于细胞内的有效成份释放出来,转移到溶剂周围被其溶解。此法选择性好、提取时间短、节省能源和溶剂,但是不利于工业化大生产。
超声波和超临界流体提取是一种新兴的分离技术,还未大规模使用。除此之外,还有一些方法由于成本高、产量低而不常被采用。例如,碱性金属盐的一些有机溶剂、2-甲氧基乙醇-氯化锂或酸性水溶液等也曾用来提取谷物非淀粉多糖。超声波提取效率高、时间短、耗能低,但需要控制超声波的功率和时间,这样可以降低对多糖分子结构的破坏。
2.2 NSP纯化分级
谷物非淀粉多糖经初步提取后得到的是多糖粗提物,其中的蛋白质、淀粉、脂质和色素等杂质可能会干扰多糖成分和结构分析,因此,在进行NSP的特性研究之前应先纯化其粗提物。在大多数情况下,纯化步骤通常涉及淀粉水解和脱蛋白以提高提取的NSP的纯度。常用Sevage法、三氯乙酸法、等电点法、盐酸法、生物酶法等去除蛋白质;α-淀粉酶和淀粉葡萄糖苷酶的酶水解去除淀粉;用吸附剂(硅藻土、纤维素、活性炭等)、氧化剂(H2O2)和离子交换柱[二乙胺乙基-纤维素(diethylaminoethyl-纤维素,DEAE-纤维素)]等脱除色素。不同来源多糖纯化方法见表3。
NSP的分离和纯化很难完全分开进行,因为有时分离方法中已经包含了纯化,有时纯化也包含分离。NSP纯化分级方法主要有沉淀法、透析法、膜分离法、柱层析法和电渗析法等,目前多采用 DEAE-凝胶或其他不同类型的凝胶柱层析,或者离子交换色谱法。
表2 谷物非淀粉多糖的提取方法及提取效果
Table 2 Extraction methods and effects of non-starch polysaccharides
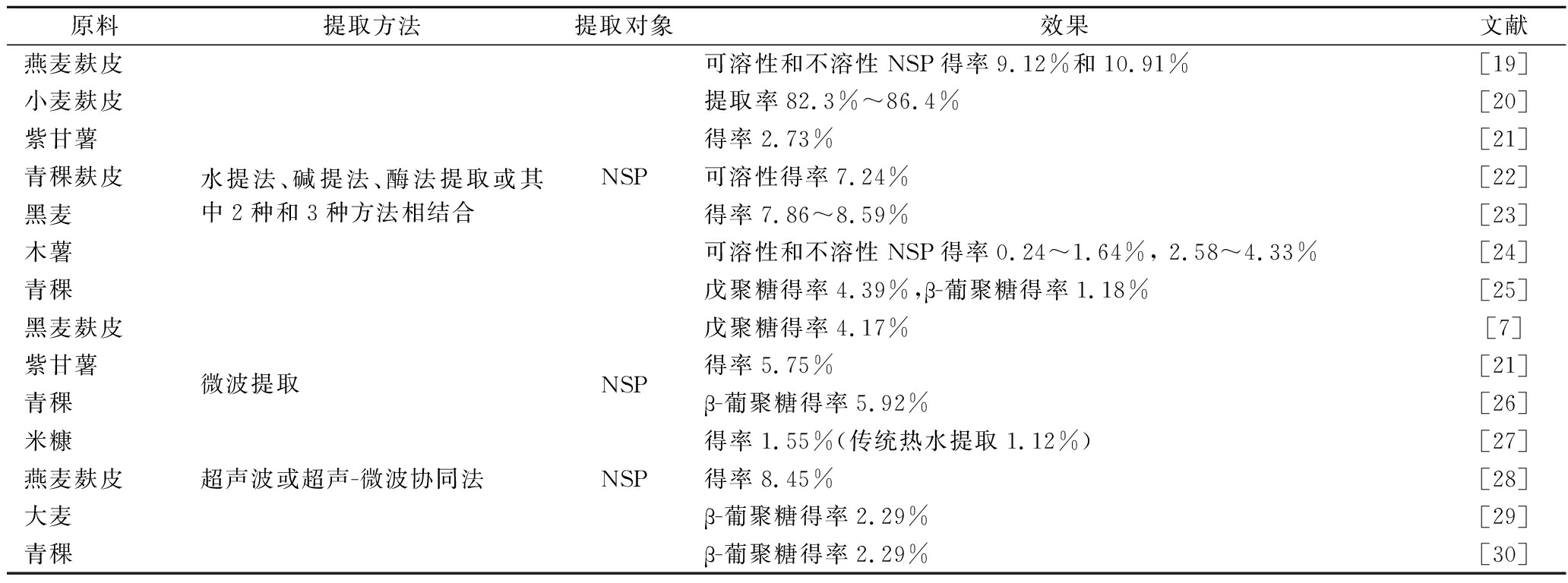
原料提取方法提取对象效果文献燕麦麸皮小麦麸皮紫甘薯青稞麸皮黑麦木薯青稞黑麦麸皮水提法、碱提法、酶法提取或其中2种和3种方法相结合NSP可溶性和不溶性NSP得率9.12%和10.91%[19]提取率82.3%~86.4%[20]得率2.73%[21]可溶性得率7.24%[22]得率7.86~8.59%[23]可溶性和不溶性NSP得率0.24~1.64%, 2.58~4.33%[24]戊聚糖得率4.39%,β-葡聚糖得率1.18%[25]戊聚糖得率4.17%[7]紫甘薯青稞微波提取NSP得率5.75%[21]β-葡聚糖得率5.92%[26]米糠燕麦麸皮大麦超声波或超声-微波协同法NSP得率1.55%(传统热水提取1.12%)[27]得率8.45%[28]β-葡聚糖得率2.29%[29]青稞β-葡聚糖得率2.29%[30]
表3 不同来源多糖纯化方法
Table 3 Purification methods of polysaccharides from different sources

纯化方法条件多糖脱除杂质脱除率/%参考文献酶解-三氯乙酸木瓜蛋白酶140 U/mL,温度55 ℃,pH 6.0,时间 60 min;6% 三氯乙酸作用 30 min米糠多糖蛋白85.52[31]酶解0.3 mL蛋白酶/100 mL样液,pH 9.0 55 ℃ 水浴中保温 2. 5 h,4 000 r/min 离心分离 15 min小麦淀粉废水中戊聚糖蛋白85.67[32]吸附法活性炭添加量6%,温度60 ℃、时间50 min小麦麸皮低聚糖色素97[33]Sevage法样液与试剂体积比2∶1,氯仿与正了醇体积比4∶1黑小麦麸皮水不溶性戊聚糖蛋白66.7[34]活性炭吸附法活性炭用量5%,温度70 ℃,时间50 min黑小麦麸皮水不溶性戊聚糖色素67[34]酶解淀粉酶浓度1%,pH 6,温度60 ℃,时间45 min黑小麦麸皮水不溶性戊聚糖淀粉46[35]树脂吸附法温度40 ℃,时间80 min,树脂添加量为15 g/100mL糖液燕麦β-葡聚糖色素55.27[36]胰蛋白酶-等电点法胰蛋白酶(125 000 U/g)加酶量2%,pH 4.4燕麦β-葡聚糖蛋白90.8[36]淀粉酶加酶量2 U/g料液,pH 6.4,温度90 ℃,时间40 min青稞麸皮水溶性β-葡聚糖淀粉100[37]胰蛋白酶-等电点法1 mL 1%胰蛋白酶,pH 4.5青稞麸皮水溶性β-葡聚糖蛋白60.23[37]树脂吸附法温度30 ℃,时间2 h,树脂添加量20 g/100mL糖液青稞麸皮水溶性β-葡聚糖色素58.24[37]
2.2.1 沉淀法
沉淀法包括分级沉淀法、季铵盐沉淀法和金属盐沉淀法等。
分级沉淀法的原理是NSP在不同浓度乙醇和丙酮中的溶解性不同,通过改变乙醇或丙酮的浓度使不同分子质量的NSP组分分级沉淀。谢昊宇等[38]采用碱提醇沉法提取青稞麸皮β-葡聚糖,再通过硫酸铵沉淀、阴离子交换和凝胶层析法对其逐步纯化, 得到94.91%的总糖含量和96.88%的β-葡聚糖含量。分级沉淀法是常用的多糖纯化方法,此法操作简单,但不易获得均匀组分的多糖。
季胺盐法的原理是是根据长链季胺盐与酸性多糖成不溶性盐而沉淀出来。常用季铵盐有十六烷基三甲基季铵盐的氢氧化物、溴化物以及十六烷基吡啶。此法选择性好,常用于纯化酸性多糖和中性高分子质量多糖,但需要精确调节和控制溶液的离子强度和pH值。
金属盐沉淀法的原理是根据不同NSP组分在一定浓度的盐溶液中具有不同的溶解性,通过离心沉淀将不同多糖组分分开以达到纯化分离的目的。该方法成本低,效率低,易形成共沉淀。常用的盐析剂有氯化钠、氯化钾和硫酸铵等,其中硫酸铵的应用最为广泛。袁建等[39]采用硫酸铵沉淀法、阴离子交换柱层析法和凝胶过滤层析法对小麦麸皮β-葡聚糖的粗提物进行纯化,得到纯度高于97%的组分。
2.2.2 柱层析法
柱层析法主要有凝胶柱层析和离子交换柱层析。前者是利用不同浓度的盐溶液和缓冲液作洗脱剂将不同分子质量的多糖分开。后者是根据多糖分子的电离性质和电荷密度不同,与交换介质的亲和力也不同,从而使多糖得到分离。常用的离子交换剂有纤维素类、树脂类和葡聚糖类。张峰[40]对提取的青稞β-葡聚糖先进行硫酸铵分级沉淀,后进行乙醇醇析,得到纯度为88.7%的β-葡聚糖,再经DEAE-52纤维素柱层析和葡聚糖凝胶G-100凝胶柱层析得到1种均一分子质量的β-葡聚糖。SAVITHA PRASHANTH等[41]采用 DEAE-纤维素离子交换层析柱纯化提取的小米糠中阿拉伯木聚糖组分,用碳酸铵洗脱,再经凝胶过滤层析得到不同组分。
2.2.3 膜分离法
膜分离是近年来发展起来的一种超滤分离技术,是用己知的超滤膜分离不同分子质量大小的多糖组分。该方法不需要经过加热和化学物质处理,不仅操作简单、能耗少、无污染,而且提取多糖的效率和含量也高,因而得到广泛的应用。目前所用的超滤膜有聚砜酰胺膜、醋酸纤维素膜等。RAI等[42]研究表明,超滤分离颗粒的允许粒度范围高于多糖的粒度范围,因此采用膜分离技术可截留不同分子质量的β-葡聚糖。严汪汪等[32]用沉淀蛋白-超滤法回收小麦淀粉加工废水中的戊聚糖,超过91.96%的戊聚糖被截留,从而达到单独分离回收的目的。
2.2.4 其他方法
其他离纯化方法,还包括制备区电泳法、亲和层析法和超速离心法等。制备区电泳法是利用多糖分子质量、形状及电荷不同而在电场作用下达到分离目的的,其分离效果较好,但耗时长,净化能力小,仅用于半微量制剂。亲和层析法原理是某些特定的多糖能与特定的分子可逆结合,这2个特定的分子结合后也能离解,利用这种特性,多糖可以通过结合离解过程提纯。另外,在对谷物非淀粉多糖的结构、性质等研究中,也会采用离子交换、冻融分级和超速离心等方法对其进行进一步纯化,以得到高纯度的多糖。超速离心法效果好,但对设备要求高,主要用于多糖的半微量制备。
3 NSP的分析鉴定
3.1 含量测定和纯度鉴定方法
目前测定谷物中 NSP 含量的方法主要有色谱法和比色法等,戊聚糖、β-葡聚糖是研究较多的谷物非淀粉多糖,此2种多糖的含量可采用相同方法,但根据其特性不同各自具体的测定方法如下。
(1)戊聚糖的测定
测定谷物及其产品中戊聚糖含量的方法主要有以下几种,见表4。目前,较常用的方法是地衣酚或间苯三酚比色法,此法快速方便,已被农业部列为标准的检测方法。
表4 谷物戊聚糖含量测定方法
Table 4 Method for determination of pentosan in cereals

方法原理优缺点色谱法先将样品通过酸水解成单糖形式的阿拉伯糖(Ara)和木糖(Xyl),然后用色谱分离测定单糖的含量,戊聚糖的含量以此2种糖之和表示该方法准确度高,专一性较强,但测定较复杂、费时,仪器费用也较高比色法戊聚糖由热酸水解为糠醛,通过与显色剂地衣酚、间苯三酚等反应,根据反应颜色与吸光度的相关性,由吸光度计算戊聚糖的含量,吸光度值越高戊聚糖含量越高该法简便、快速,是实验室常用的方法Duffau蒸馏法样品与热酸共沸,使戊聚糖水解为糠醛,用四溴化法测定蒸馏出的糠醛量,再换算成戊聚糖含量此法重复性好,所用试剂成本低,仪器简单,分析结果准确可靠
(2)β-葡聚糖的测定
谷物中β-葡聚糖含量的测定方法有以下几种,见表5[43]。另外,也有研究表明,近红外反射光谱法有潜力作为一种快速分析谷物籽粒中重要的营养多糖的方法,近红外光谱法可用于植物育种、营养和产品研究,以获得简单快速的非淀粉多糖含量估计。这种分析方法快速、廉价,但是这是一种依赖于样品光谱多元校正和精确参考分析的比较技术。
表5 谷物 β-葡聚糖含量测定方法
Table 5 Method for determination of beta-glucan in cereals

方法原理优缺点黏度法根据 β-葡聚糖的黏性特性测定是最早的测定方法。β-葡聚糖的黏度同时与含量和分子质量有关,且不同的提取条件下的黏度特性也有明显的不同。因此该法可靠性较差,准确性低,现很少有人采用沉淀法利用特定盐或有机溶剂沉淀抽提液中的β-葡聚糖该法局限于抽提不能完全排除其他物质干扰酶法采用特定 β-葡聚糖内切酶得到寡糖,再进一步用 β-葡萄糖苷酶将寡糖水解为葡萄糖,后采用葡萄糖氧化酶/过氧化物酶试剂显色测定葡萄糖含量最常用的就是由 MCCleary 提出的酶法,即 AOAC995-16 法。该法简便,用样量少,但价格相对较高,是目前定量 β-葡聚糖广泛使用的方法,己被美国谷物化学协会认可,作为一个标准方法推荐, Megazyme 公司已开发出相应的测定试剂盒。我国目前国标中测定谷物 β-葡聚糖也是基于酶法测定荧光法荧光物质可与 β-葡聚糖专一性结合形成复合物,引起荧光谱散发强度变化简便快速,精确度较高,但荧光增白剂对光敏感,使用受限。苯酚-硫酸法单糖与强酸加热产生糠醛或糠醛衍生物,然后通过显色剂缩合成有色络合物,再进行比色定量此法对 β-葡聚糖无专一性,样品中的多糖和寡糖都被浓酸水解成单糖,并通过苯酚显色,所以尽管其测定简单快速,但测定结果误差较大层析法用内(1→3)(1→4)-β-D-葡萄糖水解酶对葡萄糖专一性水解,生成寡糖,后者在 C18柱中分离,以水作为流动相和折射率检测,最后用反相高效液相层析定量检测此法测定较准确,但设备贵、耗时长、成本高刚果红法刚果红与 β-葡聚糖的结合具有专一性,在一定条件下,刚果红与 β-葡聚糖形成有色物质,反应液吸收光度的变化与 β-葡聚糖含量成正比此法多用于测定啤酒中β-葡聚糖含量,在测定固体样品时 β-葡聚糖分子易被其他分子包裹不能充分溶解,使显色不足,故不适于测定固体品中β-葡聚糖含量,只能检测水溶性β-葡聚糖。操作简单,但测定的结果偏低
谷物非淀粉多糖一般是一定分子质量范围的均一多糖组分。因此,如果对谷物非淀粉多糖的结构进行测定分析,具有较好的纯度是结构测定分析的必要前提。纯度鉴定的常用方法主要有:超速离心法、高压电泳法、凝胶色谱法、纸层析法、比旋光度法、光谱扫描法和高效液相色谱法等。其中,目前应用较多也最准确的方法的是高效液相色谱法和凝胶色谱法。
3.2 分子质量和结构分析的研究
谷物非淀粉多糖的很多活性与其分子质量有关,因此,其分子质量的测定对研究多糖的性质尤为重要。
过去常用超速离心沉降法、光散射法、渗透压法、黏度法等,这些方法操作复杂且误差较大,现已较少使用。现在较常用的方法有凝胶过滤法和高效凝胶色谱法,这2种方法须先用已知分子质量的标准多糖对照测定样品的分子质量。
NSP结构复杂,目前,对谷物非淀粉多糖结构的研究方法主要包括化学分析法和物理分析法。化学分析法包括高碘酸氧化、部分或完全酸水解、Smith降解和甲基化分析等。利用Smith降解和高碘酸氧化分析糖苷键位置、直链多糖聚合度和支链多糖分支数目等信息。甲基化分析法通常与质谱分析法结合使用,分析分支链点位置、羟基被取代位置以及重复结构中单糖数目等信息。物理分析法主要是通过精密仪器来分析多糖的结构信息,如核磁共振仪、高效液相色谱仪、红外光谱仪、气相色谱仪以及气相色谱-质谱联用仪和质谱仪等。核磁共振仪用来研究确定糖苷残基的α-构型与β-构型残基的比例,判断异头碳的构型,推断主链和支链连接键型。高效液相排阻色谱来确定单糖组分和相对分子质量分布。用高效液相色谱法或气相色谱法测定水解后多糖的单糖组成,来研究确定单糖的种类及摩尔比。红外光谱来测定多糖的官能团,研究吡喃糖环或呋喃糖环的构象以及糖苷键的构型。
不同种类谷物中非淀粉多糖的结构类似,但其不同组分的分子质量及内部结构存在一定差异性。目前已证实大麦β-葡聚糖是由线性β-(1→3)和β-(1→4)糖苷键连接而成的,不存在连续的β-(1→3)糖苷键[44]。IRAKLI等[45]利用13C NMR光谱和高效阴离子交换色谱研究了青稞β-葡聚糖的结构特征,结果表明,来自所有大麦品种的β-葡聚糖均由纤维三糖和纤维四糖单元组成,占释放低聚物总量的90.6%~92.3%,这些单元的摩尔比例为2.31~2.77。REVANAPPA等[46]通过甲基化分析、13C-核磁共振、傅里叶转换红外光谱分析、高碘酸盐氧化、Smith降解和旋光测量等方法相结合来阐明小麦阿拉伯木聚糖的结构特征,结果表明,β-(1→4)键上有1个木聚糖主链,在O-3或O-2和O-3处被取代,另外,在阿拉伯木聚糖中还观察到完全分枝的木糖基残基。DE ARCANGELI等[47]将大麦β-葡聚糖分离物与地衣酶反应,释放的低聚物用高效阴离子交换色谱结合脉冲安培检测进行分析,结果表明,水和碱可提取β-葡聚糖和残基组分中的3-O-β- 纤维三糖基 -D- 葡萄糖与3-O-β-纤维四糖-D-葡萄糖的比例较高,表明该大麦的β-葡聚糖结构更紧密。
此外,一些显微技术包括射线衍射、扫描电镜、原子力显微镜、静态和动态激光光散射等也可用于直接观察多糖结构。由于每种分析方法都有其局限性,无法单独完成多糖结构的解析,需要采用多种方法相结合,各种方法分析结果相互验证和补充,从而才能得到完整的谷物非淀粉多糖结构信息。
4 结论
近年来,越来越多的研究表明,谷物非淀粉多糖具有复杂的生物学活性和多种功能,特别是对机体免疫功能有显著的影响。NSP具有降低胆固醇,调节血糖水平,促进肠道蠕动等人体营养保健功能,由于其重要的生理功能特性,受到人们越来越多的关注。目前,NSP已成为天然药物和保健品研发的重要组成部分。
随着NSP提取、分离纯化和分析鉴定技术的飞速发展,其提取、分离纯化效果日益提高,许多高级的分析手段被用于分析多糖的结构。但非淀粉多糖的分离纯化非常复杂,很难获得均一组分的多糖组分,这是阻碍多糖研究发展的主要因素之一。分离纯化多糖的方法和途径很多,研究者必须根据所研究的多糖的特性,选择合适的分离纯化方法。另外,目前还没有一种能够有效分析多糖结构的方法,应将多种分析方法结合使用来研究多糖结构。因此,未来的发展应在现有基础上进一步改善提取和分离纯化工艺,以得到较高纯度的均一多糖组分,同时对谷物非淀粉多糖不同组分的分子结构和功能特性进行深入研究,为进一步开发谷物非淀粉多糖功能性产品,加大非淀粉多糖在食品工业中的应用提供理论参考。
[1] UTHUMPORN U, NADIAH I, IZZUDDIN I, et al. Physicochemical characteristics of non-starch polysaccharides extracted from cassava tubers[J]. Sains Malaysiana, 2017, 46(2): 223-229.
[2] BENDER D, NEMETH R, CAVAZZI G, et al. Characterization of rheological properties of rye arabinoxylans in buckwheat model systems[J]. Food Hydrocolloids, 2018, 80: 33-41.
[3] BUKSA K, NOWOTNA A, ZIOBRO R, et al. The influence of oxidizing agents on water extracts of rye flour[J]. Food Hydrocolloids, 2012, 27(1): 72-79.
[4] ARIF S, AHMED M, CHAUDHRY Q, et al. Effects of water extractable and unextractable pentosans on dough and bread properties of hard wheat cultivars[J]. LWT, 2018, 97: 736-742.
[5] BENDER D, REGNER M, D'AMICO S, et al. Effect of differently extracted arabinoxylan on gluten-free sourdough-bread properties[J]. Journal of Food Quality, 2018, 2018:1-10.
[6] 夏洁人, 徐学明, 臧继鑫. 小麦麸皮酶解产物对面包品质的影响[J]. 食品与机械, 2012 (6): 36-42.
[7] 李文多. 黑小麦麸皮非淀粉多糖制备及水解特性研究[D]. 太原:山西大学, 2012.
[8] BUKSA K, ZIOBRO R, NOWOTNA A, et al. Isolation, modification and characterization of soluble arabinoxylan fractions from rye grain[J]. European Food Research and Technology, 2012, 235(3): 385-395.
[9] KISZONAS A M, FUERST E P, MORRIS C F. Wheat arabinoxylan structure provides insight into function[J]. Cereal Chemistry, 2013, 90(4): 387-395.
[10] MOIRAGHI M, VANZETTI L, BAINOTTI C, et al. Relationship between soft wheat flour physicochemical composition and cookie-making performance[J]. Cereal Chemistry, 2011, 88(2): 130-136.
[11] MOIRAGHI M, DE LA HERA E, PÉREZ G T, et al. Effect of wheat flour characteristics on sponge cake quality[J]. Journal of the Science of Food and Agriculture, 2013, 93(3): 542-549.
[12] TURNER M A, SOH C H N, GANGULI N K, et al. A survey of water-extractable arabinopolymers in bread and durum wheat and the effect of water-extractable arabinoxylan on durum dough rheology and spaghetti cooking quality[J]. Journal of the Science of Food and Agriculture, 2008, 88(14): 2 551-2 555.
[13] AHMED J, THOMAS L. Effect of β-D-glucan concentrate and water addition on extensional rheology of wheat flour dough[J]. LWT-Food Science and Technology, 2015, 63(1): 633-639.
[14] OLIVEIRA L D C, OLIVEIRA M, MENEGHETTI V L, et al. Effect of drying temperature on quality of β-glucan in white oat grains[J]. Food Science and Technology (Campinas) 2012, 32(4):793-797.
[15] LEE S, INGLETT G E, PALMQUIST D, et al. Flavor and texture attributes of foods containing betaglucanrich hydrocolloids from oats[J]. LWT-Food Science and Technology 2009, 2: 350-357.
[16] SOUKOULIS C, LEBESI D, TZIA C. Enrichment of ice cream with dietary fibre: Effects on rheological properties, ice crystallisation and glass transition phenomena[J]. Food Chemistry, 2009, 115(2): 665-671.
[17] 葛磊. 燕麦发酵饮料的研制[D]. 无锡: 江南大学, 2012.
[18] BADER UL AIN H, SAEED F, AHMAD N, et al. Functional and health-endorsing properties of wheat and barley cell wall′s non-starch polysaccharides[J]. International Journal of Food Properties, 2018, 21(1): 1 463-1 480.
[19] 申瑞玲, 董吉林, 马婧, 等. 燕麦麸非淀粉多糖提取工艺的研究[J]. 粮油加工, 2008 (1): 108-110.
[20] 贺永惠, 李德发. 小麦非淀粉多糖的提取与鉴定[C].郑州:河南省畜牧兽医学会第七届理事会第二次会议暨 2008年学术研讨会, 2008.
[21] 贾琳璐. 紫色甘薯非淀粉多糖的提取_纯化及性质研究[D]. 郑州:河南工业大学, 2011.
[22] 姜忠杰, 李国明, 周明, 等. 青稞麸皮可溶性粗多糖的提取及其抗氧化性研究[J]. 中国食品添加剂, 2013 (6): 70-77.
[23] 申瑞玲, 林娟, 相启森. 黑麦非淀粉多糖的分离纯化[J].麦类作物学报, 2014, 34(9): 1 297-1 302.
[24] UTHUMPORN U, NADIAH I, IZZUDDIN I, et al. Physicochemical characteristics of non-starch polysaccharides extracted from cassava tubers[J]. Sains Malaysiana, 2017, 46(2): 223-229.
[25] 姚豪颖叶. 青稞中β-葡聚糖与阿拉伯木聚糖的分离纯化与结构表征[D]. 南昌:南昌大学, 2016.
[26] 罗燕平, 李家林, 张雪飞. 微波辅助提取青稞 β-葡聚糖工艺优化[J]. 农产品加工 (下), 2016 (7): 35-38.
[27] 丁宏伟. 超声波结合微波辅助提取米糠多糖的研究[J]. 核农学报, 2013, 27(3): 329-333.
[28] 梁茜茜, 李芬, 李良玉, 等. 超声-微波协同法提取燕麦麸皮多糖的参数优化及结构分析[J]. 中国食品添加剂, 2016 (9): 178-187.
[29] SOURKI A H, KOOCHEKI A, ELAHI M. Ultrasound-assisted extraction of β-d-glucan from hull-less barley: Assessment of physicochemical and functional properties[J]. International Journal of Biological Macromolecules, 2017, 95: 462-475.
[30] 游茂兰, 覃小丽, 段娇娇, 等. 超声-微波协同提取青稞β-葡聚糖[J]. 食品与发酵工业, 2019, 45(8): 178-183.
[31] 肖云, 张迎庆. 米糠多糖脱蛋白方法及条件的优化[J]. 湖北农业科学, 2013, 52(20): 5 014-5 017.
[32] 严汪汪, 向琴, 杨锦杰, 等. 超滤法回收小麦淀粉加工废水中戊聚糖[J]. 中国食品添加剂, 2014 (7): 142-146.
[33] 高雅君, 丁长河, 阮文彬, 等. 小麦麸皮低聚糖生产中高温预处理条件及其提取工艺优化[J]. 河南工业大学学报 (自然科学版), 2018: 26-31;37.
[34] 张颜廷. 黑粒小麦麸皮中多种功能成分的联合提取条件优化[D]. 泰安:山东农业大学, 2013.
[35] 徐晶晶, 董玉秀, 张慧, 等. 黑粒小麦麸皮中多种功能成分联合提取技术[J]. 食品工业, 2019 (2): 11.
[36] 董兴叶. 燕麦 β-葡聚糖的提取纯化及性质研究[D]. 哈尔滨:东北农业大学, 2014.
[37] 贾莹. 青稞麸皮水溶性β-葡聚糖的提取、分离纯化和性质研究[D]. 上海:华东理工大学, 2013.
[38] 谢昊宇, 何思宇, 贾冬英, 等. 青稞 β-葡聚糖的分离纯化及理化特性研究[J]. 食品科技, 2016 (1): 142-146.
[39] 袁建, 范哲, 王艳, 等. 小麦麸皮中β-葡聚糖的分离纯化及组成研究[J]. 食品工业科技, 2014, 35(15): 90-94.
[40] 张峰. 青稞β-葡聚糖的分离纯化及其理化性质研究[D]. 重庆:西南农业大学, 2005.
[41] SAVITHA PRASHANTH M R,MURALIKRISHNA G. Arabinoxylan from finger millet (Eleusine coracana,v. Indaf 15) bran:Purification and characterization[J]. Carbohydrate Polymers,2014,99:800-807.
[42] RAI D R, SAITO M, MASUDA R. Effect of modified atmosphere (MA) packaging on glutathione and some other qualitative parameters of hiratake mushroom[J]. Journal of the Japanese Society for Horticultural Science, 2000, 69(4): 435-439.
[43] 卞科, 郑学玲.谷物化学[M]. 北京: 科学出版社, 2018.
[44] TADA R,ADACHI Y,ISHIBASHI K,et al.Binding capacity of a barley β-D-glucan to the β-glucan recognition molecule dectin-1[J]. Journal of Agricultural and Food Chemistry,2008,56(4):1 442-1 450.
[45] IRAKLI M, BILIADERIS C G, IZYDORCZYK M S, et al. Isolation, structural features and rheological properties of water-extractable β-glucans from different Greek barley cultivars[J]. Journal of the Science of Food and Agriculture, 2004, 84(10): 1 170-1 178.
[46] REVANAPPA S B, NANDINI C D, SALIMATH P V. Structural variations of arabinoxylans extracted from different wheat (Triticum aestivum) cultivars in relation to chapati-quality[J]. Food Hydrocolloids, 2015, 43: 736-742.
[47] DE ARCANGELI S E, DJURLE S, ANDERSSON A A M, et al. Structure analysis of β-glucan in barley and effects of wheat β-glucanase[J]. Journal of Cereal Science, 2019, 85: 175-181.