在食品加工业中,通常添加蛋白质、多糖等天然乳化剂建立稳定的食品乳化体系。大豆分离蛋白(soy protein osolate,SPI)在乳状液的形成中起重要作用,不仅具有较高的营养价值,还具有良好的乳化性和稳定性,其乳化性的本质是蛋白质中的亲水、亲油基团吸附在乳液的油水界面上,形成外围的聚合膜以防止油滴聚集,从而起到乳化稳定效果[1]。KANAMOTO[2]研究发现,磷脂可以改变蛋白表面活性,对蛋白结构和表面电荷进行修饰,甚至将蛋白结合到磷脂分子形成的胶束或囊泡中去,通过磷脂与蛋白的协同作用形成稳定的乳浊液。所以利用大豆蛋白和磷脂的交互作用及双亲作用,保持油水界面稳定,制备稳定的大豆蛋白-磷脂复合乳液[3-4]。
目前,体外消化模型在国内外的应用已经相当普遍。例如 HUR等[5]建立胃肠道体外模拟模型,研究了乳化液对方便面中脂质消化的影响。CAPRIOOTI等[6]研究了大豆种子和大豆乳蛋白在体外模拟消化道消化过程中产生的潜在生物活性肽的鉴定。因为它可以模拟人体胃肠道消化吸收过程来研究食物在口腔以及胃肠道中的消化吸收、结构变化和成分释放情况。所以选用更加贴合人体实际消化情况的胃肠体外消化模型,模拟消化中实际电解质浓度以及蛋白酶的情况来设计实验过程[7]。
植物乳杆菌是一类存在于人体胃肠道内的益生菌群,具有调节免疫功能、肠道功能及保持肠道微生态平衡等作用[8-9],同时广泛存在于各类发酵食品如乳制品及葡萄酒中,有助于改善食品的风味,提高营养价值。通过探究植物乳杆菌在胃肠体外消化模型中对稳定的大豆蛋白-磷脂复合乳液稳定性的影响,研究植物乳杆菌在食物消化过程中的作用,对食品工业的实际生产提供理论指导。
1 材料与方法
1.1 材料与试剂
大豆,郑州市丹尼斯超市;大豆油(金龙鱼精炼一级),益海嘉里食品营销有限公司;粉末磷脂(丙酮不溶物质量分数98%),郑州四维生物科技有限公司;植物乳杆菌,江苏省苏州市安琪酸奶发酵剂;胃蛋白酶(活性10 000 NFU/mg)、胰蛋白酶,生工生物工程(上海)股份有限公司;α-淀粉酶,盈芯生物科技(上海)有限公司;脂肪酶(活性20 000 U/g),索莱宝;胆盐,沪慧生物科技(上海)有限公司;KH2PO4(≥99.5%)、MgCl2(≥98%)等化学试剂均为分析纯,天津市科密欧化学试剂有限公司。
1.2 仪器与设备
FD-1冷冻干燥机,北京博医康实验仪器有限公司;ZS90纳米粒度及Zeta电位分析仪,英国马尔文仪器有限公司;FA25高剪切分散乳化机,德国FLUKO公司;HH-4恒温水浴锅、85-2恒温磁力搅拌器,河南智城科技发展有限公司;BH200生物显微镜,舜宇光学科技集团有限公司;722N可见分光光度计,上海精科实业有限公司;JP-100A-2高速多功能粉碎机,永康市久品工贸有限公司;DSX-30L手提式高压蒸汽灭菌器,上海申安医疗器械厂。
1.3 实验方法
1.3.1 大豆分离蛋白的制备
对参考文献[10-11]的方法进行改进:选取优质大豆粉碎后过80目筛,采用索氏提取法对大豆粉末脱脂,将脱脂后的大豆粉末与蒸馏水以1∶10的质量比混合搅拌,滴加2 mol/L的 NaOH调pH至8.0,同时50 ℃水浴加热1 h,离心30 min(5 000 r/min)取上清液,滴加2 mol/L HCl调pH值至4.8后4 ℃冷藏过夜,次日离心50 min(5 000 r/min),并调pH值至7.0,冷冻干燥即得SPI。
1.3.2 大豆蛋白-磷脂复合乳液的制备
建立水包油(oil/water,O/W)型及油包水(water/oil,W/O)型大豆蛋白-磷脂复合乳液的稳定体系。根据参考文献[12-14]和前期实验基础,O/W型乳液中各物质质量浓度为大豆分离蛋白20 g/L、磷脂10 g/L、蒸馏水800 g/L、大豆油200 g/L;W/O型乳液中各物质质量浓度为大豆分离蛋白20 g/L、磷脂10 g/L、蒸馏水400 g/L、大豆油600 g/L。
1.3.3 植物乳杆菌菌菌液的制备
使用MRS培养基[15]活化培养植物乳杆菌。将纯化后的乳杆菌加入100 mL的MRS培养液中摇匀,置培养箱(37 ℃)培养24 h后放入冰箱中冷藏备用,此时活菌数为5×107CFU/mL。
1.3.4 唾液和胃液的制备
根据表1模拟消化液的组成成分[16]。母液电解质以500 mL为标准配制,肠液以十二指肠液、胆液以及NaHCO3按照6∶3∶1的体积比配制。
表1 模拟胃肠道消化液的组成
Table 1 Composition of simulated gastrointestinal digestive fluid

组成唾液胃液十二指肠液胆液无机液10 mL KCl 89.6 g/L9.2 mL KCl 89.6 g/L6.3 mL KCl 89.6 g/L4.2 mL KCl 89.6 g/L10 mL NaH2PO488.8 g/L6.5 mL HCl 37%(体积分数)40 mL NaCl 175.3 g/L30 mL NaCl 175.3 g/L10 mL Na2SO457 g/L3.0 mL NaH2PO4 88.8 g/L40 mL NaHCO384.7 g/L68.3 mL NaHCO384.7 g/L1.7 mL NaCl 175.3 g/L10 mL NH4Cl30.6 g/L0.18 mL HCl 37%0.15 mL HCl 37%(体积分数)20 mL NaHCO384.7 g/L15.7mL NaCl 175.3 g/L10 mL KH2PO48 g/L10 mL CaCl222.7 g/L18 mL CaCl222.7 g/L10 mL MgCl25 g/L9 mLCaCl222.7 g/l有机液8 mL 尿素 25 g/L10 mL葡萄糖65 g/L4 mL 尿素 25 g/L10 mL 尿素 25 g/L其他 290 mg α-淀粉酶0.2 g胃蛋白酶1 g胰酶3 g胆盐1g脂酶pH 6.8±0.21.3±0.28.1±0.28.2±0.2
1.3.5 胃肠体外消化模型的建立
根据体内消化的特点,参考付笑飞等[17-19]的方法,将反应过程分为3个阶段。首先模拟口腔,将100 mL的模拟唾液与100 mL的大豆蛋白-磷脂复合乳液置于锥形瓶中混合均匀,置于水浴恒温振荡器中振荡反应5 min(温度37 ℃、转速95 r/min),加植物乳杆菌组另需加入6 mL培养24 h的菌液;其次模拟胃,将200 mL的模拟胃液加入锥形瓶中;最后模拟肠道,向锥形瓶中加入400 mL的模拟肠液,锥形瓶始终置于水浴恒温振荡器中(温度37 ℃、转速95 r/min),模拟人体胃肠环境。
1.3.6 乳液的微观结构
取10 μL的样品滴在载玻片上,观察样品的形态结构并拍片保存。
1.3.7 乳液的粒径及电位测定
分别取样测量粒径以及电位,样品稀释100倍(0.05 mL样品+4.95 mL蒸馏水),设置仪器温度为25 ℃。粒径的乳液相对折射率设置为1.095(大豆油1.456与水相1.33的折射率之比),测量乳液的粒径和电位。
1.3.8 乳化活性、乳化稳定性的测定
乳化活性的测定参考文献[20],取样后立即用0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液稀释,用分光光度计(波长500 nm)测量吸光值计算乳化活性指数(emulsifying activity index,EAI),静置 30 min 后测定吸光值计算乳化稳定指数(emulsifying stability index,ESI),计算如公式(1)、公式(2)所示:
(1)
(2)
式中:T,2.303;N,稀释倍数;C,乳化液形成前蛋白质水溶液中蛋白质质量浓度,g/mL;Φ,样品中油相体积分数;A0,0 min时吸光值;A30,30 min时吸光值.
1.3.9 活菌数的测量
加菌组每隔1 h取1 mL样品,将样品加入装有9 mL无菌水的试管中,分梯度稀释后,选用 10-5、10-6、10-7梯度的稀释液在MRS培养基中涂布,37 ℃ 培养48 h后计数。
1.3.10 数据处理
试验中所有数据均取3次测定结果的平均值和误差值。采用 Origin制图,采用SAS 9.0统计学软件进行方差分析。
2 结果与分析
2.1 活菌数变化
图1为植物乳杆菌在O/W和W/O型大豆蛋白-磷脂复合乳液中的生长情况。如图1所示,胃中植物乳杆菌的数量呈降低趋势,而在小肠中菌数则不断增加至7 h后呈基本稳定趋势。利用SAS软件进行单因素方差分析,W/O型乳液与O/W型乳液的菌数随着时间的变化具有显著差异(P<0.001)。植物乳杆菌更适合在水包油的体系中生长,乳液在0 min加入胃液之后pH值由7.0变至2.0,而乳酸菌最适生长pH值是5.5~6.0,植物乳杆菌在不利的生存条件下部分死亡,数量不断减少;加入小肠液之后,可能是由于体系中的pH值适合植物乳杆菌的生长和植物乳杆菌利用其自身的黏附作用[21],数量不断增多。
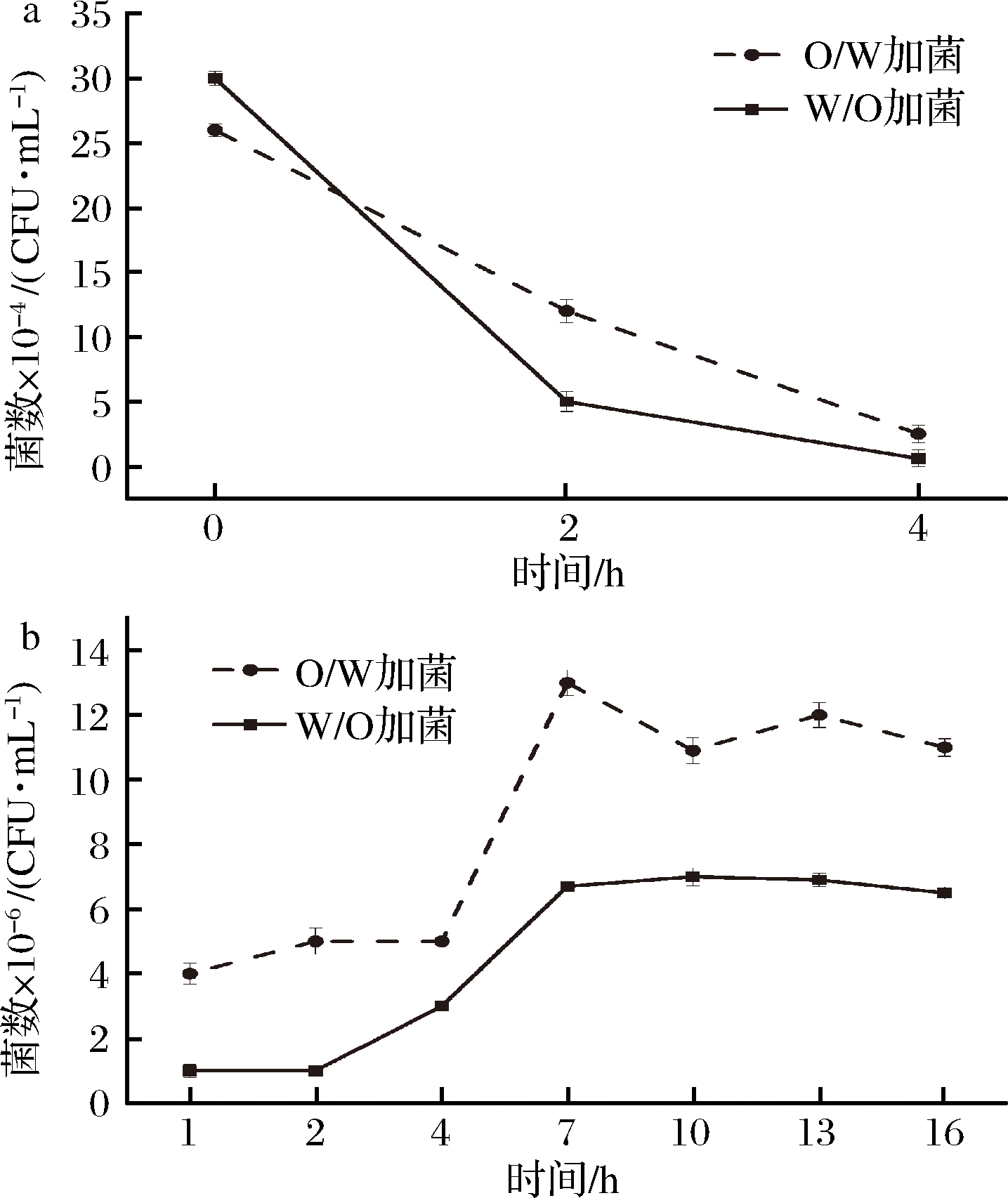
a-模拟胃液;b-模拟肠液
图1 模拟胃肠消化液中植物乳杆菌数量的变化
Fig.1 The number change of Lactobacillus plantarum in the
simulasted gastrointestinal digestive fluid
2.2 乳液的微观结构和乳液粒径的分析
图2~图4表示了O/W和W/O型大豆蛋白-磷脂复合乳液在消化液的作用下,对比加植物乳杆菌与不加植物乳杆菌的微观结构和粒径变化情况。平均粒径和粒径分布反映了乳液体系中脂肪球体积大小以及均一程度,体积越小,均一程度越高,说明乳液稳定性越好。从图4可知,加菌乳液的粒径整体大于不加菌乳液的粒径,W/O型乳液的粒径整体大于O/W型乳液的粒径。结合显微镜观察(图2、图3),W/O型乳液的油滴明显大于O/W型乳液中的油滴,并且乳液中被油滴包裹的蛋白被胃蛋白酶酶解后,失去蛋白的小油滴聚合后上浮导致胃液处理2 h后乳液粒径减小,加入肠液后上浮的部分油滴再次进入乳液开始分离成小油滴,粒径减小,乳液的均一程度变高。利用SAS软件进行方差分析,O/W型乳液和W/O型乳液具有显著性差别(P<0.05),植物乳杆菌加入前后对乳液粒径具有显著影响(P<0.001),有研究表明[22],植物乳杆菌产生的酸具有抑菌特性,因此可用于调节胃肠道的菌群微生态平衡并促进营养的消化吸收,结合图2、图3可以看出,加入植物乳杆菌促进乳液中的油滴聚集和分离,加速乳液破乳,说明植物乳杆菌在人体胃肠道中具有利于消化吸收的作用。根据刘晓明[23]的研究,乳酸菌代谢产物包括各种氨基酸、脂肪酸、寡糖、维生素、小肽、增味剂等物质。可能是菌生长过程中产生的代谢产物破坏了乳液的稳定性,或菌生长加速降解蛋白质,使乳液破乳。
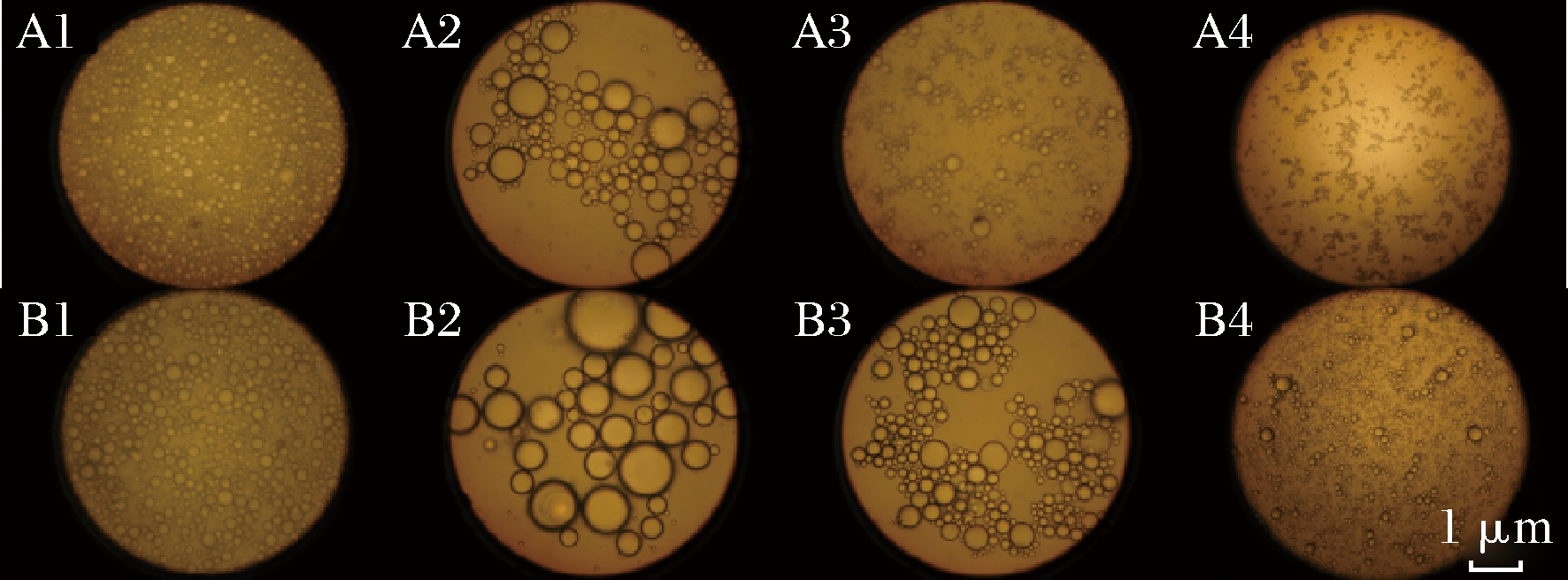
图2 O/W乳液的微观结构
Fig.2 The microstructure of the O/W emulsion
注:A1~A4和B1~B4分别表示不加菌和加菌乳液在胃消化
0、180 min,小肠消化0、7 h的油滴形态

图3 W/O乳液的微观结构图
Fig.3 The microstructure of the W/O emulsion
注:C1~C4和D1~D4分别表示不加菌和加菌乳液在胃消化
0、180 min,小肠消化0、7 h的油滴形态
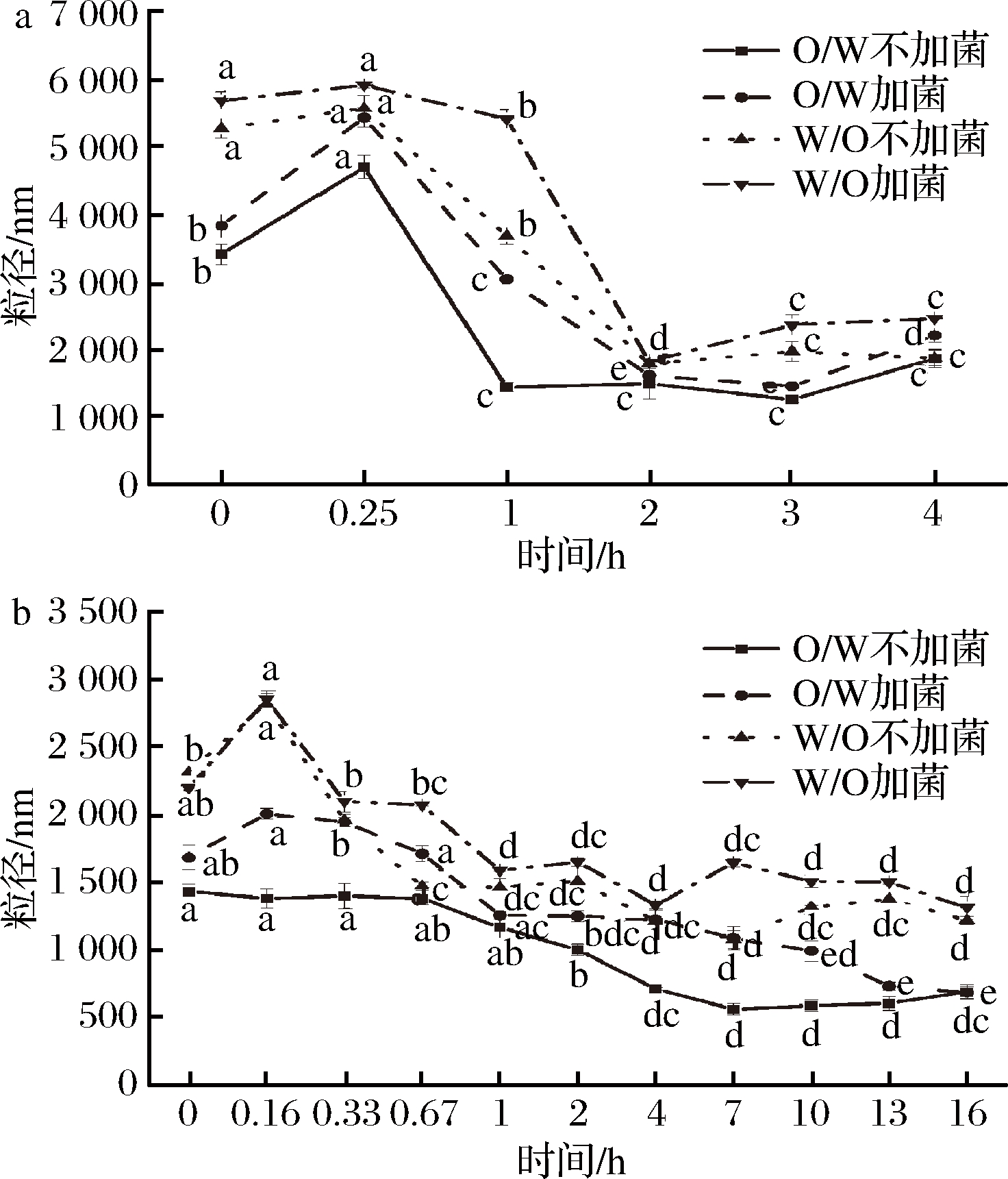
a-模拟胃液;b-模拟肠液
图4 模拟肠胃消化液中乳液的粒径变化
Fig.4 The particle size change of the emulsion in the simulated
gasrointesinal digestive fluid
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
2.3 乳液Zeta电位分析
图5为O/W和W/O型大豆蛋白-磷脂复合乳液在消化液的作用下,对比加植物乳杆菌与不加植物乳杆菌的电位变化情况。乳液界面之间的吸引和排斥作用以及静电作用会引起乳液发生分离和絮凝,乳液的Zeta电位绝对值越大,粒子间排斥力越大,稳定性越强[24]。由图5可知,在胃中2种大豆蛋白-磷脂复合乳液电位的绝对值是不断减小的,说明乳液的稳定性在不断被破坏,但在小肠中电位的绝对值是不断增大至7 h趋于稳定,说明乳液的稳定程度越来越高,且在小肠7 h时,电位绝对值最大,稳定性最好。通过方差分析得知乳液是否加菌具有显著性差异(P<0.001)。在消化的整个过程中,加菌乳液的电位普遍低于不加菌乳液的电位。可能是由于植物乳杆菌可以通过发酵产酸将乳液中的大分子蛋白质部分降解,产生小分子肽和游离氨基酸,加菌乳液中作为乳化剂的蛋白质被胃蛋白酶和乳杆菌双重降解,乳液的稳定性被破坏,说明乳杆菌加剧了乳液的破乳。
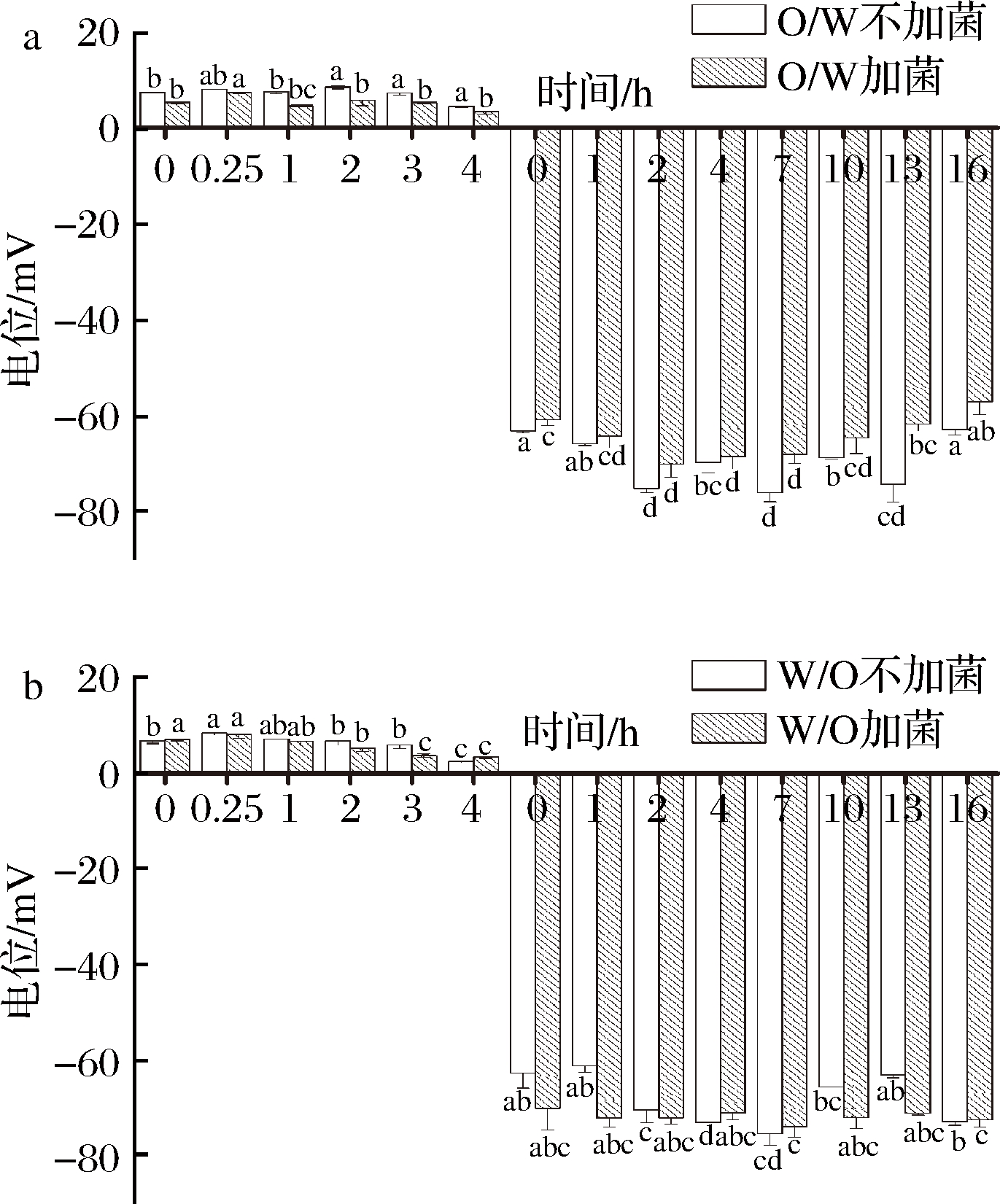
a-O/W型乳液;b-W/O型乳液
图5 不同类型乳液的电位变化
Fig.5 The potential change of different type emulsion
2.4 乳液稳定性分析
图6和图7为O/W和W/O型大豆蛋白-磷脂复合乳液在消化液的作用下,对比加植物乳杆菌与不加植物乳杆菌乳化稳定性的变化情况。EAI和ESI可以表示乳液的乳化性能,乳化形成的界面蛋白膜能够降低其表面张力,抑制乳液聚集和相互作用,EAI和ESI越大,乳液越稳定。从图6和图7中可以看出,EAI和ESI趋势基本一致,胃中乳液破乳,而在小肠中乳液的稳定性不断升高。利用SAS软件分析数据,证明加菌后对乳液的稳定性有显著影响(P<0.001),加菌后加速破坏了乳液的稳定性,验证了乳杆菌在生长过程中需要油滴表面的蛋白,破坏了蛋白-磷脂乳液的稳定结构。
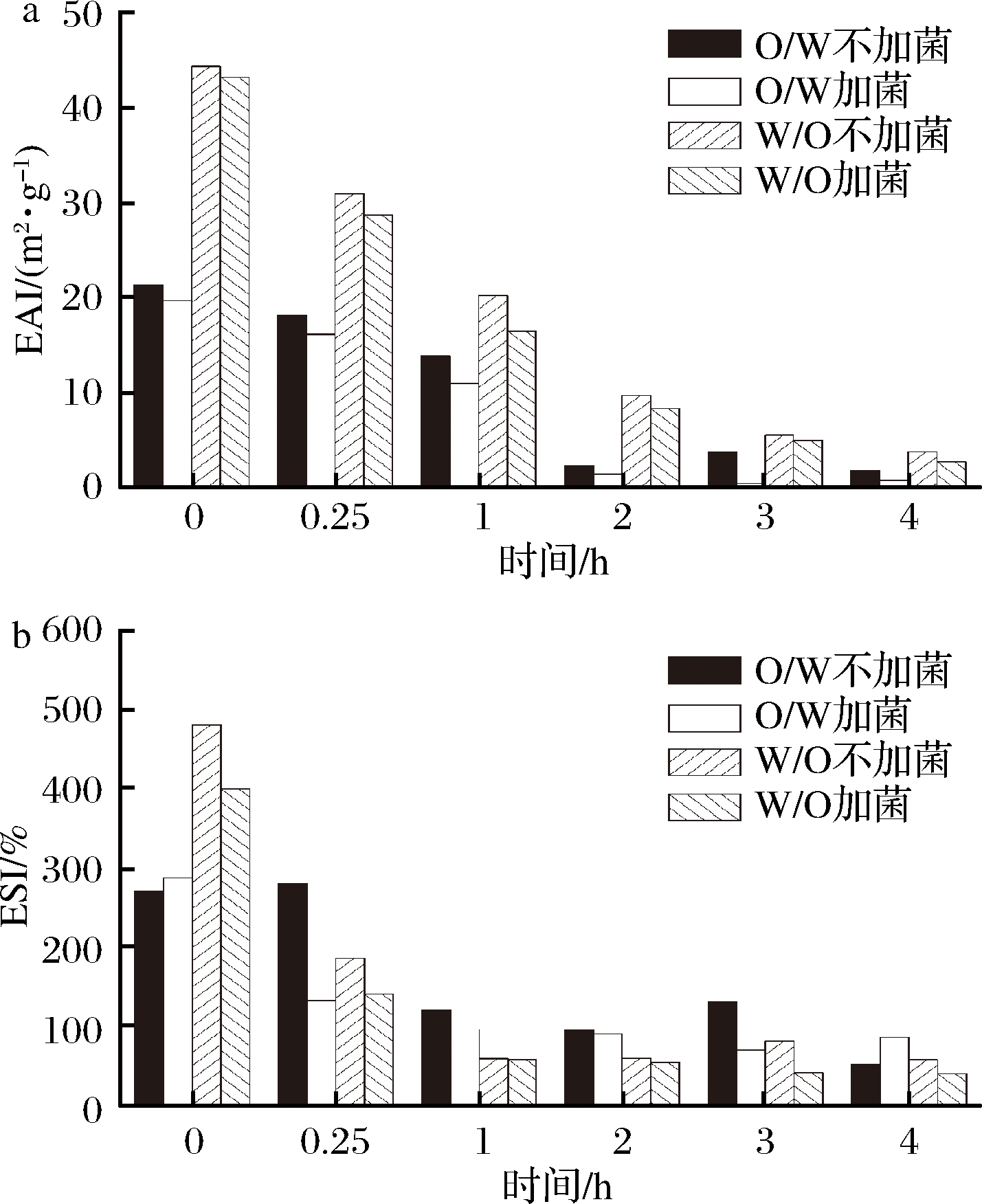
a-EAI变化;b-ESI变化
图6 模拟胃液中乳液的稳定性变化
Fig.6 The EAI and ESI change of the emulsion in the stomach
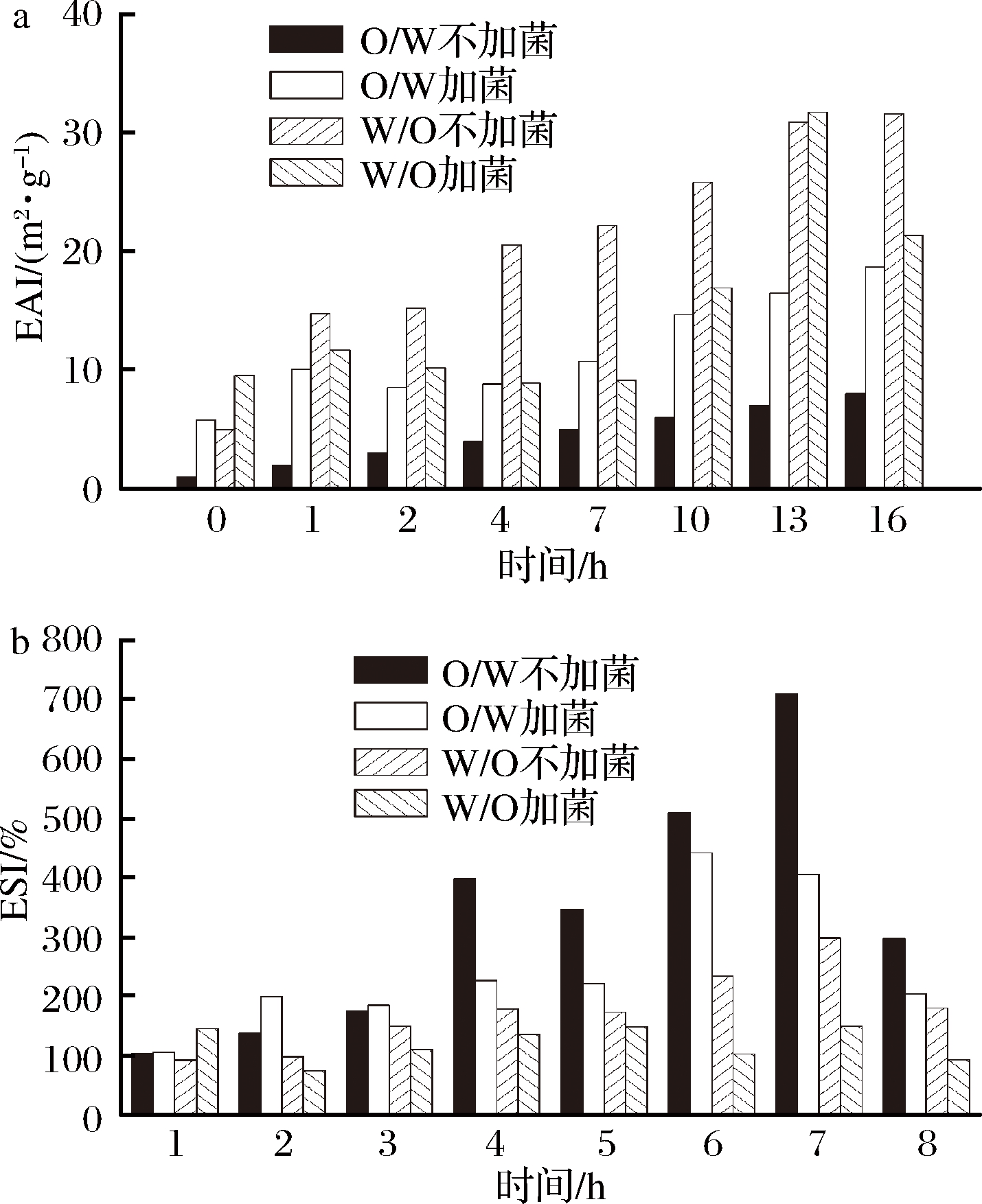
a-EAI变化;b-ESI变化
图7 模拟肠液中乳液的ESI变化
Fig.7 The EAI and ESI change of
the emulsion in the small intestine
3 结论
W/O和O/W型大豆蛋白-磷脂复合乳液中的界面蛋白在胃液中被酶解,液滴界面带电量发生改变,分子间排斥力减小并使乳液的稳定性变差,乳液发生了破乳现象;加入肠液后乳液油滴的均一程度变高,稳定性变高。植物乳杆菌能加速蛋白质的降解,使乳液的破乳现象更加严重,存在于人体消化体系中的植物乳杆菌可以促进食物的分解和消化。O/W型大豆蛋白-磷脂复合乳液比W/O型在消化体系中更易消化,植物乳杆菌更适宜在O/W型乳液体系中生长。但对于植物乳杆菌是如何破坏大豆蛋白-磷脂复合乳液的机制还不是很明确,需要对其做进一步的研究。
[1] 王欢,冯红霞,张雅娜,等. 大豆分离蛋白-磷脂复合乳化体系的制备及pH对其影响的研究[J]. 食品工业科技, 2013, 34(24): 159-162;176.
[2] KANAMOTOR K O M. Diversity of the soybean protein-phosphatidylcholine complex[J]. Agricultural and Biological Chem,1977,41(10): 2 021-2 026.
[3] 李秋慧,齐宝坤,隋晓楠,等. 大豆分离蛋白-磷脂复合乳化体系乳化及氧化稳定性研究[J]. 中国食品学报,2016,38(3): 46-52.
[4] 江连洲,王欢,韩天翔,等. 限制性酶解大豆蛋白-磷脂乳液特性分析[J]. 中国食品学报, 2018, 18(3): 269-277.
[5] HUR S J, LEE S J, LEE S Y, et al. Effect of emulsifiers on microstructural changes and digestion of lipids in instant noodle during in vitro human digestion [J]. LWT-Food Science and Technology, 2015, 60: 630-636.
[6] CAPRIOOTI A L, CARUSO G, CAVALIERE C, et al. Identification of potential bioactive peptides generated by simulated gastrointestinal digestion of soybean seeds and soy milk proteins [J]. Journal of Food Composition and Analysis, 2015, 44: 205-213.
[7] 陈责,贾慧. 体外消化模型的研究进展[J]. 农产品加工, 2017, (5): 61-64;68.
[8] 曹承旭,郭晶晶,乌日娜,等. 植物乳杆菌的生理功能和组学研究进展[J]乳业科学与技术,2018,41(1):33- 39.
[9] 胡红芹,张桂红. 乳酸菌发酵在食品加工中的应用[J]. 现代食品, 2019(6):20-22.
[10] WOLF J. Soybean proteins their functional chem and physical propertie[J]. Journal of Agricultural and Food Chem, 1970, 18(6): 969-976.
[11] DICKINSON E,MARIA G,SEMENOVA A S, et al. Effect of high-methoxy pectin on properties of casein-stabilized e-mulsions[J]. Food Hydrocolloids, 1998,12(4): 425-432.
[12] SHEN L, TANG C H. Microfluidization as a potential technique to modify surface properties of soy protein isolate[J]. Food Research International, 2012, 48(1): 108-118.
[13] MOSCHAKIS T, MURRAY B S, DICKINSON E. Microstructural evolution of viscoelastic emulsions stabilised by sodium caseinate and xanthan gum[J].Journal of Colloid & Interface Science,2005,284(2):714-728.
[14] SCURIATTI M P, TOMAS M C,WANGER J R. Influence of soybean protein isolates-phosphatidycholine interaction on the stability on il-in-water emulsions[J]. Journal of the American Oil Chemists Society,2003,80(11):1 093-1 100.
[15] 吴军林,柏建玲,莫树平,等. 高浓度培养乳酸菌发酵培养基的优化[J]. 食品工业科技, 2018, 39(9): 96-101.
[16] VERSANTVOORT C H M,OOMEN A G,VAN D K E,et al. Applicability of an in vitro digestion model in assessing the bioaccessibility of mycotoxins from food[J]. Food and Chemical Toxicology, 2005, 43(1): 31-40.
[17] 付笑飞,管军军. 基于胃液动态消化模型下SPI乳液酶解产物特性的研究[J]. 现代食品科技, 2017, 33(7): 56-62.
[18] 陈影,卢宗梅,俞建良,等. 微生物发酵饲料中益生菌的计数方法[J]. 当代化工,2018,47(5):991-994.
[19] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food-an international consensus[J]. Food and Function, 2014,5(6): 1 113-1 124.
[20] MOLINA E, PAPADOPOULOU A, LEDWARD D A. Emulsifying properties of high pressure treated soy proteinisolate and 7S and 11S globulins[J]. Food Hydrocolloids, 2001,15(3): 263-269.
[21] 程波财,魏华.乳酸菌与肠粘膜免疫[J].中国微生态学杂志,2001(5):54-56.
[22] 刘韶娜, 张斌,相德才,等. 一株植物乳杆菌的分离、鉴定及其特性研究[J].饲料研究,2019(9):73-77.
[23] 刘晓明. 乳酸菌糖类发酵代谢的研究[C]. 潍坊:山东畜牧兽医学会禽病学专业委员会禽病学术研讨会,2013:1-4.
[24] LIMAGE S, SCHIMITT M, VINCENT-BONNIEUS, et al. Characterization of solid-stabilized water/oil emulsions by scanning electron microscopy[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2010, 365(1): 154-161.